RESUMEN
Introducción
Las enterobacterias productoras de carbapenemasas son un problema de salud mundial debido a su facilidad de transmisión, la dificultad de tratamiento y su impacto económico y personal. Analizamos los factores asociados a un mayor riesgo de infección por Klebsiella pneumoniae productora de carbapenemasas (KPC) y los factores relacionados con peor pronóstico.
Material y métodos
estudio de casos y controles. Se tomaron los aislamientos de KPC durante un brote en un hospital del sur de Madrid. Con las variables se llevó a cabo una regresión logística.
Resultados
Se aislaron 16 casos causantes de infecciones clínicamente documentadas. La mortalidad global en los casos fue del 25%. La localización más frecuente fue sangre (37,5%), seguida de orina (25%). Todos, excepto uno fueron OXA-48. En cuanto a factores relacionados con mayor riesgo de desarrollar infección, únicamente la exposición previa a antibióticos presentó significación estadística OR 13 (2,40-70,46). Con respecto a la mortalidad global, se asoció a un mayor riesgo la presencia de neumonía OR 25 (1,93-323,55) o el empleo de ventilación mecánica invasiva 15,33 (1,92-122,8). Para la mortalidad atribuible solo la ventilación mecánica invasiva tuvo una asociación significativa OR 18 (1,48-218,95).
Conclusiones
La exposición a antibióticos previos es un factor de riesgo independiente de desarrollar una infección por KPC, ajustado por el resto de variables clínicas y demográficas. Factores de riesgo como la presencia de neumonía o el empleo de ventilación mecánica invasiva se relacionaron con un peor pronóstico en términos de mortalidad global y atribuible.
Palabras claves: carbapenemase-producing Klebsiella pneumoniae, OXA-48, risk factors, mortality, Spain
ABSTRACT
Introduction
Carbapenemase-producing Enterobacterias is a global health hazard due to their ease of transmission, difficulty of treatment, and their personal and economic impact. We analyze the factors associated with an increased risk of infection by Klebsiella pneumoniae carbapenemase-producing bacteria (KPC) and factors related to poor prognosis.
Materials and methods
We designed a case-control study. KPC isolates were taken during an outbreak in a hospital in Madrid. A logistic regression was performed with the main variables.
Results
Sixteen cases of clinically documented infections were isolated. Overall mortality rates in the cases group was 25%. The most frequent location was blood (37.5%) followed by urine (25%). All but one were OXA-48. Regarding factors related to an increased risk of developing infection, only previous exposure to antibiotics presented statistical significance difference OR 13 (2.40-70.46). With respect to the overall mortality, the presence of pneumonia OR 25 (1.93-323.55) or the use of invasive mechanical ventilation was associated with greater risk 15 OR 33 (1.92-122.8) For attributable mortality only invasive ventilation had a significant association OR 18 (1.48-218.95).
Conclusions
Exposure to previous antibiotics is an independent risk factor for developing KPC infection, adjusted for all other clinical and demographic variables. Risk factors such as the presence of pneumonia or the use of invasive mechanical ventilation were associated with a worse prognosis in terms of overall and attributable mortality.
Key words: Klebsiella pneumoniae productora de carbapenemasas, OXA-48, factores de riesgo, mortalidad, España
INTRODUCCIÓN
El incremento de resistencias microbianas es un problema alarmante y creciente que trasciende fronteras, constituyendo un verdadero reto en el tratamiento de algunas infecciones graves [1,2]. Las enterobacterias poseen principalmente un mecanismo de resistencia basado en la producción de β-lactamasas, enzimas capaces de hidrolizar el anillo β-lactámico de cuatro átomos, dejando así el antimicrobiano sin actividad. Las que han constituido una mayor relevancia clínica a finales del siglo XX han sido las que confieren resistencia a cefalosporinas de tercera generación, β-lactamasas de espectro extendido (BLEE) o del tipo AMPc [3,4]. Hasta ahora disponíamos de un grupo de antibióticos que se mantenían activos frente a las infecciones producidas por estos gérmenes. Sin embargo en los últimos años estamos asistiendo a un surgimiento de bacterias con producción de carbapenemasas, enzimas que confieren resistencia a todos los antibióticos β-lactámicos, incluyendo los carbapenémicos. Estas enzimas se han encontrado en numerosas especies de enterobacterias, pero con diferencia el mayor impacto epidemiológico y clínico lo encontramos en los últimos años en el patógeno Klebsiella pneumoniae, siendo responsables de brotes endémicos y casos aislados en diversas regiones del mundo. Se han identificado mecanismos de transmisión horizontal mediadas por transposones que contienen pequeños segmentos de material genético responsables de la producción de carbapenemasas y con capacidad de transmisión vía clonal [1,5].
En España los primeros casos de enterobacterias productoras de carbapenemasas (EPC) se identificaron en 2003 en Barcelona, con un genotipo de resistencia clase B (según la clasificación de Ambler) del tipo VIM-1. Desde entonces la epidemiología de las cepas ha ido variando con los años y en la actualidad encontramos un predominio claro de las cepas OXA-48 (clase D), causantes de la mayor parte de brotes intrahospitalarios con extensión interregional [2,6–9]. Las carbapenemasas de clase A tipo KPC son menos frecuentes en nuestro país y no pertenecen en su mayoría a la cepa epidémica de alto riesgo ST258.
Si bien hasta ahora existen múltiples publicaciones que documentan el impacto clínico y ecológico de las enterobacterias multirresistentes, los estudios publicados hasta la fecha sobre K. pneumoniae productora de carbapenemasas suelen ser heterogéneos, no contemplan específicamente la infección por OXA-48 y en algunas ocasiones no diferencian colonización de infección [9–13].
El objetivo del estudio fue analizar las características clínicas y la mortalidad en las infecciones por K. pneumoniae productora de carbapenemasas (KPC), su perfil de resistencias y los factores asociados con peor pronóstico.
MATERIAL Y MÉTODOS
El estudio se llevó a cabo en un hospital universitario del sur de Madrid de 406 camas durante un brote de infecciones por KPC. Para la elaboración del presente documento se tuvieron en cuenta las directrices establecidas por la declaración STROBE [14].
Diseño del estudio y participantes. Se consideraron casos todos los pacientes con aislamientos en muestras biológicas de K. pneumoniae con sensibilidad disminuida o resistentes a carbapenémicos e infección clínica documentada de acuerdo a las definiciones de la CDC, objetivados desde la declaración del primer caso en octubre del 2013, hasta el 31 de diciembre de 2015. Por cada caso se escogió un control, constituido por pacientes con aislamiento de K. pneumoniae con sensibilidad a carbapenémicos conservada, apareado por localización anatómica. Cuando existían varios controles potenciales se seleccionó aquel con edad similar y mayor proximidad en fecha al aislamiento del caso. Se excluyeron las infecciones causadas por K. pneumoniae productora de BLEE. Cada paciente fue incluido sólo una vez.
Se tuvieron en cuenta resistencias a antibióticos mediante revisión de antibiogramas de cada una de las muestras y se solicitó estudio molecular de resistencias para cada muestra analizada.
Variables a estudio. Para comprobar la distribución de variables en los casos y controles y su homogeneidad, se llevó a cabo un análisis estadístico de las variables demográficas y clínicas en ambos grupos. Se tuvieron en cuenta edad, sexo, estancia hospitalaria (días), tiempo de crecimiento del aislamiento (días), índice de Charlson, y foco de infección (urinario, respiratorio, piel y partes blandas, abdominal y bacteriemias primarias) (tabla 1).
Tabla 1.
Características demográficas y clínicas de los pacientes con infección por KPC (casos) y pacientes con K. pneumoniae sensible a carbapenem (controles) entre octubre 2013 a diciembre 2015.
| VARIABLE | CASOS | CONTROLES | p |
|---|---|---|---|
| Edad (años) | 73,19 (12,92) | 72,12 (13,97) | 0,82 |
| Sexo Hombre Mujer |
11 (55%) 5 (41,7%) |
9 (45%) 7 (58,3%) |
0,46 |
| Estancia (días) | 27,5 (RIQ 15-56,5) | 20 (RIQ 8-56,5) | 0,36 |
| Días de crecimiento | 12,5 (0-27) | 2 (0-5,5) | 0,17 |
| Índice de Charlson | 4,95 (RIQ 3-8) | 3,95 (RIQ 2,1-6,25) | 0,24 |
| Infección urinaria Sí No |
4 (50%) 12 (50%) |
4 (50%) 12 (50%) |
1 |
| Bacteriemia Sí No |
6 (50%) 10 (50%) |
6 (50%) 10 (50%) |
1 |
| Infección respiratoria Sí No |
2 (50%) 14 (50%) |
2 (50%) 14 (50%) |
1 |
| Inf. piel/partes blandas Sí No |
2 (50%) 14 (50%) |
2 (50%) 14 (50%) |
1 |
| Infección Abdominal Sí No |
2 (50%) 14 (50%) |
2 (50%) 14 (50%) |
1 |
Se llevó a cabo un análisis univariable para identificar los factores de riesgo de infección por KPC de interés clínico (tabla 2). En cuanto al tratamiento antimicrobiano previo se tuvieron en cuenta los antibióticos con actividad frente a gramnegativos empleados en un periodo de tiempo de 90 días previos al aislamiento microbiológico [15]. Posteriormente se seleccionaron aquellas variables con significación estadística o bien con un valor de p<0,3 para el análisis multivariable.
Tabla 2.
Análisis de regresión logística univariable y multivariable de los factores de riesgo asociados con infección por KPC
| Factor de Riesgo | OR (IC 95%) | p | OR ajustada (IC 95%) | p |
|---|---|---|---|---|
| Edad | 1 (0,95-1,06) | 0,82 | ||
| Diabetes mellitus | 2,14 (0,52-8,81) | 0,29 | 1,57 (0,15-16,74) | 0,71 |
| Inmunosupresión | 3,46 (0,32-37,47) | 0,31 | ||
| Insuficiencia cardíaca | 5 (0,49-50,83) | 0,17 | 7,89 (0,49-125,95) | 0,11 |
| Enfermedad hepática | 3,46 (0,32-37,47) | 0,32 | ||
| Enfermedad renal | 0,43 (0,66-2,77) | 0,37 | ||
| Neoplasia | 1 (0,22-4,46) | 1 | ||
| Ictus | 3,46 (0,32-37,47) | 0,31 | ||
| Índice de Charlson | 1,18 (0,1-1,55) | 0,24 | 0,86 (0,65-1,66) | 0,86 |
| Estancia hospitalaria | 0,99 (0,98-1) | 0,65 | ||
| Estancia en UCI | 1,8 (0,39-8,22) | 0,45 | ||
| CVC | 1,32 (0,31-5,71) | 0,71 | ||
| Sonda vesical | 1,29 (0,32-5,33) | 0,72 | ||
| VMI | 9 (0,94-86,52) | 0,06 | 6,27 (0,45-87,55) | 0,17 |
| Días crecimiento microb. | 1,03 (0,99-1,08) | 0,17 | 1,03 (0,97-1,09) | 0,35 |
| Exposición a Ab | 13 (2,40-70,46) | 0,003 | 13 (2,40-70,46) | 0,003 |
| Uso betalactámico | 3,37 (0,68-16,65) | 0,14 | 0,31 (0,02-4,70) | 0,40 |
| Uso fluorquinolonas | 3,46 (0,13-37,47) | 0,31 | ||
| Uso carbapenem | 4,2 (0,7-25,26) | 0,12 | 0,29 (0,01-6,67) | 0,43 |
| Uso aminoglucósido | 2,14 (0,17-26,33) | 0,55 |
UCI: unidad de cuidados intensivos, CVC: catéter venoso central, VMI: ventilación mecánica invasiva, Ab: antibiótico.
Para tratar de identificar los factores de riesgo asociados a mortalidad global y atribuible en el grupo de infecciones producidas por KPC se llevó a cabo un análisis univariable (tabla 3). Se definió mortalidad atribuible cuando en el momento del fallecimiento el paciente presentaba datos de infección (leucocitosis/leucopenia, fiebre/hipotermia o compromiso de órganos/sistemas) a pesar de un tratamiento antibiótico correcto. No se realizó análisis multivariable dado el escaso número de eventos ocurridos.
Tabla 3.
Factores de riesgo asociados a mortalidad global y atribuible en pacientes con infección por KPC. Análisis univariable.
| Factor de riesgo | Mortalidad global |
Mortalidad atribuible |
p |
|
|---|---|---|---|---|
| OR (IC 95%) | p | OR (IC 95%) | ||
| Edad (años) | 0,43 (0,91-1,04) | 0,85 | 0,97 (0,90-1,05) | 0,52 |
| Índice de Charlson | 1,03 (0,74-1,44) | 0,847 | 1,17 (0,71-1,76) | 0,43 |
| DM | 1,17 (0,20-6,89) | 0,87 | 1,15 (0,14-9,39) | 0,89 |
| IC | 1,10 (0,10-12,10) | 0,94 | 2 (0,16-24,33) | 0,59 |
| E. Autoinmune | 6 (0,65-55,66) | 0,12 | 13 (1,14-147,82) | 0,04 |
| Shock | 6,67 (0,97-45,79) | 0,05 | 9 (0,80-101,15) | 0,08 |
| Neoplasia | 0,39 (0,04-3,75) | 0,41 | 0,70 (0,06-7,74) | 0,77 |
| Fracaso renal | 4,50 (0,70-29,81) | 0,12 | 6,33 (0,58-69,68) | 0,13 |
| Bacteriemia | 0,80 (0,12-5,20) | 0,82 | 1,80 (0,22-14,80) | 0,59 |
| Neumonía | 25 (1,93-323,55) | 0,01 | 2,79 (0,22- 35,95) | 0,43 |
| Inf. abdominal | 1,53 (0,13-17,99) | 0,73 | 2,79 (0,22-35,95) | 0,43 |
| CVC | 5,43 (0,81-36,51) | 0,08 | 7,5 (0,67-83,26) | 0,10 |
| Catéter urinario | 1,47 (0,23-9,50) | 0,69 | 2,25 (0,21-24,40) | 0,5 |
| VMI | 15,33 (1,92-122,8) | 0,01 | 18 (1,48-218,95) | 0,02 |
| Estancia en UCI | 6,67 (0,97-45,79) | 0,05 | 9 (0,80-101,15) | 0,08 |
| Exposición Ab | 2 (0,31-12,891) | 0,47 | - | |
| Sensibilidad a carbapenem | ||||
| Resistente | 1,18 (0,17-8,33) | 0,87 | 1,60 (0,13-19,84) | 0,71 |
| Intermedia | 5,5 (0,24-128,99) | 0,29 | 12 (0,384-374,84) | 0,16 |
| Colonización previa | 1,12 (0,17-7,45) | 0,90 | 2,5 (0,30-20,92) | 0,40 |
DM: diabetes mellitus, IC: insuficiencia cardiaca, CVC: catéter venoso central, E.: enfermedad, VMI: ventilación mecánica invasiva, UCI: unidad de cuidados intensivos, Ab: antibiótico.
Análisis estadístico. Las medias, medianas, rango y frecuencia fueron calculados para cada variable. La comparación de las variables continuas se realizó mediante el test t de Student o Mann-Whitney; y el test de la Chi2 o el test exacto de Fisher en las variables cualitativas.
Se llevó a cabo un análisis univariable para identificar los factores de riesgo de infección por KPC de interés clínico y posteriormente se seleccionaron las variables con significación estadística o con una p<0,3 para realizar un análisis multivariable. Para identificar los factores de riesgo asociados a mortalidad global y atribuible a la infección, se seleccionaron variables contempladas en otros estudios relacionadas con mayor mortalidad, llevándose de igual modo un análisis univariable.
Mediante el modelo de análisis multivariable de regresión logística, y con la estimación de la curva de rendimiento diagnóstico (COR) para tratar de valorar si el modelo diseñado es el adecuado, se desarrolló una herramienta para predecir el comportamiento de las variables con significación estadística, calculando especificidad, sensibilidad y eficacia del modelo. Se introdujeron las variables definidas en el apartado anterior. Se presenta la OR ajustada y no ajustada con IC 95% utilizando el paquete estadístico SPSS® 20 para Mac.
Aspectos microbiológicos. La identificación bacteriana y los test de sensibilidad antimicrobiana se realizaron mediante paneles automatizados de microdilución (MicroScanR) y técnica de difusión disco-placa.
Las cepas en las que los valores de CMI de uno o más de los tres carbapenémicos probados (imipenem, meropenem y ertapenem ) se incrementaron por encima de los correspondientes puntos de corte epidemiológicos, se consideraron cepas con sensibilidad disminuida a carbapenems (EUCAST los ha establecido recientemente en >0,12 mg/L para ertapenem y meropenem y >1 mg/L para imipenem) [16].
Cuando esto ocurrió, se realizó el test de Hodge modificado usando un disco de ertapenem y se probaron discos de un carbapenémico combinado con inhibidores (ROSCO), carbapenémico +EDTA, carbapenémico + ácido dicpicolínico, carbapenémico + ácido fenil borónico y carbapenémico + cloxacilina comparando el halo de inhibición con discos de carbapenémico sin inhibidores y también se utilizó un disco de temocilina [17].
Las cepas con sospecha fenotípica de producción de carbapenemasa se informaron como “Cepa productora de carbapenemasa posible clase A, clase B ó clase D (OXA-48 like)” y se enviaron al CNM para genotipado molecular.
RESULTADOS
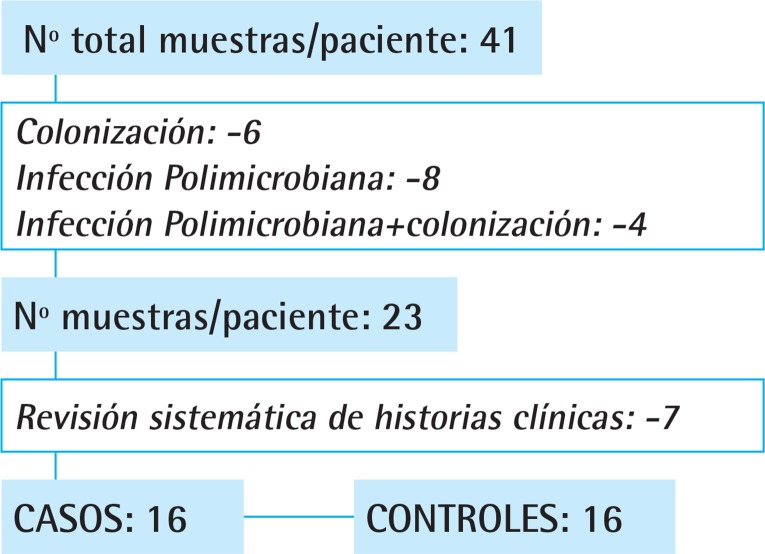
Se incluyeron todos los casos tras una revisión de los aislamientos facilitados por los servicios de Microbiología y Medicina Preventiva del hospital. Inicialmente se excluyeron a los pacientes con diagnóstico de colonización y/o infección polimicrobiana y, tras la revisión de las historias clínicas, también a 7 pacientes con diagnóstico de infección por KPC que no cumplían los criterios de la CDC. No se tuvieron en cuenta las infecciones extrahospitalarias (figura 1).
Figura 1.
Diagrama de flujo para la selección de casos/controles.
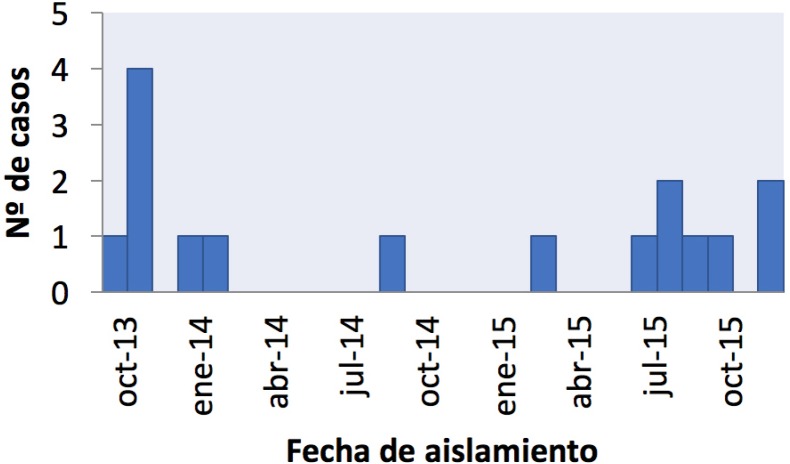
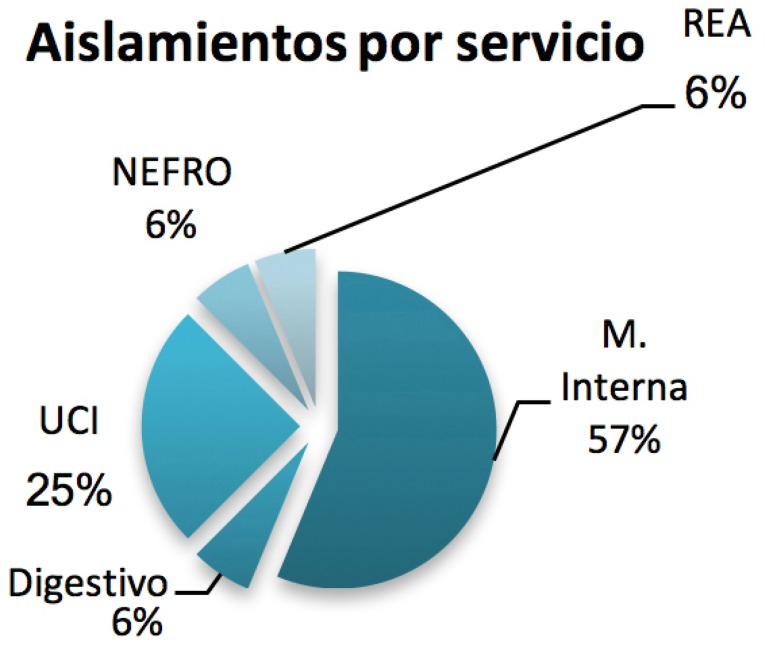
El primer caso notificado de infección invasiva por esta bacteria se declaró en octubre 2013. Desde entonces se ha producido un crecimiento de casos, que persiste a pesar de las medidas de control instauradas (figura 2). En la Figura 3 se muestra el porcentaje por servicio durante el periodo de estudio.
Figura 2.
Curva epidemiológicak del brote desde octubre 2013 a diciembre 2015.
Figura 3.
Distribución de los aislamientos de KPC por servicio.
Durante el periodo del estudio se objetivaron 16 casos de enfermedad invasiva por KPC. La distribución por localización anatómica del primer aislamiento fue: 2 infecciones respiratorias, 4 infecciones urinarias, 6 bacteriemias primarias, 2 infecciones intraabdominales y 2 infecciones de piel/partes blandas. Cuatro pacientes (25%) fallecieron en el grupo de infección por KPC y en 3 de ellos la mortalidad fue atribuible a ésta. En el grupo control fallecieron 2 pacientes por causas no atribuibles a la propia infección (12,5%). Las características demográficas y clínicas se recogen en la tabla 1. No se observaron diferencias significativas en ninguna de las variables analizadas.
El 50% de las cepas de KPC tenían resistencia a cefalosporinas de tercera generación, el 50% a fluoroquinolonas, el 37,5% a tigeciclina, el 43% era resistente a amikacina, 43% a cotrimoxazol, mientras que para carbapenémicos, el 18,75% mostraba resistencia intermedia y el 50% era resistente a los mismos. El resto de antibióticos de interés como colistina, fosfomicina o piperacilina-tazobactan no se testaron en un alto porcentaje de muestras.
En cuanto al estudio molecular de resistencias, 14 (87,5%) cepas fueron OXA-48, conteniendo también todas ellas BLEEs del tipo CTX-M15; 1 KPC (correspondiente a un paciente con neumonía asociada a ventilación mecánica) y 1 desconocida.
Se realizó una regresión logística para tratar de identificar factores de riesgo asociados a un incremento de las infecciones por KPC en ambos grupos (casos y controles). La única variable que alcanzó significación estadística en el análisis univariable fue el empleo previo de antibióticos en los 90 días previos OR 13 (2,70-70,46) p=0,003. De acuerdo con otras publicaciones se decide incluir en el análisis multivariable aquellos resultados con un nivel de significación de p<0,3, además de la variable que alcanzó significación estadística. Tras ajustar por cada una de las variables en el análisis multivariante la única relacionada con mayor riesgo de presentar infección por KPC fue el uso previo de antibióticos OR 13 (2,40-70,46) p=0,17. No se alcanzó significación estadística al evaluar cada uno de los antibióticos por separado (tabla 2). El análisis de ROC nos confirma que nuestro modelo tiene una gran exactitud diagnóstica como herramienta para predecir el riesgo de desarrollar infección por KPC, cuando ha existido exposición previa a antibióticos (AUC 0,78, Sensibilidad 81,3%, Especificidad 75%).
Para analizar factores de riesgo asociados a mayor mortalidad global y atribuible se planteó un modelo univariable incluyendo algunas variables recogidas en revisiones previas. El empleo de ventilación mecánica invasiva y la presencia de neumonía se relacionaron con mayor riesgo de mortalidad global, con OR 15,33 (1,92-122,8) y 25 (1,93-323,55) respectivamente. Aunque no alcanzaron significación estadística, otras variables dentro de este grupo presentaban mayor riesgo de mortalidad, como la presencia de enfermedad autoinmune OR 6 (0,65-55,66), fracaso renal agudo OR 4,5 (0,70-29,81), uso de CVC OR 5,43 (0,81-36,51) o estancia en UCI OR 6,67 (0,97-45,79). En cuanto a la mortalidad atribuible, únicamente el uso de ventilación mecánica invasiva se relacionó con mayor riesgo de mortalidad OR 18 (1,48-218,95). Debido al diseño del estudio, el escaso tamaño muestral y la dispersión de datos, no fue posible la realización de un análisis multivariable para ninguno de los grupos de mortalidad (tabla 3).
DISCUSIÓN
El incremento del uso de carbapenémicos en el tratamiento de infecciones graves nosocomiales por enterobacterias productoras de BLEE ha generado un aumento del número de cepas multirresistentes, cuyo tratamiento, además de ser muy complejo, aún es materia de controversia [18–20]. La eficacia en su diseminación radica en los plásmidos, estructuras bacterianas capaces de contener pequeños segmentos de genes que codifican resistencias a antibióticos y con capacidad de transmitirse intra o interespecie [21].
En España el principal problema dentro de este grupo lo constituye K. pneumoniae OXA-48, patógeno que está emergiendo como causante de infecciones intra-interhospitalarias con transmisión vía clonal y no clonal [9,22–25]. El primer informe de brote se declaró en Barcelona en abril de 2009, identificando el caso índice de un paciente procedente de una UCI de Marrakesh. Su genotipo era OXA-48 CTX-M15 [7]. Desde ese momento con diferencia es el patógeno que mayor impacto clínico y epidemiológico ha tenido en los brotes de infección nosocomial en nuestro país [26]. En nuestro estudio casi todos los aislamientos que originaron infección clínica eran OXA-48 CTX-M15, excepto un caso de KPC. Este genotipo le confiere a la bacteria una alta resistencia a la mayor parte de los antibióticos testados excepto a tigeciclina, amikacina o fosfomicina y suele estar presente en la mayoría de estas cepas. Nuestro primer caso documentado provenía de un traslado de otro hospital de la Comunidad de Madrid, por lo que asumimos un mecanismo de transmisión horizontal.
En nuestra serie de 16 pacientes encontramos un 100% resistencia a betalactámicos, cefalosporinas y quinolonas, 15 (93,75%) a piperacilina-tazobactam, 15 (93,75%) a cotrimoxazol, 5 (31,25%) a tigecilina y 3 (18,75%) a amikacina. Para los carbapenémicos, encontramos un 87,5% (14) de resistencia a ertapenem y un 56,25% (9) a Imipenem. Oteo et al, analiza en una cohorte multicéntrica de 83 hospitales españoles las enterobacterias con sensibilidad disminuida a carbapenémicos, donde de un total de 270 aislamientos de KPC tipo OXA-48, se puede observar que hay un porcentaje bastante alto con sensibilidad conservada a meropenem (80%), amikacina (84,8%) y colistina (95,2%) [27]. Otro estudio español publicado en el 2016 en el que se analizan a 41 pacientes con infección por KPC productora de OXA-48 mostró resultados similares [9].
Se observó una marcada diferencia en el tiempo para el aislamiento microbiológico con un incremento de días en los casos (12,5 [0-27]) frente a los controles (2 [0-5,5]). Es posible que esta diferencia estadística se deba a diversos factores, como a un crecimiento más lento en las cepas de KPC o factores dependientes del laboratorio de Microbiología, como el tiempo de procesamiento de las muestras, que fueron enviadas a un laboratorio externo para su genotipado. De todas formas, existe una dispersión muy amplia y no alcanzó significación estadística (p=0,12).
Existen numerosos estudios que analizan la evolución clínica y mortalidad de los pacientes con infecciones por enterobacterias en diversas regiones del mundo pero suelen ser heterogéneos y se centran en KPC debido a su impacto global [7,10]. La serie que mostramos en este estudio representa la situación actual en España con un claro predominio de OXA-48. Aunque el comportamiento en términos de supervivencia o sensibilidad de estas cepas podría considerarse a priori muy similar al resto de carbapenemasas, el auge de este genotipo particular crea la necesidad de llevar a cabo estudios que analicen factores de riesgo particulares asociados a mayor probabilidad de infección por este microorganismo y su impacto sobre la salud de nuestros pacientes. El objetivo final es controlar los brotes, desarrollando políticas sanitarias pertinentes [28].
En cuanto a los factores de riesgo asociados a mayor riesgo de desarrollar infección o colonización por KPC, se ha descrito previamente que la duración de la estancia hospitalaria, estancia en UCI, comorbilidades, presencia de vía central, uso de antibiótico previo, particularmente las fluoroquinolonas y cefalosporinas de amplio espectro son factores de riesgo independientes [10,11,15,29,30]. En nuestra serie, sólo la exposición previa a antibióticos en el análisis multivariable mostró una asociación clara, lo cual podría reflejar un tamaño muestral insuficiente. Al igual que en otros trabajos los casos presentaron mayor necesidad de ventilación mecánica e ingreso en UCI [31]. Por localización anatómica encontramos más frecuente la bacteriemia (37,5%) que la infección urinaria (25%), tracto respiratorio (12,5%), infección de piel y partes blandas (12,5%) o intraabdominal (12,5%).
La mortalidad descrita en la literatura sobre infecciones producidas por EPC es muy variable (10-72%), lo que refleja la heterogeneidad de los casos [1,15]. En un estudio en particular, el aislamiento de KPC ajustado por la gravedad de la enfermedad, se asoció independientemente a mayor riesgo de mortalidad, así como el uso previo de antibióticos [30]. En nuestro estudio, la mortalidad alcanzó el 25%. Los factores relacionados con una mayor mortalidad descritos en la literatura son la presencia de bacteriemia, neumonía, shock séptico/gravedad de la infección, comorbilidades, resistencia a carbapenémicos u otros antibióticos, empleo de antibióticos inapropiados, retraso en el inicio de antibióticos correctos, empleo de monoterapia frente a terapia combinada y la falta de control del foco [29,31]. Nosotros encontramos mayor mortalidad en el análisis univariable en aquellos pacientes que presentaban neumonía y shock séptico, no encontrando diferencias en el resto de variables, probablemente debido a la potencia del estudio, aunque sí que se encontraban presentes.
Si bien en la literatura española no son escasas las publicaciones respecto a las infecciones por KPC OXA-48, no hemos encontrado estudios específicos en pacientes de nuestro entorno que evalúen factores de riesgo en esta población y su impacto en la mortalidad global, por lo que hemos considerado necesaria su realización. Al pertenecer a la misma área geográfica y estar expuestos a los mismos factores de exposición dependientes del hospital, en cierta medida se garantiza un grado de homogeneidad. No existe consenso sobre cuál es el mejor método para la elección de un grupo control para nuestra población a estudio. Creemos que el seleccionar un control apareado por localización anatómica y cercanía en la fecha de aislamiento podría ser de utilidad para comprobar el impacto clínico de la resistencia a los carbapenémicos, ya que se minimiza la influencia de otros posibles factores de confusión.
LIMITACIONES
Nuestro estudio presenta varias limitaciones. La principal de ellas es el tamaño muestral. La casuística de estas infecciones es relativamente baja en nuestro hospital si lo comparamos con otros centros de la Comunidad de Madrid. Esto puede tener que ver con el tipo de hospital y las políticas de control locales. Al tratarse de un estudio retrospectivo presenta una serie de sesgos inherentes. La exposición a antibióticos previos es difícil de cuantificar, pues conocemos la exposición previa hospitalaria, pero no la ambulatoria. La causa de la muerte es muy difícil de determinar consultando historias clínicas, lo cual podría influir en los resultados finales, además de que el tamaño de la muestra no permitió hacer análisis multivariable. Como criterios de gravedad clínica sólo se tuvieron en cuenta el desarrollo de shock séptico o fracaso renal agudo, debido a la dificultad de aplicar las escalas de gravedad tras la revisión de historias clínicas. Por último, no se ha evaluado en el presente estudio la influencia de una antibioticoterapia correcta (monoterapia o combinada) ni el control del foco de infección sobre la mortalidad, aspectos contemplados en otros trabajos previos como factores independientes de infección/colonización y mortalidad.
CONCLUSIONES
Las infecciones producidas por KPC son un problema actual en expansión ya demostrado, con un alto impacto sobre la morbimortalidad y en España en particular por el papel que desempeña el genotipo de KPC OXA-48. Identificar los factores de riesgo asociados a mayor riesgo de infección es de vital importancia para instaurar las medidas de contención necesarias. En nuestra serie encontramos que la exposición previa a antibióticos es el factor independiente que más se relaciona con infección por estas bacterias. Creemos que para confirmar la presencia de éste y otros factores de riesgo, es necesaria la realización de estudios con un mayor tamaño muestral. Sería interesante la realización de un estudio multicéntrico que incluyese a los hospitales comarcales o nacionales con presencia de KPC OXA-48 para ayudar a despejar las áreas de incertidumbre que pone de manifiesto nuestro trabajo.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
FINANCIACIÓN
Los autores declaran no haber recibido financiación para la realización de este estudio.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
BIBLIOGRAFÍA
- 1.Tzouvelekis LS, Markogiannakis A, Psichogiou M, Tassios PT, Daikos GL. Carbapenemases in Klebsiella pneumoniae and other Enterobacteriaceae: An evolving crisis of global dimensions. Clin Microbiol Rev 2012;25:682–707. doi: 10.1128/CMR.05035-11. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Albiger B, Glasner C, Struelens MJ, Grundmann H, Monnet DL. Carbapenemase-producing Enterobacteriaceae in Europe: assessment by national experts from 38 countries , May 2015. Euro Surveill 2015;20 10.2807/1560-7917.ES.2015.20.45.30062. [DOI] [PubMed] [Google Scholar]
- 3.Rapp RP, Urban C. Klebsiella pneumoniae carbapenemases in enterobacteriaceae: History, evolution, and microbiology concerns. Pharmacotherapy 2012;32:399–407. doi: 10.1002/j.1875-9114.2012.01035.x. [DOI] [PubMed] [Google Scholar]
- 4.Nordmann P, Poirel L. The difficult-to-control spread of carbapenemase producers among Enterobacteriaceae worldwide. Clin Microbiol Infect 2014;20:821–30. doi: 10.1111/1469-0691.12719. [DOI] [PubMed] [Google Scholar]
- 5.Lopez-Cerero L, Almirante B. Epidemiology of infections caused by carbapenemase-producing Enterobacteriaceae: Reservoirs and transmission mechanisms. Enferm Infecc Microbiol Clin 2014;32:10–6. doi: 10.1016/S0213-005X(14)70169-7. [DOI] [PubMed] [Google Scholar]
- 6.Pitart C, Solé M, Roca I, Fàbrega A, Vila J, Marco F. First outbreak of a plasmid-mediated carbapenem-hydrolyzing OXA-48 β-lactamase in Klebsiella pneumoniae in Spain. Antimicrob Agents Chemother 2011;55:4398–401. doi: 10.1128/AAC.00329-11. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Oteo J, Miró E, Pérez-Vázquez M, Navarro F. Evolution of carbapenemase-producing Enterobacteriaceae at the global and national level: What should be expected in the future? Enferm Infecc Microbiol Clin 2014;32:17–23. doi: 10.1016/S0213-005X(14)70170-3. [DOI] [PubMed] [Google Scholar]
- 8.Oteo J, Saez D, Bautista V, Fernández-Romero S, Hernández-Molina JM, Pérez-Vázquez M, et al. . Carbapenemase-producing Enterobacteriaceae in Spain in 2012. Antimicrob Agents Chemother 2013;57:6344–7. doi: 10.1128/AAC.01513-13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Fernández J, Poirel L, Rosario Rodicio M, Nordmann P. Concomitant and multiclonal dissemination of OXA-48-producing Klebsiella pneumoniae in a Spanish hospital. J Antimicrob Chemother 2016;71:1734–6. doi: 10.1093/jac/dkv505. [DOI] [PubMed] [Google Scholar]
- 10.Cronin KM, Poy Lorenzo YS, Olenski ME, Bloch AE, Visvanathan K, Waters MJ, et al. . Risk factors for KPC-producing Enterobacteriaceae acquisition and infection in a healthcare setting with possible local transmission: a case–control study. J Hosp Infect 2017;96:111–5. doi: 10.1016/j.jhin.2017.02.010. [DOI] [PubMed] [Google Scholar]
- 11.Mariappan S, Sekar U, Kamalanathan A. Carbapenemase-producing Enterobacteriaceae: Risk factors for infection and impact of resistance on outcomes. Int J Appl Basic Med Res 2017;7:32. doi: 10.4103/2229-516X.198520. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Xu L, Sun X, Ma X. Systematic review and meta-analysis of mortality of patients infected with carbapenem-resistant Klebsiella pneumoniae. Ann Clin Microbiol Antimicrob 2017;16:18. doi: 10.1186/s12941-017-0191-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Tuon FF, Graf ME, Merlini A, Rocha JL, Stallbaum S, Arend LN, et al. . Risk factors for mortality in patients with ventilator-associated pneumonia caused by carbapenem-resistant Enterobacteriaceae. Brazilian J Infect Dis 2017;21:1–6. doi: 10.1016/j.bjid.2016.09.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Vandenbroucke JP, Elm E Von, Altman DG, Gøtzsche PC, Mulrow CD, Pocock SJ, et al. . Annals of Internal Medicine Academia and Clinic The Strengthening the Reporting of Observational Studies in Epidemiology ( STROBE ) Statement: Guidelines for Reporting. Ann Intern Med 2007;147:573–8. doi: 10.1136/bmj.39335.541782.AD. [DOI] [PubMed] [Google Scholar]
- 15.Paño-Pardo JR, Serrano Villar S, Ramos Ramos JC, Pintado V. Infections caused by carbapenemase-producing Enterobacteriaceae: risk factors, clinical features and prognosis. Enferm Infecc Microbiol Clin 2014;32:41–8. doi: 10.1016/S0213-005X(14)70173-9. [DOI] [PubMed] [Google Scholar]
- 16.The European Committee on Antimicrobial Susceptibility Testing Breakpoint tables for interpretation of MICs and zone diameters, version 8.0, 2018. n.d. http://www.eucast.org/clinical_breakpoints/.
- 17.Cercenado E, Cantón R. Procedimientos en Microbiología clínica número 38. Detección fenotípica de mecanismos de resistencia en gramnegativos. 2 o 2011. http://www.seimc.org/contenidos/documentoscientificos/procedimientosmicrobiologia/seimc-procedimientomicrobiologia38.pdf.
- 18.Rodríguez-Baño J, Cisneros JM, Cobos-Trigueros N. Diagnosis and antimicrobial treatment of invasive/severe infections due to multidrug-resistant Enterobacteriaceae. Guidelines from the Spanish Society of Infectious Diseases and Clinical Microbiology (SEIMC). 2014:1–109. doi: 10.1016/j.eimc.2014.11.009. [DOI] [Google Scholar]
- 19.Rodríguez-Baño J, Cisneros JM, Gudiol C, Martínez JA. Treatment of infections caused by carbapenemase-producing Enterobacteriaceae. Enferm Infecc Microbiol Clin 2014;32:49–55. doi: 10.1128/CMR.00079-17. [DOI] [PubMed] [Google Scholar]
- 20.Horcajada JP, Torre-Cisneros J, Peña C, Fariñas MC. Future alternatives for the treatment of infections caused by carbapenemase- producing Enterobacteriaceae: What is in the pipeline? Enferm Infecc Microbiol Clin 2014;32:56–60. doi: 10.1016/S0213-005X(14)70175-2. [DOI] [PubMed] [Google Scholar]
- 21.Martínez-Martínez L, González-Lopez J. Carbapenemases in Enterobacteriaceae: Types and molecular epidemiology. Enferm Infecc Microbiol Clin 2014;32:4–9. doi: 10.1016/S0213-005X(14)70168-5. [DOI] [PubMed] [Google Scholar]
- 22.Gutiérrez-Gutiérrez B, Salamanca E, de Cueto M, Hsueh PR, Viale P, Paño-Pardo JR, et al. . Effect of appropriate combination therapy on mortality of patients with bloodstream infections due to carbapenemase-producing Enterobacteriaceae (INCREMENT): A retrospective cohort study. Lancet Infect Dis 2017;3099:1–9. doi: 10.1016/S1473-3099(17)30228-1. [DOI] [PubMed] [Google Scholar]
- 23.Madueño A, González García J, Fernández-Romero S, Oteo J, Lecuona M. Dissemination and clinical implications of multidrug-resistant Klebsiella pneumoniae isolates producing OXA-48 in a Spanish hospital. J Hosp Infect 2017;96:116–22. doi: 10.1016/j.jhin.2017.02.024. [DOI] [PubMed] [Google Scholar]
- 24.Oteo J, Calbo E, Rodríguez-Baño J, Oliver A, Hornero A, Ruiz-Garbajosa P, et al. . La amenaza de las enterobacterias productoras de carbapenemasas en España: Documento de posicionamiento de los grupos de estudio GEIH y GEMARA de la SEIMC. Enferm Infecc Microbiol Clin 2014;32:666-70. doi: 10.1016/j.eimc.2014.02.011. [DOI] [PubMed] [Google Scholar]
- 25.Paño-Pardo JR, Ruiz-Carrascoso G, Navarro-San Francisco C, Gómez-Gil R, Mora-Rillo M, Romero-Gómez MP, et al. . Infections caused by oxa-48-producing Klebsiella pneumoniae in a tertiary hospital in Spain in the setting of a prolonged, hospital-wide outbreak. J Antimicrob Chemother 2013;68:89–96. doi: 10.1093/jac/dks364. [DOI] [PubMed] [Google Scholar]
- 26.Oteo J, Hernández JM, Espasa M, Fleites A, Sáez D, Bautista V, et al. . Emergence of OXA-48-producing Klebsiella pneumoniae and the novel carbapenemases OXA-244 and OXA-245 in Spain. J Antimicrob Chemother 2013;68:317–21. doi: 10.1093/jac/dks383. [DOI] [PubMed] [Google Scholar]
- 27.Oteo J, Ortega A, Bartolomé R, Bou G, Conejo C, Fernández-Martínez M, et al. . Prospective multicenter study of carbapenemase-producing Enterobacteriaceae from 83 hospitals in Spain reveals high in vitro susceptibility to colistin and meropenem. Antimicrob Agents Chemother 2015;59:3406–12. doi: 10.1128/AAC.00086-15. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Asensio Á, Cantero M, Shaw E, Vergara-Lopez S. Control strategies for carbapenemase-producing Enterobacteriaceae at different levels of the healthcare system. Enferm Infecc Microbiol Clin 2014;32:61–6. doi: 10.1016/S0213-005X(14)70176-4. [DOI] [PubMed] [Google Scholar]
- 29.Patel G, Huprikar S, Factor SH, Jenkins SG, Calfee DP. Outcomes of Carbapenem‐Resistant Infection and the Impact of Klebsiella pneumoniae Antimicrobial and Adjunctive Therapies Outcomes of Carbapenem-Resistant Klebsiella pneumoniae Infection and the Impact of Antimicrobial and Adjunctive Therapies. Infect Control Hosp Epidemiol 2008;29:1099–106. doi: 10.1086/592412. [DOI] [PubMed] [Google Scholar]
- 30.Schwaber MJ, Klarfeld-Lidji S, Navon-Venezia S, Schwartz D, Leavitt A, Carmeli Y. Predictors of carbapenem-resistant Klebsiella pneumoniae acquisition anions hospitalized adults and effect of acquisition on mortality. Antimicrob Agents Chemother 2008;52:1028–33. doi: 10.1128/AAC.01020-07. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Gasink LB, Edelstein PH, Lautenbach E, Synnestvedt M, Fishman NO. Risk Factors and Clinical Impact of Carbapenemase–Producing Klebsiella pneumoniae Risk Factors and Clinical Impact of Klebsiella pneumoniae Carbapenemase–Producing K. pneumoniae. Infect Control Hosp Epidemiol Control Hosp Epidemiol 2009;30:1180–5. doi: 10.1086/648451. [DOI] [PMC free article] [PubMed] [Google Scholar]