RESUMEN
La fiebre Q es una antropozoonosis cuyo agente causal es Coxiella burnetii que presenta una repercusión importante desde el punto de vista de la salud humana y animal. En esta revision, inicialmente se ha realizado una breve referencia histórica de la infección por C. burnetii y la fiebre Q. En un segundo apartado se describen los aspectos epidemiológicos básicos de esta infección (reservorios/fuentes de infección, forma de transmisión y formas epidemiológicas). Posteriormente se indican los datos de la infección por C. burnetii en España, tanto las series clínicas, los estudios seroepidemiológicos en humanos, la afectación de diferentes tipos de mamíferos y la participación de las garrapatas en el ciclo biológico. Además, se incluyen los datos básicos de la infección/enfermedad por C. burnetii en otras regiones del mudo. Finalmente, y teniendo en cuenta los datos previos se indican las principales características epidemiológicas de la fiebre Q en la actualidad.
Palabras clave: Fiebre Q, Coxiella burnetii, Epidemiología, España
ABSTRACT
Q fever is an anthropozoonosis whose causative agent is Coxiella burnetii, which has an important impact from the human and animal health point of view. In this review, a brief historical reference of the infection by C. burnetii and Q fever has been made initially. In a second section the basic epidemiological aspects of this infection are described (reservoirs/ sources of infection, form of transmission and epidemiological forms). Subsequently, the data of the infection by C. burnetii in Spain will be are indicated, particularly the clinical series, the seroepidemiological studies in humans, the affectation of different types of mammals and the participation of the ticks in the biological cycle. In addition, basic data on C. burnetii infection/ disease in other regions of the world will be are also included. Finally, and taking into account the previous data will indicate the main epidemiological characteristics of Q fever at present.
Keywords: Q fever, Coxiella burnetii, Epidemiology, Spain
La fiebre Q es una importante zoonosis de distribución mundial causada por Coxiella burnetii [1-6]. En esta revision, tras una breve referencia histórica, se describirán los aspectos epidemiológicos básicos de esta infección. Posteriormente se indicarán los datos de la infección por C. burnetii en España, así como una referencia a las principales series de otros países. Con los datos previos se señalarán las principales características epidemiológicas de la fiebre Q en la actualidad.
ASPECTOS HISTÓRICOS
Las primeras menciones acerca de esta enfermedad corresponden al final de la década de los 30 del siglo XX [7-9]. Así, en 1935 se describió una enfermedad que afectó a nueve trabajadores de un matadero de Queensland (Brisbane, Australia). Este cuadro clínico recibió la denominación de fiebre Q por Derrick y se caracterizaba por un síndrome febril con una duración entre 7 y 24 días acompañado de cefalea, astenia, anorexia y dolor en las extremidades inferiores con hemocultivos y pruebas serológicas frente a influenza, tifus, leptospiras, fiebre recurrente, fiebre tifoidea y paratifoidea negativos. La denominación de esta enfermedad como “fiebre Q “(“until fuller knowledge should allow a better name”) hace referencia al “misterioso” origen de la enfermedad (en inglés “query” significa duda, pregunta o interrogación) y no a su descripción en Queensland [7].
La identificación del agente causal tuvo lugar, de forma casi simultánea, en dos partes del Mundo. Por un lado, el agente causal fue aislado de los trabajadores infectados tras inoculación a cobayas, identificándose en el hígado y bazo como una rickettsia por Burnet y Freeman en 1937. En ese momento se denominó al microorganismo causal Rickettsia burnetii. Por otro lado, en Nine Mile Creek (Montana, EE.UU.), Davis y Cox publicaron en 1938 la detección de un agente filtrable en una garrapata de la zona (Dermacentor andersoni) al que denominaron Rickettsia diaporica. Además, el propio director del NIH (Instituto Nacional de Salud) (Dyer), revisando los estudios de Cox, desarrolló un cuadro clínico similar al descrito por Derrick en Australia lo que sugirió que ambos agentes causales eran similares. Teniendo en cuenta que algunas de las características de los microorganismos no correspondían exactamente a las de las especies del género Rickettsia, se denominó al agente causal Coxiella burnetii, en honor a dos de los autores responsables.
Junto a la fiebre de las trincheras y el tifus epidémico, la fiebre Q causó epidemias en los ejércitos que lucharon en Europa en la Segunda Guerra Mundial. Así, las tropas estadounidenses que ocuparon Italia presentaron cinco brotes bien documentados de fiebre Q entre el invierno de 1944 y la primavera de 1945, principalmente relacionados con la residencia en edificios ocupados previamente por animales domésticos. También los soldados alemanes fueron afectados por esta enfermedad tras su estancia en Serbia (denominándose Balkan Grippe), Italia, Crimea, Grecia, Ucrania y Córcega. Curiosamente, los civiles residentes habituales de esas regiones parecían resistir la infección y, de hecho, se encontraba entre ellos una alta tasa de anticuerpos residuales frente a C. burnetii. Esto sugería que la infección era ya endémica en la cuenca del Mediterráneo en la época de su descripción en Australia.
Desde entonces y hasta la actualidad, las referencias biblográficas acerca de diferentes aspectos de la fiebre Q (caracterización del agente causal, aspectos genéticos, patrones epidemiológicos, formas clínicas, métodos diagnósticos y medidas terapéuticas), se han incrementado de forma exponencial.
EPIDEMIOLOGÍA GENERAL
La fiebre Q es una antropozoonosis, con diferentes patrones epidemiológicos de distribución mundial (aunque con una prevalencia diferente atendiendo a países y regiones geográficas), y con una repercusión importante desde el punto de vista médico y económico [2-5,10]. En este sentido, desde el punto de vista veterinario y ganadero, la enfermedad acarrea pérdidas económicas al ser una causa importante de abortos. Por otra parte, en algunas zonas endémicas, la fiebre Q aguda puede presentarse en forma de brotes epidémicos que suponen un claro problema de salud pública, con padecimientos individuales, alto coste sanitario y absentismo laboral. Finalmente, aunque menos frecuente, la forma crónica de la enfermedad humana es muy grave, de tratamiento complejo y costoso y mortalidad no despreciable.
En los próximos apartados señalaremos las principales características de esta definición y las características epidemiológicas básicas de esta infección.
Fiebre Q como antropozoonosis
Las zoonosis son infecciones que se transmiten en condiciones naturales desde los animales al ser humano o viceversa. Se subclasifican en dos tipos principales: las antropozoonosis, en las que el agente patógeno es transmitido principalmente desde el animal al ser humano y las zooantroponosis en las que el microorganismo es transmitido desde las personas a los animales. La fiebre Q puede clasificarse principalmente como una antropozoonosis. Lógicamente, estas entidades son de más difícil erradicación que las infecciones cuyo único reservorio es el ser humano.
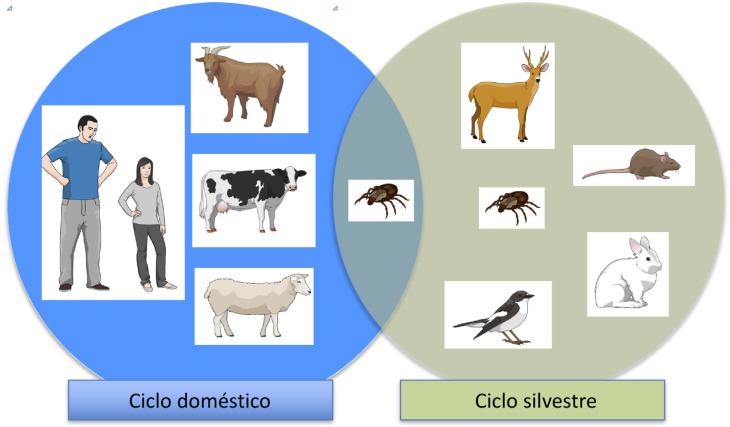
En la epidemiología de la fiebre Q es importante distinguir tres tipos de reservorios y/o fuentes de infección. En primer lugar se encuentran los animales domésticos o peridomésticos, constituidos principalmente por ganado caprino, ovino y bovino, y en menor medida gatos y perros [11]. Un segundo reservorio estaría formado por animales “silvestres”, principalmente roedores y pequeños mamíferos, aunque también ocasionalmente aves, reptiles, anfibios y peces [1]. Finalmente, varios tipos de garrapatas constituyen un importante reservorio de este agente patógeno (ver más adelante). La interacción entre el ser humano y los tres reservorios / fuentes de infección adopta dos patrones diferentes, aunque ligados entre sí: el ciclo salvaje y el ciclo doméstico (figura 1). En el ciclo salvaje, la infección de los animales salvajes y las garrapatas es el elemento clave mientras que en el ciclo doméstico es la interacción entre seres humanos y ganado. La confluencia, cada vez más estrecha, entre ambos ciclos ha llevado probablemente a una emergencia de casos en humanos.
Figura 1.
Ciclo doméstico y silvestre de la infección por C. burnetii.
Transmisión de C. burnetii al ser humano
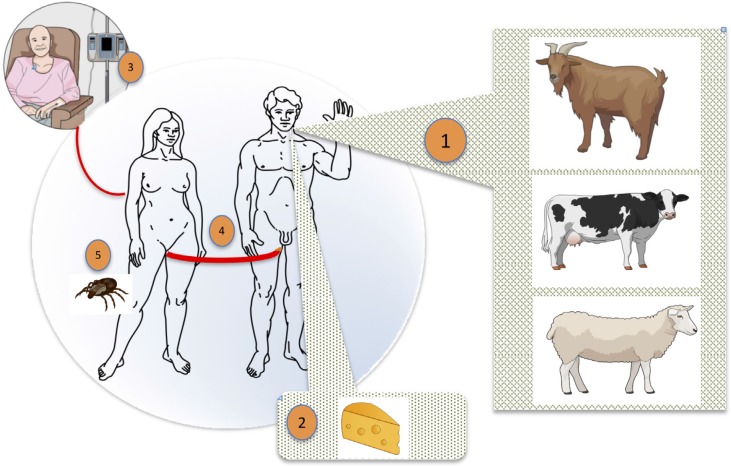
La infección en humanos por C. burnetii se produce principalmente por vía aérea, aunque se han descrito otras vías de menor importancia como la vía oral o la transmisión interhumana no profesional y otras excepcionales como la picadura de garrapatas [1-4] (figura 2).
Figura 2.
Formas de transmisión de C. burnetii al ser humano
1. Aérea. 2. Leche y derivados 3. Transfusiones 4. Sexual. 5. Garrapatas.
Transmisión por vía aérea. Sin lugar a dudas, la forma más habitual de trasmisión de infección por C. burnetii es la inhalación del agente patógeno procedente de productos patológicos de los animales domésticos infectados. Los principales fluidos contaminantes son la leche, orina, heces, y, principalmente, los derivados placentarios [12]. Por ello, la infección es más frecuente en personas que están en contacto directo con ganado o sus productos biológicos (lana, cuero, leche y derivados, paja infectada o polvo de la ropa), ya que la carga bacteriana ambiental es más elevada y además persiste durante mucho tiempo (meses e incluso años). Por todo ello, esta infección es más frecuente en granjeros, veterinarios o trabajadores de mataderos. Además, la bacteria puede transmitirse por esta vía entre humanos principalmente a sanitarios en contacto con tejidos de pacientes con fiebre Q (p. ej. microbiólogos [8,9], obstetras [13] o anatomopatólogos [4]).
Sin embargo, en un tanto por ciento importante de casos no se encuentra este factor epidemiológico, correspondiendo a casos urbanos sin contacto directo con animales o productos derivados de ellos. La explicación más plausible es la gran virulencia de C. burnetii y su capacidad para ser transmitida a muchos kilómetros de distancia del foco de origen [14,15]. Además, en los últimos años se ha comprobado la capacidad de C. burnetii para infectar amebas de vida libre (p. ej. Acanthamoeba castellanii), presentes en sistemas de aire acondicionado y responsables potenciales de algunos brotes [16]. Desde un punto de vista biológico tendría su explicación, debido a las características que incluyen a C. burnetii en la familia Legionellaceae. Por ello, las amebas de vida libre podrían constituir un nuevo nicho ecológico.
Transmisión por vía oral. Aunque se ha demostrado de forma constante la presencia de C. burnetii en la leche de animales infectados [17] y se ha asociado la fiebre Q a la ingesta de queso [18], no existen datos concluyentes de que la ingesta de lactoderivados estos productos sea responsable de la aparición de fiebre Q [4].
Transmisión interhumana no profesional. De forma excepcional se ha documentado la transmisión de C. burnetii por hemoderivados [19] y por vía sexual, identificándose el microorganismo en el semen [20,21].
Transmisión directa desde garrapatas. Aunque las garrapatas juegan un papel importante en los ciclos biológicos de C. burnetii, la transmisión directa de garrapatas a humanos es excepcional [22].
Patrones epidemiológicos
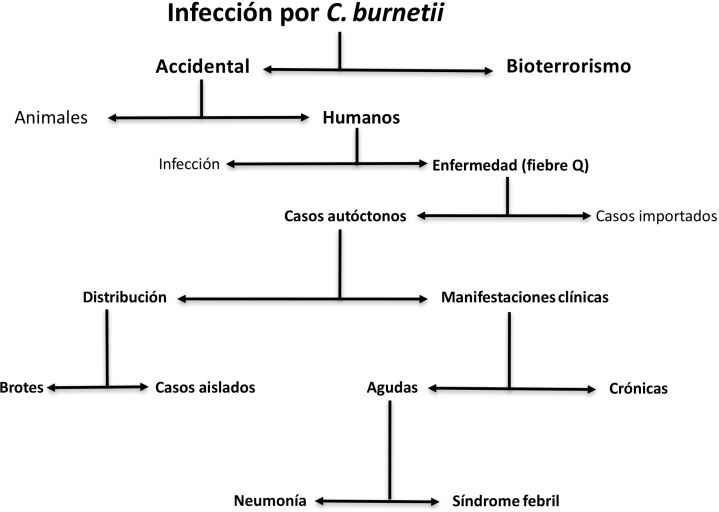
La infección por C. burnetii en la naturaleza se relaciona con un gran número de posibilidades epidemiológicas (figura 3). Así, las infecciones por este microorganismo son adquiridas de forma accidental, aunque C. burnetii es un potencial agente de bioterrorismo [9,23]. Las principales características que sustentan su clasificación como agente de bioterrorismo B son su facilidad de obtención y multiplicación, la resistencia a condiciones ambientales adversas, la vía aérea de transmisión y la diseminación a grandes distancias [1]. Sin embargo, la letalidad es baja y no todas las personas expuestas desarrollan enfermedad [1].
Figura 3.
Patrones epidemiológicos de la infección por C. burnetii.
Dentro de las formas accidentales, la fiebre Q posee importancia en dos contextos diferentes: la afectación de la cabaña ganadera y la infección en humanos. En esta revisión se han considerado principalmente los aspectos médicos, señalando exclusivamente los datos veterinarios en relación a la infección humana.
Tras el contacto del ser humano con C. burnetii, no todos los sujetos desarrollan infección. Por otro lado, dentro de los que adquieren la infección (detectada por métodos serológicos), no todos ellos desarrollan manifestaciones clínicas, es decir, enfermedad.
La fiebre Q se presenta habitualmente como enfermedad autóctona, aunque el número de casos importados publicados en los últimos años ha sido progresivamente mayor [24-32]. Los casos de fiebre Q autóctonos pueden presentarse en forma de brotes, de mayor o menor importancia o como casos aislados. En ambas situaciones la fiebre Q puede manifestarse de forma aguda o crónica. Además, las formas agudas presentan dos formas principales: neumónica y febril.
DISTRIBUCIÓN GEOGRÁFICA GENERAL
La infección por C. burnetii presenta una distribución mundial. Sin embargo, la construcción de un “mapa” unívoco de esta infección se encuentra con tres problemas fundamentales: i) las múltiples formas epidemiológicas de la infección señaladas en el apartado anterior (p. ej. datos clínicos, seroprevalencia, datos en animales domésticos y salvajes, infección de garrapatas), ii) la consideración de “no declarable de forma obligatoria” de esta enfermedad en muchos países y iii) el interés en el estudio de esta entidad. Así, estamos totalmente de acuerdo con una sentencia clásica de Didier Raoult, uno de los autores más importantes en el estudio de la fiebre Q y de las rickettsiosis, que indica acerca de la fiebre Q: “differences in prevalence are mainly related to differences in interest” [33].
Las referencias publicadas recogidas en bases internacionales son muy numerosas tanto acerca de la fiebre Q como sobre C. burnetii. Un número importante se refieren a aspectos epidemiológicos. En esta revisión nos centraremos en los datos de la bibliografía española señalando algunos aspectos importantes descritos en en otros países.
Fiebre Q en España
La descripción de casos de infección por C. burnetii en España tiene lugar en torno a los años 50 del siglo XX. En aproximadamente 3 años se describe la presencia del microorganismo en garrapatas (Hyalomma marginatum, Rhipicephalus bursa y Rhipicephalus sanguineus) en Madrid y Sevilla [34], el primer caso en humanos en Salamanca [35] y la presencia de anticuerpos en fauna silvestre (conejos y lirones) en Madrid [36].
A partir de los años 80 del siglo pasado, el interés por esta enfermedad ha sido creciente, detectándose tanto casos de fiebre Q aislados como en brotes, estudiándose la seroprevalencia de la infección en diferentes regiones y evaluándose la infección en animales domésticos y silvestres.
En las tablas 1 y 2 se indican las principales series de casos publicados de fiebre Q en España desde 1980 hasta la actualidad [37-75]. Específicamente, en la tabla 1 se indica la fecha de publicación y el primer autor responsable de la misma, la comunidad en la que se describió, el perfil epidemiológico básico (brote y/o casos esporádicos), el número de casos, la edad de los pacientes y la distribución por géneros. En la tabla 2 se incluyen otros datos epidemiológicos de interés como el ámbito de adquisición (distinguiendo los casos rurales y urbanos), la distribución estacional [Primavera (Marzo, Abril y Mayo); Verano (Junio, Julio, Agosto), Otoño (Septiembre, Octubre, Noviembre) e Invierno (Diciembre, Enero, Febrero)] o no, el contacto con animales y la forma clínica de presentación (aguda o crónica y, dentro de los casos agudos la presencia de neumonía o síndrome febril sin foco aparente).
Tabla 1.
Series de casos de fiebre Q publicadas en España. Aspectos epidemiológicos básicos
| Ref | Primer autor | Año | Comunidad | Tipo | Nº casos | Edad | Varones |
|---|---|---|---|---|---|---|---|
| 37 | Sobradillo V. | 1983 | Euskadi | Brote | 10 | 15-59 | 30% |
| 38 | Montejo M. | 1983 | Euskadi | Esporádicos | 11 | 17-65 | 80% |
| 39 | Aguirre C. | 1984 | Euskadi | Brote | 42 | 5-56 | 58% |
| 40 | Martínez F. | 1985 | Andalucía | Esporádicos | 34 | 8-68 | 59% |
| 41 | Fernández R. | 1985 | Madrid | Esporádicos | 37 | 13-57 | 72% |
| 42 | Montejo M. | 1985 | Euskadi | Mixto | 130a | 5-67 | 74% |
| 43 | Rubiés J. | 1986 | Cataluña | Esporádicos | 5 | 25-38 | 100% |
| 44 | Fernández M. | 1998 | Madrid | Esporádicos | 3 | 28-43 | 33,3% |
| 45 | Sobradillo V. | 1999 | Euskadi | Esporádicos | 116 | 30 ± 15 | 77% |
| 46 | Millán M. | 1989 | Canarias | Esporádicos | 35 | 40 | 80% |
| 47 | Rotaeche R. | 1990 | Euskadi | Brote | 5 | 12-46 | 60% |
| 48 | Antón E. | 1990 | Euskadi | Esporádicos | 60 | 14-87 | 80% |
| 49 | Murie M. | 1991 | Navarra | Esporádicos | 19 | 27 | 83% |
| 50 | Martínez JM. | 1992 | Euskadi | Brote | 30 | 17-55 | 90% |
| 51 | Bella F. | 1994 | Cataluña | Esporádicos | 17 | 32 ± 11 | 82% |
| 52 | Pascual F. | 1996 | Canarias | Esporádicos | 94 | 39 FID | ND |
| 54 Neumonía | |||||||
| 53 | Merino FJ. | 1998 | Castilla-‐León | Esporádicos | 13 | 10-41 | 85% |
| 54 | Abad A. | 1999 | Euskadi | Esporádicos | 73 | 1-68 | 78% |
| 55 | Domingo P. | 1999 | Cataluña | Esporádicos | 63 | 19-72 | 92% |
| 56 | Nebreda T. | 2001 | Soria | Brote | 18 | 14-26 | 86% |
| 57 | Nuño FJ. | 2002 | Asturias | Mixtoa | 12 | 24-85 | 75% |
| 58 | Alarcón A. | 2003 | Andalucía | Esporádicos | 231 | 8-77 | 85% |
| 59 | Bolaños M. | 2004 | Canarias | Esporádicos | 40 | 20-74 | 85% |
| 60 | Sampere M. | 2003 | Cataluña | Esporádicos | 66 | 45±18 | 85% |
| 61 | Romero MJ. | 2003 | Andalucía | Esporádicos | 109 | 31±12 | 92% |
| 62 | Miguélez M. | 2003 | Canarias | Esporádicos | 47 | 22-77 | 96% |
| 63 | Bartolomé J. | 2004 | Castilla.LaMancha | Esporádicos | 35 | 7-67 | 71% |
| 64 | Ramos JM. | 2005 | Valenciana | Esporádicos | 30 | ND | 73% |
| 65 | de los Ríos R. | 2006 | Madrid | Brote | 22 | ND | ND |
| 66 | García M. | 2004 | Asturias | Esporádicos | 60 | 46 ± 17 | 72% |
| 67 | Muñoz A. | 2007 | Extremadura | Esporádicos | 124 | 14-77 | 80% |
| 68 | Parra J. | 2008 | Andalucía | Esporádicos | 32 | ND | ND |
| 69 | Espinosa N. | 2010 | Andalucía | Esporádicos | 111 | ND | ND |
| 70 | Ruiz Seco MP. | 2011 | Madrid | Esporádicos | 54 | ND | 81% |
| 71 | Mogollón MV. | 2011 | Multicéntrico | Esporádicos | 83 | 44 ± 14 | 78% |
| 72 | Oteo JA. | 2012 | Rioja | Esporádicos | 2 | 51-74 | 100% |
| 73 | Raya M. | 2014 | Baleares | Esporádicos | 87 | 21-89 | 79% |
| 74 | Espejo F. | 2014 | Cataluña | 71 | |||
| Canarias | Esporádicos | 85 | 42 ± 15 | 80% | |||
| La Rioja | 27 | ||||||
| 75 | Alonso E | 2015 | Euskadi | Brote | 50 | 23-57 | 82% |
Incluye pacientes de referencias previas ND. Datos no disponibles
Tabla 2.
Series de casos de fiebre Q publicadas en España. Otros aspectos epidemiológicos
| Ref | Comunidad | Ámbito | Estación | Animales | Forma clínica |
|---|---|---|---|---|---|
| 37 | Euskadi | Rural | Verano | NO | Aguda (Neumonía) |
| 38 | Euskadi | Mixto Rural (50%) | - | SI | Aguda (Neumonía) |
| 39 | Euskadi | Rural | Primavera | SI | Aguda (Neumonía) |
| Aguda | |||||
| 40 | Andalucía | Mixto Rural (50%) | - | SI (50%) | |
| Fiebre (2/3) Neumonía (1/3) | |||||
| 41 | Madrid | - | Verano | SI (30%) | Aguda (32)/Crónica (5) |
| 42 | Euskadi | Rural | Primavera | SI | Aguda (Neumonía) |
| 43 | Cataluña | Urbana | - | NO | Aguda (Fiebre) |
| 44 | Madrid | - | - | - | Crónica |
| 45 | Euskadi | Mixto Rural (50%) | Invier/Prim. | SI (18%) | Aguda (Neumonía) |
| 46 | Canarias | Rural | Prim/Ver | SI (85%) | Aguda (Fiebre) |
| 47 | Euskadi | Rural | Invierno | SI | Aguda Neumonía (3) Fiebre (2) |
| 48 | Euskadi | Rural | Otoño | Si (17%) | Aguda (Neumonía) |
| 49 | Navarra | - | Invier/Prim. | - | Aguda (Neumonía) |
| 50 | Euskadi | Rural | Primavera | - | Aguda (Fiebre) |
| 51 | Cataluña | Urbana | - | - | Aguda (Fiebre) |
| 52 | Canarias | Rural | - | - | Aguda (Fiebre) |
| 53 | Castilla-León | - | - | Si (15%) | Aguda (Neumonía) |
| 54 | Euskadi | - | - | - | Aguda Neumonía (75%) |
| 55 | Cataluña | Urbana | Primavera | NO | Aguda Fiebre (54%) |
| 56 | Soria | Rural | Primavera | SI (21%) | Aguda (Neumonía 50%) |
| 57 | Asturias | Urbana | - | SI (25%) | Aguda (Neumonía ) |
| 58 | Andalucía | Mixto Urbana (53%) | Primavera | SI (39%) | Aguda Fiebre (90%) |
| 59 | Canarias | Mixto Rural (67%) | Prim./Ver. | SI (38%) | Aguda Fiebre (92%) |
| 60 | Cataluña | Urbano | Invier./Prim. | SI (33%) | Aguda (Neumonía 55%) |
| 61 | Andalucía | Mixto Rural (50%) | - | SI (27%) | Aguda Fiebre (98%) |
| 62 | Canarias | - | - | SI (51%) | Aguda (Fiebre) |
| 63 | Castilla La Mancha | Mixto Urbana (71%) | No | SI (27%) | Aguda Fiebre (71% |
| 64 | Valenciana | Mixto Urbano (67%) | No | SI (80%) | Aguda Fiebre (87%) |
| 65 | Madrid | Rural | Primavera | SI | Aguda (Fiebre) |
| 66 | Asturias | Mixto Urbana (52%) | Invierno | Si (7%) | Aguda (Neumonía) |
| 67 | Extremadura | Mixto Rural (61%) | Invierno Primavera | SI (47%) | Aguda (Fiebre 94%) |
| Crónica (6%) | |||||
| 68 | Andalucía | - | - | - | Aguda (Fiebre) |
| 69 | Andalucía | - | - | - | Aguda (Fiebre) |
| 70 | Madrid | Mixto Urbano (52%) | No | SI (59%) | Aguda (92%) Neumonía (55%) |
| Crónica (8%) | |||||
| 71 | Multicéntrico | - | - | - | Endocarditis |
| 72 | La Rioja | - | - | - | Endocarditis |
| 73 | Baleares | Mixto Rural (45%) | Prim./Ver. | SI (46%) | Aguda Neumonía (66%) |
| Cataluña | Primavera | Aguda (Fiebre 80%) | |||
| 74 | Canarias | - | Primavera | - | Aguda (Fiebre 70%) |
| La Rioja | Invierno | Aguda (Fiebre 54%) | |||
| Aguda (Fiebre 54%) | |||||
| 75 | Bilbao | Urbano | Invierno | NO | |
| Aguda (Neumonía 26%) |
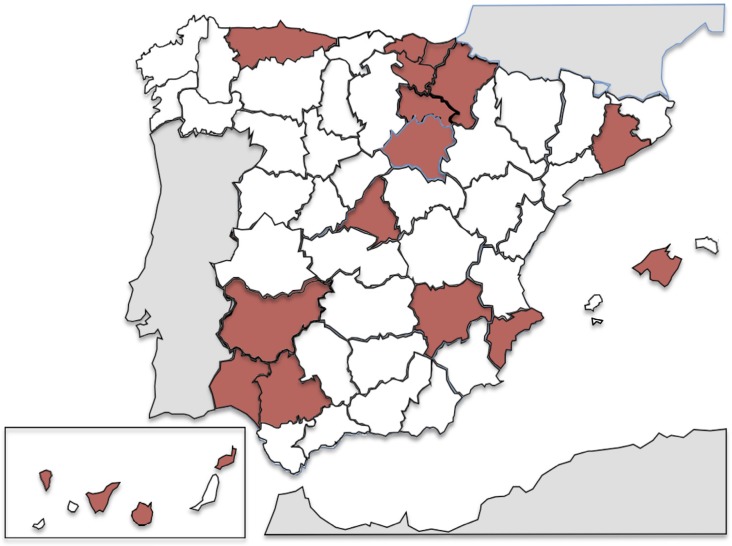
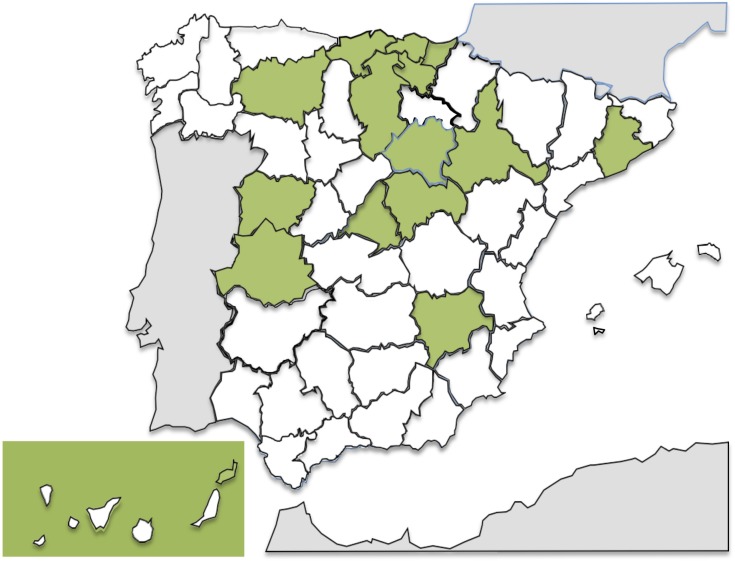
En la figura 4 se representan las comunidades en las que existen series publicadas de fiebre Q.
Figura 4.
Distribución de las series publicadas de fiebre Q en España
En la tabla 3 se indican los principales estudios seroepidemiológicos acerca de la prevalencia de infección por C. burnetii en humanos, el año de estudio y el contexto en el que se realizó [76-91].
Tabla 3.
Estudios de infección en humanos por C. burnetii publicados en España
| Ref | Primer autor | Año | Comunidad (Nº) | Contexto (Nº) | Técnica/Seroprevalencia |
|---|---|---|---|---|---|
| 76 | Daza RM. | 1980 | Madrid | Donantes | Microaglutinación: 6,2% |
| 77 | Téllez A. | 1989 | Madrid | Población general Rural (130), Urbana (91) | IFA: 8,8% (urbano)-15,4% (rural) |
| Extremadura | Población general (180) | Fijación de complemento 59,3% | |||
| 78 | Cour MI. | 1990 | Castilla-La Mancha | (86) | 32,3% |
| Madrid | (577) | 27,5-34,5% | |||
| 79 | Ruiz Beltrán R. | 1990 | Castilla-León | Población general (400) | IFA :50,2% (IgG fase II ≥ 1:40) |
| 80 | Pascual F. | 1992 | Canarias (390) | Población general (390) | Fijación de complemento 4,7-13,5% (IgG fase II ≥ 1:8) |
| 81 | Saz JV. | 1993 | Castilla León | Población general (298) | IFA: 20.8% (IgG fase II ≥ 1:80) |
| 82 | Sanzo JM. | 1993 | Euskadi | Población general (810) | IFA≥ 1/20: 32,35% IFA≥ 1/40:26,4% |
| 83 | Pérez Trallero E. | 1995 | Euskadi | Mataderos (39) | IFA : 91,7%(IgG fase II ≥ 1:80) |
| 84 | Suárez J. | 1996 | Castilla-León | Población general (406) | IFA: 60,6% (IgG fase II ≥1:80) |
| 85 | Pascual F. | 1998 | Cantabria | Población general (595) | IFA: 48,6% (IgG fase II ≥ 1:16) IFA: 37,8% ( IgG fase II ≥1:64) |
| 86 | Valencia MC. | 2000 | Aragón | Estudiantes de Veterinaria (480) | Fijación del complemento ≥ 1:10 10,02% comienzo de curso 11,02% final de curso |
| 87 | Bolaños M. | 2003 | Canarias | Población general (662) | IFA: 21,5% (IgG fase II ≥ 1:80) |
| 88 | Cardeñosa N. | 2006 | Cataluña | Población general (216) | IFA: 15% (IgG fase II ≥ 1:40) |
| 89 | Bartolomé J. | 2007 | Castilla-La Mancha | Donantes de sangre (863) | IFA: 23% (IgG fase II≥ 1:80) |
| 90 | González S. | 2014 | Castilla-La Mancha | Enfermedad cardiovascular (164) | IFA: 52% (IgG fase II≥ 1:256) |
| 91 | González S | 2015 | Castilla-León | Pacientes hospitalizados (634) | IFA: 14,5% Casos- 6,1% Control (IgG fase I ≥1:256) |
Los datos acerca de la prevalencia de infección por C. burnetii en animales domésticos en España [77, 92-102] se expresan en la tabla 4. Finalmente, en la tabla 5, se indican los datos relativos a la infección por C. burnetii en diferentes especies de garrapatas en varias regiones españolas [98,102-104].
Tabla 4.
Prevalencia de infección por C. burnetii en mamíferos en España
| Ref | Primer autor | Año | Comunidad | Tipo/s de mamífero/s Número | Técnica/Prevalencia |
|---|---|---|---|---|---|
| 92 | Palau L. | 1989 | Madrid | Rumiantes domésticos Bovinos (106) | Fijación de Complementoa 67% (IgG fase II ≥1:8) |
| 77 | Téllez A. | 1999 | Madrid | Rumiantes domésticos | Fijación de complemento≥1:8 Caprino (76,6%) |
| Bovino (17,7%) | |||||
| 93 | Barandika J. | 2007 | Euskadi | Micromamíferos silvestres (253) | PCR 3/253 |
| Apodemus sylvaticus (162) | Apodemus sylvaticus (1/162) | ||||
| Mus domesticus (28) | Mus domesticus (2/28) | ||||
| 94 | Ruiz Fons F. | 2008 | Andalucía Asturias | Rumiantes domésticos Mamíferos silvestres | IFA (IgG fase II ≥ 1:16) Corzos (15,4%) |
| Ciervo rojo silvestre (5,6%) Ciervo rojo doméstico (40%) Ganado bovino (39%) | |||||
| 95 | Navarro JA. | 2009 | Murcia | Ovinos Caprinos | PCR en placenta |
| 96 | Rodriguez. | 2010 | Canarias | ELISAc | |
| Caprino (733) | Caprino (60,4%) | ||||
| Ovinos (369) | Ovinos (31,7%) | ||||
| Bovinos (147) | Bovinos (12,2%) | ||||
| 97 | Ruiz Fons F. | 2010 | Euskadi | Rumiantes domésticos Ovinos (1.379) | ELISAb con FC posterior Ovinos (11,8%) |
| Bovinos (626) | Bovinos (6,7%) | ||||
| Caprinos (115) | Caprinos (8,7%) | ||||
| 98 | Astobiza I. | 2011 | Euskadi | Mamíferos silvestres | PCR |
| Carnívoros (206) | Carnívoros (0%) | ||||
| Lagomorfos (28) | Lagomorfos (7,1%) | ||||
| Ungulados (199) | Ungulados (8%) | ||||
| Pájaros silvestres | Pájaros (2%) | ||||
| 99 | Álvarez J. | 2012 | Madrid | Rumiantes domésticos Bovinos (1.100) | ELISAc 6,76% |
| 100 | Mentaberre G. | 2013 | Canarias | Camellos (100) | ELISAd 19% |
| 101 | Fernandez | 2016 | Pirineos Orientales | ELISA | |
| Animales salvajes (599) | Animales salvajes (1,3%) | ||||
| Animales domésticos (353) | Animales domésticos (9,3%) | ||||
| 102 | Bolaños | 2017 | Gran Canaria | PCR | |
| Roedores (100) | Roedores (8%) | ||||
| Conejos (129) | Conejos (1,5%) | ||||
Behring
ELISA Cox kit
IDVET
LSIVET
Tabla 5.
Prevalencia de infección por C. burnetii en garrapatas en España
| Ref | Primer autor | Año | Comunidad | Nº | Especies (n) | Infección por C. Burnetii |
|---|---|---|---|---|---|---|
| 103 | Barandika J. | 2008 | Euskadi | 691 | Ixodes ricinus (288) | 0% |
| Haemaphysalis punctata (109) | 1 (09%) | |||||
| Haemaphysalis inermis (95) | 0% | |||||
| Haemaphysalis conncina (52) | 0% | |||||
| Dermacentor reticulatus (97) | 0% | |||||
| Rhipicephalus bursa (50) | 0% | |||||
| 104 | Toledo A. | 2009 | Madrid | 1.482 | Hyalomma lusitanicum | 7,7% |
| Dermacentor marginatus | (80/1.039)a | |||||
| Rhipicephalus sanguineus | 3,4% | |||||
| Rhipicephalus pussilus | (15/443)b | |||||
| 98 | Astobiza I. | 2011 | Euskadi | 340 | Ixodes ricinus Ixodes hexagonus | |
| 0% | ||||||
| 102 | Bolaños M | 2017 | Gran Canaria | 377 | Rhipicephalus turanicus | 3,4%b |
| Hyalomma lusitanicum | 2,4%b | |||||
| Rhipicephalus sanguineus | 0,3%b |
Aisladas en la naturaleza;
Adheridas a animales
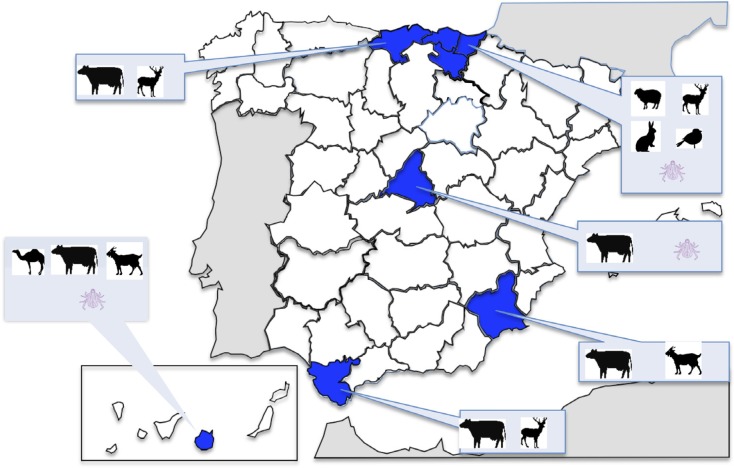
En las figuras 5 y 6 se recopila de forma gráfica la información de estos estudios.
Figura 5.
Distribución geográfica de los datos sero-epidemiológicos de infección por C. burnetii en España
Figura 6.
Estudios de infección por C. burnetii en animales
Fiebre Q en el mundo
Existe una abundante información acerca de la fiebre Q y la infección por C. burnetii en humanos y animales en todo el mundo. Una revisión exhaustiva de este aspecto escapa a los objetivos de esta revisión, por lo que únicamente señalaremos algunos aspectos de especial interés en humanos durante los últimos años.
Otros países europeos. En los últimos años se han publicado un número importante de trabajos sobre la infección por C. burnetii en varios países europeos [105-117].
En Francia, los estudios realizados entre 1982 y 2010 muestran una seroprevalencia entre el 1% (donantes de sangre) y el 71% en personas pertenecientes a grupos de riesgo [105]. En ese mismo periodo de tiempo, se han descrito siete brotes que incluían desde 5 hasta 289 personas, localizados en el Sudeste del país (Provenza, Alpes y Ródano) [105]. En otro trabajo, realizado en el mismo periodo de tiempo (1985-2009) por el grupo de Raoult [106], basado en la recogida de datos de 3.723 pacientes con confirmación serológica se observaron los siguientes datos: i) la incidencia anual de fiebre Q aguda es de 2,5/100.000 personas mientras que la incidencia de endocarditis es de 0,1/100.000 personas, ii) en los años de estudio se ha observado un incremento continuo en el número de casos y iii) la incidencia máxima tiene lugar entre Abril y Septiembre.
En Suiza, la incidencia de fiebre Q es baja (0,15/100.000 habitantes), aunque recientemente se ha descrito un brote de 15 personas en la zona de viñedos de Lavaux (próxima a las regiones francesas afectadas) [107].
Sin lugar a dudas, el mayor brote de casos de fiebre Q en la historia hasta la actualidad ha tenido lugar en Holanda durante los años 2007 a 2010 [105,108-111]. Este brote afectó a 4.026 personas en ese periodo de tiempo, siendo la incidencia máxima en 2008 (2354 individuos). El análisis de las características de este brote indicó varios aspectos de interés: i) La edad media de los pacientes fue de 50 años (RIC 21), con un discreto predominio en varones 62%); ii) La región que presentó un mayor número de casos fue Noord-Brabant, que aportó más del 50% de los pacientes; iii) Existía una asociación estadística con el hábito tabáquico; iv) Un 21% de los pacientes requirieron ingreso hospitalario; v) La forma clínica más frecuente fue la respiratoria (61,5%), describiéndose endocarditis en 3,1% de los pacientes; vi) Aunque existieron datos de asociación epidemiológica en varios grupos de pacientes, no pudo identificarse un único origen global de todo el brote; vii) Tampoco pudo identificarse un único genotipo en pacientes o animales estudiados, detectándose 10 tipos diferentes en el brote; viii) Las principales razones que sustentan la aparición de este brote son: el aumento de la cabaña ganadera en la región afectada, la estabulación en áreas abiertas, el método intensivo de cría, el aumento del número de abortos y la proximidad de la población a las granjas animales (aumento de casos si la distancia era menor de 5 Km) y ix) el control de la epidemia mediante diferentes medidas como la declaración obligatoria de abortos en animales, la implementación de las medidas de limpieza, la investigación de genoma de C. burnetii en los depósitos de leche y la vacunación, inicialmente voluntaria y posteriormente obligatoria de los animales.
Debido a la proximidad geográfica con Holanda, se realizó un estudio clínico y serológico en esas fechas en 69 trabajadores que manipulaban lana y pelo de animales en Bélgica [112]. De ellos, 35 (50,7%) presentaban evidencia serológica de contacto; 26 datos de infección pasada, 8 de infección reciente y 1 de infección crónica.
Se han publicado dos artículos de revisión importantes acerca de la incidencia de fiebre Q en Alemania que resumen las características de esta enfermedad desde 1947-1999 [113] y de 1982-2010 [105]. Los datos más destacables son: i) La identificación de 49 brotes con un número variable de personas afectas entre 1947-2010; ii) El aumento progresivo de casos en el periodo de tiempo mencionado; iii) Las diferencias geográficas, siendo la incidencia menor en el norte del país y mayor en el sur, especialmente en Baden-Württemberg, Hesse y Baviera y iv) el cambio estacional, desplazándose el mayor número de casos del periodo invierno-primavera a la temporada primavera-verano.
En Europa del Este, se han descrito brotes de fiebre Q especialmente en Bulgaria [105]. En este país se han identificado entre 1982 y 2010, seis brotes caracterizados por un número elevado de casos (desde 121 a más de 1.000 pacientes). Todos ellos se localizaron en 5 distritos (Sofia, Lovech, Pazerdjik, Veliko y Vraza) situados en la zona central y norte del país.
Finalmente, aunque se han demostrado casos de fiebre Q en las islas británicas, la incidencia de la enfermedad es estable y baja (en torno a 0,15 a 0,35 casos por 100.000 habitantes) y no presenta características diferenciales. Específicamente existen datos acerca de esta entidad en Inglaterra [114], Escocia [115], Gales [116] e Irlanda del Norte [117].
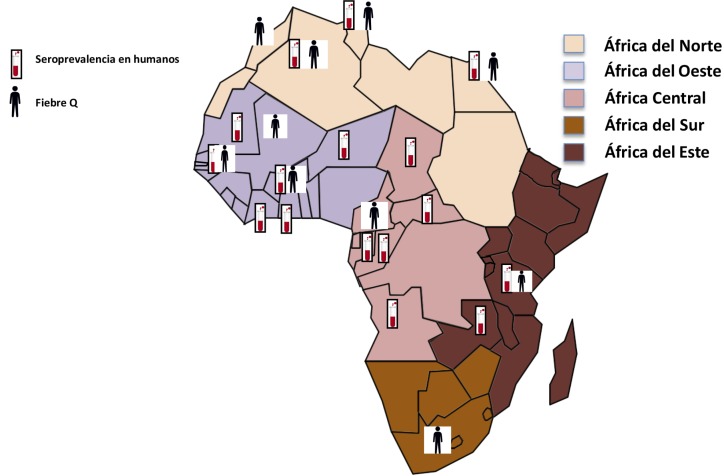
África. La información sobre la infección humana por C. burnetii en África es fragmentaria [118-128]. La mayor parte de las publicaciones evalúan la seroprevalencia de la infección en zonas concretas y sólo escasos trabajos estudian la participación de C. burnetii en humanos. Como se muestra en la figura 7, la mayor parte de los estudios han sido realizados en África del Norte y del Oeste.
Figura 7.
Estudios de infección por C. burnetii en humanos (África)
En la tabla 6 se indican los datos más relevantes de los pacientes con fiebre Q en los países señalados.
Tabla 6.
Estudios de infección por C. burnetii en humanos (África)
| Región | País/Referencia | Prevalencia/Incidencia | Observaciones |
|---|---|---|---|
| África del Norte | Argelia (125,127) | 7,5% (Urbanos) | Seroprevalencia |
| 35,5% (Rurales) | |||
| 0,3% | Síndrome febril | ||
| 3% | Endocarditis | ||
| 26% | Seroprevalencia | ||
| África del Oeste | Túnez (119,127,128) | 0-9% | Síndrome febril |
| 1-3% | Endocarditis | ||
| Egipto (124,127) | 32% | Seroprevalencia | |
| 0% | Neumonía | ||
|
| |||
| Mauritania (120) | 33% | Seroprevalencia | |
| Senegal (126) | 3,7% (Región de Diop) 24,8% (Región de Dielmo) | Seroprevalencia | |
| 2,5% | Síndrome febril | ||
| Burkina Fasso (127) | 8% | Seroprevalencia | |
| 5% | Síndrome febril | ||
| Costa de Marfil (127) | 5% | Seroprevalencia | |
| Ghana (123, 127) | 16,9% Niños | Seroprevalencia | |
| 8,9% Adultos | |||
| Costa de Marfil (127) | 5% | Seroprevalencia | |
| Niger (127) | 10% | Seroprevalencia | |
| Mali (122, 128) | 0-9,5% | Síndrome febril | |
| 24% | Seroprevalencia | ||
|
| |||
| África Central | Chad (127) | 1% | Seroprevalencia |
| Camerún (127) | 6-9% | Neumonía | |
| Gabón (128) | 0% | Síndrome febril | |
| R. Central Africana (118) | 9,1% | Seroprevalencia | |
| Congo (118) | 1% | Seroprevalencia | |
| Angola (118) | 1,8% | Seroprevalencia | |
|
| |||
| África del Sur | Sudáfrica (127) | 0% | Neumonía |
|
| |||
| África del Este | Zambia (121) | 8,2% | Seroprevalencia |
| Tanzania (127) | 5% | Seroprevalencia | |
| Tanzania (127) | 5% | Síndrome febril | |
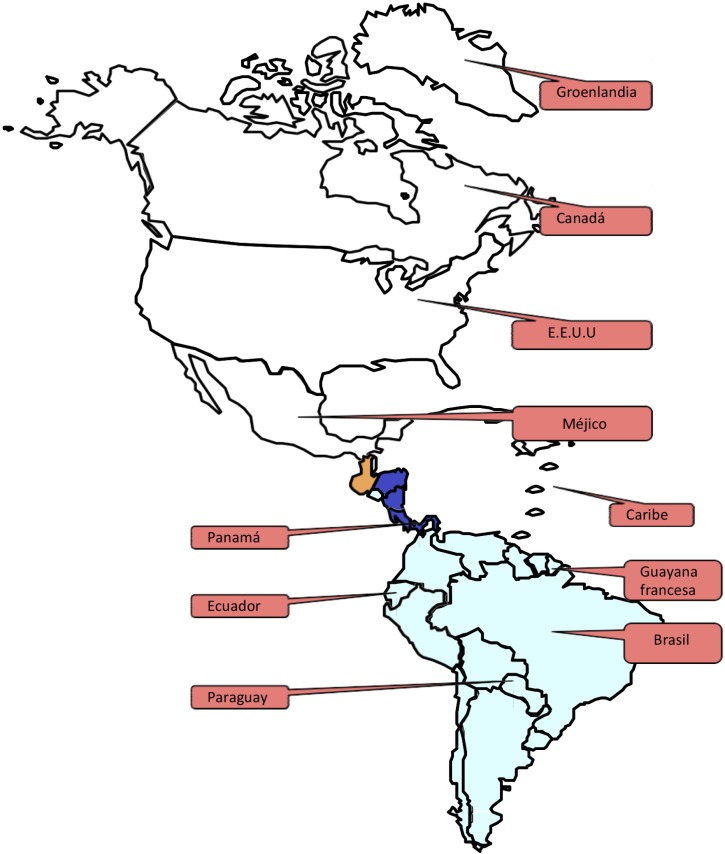
América. También se ha documentado infección humana por C. burnetii en América (figura 8).
Figura 8.
Estudios de infección por C. burnetii en humanos (América)
En América del Norte se han descrito casos en Groenlandia (políticamente dependiente de Dinamarca) [129], Canadá (Alberta y Nueva Escocia) [12,130], EEUU [131,132] y Méjico [133]. Se debe destacar que el número de casos notificados es muy escaso en todos los países mencionados.
Existen muy pocos datos de la incidencia de fiebre Q en América Central, aunque se ha estudiado la prevalencia de infección por C. burnetii en la zona continental (Panamá) [134] y en el Caribe [135], siendo de 9,4% y 2,3% respectivamente.
En América del Sur la infección por C. burnetii (específicamente el genotipo 17) es responsable de hasta el 24% de las neumonías adquiridas en la comunidad en la Guayana Francesa [136,137]. Por el contrario, la principal manifestación de la infección por C. burnetii en Ecuador es la fiebre sin foco aparente [138]. En Brasil se han descrito casos con ambas formas clínicas de la enfermedad [139,140]. Finalmente, en Uruguay se ha descrito un número importante de brotes de fiebre Q [141].
Asia. Con excepción de Asia Central se ha descrito la infección en todas las regiones de este continente (figura 9).
Figura 9.
Estudios de infección por C. burnetii en humanos (Asia)
Así, en Asia Occidental se han identificado brotes rurales y urbanos de fiebre Q en Israel, [142-144], Turquía (zona del Mar Negro) [145], Arabia Saudita [146] y Omán [147]. La manifestación clínica predominante es esta región es la fiebre de duración intermedia.
También la fiebre Q está bien descrita en Asia Oriental. Así, recientemente se ha publicado una revisión en China, siendo la prevalencia en humanos del 10%, en bovinos del 15% y en caprinos del 12% [148]. Tiene interés señalar que en este país se ha observado una alta prevalencia de infección por C. burnetii en ratones. También se han descrito casos de fiebre Q en Hong Kong [149] y Taiwán [150-152]. Por otro lado, en una revisión actual se recogen los casos de fiebre Q en Japón en los últimos años [153]. En este trabajo se señalan dos datos diferenciales con otras series: el mayor número de casos en edad pediátrica y la importancia de los gatos en el ciclo biológico.
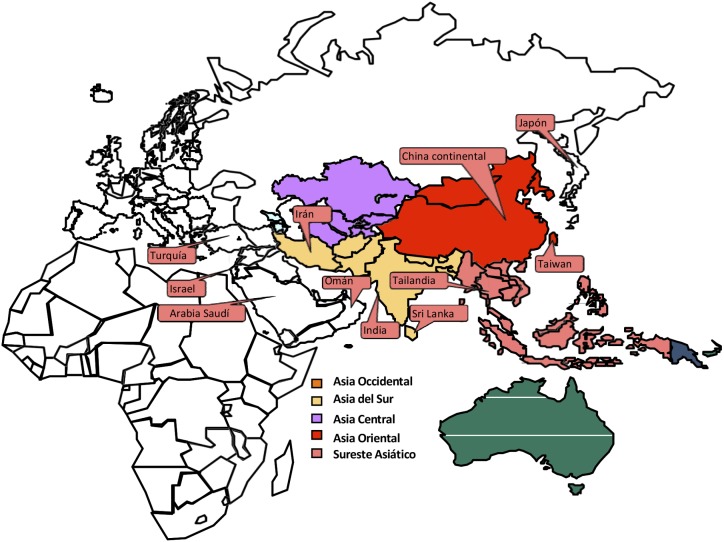
Finalmente, también se han descrito casos de fiebre Q en Asia del Sur y Sudeste Asiático, específicamente en Irán, India, Sri Lanka y Tailandia [154-158].
Oceanía. La incidencia actual de fiebre Q en Australia es baja debido a tres factores: la vacunación, la falta de interés en el diagnóstico y limitaciones diagnósticas [1].
REFLEXIONES FINALES
El análisis de todos los datos referidos en la literatura acerca de la infección por C. burnetii permite realizar varias generalizaciones:
Existe un importante sesgo en la identificación de casos de infección por C. burnetii, tanto en España como en el resto del Mundo. A modo de ejemplo, existen regiones en las que no se han publicado casos clínicos, pero si de la prevalencia de infección y viceversa. Por otro lado, el número de casos clínicos publicados en determinadas zonas geográficas es mucho menor que los detectados en laboratorios de referencia.
La infección por C. burnetii presenta un patrón epidemiológico similar a otras enfermedades infecciosas intracelulares (p. ej. tuberculosis), de tal forma que del contacto con el microorganismo no siempre deriva la infección y, por otro lado, no todos los casos de infección se manifiestan clínicamente (enfermedad). Finalmente, la enfermedad puede manifestarse de forma aguda o crónica, dependiendo principalmente de las características del hospedador.
En general, la fiebre Q es una enfermedad que afecta predominantemente a adultos en edad media de la vida. No obstante, también se describen casos en niños y ancianos dependiendo de las series estudiadas. Entre los factores implicados se han descrito las modificaciones hormonales que tienen lugar tras la pubertad, el riesgo de exposición ambiental y determinadas regiones geográficas [4]. En algunos estudios se ha observado que la media de edad fue significativamente menor en pacientes con hepatitis y significativamente mayor en pacientes con afectación pulmonar.
Con algunas excepciones, las diversas series de fiebre Q muestran un claro predominio en el género masculino. Este hecho se ha interpretado por el papel protector del 17-ß-estradiol en la expresión clínica de la infección [159, 160].
Existe una distribución interanual y estacional variable de la fiebre Q dependiendo de los países y dentro de las diferentes regiones de cada país. De forma general, predomina en primavera y verano, lo que se ha relacionado con la exposición ambiental, aunque en otras series se observa un mayor número de casos en otoño o invierno.
Clásicamente la fiebre Q se ha considerado una enfermedad que predomina en ámbito rural y en personas en contacto con animales (principalmente ganado vacuno y caprino). No obstante, y dependiendo de las series, un número importante de casos aparecen en zonas urbanas, sin contacto con rumiantes o relacionadas con contacto con otro tipo de animales (p. ej. gatos, ratones).
FINANCIACIÓN
Los autores no han recibido financiación para la realización de este trabajo.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
BIBLIOGRAFÍA
- 1.Parker NR, Barralet JH, Bell AM. Q fever. Lancet. 2006; 367:679-88. DOI: 10.1016/S0140-6736(06)68266-4 [DOI] [PubMed] [Google Scholar]
- 2.Alarcón A. Fiebre Q: todavía muchas preguntas por responder. Enferm Infecc Microbiol Clin 2007; 25: 165-7. PMID: [DOI] [PubMed] [Google Scholar]
- 3.Hartzell JD, Wood-Morris RN, Martinez LJ, Trotta RF. Q fever: epidemiology, diagnosis, and treatment. Mayo Clin Proc. 2008; 83:574-9. doi: 10.4065/83.5.574. [DOI] [PubMed] [Google Scholar]
- 4.Angelakis E, Raoult D. Q Fever. Vet Microbiol. 2010;140 297-309. Doi 10.1016/j.vetmic.2009.07.016 [DOI] [PubMed] [Google Scholar]
- 5.Fraile Fariñas MT, Muñoz Collado C. Infección por Coxiella burnetii. Enferm Infecc Microbiol Clin. 2010;28 (Supl 1):29-32. Doi 10.1016/S0213-005X(10)70005-7. [DOI] [PubMed] [Google Scholar]
- 6.Marrie TJ, Raoult D. Q fever- a review and issues for the next century. J. Antimicrob Agents. 1997; 8:146-61. PMID: [DOI] [PubMed] [Google Scholar]
- 7.Wentworth BB. Historical review of the literature on Q fever. Bacteriol Rev. 1955; 19: 129-49. PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.McDade JE. Historical aspects of Q fever. En: TJ Marrie, ed. Q fever, the disease. Boca Raton: CRC Press, 1990: 6–21. [Google Scholar]
- 9.Byrne W. Q fever. In R Zajtchuk, ed. Textbook of Military Medicine: Medical Aspects of Chemical and Biological Warfare. Washington, DC: US Department of the Army, Surgeon General, and the Borden Institute; 1997: 523-37. [Google Scholar]
- 10.Fernández Guerrero ML. Fiebre Q en España: “una historia inconclusa”. Enferm Infecc Microbiol Clin. 2014; 32:211-2. doi: 10.1016/j.eimc.2014.02.001 [DOI] [PubMed] [Google Scholar]
- 11.Komiya T, Sadamasu K, Toriniwa H, Kato K, Arashima Y, Fukushi H, et al. Epidemiological survey on the route of Coxiella burnetii infection in an animal hospital. J Infect Chemother. 2003; 9:151-5. DOI: 10.1007/s10156-003-0237-7 [DOI] [PubMed] [Google Scholar]
- 12.Marrie TJ, Campbell N, McNeil SA, Webster D, Hatchette TF. Q fever update, Maritime Canada. Emerg Infect Dis. 2008; 14:67-9. DOI: 10.3201/eid1401.071256 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Carcopino X, Raoult D, Bretelle F, Boubli L, Stein A. Q Fever during pregnancy: a cause of poor fetal and maternal outcome. Ann N Y Acad Sci. 2009;1166:79-89. doi: 10.1111/j.1749-6632.2009.04519.x. [DOI] [PubMed] [Google Scholar]
- 14.Tissot-Dupont H, Torres S, Nezri M, Raoult D. Hyperendemic focus of Q fever related to sheep and wind. Am J Epidemiol 1999; 150: 67–74. PMID: [DOI] [PubMed] [Google Scholar]
- 15.Hawker JI, Ayres JG, Blair I, Evans MR, Smith DL, Burge PS et al. A large outbreak of Q fever in the West Midlands: windborne spread into a metropolitan area? Commun Dis Public Health 1998; 1: 180–87. PMID: [PubMed] [Google Scholar]
- 16.Raoult D. Q fever, free amoeba, and air conditioning. Clin Infect Dis. 2010; 51: 869-70. DOI: 10.1086/656292 [DOI] [PubMed] [Google Scholar]
- 17.García-Pérez AL, Astobiza I, Barandika JF, Atxaerandio R, Hurtado A, Juste RA. Short communication: investigation of Coxiella burnetii occurrence in dairy sheep flocks by bulk-tank milk analysis and antibody level determination. J Dairy Sci. 2009; 92: 1581-4. doi: 10.3168/jds.2008-1672 [DOI] [PubMed] [Google Scholar]
- 18.Hatchette T, Hudson R, Schlech W, Campbell N, Hatchette J, Ratnam S, et al. Caprine-associated Q fever in Newfoundland. Can Commun Dis Rep 2000; 26: 17–9. PMID: [PubMed] [Google Scholar]
- 19.Kanfer E, Farrag N, Price C, MacDonald D, Coleman J, Barrett A. Q fever following bone marrow transplantation. Bone Marrow Transplant 1988; 3: 165–6. PMID: [PubMed] [Google Scholar]
- 20.Milazzo A, Hall R, Storm PA, Harris RJ, Winslow W, Marmion BP. Sexually transmitted Q fever. Clin Infect Dis. 2001; 33:399-402. DOI: 10.1086/321878 [DOI] [PubMed] [Google Scholar]
- 21.Miceli MH, Veryser AK, Anderson AD, Hofinger D, Lee SA, Tancik C. A case of person-to-person transmission of Q fever from an active duty serviceman to his spouse. Vector Borne Zoonotic Dis. 2010; 10:539-41. DOI: 10.1089/vbz.2009.0101 [DOI] [PubMed] [Google Scholar]
- 22.Rolain JM, Gouriet F, Brouqui P, Larrey D, Janbon F, Vene S, et al. Concomitant or consecutive infection with Coxiella burnetii and tickborne diseases. Clin Infect Dis. 2005; 40:82-8. DOI: 10.1086/426440 [DOI] [PubMed] [Google Scholar]
- 23.Pappas G, Blanco JR, Oteo JA. Q fever in Logroño: an attack scenario. Enferm Infecc Microbiol Clin. 2007; 25:199-203. PMID: [DOI] [PubMed] [Google Scholar]
- 24.Palosuo T, Leinikki P, Pettersson T , Saikku P, Jäntti V. Hazards of expanding tourism: report of six cases of Q fever in Finland. Scand J Infect Dis. 1974; 6: 173-176. PMID: [DOI] [PubMed] [Google Scholar]
- 25.Potasman I, Rzotkiewicz S, Pick N, Keysary A. Outbreak of Q fever following a safari trip. Clin Infect Dis. 2000; 30:214-5. DOI: 10.1086/313613 [DOI] [PubMed] [Google Scholar]
- 26.Brouqui P, Rolain JM, Foucault C, Raoult D. Short report: Q fever and Plasmodium falciparum malaria co-infection in a patient returning from the Comoros archipelago. Am J Trop Med Hyg. 2005; 73:1028-30. PMID: [PubMed] [Google Scholar]
- 27.Somasundaram R, Loddenkemper C, Zeitz M, Schneider T. A souvenir from the Canary Islands. Lancet 2006; 367: 1116 DOI: 10.1016/S0140-6736(06)68480-8 [DOI] [PubMed] [Google Scholar]
- 28.Cohen NJ, Papernik M, Singleton J, Segreti J, Eremeeva ME. Q fever in an American tourist returned from Australia. Travel Med Infect Dis. 2007; 5:194-5. 10.1016/j.tmaid.2006.09.002 [DOI] [PubMed] [Google Scholar]
- 29.Ta TH, Jiménez B, Navarro M, Meije Y, González FJ, Lopez-Velez R. Q Fever in returned febrile travelers. J Travel Med. 2008. 15:126-9. doi: 10.1111/j.1708-8305.2008.00191.x. [DOI] [PubMed] [Google Scholar]
- 30.Kobbe R, Kramme S, Gocht A, Werner M, Lippert U, May J, et al. . Travel-associated Coxiella burnetii infections: three cases of Q fever with different clinical manifestation. Travel Med Infect Dis. 2007; 5:374-9. DOI: 10.1016/j.tmaid.2007.07.005 [DOI] [PubMed] [Google Scholar]
- 31.Jensenius M, Davis X, von Sonnenburg F, Schwartz E, Keystone JS, Leder K, et al. Multicenter GeoSentinel analysis of rickettsial diseases in international travelers, 1996-2008. Emerg Infect Dis. 2009; 15:1791-8. doi: 10.3201/eid1511.090677. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Delord M, Socolovschi C, Parola P. Rickettsioses and Q fever in travelers (2004-2013). Travel Med Infect Dis. 2014; 12:443-58. doi: 10.1016/j.tmaid.2014.08.006. [DOI] [PubMed] [Google Scholar]
- 33.Raoult D. Clinical presentation of acute australian Q fever. Am J Med 1994; 96: 397-398. PMID: [DOI] [PubMed] [Google Scholar]
- 34.Sobradillo V, Ansola P, Baranda F. Neumonia por fiebre Q en España. Arch Bronconeumol 1986; 22:227-32. [Google Scholar]
- 35.Prada J, LLorente A. Primer caso de fiebre Q humana en España. Rev Iberica de Parasitologia 1950; 10:275-9. PMID:15423089 [Google Scholar]
- 36.Pérez-Gallardo F, Clavero G, Hernández-Fernández S. Investigaciones sobre la epidemiologia de la fiebre Q en España. Los conejos de monte y los lirones como reservorio de Coxiella burnetii. Rev San Hig Pub. 1952; 26:81-7. PMID: [PubMed] [Google Scholar]
- 37.Sobradillo Peña V, Aguirre Errasti C, Villate Navarro JL, Antoñana Larrieta JM, Montejo Baranda M, Cisterna Cancer R. Fiebre Q: Brote epidémico en el Pais Vasco. Descripción de diez casos. Med Clin (Barc). 1983; 80:3-6. PMID: [PubMed] [Google Scholar]
- 38.Montejo Baranda M, Senosiain Gascue JM, Alvarez Blanco A, Hernández Almaraz JL, Aguirre Errasti C. Fiebre Q aguda. Estudio de 11 casos esporádicos en un área endémica. Rev Clin Esp. 1983; 171:141-4. PMID: [PubMed] [Google Scholar]
- 39.Aguirre Errasti C, Montejo Baranda M, Hernandez Almaraz JL, de la Hoz Torres C, Martinez Gutierrez E, Villate Navarro JL, et al. An outbreak of Q fever in the Basque country. Can Med Assoc J. 1984; 131:48-9. PMID: [PMC free article] [PubMed] [Google Scholar]
- 40.Martínez-Luengas F, Borobio MV, Gálvez J, León de Lope M, Corral JL, Mañas R, et al. Fiebre Q en Sevilla. Comparación con otras entidades. Descripción de 34 casos y revisión. Rev Clin Esp. 1985; 176:400-5. PMID: [PubMed] [Google Scholar]
- 41.Fernández Roblas R, Wilhelmi I, Díaz Curiel M, Gómez P, Aguado JM, Fernández Guerrero ML, et al. Fiebre Q aguda y crónica: clínica. epidemiología, aislamiento del agente y datos serológicos. Rev Clin Esp. 1985; 177:62-9. PMID: [PubMed] [Google Scholar]
- 42.Montejo Baranda M, Corral Carranceja J, Aguirre Errasti C. Q fever in the Basque Country: 1981-1984. Rev Infect Dis. 1985; 7:700-1. PMID: [DOI] [PubMed] [Google Scholar]
- 43.Rubiés-Prat J, Martí J, Cuxart A. Clotet B. Forma hepática y febril autolimitada de la fiebre Q. Med Clin (Barc). 1986; 86:261. PMID: [PubMed] [Google Scholar]
- 44.Fernández-Guerrero ML, Muelas JM, Aguado JM, Renedo G, Fraile J, Soriano F, et al. Q fever endocarditis on porcine bioprosthetic valves. Clinicopathologic features and microbiologic findings in three patients treated with doxycycline, cotrimoxazole, and valve replacement. Ann Intern Med. 1988; 108:209-13. PMID: [DOI] [PubMed] [Google Scholar]
- 45.Sobradillo V, Ansola P, Baranda F, Corral C. Q fever pneumonia: a review of 164 community-acquired cases in the Basque country. Eur Respir J. 1989; 2:263-6. PMID: [PubMed] [Google Scholar]
- 46.Millán Mon A, Argany Fajardo A, Febles Bethencourt J, González Caloca C, Vento Remedios TE, Fernández Cabrera M. Fiebre Q en la isla de La Palma. Una revisión de 35 pacientes. An Med Interna. 1989; 6:527-30. PMID: [PubMed] [Google Scholar]
- 47.Rotaeche del Campo R, Anta Unanue JL. Fiebre Q. Brote familiar de 5 casos. Aten Primaria. 1990; 7:211-2, 214-5. PMID: [PubMed] [Google Scholar]
- 48.Antón Aranda E, Altuna Basurto E, García Martín C, Martí Cabane J, Bustillo Gutiérrez JM. Incidencia y características de la fiebre Q en un hábitat comarcal. Enferm Infecc Microbiol Clin. 1990; 8:350-3. PMID: [PubMed] [Google Scholar]
- 49.Murie Carrillo de Albornoz M, Pérez de Heredia JH, Sánchez Alvarez J, Tiberio López G, Hernández Palacios R, Rivero Puente A. Epidemiología de las neumonías adquiridas en la comunidad del Área de Salud I de Navarra. Med Clin (Barc). 1991; 97:50-2. PMID: [PubMed] [Google Scholar]
- 50.Martínez Eizaguirre JM, Pérez Rizo M, Olivella Pedregal A, García Ventura S, Cancio Fanlo M, Basabe Zapirain M. Fiebre Q. Brote epidémico de la forma febril pura. Aten Primaria. 1992; 9: 425-8. PMID: [PubMed] [Google Scholar]
- 51.Bella F, Espejo E, Mauri M, Alegre MD. Clinical presentation of acute ustralian Q fever. Am J Med. 1994; 96:397-8. PMID: [DOI] [PubMed] [Google Scholar]
- 52.Pascual Velasco F, Borobio Enciso MV, González Lama Z, Carrascosa Porras M. Clinical presentation of acute Q fever in Lanzarote (Canary Islands): a 2-year prospective study. Scand J Infect Dis. 1996; 28:533-4. PMID: [DOI] [PubMed] [Google Scholar]
- 53.Merino FJ, Nebreda T, Campos A. Most common clinical presentation of Q fever in a province in the north of Spain. Eur J Epidemiol. 1998; 14:729-30. PMID: [DOI] [PubMed] [Google Scholar]
- 54.Abad A, Pardo C, Imaz M. Fiebre Q: estudio retrospectivo de los últimos 10 años en el área del Hospital de Basurto (Bilbao). Rev Clin Esp. 1999; 199:618-9. PMID: [PubMed] [Google Scholar]
- 55.Domingo P, Muñoz C, Franquet T, Gurguí M, Sancho F, Vazquez G. Acute Q fever in adult patients: report on 63 sporadic cases in an urban area. Clin Infect Dis. 1999; 29:874-9. DOI: 10.1086/520452 [DOI] [PubMed] [Google Scholar]
- 56.Nebreda T, Contreras E, Merino FJ, Dodero E, Campos A. Brote de fiebre Q y seroprevalencia en una población rural de la provincia de Soria. Enferm Infecc Microbiol Clin. 2001; 19:57-60. PMID: [DOI] [PubMed] [Google Scholar]
- 57.Nuño Mateo FJ, Noval Menéndez J, Campoamor Serrano MT, del Valle Prieto A. Fiebre Q aguda en Asturias. Rev Clin Esp 2002; 202:569-73. PMID: [PubMed] [Google Scholar]
- 58.Alarcón A, Villanueva JL, Viciana P, López-Cortés L, Torronteras R, Bernabeu M, et al. Q fever: epidemiology, clinical features and prognosis. A study from 1983 to 1999 in the South of Spain. J Infect. 2003; 47:110-6. PMID: [DOI] [PubMed] [Google Scholar]
- 59.Bolaños M, Santana OE, Pérez-Arellano JL, Angel-Moreno A, Moreno G, Burgazzoli JL, et al. Fiebre Q en Gran Canaria: 40 nuevos casos. Enferm Infecc Microbiol Clin. 2003; 21:20-3. PMID: [DOI] [PubMed] [Google Scholar]
- 60.Sampere M, Font B, Font J, Sanfeliu I, Segura F. Q fever in adults: review of 66 clinical cases. Eur J Clin Microbiol Infect Dis. 2003; 22:108-10. DOI: 10.1007/s10096-002-0873-3 [DOI] [PubMed] [Google Scholar]
- 61.Romero-Jiménez MJ, Suárez-Lozano I, Fajardo JM, Benavente A, Menchero A, de la Iglesia A. Hepatitis aislada como forma de presentación de la fiebre Q: características clínicas y epidemiológicas en 109 pacientes Enferm Infecc Microbiol Clin. 2003; 21:193-5. PMID: [DOI] [PubMed] [Google Scholar]
- 62.Miguélez M, Laynez P, Linares M, Hayek M, Abella L, Marañez I. Tifus murino en Tenerife. Estudio clinicoepidemiológico y características clínicas diferenciales con la fiebre Q. Med Clin (Barc). 2003; 121:613-5. PMID: [DOI] [PubMed] [Google Scholar]
- 63.Bartolomé J, Marín A, Lorente S, Heredero E, Crespo MD. Fiebre Q aguda: 35 casos en Castilla-La Mancha. Enferm Infecc Microbiol Clin 2004; 22:292-4. PMID: [DOI] [PubMed] [Google Scholar]
- 64.Ramos JM, Masía M, Rodríguez JC, Gutiérrez F. Fiebre Q aguda en la Comunidad Valenciana. Estudio de 30 casos. Enferm Infecc Microbiol Clin. 2005; 23:512-3. PMID: [DOI] [PubMed] [Google Scholar]
- 65.de los Ríos-Martín R, Sanz-Moreno JC, Martín-Martínez F, Tébar-Betegón MA, Cortés-García M, Escudero-Nieto R. Brote de fiebre Q en un área urbana asociado a la visita a una granja-escuela. Med Clin (Barc). 2006; 126:573-5. PMID: [DOI] [PubMed] [Google Scholar]
- 66.García-Clemente M, Seco-García AJ, Gutiérrez-Rodríguez M, Romero-Alvarez P, Fernández-Bustamante J, Rodríguez-Pérez M. Brote epidémico de neumonía por Coxiella burnetii. Enferm Infecc Microbiol Clin. 2007; 25:184-6. PMID: [DOI] [PubMed] [Google Scholar]
- 67.Muñoz-Sanz A, Vera A, Rodríguez Vidigal FF. Fiebre Q en Extremadura: una infección emergente. Enferm Infecc Microbiol Clin. 2007; 25:230-4. PMID: [DOI] [PubMed] [Google Scholar]
- 68.Parra Ruiz J, Peña Monje A, Tomás Jiménez C, Parejo Sánchez MI, Vinuesa García D, Muñoz Medina L, et al. Clinical spectrum of fever of intermediate duration in the south of Spain. Eur J Clin Microbiol Infect Dis. 2008; 27:993-5. doi: 10.1007/s10096-008-0530-6 [DOI] [PubMed] [Google Scholar]
- 69.Espinosa N, Cañas E, Bernabeu-Wittel M, Martín A, Viciana P, Pachón J. Cambios en el espectro etiológico de la fiebre de duración intermedia. Enf Infecc Microbiol Clin 2010; 28:416-20. doi: 10.1016/j.eimc.2009.07.014 [DOI] [PubMed] [Google Scholar]
- 70.Ruiz Seco MP, López Rodríguez M, Estébanez Muñoz M, Pagán B, Gómez Cerezo JF, et al. . Fiebre Q: 54 nuevos casos de un hospital terciario de Madrid. Rev Clin Esp. 2011; 211: 240-4. DOI: 10.1016/j.rce.2011.01.003 [DOI] [PubMed] [Google Scholar]
- 71.Mogollón MV, Anguita MP, Aguado JM, Tornos P, Miró JM, Gálvez-Acebal J, et al. Q fever endocarditis in Spain. Clinical characteristics and outcome. Enferm Infecc Microbiol Clin. 2011; 29:109–116. doi: 10.1016/j.eimc.2010.07.015 [DOI] [PubMed] [Google Scholar]
- 72.Oteo JA, Pérez-Cortés S, Santibáñez P, Gutiérrez E, Portillo A, Blanco JR, et al. Q fever endocarditis associated with a cardiovascular implantable electronic device. Clin Microbiol Infect. 2012; 18:e482-4. doi: 10.1111/j.1469-0691.2012.03992.x [DOI] [PubMed] [Google Scholar]
- 73.Raya Cruz M, Gállego Lezaún C, García Gasalla M, Cifuentes Luna C, Forteza Forteza T, Fernández-Baca V et al. Fiebre Q aguda sintomática: 87 casos en un área de Mallorca. Enferm Infecc Microbiol Clin. 2014; 32:213-8. doi: 10.1016/j.eimc.2013.06.004 [DOI] [PubMed] [Google Scholar]
- 74.Espejo E, Gil-Díaz A, Oteo JA, Castillo-Rueda R, García-Alvarez L, Santana-Báez S, et al. Clinical presentation of acute Q fever in SpaIn: seasonal and geographical differences. Int J Infect Dis. 2014; 26:162-4. doi: 10.1016/j.ijid.2014.06.016 [DOI] [PubMed] [Google Scholar]
- 75.Alonso E, Lopez-Etxaniz I, Hurtado A, Liendo P, Urbaneja F, Aspiritxaga I, et al. Q Fever Outbreak among Workers at a Waste-Sorting Plant. PLoS One. 2015;10:e0138817. doi: 10.1371/journal.pone.0138817. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 76.Daza Pérez RM, Castillo Ribera R, García-Carbajosa S, Ojeda Fernández E, Dámaso López D, Moreno López M. Estudio de la tasa de anticuerpos a Coxiella burnetii en la población sana. Med Clin (Barc). 1980. ;74 :52-4. PMID: [PubMed] [Google Scholar]
- 77.Tellez A, Martin A, Anda P, De la Fuente L, Benitez P, Garcia C, Leon P. Study of C. burnetii human and animal seroprevalence in a rural population in Madrid community. Eur J Epidemiol. 1989; 5:444-6. PMID: [DOI] [PubMed] [Google Scholar]
- 78.Cour Boveda MI, González Sinde MC, González Cuadrado S, Palau Beato ML, González Gómez C, Ferro Dalda A. Coxiella burnetii: estudio serológico en diferentes poblaciones. An Med Interna (Madrid). 1990; 7:513-6. PMID: [PubMed] [Google Scholar]
- 79.Ruiz-Beltrán R, Herrero-Herrero JI, Martín-Sánchez AM, Martín-González JA. Prevalence of antibodies to Rickettsia conorii, Coxiella burnetii, and Rickettsia typhi in Salamanca Province (Spain). Serosurvey in the human population. Eur J Epidemiol. 1990; 6:293-9. PMID: [DOI] [PubMed] [Google Scholar]
- 80.Pascual Velasco F, Rodríguez Pérez JC, Otero Ferrio I, Borobio Enciso MV. Seroprevalence of Q fever among the adult population of Lanzarote (Canary Islands). An Med Interna. 1992; 9:428-32. PMID: [PubMed] [Google Scholar]
- 81.Saz JV, Bacellar F, Merino FJ, Filipe A. Seroprevalencia de la infección por Coxiella burnetii y Rickettsia conorii en la provincia de Soria. Enferm Infecc Microbiol Clin. 1993; 11: 469-73. PMID: [PubMed] [Google Scholar]
- 82.Sanzo JM, Garcia-Calabuig MA, Audicana A, Dehesa V. Q fever: prevalence of antibodies to Coxiella burnetii in the Basque country. Int J Epidemiol. 1993; 22:1183-8. PMID: [DOI] [PubMed] [Google Scholar]
- 83.Pérez-Trallero E, Cilla G, Montes M, Saénz-Dominguez JR, Alcorta M. Prevalence of Coxiella burnetii infection among slaughterhouse workers in northern Spain. Eur J Clin Microbiol Infect Dis. 1995; 14:71-3. PMID: [DOI] [PubMed] [Google Scholar]
- 84.Suárez-Estrada J, Rodríguez-Barbosa JI, Gutiérrez-Martín CB, Castañeda-López MR, Fernández-Marcos JM, González-Llamazares OR, et al. Seroepidemiological survey of Q fever in León province, Spain. Eur J Epidemiol. 1996; 12:245-50. PMID: [DOI] [PubMed] [Google Scholar]
- 85.Pascual-Velasco F, Montes M, Marimón JM, Cilla G. High seroprevalence of Coxiella burnetii infection in Eastern Cantabria (Spain). Int J Epidemiol. 1998; 27:142-5. PMID: [DOI] [PubMed] [Google Scholar]
- 86.Valencia MC, Rodriguez CO, Puñet OG, de Blas Giral I. Q fever seroprevalence and associated risk factors among students from the Veterinary School of Zaragoza, Spain. Eur J Epidemiol. 2000; 16:469-76. PMID: [DOI] [PubMed] [Google Scholar]
- 87.Bolaños M, Santana OE, Angel-Moreno A, Pérez-Arellano JL, Limiñana JM, Serra-Majem L, et al. Seroprevalence of infection by Coxiella burnetii in Canary Islands (Spain). Eur J Epidemiol. 2003; 18:259-62. PMID: [DOI] [PubMed] [Google Scholar]
- 88.Cardeñosa N, Sanfeliu I, Font B, Muñoz T, Nogueras MM, Segura F. Short report: seroprevalence of human infection by Coxiella burnetii in Barcelona (Northeast of Spain). Am J Trop Med Hyg. 2006; 75:33-5. PMID: [PubMed] [Google Scholar]
- 89.Bartolomé J, Riquelme E, Hernández-Pérez N, García-Ruiz S, Luján R, Lorente S, et al. Seroepidemiología de la infección por Coxiella burnetii en donantes de sangre en Albacete. Enferm Infecc Microbiol Clin. 2007; 25:382-6. PMID: [DOI] [PubMed] [Google Scholar]
- 90.González-Quijada S, Mora-Simón MJ, Martin-Ezquerro A. Association between serological evidence of past Coxiella burnetii infection and atherosclerotic cardiovascular disease in elderly patients. Clin Microbiol Infect. 2014; 20:873-8. PMID: [DOI] [PubMed] [Google Scholar]
- 91.González-Quijada S, Salazar-Thieroldt E, Mora-Simón MJ. Persistent Q fever and ischaemic stroke in elderly patients. Clin Microbiol Infect. 2015;21:362-7. doi: 10.1016/j.cmi.2014.11.028. [DOI] [PubMed] [Google Scholar]
- 92.Palau Beato L, Lopez Bartolome O, Cour Boveda MI, Gonzalez Sinde MC, Cuevas Beltran L, Garcia Lerin MC. Coxiella burnetii: Un estudio serológico de bóvidos en la Comunidad de Madrid. Rev Sanid Hig Publica (Madr). 1989; 63:43-6. PMID: [PubMed] [Google Scholar]
- 93.Barandika JF, Hurtado A, García-Esteban C, Gil H, Escudero R, Barral M, et al. Tick-borne zoonotic bacteria in wild and domestic small mammals in northern Spain. Appl Environ Microbiol. 2007; 73:6166-71. DOI: 10.1128/AEM.00590-07 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 94.Ruiz-Fons F, Rodríguez O, Torina A, Naranjo V, Gortázar C, de la Fuente J. Prevalence of Coxiella burnetii infection in wild and farmed ungulates. Vet Microbiol. 2008; 126:282-6. PMID: [DOI] [PubMed] [Google Scholar]
- 95.Navarro JA, Ortega N, Buendia AJ, Gallego MC, Martínez CM, Caro MR, et al. Diagnosis of placental pathogens in small ruminants by immunohistochemistry and PCR on paraffin-embedded samples. Vet Rec. 2009; 165:175-8. PMID: [DOI] [PubMed] [Google Scholar]
- 96.Rodríguez NF, Carranza C, Bolaños M, Pérez-Arellano JL, Gutierrez C. Seroprevalence of Coxiella burnetii in domestic ruminants in Gran Canaria Island, Spain. Transbound Emerg Dis. 2010; 57:66-7. doi: 10.1111/j.1865-1682.2010.01116.x. [DOI] [PubMed] [Google Scholar]
- 97.Ruiz-Fons F, Astobiza I, Barandika JF, Hurtado A, Atxaerandio R, Juste RA, et al. Seroepidemiological study of Q fever in domestic ruminants in semi-extensive grazing systems. BMC Vet Res. 2010; 6:3. doi: 10.1186/1746-6148-6-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 98.Astobiza I, Barral M, Ruiz-Fons F, Barandika JF, Gerrikagoitia X, Hurtado A, et al. Molecular investigation of the occurrence of Coxiella burnetii in wildlife and ticks in an endemic area. Vet Microbiol. 2011; 147:190-4. doi: 10.1016/j.vetmic.2010.05.046. [DOI] [PubMed] [Google Scholar]
- 99.Alvarez J, Perez A, Mardones FO, Pérez-Sancho M, García-Seco T, Pagés E, et al. Epidemiological factors associated with the exposure of cattle to Coxiella burnetii in the Madrid region of Spain. Vet J. 2012; 194:102-7. doi: 10.1016/j.tvjl.2012.02.022. [DOI] [PubMed] [Google Scholar]
- 100.Mentaberre G, Gutiérrez C, Rodríguez NF, Joseph S, González-Barrio D, Cabezón O, et al. A transversal study on antibodies against selected pathogens in dromedary camels in the Canary Islands, Spain. Vet Microbiol. 2013; 167:468-73. doi: 10.1016/j.vetmic.2013.07.029 [DOI] [PubMed] [Google Scholar]
- 101.Fernández-Aguilar X, Cabezón Ó, Colom-Cadena A, Lavín S, López-Olvera JR. Serological survey of Coxiella burnetii at the wildlife-livestock interface in the Eastern Pyrenees, Spain. Acta Vet Scand. 2016;58:26. doi: 10.1186/s13028-016-0209-4 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 102.Bolaños-Rivero M, Carranza-Rodríguez C, Rodríguez NF, Gutiérrez C, Pérez-Arellano JL. Detection of Coxiella burnetii DNA in Peridomestic and Wild Animals and Ticks in an Endemic Region (Canary Islands, Spain). Vector Borne Zoonotic Dis. 2017;17:630-634. doi: 10.1089/vbz.2017.2120. [DOI] [PubMed] [Google Scholar]
- 103.Barandika JF, Hurtado A, García-Sanmartín J, Juste RA, Anda P, García-Pérez AL. Prevalence of tick-borne zoonotic bacteria in questing adult ticks from northern Spain. Vector Borne Zoonotic Dis. 2008; 8:829-35. doi: 10.1089/vbz.2008.0023. [DOI] [PubMed] [Google Scholar]
- 104.Toledo A, Jado I, Olmeda AS, Casado-Nistal MA, Gil H, Escudero R, et al. Detection of Coxiella burnetii in ticks collected from Central Spain. Vector Borne Zoonotic Dis. 2009; 9:465-8. doi: 10.1089/vbz.2008.0070. [DOI] [PubMed] [Google Scholar]
- 105.Georgiev M, Afonso A, Neubauer H, Needham H, Thiery R, Rodolakis A, et al. Q fever in humans and farm animals in four European countries, 1982 to 2010. Euro Surveill. 2013;18. pii: . PMID: [PubMed] [Google Scholar]
- 106.Frankel D, Richet H, Renvoisé A, Raoult D. Q fever in France, 1985-2009. Emerg Infect Dis. 2011; 17:350-6. doi: 10.3201/eid1703.100882. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 107.Bellini C, Magouras I, Chapuis-Taillard C, Clerc O, Masserey E, Peduto G, et al. Q fever outbreak in the terraced vineyards of Lavaux, Switzerland. New Microbes New Infect. 2014; 2:93-9. doi: 10.1002/nmi2.37 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 108.Speelman P. The largest Q fever outbreak ever reported. Neth J Med. 2010; 68: 380-1. PMID: [PubMed] [Google Scholar]
- 109.Roest HI, Tilburg JJ, van der Hoek W, Vellema P, van Zijderveld FG, Klaassen CH, et al. The Q fever epidemic in The Netherlands: history, onset, response and reflection. Epidemiol Infect. 2011; 139:1-12. doi: 10.1017/S0950268810002268. [DOI] [PubMed] [Google Scholar]
- 110.Dijkstra F, van der Hoek W, Wijers N, Schimmer B, Rietveld A, Wijkmans CJ, et al. The 2007–2010 Q fever epidemic in The Netherlands: characteristics of notified acute Q fever patients and the association with dairy goat farming. FEMS Immunol Med Microbiol. 2012; 64:3-12. doi: 10.1111/j.1574-695X.2011.00876.x. [DOI] [PubMed] [Google Scholar]
- 111.Schneeberger PM, Wintenberger C, van der Hoek W, Stahl JP. Q fever in the Netherlands - 2007-2010: what we learned from the largest outbreak ever. Med Mal Infect. 2014; 44: 339-53. doi: 10.1016/j.medmal.2014.02.006. [DOI] [PubMed] [Google Scholar]
- 112.Wattiau P, Boldisova E, Toman R, Van Esbroeck M, Quoilin S, Hammadi S, et al. Q fever in Woolsorters, Belgium. Emerg Infect Dis. 2011; 17:2368-9. doi: 10.3201/eid1712.101786. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 113.Hellenbrand W, Breuer T, Petersen L. Changing epidemiology of Q fever in Germany, 1947-1999. Emerg Infect Dis. 2001; 7:789-96. DOI: 10.3201/eid0705.010504 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 114.Wallensten A, Moore P, Webster H, Johnson C, van der Burgt G, Pritchard G, et al. Q fever outbreak in Cheltenham, United Kingdom, in 2007 and the use of dispersion modelling to investigate the possibility of airborne spread. Euro Surveill. 2010;15. pii: . PMID: [PubMed] [Google Scholar]
- 115.Wilson LE, Couper S, Prempeh H, Young D, Pollock KG, Stewart WC, et al. Investigation of a Q fever outbreak in a Scottish co-located slaughterhouse and cutting plant. Zoonoses Public Health. 2010; 57:493-8. doi: 10.1111/j.1863-2378.2009.01251.x. [DOI] [PubMed] [Google Scholar]
- 116.Hussain-Yusuf H, Islam A, Healy B, Lockhart M, Nguyen C, Sukocheva O, et al. An analysis of Q fever patients 6 years after an outbreak in Newport, Wales, UK. QJM. 2012; 105:1067-73. doi: 10.1093/qjmed/hcs119. [DOI] [PubMed] [Google Scholar]
- 117.McCaughey C, McKenna J, McKenna C, Coyle PV, O’Neill HJ, Wyatt DE, et al. Human seroprevalence to Coxiella burnetii (Q fever) in Northern Ireland. Zoonoses Public Health. 2008; 55:189-94. doi: 10.1111/j.1863-2378.2008.01109.x. [DOI] [PubMed] [Google Scholar]
- 118.Dupont HT, Brouqui P, Faugere B, Raoult D. Prevalence of antibodies to Coxiella burnetii, Rickettsia conorii, and Rickettsia typhi in seven African countries. Clin Infect Dis. 1995; 21:1126-33. PMID: [DOI] [PubMed] [Google Scholar]
- 119.Letaief AO, Yacoub S, Dupont HT, Le Cam C, Ghachem L, Jemni L, et al. Sero-epidemiological survey of rickettsial infections among blood donors in central Tunisia. Trans R Soc Trop Med Hyg. 1995; 89:266-8. PMID: [DOI] [PubMed] [Google Scholar]
- 120.Niang M, Parola P, Tissot-Dupont H, Baidi L, Brouqui P, Raoult D. Prevalence of antibodies to Rickettsia conorii, Ricketsia africae, Rickettsia typhi and Coxiella burnetii in Mauritania. Eur J Epidemiol. 1998; 14:817-8. PMID: [DOI] [PubMed] [Google Scholar]
- 121.Okabayashi T, Hasebe F, Samui KL, Mweene AS, Pandey SG, Yanase T, et al. Short report: prevalence of antibodies against spotted fever, murine typhus, and Q fever rickettsiae in humans living in Zambia. Am J Trop Med Hyg. 1999; 61:70-2. PMID: [DOI] [PubMed] [Google Scholar]
- 122.Steinmann P, Bonfoh B, Péter O, Schelling E, Traoré M, Zinsstag J. Seroprevalence of Q-fever in febrile individuals in Mali. Trop Med Int Health. 2005; 10:612-7. DOI: 10.1111/j.1365-3156.2005.01420.x [DOI] [PubMed] [Google Scholar]
- 123.Kobbe R, Kramme S, Kreuels B, Adjei S, Kreuzberg C, Panning M, et al. Q Fever in Young Children, Ghana. Emerg Infect Dis. 2008; 14: 344–346. doi: 10.3201/eid1402.070971. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 124.El Sayed Zaki M, Goda T. Clinico-pathological study of atypical pathogens in community-acquired pneumonia: a prospective study. J Infect Dev Ctries. 2009; 3:199-205. PMID: [DOI] [PubMed] [Google Scholar]
- 125.Lacheheb A, Raoult D. Seroprevalence of Q-fever in Algeria. Clin Microbiol Infect. 2009; 15 Suppl 2:167-8. doi: 10.1111/j.1469-0691.2008.02211.x [DOI] [PubMed] [Google Scholar]
- 126.Mediannikov O, Fenollar F, Socolovschi C, Diatta G, Bassene H, Molez JF, et al. Coxiella burnetii in humans and ticks in rural Senegal. PLoS Negl Trop Dis. 2010. 6; 4:e654. doi: 10.1371/journal.pntd.0000654. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 127.Vanderburg S, Rubach MP, Halliday JE, Cleaveland S, Reddy EA, Crump JA. Epidemiology of Coxiella burnetii infection in Africa: a OneHealth systematic review. PLoS Negl Trop Dis. 2014; 8: e2787. doi: 10.1371/journal.pntd.0002787. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 128.Angelakis E, Mediannikov O, Socolovschi C, Mouffok N, Bassene H, Tall A, et al. Coxiella burnetii-positive PCR in febrile patients in rural and urban Africa. Int J Infect Dis. 2014; 28:107-10. doi: 10.1016/j.ijid.2014.05.029. [DOI] [PubMed] [Google Scholar]
- 129.Koch A, Svendsen CB, Christensen JJ, Bundgaard H, Vindfeld L, Christiansen CB. Q fever in Greenland. Emerg Infect Dis. 2010; 16:511-3. doi: 10.3201/eid1603.091220. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 130.Snedeker KG, Sikora C. Q fever in Alberta, Canada: 1998-2011. Zoonoses Public Health. 2014; 1:124-30. doi: 10.1111/zph.12053 [DOI] [PubMed] [Google Scholar]
- 131.Dahlgren FS, McQuiston JH, Massung RF, Anderson AD. Q fever in the United States: summary of case reports from two national surveillance systems, 2000-2012. Am J Trop Med Hyg. 2015; 92:247-55. doi: 10.4269/ajtmh.14-0503 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 132.Mc Quiston JH, Childs JE. Q fever in humans and animals in the United States. Vector Borne Zoonotic Dis 2002; 2:179-91. DOI: 10.1089/15303660260613747 [DOI] [PubMed] [Google Scholar]
- 133.Araujo-Meléndez J, Sifuentes-Osornio J, Bobadilla-del-Valle JM, Aguilar-Cruz A, Torres-Angeles O, Ramírez-González JL, et al. What do we know about Q fever in Mexico?. Rev Invest Clin. 2012; 64:541-5. PMID: [PubMed] [Google Scholar]
- 134.Kourany M, Johnson KM. A survey of Q fever antibodies in a high risk population in Panama. Am J Trop Med Hyg. 1980; 29:1007-11. PMID: [DOI] [PubMed] [Google Scholar]
- 135.Wood H, Drebot MA, Dewailly E, Dillon L, Dimitrova K, Forde M et al. Seroprevalence of seven zoonotic pathogens in pregnant women from the Caribbean. Am J Trop Med Hyg. 2014; 91:642-4. doi: 10.4269/ajtmh.14-0107 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 136.Epelboin L, Chesnais C, Boullé C, Drogoul AS, Raoult D, Djossou F, et al. Q fever pneumonia in French Guiana: prevalence, risk factors, and prognostic score. Clin Infect Dis. 2012; 55:67-74. doi: 10.1093/cid/cis288. [DOI] [PubMed] [Google Scholar]
- 137.Eldin C, Mahamat A, Demar M, Abboud P, Djossou F, Raoult D. Q fever in French Guiana. Am J Trop Med Hyg. 2014; 91:771-6. doi: 10.4269/ajtmh.14-0282. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 138.Manock SR, Jacobsen KH, de Bravo NB, Russell KL, Negrete M, Olson JG, et al. Etiology of acute undifferentiated febrile illness in the Amazon basin of Ecuador. Am J Trop Med Hyg. 2009; 81:146-51. PMID: [PubMed] [Google Scholar]
- 139.Lemos ER, Rozental T, Mares-Guia MA, Almeida DN, Moreira N, Silva RG, et al. Q fever as a cause of fever of unknown origin and thrombocytosis: first molecular evidence of Coxiella burnetii in Brazil. Vector Borne Zoonotic Dis. 2011; 11:85-7. doi: 10.1089/vbz.2009.0261 [DOI] [PubMed] [Google Scholar]
- 140.Rozental T, Mascarenhas LF, Rozenbaum R, Gomes R, Mattos GS, Magno CC, et al. Coxiella burnetii, the agent of Q fever in Brazil: its hidden role in seronegative arthritis and the importance of molecular diagnosis based on the repetitive element IS1111 associated with the transposase gene. Mem Inst Oswaldo Cruz. 2012; 107:695-7. PMID: [DOI] [PubMed] [Google Scholar]
- 141.Somma-Moreira RE, Caffarena RM, Somma S, Pérez G, Monteiro M. Analysis of Q fever in Uruguay. Rev Infect Dis. 1987; 9:386-7. PMID: [DOI] [PubMed] [Google Scholar]
- 142.Oren I, Kraoz Z, Hadani Y, Kassis I, Zaltzman-Bershadsky N, Finkelstein R. An outbreak of Q fever in an urban area in Israel. Eur J Clin Microbiol Infect Dis. 2005; 24:338-41. DOI: 10.1007/s10096-005-1324-8 [DOI] [PubMed] [Google Scholar]
- 143.Ergas D, Keysari A, Edelstein V, Sthoeger ZM. Acute Q fever in Israel: clinical and laboratory study of 100 hospitalized patients. Isr Med Assoc J. 2006; 8:337-41. PMID: [PubMed] [Google Scholar]
- 144.Amitai Z, Bromberg M, Bernstein M, Raveh D, Keysary A, David D, et al. A large Q fever outbreak in an urban school in central Israel. Clin Infect Dis. 2010; 50:1433-8. doi: 10.1086/652442. [DOI] [PubMed] [Google Scholar]
- 145.Gozalan A, Esen B, Rolain JM, Akin L, Raoult D. Is Q fever an emerging infection in Turkey?. East Mediterr Health J. 2005;11: 384-91. PMID: [PubMed] [Google Scholar]
- 146.Almogren A, Shakoor Z, Hasanato R, Adam MH. Q fever: a neglected zoonosis in Saudi Arabia. Ann Saudi Med. 2013; 33:464-8. doi: 10.5144/0256-4947.2013.464. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 147.Scrimgeour EM, Al-Ismaily SI, Rolain JM, Al-Dhahry SH, El-Khatim HS, Raoult D. Q Fever in human and livestock populations in Oman. Ann N Y Acad Sci. 2003; 990:221-5. PMID: [DOI] [PubMed] [Google Scholar]
- 148.El-Mahallawy HS, Lu G, Kelly P, Xu D, Li Y, Fan W, et al. Q fever in China: a systematic review, 1989-2013. Epidemiol Infect. 2015; 143:673-81. doi: 10.1017/S0950268814002593 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 149.Chan JF, Tse H, To KK, Li IW, Tang BS, Cheng VC, Yuen KY. Q fever: underdiagnosed in Hong Kong? Hong Kong Med J. 2010; 16:56-8. PMID: [PubMed] [Google Scholar]
- 150.Lai CH, Chen YH, Lin JN, Chang LL, Chen WF, Lin HH. Acute Q fever and scrub typhus, southern Taiwan. Emerg Infect Dis. 2009; 15:1659-61. doi: 10.3201/eid1510.090007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 151.Lai CH, Huang CK, Weng HC, Chung HC, Liang SH, Lin JN, et al. The difference in clinical characteristics between acute Q fever and scrub typhus in southern Taiwan. Int J Infect Dis. 2009; 13:387-93. doi: 10.1016/j.ijid.2008.07.020 [DOI] [PubMed] [Google Scholar]
- 152.Hung MN, Chou YF, Chen MJ, Hou MY, Lin PS, Lin CC, et al. Q fever outbreak in a small village, Taiwan. Taiwan Jpn J Infect Dis. 2010; 63:212-3. PMID: [PubMed] [Google Scholar]
- 153.Porter SR, Czaplicki G, Mainil J, Horii Y, Misawa N, Saegerman C. Q fever in Japan: an update review. Vet Microbiol. 2011; 149: 298-306. doi: 10.1016/j.vetmic.2010.11.017 [DOI] [PubMed] [Google Scholar]
- 154.Khalili M, Shahabi-Nejad N, Golchin M. Q fever serology in febrile patients in southeast Iran. Trans R Soc Trop Med Hyg. 2010; 104:623-4. doi: 10.1016/j.trstmh.2010.04.002 [DOI] [PubMed] [Google Scholar]
- 155.Metanat M, Sepehri Rad N, Alavi-Naini R, Shahreki S, Sharifi-Mood B, Akhavan A, et al. Acute Q fever among febrile patients in Zahedan, southeastern Iran. Turk J Med Sci. 2014; 44:99-103. PMID: [DOI] [PubMed] [Google Scholar]
- 156.Balakrishnan N, Menon T, Fournier PE, Raoult D. Bartonella quintana and Coxiella burnetii as causes of endocarditis, India. Emerg Infect Dis. 2008; 14:1168-9. doi: 10.3201/eid1407.071374. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 157.Suputtamongkol Y, Rolain JM, Losuwanaruk K, Niwatayakul K, Suttinont C, Chierakul W, et al. Q fever in Thailand. Emerg Infect Dis. 2003; 9:1186-7. DOI: 10.3201/eid0909.030086 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 158.Angelakis E, Munasinghe A, Yaddehige I, Liyanapathirana V, Thevanesam V, Bregliano A, et al. Detection of rickettsioses and Q fever in Sri Lanka. Am J Trop Med Hyg. 2012; 86:711-2. doi: 10.4269/ajtmh.2012.11-0424. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 159.Leone M, Honstettre A, Lepidi H, Capo C, Bayard F, Raoult D, et al. Effect of sex on Coxiella burnetii infection: protective role of 17 beta-estradiol. J Infect Dis. 2004; 189:339-45. DOI: 10.1086/380798 [DOI] [PubMed] [Google Scholar]
- 160.Raoult D, Marrie T, Mege J. Natural history and pathophysiology of Q fever. Lancet Infect Dis. 2005. ;5:219-26. PMID: [DOI] [PubMed] [Google Scholar]