Abstract
Introducción
Las infecciones por Clostridium difficile presentan una elevada tasa de recurrencias, lo que puede complicar el pronóstico de los pacientes afectados. Por ello, es relevante establecer una detección precoz y una estrategia terapéutica adecuada. El objetivo de este documento fue conocer la opinión de un grupo de expertos sobre cuáles son los factores predictores de mala evolución, así como el uso de fidaxomicina en distintos grupos de pacientes de alto riesgo.
Métodos
Un comité científico formado por tres expertos en enfermedades infecciosas revisó la bibliografía más reciente sobre el manejo de las infecciones causadas por C. difficile y el uso de fidaxomicina, elaborando un cuestionario de 23 aseveraciones para ser consensuadas, en una sola ronda mediante un método Delphi modificado, por 15 especialistas en este tipo de infecciones.
Resultados
El consenso alcanzado por los panelistas fue del 91,3% en términos de acuerdo. Entre los acuerdos más importantes destacan: la recurrencia es un criterio de riesgo en sí mismo; fidaxomicina es eficaz y segura para el tratamiento de infecciones causadas por C. difficile en pacientes críticos, inmunodeprimidos o con insuficiencia renal crónica; en pacientes con factores de riesgo de recurrencia bien contrastados se recomienda usar fidaxomicina desde un primer episodio de infección para asegurar su máxima eficacia.
Conclusiones
Los expertos consultados mostraron un alto grado de acuerdo sobre la selección de pacientes con peor pronóstico, así como en el uso de fidaxomicina en determinados grupos de pacientes de alto riesgo, bien en primera línea o en situaciones de recurrencia.
Palabras clave: Pacientes críticos, antimicrobianos, infecciones, recurrencia
Abstract
Introduction
Clostridium difficile infections have a high recurrence rate, which can complicate the prognosis of affected patients. It is therefore important to establish an early detection and an appropriate therapeutic strategy. The objective of this manuscript was to gather the opinion of an expert group about the predictive factors of poor progression, as well as when to use fidaxomicin in different groups of high-risk patients.
Methods
A scientific committee of three experts in infectious diseases reviewed the most recent literature on the management of C. difficile infections, and the use of fidaxomicin. They developed a questionnaire of 23 items for consensus by 15 specialists in this type of infection using a modified Delphi method.
Results
The consensus reached by the panelists was 91.3% in terms of agreement. The most important agreements were: recurrence is a risk criterion per se; fidaxomicin is effective and safe for the treatment of infections caused by C. difficile in critical patients, immunosuppressed patients, or patients with chronic renal failure; fidaxomicin is recommended from the first episode of infection to ensure maximum efficacy in patients with well-contrasted recurrence risk factors.
Conclusions
The experts consulted showed a high degree of agreement on topics related to the selection of patients with poorer prognosis, as well as on the use of fidaxomicin in groups of high-risk patients, either in the first line or in situations of recurrence.
Keywords: Critical patients, antimicrobials, infections, recurrence
INTRODUCCIÓN
La infección por Clostridium difficile (ICD) es la principal causa de diarrea infecciosa nosocomial y una de las principales infecciones que ocurren en las instalaciones sanitarias [1-4]. Su incidencia se ha incrementado considerablemente en los últimos años, así como la mortalidad asociada a ella [5-7]. En 2011, en Estados Unidos se notificaron 453.000 casos de ICD y aproximadamente 29.000 fallecimientos relacionados con ella [3]. En Europa, la epidemiología de esta infección es difícil de estimar debido a las diferencias en los sistemas sanitarios de cada país, aunque por extrapolación de datos del Reino Unido, se han estimado 172.000 casos anuales de ICD [8]. Recientemente se ha publicado un estudio en España en el que se constató que la tasa de hospitalizaciones debidas a esta infección aumentó desde 3,9 (en 2001) hasta 12,97 (en 2015) casos por cada 100.000 habitantes [9]. También se evidenció que la incidencia de casos graves de ICD y el coste por paciente ascendió de 6,36% y 3.750,11€ en 2001, a 11,19% y 4.340.91€ en 2015, respectivamente [9].
Sin embargo, es muy probable que la carga de esta enfermedad en los sistemas sanitarios esté infraestimada, pues la mayoría de los estudios en la literatura están basados en ICD diagnosticadas y tratadas en los hospitales, sin tener en cuenta los casos de pacientes sometidos a cuidados a largo plazo y en la comunidad [10]. Además, muchos de los diagnósticos se realizan mediante inmunoensayos enzimáticos sobre heces como único método [11].
Como ocurre en otras muchas enfermedades infecciosas, la ICD deviene en formas de presentación que abarcan desde la colonización asintomática a la sepsis y shock fulminantes [12,13]. La prevalencia de la colonización asintomática en adultos sanos oscila entre el 0-17,5% [1]. Sin embargo, cuando los pacientes tienen contacto con el sistema sanitario (p. ej. hospitalizaciones o centros de cuidados a largo plazo), esta prevalencia puede incrementarse hasta cerca del 51% [1]. La disminución de ácido en el estómago, el desequilibrio de la microbiota intestinal y la alteración en la producción de ácidos biliares e inmunoglobulina A (IgA) puede contribuir al paso de una de una colonización asintomática a una infección [1]. Por ejemplo, el uso de antibióticos puede alterar la composición de la microbiota intestinal favoreciendo la ICD, especialmente con las nuevas quinolonas utilizadas en humanos y animales [1]. Un estudio muy reciente puso de manifiesto que el uso de trehalosa como edulcorante ha podido ayudar a incrementar la virulencia de algunas de sus cepas [14]. Otros factores que incrementan el riesgo de ICD son una edad avanzada, el uso de fármacos que inhiben la secreción ácida en el estómago, el uso de quimioterapia durante el tratamiento del cáncer, la inmunosupresión y el trasplante o la diálisis, entre otros [1,15-18]. Se ha estimado que el 12% de los pacientes con ICD progresan a una situación grave [19,20].
Las principales opciones terapéuticas para la ICD incluyen el uso de antibióticos activos frente a C. difficile, la inmunoterapia y el trasplante de microbiota fecal [21]. Solo en casos muy leves puede esperarse la resolución espontánea suspendiendo el empleo de los antibióticos sistémicos. Durante décadas, esta infección ha sido tratada con metronidazol o vancomicina [21]. Aunque estos fármacos han mostrado ser eficaces para conseguir la curación del episodio infeccioso, también se ha observado una recurrencia de aproximadamente un 20-25%, con una alta tasa de morbilidad y mortalidad relacionada [10,22,23]. Posteriormente se comercializó fidaxomicina con tasas de curación de los episodios infecciosos en los ensayos clínicos similares a las obtenidas con vancomicina (87,7-88,2% para fidaxomicina y de 85,8-86,8% para vancomicina). Sin embargo, las tasas de recurrencias de ICD fueron significativamente menores en los pacientes tratados con fidaxomicina (15,4% para fidaxomicina y 25,3% para vancomicina, p=0,005) [24,25].
De no ser por su mayor coste económico, no habría razones para no emplear fidaxomicina como tratamiento de elección para el primer episodio de ICD. Este mayor coste ha llevado a restringir de forma muy variable su utilización en los diferentes países e instituciones dentro de cada país. Las guías clínicas no resuelven la cuestión y surge, por tanto, el interés de conocer la opinión de expertos sobre su papel en el manejo de la enfermedad.
El objetivo de este consenso es conocer la opinión de un grupo de expertos en ICD sobre cuáles son los factores predictores de mala evolución, así como el uso de fidaxomicina en pacientes críticos, inmunodeprimidos, con enfermedad subyacente grave o con un alto riesgo de recurrencia.
MÉTODOS
Diseño del estudio. El estudio fue diseñado empleando un método Delphi modificado, una técnica utilizada en el entorno de diversos ámbitos sanitarios para alcanzar un consenso sobre determinadas cuestiones clínicas [26,27]. En esencia, este método consiste en un proceso iterativo que permite explorar y unificar las opiniones de un grupo de expertos sobre una aseveración clínica previamente definida para la que no se dispone de suficiente evidencia o su conocimiento es incompleto o incierto. También permite explorar y unificar las opiniones de un grupo de expertos sobre un tema sin las dificultades e inconvenientes inherentes a los métodos de consenso con discusión presencial, como los desplazamientos o los sesgos de influencia o interacción no confidencial.
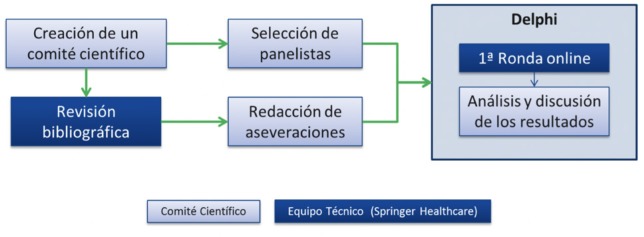
El estudio fue llevado a cabo en varias fases (figura 1): a) planteamiento del proyecto y creación de un comité científico de expertos en enfermedades infecciosas; b) revisión de la bibliografía más reciente sobre el manejo de ICD, centrándose especialmente en el uso de fidaxomicina, y en la proposición de aseveraciones a discutir mediante una reunión online; c) creación de un cuestionario con las aseveraciones consideradas más relevantes y consensuadas por el comité científico; d) selección de un panel de expertos en ICD cuya tarea fue la de responder el cuestionario; e) presentación online en la que se explicó el motivo por el que se seleccionaron y consensuaron las aseveraciones propuestas en el cuestionario; f) una sola ronda para conocer la opinión de los panelistas mediante una encuesta online; y g) recopilación, análisis y discusión de los resultados para elaborar unas conclusiones mediante una reunión online.
Figura 1.
Diseño del estudio.
Participantes. En el estudio participaron tres tipos de profesionales: un comité científico, un equipo técnico y un panel de expertos. El comité científico constó de 3 expertos en ICD, cuya función fue revisar la bibliografía y elaborar un cuestionario con aseveraciones relativas al tratamiento de ICD y al papel de fidaxomicina en estas infecciones. El equipo técnico, que dirigió y supervisó todo el proceso, fue el responsable de la implementación instrumental del método (búsqueda de la bibliografía, distribución del cuestionario a los panelistas, análisis de las respuestas e interpretación estadística del consenso). Finalmente, el comité científico eligió el panel de expertos formado por un total de 15 profesionales sanitarios expertos en ICD con reconocida experiencia clínica y que cumplían los siguientes criterios: 1) experiencia en el manejo de pacientes con enfermedades infecciosas; 2) trabajar en un hospital de más de 500 camas, con acceso al uso de fidaxomicina y una casuística de ICD de al menos 50 pacientes al año; y 3) haber tratado o participado en la decisión terapéutica con fidaxomicina en al menos 5 pacientes al año. Además, se procuró disponer de una adecuada distribución territorial entre todas las Comunidades Autónomas de España.
Cuestionario. Después de una búsqueda sistemática de la literatura y del análisis de la bibliografía, el comité científico elaboró un total de 23 aseveraciones agrupadas en los siguientes temas: 1) factores predictores de mala evolución de una ICD (7 aseveraciones); 2) uso de fidaxomicina en pacientes críticos, inmunodeprimidos y con enfermedad subyacente grave (9 aseveraciones); y 3) uso de fidaxomicina en pacientes con alto riesgo de recurrencia (7 aseveraciones).
Para la valoración del cuestionario se propuso una única escala ordinal tipo Likert de 9 puntos, según el modelo desarrollado por la UCLA-RAND Corporation para la valoración comparativa y priorización entre distintas opciones sanitarias (mínimo 1, pleno desacuerdo; y máximo 9, pleno acuerdo) [28]. Esta escala fue estructurada en tres grupos según el nivel de acuerdo-desacuerdo de la aseveración: de 1 a 3, interpretado como rechazo o desacuerdo; de 4 a 6, interpretado como sin acuerdo o sin desacuerdo; y de 7 a 9, interpretado como expresión de acuerdo o apoyo.
Fases del proceso. Mediante una reunión no presencial del comité científico se consensuaron aquellas aseveraciones más relevantes respecto a las ICD y su tratamiento con fidaxomicina. Posteriormente, mediante una única ronda llevada a cabo en febrero de 2018, el panel de expertos respondió al cuestionario elaborado por el comité científico a través de un sistema electrónico. El equipo técnico evaluó las respuestas y las presentó en gráficos de barras para facilitar los comentarios y las aclaraciones de cada participante. El estudio finalizó en marzo de 2018 con una nueva reunión no presencial en la que el comité científico debatió e interpretó los resultados.
Análisis e interpretación de los resultados. Para analizar la opinión grupal y el tipo de consenso alcanzado sobre cada cuestión planteada, se empleó la mediana y el intervalo intercuartílico de las puntuaciones obtenidas para cada aseveración. Se consideró que hubo consenso en cualquiera de ellas si menos de un 33,33% de los panelistas votaron en contra de la respuesta mayoritaria y si la dispersión de las votaciones fue inferior a un índice intercuartílico de 4. De esta forma, se consideró que hubo acuerdo si la mediana fue ≥ 7, desacuerdo si la mediana fue ≤ 3 y dudoso en aquellas aseveraciones con una mediana entre 3 y 7. Por el contrario, se consideró que no hubo consenso cuando un 33,33% o más de los panelistas votaron en contra de la respuesta mayoritaria y cuando la dispersión de las votaciones fue igual o superior a un intervalo intercuartílico de 4.
RESULTADOS
Todos los panelistas consultados (n=15) respondieron a las 23 aseveraciones propuestas. En 21 de ellas (91,3%) se alcanzó un consenso en términos de “acuerdo” y en 2 (8,7%) no se llegó a ningún consenso. Dado el elevado grado de acuerdo alcanzando en la primera ronda, se consideró que no era necesario llevar a cabo una segunda ronda. En las tablas 1-3 se muestran los resultados obtenidos en cada aseveración.
Tabla 1.
Bloque 1: Factores predictores de mala evolución de una infección por Clostridium difficile.
| Aseveraciones | Mediana (IIC) | % Acuerdo | % en contra de la respuesta mayoritaria |
|---|---|---|---|
| Una vez establecido el diagnóstico del primer episodio de infección por Clostridium difficile, es posible seleccionar una población de pacientes con una mayor probabilidad de empeorar o recurrir (sufrir una mala evolución) en base a datos meramente clínicos y fácilmente disponibles con un grado aceptable de precisión. | 8 (2) | 86,66 | 13,33 |
| Después de un primer episodio, cualquier paciente tiene un mayor riesgo de evolución desfavorable; la recurrencia es un criterio de riesgo en sí mismo. | 8 (2) | 93,33 | 6,67 |
| La edad avanzada, la necesidad de continuar con antibióticos y la gravedad de la enfermedad de base son algunos de los factores que más predisponen a la mala evolución. | 9 (1) | 93,33 | 6,67 |
| Los pacientes con una elevada cantidad de toxina de Clostridium difficile por gramo de heces tienen una mayor tendencia a una mala evolución. | 7 (3) | 66,65 | 33,33 |
| Disponer de información sobre la cantidad de toxina de Clostridium difficile ayudaría a mejorar la predicción de una mala evolución de los pacientes que la basada en datos exclusivamente clínicos. | 7 (2) | 66,65 | 33,33 |
| Una amplificación rápida del gen de la toxina de Clostridium difficile (como marcador subrogado) es un elemento que por sí mismo permite discriminar a una población de pacientes con mayor riesgo de mal pronóstico que el resto de la población y contribuye a establecer un “score” pronóstico. | 7 (3) | 73,34 | 26,67 |
| Los pacientes con bajos niveles de anticuerpos anti-toxina tienen una mayor tendencia a una mala evolución y cuando se incorporen al uso clínico rutinario contribuirán a seleccionar mejor una población en riesgo de recurrencia o de sufrir un primer episodio. | 7 (1) | 80,0% | 20,00 |
IIC: intervalo intercuartílico.
Tabla 3.
Bloque 3: Uso de fidaxomicina en pacientes con alto riesgo de recurrencia
| Aseveraciones | Mediana (IIC) | % Acuerdo | % en contra de la respuesta mayoritaria |
|---|---|---|---|
| Fidaxomicina es más eficaz en los primeros episodios que en episodios recurrentes, por lo que su empleo no debería reservarse para pacientes con recurrencias múltiples. | 9 (2) | 93,33 | 6,67 |
| En la decisión sobre el empleo de fidaxomicina debe tenerse en cuenta no solo el riesgo de recurrencia de la infección por Clostridium difficile, sino el previsible impacto o consecuencias de una eventual recurrencia. | 9 (1) | 100,0 | 0,0 |
| En pacientes que presenten factores de riesgo de recurrencia bien contrastados (como edad avanzada, necesidad de continuar con antibióticos o insuficiencia renal), o en los que una herramienta clínica predictiva indique un riesgo elevado de recurrencia, debe considerarse el empleo de fidaxomicina durante el primer episodio. | 9 (1) | 100,0 | 0,0 |
| El espectro más selectivo de fidaxomicina sobre la microbiota intestinal, en comparación con otros tratamientos útiles para tratar la infección por Clostridium difficile, permite una recuperación más rápida de la microbiota intestinal y reduce el riesgo de colonización por microorganismos multirresistentes. | 8 (2) | 93,33 | 6,67 |
| No existe evidencia para recomendar el uso de fidaxomicina en combinación, salvo en casos en que no pueda garantizarse con seguridad el tránsito gastrointestinal. | 8 (2) | 80,0 | 20,00 |
| Dada la dispersión de la infección por Clostridium difficile en los centros sanitarios, el rápido incremento de la información sobre la enfermedad y la comercialización de nuevos tratamientos de coste elevado, es recomendable que el manejo de los pacientes con esta infección sea asesorado por expertos en ella. | 9 (1) | 93,34 | 6,67 |
| La reducción en la contaminación ambiental por esporas de Clostridium difficile supone una ventaja adicional de la utilización de fidaxomicina. | 8 (2) | 80,0 | 20,0 |
IIC: intervalo intercuartílico.
Bloque 1. Factores predictores de mala evolución de una infección por Clostridium difficile
De las 7 aseveraciones propuestas en este bloque, solo en 2 no hubo consenso por parte de los panelistas (33,33% en contra de la respuesta mayoritaria) (tabla 1). En una de las aseveraciones no consensuadas se indicaba que “los pacientes con una elevada cantidad de toxina de C. difficile por gramo de heces tienen una mayor tendencia a una mala evolución”. La otra aseveración no consensuada fue “disponer de información sobre la cantidad de toxina de C. difficile ayudaría a mejorar la predicción de una mala evolución de los pacientes que la basada en datos exclusivamente clínicos”. Por otro lado, una de las aseveraciones con mayor grado de acuerdo (93,33%) fue aquella en la que se indicaba que “después de un primer episodio, cualquier paciente tiene un mayor grado de riesgo de evolución desfavorable; la recurrencia es un criterio de riesgo en sí mismo”. La otra aseveración con un 93,33% de acuerdo decía que “la edad avanzada, la necesidad de continuar con antibióticos y la gravedad de la enfermedad de base son algunos de los factores que más predisponen a la mala evolución”.
Bloque 2. Uso de fidaxomicina en pacientes críticos, inmunodeprimidos y con enfermedad subyacente grave
Todas las aseveraciones propuestas en ese bloque se consensuaron en términos de acuerdo (tabla 2). Las aseveraciones con un consenso total (acuerdo del 100%) fueron aquellas en las que se describía que fidaxomicina es eficaz y segura en el tratamiento de la ICD en pacientes oncológicos, sin trasplante por neoplasias hematológicas o de órgano sólido, y en aquellos con insuficiencia renal crónica moderada (filtrado glomerular < 60 ml/min/1,73 m2). Además, todos los panelistas se mostraron de acuerdo en que los estudios de coste-efectividad son favorables al uso de fidaxomicina en pacientes con cáncer, insuficiencia renal y en los tratados con antibióticos en los que se diagnostique una ICD. La aseveración con menor acuerdo (73,33%) fue “en los pacientes trasplantados, el uso de fidaxomicina reduce el riesgo de colonización intestinal por Enterococcus spp. resistente a vancomicina”.
Tabla 2.
Bloque 2: Uso de fidaxomicina en pacientes críticos, inmunodeprimidos y con enfermedad subyacente grave
| Aseveraciones | Mediana (IIC) | % Acuerdo | % en contra de la respuesta mayoritaria |
|---|---|---|---|
| Las indicaciones de fidaxomicina en pacientes ingresados en unidades de críticos son las mismas que las de los pacientes hospitalizados en unidades convencionales. | 8 (2) | 80,00 | 20,00 |
| La respuesta clínica y la seguridad de fidaxomicina para el tratamiento de la diarrea asociada a Clostridium difficile en pacientes ingresados en unidades de críticos son similares a las observadas en enfermos hospitalizados en unidades convencionales. | 8 (2) | 86,66 | 13,33 |
| Fidaxomicina administrada por tubo nasogástrico es efectiva y segura en pacientes críticos con un cuadro grave de diarrea asociada a Clostridium difficile. | 8 (2) | 86,67 | 13,33 |
| La eficacia de fidaxomicina en los pacientes trasplantados, en ausencia de mucositis grave o de episodios previos de diarrea asociada a Clostridium difficile, es similar a la observada con otras pautas terapéuticas, por lo que puede ser utilizada en estos pacientes. | 8 (2) | 93,33 | 6,67 |
| En los pacientes trasplantados, el uso de fidaxomicina reduce el riesgo de colonización intestinal por Enterococcus spp. resistente a vancomicina. | 8 (3) | 73,33 | 26,67 |
| Fidaxomicina es eficaz y segura en el tratamiento de la infección por Clostridium difficile en pacientes oncológicos. | 9 (1) | 100,0 | 0,0 |
| Fidaxomicina reduce el riesgo de recurrencia en pacientes sin trasplante con neoplasias hematológicas o de órgano sólido. | 8 (1) | 100,0 | 0,0 |
| Los pacientes con infección por Clostridium difficile insuficiencia renal crónica moderada-grave (filtrado glomerular < 60 ml/min/1,73 m2) se pueden beneficiar del tratamiento con fidaxomicina. | 8 (1) | 100,0 | 0,0 |
| Los estudios de coste-utilidad son favorables al uso de fidaxomicina en pacientes con cáncer, insuficiencia renal y tratados con antibióticos en los que se diagnostique una infección por Clostridium difficile. | 8 (2) | 100,0 | 0,0 |
IIC: intervalo intercuartílico.
Bloque 3. Uso de fidaxomicina en pacientes con alto riesgo de recurrencia
En el tercer bloque también se consensuaron todas las aseveraciones en términos de acuerdo (tabla 3). De entre ellas, cabe destacar con un 100% de acuerdo aquellas que indican que “en la decisión sobre el empleo de fidaxomicina debe tenerse en cuenta no solo el riesgo de recurrencia de la ICD, sino el previsible impacto o consecuencias de una eventual recurrencia” y la aseveración “en pacientes que presenten factores de riesgo de recurrencia bien contrastados, o en los que una herramienta clínica predictiva indique un riesgo elevado de recurrencia, debe considerarse el empleo de fidaxomicina durante el primer episodio”. Por el contrario, las aseveraciones con menor grado de acuerdo (80%) fueron las que indicaban que “no existe evidencia para recomendar el uso de fidaxomicina en combinación, salvo en casos en que no pueda garantizarse con seguridad el tránsito gastrointestinal” y “la reducción en la contaminación ambiental por esporas de C. difficile supone una ventaja adicional de la utilización de fidaxomicina”.
DISCUSIÓN
En este artículo se abordan algunas cuestiones relativas al manejo clínico de las ICD en distintos grupos de pacientes, así como el papel que juega fidaxomicina en su tratamiento. Para ello se ha utilizado un método Delphi modificado, llegándose a consensuar el 91,3% de las aseveraciones planteadas. Aunque se han llevado a cabo numerosos consensos con metodología Delphi sobre el diagnóstico y manejo de la ICD, ninguno de ellos ha explorado las opiniones de los profesionales sanitarios sobre el uso de fidaxomicina.
Para poder establecer una estrategia terapéutica adecuada, es importante identificar y seleccionar aquellos pacientes con peor pronóstico o con alto riesgo de recurrencia. En este sentido, en un consenso llevado a cabo con expertos europeos de diferentes especialidades se señalaron varios aspectos relacionados con la identificación y el manejo de la ICD, haciendo especial énfasis en las consecuencias de la recurrencia y cómo actuar ante ella [29]. Una de las aseveraciones con mayor grado de acuerdo fue la que afirmaba que la recurrencia de la enfermedad contribuye de forma importante a una mala evolución clínica, una mayor estancia hospitalaria y a mayores costes económicos (97,3%). Así mismo, se expuso que hay ciertos tipos de pacientes (p. ej. aquellos que toman antibióticos, inmunosupresores, tratamientos oncológicos o han sido sometidos a una cirugía) que presentan un mayor riesgo de recurrencia (97,5%) [29]. Los resultados de este consenso europeo coinciden en su mayoría con los expuestos en el nuestro. Entre otros factores predictores de mala evolución, nuestros panelistas destacaron la edad avanzada, la necesidad de continuar con antibióticos y la gravedad de la enfermedad de base. Además, nuestros panelistas indicaron que después de un primer episodio, cualquier paciente tiene un mayor riesgo de evolución desfavorable y que la recurrencia es un criterio de riesgo en sí mismo.
Para facilitar la identificación de pacientes de alto riesgo, un estudio desarrolló un método para predecir el riesgo de recurrencia en estos pacientes y comprobó que el mayor riesgo se producía en mayores de 65 años, con enfermedad grave o fulminante, que requerían un uso adicional de antibióticos y que presentaban unos niveles de IgG frente a la toxina TcdA inferiores a 1,29 unidades de la técnica ELISA [23]. La presencia de toxina libre de C. difficile en heces también se ha empleado para identificar a aquellos pacientes con un peor pronóstico y con una diarrea más grave [30,31]. Sin embargo, este punto fue de los pocos no consensuados por nuestros panelistas. Algunos panelistas expusieron que, aunque la detección de la toxina ayudaría a predecir una mala evolución de los pacientes, dependerá de la posibilidad de corregir los factores que se creen relacionados con el desarrollo de la infección, como, por ejemplo, el tratamiento concomitante con antibióticos.
Fidaxomicina es un antibiótico que pertenece al grupo de los antibacterianos macrocíclicos y está indicado en adultos para el tratamiento de ICD [32]. Aunque en su ficha técnica no se especifica de forma directa, se ha demostrado que la tasa de respuestas globales y la tasa de recurrencia a los 30 días durante el uso de fidaxomicina es similar tanto en los pacientes ingresados en la unidad de cuidados intensivos (60% y 8%, respectivamente) como en los tratados en unidades convencionales (67% y 10%, respectivamente) [33]. De hecho, así lo manifestaron nuestros panelistas con un alto grado de acuerdo. En comparación con otros tratamientos útiles para tratar la ICD, fidaxomicina presenta un espectro de acción más selectivo sobre la microbiota intestinal; lo que permite una recuperación más rápida de la misma y reduce el riesgo de colonización por microorganismos multirresistentes [34,35]. Se ha comprobado que, en comparación con vancomicina, la administración de fidaxomicina se asocia a un menor riesgo de colonización por enterococos resistentes a vancomicina y de Klebsiella pneumoniae productora de β-lactamasa de espectro extendido [36,37].
Sobre la administración de fidaxomicina, los panelistas se mostraron de acuerdo sobre que no existe evidencia para recomendar fidaxomicina en combinación. De hecho, se ha comprobado que su eficacia es mayor cuando se administra en monoterapia que en combinación. Cuando se administraba este fármaco en monoterapia, se proporcionaban unas tasa de curación clínica del 86,2%, y cuando se administraba en combinación con vancomicina oral o rectal, o metronidazol oral o intravenoso, la tasa era del 59,4% (p=0,04) [38]. Aunque puede haber otras explicaciones, combinar fidaxomicina, un fármaco selectivo sobre la microbiota intestinal en comparación con otros tratamientos, con otros fármacos no selectivos (como metronidazol) que sí alteran esta microbiota, podría anular el efecto beneficioso del primero.
Todos los panelistas se mostraron completamente de acuerdo sobre la eficacia y seguridad de fidaxomicina en el tratamiento de la ICD en diferentes escenarios: en pacientes críticos mediante administración por vía nasogástrica; en pacientes trasplantados con ausencia de mucositis grave o de episodios previos de diarrea asociada a C. difficile; en pacientes oncológicos, en pacientes con insuficiencia renal crónica y en situaciones de recurrencia. De hecho, todos estos escenarios han sido estudiados ofreciendo resultados positivos para este fármaco y superiores a los obtenidos por otros antibióticos como vancomicina o metronidazol [39-50]. De entre ellos cabe destacar un estudio post hoc en el que se comparó fidaxomicina con vancomicina en pacientes con tumores hematológicos o sólidos, donde fidaxomicina demostró proporcionar unas tasas de respuesta mantenida significativamente superiores (fidaxomicina 73,6% vs. vancomicina 52,1%, p=0,003) [49]. Además, también se ha visto que el uso de fidaxomicina en pacientes con insuficiencia renal crónica produce unas tasas de recurrencia inferiores a vancomicina, lo que le convierte en el tratamiento de elección en estos casos [48]. Un metaanálisis demostró que la persistencia de la diarrea asociada a ICD y la tasa de recurrencias o muertes son inferiores con fidaxomicina que con vancomicina y, a su vez, inferiores si se administra en el primer episodio que en episodios recurrentes [50]. De hecho, la guía de la European Society of Clinical Microbiology and Infectious Diseases (ESCMID) recomienda el empleo de fidaxomicina durante los primeros episodios, las primeras recurrencias, en pacientes con alto riesgo de recurrencia y en pacientes con múltiples recurrencias [21].
A pesar de los buenos resultados de eficacia ofrecidos por fidaxomicina, muchas instituciones sanitarias restringen el uso de este fármaco alegando su elevado precio o relegándolo a ser usado tras muchas recurrencias. Sin embargo, varios estudios han demostrado que su uso desde el primer episodio en pacientes con factores de riesgo de recurrencia bien contrastados (como edad avanzada, necesidad de continuar con antibióticos o insuficiencia renal) mejora los resultados [50,51]. De ahí la importancia de establecer herramientas que permitan predecir el riesgo de recurrencia de estos pacientes [23,52,53]. Así mismo, se ha comprobado que el uso de fidaxomicina es coste-efectivo en pacientes con cáncer (con un ahorro de 2.397€ por paciente), tratados con antibióticos (con un ahorro de 1.452€ por paciente) y con insuficiencia renal (con un ahorro de 1.432€ por paciente) [54]. Nuestros panelistas también se mostraron completamente de acuerdo con la eficiencia de fidaxomicina.
La principal limitación de este estudio es el haber realizado una única ronda de opiniones. Sin embargo, debido al elevado nivel de consenso alcanzado, se decidió que no era necesario llevar a cabo más rondas. Aunque esta no es la aproximación más habitual, existen publicaciones previas donde se tomó la misma decisión ante el alto grado de consenso observado [55,56]. Otras limitaciones son las habituales en este tipo de consensos, como por ejemplo la dificultad para matizar o aclarar las valoraciones personales de los expertos y el hecho de no ser un método exento de posibles influencias de sus promotores. Para solucionar estas limitaciones se eligió un comité científico avalado por la autoría de publicaciones sobre el tema; además, el análisis de los resultados se llevó a cabo por una agencia externa que el comité científico supervisó.
Como resumen, y gracias al nivel de consenso alcanzado entre los panelistas consultados, cabe considerar como factores predictores de mala evolución de las ICD una infección previa, la edad avanzada, enfermedad grave y la necesidad de continuar con el tratamiento antibiótico de base. Por otro lado, el uso de fidaxomicina se recomienda en determinados grupos de pacientes, como los pacientes críticos, los sometidos a trasplantes, los pacientes con cáncer o aquellos con insuficiencia renal crónica, bien como tratamiento de primera línea o en situaciones de recurrencia.
AGRADECIMIENTOS
Los autores quieren agradecer al Dr. Fernando Sánchez Barbero y a Springer Healthcare su ayuda en la preparación de este manuscrito, esta ayuda ha sido financiada por Astellas Pharma.
FINANCIACIÓN
Astellas Pharma promocionó y financió el trabajo sin participar en su diseño, análisis de datos, ni en la redacción del artículo.
CONFLICTOS DE INTERÉS
Emilio Bouza, Javier Cobo y Antonio Ramos Martínez han recibido honorarios por asesoría científica o participación en reuniones científicas de Astellas y MSD. Benito Almirante ha recibido honorarios por asesoría científica o participación en reuniones científicas de Astellas, MSD, Pfizer, Gilead y Angelini. Csaba Fehér ha recibido honorarios por participar en reuniones científicas y congresos de Astellas, GSK, Pfizer y Gilead. Dolors Rodríguez-Pardo ha recibido honorarios por asesoría científica o participación en reuniones científicas de Astellas, MSD, Pfizer y Angelini. Cristina Sarriá ha recibido honorarios por asesoría científica o participación en reuniones científicas de Astellas, MSD y Angelini.
Grupo de trabajo CLOstridium DIfficile EXpert PANel (CLODIEXPAN)
Carlos Dueñas (Hospital Clínico Universitario de Valladolid, Valladolid); Rosa Escudero (Hospital Universitario Ramón y Cajal, Madrid); Carmen Fariñas (Hospital Universitario Marqués de Valdecilla, Universidad de Cantabria, Santander); Csaba Fehér (Hospital Clínico y Provincial de Barcelona; Barcelona); Juan Pablo Horcajada (Hospital del Mar, Barcelona); Esperanza Merino (Hospital General Universitario de Alicante, Alicante); Paloma Merino (Hospital Clínico San Carlos, Madrid); Miguel Montejo (Hospital Universitario de Cruces, Baracaldo); María Olmedo (Hospital General Universitario Gregorio Marañón, Madrid); Antonio Ramos-Martínez (Hospital Universitario Puerta de Hierro-Majadahonda, Madrid); Dolors Rodríguez-Pardo (Hospital Universitario Vall d’Hebron, Barcelona); Juan Diego Ruiz Mesa (Hospital Regional Universitario Carlos Haya, Málaga); Miguel Salavert (Hospital Universitario y Politécnico La Fe, Valencia); Cristina Sarriá (Hospital Universitario de La Princesa, Madrid); José Tiago Silva (Hospital Universitario 12 de Octubre, Madrid)
BIBLIOGRAFÍA
- 1.Schäffler H, Breitrück A. Clostridium difficile - from colonization to infection. Front Microbiol 2018;9:646. DOI: 10.3389/fmicb.2018.00646; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Moore SC. Clostridium difficile: More challenging than ever. Crit Care Nurs Clin North Am 2018;30(1):41-53. DOI: 10.1016/j.cnc.2017.10.004; PMID: [DOI] [PubMed] [Google Scholar]
- 3.Lessa FC, Mu Y, Bamberg WM, Beldavs ZG, Dumyati GK, Dunn JR, et al. . Burden of Clostridium difficile infection in the United States. N Engl J Med 2015;372(9):825-34. DOI: 10.1056/NEJMoa1408913; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Davies KA, Longshaw CM, Davis GL, Bouza E, Barbut F, Barna Z, et al. . Underdiagnosis of Clostridium difficile across Europe: the European, multicentre, prospective, biannual, point-prevalence study of Clostridium difficile infection in hospitalised patients with diarrhoea (EUCLID). Lancet Infect Dis 2014;14(12):1208-19. DOI: 10.1016/S1473-3099(14)70991-0; PMID: [DOI] [PubMed] [Google Scholar]
- 5.Ananthakrishnan AN. Clostridium difficile infection: epidemiology, risk factors and management. Nat Rev Gastroenterol Hepatol 2011;8(1):17-26. DOI: 10.1038/nrgastro.2010.190; PMID: [DOI] [PubMed] [Google Scholar]
- 6.Lo Vecchio A, Zacur GM. Clostridium difficile infection: an update on epidemiology, risk factors, and therapeutic options. Curr Opin Gastroenterol 2012;28(1):1-9. DOI: 10.1097/MOG.0b013e32834bc9a9; PMID: [DOI] [PubMed] [Google Scholar]
- 7.Tattevin P, Buffet-Bataillon S, Donnio PY, Revest M, Michelet C. Clostridium difficile infections: do we know the real dimensions of the problem? Int J Antimicrob Agents 2013;42(Suppl):S36-40. DOI: 10.1016/j.ijantimicag.2013.04.009; PMID: [DOI] [PubMed] [Google Scholar]
- 8.Barbut F, Cornely OA, Fitzpatrick F, Kuijper E, Nagy E, Rupnik M, et al. Clostridium difficile Infection in Europe: A CDI Europe Report . 2013 [citado April 30 2018]. Disponible en: http://www.multivu.com/assets/60637/documents/60637-CDI-HCP-Report-original.pdf.
- 9.Esteban-Vasallo MD, de Miguel-Díez J, López-de-Andrés A, Hernández-Barrera V, Jiménez-García R. Clostridium difficile-related hospitalizations and risk factors for in-hospital mortality in Spain between 2001 and 2015. J Hosp Infect 2018:. DOI: 10.1016/j.jhin.2018.09.006; PMID: [DOI] [PubMed] [Google Scholar]
- 10.Dubberke ER, Olsen MA. Burden of Clostridium difficile on the healthcare system. Clin Infect Dis 2012;55(Suppl 2):S88-92. DOI: 10.1093/cid/cis335; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Alcalá L, Marín M, Martín A, Sánchez-Somolinos M, Catalán P, Pelaez MT, et al. . Laboratory diagnosis of Clostridium difficile infection in Spain: a population-based survey. J Hosp Infect 2011;79(1):13-7. DOI: 10.1016/j.jhin.2011.05.017; PMID: [DOI] [PubMed] [Google Scholar]
- 12.Gerding DN, Johnson S, Peterson LR, Mulligan ME, Silva J Jr. Clostridium difficile-associated diarrhea and colitis. Infect Control Hosp Epidemiol 1995;16(8):459-77. PMID: [DOI] [PubMed] [Google Scholar]
- 13.Rupnik M, Wilcox MH, Gerding DN. Clostridium difficile infection: new developments in epidemiology and pathogenesis. Nat Rev Microbiol 2009;7(7):526-36. DOI: 10.1038/nrmicro2164; PMID: [DOI] [PubMed] [Google Scholar]
- 14.Collins J, Robinson C, Danhof H, Knetsch CW, van Leeuwen HC, Lawley TD, et al. . Dietary trehalose enhances virulence of epidemic Clostridium difficile. Nature 2018;553(7688):291-4. DOI: 10.1038/nature25178; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Huang AM, Marini BL, Frame D, Aronoff DM, Nagel JL. Risk factors for recurrent Clostridium difficile infection in hematopoietic stem cell transplant recipients. Transpl Infect Dis 2014;16(5):744-50. DOI: 10.1111/tid.12267; PMID: [DOI] [PubMed] [Google Scholar]
- 16.Stringer AM, Gibson RJ, Bowen JM, Keefe DM. Chemotherapy-induced modifications to gastrointestinal microflora: evidence and implications of change. Curr Drug Metab 2009;10(1):79-83. DOI: 10.2174/138920009787048419; PMID: [DOI] [PubMed] [Google Scholar]
- 17.Tirath A, Tadros S, Coffin SL, Kintziger KW, Waller JL, Baer SL, et al. . Clostridium difficile infection in dialysis patients. J Investig Med 2017;65(2):353-7. DOI: 10.1136/jim-2016-000183; PMID: [DOI] [PubMed] [Google Scholar]
- 18.Rogala BG, Malat GE, Lee DH, Harhay MN, Doyle AM, Bias TE. Identification of risk factors associated with clostridium difficile infection in liver transplantation recipients: A single-center analysis. Transplant Proc 2016;48(8):2763-8. DOI: 10.1016/j.transproceed.2016.08.006; PMID: [DOI] [PubMed] [Google Scholar]
- 19.Henrich TJ, Krakower D, Bitton A, Yokoe DS. Clinical risk factors for severe Clostridium difficile-associated disease. Emerg Infect Dis 2009;15(3):415-22. DOI: 10.3201/eid1503.080312; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Hensgens MP, Dekkers OM, Goorhuis A, LeCessie S, Kuijper EJ. Predicting a complicated course of Clostridium difficile infection at the bedside. Clin Microbiol Infect 2014;20(5):O301-8. DOI: 10.1111/1469-0691.12391; PMID: [DOI] [PubMed] [Google Scholar]
- 21.Debast SB, Bauer MP, Kuijper EJ, European Society of Clinical Microbiology Infectious Diseases European Society of Clinical Microbiology and Infectious Diseases: Update of the treatment guidance document for Clostridium difficile infection . Clin Microbiol Infect 2014;20 (Suppl 2):1-26. DOI: 10.1111/1469-0691.12418; PMID: [DOI] [PubMed] [Google Scholar]
- 22.Vardakas KZ, Polyzos KA, Patouni K, Rafailidis PI, Samonis G, Falagas ME. Treatment failure and recurrence of Clostridium difficile infection following treatment with vancomycin or metronidazole: a systematic review of the evidence. Int J Antimicrob Agents 2012;40(1):1-8. DOI: 10.1016/j.ijantimicag.2012.01.004; PMID: [DOI] [PubMed] [Google Scholar]
- 23.Hu MY, Katchar K, Kyne L, Maroo S, Tummala S, Dreisbach V, et al. . Prospective derivation and validation of a clinical prediction rule for recurrent Clostridium difficile infection. Gastroenterology 2009;136(4):1206-14. DOI: 10.1053/j.gastro.2008.12.038; PMID: [DOI] [PubMed] [Google Scholar]
- 24.Louie TJ, Miller MA, Mullane KM, Weiss K, Lentnek A, Golan Y, et al. . Fidaxomicin versus vancomycin for Clostridium difficile infection. N Engl J Med 2011;364(5):422-31. DOI: 10.1056/NEJMoa0910812; PMID: [DOI] [PubMed] [Google Scholar]
- 25.Cornely OA, Crook DW, Esposito R, Poirier A, Somero MS, Weiss K, et al. . Fidaxomicin versus vancomycin for infection with Clostridium difficile in Europe, Canada, and the USA: a double-blind, non-inferiority, randomised controlled trial. Lancet Infect Dis 2012;12(4):281-9. DOI: 10.1016/S1473-3099(11)70374-7; PMID: [DOI] [PubMed] [Google Scholar]
- 26.Wood L, Bjarnason GA, Black PC, Cagiannos I, Heng DY, Kapoor A, et al. . Using the Delphi technique to improve clinical outcomes through the development of quality indicators in renal cell carcinoma. J Oncol Pract 2013;9(5):e262-7. DOI: 10.1200/JOP.2012.000870; PMID: [DOI] [PubMed] [Google Scholar]
- 27.Powell C. The Delphi technique: myths and realities. J Adv Nurs 2003;41(4):376-82. DOI: 10.1046/j.1365-2648.2003.02537.x; PMID: [DOI] [PubMed] [Google Scholar]
- 28.Fitch K, Bernstein SJ, Aguilar MD, Burnand B, LaCalle JR, Lázaro P, et al. The RAND/UCLA appropriateness method user’s manual. [citado April 25 2018]. Disponible en: http://www.rand.org/pubs/monograph_reports/MR1269.html.
- 29.Aguado JM, Anttila VJ, Galperine T, Goldenberg SD, Gwynn S, Jenkins D, et al. . Highlighting clinical needs in Clostridium difficile infection: the views of European healthcare professionals at the front line. J Hosp Infect 2015;90(2):117-25. DOI: 10.1016/j.jhin.2015.03.001; PMID: [DOI] [PubMed] [Google Scholar]
- 30.Planche TD, Davies KA, Coen PG, Finney JM, Monahan IM, Morris KA, et al. . Differences in outcome according to Clostridium difficile testing method: a prospective multicentre diagnostic validation study of C difficile infection. Lancet Infect Dis 2013;13(11):936-45. DOI: 10.1016/S1473-3099(13)70200-7; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Akerlund T, Svenungsson B, Lagergren A, Burman LG. Correlation of disease severity with fecal toxin levels in patients with Clostridium difficile-associated diarrhea and distribution of PCR ribotypes and toxin yields in vitro of corresponding isolates. J Clin Microbiol 2006;44(2):353-8. DOI: 10.1128/JCM.44.2.353-358.2006; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Pichenot M, Hequette-Ruz R, Le Guern R, Grandbastien B, Charlet C, Wallet F, et al. . Fidaxomicin for treatment of Clostridium difficile infection in clinical practice: a prospective cohort study in a French University Hospital. Infection 2017;45(4):425-31. DOI: 10.1007/s15010-017-0981-8; PMID: [DOI] [PubMed] [Google Scholar]
- 33.Penziner S, Dubrovskaya Y, Press R, Safdar A. Fidaxomicin therapy in critically ill patients with Clostridium difficile infection. Antimicrob Agents Chemother 2015;59(3):1776-81. DOI: 10.1128/AAC.04268-14; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Lewis BB, Buffie CG, Carter RA, Leiner I, Toussaint NC, Miller LC, et al. . Loss of microbiota-mediated colonization resistance to Clostridium difficile infection with oral vancomycin compared with metronidazole. J Infect Dis 2015;212(10):1656-65. DOI: 10.1093/infdis/jiv256; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Isaac S, Scher JU, Djukovic A, Jiménez N, Littman DR, Abramson SB, et al. . Short- and long-term effects of oral vancomycin on the human intestinal microbiota. J Antimicrob Chemother 2017;72(1):128-36. DOI: 10.1093/jac/dkw383; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Nerandzic MM, Mullane K, Miller MA, Babakhani F, Donskey CJ. Reduced acquisition and overgrowth of vancomycin-resistant enterococci and Candida species in patients treated with fidaxomicin versus vancomycin for Clostridium difficile infection. Clin Infect Dis 2012;55(Suppl 2):S121-6. DOI: 10.1093/cid/cis440; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Deshpande A, Hurless K, Cadnum JL, Chesnel L, Gao L, Chan L, et al. . Effect of fidaxomicin versus vancomycin on susceptibility to intestinal colonization with vancomycin-resistant enterococci and Klebsiella pneumoniae in mice. Antimicrob Agents Chemother 2016;60(7):3988-93. DOI: 10.1128/AAC.02590-15; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Vargo CA, Bauer KA, Mangino JE, Johnston JE, Goff DA. An antimicrobial stewardship program’s real-world experience with fidaxomicin for treatment of Clostridium difficile infection: a case series. Pharmacotherapy 2014;34(9):901-9. DOI: 10.1002/phar.1451; PMID: [DOI] [PubMed] [Google Scholar]
- 39.Arends S, Defosse J, Diaz C, Wappler F, Sakka SG. Successful treatment of severe Clostridium difficile infection by administration of crushed fidaxomicin via a nasogastric tube in a critically ill patient. Int J Infect Dis 2017;55:27-8. DOI: 10.1016/j.ijid.2016.12.020; PMID: [DOI] [PubMed] [Google Scholar]
- 40.Maseda E, Hernández-Gancedo C, López-Tofino A, Suárez-de-la Rica A, García-Bujalance S, Gilsanz F. Use of fidaxomicin through a nasogastric tube for the treatment of septic shock caused by Clostridium difficile infection in a patient with oral cancer admitted to the Surgical Critical Care Unit. Rev Esp Quimioter 2013;26(4):375-7. PMID: [PubMed] [Google Scholar]
- 41.Clutter DS, Dubrovskaya Y, Merl MY, Teperman L, Press R, Safdar A. Fidaxomicin versus conventional antimicrobial therapy in 59 recipients of solid organ and hematopoietic stem cell transplantation with Clostridium difficile-associated diarrhea. Antimicrob Agents Chemother 2013;57(9):4501-5. DOI: 10.1128/AAC.01120-13; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Esmaily-Fard A, Tverdek FP, Crowther DM, Ghantoji SS, Adachi JA, Chemaly RF. The use of fidaxomicin for treatment of relapsed Clostridium difficile infections in patients with cancer. Pharmacotherapy 2014;34(11):1220-5. DOI: 10.1002/phar.1479; PMID: [DOI] [PubMed] [Google Scholar]
- 43.D’Agata EM, Mount DB, Thayer V, Schaffner W. Hospital-acquired infections among chronic hemodialysis patients. Am J Kidney Dis 2000;35(6):1083-8. DOI: 10.1016/S0272-6386(00)70044-8; PMID: [DOI] [PubMed] [Google Scholar]
- 44.Dial S, Kezouh A, Dascal A, Barkun A, Suissa S. Patterns of antibiotic use and risk of hospital admission because of Clostridium difficile infection. CMAJ 2008;179(8):767-72. DOI: 10.1503/cmaj.071812; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Yousuf K, Saklayen MG, Markert RJ, Barde CJ, Gopalswamy N. Clostridium difficile-associated diarrhea and chronic renal insufficiency. South Med J 2002;95(7):681-3. PMID: [PubMed] [Google Scholar]
- 46.Pant C, Madonia P, Minocha A, Manas K, Jordan P, Bass P. Laboratory markers as predictors of mortality in patients with Clostridium difficile infection. J Investig Med 2010;58(1):43-5. DOI: 10.2310/JIM.0b013e3181bca525; PMID: [DOI] [PubMed] [Google Scholar]
- 47.Pepin J, Vo TT, Boutros M, Marcotte E, Dial S, Dube S, et al. . Risk factors for mortality following emergency colectomy for fulminant Clostridium difficile infection. Dis Colon Rectum 2009;52(3):400-5. DOI: 10.1007/DCR.0b013e31819a69aa; PMID: [DOI] [PubMed] [Google Scholar]
- 48.Mullane KM, Cornely OA, Crook DW, Golan Y, Louie TJ, Miller MA, et al. . Renal impairment and clinical outcomes of Clostridium difficile infection in two randomized trials. Am J Nephrol 2013;38(1):1-11. DOI: 10.1159/000351757; PMID: [DOI] [PubMed] [Google Scholar]
- 49.Cornely OA, Miller MA, Fantin B, Mullane K, Kean Y, Gorbach S. Resolution of Clostridium difficile-associated diarrhea in patients with cancer treated with fidaxomicin or vancomycin. J Clin Oncol 2013;31(19):2493-9. DOI: 10.1200/JCO.2012.45.5899; PMID: [DOI] [PubMed] [Google Scholar]
- 50.Crook DW, Walker AS, Kean Y, Weiss K, Cornely OA, Miller MA, et al. . Fidaxomicin versus vancomycin for Clostridium difficile infection: meta-analysis of pivotal randomized controlled trials. Clin Infect Dis 2012;55(Suppl 2):S93-103. DOI: 10.1093/cid/cis499; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Mullane KM, Miller MA, Weiss K, Lentnek A, Golan Y, Sears PS, et al. . Efficacy of fidaxomicin versus vancomycin as therapy for Clostridium difficile infection in individuals taking concomitant antibiotics for other concurrent infections. Clin Infect Dis 2011;53(5):440-7. DOI: 10.1093/cid/cir404; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.D’Agostino RB, Collins SH, Pencina KM, Kean Y, Gorbach S. Risk estimation for recurrent Clostridium difficile infection based on clinical factors. Clin Infect Dis 2014;58(10):1386-93. DOI: 10.1093/cid/ciu107; PMID: [DOI] [PubMed] [Google Scholar]
- 53.Cobo J, Merino E, Martínez C, Cózar-Llistó A, Shaw E, Marrodán T, et al. . Prediction of recurrent Clostridium difficile infection at the bedside: the GEIH-CDI score. Int J Antimicrob Agents 2018;51(3):393-8. DOI: 10.1016/j.ijantimicag.2017.09.010; PMID: [DOI] [PubMed] [Google Scholar]
- 54.Rubio-Terrés C, Cobo Reinoso J, Grau Cerrato S, Mensa Pueyo J, Salavert Lletí M, Toledo A, et al. . Economic assessment of fidaxomicin for the treatment of Clostridium difficile infection (CDI) in special populations (patients with cancer, concomitant antibiotic treatment or renal impairment) in Spain. Eur J Clin Microbiol Infect Dis 2015;34(11):2213-23. DOI: 10.1007/s10096-015-2472-0; PMID: [DOI] [PubMed] [Google Scholar]
- 55.Carl M, Alms A, Braun J, Dongas A, Erb J, Goetz A, et al. . S3 guidelines for intensive care in cardiac surgery patients: hemodynamic monitoring and cardiocirculary system. German medical science : GMS e-journal 2010;8:Doc 12. DOI: 10.3205/000101; PMID: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Calhoun Thielen C, Sadowsky C, Vogel LC, Taylor H, Davidson L, Bultman J, et al. . Evaluation of the Walking Index for Spinal Cord Injury II (WISCI-II) in children with Spinal Cord Injury (SCI). Spinal cord 2017;55(5):478-82. DOI: 10.1038/sc.2016.142; PMID: [DOI] [PubMed] [Google Scholar]