RESUMEN
Baloxavir marboxil (ácido 5-hidroxi-4-piridona-3-carboxilo) es un nuevo fármaco antiviral con especial eficacia sobre los virus gripales que actúa inhibiendo la endonuclease cap-dependiente que precisan para su replicación. Es el primer representante de los denominados inhibidores de la proteína básica 2 (PB2) gripal. Ha mostrado eficacia frente a los virus gripales A y B y la mayoría de cepas de origen animal (gripe aviar). Los ensayos clínicos realizados en pacientes sanos de entre 12 y 64 años sin patologías y no hospitalizados (gripe leve) han mostrado una reducción de la duración de la sintomatología parecida a la obtenida por oseltamivir. Sin embargo baloxavir es un inhibidor de la replicación viral mucho más potente que este fármaco. Se ha mostrado como un fármaco seguro y bien tolerado. Se administra una sola dosis de 40-80 mg las primeras 48 horas del inicio de los síntomas. En estos ensayos se han detectado cepas con sensibilidad moderada (mutantes PA/I38T) en el 2,2% de la gripe A (H1N1)pdm09 y en el 9,7% de la gripe A (H3N2). A pesar de estos datos podría ser un buen fármaco para tratar la gripe leve o moderada, precisando de ensayos en gripe grave y pacientes con patologías crónicas para establecer su verdadera utilidad clínica.
Palabras clave: Baloxavir marboxil, Virus gripales, Eficacia clínica
ABSTRACT
Baloxavir marboxil (5-hydroxy-4-pyridone-3-carboxyl acid) is a new antiviral drug with special efficacy on influenza viruses that acts by inhibiting the cap-dependent endonuclease required for its replication. It is the first representative of the so-called inhibitors of influenza-like PB2. It has shown efficacy against influenza viruses A and B and most strains of animal origin (avian flu). Clinical trials conducted in healthy patients between 12 and 64 years without pathologies and not hospitalized (mild flu) have shown a reduction in the duration of symptoms similar to that obtained by oseltamivir. However, baloxavir is a much more potent inhibitor of viral replication than this drug. It has been shown as a safe and well tolerated drug. A single dose of 40-80 mg is administered the first 48 hours after onset of symptoms. In these trials, strains with moderate sensitivity (PA / I38T mutants) were detected in 2.2% of influenza A (H1N1) pdm09 and in 9.7% of influenza A (H3N2). Although these data could be a good drug to treat mild or moderate influenza, requiring trials in severe influenza and patients with chronic diseases to establish their true clinical utility.
Keywords: Baloxavir marboxil, Influenza viruses, Clinical efficacy
INTRODUCCIÓN
La gripe es una enfermedad causada por los virus gripales A y B que se presenta como epidemias anuales en los meses invernales y de forma pandémica sólo de manera ocasional. Aunque es una enfermedad leve y autolimitada, cuando afecta a la población de edad avanzada o a personas con patologías crónicas de base, puede presentar una elevada morbilidad e incluso mortalidad [1].
La mejor estrategia para hacer frente a las epidemias anuales de gripe es la prevención mediante la aplicación de la adecuada vacuna antigripal. Sin embargo la eficacia y efectividad de la misma no siempre es lo deseada, de modo que en las presentaciones graves debemos utilizar algún tratamiento antiviral [2,3].
Los fármacos antivirales antigripales son todavía escasos y pueden agruparse en dos tipos de acción diferente [4,5]. Los más antiguos, o clásicos, son los inhibidores de la proteína M2 o del canal iónico (amantadina y rimantadina); la eficacia de los cuales ha disminuido mucho en los últimos años por la aparición de resistencias frente a los mismos [4,5]. El segundo grupo lo constituyen los inhibidores de la neuraminidasa (zanamivir, oseltamivir y peramivir), cuya eficacia ha sido ampliamente cuestionada, especialmente en los pacientes con neumonías gripales graves ingresados [5,6]. Su capacidad para reducir la carga viral, si son administrados las primeras 48 horas, no parece suficiente en este tipo de pacientes y quizás sólo serían de utilidad en pacientes con gripe leve o moderada que no precisen del ingreso hospitalario [6].
Hasta 2014 la Food and Drug Administration (FDA) americana sólo había aprobado para el tratamiento farmacológico específico frente a la gripe los inhibidores de la neuraminidasa (oseltamivir y zanamivir en 1999) y peramivir intravenoso en este mismo año. Debido a ello y al impacto de la gripe en salud pública en los últimos años se han desarrollado nuevos fármacos con un mecanismo de acción mucho más específico que bloquean el proceso de replicación viral. Así uno de ellos es favipiravir que actúa directamente sobre la ARN-polimersa de los virus gripales [7].
En febrero de 2018 otro fármaco que también bloquea la replicación viral aunque en otra diana molecular fue aprobado en Japón para el tratamiento de la gripe A y B [8] y en octubre de este mismo año la FDA lo aprobó para su uso clínico en Estados Unidos. Este nuevo fármaco se denomina baloxavir marboxil (XoFluzaTM) (código producto S-033188) [9].
MECANISMO DE ACCIÓN Y ESTRUCTURA
El genoma de los virus gripales está formado por ocho segmentos de ARN monofilar negativo de unas 12.000 pares de bases en total. Cada uno de los segmentos genéticos se replica de forma sincrónica a través del denominado complejo transcripcional [1]. Este complejo está constituido por una ARN-polimerasa heterotrímera formada por las subunidades proteicas PA (polimerasa), PB1 (proteína básica 1) y PB2 (proteína básica 2) que son esenciales para la replicación viral [1]. La transcripción de los ARN mensajeros virales depende de un mecanismo único denominado “cap-snatching” (de arrebatar). La proteína PB2 se une al extremo cap del ARN pre-mensajero de la célula huésped para ser posteriormente escindida por una endonucleasa cap-dependiente (ECD) gripal en la proteína PA que se encarga de producir un fragmento de 9-13 bases del extremo 3´-cap que actúa como iniciador de la ARN-polimerasa viral [10]. Este proceso es esencial para el inicio de la replicación viral y por ello una posible diana farmacológica [11].
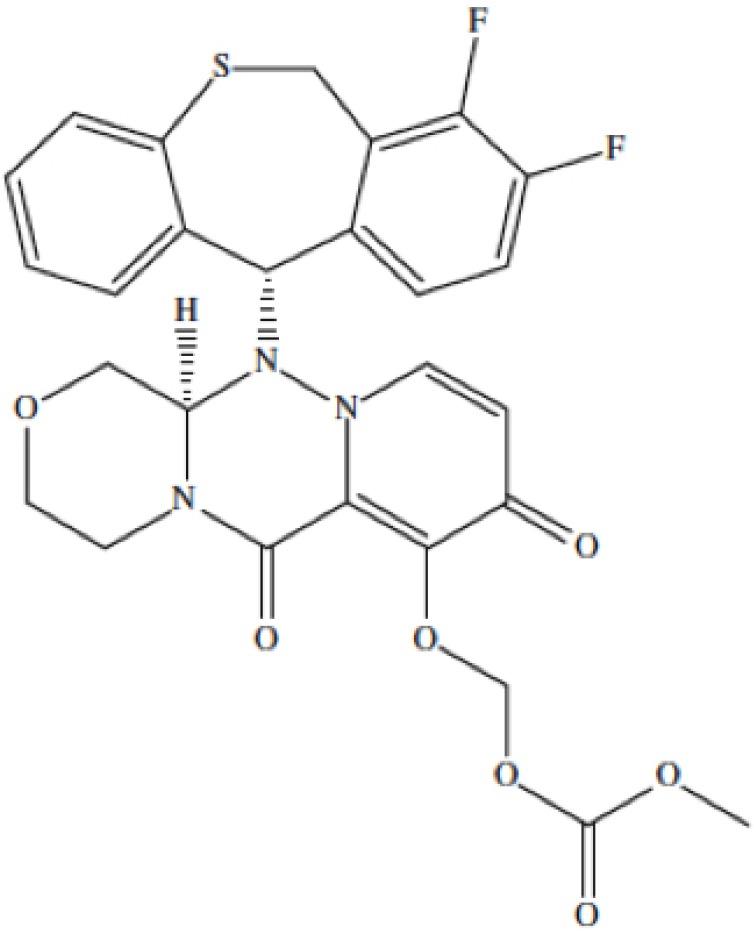
De los diferentes inhibidores químicos de la ECD, tales como el ácido 4-2,4-dioxobutanoic, las catequinas derivadas del te verde, los análogos del fenetilfeniltalimida o los catecoles, sólo el ácido 5-hidroxi-4-piridona-3-carboxilo (baloxavir-marboxil) (figura 1) ha mostrado eficacia in vitro frente a los virus gripales A y B [12-14]. Los estudios in vitro realizados por Noshi et al [15] han confirmado la capacidad del baloxavir para bloquear la ECD sobre la proteína PA en el proceso de transcripción viral; este fármaco es el primer representante de los denominados inhibidores de la PB2 gripal. Esta actividad se presenta tanto en los virus gripales A como B así como con virus de otras especies animales. Este amplio espectro de acción puede explicarse con la elevada conservación de los aminoácidos en el centro activo del enzima ECD [15].
Figura 1.
Estructura química del baloxavir, un inhibidor de la endonucleasa-cap-dependiente de los virus gripales
Sin embargo algunos estudios habían observado que a pesar de que la posición 38 de la PA está formada mayoritariamente por isoleucina (99,9%), se han descrito sustituciones por valina (0,04%) o treonina (0,02%) [16]. Baloxavir es capaz de actuar sobre estos polimorfismos y variedades PA/V38 (mutantes de escape) siendo las escasas cepas estudiadas moderadamente sensibles a este nuevo fármaco. La incidencia de la mutación PA/T38 en el virus A (H1N1)pdm09 es tan solo del 0,02%, sugiriendo que sólo se produciría en presencia del baloxavir [15]. La aparición de estas cepas de baja sensibilidad es sólo el resultado del tratamiento con este fármaco, es decir todavía no se han descrito resistencias primarias. En estos momentos se considera que las cepas mutantes con el marcador PA/I38T son las que pueden presentar sensibilidades reducidas y ya fueron descritas por Omoto et al [17] y Hayden et al [18] en 2018. Las mutantes de escape presentan una disminución de la sensibilidad frente a baloxivir de 30-50 veces en la gripe A y de unas 7 veces en gripe B [19-22].
Hayden et al [18] en sus ensayos clínicos en Fases II y III han detectado un 2,2% de cepas de gripe A (H1N1)pdm09 y del 9,7% en gripe A (H3N2) con sensibilidad disminuida frente a baloxavir y con la presencia de las mutaciones PA/I/MF. Estas mutaciones podrían asociarse con repuntes en el título y la carga viral y quizás en la prolongación de los síntomas gripales y la transmisibilidad; aunque estudios en cultivos celulares parecen indicar que estas cepas mutantes presentan un menor fitness y capacidad de diseminación aunque no de intensidad replicativa; en los pacientes con cepas mutantes el virus A (H3N2) podía detectarse en el 91% de ellos a los 5 días del tratamiento [18,19]. Omoto et al [17] al analizar las estructuras co-cristalinas de las cepas salvajes y de las mutantes en PA/I38 observaron como el dominio terminal de esta proteína tenía una menor afinidad por baloxavir, de modo que esta mutación reduce las interacciones entre la proteína y el fármaco. Una sola dosis por vía oral de baloxavir es capaz de reducir la carga viral en dos logaritmos, disminuyendo la mortalidad de los ratones en más del 80% en comparación con el oseltamivir [12,15,23].
Tanto baloxavir como favipiravir muestran una pendiente de inhibición mas acentuada en un amplio rango dinámico comparado con los inhibidores de la neuraminidasa. De este modo baloxavir reduce de forma drástica la síntesis del ARN-mensajero, ARN viral y la síntesis del ARN-complementario; mientras que favipiravir tan solo reduce el ARN viral completo. Por todo ello debe considerarse que ambos fármacos actúan en dianas distintas y que podrían ser complementarios [15].
ENSAYOS CLÍNICOS
Baloxavir marboxil es un profármaco que administrado por vía oral rápidamente es hidrolizado a baloxavir (forma activa) por el enzima arilacetamida deacetilasa en el intestino delgado, sangre e hígado. Es metabolizado in vivo principalmente por la uridina difosfato glucuroniltransferasa 1A3, con escasa contribución del citocromo P450 3A4, y es excretado en cerca del 80% por las heces [9,18,19,24]. La forma marboxil apenas puede detectarse en sangre, siendo el ácido baloxavir el detectado mayoritariamente. Este fármaco presenta una farmacocinética lineal de acuerdo con el rango de dosis estudiada (6-80 mg) y una vida media de eliminación de entre 80-100 horas tras una sola administración oral; la dosis recomendada es de 40 mg en personas de <80 kilos y 80 mg en >80 Kg [8,14,24,25].
Koshimichi et al [25] han realizado un estudio en humanos sanos Fase I para evaluar la seguridad, tolerabilidad y farmacocinética de este nuevo fármaco. En una de las ramas los voluntarios recibían una sola dosis oral de baloxavir (6, 20, 40, 60 o 80 mg; seis personas por dosis) y en la otra (15 sujetos) recibían también una sola dosis oral de 20 mg antes y después de comer. El fármaco fue muy bien tolerado por todos los sujetos y todas las dosis; se presentaron muy pocos efectos adversos leves y ninguno grave. La concentración media de baloxavir en plasma después de las 24 horas (C24) de la administración de 6 mg fue de 6,92 ng/ml, siendo ligeramente superior a la C24 estimada en los estudios no clínicos de 6,85 ng/ml. El pico máximo de concentración se obtuvo a las 3,5 horas de su administración y la vida media de eliminación se situó entre las 49 y 91 horas. La concentración plasmática bajo la curva disminuyó con la ingesta de comida hasta en un 40%, aunque la concentración obtenida está dentro del rango terapéutico [18,25].
Hayden et al [18] han realizado una serie de ensayos clínicos Fase II y III (en personas japonesas y americanas de entre 12-64 años) aleatorizado, doble ciego en personas sin factores de riesgo no hospitalizadas y con gripe no complicada (CAPSTONE-1). Se ha observado como una sola dosis oral de baloxavir (40 o 80 mg) era perfectamente tolerada y disminuía el tiempo de duración de los síntomas de la gripe con una reducción muy similar a la observada con oseltamivir (53 horas baloxavir, 53 horas oseltamivir y 80 horas placebo). Este estudio lo más importante es que ha demostrado la reducción significativa en el tiempo de excreción viral por parte de baloxavir (24 horas baloxavir, 72 horas oseltamivir y 96 horas placebo); este hecho es importante desde el punto de vista patológico pulmonar como en el proceso infeccioso de la gripe y su diseminación comunitaria.
De este modo se confirma que baloxavir es superior como fármaco antiviral, no anti-sintomático, frente a oseltamivir y evidentemente placebo. Tras 24 horas de la administración oral de baloxavir el título viral en faringe disminuyó 3,5 log10 TCID50/ml comparado con placebo y sólo 1,5 log10 TCID50/ml con oseltamivir y placebo [18,25].
Recientemente se ha presentado un estudio internacional, aleatorizado, doble ciego y con placebo +/- oseltamivir para el tratamiento de pacientes con riesgo de gripe grave [26]. Los criterios de inclusión fueron de mayores de 12 años, fiebre y síntomas compatibles con gripe de menos de 48 horas de inicio y presencia de alguno de alguno de los criterios de riesgo establecidos por el CDC (asma, enfermedad pulmonar crónica o edad >65 años). La dosis única fue de 40 o 80 mg según el peso. De los 2184 pacientes analizados el 53% presentaron una disminución cuantificable de los síntomas clínicos (47% con gripe A (H3N2), 6,9% con gripe A (H1N1)pdm y 41,6% con gripe B). Esta reducción fue significativamente mayor con baloxavir que con placebo (73 horas frente 103.3 horas) y numéricamente superior que con oseltamivir (81 horas). El tiempo medio de desaparición de la excreción viral en el frotis faríngeo (determinada por una RT-PCR) fue de 48 horas para baloxavir frente a las 96 horas de las otras terapias. La incidencia de algún efecto adverso fue menor con baloxavir (25,1%) y la incidencia de efectos adversos serios (0,7-1,2%) fue semejante a las otras terapias. De este modo se concluye que los pacientes con riesgo de gravedad frente a la gripe baloxavir es bien tolerado y se asocia a una recuperación mas precoz reduciendo las complicaciones y el tiempo de excreción viral, siendo en todo ello superior a oseltamivir [26].
Baloxavir es un potente inhibidor del transporte activo mediado por la glicoproteína P, habiéndose comunicado que oseltamivir es un sustrato que utiliza esta glicoproteína y el transportador peptídico 1 [24]. Debido a este hecho se ha realizado un estudio in vitro e in vivo sobre las posibles interacciones entre baloxavir y oseltamivir en un intento de analizar la utilización conjunta de estos fármacos en los casos graves de gripe [27]. Kawaguchi et al [24] han realizado un estudio en Fase I en el que 18 adultos sanos recibieron tres tipos de tratamiento: (a) una sola dosis de baloxavir oral de 40 mg; (b) oseltamivir 75 mg dos veces al día durante cinco días; y (c) una sola administración de baloxavir 40 mg en combinación con 75 mg dos veces al día de oseltamivir durante cinco días.
La relación (intervalo de confianza 90%) de la concentración máxima en plasma y del área bajo la curva de baloxavir en combinación frente a baloxavir solo fue de 1,03 (0,92-1,15) y de 1,01 (0,96-1,06) respectivamente. La relación (intervalo de confianza 90%) de la concentración máxima en plasma y del área bajo la curva de oseltamivir en combinación frente a oseltamivir solo fue de 0,96 (0,93-1,00) y de 0,99 (0,93-1,00) respectivamente [24]. Este estudio no terapéutico sugiere que la combinación de estos dos fármacos muestra una actividad antiviral sinérgica frente a los virus gripales. Esta combinación es capaz de inhibir el efecto citopático inducido por la cepa gripal A/PR/8/34 en los cultivos celulares MDCK [17,24]. En los ratones infectados con dosis letales de gripe, el tratamiento con baloxavir (0,5 mg/Kg) mas oseltamivir (10 mg/Kg) producía un mayor efecto protector disminuyendo la mortalidad de los animales [24,28]. Por lo tanto parece que esta combinación podría ser una buena candidata para los pacientes con gripe grave o complicada.
En el modelo de gripe letal de los ratones, baloxavir también actúa suprimiendo la respuesta precoz de citoquinas (IL-6 y MCP-1) inducidas por el virus. Este hecho comporta una disminución de la infiltración inflamatoria células (macrófagos y neutrófilos) en el parénquima pulmonar, protegiendo a este órgano de los cambios inflamatorios y patogénicos. Por su parte oseltamivir apenas actúa en este fenómeno, de modo que su combinación con baloxavir mejoraría todo el proceso patológico de la gripe a nivel pulmonar [27,28].
En resumen parece que baloxavir es un nuevo fármaco antiviral frente a los virus gripales bien tolerado y sin especiales efectos adversos que tiene un potente efecto antiviral si se administra las primeras 48 horas y que podría utilizarse en los pacientes con gripe leve y además frente aquellas cepas resistentes a los inhibidores de la neuraminidasa. La detección de cepas con baja sensibilidad a este fármaco durante su tratamiento obliga a realizar un seguimiento de la presencia de mutaciones de resistencia en el gen PA como marcador epidemiológico.
A pesar de ello se precisan todavía de estudios aleatorizados sobre su eficacia en grupos de riesgo tales como <12 años y >65 años, embarazadas y patología crónicas no respiratorias. También debe conocerse su eficacia terapéutica mas allá de las 48 horas del inicio de los síntomas y de su utilidad como prevención de brotes epidémicos en centros cerrados como residencias de la tercera edad.
CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de intereses.
REFERENCIAS
- 1.Wright PF, Neumann G, Kawaoka Y. Orthomyxoviruses. En: Knipe DM, Howey PM (ed.). Fields Virology (6th ed). Lippincott Williams & Wilkins; Philadelphia, 2013, p.1186-1244. [Google Scholar]
- 2.Monto AS. The role of antivirals in the control of influenza. Vaccine 2003; 21:1796-1800. PMID: . [DOI] [PubMed] [Google Scholar]
- 3.Fiore AE, Fry A, Shay D, Gubareva L, Breese JS, Uyeki TM, Centers for Disease Control and Prevention Antiviral agents for the treatment and chemoprophylaxis of influenza-recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2011; 60_1-24. PMID: . [PubMed] [Google Scholar]
- 4.De Clerq E. Highlights in antiviral drug research: antivirals at the horizon. Med Res Rev 2013; 33:1215-48. doi: 10.1002/med.21256. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.De Clerq E, Li G. Approved antiviral drugs over the past 50 years. Clin Microbiol Rev 2016; 29:695-746. doi: 10.1128/CMR.00102-15. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Dobson J, Whitley RJ, Pocok S, Monto AS. Oseltamivir treatment for influenza in adults: a meta-analysis of randomised controlled trials. Lancet 2015; 385:1729-37. PMID: . [DOI] [PubMed] [Google Scholar]
- 7.Reina J, Reina N. Favipirarvir, un nuevo concepto de fármaco antiviral frente a los virus gripales. Rev Esp Quimiotera 2017; 30:79-83. PMID: . [PubMed] [Google Scholar]
- 8.Shionogi & Co. Ltd XofluzaTM (baloxavir): Japanese prescribing information 2018. http://www.pmda.go.jp.
- 9.Roche Media Release Roche announces FDA approval of Xofluza (baloxavir marboxil) for influenza. Media.relations@roche.com. [Google Scholar]
- 10.Yuan P, Bartlam M, Lou Z. Crystal structure of an avian influenza polymerase PA (N) reveals an endonuclease active site. Nature 2009; 458:909-13. doi: 10.1038/nature07720. [DOI] [PubMed] [Google Scholar]
- 11.Shibagaki Y, Ikuta N, Iguchi S, Takaki K, Watanabe S, Mizumoto K et al. An efficient screening system for influenza virus cap-dependent endonucleaes inhibitors. J Virol Meth 2014; 202:8-14. doi: 10.1016/j.viromet.2014.02.005. [DOI] [PubMed] [Google Scholar]
- 12.Miyagawa M, Akiyama T, Mikamiyama-Iwata M, Hattori K, Kurihara N, Taoda Y et al. Discovery of novel 5-hydroxy-4-pyridone-3-carboxy acids as potent inhibitors of influenza Cap-dependent endonuclease. Bioorg Med Chem Lett 2016; 26:4739-42. doi: 10.1016/j.bmcl.2016.08.038. [DOI] [PubMed] [Google Scholar]
- 13.Koszalka P, Tilmanis D, Hurt AC. Influenza antivirals currently in late-phase clinical trials. Influenza Other Respir Viruses 2017; 11:240-6. doi: 10.1111/irv.12446. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Heo YA. Baloxavir: first global approval. Drugs 2018. doi: 10.1007/s40265-018.0899-1. [DOI] [PubMed] [Google Scholar]
- 15.Noshi T, Kitano M, Taniguchi K, Yamamoto A, Omoto S, Baba K et al. In vitro characterization of baloxavir acid, a first-in-class cap-dependent endonuclease inhibitor of the influenza virus polymerase PA subunit. Antiviral Res 2018. doi: 10.1016/jantiviral.2018.10.008. [DOI] [PubMed] [Google Scholar]
- 16.Stevaert A, Dallocchio R, Dessi A, Pala N, Rogolino D, Sechi M et al. Mutational analysis of the binding pockets of the diketo acid inhibitor L-742.001 in the influenza virus PA endonuclease. J Virol 2013; 87:10524-38. doi: 10.1128/JVI.00832. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Omoto S, Speranzini V, Hashimoto T, Noshi T, Yamaguchi H, Kawai M et al. Characterization of influenza virus variants induced by treatment with the endonuclease inhibitor baloxavir marboxil. Sci Rep 2018; 8:9633. doi: 10.1038/s41598-018-27890-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Hayden FG, Sugaya N, Hirotsu N, Lee N, de Jong MD, Hurt AC et al. Baloxavir marboxil for uncomplicated influenza in adults and adolescents. N Engl J Med 2018; 379:913-23. doi: 10.1056/NEJMoa1716197. [DOI] [PubMed] [Google Scholar]
- 19.Uyeki TM. A step forward in the treatment of influenza. N Engl J Med 2018; 379:975-6. doi: 10.1056/NEJMe1810815. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Kikuchi T, Watanabe A. Baloxavir heralds a new era in influenza virus biology. Respir Invest doi: 10.106/j.resinv.2018.10002. [DOI] [PubMed] [Google Scholar]
- 21.Hawkes N. Sixty seconds on baloxavir. Br Med J 2018; 363:k4531, doi: 10.1136/bmj.k4531. [DOI] [PubMed] [Google Scholar]
- 22.Mushtaq A. Baloxavir: game-changer or mucha do about nothing?. Lancet Respir Med 2018. doi: 10.1016/S2213-2600(18)30469-7. [DOI] [PubMed] [Google Scholar]
- 23.Jones JC, Kumar G, Barman S, Najera I, White SW, Webby RJ, Govorkova EA. Identification of the I38T PA substitution as a resistance marker for next-generation influenza virus endonuclease inhibitors. MBio 2018; 9(2):e00430-e18. doi: 10.1128/mBio.00430-18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Kawaguchi N, Koshimichi H, Ishibashi T, Wajima T. Evaluation of drug-drug interaction potential between baloxavir marboxil and oseltamivir in healthy subjects. Clin Drug Invest 2018; 38:1053-60. doi: 10.1007/s40261-018-0697-2. [DOI] [PubMed] [Google Scholar]
- 25.Koshimichi H, Ishibashi T, Kawaguchi N, Sato C, Kawasaki A, Wajima T. Safety, tolerability and pharmacokinetics of the novel anti-influenza agent baloxavir marboxil in health adults: Phase I study findings. Clin Drug Invest doi: 10.1007/s40261-018-0710-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Ison MG, Yoshida Y, Shishido T, Hayden F, Uehara T. Phase 3 trial of baloxavirir marboxil in high risk influenza patients (CAPSTONE-2 study). IDSA, Infectious Disease Week. 2018 October 3-7, San Francisco CA, USA, Abstract LB16. https://idsa.confex.com/idsa/2018/webprogram/Paper74204.html. [Google Scholar]
- 27.Fukao K, Noshi T, Yamamoto A, Kitano M, Ando Y, Noda T et al. Combination treatment with cap-dependent endonuclease inhibitor baloxavir marboxil and a nuraminidase inhibitor in a mouse model of influenza A virus infection. J Antimicrob Chemother doi: 10.1093/jac/dky462. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Kitano M, Matsuzski T, Oka R, Baba K, Noda T, Yoshida Y et al. Therapeutic effects of baloxavir marboxil against influenza A virus infection in ferrets. IDSA, Infectious Disease Week. 2018 October 3-7, San Francisco CA, USA, Abstract 1350. https://idsa.confex.com/isda/2018/webprogram/ Paper74204.html. [Google Scholar]