Abstract
Objetivo
Evaluar la capacidad del lactato o el índice de Charlson para mejorar la capacidad del SIRS y el qSOFA para identificar el riesgo de muerte a corto plazo de los pacientes ancianos, sin deterioro funcional grave, atendidos por sospecha de infección en urgencias.
Metodología
Estudio de cohorte observacional prospectivo que incluyó a todos los pacientes de 75 años o más, sin deterioro funcional, atendidos por una infección aguda en 69 servicios de urgencias españoles durante 2 días en cada periodo estacional. Se recogieron datos demográficos, clínicos y analíticos. La variable de resultado principal fue la mortalidad por cualquier causa a los 30 días de la visita índice.
Resultados
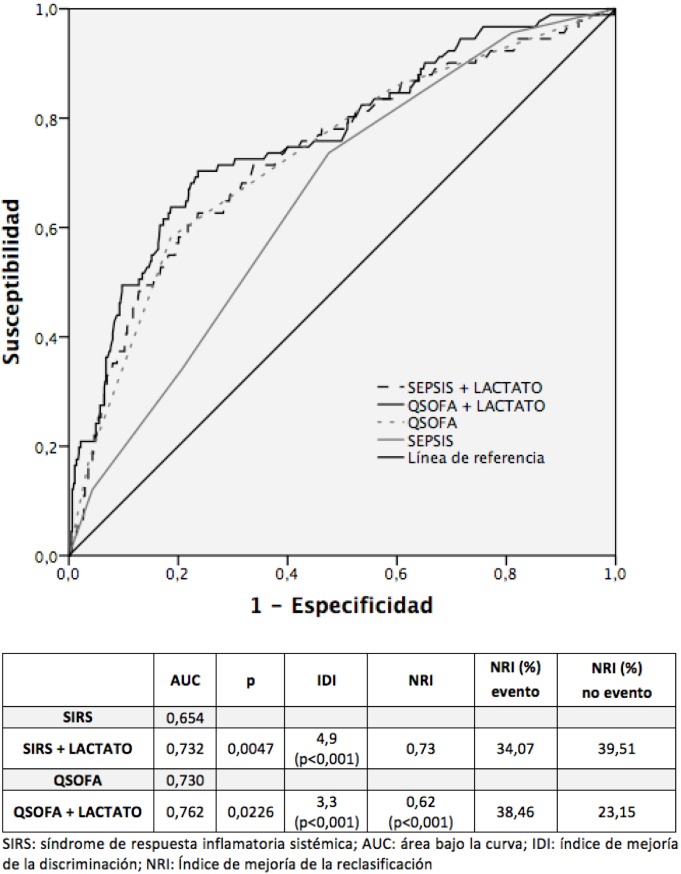
Se incluyeron 739 pacientes con una edad media de 84,9 (DE 6,0) años y 375 (50,7%) fueron mujeres. Noventa y un (12,3%) pacientes fallecieron dentro de los 30 días posteriores a la visita a urgencias. El ABC para el SIRS ≥ 2 y el qSOFA ≥ 2 fue de 0,637 (IC 95% 0,587-0,688; p<0,001) y 0,698 (IC 95% 0,635-0,761; p<0,001), respectivamente. La comparación entre esta curvas muestra una mejor capacidad de clasificación por parte del qSOFA ≥ 2 (p=0,041). Ambas escalas incrementan su capacidad de clasificación al añadir el lactato, siendo el ABC para SIRS más lactato de 0,705 (IC95% 0,652-0,758; p<0,001) y para qSOFA más lactato de 0,755 (IC95% 0,696-0,814; p<0,001), existiendo una tendencia estadística a un mejor rendimiento pronóstico de la segunda estrategia (p=0,0727). No ocurre lo mismo con el índice de Charlson, que no tiene efectos de mejora en la clasificación realizada con el SIRS (p=0,2269) ni con qSOFA (p=0,2573).
Conclusiones
La inclusión de la valoración del lactato a las escalas SIRS y qSOFA mejoran su capacidad para identificar pacientes ancianos atendidos por infección en riesgo de muerte a corto plazo. La valoración del índice de Charlson no tiene efecto.
Palabras claves: sepsis, paciente anciano infectado, pronóstico, urgencias, mortalidad, SIRS, qSOFA
Abstract
Objective
The aim of this study was to determine the utility of a post hoc lactate added to SIRS and qSOFA score to predict 30-day mortality in older non-severely dependent patients attended for infection in the Emergency Department (ED).
Methods
We performed an analytical, observational, prospective cohort study including patients of 75 years of age or older, without severe functional dependence, attended for an infectious disease in 69 Spanish ED for 2-day three seasonal periods. Demographic, clinical and analytical data were collected. The primary outcome was 30-day mortality after the index event.
Results
We included 739 patients with a mean age of 84.9 (SD 6.0) years; 375 (50.7%) were women. Ninety-one (12.3%) died within 30 days. The AUC was 0.637 (IC 95% 0.587-0.688; p<0.001) for SIRS ≥ 2 and 0.698 (IC 95% 0.635-0.761; p<0,001) for qSOFA ≥ 2. Comparing receiver operating characteristic (ROC) there was a better accuracy of qSOFA vs SIRS (p=0.041). Both scales improve the prognosis accuracy with lactate inclusion. The AUC was 0.705 (IC95% 0.652-0.758; p<0.001) for SIRS plus lactate and 0.755 (IC95% 0.696-0.814; p<0.001) for qSOFA plus lactate, showing a trend to statistical significance for the second strategy (p=0.0727). Charlson index not added prognosis accuracy to SIRS (p=0.2269) or qSOFA (p=0.2573).
Conclusions
Lactate added to SIRS and qSOFA score improve the accuracy of SIRS and qSOFA to predict short-term mortality in older non-severely dependent patients attended for infection. There is not effect in adding Charlson index.
Keywords: sepsis, infected older patient, prognosis, emergency, mortality, SIRS, qSOFA
INTRODUCCIÓN
Las enfermedades infecciosas constituyen un grave problema de salud, asociándose con una elevada morbi-mortalidad [1]. Los pacientes diagnosticados de infección en los servicios de urgencias hospitalarios (SUH) en España han aumentado en la última década, constituyendo actualmente el 14,3% de las asistencias [2]. Además, 1 de cada 3 pacientes atendidos por infección en el SUH tiene 75 años ó más [3].
El SUH representa un eslabón clave en la atención del paciente infectado, ya que es donde se realiza la sospecha clínica y comienza el tratamiento específico. Una de las decisiones iniciales más trascedentes es la estratificación pronóstica de los pacientes, que puede determinar las medidas terapéuticas y diagnósticas a poner en marcha y, sobre todo, la rapidez con la que se hacen, así como indicar la necesidad de ingreso o no de los pacientes [4]. Estas decisiones iniciales pueden condicionar la evolución clínica del paciente [5].
Los ancianos constituyen un segmento poblacional de enorme complejidad de cara al diagnóstico y a la estratificación pronóstica. La inmunosenescencia, los cambios fisiológicos propios de la edad, el deterioro funcional, el acúmulo de comorbilidad, la polifarmacia o la frecuente exposición al sistema sanitario hacen que con frecuencia presenten sintomatología atípica, escasa respuesta inflamatoria que limita los hallazgos analíticos e incluso una limitada alteración en sus constantes vitales [6,7]. Constituyen, por tanto, un grupo donde el riesgo de malos resultados puede infra-estimarse durante la evaluación inicial en urgencias, y en consecuencia el manejo inadecuado podría ser más habitual [8].
A raíz de la publicación de las definiciones de Sepsis-3 [9] se ha instaurado en la literatura científica una importante discusión acerca de la efectividad de la escala qSOFA (Quick Sequential Sepsis-related Organ Failure Assessment) para identificar pacientes con sepsis. En los últimos años, se han venido publicando múltiples estudios que evalúan la precisión del qSOFA o el síndrome de respuesta inflamatoria sistémica (SIRS) en la evaluación inicial del paciente con sospecha de infección [10,11], observándose resultados discrepantes que podrían estar relacionados con la heterogeneidad de las poblaciones estudiadas. En general, los resultados muestran una inferior sensibilidad del qSOFA respecto al SIRS, que podría condicionar una menor capacidad para la detección en los SUH de pacientes potencialmente graves.
El lactato es un biomarcador barato y de rápida y sencilla determinación a pie de cama del paciente, que se ha asociado en múltiples estudios a un mayor riesgo de resultados adversos para los pacientes [12,13]. Por este motivo, es el biomarcador más utilizado en los SUH de cara a la estratificación pronóstica de los pacientes a su llegada. Sin embargo, durante el desarrollo de los estudios de cara a establecer las definiciones de Sepsis-3, el lactato sérico no cumplió con los umbrales estadísticos para su inclusión en la construcción del modelo de qSOFA, hecho que podría justificarse por la gran cantidad de pacientes con valores ausentes de lactato [9].
Por último, mencionar que el índice Charlson, como medida cuantitativa de la comorbilidad acumulada por el paciente, ha mostrado ser una variable independiente que aumenta significativamente la mortalidad de los pacientes durante el ingreso hospitalario cuando éste es mayor de 2 [14].
En base a lo expuesto previamente, el objetivo de nuestro estudio fue evaluar, en población con sospecha de infección de 75 años o más y sin dependencia funcional grave, la capacidad del qSOFA y el SIRS para identificar pacientes con riesgo de muerte a corto plazo, así como determinar si la inclusión del valor inicial del lactato o del índice de Charslon a estas escalas pueden mejorar su capacidad para estratificar el riesgo de los pacientes.
METODOLOGÍA
Diseño. Se realizó un estudio de cohorte observacional prospectivo que incluyó a todos los pacientes de 75 años o más atendidos por una infección aguda en 69 SUH españoles durante 2 días en 3 períodos estacionales (1 y 22 de octubre de 2015, 12 y 19 de enero de 2016 y 13 y 27 Abril de 2016). El Comité de Ética del centro de referencia aprobó el estudio. Todos los pacientes o tutores legales dieron su consentimiento informado para participar en el estudio. Los SUH que participaron en el estudio están incluidos en la red de centros del Grupo de Enfermedades Infecciosas de la Sociedad Española de Medicina de Emergencia (INFURG-SEMES) (adendum).
Selección de pacientes. Se incluyeron pacientes mayores de 75 años que no tenían dependencia funcional grave (índice de Barthel > 40), se les diagnosticó clínicamente una infección aguda en los SUH participantes y aceptaron participar en el estudio.
Definición de las variables. Se recogieron datos demográficos (edad y sexo), comorbilidades (índice de Charlson), estado funcional basal (índice de Barthel), datos clínicos y analíticos a la llegada del paciente al SUH (estado del mental según la escala de coma de Glasgow, frecuencia cardíaca y respiratoria, temperatura, presión arterial, saturación de oxígeno, nivel de lactato y recuento de leucocitos) y el modelo de infección (urinaria, respiratoria, intraabdominal, de piel y tejidos blandos u otras infecciones).
Se consideró comorbilidad grave cuando el paciente presentaba un índice de Charlson de 3 o más. Se estableció como variable dependiente la mortalidad por cualquier causa durante los primeros 30 días tras la visita índice al SUH.
Se consideró SIRS si se presentaron dos o más de los siguientes parámetros: temperatura corporal >38ºC o <36ºC, frecuencia cardíaca >90 latidos por minuto, hiperventilación documentada por una frecuencia respiratoria >20 respiraciones por minuto o PaCO2 <32 mmHg y un recuento de leucocitos >12.000 células/μl o <4.000/μl. Para la consideración del qSOFA se tuvieron en cuenta la presencia de una presión arterial sistólica ≤100 mmHg, una frecuencia respiratoria ≥22 y una alteración de estado mental definido como una puntuación de <15 en la escala de coma de Glasgow.
Las variables se registraron en un formulario electrónico creado ad hoc para el presente estudio. Los diferentes criterios y parámetros fueron definidos previamente por el grupo en base a las pautas clínicas actuales y posteriormente todos los investigadores fueron informados por el investigador principal de cada centro. El seguimiento fue realizado por el investigador principal de cada centro consultando la historia clínica electrónica o por teléfono para determinar la muerte dentro de los primeros 30 días después de haber sido atendido en el SUH.
Análisis estadístico. Las variables cuantitativas se expresan como media y desviación estándar (DE) y las variables cualitativas se expresan como frecuencias absolutas y relativas. Las variables cualitativas se analizaron usando la prueba exacta de Chi-cuadrado o Fisher, si más del 25% de las frecuencias esperadas eran menores de 5, y la prueba de la t de Student se utilizó para las variables cuantitativas.
Se calculó el áreas bajo la curva (ABC) para las puntuaciones de sepsis y qSOFA, así como la asociación de éstas con el lactato y con el índice de Charlson. Se calcularon la sensibilidad, especificidad y la razón de verosimilitud positiva y negativa y los intervalos de confianza del 95% (IC 95%).
El ABC y el rendimiento de las diferentes escalas predictivas se compararon por una prueba no paramétrica. Consideramos un error α menor que 0,05. Los análisis estadísticos se realizaron utilizando el paquete estadístico SPSS 18.0® (SPSS Inc., Chicago, Illinois, EE. UU.) Y STATA 12.0 (StataCorp LP, CollegeStation, Texas, EE. UU.).
RESULTADOS
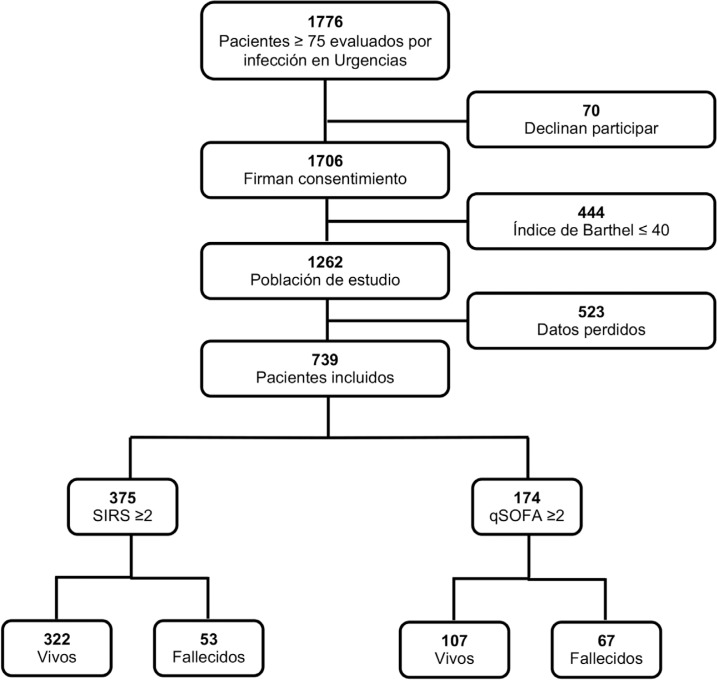
Se incluyeron 739 de los 1.776 pacientes infectados evaluados en el SU. Setenta pacientes no aceptaron participar en el estudio, 444 pacientes tenían dependencia funcional grave y 523 pacientes no se disponían de todos los datos necesarios para el cálculo del qSOFA y el SIRS, o no se había solicitado lactato durante la primera atención en el SUH (figura 1).
Figura 1.
Flujograma de los pacientes incluidos en el estudio
La edad media de los pacientes fue de 84,9 (DE 6,0) años y 375 (50,7%) fueron mujeres. La tabla 1 muestra las características de los pacientes incluidos en el estudio. En el momento de la primera evaluación en el SUH, 375 (50,7%) tenían ≥ 2 criterios SIRS y 174 (23,5%) una puntuación qSOFA ≥ 2. Noventa y un (12,3%) pacientes fallecieron dentro de los 30 días posteriores a la visita al SUH. La tabla 2 muestra el análisis univariante que relaciona mortalidad a 30 días con las escalas pronósticas utilizadas y el nivel de lactato.
Tabla 1.
Características de los pacientes incluidos en el estudio.
| Total (N=739) | |
|---|---|
| Datos demográficos | |
| Edad (años) [media (DE)] | 84,9 (6,0) |
| Sexo mujer [N(%)] | 375 (50,7) |
| Comorbilidad | |
| Hipertensión arterial [N(%)] | 542 (73,3) |
| Diabetes mellitus [N(%)] | 171 (23,1) |
| Cardiopatía isquémica [N(%)] | 135 (18,3) |
| Insuficiencia renal crónica [N(%)] | 126 (17,1) |
| Enfermedad cerebrovascular [N(%)] | 118 (16,0) |
| Enfermedad vascular periférica [N(%)] | 68 (9,2) |
| Enfermedad pulmonar obstructiva crónica [N(%)] | 197 (26,7) |
| Insuficiencia cardiaca crónica [N(%)] | 123 (16,6) |
| Demencia [N(%)] | 201 (27,2) |
| Hepatopatía [N(%)] | 25 (3,4) |
| Ulcera gastrointestinal [N(%)] | 31 (4,2) |
| Cáncer [N(%)] | 73 (9,9) |
| Tumor metastásico [N(%)] | 22 (3,0) |
| Enfermedad del tejido conectivo [N(%)] | 18 (2,4) |
| Leucemia [N(%)] | 10 (1,4) |
| Linfoma [N(%)] | 11 (1,5) |
| Comorbilidad grave (Índice de Charlson ≥ 3) [N(%)] | 319 (43,2) |
| Factores de riesgo para infección por microorganismos resistentes | |
| Catéter urinario [N(%)] | 46 (6,2) |
| Vía central [N(%)] | 5 (0,7) |
| Instrumentalización [N(%)] | 50 (6,8) |
| Procedente de residencia [N(%)] | 147 (19,9) |
| Tratamiento corticoideo crónico [N(%)] | 50 (6,8) |
| Tratamiento inmunosupresor [N(%)] | 26 (3,5) |
| Hospitalización en el mes previo [N(%)] | 169 (22,9) |
| Antibioterapia en el mes previo [N(%)] | 204 (27,6) |
| Variables hemodinámicas | |
| Nivel de consciencia (escala de Glasgow) [media (DE)] | 14.1 (1,7) |
| Presión sistólica (mmHg) [media (DE)] | 131,3 (28,9) |
| Frecuencia respiratoria (rpm) [media (DE)] | 21,5 (8,0) |
| Frecuencia cardiaca (lpm) [media (DE)] | 90,1 (21,2) |
| Temperatura (ºC) [media (DE)] | 36.9 (1,0) |
| Tipo de infección | |
| Infección del tracto urinario | 156 (21,1) |
| Infección del tracto respiratorio | 445 (60,2) |
| Infección intraabdominal | 85 (11,5) |
| Infección de piel y partes blandas | 49 (6,6) |
| Otros | 4 (0,6) |
*DE: desviación estándar; lpm: latidos por minuto; rpm: respiraciones por minuto.
Tabla 2.
Análisis univariante. Mortalidad a 30 días en función de las escalas pronósticas y valor de lactato.
| Total [n (%)] | Mortalidad [n (%)] | Valor de la p | |
|---|---|---|---|
| SIRS ≥ 2 | 375 (50,7) | 67 (17,9) | <0,001 |
| qSOFA ≥ 2 | 174 (23,5) | 53 (30,5) | <0,001 |
| Índice Charlson ≥ 3 | 319 (43,2) | 46 (14,4) | 0,129 |
| Lactato ≥ 2 mmol/L | 283 (38,3) | 63 (22,3) | <0,001 |
| Lactato ≥ 3 mmol/L | 139 (18,8) | 51 (36,7) | <0,001 |
| Lactato ≥ 4 mmol/L | 81 (11) | 32 (39,5) | <0,001 |
SIRS: síndrome de respuesta inflamatoria sistémica; qSOFA: quick Sequential Sepsis-related Organ Failure Assessment
La tabla 3 muestra el rendimiento pronóstico para predecir la mortalidad a 30 días de los criterios de SIRS, qSOFA y las distintas estrategias establecidas combinando estas escalas con el nivel de lactato y la comorbilidad, evaluada mediante el índice de Charlson. La sensibilidad para el SIRS ≥ 2 fue de 73,63 (IC 95% 64,02-83,23) y su especificidad 52,47 (IC 95% 48,55-56,39), mientras que para el qSOFA ≥ 2 la sensibilidad resultó de 58,24 (IC 95% 47,56-68,92) y su especificidad 81,33 (IC 95% 78,25-84,40). El ABC para el SIRS ≥ 2 y el qSOFA ≥ 2 fue de 0,637 (IC 95% 0,587-0,688; p<0,001) y 0,698 (IC 95% 0,635-0,761; p<0,001), respectivamente. La comparación entre esta curvas muestra una mejor capacidad de clasificación por parte del qSOFA ≥ 2 (p=0,041).
Tabla 3.
Rendimiento para la predicción de mortalidad a 30 días de las distintas estrategias establecidas.
| Se | Esp | VPP | VPN | CPP | CPN | ABC | IDI (%) | |
|---|---|---|---|---|---|---|---|---|
| SIRS ≥ 2 | 73,63 (64,02-83,23) |
52,47 (48,55-56,39) |
17,87 (13,86-21,88) |
93,41 (90,72-96,09) |
1,55 (1,34-1,79) |
0,55 (0,35-0,71) |
0,637 (0,587-0,688) |
- |
| SIRS ≥ 2 + LACTATO > 2 |
89,01 (82,04-95,99) |
39,04 (35,21-42,88) |
17,02 (13,54-20,50) |
96,20 (93,70-98,70) |
1,46 (1,33-1,61) |
0,28 (0,16-0,51) |
0,721 (0,666-0,775) |
4,8 (<0,001) |
| SIRS ≥ 2 + LACTATO > 3 |
85,71 (77,98-93,45) |
48,61 (44,69-52,54) |
18,98 (15,07-22,89) |
96,04 (93,77-98,30) |
1,67 (1,49-1,87) |
0,29 (0,18-0,49) |
0,760 (0,705-0,815) |
10,9 (<0,001) |
| SIRS ≥ 2 + LACTATO > 4 |
82,42 (74,05-90,79) |
50,31 (46,38-54,24) |
18,89 (14,92-22,87) |
95,32 (92,94-97,71) |
1,66 (1,47-1,87) |
0,35 (0,22-0,55) |
0,720 (0,663-0,778) |
7,2 (<0,001) |
| SIRS ≥ 2 + CHARLSON ≥ 3 |
89,01 (82,04-95,99) |
32,10 (28,43-35,77) |
15,55 (12,34-18,75) |
95,41 (92,41-98,42) |
1,31 (1,20-1,43) |
0,34 (0,19-0,62) |
0,647 (0,592-0,703) |
0,32 (0,124) |
| QSOFA ≥ 2 | 58,24 (47,56-68,92) |
81,33 (78,25-84,40) |
30,46 (23,33-37,59) |
93,27 (91,12-95,43) |
3,12 (2,46-3,95) |
0,51 (0,40-0,66) |
0,698 (0,635-0,761) |
- |
| QSOFA ≥ 2 + LACTATO > 2 |
79,12 (70,22-88,02) |
57,25 (53,3761,14) |
20,63 (16,24-25,02) |
95,13 (92,86-97,39) |
1,85 (1,61-2,13) |
0,36 (0,24-0,55) |
0,749 (0,691-0,807) |
3,7 (<0,001) |
| QSOFA ≥ 2 + LACTATO > 3 |
72,53 (62,81-82,25) |
73,30 (69,82-76,79) |
27,62 (21,74-33,49) |
95,00 (92,99-97,01) |
2,72 (2,27-3,25) |
0,37 (0,27-0,53) |
0,768 (0,708-0,827) |
8,4 (<0,001) |
| QSOFA ≥ 2 + LACTATO > 4 |
68,13 (58,01-78-26) |
77,16 (73,85-80,47) |
29,52 (23,12-35,93) |
94,52 (92,48-96,55) |
2,98 (2,44-3,64) |
0,41 (0,30-0,56) |
0,743 (0,683-0,803) |
5,0 (0,001) |
| QSOFA ≥ 2 + CHARLSON ≥ 3 |
79,12 (70,22-88,02) |
48,30 (44,38-52,23) |
17,69 (13,86-21,52) |
94,28 (91,63-96,93) |
1,53 (1,35-1,74) |
0,43 (0,29-0,65) |
0,715 (0,655-0,775) |
0,1 (0,597) |
SIRS: síndrome de respuesta inflamatoria sistémica; qSOFA: quick Sequential Sepsis-related Organ Failure Assessment; Se: sensibilidad; Esp: especificidad; VPP: valor predictivo positivo; VPN: valor predictivo negativo; CPP: coeficiente de probabilidad positiva; CPN: coeficiente de probabilidad negativa; ABC: área bajo la curva; IDI: índice de mejoría de la discriminación.
Ambas escalas incrementan su rendimiento pronóstico al añadir el lactato, indistintamente del punto de corte de éste, al producirse un aumento significativo del ABC y del índice de discriminación (tabla 3). No ocurre lo mismo con el índice de Charlson, que no tiene efectos de mejora en la clasificación realizada con el SIRS (p=0,2269) ni con qSOFA (p=0,2573).
El ABC para el para el SIRS ≥ 2 + lactato ≥ 2 mmol/L fue de 0,721 (IC 95% 0,666-0,775; p<0,001); para el SIRS ≥ 2 + lactato ≥ 3 mmol/L de 0,760 (IC 95% 0,705-0,815; p<0,001); y para el SIRS ≥ 2 + lactato ≥ 4 mmol/L de 0,720 (IC 95% 0,663-0,778; p<0,001). Las diferencias estadísticas al comparar las ABC fueron: SIRS ≥ 2 vs SIRS ≥ 2 + lactato ≥ 2 mmol/L, p=0,0002; SIRS ≥ 2 vs SIRS ≥ 2 + lactato ≥ 3 mmol/L, p<0,001; y SIRS ≥ 2 vs SIRS ≥ 2 + lactato ≥ 4 mmol/L, p<0,001.
El punto de corte ≥ 3 para el lactato es, en el caso del SIRS, el que mayor ABC y mayor índice de discriminación presenta. Las diferencias estadísticas al comparar las ABC obtenidas para el SIRS con los diferentes puntos de corte de lactato fueron: SIRS ≥ 2 + lactato ≥ 3 mmol/L vs SIRS ≥ 2 + lactato ≥ 2 mmol/L, p=0,0163; SIRS ≥ 2 + lactato ≥ 3 mmol/L vs SIRS ≥ 2 + lactato ≥ 4 mmol/L, p=0,0156.
El ABC para el qSOFA ≥ 2 + lactato ≥ 2 mmol/L fue de 0,749 (IC 95% 0,691-0,807; p<0,001); para el qSOFA ≥ 2 + lactato ≥ 3 mmol/L de 0,768 (IC 95% 0,708-0,827; p<0,001); y para el qSOFA ≥ 2 + lactato ≥ 4 mmol/L de 0,743 (IC 95% 0,683-0,803; p<0,001). Las diferencias estadísticas al comparar las ABC fueron: qSOFA ≥ 2 vs qSOFA ≥ 2 + lactato ≥ 2 mmol/L, p=0,0007; qSOFA ≥ 2 vs qSOFA ≥ 2 + lactato ≥ 3 mmol/L, p=0,0007; y qSOFA ≥ 2 vs qSOFA ≥ 2 + lactato ≥ 4 mmol/L, p=0,0005.
El punto de corte ≥ 3 para el lactato es, en el caso del qSOFA, el que presenta un mayor índice de discriminación y una mayor ABC, pero sin diferencias estadísticamente significativas frente a otros puntos de corte. Las diferencias estadísticas al comparar las ABC obtenidas para el qSOFA con los diferentes puntos de corte de lactato fueron: qSOFA ≥ 2 + lactato ≥ 3 mmol/L vs qSOFA ≥ 2 + lactato ≥ 2 mmol/L, p=0,1967; qSOFA ≥ 2 + lactato ≥ 3 mmol/L vs frente a qSOFA ≥ 2 y lactato ≥ 4 mmol/L, p=0,0748.
En la figura 2 se observa el rendimiento pronóstico observado al combinar el valor del lactato con el SIRS o el qSOFA. Existe una tendencia estadística a un mejor rendimiento pronóstico de la estrategia qSOFA más lactato (p=0,0727).
Figura 2.
Rendimiento para la predicción de mortalidad a 30 días de las distintas estrategias establecidas considerando las variables como continuas (curvas ROC).
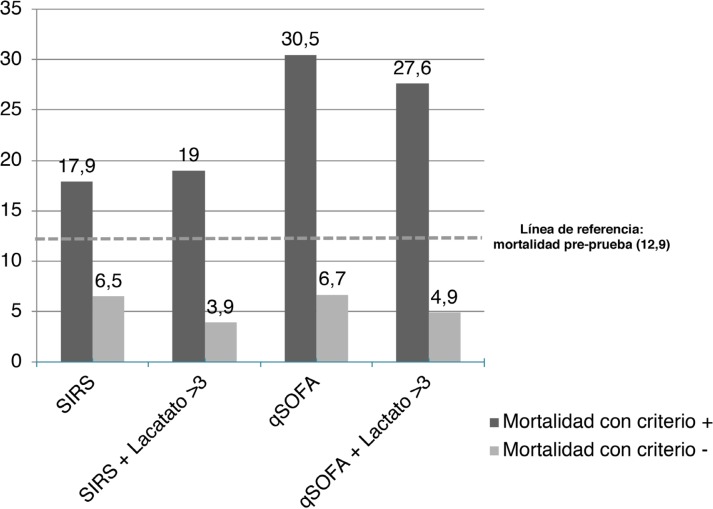
En la figura 3 se muestra la probabilidad post-prueba de mortalidad a 30 días para un resultado positivo y negativo del SIRS ≥ 2 y del QSOFA ≥ 2 de manera aislada y en combinación con el lactato ≥ 3. La probabilidad post-prueba de mortalidad cuando el criterio es positivo para la combinación del lactato ≥ 3 con el qSOFA y SIRS fue de 27,6% y 19,0%, respectivamente, mientras que la probabilidad cuando el criterio fue negativo fue del 3,9% y 4,9%, respectivamente.
Figura 3.
Probabilidad de muerte a 30 días basado en la escala de riesgo y el nivel de lactato.
DISCUSIÓN
Nuestros resultados muestran una limitada capacidad, tanto del SIRS como del qSOFA, para identificar pacientes infectados mayores de 75 años en riesgo de muerte a corto plazo, con un ABC < 0,70 en ambos casos. La capacidad del qSOFA es, no obstante, superior a la del SIRS. En cualquier caso, ambas muestran un bajo poder predictivo pronóstico para la población estudiada. qSOFA, por otra parte, muestra una menor sensibilidad en comparación con el SIRS, algo ya descrito en otros estudios [15,16].
Añadir en la evaluación del riesgo la cifra de lactato mejora la capacidad de ambas escalas, obteniéndose en ambos casos un ABC por encima de 0,70, siendo el punto de corte óptimo del lactato, aquel que ofrece una mayor ABC e índice de discriminación, de 3 mmol/L en ambas escalas. En este sentido, existe una tendencia estadística a un mejor rendimiento pronóstico para identificar pacientes de alto riesgo con la combinación de la escala qSOFA y la determinación de lactato que con SIRS más lactato (p=0,0727). Además, la estrategia que utiliza el qSOFA en lugar del SIRS resultaría más parsimoniosa, al no requerir esperar a la determinación analítica de los leucocitos, que puede retrasar el cálculo de la escala SIRS.
Una de las críticas más importantes realizadas a la utilización del qSOFA es su limitada sensibilidad. La inclusión de la valoración del lactato mejora sustancialmente la sensibilidad manteniendo una adecuada especificidad. Resaltar que para el punto de corte del lactato de 3 mmol/L, la sensibilidad de la combinación es del 72,52%, manteniendo una especificidad del 73,3%. Las herramientas de estratificación de riesgo con alta sensibilidad y baja especificidad pueden conducir a una asignación inapropiada de recursos, mientras que las herramientas con baja sensibilidad pueden llevar a los médicos a desconfiar de ellas [17], por lo que es necesario guardar un adecuado equilibrio entre ambos parámetros.
En la línea de nuestro resultados, otros estudios ya han demostrado que el añadir o combinar distintos biomarcadores a las escalas pronosticas condiciona un aumento del poder predictivo de ambos, consiguiendo un mayor rendimiento [18-20]. Otro estudio reciente [17] muestra que con la adición de lactato ≥2 mmol/L como un punto adicional a la escala qSOFA se logra una mayor capacidad predictiva, mejorando la sensibilidad del qSOFA y obteniendo una mejora en la identificación del riesgo de resultados adversos en pacientes con sospecha de sepsis, datos que se asemejan a los nuestros.
El lactato es uno de los biomarcadores que presentan un mejor poder predictivo de mala evolución clínica y de mortalidad, incluso en ausencia de hipotensión [12,13]. Por otra parte, tiene una amplia implantación en los hospitales, es de fácil y rápida obtención, barato y accesible a pie de cama del paciente, por lo que su inclusión en el árbol de decisión no tiene porque retrasar la adopción de las medidas terapéuticas oportunas. Además, ha estado incluido clásicamente dentro de las variables recomendadas para la valoración de los pacientes con sepsis y actualmente esta incluido en la definición de shock séptico.
El disponer de una estrategia de identificación del riesgo de manera rápida y eficaz nos ayuda a la toma inicial de decisiones, como son la extracción de muestras bilógicas para cultivos, la realización de procedimientos invasivos, la administración inmediata del antimicrobiano, así como determinar la necesidad de ingreso o alta hospitalaria.
Un reciente metanálisis [11] muestra una variación muy importante en los resultados de sensibilidad y especificidad entre los 38 estudios evaluados, tanto para el SIRS como para el qSOFA. Esto muestra que probablemente las poblaciones estudiadas sean muy heterogéneas o que el estadio clínico de la infección sea diferente, porque de lo contrario no se puede explicar la dispersión de los resultados informados. La sepsis es un síndrome heterogéneo secundario a diferentes etiologías y con un rango de gravedad y de intervención variables [21-24]. La presentación clínica y el pronóstico depende del modelo de infección, la situación inmunológica del huésped, la edad, la comorbilidad o el tiempo de evolución. El estudio de las poblaciones más homogéneas, como ocurre en nuestro estudio, podría ofrecer resultados más fiables para la población estudiada.
Es importante reseñar que el presente estudio no evalúa la capacidad diagnóstica de infección de las escalas estudiadas, sino tan solo su capacidad pronóstica. Varias revisiones sistemáticas y metanálisis [17,25] han sido publicados recientemente mostrando que la predicción de mortalidad hospitalaria es mayor con el qSOFA, mientras que el SIRS muestra una mejor sensibilidad para el diagnóstico de infección. A raíz de estos datos, existe una propuesta que consiste en combinar el SIRS y el qSOFA, el primero para la identificación del paciente infectado y el segundo de cara a estratificar el pronóstico [25].
No obstante, el SIRS se ha utilizado clásicamente para identificar pacientes infectados susceptibles de peores resultados clínicos, sobre los que actuar desde el punto de vista diagnóstico y terapéutico de una manera más enérgica [26]. El diagnóstico de infección es mucho más complejo y no se puede establecer con una escala [27]. Es evidente que SIRS puede ayudar a identificar mejor al paciente infectado, al incluir una variable tan específica como la fiebre, pero no debemos olvidar que la fiebre esta ausente en múltiples ocasiones, sobre todo en poblaciones especiales como son los ancianos y los inmunodeprimidos [28]. Las variables incluidas en el SIRS (temperatura, frecuencia respiratoria o PaCO2, recuento de leucocitos y frecuencia cardíaca) podrían ser útiles para aumentar la conciencia de la infección, pero debe tenerse en cuenta su escasa especificidad y su alta prevalencia entre los pacientes hospitalizados [21,28]. Ni los criterios SIRS ni los qSOFA son diagnósticos de infección, pero ofrecen información sobre la reacción inflamatoria del huésped ante un insulto y el grado de perturbación fisiológica, y ambos proporcionan información sobre el pronóstico a corto plazo del paciente [22,25,29].
Nuestros datos muestran también que añadir el índice de Charlson no mejora, en nuestra experiencia, la capacidad pronóstica de las escalas. Esto podría explicarse por la elevada comorbilidad que presenta nuestra población de estudio debido a su avanzada edad. Más de un 40% presentaba un índice de Charlson ≥ 3 lo que puede provocar que el estudio no tenga la suficiente potencia para encontrar estas diferencias.
Nuestro estudio presenta una serie de limitaciones. En primer lugar, existe una gran cantidad de pacientes que han debido ser excluidos por no disponer de todos los datos precisos para el cálculo de las escalas, el índice de Charlson o del lactato. En segundo lugar, excluimos a los pacientes con dependencia funcional grave, ya que la limitación terapéutica puede jugar un papel muy importante en la evolución del paciente lo que puede actuar como un factor de confusión en la estratificación del riesgo. Además, estos pacientes probablemente no sean susceptibles a las terapias intensivas. Por lo tanto, nuestros resultados no deberían aplicarse a esta población específica. En tercer lugar, el momento y el tipo de tratamiento no se evaluaron, y ambos aspectos pueden condicionar el desenlace de la enfermedad. Sin embargo, las pautas de tratamiento locales para los pacientes con este perfil se aplicaron durante el estudio. Finalmente, el criterio de inclusión en el estudio es que existiera un diagnóstico clínico de infección en el SUH, algo que puede o no confirmarse posteriormente durante el ingreso hospitalario. Aunque esto puede representar un sesgo del estudio, pensamos que este enfoque es más similar a la vida real y las decisiones tomadas durante la evaluación inicial de los pacientes durante la atención urgente.
En conclusión, nuestro estudio muestra que en población anciana, sin dependencia grave, atendida por sospecha de infección en urgencias, la adición del lactato a las escalas SIRS y qSOFA mejora su capacidad para identificar pacientes en riesgo de muerte a corto plazo. La estrategia basada en qSOFA más lactato presenta una tendencia estadística a la superioridad y es más sencilla y rápida de calcular al no precisar la determinación de la cifra de leucocitos. Esta estratificación puede ayudar al médico que realiza la atención urgente a seleccionar pacientes que requieren estudios y un manejo más complejos o una terapia más agresiva.
ADENDUM
Colaboradores. Miembros del Grupo de Infecciones de la Sociedad Española de Medicina de Urgencias y Emergencias (INFURG-SEMES) que han participado en este estudio: Pablo Herrero Puente (Hospital Universitario Central de Asturias), Rafael Rubio Díaz (Complejo Hospitalario de Toledo), Diana Moya Olmeda (Hospital Virgen de la Luz, Cuenca), Raúl López Izquierdo (Hospital Rio Hortega, Valladolid), José Andrés Sánchez Nicolás (Hospital Universitario Reina Sofía, Murcia), Ángel Aurelio Álvarez Hurtado y Carlos del Pozo Vegas (Hospital Clínico de Valladolid), José Gallardo Bautista (Hospital Universitario Virgen de la Macarena, Sevilla), Francisco Javier Candel (Hospital Universitario Clínico San Carlos, Madrid), Borja Cobanera Echebarria (Hospital Universitario de Basurto, Bilbao), Francisco Román y Pere Llorens (Hospital Universitario General de Alicante), Ramón Perales (Hospital General de Albacete), Javier Oñate (Hospital de Cruces, Baracaldo), Begoña Mora Ordoñez y Eva Fragero (Hospital Virgen de la Victoria, Málaga), Mar Ortega (Hospital Clinic, Barcelona), Guillermo Burillo y Carolina Gómez Hernández (Hospital Universitario de Canarias, Tenerife), María Jesús Arranz y Ricardo Juárez (Hospital Nuestra Señora del Prado, Talavera), José María Ferreras Amez (Hospital Royo Villanova, Zaragoza), Eva Muro y Luis Pérez Ordoño (Hospital Universitario 12 de Octubre, Madrid), Jorge García Criado (Hospital Universitario, Salamanca), Andrés von Wernitz y Carmen del Arco (Hospital de Universitario La Princesa, Madrid), Pablo Javier Marchena Yglesias (Parc Sanitari Sant Joan de Déu Hospital General. Sant Boi de Llobregat, Barcelona. Hospital Moises Broggi Sant Joan Despí, Barcelona), Francisco Ruiz (Hospital Clínico Universitario, Zaragoza), Luis García Castrillo y Héctor Alonso (Hospital de Valdecilla, Santander), Manuel Salido (Hospital Carlos Haya, Málaga), Belén Rodríguez Miranda (Hospital Rey Juan Carlos, Madrid), Martín Ruiz Grinspan (Hospital del Henares, Madrid), Josep María Guardiola Tey, Sergio Herrera Mateo y Miriam Mateo Roca (Hospital de Sant Pau, Barcelona), Francisco José Ezponda (Hospital de Zumárraga, Zumárraga), Elena Diez (Hospital de San Juan, Alicante), Francisco Gracia García (Hospital Reina Sofía, Córdoba), Itziar Huarte (Hospital de Donosti, San Sebastián), Sara Gayoso Martín (Hospital del Escorial, San Lorenzo del Escorial), María Cubillo Moreno y Silvia Juárez de Sosa (Hospital Universitario de Burgos, Burgos), Ana de la Chica (Hospital del Sol, Marbella), Carles Ferré Losa (Hospital Universitario de Bellvitge, L’Hospitalet de Llobregat), Rigoberto Del Rio Navarro (Hospital Universitario de Torrevieja, Torrevieja), Ángel Estella (Hospital de Jerez, Jerez), Marta Iglesias Vela y Luis Miguel Maestro Gilmartin (Hospital de León, León), Carlos Avellaneda Martínez (Hospital de Segovia, Segovia), Virginia Álvarez Rodríguez (Hospital Universitario de Getafe, Getafe), Manuel Fernández Rodríguez (Hospital San Eloy, Barakaldo), Alexandra María Guiu Marti (Hospital Son Espases, Palma), Octavio J. Salmerón Béliz (Hospital Universitario Fundación Alcorcón, Alcorcón), Silvia Flores Quesada y Osvaldo Troiano Ungerer (Hospital de Sant Pau i Santa Tecla, Tarragona), Tania Cano Rodríguez (Hospital Santiago Apóstol, Miranda de Ebro, Burgos), Luis Lapuerta Irigoyen (Hospital de Soria, Soria), Carmen Andonegui (Hospital de Mendaro, Mendaro), Nieves Cortes (Hospital Alto Deba, Mondragón), Gema Muñoz Gamito (Hospital Universitario Mútua Terrassa, Terrassa), Beatriz Valle Borrego (Hospital Severo Ochoa, Leganés), María Arranz Betegon y Ángel Sierra Moreno (Hospital de Viladecans, Viladecans), Manel R. Chanovas Borràs (Hospital Verge de la Cinta de Tortosa, Tortosa), Ainhoa Urraca Gamaury (Hospital de Zamora, Zamora), Jesús Cruzado Quevedo (Hospital General Universitario Santa Lucia, Cartagena), Verónica Carpio Muñoz (Hospital Juan Ramón Jiménez, Huelva), Cristóbal Marchante Tejada (Hospital Nuestra Señora de Valme, Sevilla), Bakarne Menchaca (Hospital de Bidasoa, Hondarribia), Josep María Mòdol Deltell (Hospital Universitario Germans Trias i Pujol, Badalona), Ángel Macías López (Hospital de Ávila, Ávila), María Ángeles Leciñera (Hospital Can Misess, Ibiza), Salvador Sarrà Moretó (Hospital del Vendrell, El Vendrell), Coral Suero Méndez y Salvador Pendón Fernández (Hospital de la Axarquía, Málaga), Raimundo Rodríguez y Miguel Ángel Cardenete Aljama (Hospital Universitario de Ciudad Real, Ciudad Real), Maite Fernández Rivas (Hospital del Bierzo, Ponferrada), Luis Amador (Hospital de Vigo, Vigo), José Eduardo Cobo Muñoz (Complejo Hospitalario de Jaén, Jaén), Elena Carrasco (Virgen de Alta Gracia, Manzanares), David Rodríguez Salazar (Hospital Comarcal d’Amposta, Amposta), María José Núñez Orantos (Hospital Clínico San Carlos, Madrid) y Esther Rodríguez Adrada (Instituto de Investigación Sanitaria, Hospital Universitario Rey Juan Carlos, Madrid).
CONFLICTOS DE INTERÉS
Los autores declaran que no existen conflictos de interés.
FINANCIACIÓN
Los autores declaran que no han recibido fondos para la realización de este estudio.
BIBLIOGRAFÍA
- 1.Freund Y, Ortega M. Sepsis and prediction of in-hospital mortality. Emergencias. 2017;29:79-80. PMID: [PubMed] [Google Scholar]
- 2.Martínez Ortiz de Zárate M, González Del Castillo J, Julián Jiménez A, Piñera Salmerón P, Llopis Roca F, Guardiola Tey JM, et al. . Estudio INFURG-SEMES: epidemiología de las infecciones atendidas en los servicios de urgencias hospitalarios y evolución durante la última década. Emergencias. 2013;25:368-78. [Google Scholar]
- 3.Martín-Sánchez FJ, Julián-Jiménez A, Candel González FJ, Llopis Roca F, Martínez Ortiz de Zárate M, González del Castillo J. Perfil y manejo inicial de los ancianos atendidos por infección en los servicios de Urgencias hospitalarios. Rev Esp Geriatr Gerontol. 2017;52:9–14. doi: 10.1016/j.regg.2016.02.006. [DOI] [PubMed] [Google Scholar]
- 4.Martínez-Segura E, Lleixà-Fortuño M, Salvadó-Usach T, Solà-Miravete E, Adell-Lleixà M, Chanovas-Borrás MR, et al. . Perfil competencial en los profesionales de triaje de los servicios de urgencias hospitalarios. Emergencias. 2017;29:173-7. PMID: [PubMed] [Google Scholar]
- 5.González J, Clemente C, Candel FJ, Martín-Sánchez FJ. New sepsis criteria: Do they replace or complement what is known in the approach to the infectious patient? Rev Esp Quimioter. 2017;30 (Suppl. 1):48–51. PMID: [PubMed] [Google Scholar]
- 6.González Del Castillo J, Martín-Sánchez FJ. Resistant microorganisms in the emergency department: what should we do to meet the challenge?. Emergencias. 2017;29:303-5. PMID: [PubMed] [Google Scholar]
- 7.Rivero-Santana A, Del Pino-Sedeño T, Ramallo-Fariña Y, Vergara I, Serrano-Aguilar P. Valor de los instrumentos ISAR y TRST para predecir resultados adversos en población general geriátrica asistida en los servicios de urgencias: metanálisis. Emergencias. 2017;29:49-60. PMID: [PubMed] [Google Scholar]
- 8.Lobón LF, Anderson P. Innovación en Medicina de Urgencias y Emergencias: cinco aspectos organizativos que podrían cambiar nuestra práctica. Emergencias. 2017;29:61-4. PMID: [PubMed] [Google Scholar]
- 9.Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. . The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315:801-10. DOI: 10.1001/jama.2016.0287 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Hamilton F, Arnold D, Baird A, Albur M, Whiting P. Early Warning Scores do not accurately predict mortality in sepsis: A meta-analysis and systematic review of the literature. J Infect. 2018;76:241-248. DOI: 10.1016/j.jinf.2018.01.002 [DOI] [PubMed] [Google Scholar]
- 11.Fernando SM, Tran A, Taljaard M, Cheng W, Rochwerg B, Seely AJE, et al. . Prognostic Accuracy of the Quick Sequential Organ Failure Assessment for Mortality in Patients With Suspected Infection: A Systematic Review and Meta-analysis. Ann Intern Med. 2018;168:266-275. DOI: 10.7326/M17-2820 [DOI] [PubMed] [Google Scholar]
- 12.Del Portal DA, Shofer F, Mikkelsen ME, Dorsey PJ, Gaieski DF, Goya lM, et al. . Emergency department lactate is associated with mortality in older adults admitted with and without infections. Acad Emerg Med. 2010;17:260–8. DOI: 10.1111/j.1553-2712.2010.00681.x [DOI] [PubMed] [Google Scholar]
- 13.Londoño J, León AL, Rodríguez F, Barrera L, de la Roca G, Dennis R, al et.. Láctico sérico en urgencias como factor pronóstico en pacientes con sepsis sin hipotensión. Med Clin (Barc). 2013;141:246-51. DOI: 10.1016/j.medcli.2012.05.033 [DOI] [PubMed] [Google Scholar]
- 14.Quan H, Li B, Couris CM, Fushimi K, Graham P, Hider P, et al. . Updating and validating the Charlson comorbidity index and score for risk adjustment in hospitaldischarge abstracts using data from 6 countries. Am J Epidemiol. 2011;173:676-82. DOI: 10.1093/aje/kwq433 [DOI] [PubMed] [Google Scholar]
- 15.García-Villalba E, Cano-Sánchez A, Alcaraz-García A, Cinesi-Gómez C, Piñera-Salmerón P, Marín I, et al. . Nomograma para predecir mal pronóstico en pacientes procedentes de urgencias con sepsis y bajo riesgo de daño orgánico evaluado mediante SOFA. Emergencias. 2017;29:81-6. PMID: [PubMed] [Google Scholar]
- 16.Raith EP, Udy AA, Bailey M, McGloughlin S, MacIsaac C, Bellomo R, et al. . Australian and New Zealand Intensive Care Society (ANZICS) Centre for Out-comes and Resource Evaluation (CORE) Prognostic accuracy of the SOFAScore, SIRS Criteria, and qSOFA Score for in-hospital mortality among adultswith suspected infection admitted to the Intensive Care Unit. JAMA. 2017;317:290–300. DOI: 10.1001/jama.2016.20328 [DOI] [PubMed] [Google Scholar]
- 17.Shetty A, MacDonald SP, Williams JM, van Bockxmeer J, de Groot B, Esteve Cuevas LM, Ansems A, Green M, et al. . Lactate ≥2 mmol/L plus qSOFA improves utility over qSOFA alone in emergency department patients presenting with suspected sepsis. Emerg Med Australas. 2017;29:626-634. DOI: 10.1111/1742-6723.12894 [DOI] [PubMed] [Google Scholar]
- 18.Julián-Jiménez A, González del Castillo J, Martínez Ortiz M, Arranz-Nieto MJ, González Martínez F, Piñera-Salmerón P, et al. . Factores pronósticos a corto plazo en los ancianos atendidos en urgencias por infección. Enferm Infecc Microbiol Clin. 2017;35:214-219. DOI: 10.1016/j.eimc.2015.10.016 [DOI] [PubMed] [Google Scholar]
- 19.Julián-Jiménez A, Gutiérrez Martín P, Lizcano Lizcano A, López Gurrero MA, Barroso Manso A, Heredero Gálvez E. Utilidad de la procalcitonina y proteína C reactiva para predecir bacteriemia en las infecciones del tracto urinario en el servicio de urgencias. Actas Urol Esp. 2015; 39: 502-10. DOI: 10.1016/j.acuro.2015.03.003 [DOI] [PubMed] [Google Scholar]
- 20.Julián-Jiménez A, González-del Castillo J, Candel FJ. Utilidad y valor pronóstico de los biomarcadores en los pacientes con neumonía adquirida en la comunidad en los servicios de urgencias. Med Clin (Barc). 2017;148:501–10. PMID: [DOI] [PubMed] [Google Scholar]
- 21.Gilbert DN, Kalil AC, Klompas M, Masur H, Winslow DL. IDSA POSITION STATEMENT: Why IDSA Did Not Endorse the Surviving Sepsis Campaign Guidelines. Clin Infect Dis. 2017. doi: 10.1093/cid/cix997 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Singer M, Shankar-Hari M. qSOFA, Cue Confusion. Ann Intern Med. 2018;168:293–295. DOI: 10.7326/M17-3415 [DOI] [PubMed] [Google Scholar]
- 23.Estella A, Gamazo-Del Rio J, Álvarez-Manzanares J, Julián-Jiménez A, González Del Castillo J. Prognostic accuracy of qsofa according to the site of infection in older patient attended in Emergency Department. Eur J Intern Med. 2018; 50:e13-e15. DOI: 10.1016/j.ejim.2018.01.005 [DOI] [PubMed] [Google Scholar]
- 24.Peltan ID, Mitchell KH, Rudd KE, Mann BA, Carlbom DJ, Hough CL, et al. . Physician Variation in Time to Antimicrobial Treatment for Septic Patients Presenting to the Emergency Department. Crit Care Med. 2017;45:1011-1018. DOI: 10.1097/CCM.0000000000002436 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Serafim R, Gomes JA, Salluh J, Póvoa P. A Comparison of the Quick-SOFA and Systemic Inflammatory Response Syndrome Criteria for the Diagnosis of Sepsis and Prediction of Mortality: A Systematic Review and Meta-Analysis. Chest. 2018;153:646-655. DOI: 10.1016/j.chest.2017.12.015 [DOI] [PubMed] [Google Scholar]
- 26.Dellinger RP, Carlet JM, Masur H, Gerlach H, Calandra T, Cohen J, Gea-Banacloche J, Keh D, Marshall JC, Parker MM, Ramsay G, Zimmerman JL, Vincent JL, Levy MM. Surviving Sepsis Campaign Guidelines for the management of severe sepsis and septic shock. Intensive Care Med 2004; 30: 536-555. DOI: 10.1007/s00134-004-2210-z [DOI] [PubMed] [Google Scholar]
- 27.Kalil AC, Sweeney DA. Should We Manage All Septic Patients Based on a Single Definition? An Alternative Approach. Crit Care Med. 2018;46:177-180. DOI: 10.1097/CCM.0000000000002778 [DOI] [PubMed] [Google Scholar]
- 28.Klein Klouwenberg PM, Cremer OL, van Vught LA, Ong DS, Frencken JF, Schultz MJ, et al. . Likelihood of infection in patients with presumed sepsis at the time of intensive care unit admission: a cohort study. Crit Care. 2015;19:319 DOI: 10.1186/s13054-015-1035-1 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Ferreras Amez JM, Arribas Entrala B, Sarrat Torres MA, García Noaín A, Caudevilla Martínez A, Colás Oros C, et al. . Evaluación de los resultados antes y después de la implantación del Código Sepsis en Aragón. Emergencias. 2017;29:154-60. PMID: [PubMed] [Google Scholar]