Watch a video presentation of this article
En Estados Unidos, la asignación de órganos para el trasplante hepático se realiza en función de un sistema de puntuación basado en un modelo de enfermedad hepática avanzada. La creatinina sérica es una de las tres variables de este sistema, y a menudo los pacientes que van a recibir un trasplante de hígado también presentan insuficiencia renal. En este informe se revisan las causas de la insuficiencia renal en la población pretrasplante y su repercusión sobre la sobrevida de los pacientes mientras esperan el trasplante. A continuación se examina el impacto del trasplante de hígado sobre la función renal y el impacto que tiene la insuficiencia renal en el momento del trasplante sobre la sobrevida postrasplante. También se analiza el papel del trasplante simultáneo de hígado y riñón y, por último, se estudia la función renal después del trasplante de hígado y el impacto que tienen los fármacos antirrechazo sobre ella.
Daño renal agudo y enfermedad renal crónica en pacientes con cirrosis en espera de un trasplante hepático
La insuficiencia renal es frecuente en los pacientes que esperan un trasplante de hígado, y sus posibles causas se muestran en la Tabla 1. Un informe detectó daño renal agudo (DRA) en el 19% de los pacientes hospitalizados con cirrosis, y este era prerrenal en el 68% de los casos e intrarrenal en el 32% restante1. Alrededor de la mitad de los pacientes con DRA prerrenal presentaban síndrome hepatorrenal (SHR). En la Tabla 1 se muestran también las causas intrínsecas de la enfermedad renal en la población de pacientes con cirrosis. Teniendo en cuenta la epidemia de obesidad y diabetes que se registra en los Estados Unidos, cada vez son más los pacientes con esteatohepatitis no alcohólica que además presentan nefropatía diabética. La única forma de DRA que mejora claramente con el trasplante de hígado es el SHR. Todas las demás formas de DRA siguen una evolución incierta, en función de la etiología de la insuficiencia renal. El tratamiento eficaz de la hepatitis B y la hepatitis C puede dar lugar a la resolución del daño renal originado por estas infecciones.
Table 1.
Causas de insuficiencia renal en la cirrosis
| DRA |
| Prerrenal |
| Infección |
| Hipovolemia |
| SHR (tipos 1 y 2)a |
| Intrarrenal |
| Necrosis tubular aguda |
| Glomerulonefritis aguda |
| Daño por fármacos (contraste y antibióticos) |
| Enfermedad renal crónica |
| Nefropatía diabéticab |
| GNMP‐VHCb, c |
| GNMP‐VHBb, c |
| Nefropatía por IgA |
Abreviaturas. VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; IgA: inmunoglobulina A; GNMP: glomerulonefritis membrano‐proliferativa.
El daño renal podría resolverse mediante un trasplante de hígado.
El daño renal podría resolverse tras un tratamiento eficaz de la infección vírica.
El daño renal podría empeorar tras el trasplante debido a nefrotoxicidad por la medicación antirrechazo.
La nefropatía diabética puede empeorar después del trasplante debido a la nefrotoxicidad asociada a los inhibidores de la calcineurina y a los efectos de estos fármacos sobre la presión sanguínea y la tolerancia a la glucosa.
Efecto de la insuficiencia renal sobre los resultados y la sobrevida pre y postrasplante
En los pacientes que están en espera de un trasplante hepático, la disminución de las tasas de filtrado glomerular (GFRs) se asocia a un aumento de la mortalidad. También la hiponatremia (que refleja la disfunción renal) aumenta el riesgo de muerte en este grupo de pacientes2. Los pacientes que presentan disfunción renal después del trasplante hepático necesitan más tiempo de hospitalización y tienen una probabilidad mayor de presentar enfermedad renal crónica. Adicionalmente, el desarrollo de enfermedad renal crónica aumenta el riesgo de fallecimiento tras el trasplante de hígado3. Para mejorar los resultados es necesario comprender mejor las causas del DRA pretrasplante y contar con mejores parámetros predictivos de la reversibilidad de estos procesos, antes como después del trasplante.
Pretrasplante, efecto del trasplante hepático en la función renal y la sobrevida, y papel del trasplante simultáneo de hígado y riñón
El SHR es frecuente en los pacientes descompensados con cirrosis, y su desarrollo (especialmente en el caso del SHR de tipo 1) se asocia a una mortalidad elevada. Tanto en los pacientes tratados con paracentesis de gran volumen como en los que presentan peritonitis bacteriana espontánea, el uso de albúmina reduce la incidencia de SHR de tipo 1, y es probable que también el uso profiláctico de antibióticos tras un sangrado de varices reduzca el riesgo de desarrollar SHR de tipo 1. Varios estudios han mostrado que el uso de terlipresina combinada con albúmina resuelve el SHR aproximadamente en un tercio de los pacientes (significativamente mejor que placebo) y da lugar a una mejoría de la sobrevida en los pacientes con respuesta4, 5. Los pacientes que no responden a terlipresina presentan mal pronóstico.
Un trasplante hepático con éxito en los pacientes con SHR de tipo 1 mejora de manera importante la sobrevida (>90% a los 90 días) en comparación con los pacientes que no han recibido trasplante (mortalidad >90% a los 90 días) (Figura 1)6. También la función renal mejora después del trasplante en la mayoría de los pacientes con SHR‐17.
Figure 1.
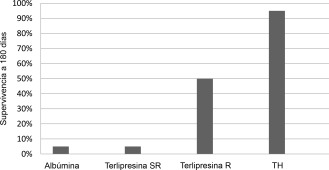
El gráfico muestra la sobrevida a 180 días en pacientes con SHR de tipo 1 tras el uso de albúmina y terlipresina sin respuesta (SR) o con respuesta (R) frente al SHR, o con trasplante hepático (TH)6.
Varios estudios han evaluado qué factores podrían predecir la recuperación de la función renal después del trasplante de hígado. En todos los casos, la duración de la terapia de sustitución renal (TSR) antes del trasplante está inversamente relacionada con la recuperación renal postrasplante. Un análisis de la base de datos UNOS (Red Unida para Compartir los Órganos) reveló que el 70% de los pacientes que habían recibido TSR durante <30 días pudieron abandonar la diálisis tras el trasplante hepático, frente a solo el 11% de los que la habían recibido durante más de 90 días8. Las recomendaciones de la red UNOS sobre los criterios que deben cumplir los pacientes para recibir un trasplante simultáneo de hígado y riñón son las siguientes: pacientes con enfermedad renal terminal, pacientes con enfermedad renal crónica con una GFR ≤30 mL/minuto, pacientes con DRA que presenten un nivel de creatinina ≥2,0 mg/dL y que lleven en diálisis ≥8 semanas, y por último pacientes cirróticos con evidencia mediante biopsia de un daño renal crónico significativo9. Sin embargo, la mayoría de los centros de Estados Unidos no siguen estas recomendaciones en los pacientes con DRA. Además, los datos relativos a los beneficios del trasplante simultáneo de hígado/riñón no son consistentes9, 10. Teniendo en cuenta que no existen parámetros predictivos de la recuperación de la función renal verdaderamente discriminatorios, ni estudios definitivos sobre los beneficios del trasplante simultáneo de hígado y riñón, es urgente realizar estudios prospectivos bien diseñados que amplíen nuestros conocimientos sobre estos dos aspectos.
Disfunción renal postrasplante y efecto de los fármacos
La disfunción renal postrasplante es frecuente y tiene efectos adversos sobre la calidad de vida y la sobrevida del paciente. Varios fármacos que se administran de forma rutinaria después del trasplante de hígado (Tabla 2) pueden contribuir a ella. Los inhibidores de la calcineurina (ICN) tacrolimus y ciclosporina pueden producir una reducción reversible del flujo sanguíneo renal y la GFR. Este efecto reversible se debe a una vasoconstricción relativa de las arteriolas aferentes glomerulares. Se trata de un efecto fisiológico que de algún modo está relacionado con la concentración, y la mayoría de las veces es totalmente reversible. El uso de ICN también puede asociarse a fibrosis intersticial renal progresiva y pérdida tubular, y la toxicidad puede acelerarse si existe una patología renal subyacente. Además, los ICN pueden influir indirectamente sobre la disfunción renal, induciendo hipertensión y alteraciones en la regulación de la glicemia11.
Table 2.
Nefrotoxicidad de los fármacos utilizados después del trasplante
| Fármaco | Mecanismo de la nefrotoxicidad |
|---|---|
| ICN (ciclosporina y tacrolimus) | Vasoconstricción reversible de las arteriolas aferentes, que da lugar a una reducción del flujo sanguíneo renal y el FG |
| Defectos tubulares en la secreción de potasio | |
| Pérdida de fósforo | |
| Fibrosis intersticial irreversible | |
| Empeoramiento de la hipertensión, diabetes (indirecto) | |
| Inhibidores de mTOR (sirolimus y everolimus) | Empeoramiento de la proteinuria (toxicidad directa a nivel de podocitos) |
| Acentuación de la toxicidad por ICN a través de efectos hemodinámicos y fibrosis | |
| Trimetoprim | Reducción de la secreción de creatinina |
| Bloqueo del canal de Na+ que da lugar a alteración de la secreción de potasio | |
| Aciclovir | Nefropatía por cristales |
Se ha demostrado que los inhibidores de mTOR (molécula diana de la rapamicina en los mamíferos) sirolimus y everolimus prolongan la recuperación del daño por isquemia/reperfusión, posiblemente debido a una inhibición de los factores de crecimiento epitelial y endotelial. Aparte de sus efectos directos, los inhibidores de mTOR acentúan la toxicidad de los ICN a través de mecanismos que todavía no se conocen bien. La combinación de un ICN y un inhibidor de mTOR disminuye la GFR en mayor medida que un ICN solo, y en modelos animales esta combinación aumenta la fibrosis renal asociada al ICN. Por último, los inhibidores de mTOR se asocian a proteinuria y a un empeoramiento significativo de la proteinuria preexistente. Esto podría asociarse a toxicidad directa a nivel de podocitos o a toxicidad indirecta, mediante la alteración de la reparación vascular glomerular. Los pacientes con proteinuria no deben ser tratados con un inhibidor de mTOR, salvo en circunstancias excepcionales12.
Abreviaturas
- DRA
daño renal agudo
- ICN
inhibidores de la calcineurina
- FG
filtrado glomerular
- SHR
síndrome hepatorrenal
- mTOR
diana de la rapamicina en los mamíferos
- TSR
terapia de sustitución renal.
Posibles conflictos de intereses: nada que declarar.
Referencias bibliográficas
- 1. Garcia‐Tsao G, Parikh CR, Viola A.Acute kidney injury in cirrhosis. Hepatology 2008;48:2064‐2077. [DOI] [PubMed] [Google Scholar]
- 2. Lim Y‐S, Larson TS, Benson JT, Kamath PS, Kremers W, Therneau TM, et al. Serum sodium, renal function, and survival of patients with end‐stage live disease. J Hepatol 2010;52:523‐528. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. Fabrizi F, Dixit V, Martin P, Messa P. Pre‐transplant kidney function predicts chronic kidney disease after liver transplant: meta‐analysis of observational studies. Dig Dis Sci 2011;56:1282‐1289. [DOI] [PubMed] [Google Scholar]
- 4. Sanyal AK, Boyer T, Garcia‐Tsao G, Regenstein F, Rossaro L, Appenrodt B, et al. A randomized, prospective, double blind, placebo‐controlled study of terlipressin for type I hepatorenal syndrome. Gastroenterology 2008:134:1360‐1368. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Martin‐Llahi M, Pepin MN, Guevara M, Diaz F, Torre A, Monescillo A, et al. Terlipressin and albumin vs. albumin in patients with cirrhosis and hepatorenal syndrome: a randomized study. Gastroenterology 2008;134:1352‐1359. [DOI] [PubMed] [Google Scholar]
- 6. Boyer TD, Sanyal AJ, Garcia‐Tsao G, Regenstein F, Rossaro L, et al. Impact of liver transplantation on survival of patients treated for type 1 hepatorenal syndrome. Liver Transpl 2011:17;1328‐1332. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Rice JP, Skagen C, Said A. Liver transplant outcomes for patients with hepatorenal syndrome treated with pretransplant vasoconstrictors and albumin. Transplantation 2011;91:1141‐1147. [DOI] [PubMed] [Google Scholar]
- 8. Northrup PG, Argo CK, Bakhru MR, Schmitt TM, Berg CL, Rosner MH. Pretransplant predictors of recovery of renal function after liver transplantation. Liver Transpl 2010;16:440‐446. [DOI] [PubMed] [Google Scholar]
- 9. Eason JD, Gonwa TA, Davis CL, Sung RS, Gerber D, Bloom RD. Proceedings of consensus conference on simultaneous liver kidney transplantation (SLK). Am J Transpl 2008;2243‐2251. [DOI] [PubMed] [Google Scholar]
- 10. Martin EF, Huang J, Xiang Q, Klein JP, Bajaj J, Saelan K. Recipeint survival and graft survival are not diminished by simultaneous liver‐kidney transplantation: an analysis of the United Network for Organ Sharing Database. Liver Transpl 2012;18:914‐929. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Naesens M, Kuypers D, Sarwal M. Calcineurin inhibitor nephrotoxicity. Clin J Am Soc Nephrol 2009;4:481‐508. [DOI] [PubMed] [Google Scholar]
- 12. Stallone G, Infante B, Pontrelli P, Gigante M, Montemurno E, Loverre A, et al. Sirolimus and proteinuria in renal transplant patients: evidence for a dose‐dependent effect on slit diaphragm‐associated proteins. Transplantation 2011; 91:997‐1004. [DOI] [PubMed] [Google Scholar]


