Résumé
Objectif
Utiliser les meilleures données probantes et les meilleurs principes de prise de décision partagée et éclairée à notre disposition pour élaborer des lignes directrices de pratique clinique visant une approche simplifiée de prise en charge du trouble de consommation d’opioïdes (TCO) en première ligne.
Méthodes
Onze professionnels de la santé et professionnels paramédicaux représentant divers milieux de pratique, professions et lieux ont créé une liste de questions pertinentes à la prise en charge du TCO en première ligne. Ces questions étaient liées au contexte thérapeutique, au diagnostic, au traitement et à la prise en charge des comorbidités dans le TCO. Les questions ont été étudiées par une équipe expérimentée dans l’évaluation des données probantes à l’aide d’une série de revues systématiques d’études randomisées et contrôlées. Les recommandations émises par le comité des lignes directrices reposent sur les revues systématiques.
Recommandations
Les recommandations font ressortir le rôle des soins primaires dans le traitement des patients aux prises avec un TCO, de même que les traitements pharmacologiques et psychothérapies et les diverses pratiques de prescription (p. ex. test urinaire de dépistage de drogues et contrats). Aucune recommandation précise n’a pu être faite sur la prise en charge des comorbidités chez les patients aux prises avec un TCO, en raison des données probantes limitées.
Conclusion
Les recommandations contribueront à simplifier la prise en charge des cas complexes de TCO en première ligne. Elles aideront tant les cliniciens que les patients à prendre des décisions éclairées au sujet de leurs soins.
En 2017, le nombre de décès liés aux opioïdes a frôlé les 4000 au Canada1; le fentanyl ou les analogues du fentanyl illicites étaient impliqués dans la plupart de ces décès1. Trente-cinq pour cent des décès et 53 % des hospitalisations liés aux opioïdes concernaient des personnes ayant des ordonnances médicales d’opioïdes2,3. En 2016, environ 1 Canadien sur 8 a reçu une ordonnance d’opioïdes4. Une ordonnance d’opioïdes d’à peine 5 jours augmenterait la probabilité de consommation prolongée d’opioïdes5,6.
Le trouble de consommation d’opioïdes (TCO) est actuellement défini par les critères du Manuel diagnostique et statistique des troubles mentaux (DSM), 5e édition; mais la définition a changé au fil du temps. Vu l’incohérence de la définition et les différentes méthodologies d’études, l’estimation raisonnable du risque de TCO après une ordonnance initiale d’opioïdes serait de 4,7 %, tout en reconnaissant que les études varient grandement, allant de 0 à 34 %7–14. En réponse au nombre de Canadiens aux prises avec un TCO et au nombre de décès liés aux opioïdes, le gouvernement du Canada a lancé la Stratégie canadienne sur les drogues et autres substances15,16. Dans le cadre de cette stratégie, les restrictions nationales sur la prescription de méthadone ont été levées17 et les lignes directrices nationales sur le TCO ont été publiées18.
Environ au même moment, le groupe PEER (Patients, Experience, Evidence, Research) a été chargé de revoir les publications scientifiques sur le TCO. De manière rassurante, en dépit des différents processus d’examen des données probantes et de la diversité des comités des lignes directrices, les recommandations qui en ont découlé sont semblables aux recommandations émises par les lignes directrices de l’Initiative canadienne de recherche sur l’abus de substances18. Les lignes directrices simplifiées de PEER offrent le point de vue des soins de première ligne et fournissent un contenu supplémentaire substantiel pour appuyer les omnipraticiens et la prise de décision partagée et éclairée conjointement avec les patients.
MÉTHODOLOGIE
À l’instar des lignes directrices publiées antérieurement par PEER19,20, nous avons suivi les principes des Clinical Practice Guidelines We Can Trust de l’Institute of Medicine21.
Treize personnes représentant des pratiques diverses à différents endroits du Canada et expérimentés dans la prise en charge du TCO composaient le comité des lignes directrices (2 médecins de famille généralistes [C.K., D.K.], 1 généraliste en milieu rural [E.O.], 2 médecins de famille en milieu urbain [J.M., T.M.], 1 médecin de famille spécialisé en toxicomanie et en gestion de la douleur [N.W.], 1 psychiatre [W.L.], 1 infirmière praticienne [R.Q.], 1 pharmacien [T.N.], 1 travailleuse sociale [K.R.], 1 travailleuse en soutien communautaire [C.B.] et 2 pharmaciennes gestionnaires de projet n’ayant pas droit de vote [B.T., A.J.L.]). Un membre du comité représentait également une personne ayant vécu l’expérience. Les membres ont divulgué tout conflit d’intérêts potentiels; les divulgations complètes se trouvent sur CFPlus*. Par l’entremise d’un processus itératif, ce groupe a déterminé les questions clés auxquelles les lignes directrices devaient répondre. Ces questions étaient liées à ce qui suit :
efficacité de la prise en charge du TCO en première ligne;
diagnostic de TCO;
pharmacothérapie (buprénorphine-naloxone, méthadone, naltrexone et cannabinoïdes);
pratiques de prescription (ingestion devant témoin, test urinaire de dépistage de drogues et ententes thérapeutiques [« contrats »]);
traitement dégressif (opioïdes ou agoniste des récepteurs opioïdes);
prise en charge psychosociale;
traitement résidentiel;
prise en charge des comorbidités chez les patients aux prises avec un TCO (douleur aiguë ou chronique, trouble déficitaire de l’attention avec hyperactivité, anxiété et insomnie).
Des revues systématiques ont été réalisées pour répondre à chaque question par une équipe de professionnels de la santé expérimentés dans l’évaluation des données probantes (y compris les auteurs C.K., D.P., J.T., G.M.A., M.R.K., S.G., B.T., N.D., A.J.L.), avec l’aide d’une bibliothécaire. Les détails complets du processus de revue systématique se trouvent dans notre copublication (page e195)22. Brièvement, l’équipe a opté pour la méthodologie de revue systématique des revues systématiques, avec recherche supplémentaire d’études plus récentes que la revue systématique la plus récente dans les études randomisées et contrôlées. Les études d’observation n’ont été utilisées qu’en l’absence de données provenant de revues systématiques ou d’études randomisées et contrôlées. Deux auteurs (D.P., J.T.) ont réalisé la recherche à l’aide de MEDLINE, de la bibliothèque Cochrane et de Google; les lignes directrices publiées sur le TCO et les listes de références des revues systématiques incluses ont aussi été examinées, à la recherche d’études pertinentes. Toutes les revues ont été soumises à une revue et à l’extraction des données. Les études ayant porté sur la désintoxication seulement sans traitement d’entretien étaient exclues. Nous avons utilisé la définition du TCO fournie dans chaque étude randomisée et contrôlée ou revue systématique.
Durant ce processus, 2 nouvelles questions ont fait surface : 1) Y a-t-il des données probantes étayant l’emploi des agonistes des récepteurs opioïdes en l’absence du soutien psychosocial multidisciplinaire habituel? 2) Quelle est l’efficacité de la morphine orale à libération retardée dans le TCO? Pour ces 2 questions, une recherche a été réalisée dans PubMed afin de relever les revues systématiques et les études randomisées et contrôlées pertinentes.
Le comité des lignes directrices s’est appuyé sur les résultats de toutes les revues systématiques pour rédiger les recommandations sur la pratique à l’aide de la méthode GRADE (Grading of Recommendations Assessment, Development and Evaluation) et a composé les lignes directrices23. Ces documents ont été peaufinés, au besoin, en fonction du consensus au sein du comité, et ont été soumis à un processus important de revue par les pairs comptant 52 professionnels de la santé et 5 personnes ayant vécu l’expérience. Comme le souligne GRADE, les fortes recommandations commençaient par les mots « nous recommandons », alors que les recommandations faibles commençaient par les mots « pourrait envisager ».
Limites des données probantes
La littérature était truffée des limites fréquentes22. D’abord, la terminologie n’était pas uniforme, pour définir tant le TCO (p. ex. usage abusif d’héroïne, usage d’opioïdes, toxicomanie, dépendance aux opioïdes) que les comparateurs étudiés (p. ex. soins habituels). La plupart des patients, surtout dans les études sur le traitement, faisaient usage d’héroïne plutôt que d’opioïdes sur ordonnance. Les résultats étaient également mesurés de diverses façons (p. ex. consommation actuelle de drogues définie par l’autodéclaration, dépistage de drogues dans l’urine ou échantillon capillaire). En outre, les études sur le traitement ont connu des taux élevés d’abandons, ce qui a potentiellement entraîné un biais d’attrition, et ces études étaient souvent réalisées en mode ouvert. L’une des plus grandes préoccupations était l’absence de résultats axés sur les patients. La plupart des études n’avaient pas la méthodologie nécessaire pour déterminer les effets de la morbi-mortalité, mais s’intéressaient plutôt aux résultats et aux marqueurs de substitution de consommation de drogues.
RECOMMANDATIONS
Prise de décision partagée et éclairée
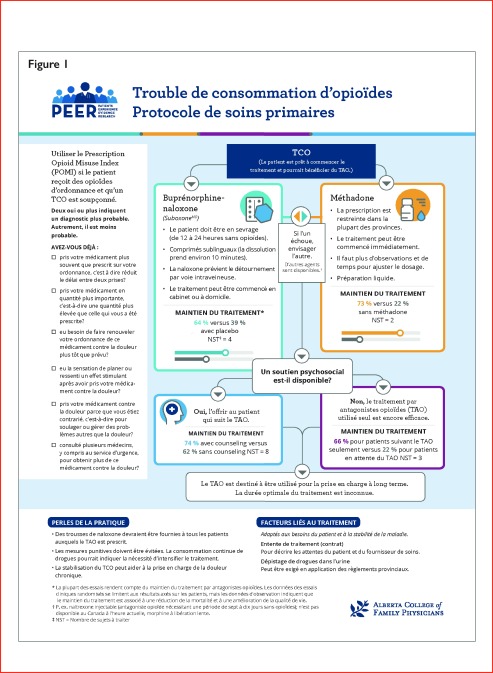
Alors que les recommandations sont résumées dans l’Encadré 1, ces lignes directrices fournissent aussi un tableau qui présente les effets relatifs de divers traitements pour aider la prise de décision partagée et éclairée entre le fournisseur de soins et le patient (Tableau 1). Les lignes directrices présentent aussi un algorithme et une voie d’induction au traitement par la buprénorphine-naloxone (Figures 1 et 2).
Encadré 1. Résumé des recommandations.
Première ligne
Nous recommandons que la prise en charge du TCO ait lieu en première ligne* dans le cadre du continuum des soins pour les patients aux prises avec un TCO (forte recommandation, données probantes de qualité modérée)
Diagnostic
Les cliniciens peuvent envisager d’utiliser un outil simple comme l’indice POMI s’ils ont besoin d’aide pour identifier les patients souffrant de douleur chronique qui pourraient être aux prises avec un TCO (faible recommandation, données probantes de très faible qualité)
Pharmacothérapie
- Nous recommandons que les cliniciens discutent avec leurs patients du recours à la buprénorphine-naloxone ou à la méthadone pour le traitement du TCO (forte recommandation, données probantes de qualité modérée)
- -La méthadone serait supérieure à la buprénorphine-naloxone en matière de rétention en traitement; toutefois, cette dernière pourrait être plus facile à mettre en application en raison du moins grand nombre de restrictions et de considérations dont il faut tenir compte lors de la prescription
Les cliniciens pourraient envisager la naltrexone chez les patients qui n’ont pas pris d’opioïdes depuis au moins 7 à 10 jours et qui sont incapables d’utiliser les agonistes des récepteurs opioïdes ou ne sont pas prêts à le faire (faible recommandation, données probantes de faible qualité)
Nous recommandons d’éviter les cannabinoïdes dans la prise en charge du TCO (forte recommandation, données probantes de très faible qualité)
Pratiques de prescription
Les cliniciens pourraient envisager l’option des doses à emporter (p. ex. 2 à 7 jours) en fonction des besoins et de la stabilité (faible recommandation, données probantes de très faible qualité)
Les cliniciens pourraient envisager les tests urinaires de dépistage de drogues dans le cadre de la prise en charge des patients aux prises avec un TCO (faible recommandation, pas de données probantes tirées d’études randomisées et contrôlées)
Les cliniciens pourraient envisager les ententes thérapeutiques (c.-à-d. contrats) dans la prise en charge de certains patients aux prises avec un TCO (faible recommandation, pas de données probantes tirées d’études randomisées et contrôlées)
Nous recommandons d’éviter les mesures punitives faisant intervenir le traitement par agoniste des récepteurs opioïdes (c.-à-d. réduction de la dose et perte du privilège de l’emporter à domicile), à moins que la sécurité soit une préoccupation (forte recommandation, données probantes de qualité modérée)
Traitement dégressif
Nous recommandons d’éviter d’instaurer un traitement par agoniste des récepteurs opioïdes dans l’intention de l’arrêter à court terme. Les agonistes des récepteurs opioïdes sont destinés au traitement prolongé. La durée optimale de ce traitement est inconnue et serait potentiellement indéfinie (forte recommandation, données probantes de faible qualité)
Interventions psychosociales
Nous recommandons d’ajouter, dans la mesure du possible, le counseling à la pharmacothérapie chez les patients aux prises avec un TCO (forte recommandation, données probantes de faible qualité)
Traitement résidentiel
Les données probantes sont insuffisantes pour émettre une recommandation pour ou contre le recours au traitement résidentiel chez les patients aux prises avec un TCO (aucune recommandation, pas de données probantes tirées d’études randomisées et contrôlées)
Comorbidités
Les données probantes sont insuffisantes pour émettre une recommandation sur les comorbidités suivantes chez les patients aux prises avec un TCO : douleur chronique, douleur aiguë, insomnie, anxiété et TDAH (aucune recommandation, données probantes insuffisantes)
TDAH—trouble déficitaire de l’attention avec hyperactivité, TCO—trouble de consommation d’opioïdes, POMI—Prescription Opioid Misuse Index.
*Dans les études randomisées et contrôlées, les soins de première ligne auraient pu inclure les soins dispensés en équipe, l’offre de soutien et de formation, l’affiliation avec des cliniques spécialisées dans l’abus de drogues, ou le soutien par téléavertisseur 24 heures sur 24.
La formation et le soutien varient en fonction du praticien, des centres de pratique et de la population desservie.
Tableau 1.
Effets estimés des traitements du trouble de consommation d’opioïdes à l’aide de l’évaluation GRADE des données probantes
| SUJET | INTERVENTION C. TÉMOINS | PARAMÈTRE D’ÉVALUATION | BIENFAITS ESTIMÉS, % | INTERVALLE DU SUIVI | NPT OU NNN | QUALITÉ DES DONNÉES SELON GRADE | |
|---|---|---|---|---|---|---|---|
|
| |||||||
| INTERVENTION | TÉMOINS | ||||||
| Soins de première ligne | Première ligne c. soins spécialisés | Rétention en traitement | 86 | 67 | 12–52 sem. | 6 | Modérée |
| Première ligne c. soins spécialisés | Abstinence | 53 | 35 | 12–52 sem. | 6 | Faible | |
| Pharmacothérapie | Buprénorphine c. placebo | Rétention en traitement | 64 | 39 | 30 j à 52 sem. | 4 | Modérée |
| Méthadone c. pas de méthadone | Rétention en traitement | 73 | 22 | 45 j à 2 ans | 2 | Modérée | |
| Méthadone c. buprénorphine | Rétention en traitement | 60 | 45 | 2–52 sem. | 7 | Modérée | |
| Méthadone c. buprénorphine | Abstinence | 30 | 28 | 2–52 sem. | NSS | Faible | |
| Méthadone c. buprénorphine | Sédation | 58 | 26 | 6 sem. | 3 | Modérée | |
| Naltrexone c. placebo ou soins habituels | Rétention en traitement | 33 | 25 | 8–26 sem. | 13 | Faible | |
| Naltrexone c. placebo ou soins habituels | Abstinence | 39 | 27 | 8–26 sem. | 9 | Faible | |
| Naltrexone c. placebo ou soins habituels | Réincarcération | 24 | 33 | 8–40 sem. | 12 | Faible | |
| Pratiques de prescription | Ingestion supervisée c. non supervisée | Rétention en traitement | 66 | 62 | 3–6 mois | NSS | Modérée |
| Ingestion supervisée c. non supervisée | Usage de drogues illicites | 59 | 53 | 3–6 mois | NSS | Faible | |
| Interventions psychosociales | Counseling c. counseling minimal ou pas de counseling | Rétention en traitement | 74 | 62 | 16–26 sem. | 8 | Faible |
| « Standard » c. counseling prolongé | Rétention en traitement | 54 | 45 | 12–24 sem. | NSS | Faible | |
| Contingences positives c. soins habituels | Rétention en traitement | 75 | 66 | 6–26 sem. | 11 | Modérée | |
| Contingences médicamenteuses c. soins habituels | Rétention en traitement | 68 | 77 | 12–52 sem. | 11 | Modérée | |
GRADE—Grading of Recommendations Assessment, Development and Evaluation; NNN—nombre nécessaire pour nuire; NPT—nombre de patients à traiter; NSS—non statistiquement significatif.
Figure 1.
Figure 2.
Le résumé des résultats GRADE se trouve sur CFPlus*. Toutes les recommandations se trouvant dans ces lignes directrices entendent aider les cliniciens et les patients à concevoir un plan de traitement individualisé qui incorpore les préférences et les valeurs individuelles des patients. De plus, nous recommandons d’associer les données probantes trouvées dans ces lignes directrices aux exigences réglementaires provinciales et aux normes de soins des patients aux prises avec un TCO. Des ressources supplémentaires (y compris des liens vers les exigences provinciales) se trouvent également sur CFPlus*. Aucune des recommandations ne s’adresse aux femmes enceintes ni aux patients de moins de 18 ans.
Prise en charge du TCO en première ligne
Quatre études cliniques ont étudié les programmes d’administration d’agonistes des récepteurs opioïdes répartis aléatoirement pour être fondés soit dans les soins de première ligne (c.-à-d. ayant lieu dans un « centre de médecine de famille » qui dispense des soins médicaux complets) ou dans les soins spécialisés (c.-à-d. dans une clinique vouée au TCO)22. Les patients dépendants aux opioïdes avaient plus tendance à observer un programme d’administration d’agonistes des récepteurs opioïdes (86 c. 67 %) et à éviter les opioïdes de rue (67 c. 35 %), et ils ont obtenu un taux supérieur de satisfaction lorsque ce programme était dispensé en première ligne22.
Il importe de tenir compte du contexte dans lequel l’équipe de soutien exécutait les programmes de première ligne à l’étude. Bien que les omnipraticiens aient été les seuls prescripteurs, les infirmières ou les pharmaciens attachés à la clinique aidaient à administrer le programme (p. ex. participaient au suivi, aux tests urinaires de dépistage de drogues et à l’administration des médicaments). Certains fournisseurs ont reçu des séances supplémentaires de formation ou étaient expérimentés dans le TCO, et d’autres avaient accès à un service de soutien par téléavertisseur 24 h sur 24. Les résultats chez les patients et l’acceptabilité de ces programmes pour les fournisseurs auraient pu différer si un soutien de cette nature n’avait pas existé. Cela dit, dans 3 études à répartition aléatoire ayant comparé les agonistes des récepteurs opioïdes à un placebo ou à un groupe témoin sur liste d’attente, les agonistes des récepteurs opioïdes seuls, sans soutien supplémentaire offert aux patients ni aux fournisseurs, ont entraîné une meilleure rétention en traitement (66 c. 22 %, nombre de patients à traiter [NPT] : 3, à 3 ou 4 mois), un meilleur sentiment de bien-être chez les patients et un moindre usage d’opioïdes de rue22.
Nous recommandons donc que, comme c’est le cas pour les autres maladies chroniques, la prise en charge du TCO ait lieu en première ligne dans le cadre du continuum des soins des patients aux prises avec un TCO.
Diagnostic de TCO
Les critères diagnostiques du DSM-IV et du DSM-5 sont les critères diagnostiques de TCO les mieux acceptés22. Cependant, la subjectivité et la longueur des critères pourraient en limiter l’utilisation. Nous n’avons relevé aucune étude ayant évalué d’autres critères diagnostiques du TCO.
Malgré le fait qu’on ait trouvé 14 revues systématiques ayant porté sur l’identification des patients aux prises avec un TCO, seules 2 études avaient comparé les outils de recherche de cas aux critères du DSM22. L’outil le plus prometteur pour les patients souffrant de douleur chronique sous opioïdes est l’indice POMI (Prescription Opioid Misuse Index), une liste de vérification à 6 items qui identifie les patients qui pourraient être aux prises avec un TCO (disponible sur CFPlus*)24. Une étude de cohorte menée auprès de 74 patients ayant reçu une ordonnance d’oxycodone contre la douleur a révélé que les scores POMI de 2 points ou plus étaient très utiles pour inclure le TCO (ratio de vraisemblance positif de 10,3) et modérément utiles pour éliminer le TCO (ratio de vraisemblance négatif de 0,2)22. L’échelle COMM (Current Opioid Misuse Measure) serait aussi raisonnablement utile pour aider à poser un diagnostic de TCO, mais l’échelle est trop longue pour être utilisée régulièrement en première ligne22. Les autres outils (p. ex. SOAPP [Screener and Opioid Assessment for Patients with Pain], ORT [Opioid Risk Tool]) n’ont pas été comparés aux critères du DSM, ce qui signifie que leur validité auprès d’une population atteinte de TCO est inconnue22.
Compte tenu de ces données probantes limitées, les cliniciens doivent envisager d’utiliser un outil simple comme le POMI s’ils ont besoin d’aide pour identifier les patients souffrant de douleur chronique susceptibles d’être aux prises avec un TCO.
Pharmacothérapie
Nous avons examiné 3 pharmacothérapies principales : les agonistes des récepteurs opioïdes (méthadone et buprénorphine avec ou sans naloxone) et l’antagoniste des récepteurs opioïdes naltrexone (une liste des formes posologiques à venir se trouve sur CFPlus*). Bien qu’un certain nombre d’études randomisées et contrôlées se soient intéressées à l’usage de ces drogues, aucune n’avait la puissance nécessaire pour rapporter de manière fiable la mortalité, les surdoses non mortelles, le suicide, les hospitalisations, les visites à l’urgence ou la transmission de maladies infectieuses. Toutefois, lorsqu’on réunit les résultats des études sur la buprénorphine, la méthadone et la naltrexone, on observe une réduction de la mortalité toutes causes confondues avec l’utilisation de la pharmacothérapie contre le TCO (rapport de cotes : 0,34; IC à 95 % : 0,10 à 0,95, 7 études randomisées et contrôlées totalisant 1222 patients)22.
La buprénorphine et la méthadone sont associées à un taux plus élevé de rétention en traitement que les comparateurs non pharmacologiques ou le placebo (taux de rétention sous la buprénorphine : 64 c. 39 % sous le placebo, NPT = 4, 10 études randomisées et contrôlées; taux de rétention sous la méthadone : 73 c. 22 % sous les comparateurs, NPT = 2, 6 études randomisées et contrôlées)22. L’usage continu d’opioïdes est aussi inférieur sous la méthadone (53 c. 78 % sous le traitement non pharmacologique ou le placebo, NPT = 4, 4 études randomisées et contrôlées)22. L’usage continu d’opioïdes est aussi inférieur sous la buprénorphine, mais il est généralement rapporté comme la proportion d’échantillons d’urine qui sont négatifs pour les opioïdes, plutôt que comme la proportion de patients qui obtiennent des résultats négatifs pour les opioïdes22.
Les comparaisons indirectes pointent vers des taux comparables de rétention en traitement sous la méthadone et la buprénorphine (73 c. 65 à 75 % sous la buprénorphine)22. Les comparaisons directes entre la méthadone et la buprénorphine ont cependant donné lieu à un taux de rétention plus élevé sous la méthadone (60 c. 45 %, NPT = 7 à 22 semaines, 24 études randomisées et contrôlées)22. On n’a observé aucune différence quant au taux d’abstinence des opioïdes entre la méthadone et la buprénorphine (28 c. 30 %, 6 études randomisées et contrôlées) lorsque l’abstinence était mesurée par un test urinaire de dépistage de drogues22. Les rapports d’effets indésirables laissent à désirer dans les études randomisées et contrôlées. Une revue systématique a rapporté une plus grande sédation sous la méthadone que sous la buprénorphine, selon 1 étude randomisée et contrôlée (58 c. 26 %, nombre nécessaire pour nuire : 3)22.
La naltrexone améliore la rétention en traitement (33 c. 25 %, NPT = 13, 8 études randomisées et contrôlées) et réduit le risque de réincarcération (24 c. 33 %, NPT = 12, 4 études randomisées et contrôlées), comparativement au placebo ou aux soins habituels22. Il faut cependant noter que la naltrexone précipite le sevrage chez les patients qui n’ont pas été soumis à une période de 7 à 10 jours sans opioïdes. Puisque la plupart des études ont été réalisées auprès de patients qui étaient déjà passés par la désintoxication (p. ex. patients incarcérés), les résultats ne s’appliqueraient pas aux patients qui font toujours usage d’opioïdes. Les données incluaient la naltrexone orale et en injection à action prolongée; mais la naltrexone par injection n’est pas commercialisée au Canada.
La morphine orale à libération retardée (MOLR) est une autre option thérapeutique potentielle contre le TCO. Presque toutes les études à répartition aléatoire et contrôlées étaient transversales et ont été menées auprès de patients déjà stabilisés sous la méthadone. Seule une étude randomisée et contrôlée a rapporté le taux de rétention en traitement chez les patients qui ne prenaient pas de méthadone, et les taux entre la méthadone et la MOLR étaient comparables. De fortes doses de MOLR ont été nécessaires (c.-à-d. 680 mg/j). Aucune étude randomisée et contrôlée portant sur la MOLR n’a été menée auprès de patients qui faisaient usage d’opioïdes autres que l’héroïne22.
Les cannabinoïdes sont aussi fréquemment proposés pour le traitement du TCO. Nous recommandons cependant d’éviter de les utiliser en raison de l’absence de données probantes étayant leurs bienfaits22.
Dans l’ensemble, la pharmacothérapie est fortement recommandée pour prendre en charge le TCO. Bien que la méthadone soit supérieure à la buprénorphine-naloxone en matière de rétention en traitement, cette dernière serait plus facile à mettre en application en raison du moins grand nombre de restrictions et de considérations dont il faut tenir compte à la prescription.
Pratiques de prescription
Certains cliniciens ont recours à des activités prescrites connexes (ingestion quotidienne d’un agoniste des récepteurs opioïdes devant témoin, test urinaire de dépistage de drogues et ententes thérapeutiques) pour tenter de réduire au minimum le risque de diversion des médicaments ou de surdose chez les patients aux prises avec un TCO. Ces activités sont toutefois chronophages et malcommodes pour les patients, et elles érigent donc des obstacles additionnels au traitement.
Ingestion quotidienne devant témoin.
Pour la plupart des paramètres d’évaluation des 5 études randomisées et contrôlées, on n’a observé aucune différence entre les médicaments pour emporter « non supervisés » (c.-à-d. doses à emporter à domicile) et l’ingestion « supervisée » d’agonistes des récepteurs opioïdes22. Les études ont cependant comparé différents niveaux de supervision (p. ex. comparer l’ingestion devant témoin 2 fois plutôt que 5 par semaine) plutôt que les doses pour emporter non supervisées comparées à l’ingestion supervisée d’agonistes des récepteurs opioïdes22. Toutes les études comprenaient une phase de stabilisation (de 8 jours à 3 mois), ce qui pourrait aussi avoir eu un effet sur les résultats.
Aucune étude randomisée et contrôlée n’a rapporté les taux de mortalité ou de surdose22. Une étude a rapporté le taux d’hospitalisations, mais une erreur typographique nous a empêchés d’interpréter les résultats22. Nous avons communiqué avec les auteurs, mais ils ont été incapables de clarifier l’erreur. L’activité criminelle est demeurée inchangée chez les patients non supervisés22. La qualité de vie ou la satisfaction à l’égard du traitement n’a pas changé, mais moins de patients du groupe non supervisé ont rapporté détourner leurs médicaments22. L’usage de drogues illicites rapporté par le patient ou confirmé par une analyse urinaire était non significativement inférieur chez les patients non supervisés. Finalement, on n’a observé aucune différence quant au taux de rétention en traitement entre les patients non supervisés et les patients du groupe sous agoniste des récepteurs opioïdes supervisés (rapport de risque : 1,06; IC à 95 % : 0,94 à 1,19)22.
Puisque la plupart des résultats soit n’ont révélé aucune différence soit ont favorisé le traitement non supervisé, nous pensons que les doses à emporter pourraient être appropriées lorsqu’elles sont indiquées en fonction des besoins et de la stabilité.
Tests urinaires de dépistage de drogues.
Seule 1 étude de cohorte rétrospective a comparé les résultats cliniques chez les patients aux prises avec un TCO qui avaient subi un test urinaire de dépistage de drogues et chez les patients qui n’en avaient pas subi; cependant, les facteurs de confusion résiduels expliqueraient les différences relevées22. En conséquence, nous ne pouvons émettre qu’une recommandation faible en matière de tests urinaires de dépistage de drogues dans la prise en charge du TCO. Les tests urinaires de dépistage de drogues ne doivent pas servir de punition pour le patient. Ils pointent plutôt vers l’instabilité clinique et le besoin d’intensifier le traitement.
Ententes thérapeutiques (« contrats »).
Les ententes thérapeutiques sont utiles pour décrire les attentes, négocier les limites et réduire les conflits au minimum entre les fournisseurs de soins et les patients aux prises avec un TCO. Une revue systématique a comparé les ententes thérapeutiques aux « soins standards22 ». Cependant, seules 2 des études randomisées et contrôlées incluses avaient été menées auprès de patients aux prises avec un TCO. Ces 2 études avaient incorporé l’organisation positive et négative des contingences (récompenser le comportement ou retirer les privilèges, respectivement, selon la réussite du traitement). Malheureusement, à elles seules, ces contingences influent sur les résultats thérapeutiques; il est ainsi impossible dans ces études de différencier l’effet des ententes thérapeutiques de celui de l’organisation des contingences22. Nous suggérons d’envisager les ententes thérapeutiques chez certains patients en fonction des principes d’optimisation de la communication et de clarification des attentes.
Traitement dégressif
Nous avons examiné 3 définitions de traitement dégressif : réduire jusqu’à arrêter les opioïdes prescrits aux patients aux prises avec un TCO, réduire jusqu’à arrêter les agonistes des récepteurs opioïdes plutôt que de poursuivre indéfiniment le traitement par ces médicaments et arrêter les agonistes des récepteurs opioïdes à l’aide de protocoles dégressifs rapides plutôt que lents.
Réduire jusqu’à arrêter les opioïdes prescrits aux patients aux prises avec un TCO.
Nous voulions quantifier les effets liés à la réduction des opioïdes sur ordonnance à titre d’intervention thérapeutique chez les patients aux prises avec un TCO. Il n’existe cependant aucune étude randomisée et contrôlée ayant porté sur cette approche22.
Réduire jusqu’à arrêter les agonistes des récepteurs opioïdes plutôt que de poursuivre le traitement indéfiniment.
Trois études randomisées et contrôlées ayant porté sur le traitement dégressif par agonistes des récepteurs opioïdes plutôt que de poursuivre le traitement ont révélé que la poursuite du traitement par agonistes des récepteurs opioïdes prolongeait la rétention en traitement et réduisait l’usage de drogues22. Par exemple, dans une petite étude randomisée et contrôlée comptant 12 patients, tous les patients ayant été choisis au hasard pour un traitement dégressif par la buprénorphine-naloxone soit étaient incapables de réduire la dose, soit avaient abandonné l’étude. Deux autres études randomisées et contrôlées ont observé un usage accru de drogues chez les patients choisis au hasard pour le traitement dégressif (p. ex. usage d’opioïdes illicites de 0,8 jour de plus par semaine).
Arrêter les agonistes des récepteurs opioïdes à l’aide de protocoles dégressifs rapides plutôt que lents.
Les données tirées de 4 études randomisées et contrôlées sur le traitement dégressif par la buprénorphine ou la buprénorphine-naloxone ont révélé que les protocoles dégressifs lents (28 à 56 jours) entraînaient moins de symptômes de sevrage et une plus grande satisfaction des patients que les protocoles dégressifs rapides (7 à 28 jours)22.
Bien que le traitement dégressif par agoniste des récepteurs opioïdes puisse être envisagé chez certains patients, ces médicaments sont destinés au traitement prolongé, potentiellement indéfini, dont la durée optimale est inconnue. Si l’on envisage de cesser l’agoniste des récepteurs opioïdes, la dégression doit être lente et individualisée.
Interventions psychosociales
L’ajout de counseling standard, généralement défini comme des visites hebdomadaires ou bimensuelles de 15 à 20 minutes, améliore significativement la rétention en traitement (74 c. 62 %, NPT = 8; rapport de risque : 1,20; IC à 95 % : 1,06 à 1,36) comparativement au counseling très minimal ou « en cas d’urgence seulement »22. Le counseling prolongé (séances hebdomadaires ou bimensuelles de 45 à 60 minutes) n’a pas produit davantage de bienfaits que l’intervention standard. L’entrevue motivationnelle brève améliore la rétention en traitement à 6 mois (84 c. 73 %, NPT = 11)22. Les interventions prolongées ne produisent aucun bienfait additionnel22. La thérapie cognitivo-comportementale n’a pas montré pouvoir améliorer la rétention par rapport aux soins standards (qui incluent en général un contact hebdomadaire avec le médecin)22. Nous recommandons donc d’ajouter à la pharmacothérapie des interventions psychosociales brèves, comme le counseling (lorsque celui-ci est offert) chez les patients aux prises avec un TCO.
Les interventions psychosociales standards (p. ex. thérapie cognitivo-comportementale) par ordinateur entraînent une rétention comparable à celle obtenue avec le counseling standard tout en exigeant moins de temps (264 minutes c. 647 minutes pour le counseling)22. Les interventions psychosociales standards par ordinateur pourraient être une option lorsque les patients sont incapables d’accéder aux ressources locales ou ne sont pas prêts à le faire.
Une revue systématique a rapporté l’absence de bienfaits avec le recours à l’organisation des contingences (recours aux récompenses et aux punitions pour le comportement) dans les cas de TCO, bien que toutes les contingences aient été analysées dans un tout22. Les contingences qui font appel à des prix et à des bons d’échange (c.-à-d. positives) améliorent la rétention en traitement à 12 semaines (75 c. 66 %, NPT = 11)22. La réduction des doses des médicaments ou le retrait du privilège d’emporter ses médicaments à domicile pour cause de non-observance (c.-à-d. contingences négatives) réduit la rétention en traitement (68 c. 77 %, nombre nécessaire pour nuire de 11) et ne réduit pas l’usage de drogues illicites22. Nous recommandons d’utiliser des stratégies de renforcement positif dans la mesure du possible. Le fait de réduire la dose des médicaments ou de révoquer les privilèges d’apporter ses médicaments à domicile va à l’encontre du succès et doit être évité, à moins que la sécurité du patient ou de la communauté soit une préoccupation.
Traitement résidentiel
Les traitements offerts par les programmes résidentiels varient considérablement, et certains de ces programmes interdisent l’usage d’agonistes des récepteurs opioïdes. L’absence d’études randomisées et contrôlées ayant porté sur les programmes de traitement résidentiel nous a empêchés d’émettre une recommandation sur leur utilisation22.
Prise en charge des comorbidités chez les patients aux prises avec un TCO
La prise en charge des comorbidités est parfois complexe chez les patients sous agonistes des récepteurs opioïdes. Malheureusement, on ne dispose pas de données probantes tirées d’études randomisées et contrôlées à ce sujet. Pour ce qui est de la prise en charge de la douleur aiguë chez les patients sous agonistes des récepteurs opioïdes, 1 étude randomisée et contrôlée a rapporté que la morphine était supérieure à la mépéridine en situation d’urgence22. Cette conclusion n’est pas toujours applicable en milieu ambulatoire, et les options non opioïdes n’ont pas été étudiées. La prise en charge de la douleur chronique chez les patients sous agonistes des récepteurs opioïdes demeure aussi nébuleuse. Une étude randomisée et contrôlée a révélé que tous les patients souffrant de douleur chronique ayant été choisi au hasard pour un traitement dégressif par agonistes des récepteurs opioïdes ont abandonné l’étude. Une deuxième étude randomisée et contrôlée a donné à croire que la buprénorphine ne différait pas de la méthadone contre la douleur22. Mis à part le maintien des patients sous agonistes des récepteurs opioïdes, les données probantes ne sont pas suffisantes pour orienter le traitement de la douleur chronique.
L’insomnie, l’anxiété et le trouble déficitaire de l’attention avec hyperactivité sont d’autres exemples de comorbidités qui ajoutent à la complexité des soins chez les patients aux prises avec un TCO. Seule 1 étude randomisée et contrôlée traitant de chacun de ces sujets a été relevée - toutes démontraient l’absence de bienfaits au-delà de ceux observés avec le placebo22. Bien que l’absence de données probantes limite les recommandations en matière de prise en charge optimale de ces comorbidités en première ligne, tous les patients doivent recevoir les mêmes soins standards, qu’ils soient ou non aux prises avec un TCO.
Pratiques exemplaires
Puisque les données probantes sur divers aspects de la prise en charge des patients aux prises avec un TCO se font rares, le comité des lignes directrices a créé une liste de pratiques exemplaires visant à aider les cliniciens à dispenser des soins à ces patients (Encadré 2). Ces exemples sont basés sur l’opinion du comité et sur les tendances actuelles de la pratique.
Encadré 2. Pratiques exemplaires : Les exemples sont basés sur l’opinion du comité des lignes directrices et sur les tendances actuelles de la pratique.
Traitement par agoniste des récepteurs opioïdes
Favoriser la réduction des préjudices, comme veiller à ce que les patients aient à leur disposition une trousse de naloxone
Les patients doivent avoir un coffre verrouillé pour les doses à emporter d’agonistes des récepteurs opioïdes
Malgré la plupart des références indiquant que la dose maximale de buprénorphine-naloxone est de 24 mg/j, la dose peut aller jusqu’à 32 mg/j dans certains cas
En cas d’incertitude quant à la sédation lors de l’augmentation de la dose de l’agoniste des récepteurs opioïdes, demander aux patients de prendre la dose le matin et fixer un rendez-vous de 3 à 4 h après la dose pour s’assurer qu’ils ne sont pas trop endormis
Ajuster la dose de l’agoniste des récepteurs opioïdes en fonction des symptômes de sevrage. Demander à quelle heure les symptômes culminent. Les symptômes de sevrage réels culminent juste avant l’heure de la prochaine dose
- Les effets indésirables des agonistes des récepteurs opioïdes sont semblables à ceux observés avec les opioïdes, c’est-à-dire constipation, aménorrhée chez les femmes et faible taux de testostérone chez les hommes
- -La méthadone cause la sudation, qui peut aussi être un symptôme de sevrage
- Chez les patients souffrant de douleur chronique, stabiliser d’abord le TCO avant de prendre en charge la douleur
- -La douleur pourrait s’atténuer avec la stabilisation du TCO
Les agonistes des récepteurs opioïdes peuvent toujours être utilisés dans le contexte d’un trouble de consommation de plusieurs drogues (p. ex. TCO et trouble de consommation de stimulants)
Si la sécurité est un facteur critique de l’emploi des patients, vérifier les normes de l’employeur en matière de test urinaire de dépistage de drogues et de pharmacothérapie
Si le test urinaire de dépistage de drogues est négatif pour la méthadone ou la buprénorphine-naloxone (ou leurs métabolites) chez un patient sous traitement par agoniste des récepteurs opioïdes, envisager la possibilité de détournement
Symptômes de sevrage
Non traités, les symptômes de sevrage persistent pendant des semaines. Avec un traitement (p. ex. buprénorphine), ils disparaissent habituellement en 3 à 5 jours, selon l’ajustement de la dose
Se familiariser avec les signes et les symptômes du sevrage. L’examen physique est-il corrélé avec le rapport subjectif du patient en matière de symptômes?
Le besoin irrépressible de drogues est un symptôme de sevrage
Accès à des ressources supplémentaires
Consulter les pharmaciens communautaires pour recueillir de l’information sur les patients qui vous inquiètent. De quoi ont-ils l’air lorsqu’ils sont à la pharmacie? Sont-ils endormis ou intoxiqués?
Envisager les réseaux de mentorat, s’ils sont disponibles, pour aider à prendre en charge les comorbidités (p. ex. la douleur) ou pour discuter d’autres méthodes de prise en charge chez les patients dont la réponse est sous-optimale au traitement par agoniste des récepteurs opioïdes, etc.
TCO—trouble de consommation d’opioïdes
Conclusion
La prise en charge en première ligne des patients aux prises avec un TCO et la thérapie prolongée par agonistes des récepteurs opioïdes améliorent les résultats chez les patients. Il pourrait être utile aussi d’ajouter des interventions psychosociales et d’éviter les mesures punitives. Toutes les discussions sur le traitement doivent tenir compte des préférences et des valeurs des patients. Nous espérons que les futures études randomisées et contrôlées clarifieront les effets de la pharmacothérapie sur la morbi-mortalité et le fonctionnement social (p. ex. l’emploi); la prise en charge des comorbidités dans le TCO; et la meilleure méthode pour poser un diagnostic de TCO chez les patients qui consomment des opioïdes depuis longtemps.
Remerciements
Nous souhaitons remercier Janice Kung, MBSI, pour son aide à la création de la stratégie de recherche; Caitlin R. Finley, Rhonda Ting et Peter (Ran) Yang pour leur contribution à la revue des données probantes; nos pairs réviseurs pour leurs commentaires précieux; et le Collège des médecins de famille de l’Alberta pour son soutien continu. Ce projet a été financé par Alberta Health, par l’entremise de la Primary Health Care Opioid Response Initiative.
Points de repère du rédacteur
▸ Ces lignes directrices simplifiées en matière de prise en charge du trouble de consommation d’opioïdes (TCO) ont été élaborées en se concentrant sur les soins de première ligne au moyen d’une revue systématique de revues systématiques. Les recommandations s’accompagnent d’exemples de pratiques exemplaires et de ressources supplémentaires pour appuyer les omnipraticiens ainsi que la prise de décision partagée et éclairée avec les patients.
▸ La prise en charge du TCO et l’offre d’un traitement prolongé par un agoniste des récepteurs opioïdes en première ligne améliorent les résultats chez les patients. Il pourrait aussi être utile d’ajouter des interventions psychosociales et d’éviter les mesures punitives. Toutes les discussions sur le traitement doivent tenir compte des préférences et des valeurs des patients.
▸ Les futures études randomisées et contrôlées doivent clarifier les effets de la pharmacothérapie sur la morbi-mortalité et le fonctionnement social (p. ex. l’emploi); la prise en charge des comorbidités dans le TCO; et la meilleure méthode pour poser un diagnostic de TCO chez les patients qui consomment des opioïdes de manière chronique.
Footnotes
La divulgation complète des intérêts concurrents, le résumé des résultats GRADE, l’indice POMI (Prescription Opioid Misuse Index), une liste des formes posologiques de buprénorphine et de naltrexone à venir et des ressources additionnelles se trouvent en anglais à www.cfp.ca. Allez au texte intégral (Full text) de l’article en ligne, puis cliquez sur l’onglet CFPlus.
Collaborateurs
Le comité des lignes directrices était composé des personnes suivantes : les Drs Korownyk, Kennedy, Orrantia, Marlinga, Mogus, Wong, Lamba et Lindblad, et Mme de Queiroz, M. Nickonchuk, Mme Reich, Mme Bateman et Mme Thomas. L’équipe de revue des données probantes était composée des personnes suivantes : les Drs Korownyk, Ton, Allan, Kolber, Garrison, Dugré et Lindblad, et Mme Perry et Mme Thomas. Tous les auteurs ont contribué à la formulation des recommandations et à la préparation du manuscrit aux fins de soumission.
Intérêts concurrents
Aucun des auteurs n’a des conflits d’intérêts financiers à déclarer. Les divulgations complètes sont disponibles sur CFPlus.*
Cet article donne droit à des crédits d’autoapprentissage certifiés Mainpro+. Pour obtenir des crédits, rendez-vous sur www.cfp.ca et cliquez sur le lien Mainpro+.
Cet article a fait l’objet d’une révision par des pairs.
The English version of this article is available at www.cfp.ca on the table of contents for the May 2019 issue on page 321.
Références
- 1.Comité consultatif spécial sur l’épidémie de surdoses d’opioïdes . Ottawa, ON: Agence de la santé publique du Canada; 2018. Rapport national : Décès apparemment liés à la consommation d’opioïdes au Canada (publié en mars 2018) [Google Scholar]
- 2.Gomes T, Khuu W, Martins D, Tadrous M, Mamdani MM, Paterson JM, et al. Contributions of prescribed and non-prescribed opioids to opioid related deaths: population based cohort study in Ontario, Canada. BMJ. 2018;362:k3207. doi: 10.1136/bmj.k3207. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Gomes T, Khuu W, Craiovan D, Martins D, Hunt J, Lee K, et al. Comparing the contribution of prescribed opioids to opioid-related hospitalizations across Canada: a multi-jurisdictional cross-sectional study. Drug Alcohol Depend. 2018;191:86–90. doi: 10.1016/j.drugalcdep.2018.06.028. Publ. en ligne du 31 juill. 2018. [DOI] [PubMed] [Google Scholar]
- 4.Institut canadien d’information sur la santé. Tendances pan-canadiennes en matière de prescription d’opioïdes, de 2012 à 2016. Ottawa, ON: Institut canadien d’information sur la santé; 2017. Accessible à : https://secure.cihi.ca/free_products/pan-canadian-trends-opioid-prescribing-2017-fr-web.pdf. Réf. du 10 mars 2019. [Google Scholar]
- 5.Shah A, Hayes CJ, Martin BC, Centers for Disease Control and Prevention Characteristics of initial prescription episodes and likelihood of long-term opioid use—United States, 2006–2015. Morb Mortal Wkly Rep. 2017;66(10):265–9. doi: 10.15585/mmwr.mm6610a1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Bratt GA, Agniel D, Beam A, Yorkgitis B, Bicket M, Homer M, et al. Postsurgical prescriptions for opioid naive patients and association with overdose and misuse: retrospective cohort study. BMJ. 2018;360 doi: 10.1136/bmj.j5790. j5790. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Boscarino JA, Rukstalis M, Hoffman SN, Han JJ, Erlich PM, Gerhard GS, et al. Risk factors for drug dependence among out-patients on opioid therapy in a large US health-care system. Addiction. 2010;105(10):1776–82. doi: 10.1111/j.1360-0443.2010.03052.x. Publ. en ligne du 16 août 2010. [DOI] [PubMed] [Google Scholar]
- 8.Sullivan MD, Edlund MJ, Fan MY, Devries A, Brennan Braden J, Martin BC. Risks for possible and probable opioid misuse among recipients of chronic opioid therapy in commercial and Medicaid insurance plans: the TROUP study. Pain. 2010;150(2):332–9. doi: 10.1016/j.pain.2010.05.020. Publ. en ligne du 15 juin 2010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Højsted J, Nielsen PR, Guldstrand SK, Frich L, Sjøgren P. Classification and identification of opioid addiction in chronic pain patients. Eur J Pain. 2010;14(10):1014–20. doi: 10.1016/j.ejpain.2010.04.006. Publ. en ligne du 21 mai 2010. [DOI] [PubMed] [Google Scholar]
- 10.Degenhardt L, Bruno R, Lintzeris N, Hall W, Nielsen S, Larance B, et al. Agreement between definitions of pharmaceutical opioid use disorders and dependence in people taking opioids for chronic non-cancer pain (POINT): a cohort study. Lancet Psychiatry. 2015;2(4):314–22. doi: 10.1016/S2215-0366(15)00005-X. Publ. en ligne du 31 mars 2015. [DOI] [PubMed] [Google Scholar]
- 11.Von Korff M, Walker RL, Saunders K, Shortreed SM, Thakrai M, Parchman M, et al. Prevalence of prescription opioid use disorder among chronic opioid therapy patients after health plan opioid dose and risk reduction initiatives. Int J Drug Policy. 2017;46:90–8. doi: 10.1016/j.drugpo.2017.05.053. Publ. en ligne du 27 juin 2017. [DOI] [PubMed] [Google Scholar]
- 12.Just JM, Bingener L, Bleckwenn M, Schnakenberg R, Wechbecker K. Risk of opioid misuse in chronic non-cancer pain in primary care patients—a cross sectional study. BMC Fam Pract. 2018;19(1):92. doi: 10.1186/s12875-018-0775-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Higgins C, Smith BH, Matthews K. Incidence of iatrogenic opioid dependence or abuse in patients with pain who were exposed to opioid analgesic therapy: a systematic review and meta-analysis. Br J Aneasthesia. 2018;120(6):1335–44. doi: 10.1016/j.bja.2018.03.009. Publ. en ligne du 21 avr. 2018. [DOI] [PubMed] [Google Scholar]
- 14.Minozzi S, Amato L, Davoli M. Development of dependence following treatment with opioid analgesics for pain relief: a systematic review. Addiction. 2013;108(4):688–98. doi: 10.1111/j.1360-0443.2012.04005.x. Publ. en ligne du 18 oct. 2012. [DOI] [PubMed] [Google Scholar]
- 15.Gouvernement du Canada . Le renforcement de l’approche du Canada à l’égard des enjeux liés à la consommation de substances. Ottawa, ON: gouvernement du Canada; 2018. Accessible à : https://www.canada.ca/fr/sante-canada/services/dependance-aux-drogues/strategie-canadienne-drogues-substances/renforcement-approche-canada-egard-questions-liees-consommation-substances.html. Réf. du 10 mars 2019. [Google Scholar]
- 16.Mesures du gouvernement du Canada sur les opioïdes : 2016 et 2017. Ottawa, ON: gouvernement du Canada; 2018. Accessible à : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/mesures-opioides-2016-2017.html. Réf. du 10 mars 2019. [Google Scholar]
- 17.Gouvernement du Canada. Traitement d’entretien à la méthadone. Ottawa, ON: Gouvernement du Canada; 2017. Accessible à : https://www.canada.ca/fr/sante-canada/services/preoccupations-liees-sante/substances-controlees-precurseurs-chimiques/exemptions/traitement-entretien-methadone.html. Réf. du 10 mars 2019. [Google Scholar]
- 18.Bruneau J, Ahamad K, Goyer MÉ, Poulin G, Selby P, Fischer B, et al. Management of opioid use disorders: a national clinical practice guideline. CMAJ. 2018;190:E247–57. doi: 10.1503/cmaj.170958. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Allan GM, Lindblad AJ, Comeau A, Coppola J, Hudson B, Mannarino M, et al. Simplified lipid guidelines. Prevention and management of cardiovascular disease in primary care. Can Fam Physician. 2015;61:857–67. (ang), e439–50 (fr). [PMC free article] [PubMed] [Google Scholar]
- 20.Allan GM, Ramji J, Perry D, Ton J, Beahm NP, Crisp N, et al. Simplified guideline for prescribing medical cannabinoids in primary care. Can Fam Physician. 2018;64:111–20. (ang), e64–75 (fr). [PMC free article] [PubMed] [Google Scholar]
- 21.Greenfield S, Steinberg EP, Auerbach A, Avorn J, Galvin R, Gibbons R, et al. Clinical practice guidelines we can trust. Washington, DC: Institute of Medicine; 2011. Accessible à : www.nationalacademies.org/hmd/Reports/2011/Clinical-Practice-Guidelines-We-Can-Trust.aspx. Réf. du 19 janv. 2019. [Google Scholar]
- 22.Korownyk C, Perry D, Ton J, Kolber MR, Garrison S, Thomas B, et al. Opioid use disorder in primary care. PEER umbrella systematic review of systematic reviews. Can Fam Physician. 2019;65:e194–206. [PMC free article] [PubMed] [Google Scholar]
- 23.Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. J Clin Epidemiol. 2013;66(7):719–25. doi: 10.1016/j.jclinepi.2012.03.013. Publ. en ligne du 9 janv. 2013. [DOI] [PubMed] [Google Scholar]
- 24.Cochran G, Bacci JL, Ylioja T, Hruschak V, Miller S, Seybert AL, et al. Prescription opioid use: patient characteristics and misuse in community pharmacy. J Am Pharm Assoc. 2016;56(3):248–56. doi: 10.1016/j.japh.2016.02.012. Publ. en ligne du 24 mars 2016. [DOI] [PMC free article] [PubMed] [Google Scholar]