RESUMEN
Objetivo
. Evaluar el impacto clínico de la PCR-múltiple FilmArray® panel Meningitis/Encefalitis en el diagnóstico de infecciones del sistema nervioso central y comparar los resultados obtenidos y el tiempo necesario hasta el diagnóstico con las técnicas microbiológicas convencionales.
Pacientes y métodos
Estudio prospectivo observacional en una Unidad de Cuidados Intensivos (UCI) de adultos de un hospital de tercer nivel. Se realizó punción lumbar a todos los pacientes y en el LCR extraído se realizó FilmArray® panel de meningitis /encefalitis, estudio citoquímico, Gram y cultivos microbiológicos convencionales.
Resultados
21 pacientes ingresados con sospecha de Meningitis/Encefalitis. Edad: mediana 58,4 años (RIQ 38,1-67,3), APACHE II: mediana 18 (RIQ 12-24). La mediana de estancia en UCI fue de 4 días (RIQ 2-6) y la hospitalaria de 17 días (RIQ 14-28). Mortalidad 14,3%. Se estableció un diagnóstico clínico final de Meningitis/Encefalitis en 16 pacientes, con diagnóstico etiológico en 12 casos (75%). La etiología más frecuente fue Streptococcus pneumoniae (8 casos). FilmArray® permitió diagnóstico etiológico en 3 casos con cultivo negativo y el resultado implicó cambios en el tratamiento antibiótico de 7 de los 16 pacientes (43,8%). Para la totalidad de pacientes, FilmArray® presentó una sensibilidad y especificidad del 100% y 90% respectivamente. La mediana de tiempo hasta la obtención del resultado de FilmArray® fue de 2,9 horas (RIQ 2,1-3,8) y del cultivo incluyendo antibiograma 45,1 horas (RIQ 38,9-58,7).
Conclusiones
FilmArray® panel Meningitis/Encefalitis realiza un diagnóstico etiológico más precoz que los cultivos convencionales, muestra una mayor sensibilidad y permite realizar un tratamiento antimicrobiano dirigido.
Palabras clave: FilmArray, Meningitis, Encefalitis, PCR multiple
ABSTRACT
Objetive
To evaluate the clinical impact of Meningitis/ Encephalitis FilmArray® panel for the diagnosis of cerebral nervous system infection and to compare the results (including time for diagnosis) with those obtained by conventional microbiological techniques.
Patients and methods
A prospective observational study in an Intensive Care Unit of adults from a tertiary hospital was carried out. Cerebrospinal fluid from all patients was taken by lumbar puncture and assessed by the meningitis/encephalitis FilmArray® panel ME, cytochemical study, Gram, and conventional microbiological cultures.
Results
A total of 21 patients admitted with suspicion of Meningitis/Encephalitis. Median age of patients was 58.4 years (RIQ 38.1-67.3), median APACHE II 18 (RIQ 12-24). Median stay in ICU and median hospital stay was 4 (RIQ 2-6) and 17 days (RIQ 14-28), respectively. The overall mortality was 14.3%. A final clinical diagnosis of meningitis or encephalitis was established in 16 patients, obtaining the etiological diagnosis in 12 of them (75%). The most frequent etiology was Streptococcus pneumoniae (8 cases). FilmArray® allowed etiological diagnosis in 3 cases in which the culture had been negative, and the results led to changes in the empirical antimicrobial therapy in 7 of 16 cases (43.8%). FilmArray® yielded a global sensitivity and specificity of 100% and 90%, respectively. The median time to obtain results from the latter and conventional culture (including antibiogram) was 2.9 hours (RIQ 2.1-3.8) and 45.1 hours (RIQ 38.9-58.7), respectively.
Conclusions
The Meningitis/Encephalitis FilmArray® panel was able to establish the etiologic diagnosis faster than conventional methods. Also, it achieved a better sensitivity and led to prompt targeted antimicrobial therapy.
Key-words: FilmArray, Meningitis, Encephalitis, Multiplex polymerase chain reaction
INTRODUCCIÓN
Las infecciones del sistema nervioso central (SNC) como meningitis y encefalitis (M/E) constituyen una grave patología que requiere un diagnóstico etiológico rápido. Iniciar precozmente un tratamiento antimicrobiano dirigido contribuye a disminuir morbimortalidad, estancia hospitalaria y reduce costes sanitarios [1]. Los pacientes que sobreviven a estas graves infecciones pueden tener importantes secuelas. En el diagnóstico, la sintomatología clásica es inespecífica y la celularidad y bioquímica del líquido cefalorraquídeo (LCR) aunque ayudan a diferenciar infección vírica de bacteriana, tampoco son definitivas [2, 3].
El cultivo del LCR se considera el patrón oro para el diagnóstico de la meningitis bacteriana a pesar de sus limitaciones. En el diagnóstico de las infecciones virales del SNC, los cultivos son lentos y de bajo rendimiento por lo que las técnicas de reacción en cadena de la polimerasa (PCR) han ido desplazando al cultivo, pero su uso permanece infrautilizado por su complejidad y disponibilidad limitada [4]. Estas limitaciones han contribuido a estimular el interés por sistemas comerciales de PCR-múltiple, que integran todo el proceso en sistemas cerrados, ofrecen resultados muy rápidos, tienen alta especificidad y sensibilidad al no requerir un patógeno viable, son fáciles de realizar y pueden estar disponibles en cualquier tipo de hospital. Estos sistemas están cambiando el diagnóstico en la sepsis, infecciones respiratorias y otras patologías infecciosas [5-10]. En las infecciones del SNC del paciente crítico el “tiempo es vida” por lo que en estos casos la literatura recomienda utilizar sistemas de PCR múltiple en tiempo real [11-17].
En octubre del año 2015 la FDA autorizó el primer panel para la detección de patógenos del SNC (FilmArray®) [18]. Para bacterias como Streptococcus pneumoniae, Neisseria meningitidis y Haemophilus influenzae la sensibilidad y especificidad es del 89% y 100% [29] y para Cryptococcus spp. algunos autores refieren una sensibilidad y especificidad del 100% [20]. El objetivo de este estudio ha sido evaluar el impacto clínico de la PCR-múltiple FilmArray® panel Meningitis/Encefalitis en el diagnóstico de infecciones del SNC en la Unidad de Cuidados Intensivos (UCI), y comparar los resultados obtenidos y el tiempo necesario hasta el diagnóstico con las técnicas microbiológicas convencionales.
PACIENTES Y MÉTODOS
Pacientes. Análisis prospectivo de todos los pacientes ingresados consecutivamente en una UCI de adultos con sospecha clínica de meningitis/encefalitis. El estudio fue aprobado por el Comité de Ética del hospital.
Ámbito del estudio. UCI polivalente de un Hospital Universitario de tercer nivel y centro de referencia para Neurocirugía.
Periodo de estudio. Desde el 9 de Enero de 2017 hasta el 20 de Junio de 2018
Criterios diagnósticos. Se consideró sospecha clínica de meningitis la presencia de fiebre acompañada de signos meníngeos, rigidez de nuca, vómitos y otros síntomas neurológicos, como deterioro del nivel de consciencia, convulsiones o agitación psicomotora. Si presentaba al menos tres de ellos se consideró sospecha clínica alta y si solamente tenían uno o dos síntomas se consideró como sospecha clínica baja. Se definió leucocitosis como un nivel de leucocitos en sangre superior a 12.000/mm3. El límite alto de normalidad de procalcitonina se estableció en 0,5 mg/dl. Criterios diagnósticos en citoquímica de LCR: hipoglucorraquia, ratio de glucosa en LCR/glucosa en sangre menor de 0,5; hiperproteinorraquia, proteínas en LCR > 50 mg/dl, pleocitosis: leucocitos en LCR > 5 /mm3. Se consideró que existía predominio de neutrófilos si representaban más del 80% de las células. El diagnóstico etiológico se consideró positivo de acuerdo al resultado del Gram, antígeno de neumococo en LCR y orina, PCR del gen codificante de la subunidad 16S ribosomal bacteriana, cultivos bacterianos /PCR “casera” (in house) de virus y PCR múltiple en tiempo real, FilmArray®.
Diagnóstico microbiológico. Los LCR para cultivo bacteriológico fueron procesados de acuerdo al protocolo recomendado por la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica [21]. Para ello se sembraron en placas de agar sangre, agar chocolate y caldo tioglicolato (BioMérieux, Marcy l’Étoile) y se incubaron hasta 5 días. Para el diagnóstico virológico se realizó la extracción de ADN del LCR mediante AmpliPrep COBAS® (Roche Diagnostics) y PCR “casera” (in house) incluyendo las dianas Virus herpes simple 1 (VHS1), Virus herpes simple 2 (VHS2), Varicela-Zoster (VVZ), citomegalovirus (CMV), virus Epstein-Barr y Virus herpes 6 y 7. Se realizó antígeno de neumococo en LCR y/u orina a criterio del médico responsable. En los casos que se consideró necesario se realizó también identificación microbiana mediante PCR16S.
Variables del estudio. Se registraron datos demográficos, síntomas y signos al ingreso, APACHE II, días de ingreso, tiempo de ventilación mecánica, mortalidad en UCI e intra-hospitalaria, tratamiento antibiótico, resultados citoquímicos de LCR, hemocultivos y resultados microbiológicos del LCR (antígeno de neumococo, Gram, cultivo, FilmArray®), antígeno de neumococo en orina, y tiempos desde la realización de la punción lumbar hasta la identificación del patógeno y su validación en la historia clínica electrónica. Cuando se realiza la identificación del patógeno, el Servicio de Microbiología comunica el resultado vía telefónica, pero ante la imposibilidad de medir estos tiempos se optó por considerar la identificación validada en la historia clínica que incluye el resultado del cultivo y el antibiograma.
FilmArray® (BioFire Diagnostics, LLC, Salt Lake City, UT, EEUU): El panel diagnóstico para meningitis/encefalitis utilizado es un sistema automatizado con técnica de PCR-múltiple, que permite la extracción y purificación de ácidos nucleicos microbianos a partir de una muestra de 200 µl de LCR. El panel incluye los patógenos más frecuentes para meningitis/encefalitis incluyendo virus, bacterias y levaduras hasta un total de 14 microorganismos. La técnica se realiza en una hora. Los patógenos incluidos en el panel son: Escherichia coli K1, H. influenzae, Listeria monocytogenes, N. meningitidis, Strepto-coccus agalactiae, S. pneumoniae, CMV, Enterovirus (EV), VHS-1, VHS-2, Herpesvirus humano 6 (VHH 6), Parechovirus humano (HPeV), Virus VVZ, y Cryptococcus neoformans/Cryptococcus gattii. Las muestras fueron procesadas de acuerdo con las recomendaciones del fabricante. Se determinó la sensibilidad, especificidad, valor predictivo positivo y negativo y eficiencia del test. Para S. pneumoniae se consideró el patrón oro el cultivo positivo y/o un antígeno de neumococo positivo en LCR u orina.
Análisis estadístico. Los datos fueron analizados me diante el programa Stata/IC 14 para Mac (StataCorp 2015. Stata Statistical Software: Release 14. College Station, TX: StatCorp LP). Estadística descriptiva, las variables cualitativas se expresan en frecuencia y porcentaje y las variables cuantitativas en media e intervalo de confianza de 95% o mediana y rango interquartílico (RIQ). Se comparan proporciones mediante Test Exacto de Fisher. Se considera significativo un resultado con p<0,05.
RESULTADOS
Se estudiaron 21 pacientes, 13 mujeres (61,9%) y 8 varones (38,1%). La mediana de edad fue de 58,4 años (RIQ 38,167,3), mediana de APACHE II de 18 (RIQ 12-24). La mediana de estancia en UCI fue de 4 días (RIQ 2-6) y la hospitalaria de 17 días (RIQ 14-28). La mortalidad en UCI fue de 9,5% y la hospitalaria 14,3%.
Con respecto a la sintomatología al ingreso, el síntoma más frecuente fue la fiebre (81%), seguido de cefalea (61,9%) y rigidez de nuca (52,4%). Presentaron deterioro del nivel de consciencia que precisó intubación traqueal y ventilación mecánica 13 pacientes (61,9%) y convulsiones 3 pacientes (14,3%). La mediana de ventilación mecánica fue de 42,3 horas (RIQ 28,6-141,2). Leucocitosis 12 pacientes (57,1%) y elevación de procalcitonina 14 casos (66,7%). Analítica de LCR: pleocitosis 90,5%, neutrofilia 14 (66,7%), hipoglucorraquia 13 (61,9%) y proteínas elevadas en 19 (90,5%). El antígeno de neumococo en LCR fue positivo en 5 de los 6 casos con FilmArray® positivo y en orina en 3 de 5 pacientes. Los resultados clínicos, bioquímicos y microbiológicos se pueden ver en la tabla 1. Los valores de sensibilidad, especificidad, valor predictivo positivo (VPP) y negativo (VPN) se muestran en la tabla 2, y se calcularon comparando los resultados con los obtenidos por el resto de técnicas microbiológicas. Este análisis se realizó sobre los 21 pacientes del estudio y también de forma específica sobre S. pneumoniae al ser el microorganismo más frecuente de la serie.
Tabla 1.
Resultados clínicos, bioquímicos y microbiológicos
| Nº | Sospecha clínica | Citoquímica LCR | Diagnóstico microbiológico | Tratamiento | Diagnóstico final | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Glucosa LCR (mg/dl) (ratio LCR/sangre) | Leucocitos LCR (mm3) (% Neutrófilos/ % Linfocitos) |
Hematíes LCR (mm3) | Proteínas LCR (mg/dl) | Tinción de Gram | Antígeno de neumococo LCR/orina | FilmArray® (horas)a | Cultivo (horas)a/PCR (in house) virus | Antibiótico empírico | Antibiótico tras FilmArray® | |||
| 1 | Alta | 2 (0,01) | 6.436 (96/4) | 1.000 | 820 | CG+ | No realizados | S. pneumoniae(2,1) | S. pneumoniae(86,4) | Cefotaxima Vancomicina | Cefotaxima Vancomicina | Meningitis neumocócica |
| 2 | Alta | 2 (0,01) | 209 (87/13) | 2.000 | 870 | CG+ | +/+ | S. pneumoniae(3,8) | S. pneumoniae(30,2) | Ampicilina Cefotaxima Vancomicina | Cefotaxima Vancomicina | Meningitis neumocócica |
| 3 | Baja | 108 (0,6) | 92(96/4) | 7 | 59 | Sin hallazgos | No realizados | Negativo (2,9) | Negativo (203,9) | Vancomicina Rifampicina Aciclovir | Vancomicina Rifampicina Aciclovir | Meningitis estéril Bacteriemia por Staphylococcusaureusfocoarticular |
| 4 | Alta | 2 (0,01) | 15.225(92/8) | 2.000 | 780 | Sin hallazgos | No realizados | H. influenzae(1,7) | H. Influenzae(58,7) | Ampicilina Ceftriaxona | Ampicilina Cefotaxima | Meningitis por H. influenzae |
| 5 | Alta | 2 (0,02) | 15.280(89/11) | 38 | 288 | CG+ | +/No realizado | S. pneumoniae(2,9) | Negativo (236,3) | Ampicilina Cefotaxima | Cefotaxima Vancomicina | Meningitis neumocócica |
| 6 | Alta | 68 (0,49) | 323(49/51) | 20 | 66 | Sin hallazgos | No realizados | Negativo (11,4) | Negativo (125,7) | No | Vancomicina Cefotaxima Aciclovir | Meningoencefalitis vírica |
| 7 | Alta | 2 (0,01) | 7.240(99/1) | 265 | 840 | CG+ | No realizado/+ | S. pneumoniae(2,3) | S. pneumoniae(42,3) | Ampicilina Ceftriaxona Vancomicina | Ceftriaxona Vancomicina | Meningitis neumocócica |
| 8 | Alta | 18 (0,15) | 1.524(99/1) | 144 | 211 | CG+ | +/+ | S. pneumoniae(2,1) | S. pneumoniae(48) | Ampicilina Ceftriaxona Vancomicina | Cefotaxima Vancomicina | Meningitis neumocócica |
| 9 | Baja | 78 (0,55) | 872(4/96) | 54 | Sin hallazgos | No realizados | Negativo (25,3) | Negativo (46,7) | Ampicilina Vancomicina Ceftriaxona Aciclovir | Ampicilina Vancomicina Ceftriaxona Aciclovir | Encefalomielitis aguda diseminada | |
| 10 | Baja | 49 (0,51) | 6 (-/-) | 3 | 58 | Sin hallazgos | No realizados | Negativo (1,9) | Negativo (130,5) | No | No | Hiponatremia grave |
| 11 | Baja | 65 (0,52) | 2 (-/-) | 3 | 45 | Sin hallazgos | No realizados | Negativo (2,9) | Negativo (161,4) | No | No | Crisis epiléptica |
| 12 | Baja | 58 (0,41) | 391 (51/49) | 9.000 | 671 | Sin hallazgos | No realizados | Negativo (17,3) | Negativo (279,4) | No | No | Parada cardiaca por hipopotasemia |
| 13 | Baja | 58 (0,52) | 143 (73/27) | 136 | 59 | Sin hallazgos | No realizados | Negativo (2,3) | Negativo (143,5) | Cefotaxima Vancomicina | Cefotaxima Vancomicina | Meningitis autoinmune |
| 14 | Alta | 19 (0,07) | 275(67/33) | 15.000 | 171 | BGN | No realizados | Negativo (8,6) | Escherichiacoli(31,7) | Meropenem Vancomicina | Meropenem Vancomicina | Meningitis postquirúrgica por Escherichia coli |
| 15 | Alta | 2 (0,01) | 2.090(85/15) | 250 | 470 | CG+ | +/+ | S. pneumoniae(3,9) | S. pneumoniae(37,9) | Ampicilina Ceftriaxona Vancomicina | Ceftriaxona Vancomicina | Meningitis neumocócica |
| 16 | Baja | 70 (0,58) | 72(28/72) | 9 | 51 | Sin hallazgos | No realizados | VHS1 (4,1) | VHS1 (33,2) | Aciclovir Ceftriaxona | Aciclovir | Encefalitis herpética |
| 17 | Alta | 2 (0,01) | 14.739(91/9) | 900 | 226 | Sin hallazgos | +/No realizado | S. pneumoniae(2,6) | Negativo (139,6) | Meropenem Vancomicina | Cefotaxima Vancomicina | Meningitis neumocócica |
| 18 | Baja | 38 (0,54) | 73(93/7) | 88.000 | 191 | Sin hallazgos | No realizados | Negativo (2,1) | Negativo (113,7) | Ampicilina Ceftriaxona Vancomicina Aciclovir | Ampicilina Ceftriaxona Vancomicina Aciclovir | Delirium. EPOC agudizado. |
| 19 | Alta | 5 (0,03) | 3.200(98/2) | 400 | 687 | Sin hallazgos | No realizado | S. pneumoniae(2,4) | Negativob(155,7) | Ceftriaxona Vancomicina | Ceftriaxona Vancomicina | Meningitis neumocócica |
| 20 | Baja | 57 (0,52) | 2 (-/-) | 4 | 21 | Sin hallazgos | -/- | S. pneumoniae(4,3) | Negativoc(109,5) | No | No | Trastorno psicótico |
| 21 | Alta | 5 (0,06) | 402(73/27) | 4.000 | 212 | Sin hallazgos | No realizados | L. monocytogenes(2,8) | L. monocytogenes(45,5) | Ampicilina Cefotaxima Vancomicina | Ampicilina Gentamicina | Meningitis por L. monocytogenes |
LCR: Líquido cefalorraquídeo. CG+: Cocos grampositivos. BGN: Bacilos gramnegativos. VHS1: Virus Herpes Simple 1.
aHoras desde la realización de la punción lumbar hasta el resultado del cultivo incluyendo antibiograma. bHemocultivos positivos para S. pneumoniae. c16S negativo
Tabla 2.
Rendimiento de las pruebas diagnósticas
| FilmArray® análisis global (21 pacientes) | FilmArray® análisis para Streptococcus pneumoniae | |
|---|---|---|
| Verdadero Negativo | 9 | 12 |
| Verdadero Positivo | 11 | 8 |
| Falso Positivo | 1 | 1 |
| Falso Negativo | 0 | 0 |
| Sensibilidad | 100% | 100% |
| Especificidad | 90% | 92,3% |
| Valor predictivo positivo | 91,7% | 90% |
| Valor predictivo negativo | 100% | 100% |
| Eficiencia del test | 95,2% | 95,5% |
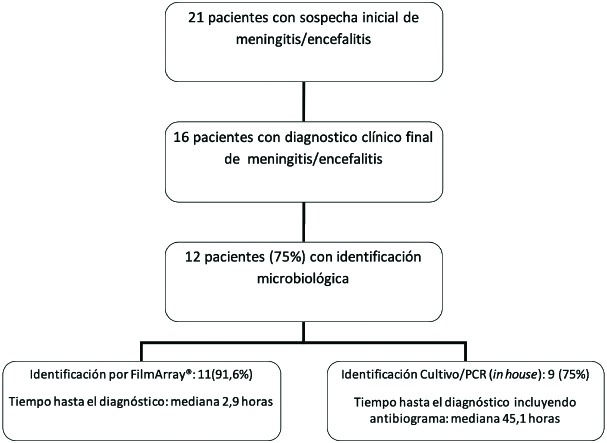
Basándose en la clínica y análisis citoquímico de LCR se estableció un diagnóstico de meningitis/encefalitis al alta hospitalaria en 16 pacientes, identificándose la etiología en 12 casos (75 %), 8 S. pneumoniae, 1 H. influenzae, 1 L. mono-cytogenes, 1 VHS1 y 1 E. coli (figura 1). De estos 12 pacientes, en 11 (91,6%) el diagnóstico se obtuvo por FilmArray® y en 9 (75%), por cultivo convencional (p=0,59) La mediana de tiempo hasta el diagnóstico por FilmArray®: fue de 2,9 horas (RIQ 2,3-4,1). La mediana para el diagnóstico mediante cultivo bacteriano positivo (incluyendo antibiograma) fue de 45,1 horas (RIQ 38,9-58,7). En los casos de cultivo negativo, la mediana se prolonga hasta 139,1 horas (RIQ 111,6-182,6). En el caso de encefalitis por VHS1 el tiempo hasta el diagnóstico definitivo por PCR in house fue de 33,2 horas. En nuestro estudio FilmArray® ha permitido modificar/desescalar el tratamiento antimicrobiano en 7 casos de los 16 pacientes con tratamiento empírico (43,8%). La sensibilidad de los microorganismos identificados fue la habitual en cada caso, sin identificar resistencias reseñables. En 5 pacientes con un microorganismo distinto a L. monocytogenes se suspendió el tratamiento con ampicilina. En el caso de meningitis por L. monocytogenes, se optimizó el tratamiento asociando gentamicina desde las primeras horas y suspendiendo cefotaxima y vancomicina y en el paciente nº 17 (ver tabla) se desescaló el tratamiento antibiótico de meropenem a cefotaxima. En el caso de la encefalitis por VHS1 la identificación permitió iniciar el tratamiento con aciclovir prescindiendo del tratamiento antibiótico innecesario.
Figura 1.
Flujo diagnóstico de los 21 pacientes ingresados en la Unidad de Cuidados Intensivos con sospecha de meningitis/encefalitis
DISCUSIÓN
En nuestro estudio FilmArray® se mostró superior al cultivo al diagnosticar 3 casos de meningitis neumocócica no identificadas por cultivo, aunque dado el escaso tamaño muestral, el resultado no es estadísticamente significativo (p=0,59). Nuestros resultados coinciden con la literatura, donde algunos autores refieren un aumento en la detección de agentes etiológicos cuando se asocian estos sistemas de PCR-múltiple a los métodos microbiológicos convencionales [17, 22] ya que su sensibilidad no se afecta por algunos factores como el uso previo de antimicrobianos [21]. También se ha demostrado que la identificación de patógenos mediante el uso de técnicas de PCR-múltiple es superior a la detección por tinción de Gram [23], hallazgo que hemos confirmado en nuestro estudio (11 casos diagnosticados versus 7 mediante tinción de Gram).
FilmArray® identificó todos los microorganismos aislados por cultivo excepto en el caso del paciente nº 14 que se trataba de una meningitis nosocomial postquirúrgica por E. coli. El panel incluye exclusivamente patógenos comunitarios como el E. coli, serotipo K1. Dado que se trataba de una infección nosocomial postquirúrgica, al no ser identificado, deducimos que se trataba de otro serotipo y aunque esta hipótesis no fue confirmada, no fue considerado un falso negativo de la técnica [11]. Para el diagnóstico de meningitis nosocomial este panel comercial no es adecuado y en estos casos estaría indicado utilizar otro tipo de panel que incluya patógenos hospitalarios. Hay que tener en cuenta, por lo tanto, que la obtención de un resultado negativo no excluye la infección ya que el patógeno puede no estar incluido en el panel.
Respecto a los falsos positivos, aunque la detección teóricamente es muy específica al registrar secuencias propias del genoma de cada microorganismo, se han descrito falsos positivos para S. pneumoniae y Cryptococcus spp. en FilmArray® [15, 19, 24]. En el caso de S. pneumoniae se atribuye a una posible contaminación de la muestra por los profesionales que realizan la punción lumbar o durante el procesamiento en el laboratorio. Otra de las razones por las cuales podrían existir falsos positivos es por problemas inherentes a las técnicas PCR. En nuestra serie, el paciente nº 20 que tenía baja sospecha clínica, cultivo y antígeno de S. pneumoniae negativo en LCR/orina y 16S negativo, fue positivo para S. pneumoniae siendo considerado el único caso falso positivo de la serie. Otros pacientes con PCR positiva para neumococo y cultivo negativo, se consideraron falsos negativos del cultivo en base a una sospecha clínica alta y confirmación por otros métodos microbiológicos (antígeno o hemocultivos).
A pesar del bajo número de casos, para los tres pacientes con aislamiento de L. monocytogenes, H. influenzae y VHS1, la concordancia entre la PCRmúltiple y el cultivo/PCR (in house) fue del 100%. En nuestro estudio, para la totalidad de pacientes, FilmArray® presentó una sensibilidad y especificidad del 100% y 90% respectivamente, datos concordantes con los obtenidos por otros autores [15, 19]. Dada su elevada sensibilidad, estas técnicas pueden mostrar resultados inesperados que no concuerden con la clínica. Para interpretar adecuadamente los resultados y realizar un correcto juicio clínico es necesario un buen intercambio de información con el Servicio de Microbiología [18]. En el caso de los virus hay que tener en cuenta que la técnica detecta su presencia, pero no distingue entre la forma de infección latente y activa de CMV y VHH-6 por lo que su detección puede indicar infección primaria, reactivación secundaria o simplemente presencia de virus latente. Los resultados deben interpretarse en conjunto con otros datos clínicos, epidemiológicos y de laboratorio.
Uno de los aspectos más interesantes a destacar con este tipo de técnicas es la rapidez del diagnóstico. El tiempo de realización de la prueba es de 1 hora y algunos autores han estimado un tiempo de 3 horas desde el transporte de la muestra hasta la información al clínico [24, 25], lo que concuerda con los resultados de nuestro estudio donde obtenemos una mediana de 2,9 horas desde la punción lumbar hasta el diagnóstico con PCR-múltiple versus 45,1 horas con el cultivo bacteriano (incluyendo antibiograma).
La identificación del patógeno permite desescalar antibióticos y optimiza el tratamiento dirigido, algo imprescindible para disminuir morbimortalidad, estancia hospitalaria, efectos secundarios, multirresistencias y costes sanitarios [26]. En nuestro estudio la utilización del sistema de PCR-múltiple permitió modificar/ desescalar el tratamiento antimicrobiano en el 43,8% de los 16 pacientes con tratamiento empírico. Por otra parte, la identificación microbiológica en las meningitis tiene importantes implicaciones en salud pública sobre todo en el caso de las meningitis por meningococo, donde es imperativo la profilaxis en el entorno del paciente [22], en este caso, la identificación precoz puede evitar un uso innecesario de la profilaxis.
Nuestro estudio tiene algunas limitaciones, es una serie pequeña con pocos pacientes con detección positiva lo que impide realizar un análisis de impacto sobre el consumo de antibióticos, estancia media y mortalidad.
Los sistemas de PCR-múltiple están cambiando el abordaje diagnóstico en el Servicio de Microbiología consiguiendo un diagnóstico seguro, rápido, fácil de realizar y accesible 24/365. Estos sistemas deberían realizarse, siguiendo las recomendaciones descritas en la literatura, en pacientes con sospecha clínica de meningitis/encefalitis, especialmente en aquellos que hayan recibido antibióticos, inmunodeprimidos y/o con celularidad del LCR alterada [18, 21]. Uno de los inconvenientes de la PCRmúltiple es su elevado coste, pero considerando que el número de determinaciones al año es escaso y que su utilización permite iniciar precozmente un tratamiento antimicrobiano dirigido, algo esencial en el manejo de enfermedades infecciosas graves, hace recomendable su incorporación a la cartera de servicios de Microbiología. A la vista de nuestros resultados, podemos concluir que este sistema es un método asequible, rápido con alta sensibilidad y especificidad lo que lo hace especialmente atractivo para su uso en el paciente crítico. Serán necesarios más estudios para valorar adecuadamente estos sistemas de PCR múltiple, pero parece que es tiempo de cambio.
FINANCIACIÓN
Los autores declaran no haber recibido financiación para la realización de este estudio
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
BIBLIOGRAFÍA
- 1.Brouwer MC, Tunkel AR, van de Beek D. Epidemiology, diagnosis, and antimicrobial treatment of acute bacterial meningitis. Clin Mi-crobiol Rev 2010;23:467-92. DOI: 10.1128/CMR.00070-09. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Blanquer J, Solé-Violán J, Carvajal J, Lucena F. Infecciones comuni-tarias que requieren ingreso en UCI. Med Intensiva. 2010; 34:388-96. 10.1016/j.medin.2010.03.003. [DOI] [PubMed] [Google Scholar]
- 3.Spanos A, Harrell FE Jr, Durack DT. Differential diagnosis of acute meningitis. An analysis of the predictive value of ini-tial observations. JAMA 1989;262:2700-07. DOI: 10.1001/jama.1989.03430190084036 [DOI] [PubMed] [Google Scholar]
- 4.Nesher L, Hadi CM, Salazar L, Wootton SH, Garey K, Lasco T et al. Epidemiology of meningitis with a negative CSF Gram stain: under-utilization of available diagnostic tests. Epidemiol Infect. 2016;144:189-97. DOI: 10.1017/S0950268815000850 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Pulido MR, Moreno-Martínez P, González-Galán V, Fernández Cuenca F, Pascual Á, Garnacho-Montero J et al. Application of the BioFire FilmArray Blood Culture Identification Panel for Rapid Identification of the Causative Agents of Ventilator Associated Pneumonia. Clin Microbiol Infect. 2018;S1198-743X(18)30460-9. DOI: 10.1016/j.cmi.2018.06.001 [DOI] [PubMed] [Google Scholar]
- 6.López-Fabal MF, Gómez-Garcés JL, López Lomba M, Ruiz Bastián M. Evaluation of a PCR-multiplex technique for the rapid diagnosis of bacteriemia. Rev Esp Quimioter. 2018;31:263-67. PMid: [PMC free article] [PubMed] [Google Scholar]
- 7.Kaku N, Hashiguchi K, Iwanaga Y, Akamatsu N, Matsuda J, Kosai K, et al. Evaluation of FilmArray respiratory panel multiplex polymerase chain reaction assay for detection of pathogens in adult out-patients with acute respiratory tract infection. J Infect Chemother. 2018;24(9):734-38. DOI: 10.1016/j.jiac.2018.05.006 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Calderaro A, Martinelli M, Buttrini M, Montecchini S, Covan S, Ros-si S et al. Contribution of the FilmArray® Gastrointestinal Panel in the laboratory diagnosis of gastroenteritis in a cohort of children: a two-year prospective study. Int J Med Microbiol. 2018;308:514-21. DOI: 10.1016/j.ijmm.2018.04.007 [DOI] [PubMed] [Google Scholar]
- 9.Meyers L, Ginocchio CC, Faucett AN, Nolte FS, Gesteland PH, Leber A. Automated Real-Time Collection of Pathogen-Specific Diag-nostic Data: Syndromic Infectious Disease Epidemiology. JMIR Public Health Surveill. 2018;4:e59 10.2196/publichealth.9876 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Altun O, Almuhayawi M, Ullberg M, Ozenci V. Rapid identification of microorganisms from sterile body fluids by use of FilmArray. J Clin Microbiol 2015;53:710-2. DOI: 10.1128/JCM.03434-14 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Liesman RM, Strasburg AP, Heitman AK, Theel ES, Patel R, Binnicker MJ. Evaluation of a Commercial Multiplex Molecular Panel for Diagnosis of Infectious Meningitis and Encephalitis. J Clin Microbiol. 2018;56: e01927-17. DOI: 10.1128/JCM.01927-17 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Chang D, Okulicz JF, Nielsen LE, White BK. A Tertiary Care Center’s Experience with Novel Molecular Meningitis/Encephalitis Diagnos-tics and Implementation with Antimicrobial Stewardship. Mil Med. 2018;183:e24-e27. DOI: 10.1093/milmed/usx025 [DOI] [PubMed] [Google Scholar]
- 13.Launes C, Casas-Alba D, Fortuny C, Valero-Rello A, Cabrerizo M, Muñoz-Almagro C. Utility of FilmArray Meningitis/Encephalitis Panel during Outbreak of Brainstem Encephalitis Caused by En-terovirus in Catalonia in 2016. J Clin Microbiol. 2016;55:336-38. DOI: 10.1128/JCM.01931-16 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Soucek DK, Dumkow LE, VanLangen KM, Jameson AP. Cost Jus-tification of the BioFire FilmArray Meningitis/Encephalitis Panel Versus Standard of Care for Diagnosing Meningitis in a Com-munity Hospital. J Pharm Pract. 2017;1:897190017737697 DOI: 10.1177/0897190017737697 [DOI] [PubMed] [Google Scholar]
- 15.Leber AL, Everhart K, Balada-Llasat JM, Cullison J, Daly J, Holt S,et al. Multicenter Evaluation of BioFire FilmArray Meningitis/Encephalitis Panel for Detection of Bacteria, Viruses, and Yeast in Cerebrospinal Fluid Specimens. J Clin Microbiol. 2016;54:2251-61. DOI: 10.1128/JCM.00730-16 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Naccache SN, Lustestica M, Fahit M, Mestas J, Dien Bard J. One Year in the Life of a Rapid Syndromic Panel for Meningitis/Encephali-tis: a Pediatric Tertiary Care Facility’s Experience. J Clin Microbiol. 2018;56(5): e01940-17. DOI: 10.1128/JCM.01940-17 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Conca N, ME Santolaya, MJ Farfan, F Cofré, Vergara A, Salazar L, et al. Diagnóstico etiológico en meningitis y encefalitis por técnicas de biología molecular Rev Chil Pediatr.2016;87:24-30. DOI: 10.1016/j.rchipe.2015.07.024 [DOI] [PubMed] [Google Scholar]
- 18.Hanson KE. The first fully automated molecular diagnostic panel for meningitis and encephalitis: how well does it perform, and when should it be used ? J Clin Microbiol. 2016;54:2222-24. DOI: 10.1128/JCM.01255-16 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Reyes M, Torres J, Prado V, Vidal R. Diseño y evaluación de una reac-ción de polimerasa en cadena (RPC) múltiple, para la identificación de bacterias causantes de meningitis aguda en líquido cefalorra-quídeo de niños chilenos. Rev Med Chil. 2008;136(3):338-46. DOI: 10.4067/S0034-98872008000300009 [DOI] [PubMed] [Google Scholar]
- 20.Rhein J, Bahr NC, Hemmert AC, Cloud JL, Bellamkonda S, Oswald C, et al. Diagnostic performance of a multiplex PCR assay for meningitis in an HIV-infected population in Uganda. Diagn Microbiol Infect Dis. 2016; 84:268-73. DOI: 10.1016/j.diagmicrobio.2015.11.017 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Codina MG, de Cueto M, Echevarría J E, Prats G. Diagnóstico microbiológico de las infecciones del sistema nervioso central. Enferm Infecc Microbiol ClIn. 2011;29:127-34. DOI: 10.1016/j.eimc.2010.10.003 [DOI] [PubMed] [Google Scholar]
- 22.Van de Beek D, Cabellos C, Dzupova O, Esposito S, Klein M, Kloek T et al. ESCMID guideline: Diagnosis and treatment of acute bacterial meningitis. Clin Microbiol Infect. 2016;22:S37-S62. DOI: 10.1016/j.cmi.2016.01.007 [DOI] [PubMed] [Google Scholar]
- 23.Wootton SH, Aguilera E, Salazar L, Hemmert AC, Hasbun R. En-hancing pathogen identification in patients with meningitis and a negative Gram stain using the BioFire FilmArray® Meningitis/ Encephalitis panel. Ann Clin Microbiol Antimicrob. 2016;15:26 DOI: 10.1186/s12941-016-0137-1 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Blaschke AJ, Holmberg KM, Daly JA, Leber AL, Bard JD, Korgenski EK et al. Retrospective Evaluation of Infants Aged 1-60 Days With Residual CSF Tested Using the FilmArray® Meningitis/Encephalitis (ME) Panel. J Clin Microbiol. 2018;56:e00277-18. DOI: 10.1128/JCM.00277-18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Messacar K, Breazeale G, Robinson CC, Dominguez SR. Potential clinical impact of the film array meningitis encephalitis panel in children with suspected central nervous system infections. Diagn Microbiol Infect Dis. 2016;86:118-20. DOI: 10.1016/j.diagmicro-bio.2016.05.020 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Pardo J, Klinker KP, Borgert SJ, Butler BM, Giglio PG, Rand KH. Cli-nical and economic impact of antimicrobial stewardship interven-tions with the FilmArray blood culture identification panel. Diagn Microbiol Infect Dis. 2016;84:159-64. DOI: 10.1016/j.diagmicro-bio.2015.10.023 [DOI] [PubMed] [Google Scholar]