Abstract
There is now overwhelming experimental and clinical evidence that atherosclerosis is a chronic inflammatory disease. Lessons from genome-wide association studies, advanced in vivo imaging techniques, transgenic lineage tracing mice, and clinical interventional studies have shown that both innate and adaptive immune mechanisms can accelerate or curb atherosclerosis. Here, we summarize and discuss the pathogenesis of atherosclerosis with a focus on adaptive immunity. We discuss some limitations of animal models and the need for models that are tailored to better translate to human atherosclerosis and ultimately progress in prevention and treatment.
Keywords: atherosclerosis, immunity, inflammation, myeloid cells, vaccination
Zusammenfassung
Solide experimentelle und klinische Evidenz zeigt, dass Arteriosklerose eine chronisch-entzündliche Erkrankung ist. Genomweite Assoziationsstudien (GWAS), bildgebende Verfahren, transgene Mausmodelle und klinische Interventionsstudien zeigen, dass sowohl das angeborene als auch das adaptive Immunsystem Arteriosklerose beschleunigen oder verlangsamen können. In diesem Beitrag fassen wir die Pathogenese der Arteriosklerose zusammen und diskutieren besonders die Rolle des adaptiven Immunsystems. Wir beleuchten einige Einschränkungen von Tiermodellen und betonen die Notwendigkeit, Modelle zu entwickeln, deren Ergebnisse besser auf den Menschen übertragen werden können und letztendlich zu Fortschritten in der Prävention und Behandlung der Arteriosklerose führen.
Keywords: Arteriosklerose, Immunität, Entzündung, myeloide Leukozyten, Impfung
Arteriosklerose ist die häufigste pathologische Ursache für koronare Herzkrankheit, periphere Arterienerkrankung und Hirnarterienerkrankung (1,2). Das chronische Wachstum gefäßverengender Plaques in der subendothelialen Neointima von großen und mittelgroßen Arterien führt letztendlich zu erheblichen Stenosen, die die Durchblutung vermindern und kritische Gewebehypoxie verursachen (3). Die häufigsten Komplikationen, Herzinfarkte und Schlaganfälle, werden von spontganen thrombotischen Gefäßverschlüssen verursacht und stellen zusammen die weltweit häufigste Todesursache dar (4,5). Die gegenwärtigen klinischen Leitlinien konzentrieren sich auf die Behandlung dieser Komplikationen (6). Klinische Therapieansätze, die das Fortschreiten der Arteriosklerose verhütenoader verlangsamen, sind auf Medikamente beschränkt, die LDL (low density lipoprotein) Cholesterin senken. Früher wurde Arteriosklerose als eine Erkrankung der Cholesterinablagerung durch Zurückhalten von LDL und anderen Lipoproteinen in der Neointima angesehen. LDL in der Gefäßwand wird verändert und dann von Scavenger-Rezeptoren erkannt und aufgenommen. Dieser Vorgang führt zu kontinuierlichem Wachstum der fett- und leukozytenreichen Infiltrate, die makroskopisch als Plaques erscheinen. Plasmakonzentrationen von Cholesterin, LDL Cholesterin und Apolipoproteinen einschließlich Apolipoprotein B (ApoB) sind stark mit klinischer Arteriosklerose korreliert (7,8). Maus- und andere Tiermodelle zeigen Hinweise auf einen ursächlichen Zusammenhang: erhöhte Plasmacholesterinkonzentrationen durch genetische Nullmutationen der LDL-Rezeptor (LDLR) oder Apolipoprotein-E-Gene in Mäusen verursacht Atherosklerose in dem C57BL/6-Mausstamm, der normalerweise keine spontane Arteriosklerose entwickelt (9,10). Genomweite Assoziationsstudien (GWAS) korelieren viele Einzelbasen-Polymorphismen (SNPs) in oder in der Nähe von Genen, die für lipidrelevante Proteine kodieren. LDLR, APOB und Proprotein Konvertase Subtilisin/Kexin Typ 9 (PCSK9) beeinflussen LDL-Cholesterinwerte und sind Risikofaktoren für Arteriosklerose und Herzinfarkte (11, 12). Arteriosklerose wird von einer chronischen, schwelenden Entzündungsreaktion begleitet, die Leukozyten des angeborenen und des adaptiven Immunsystems anzieht. Diese Leukozyten und Makrophagen wandern in die Plaques ein (3), und manche erkennen ApoB, das Hauptlipoprotein von LDL. Wir haben daher Arteriosklerose als eine chronisch-entzündliche Erkrankung mit einer Autoimmunkomponente klassifiziert (13). Diese Autoimmunantwort manifestiert klinisch am besten in Antikörpern gegen LDL und andere Arteioskleroseantigene sichtbar, die in allen Patienten und Tiermodellen nachweisbar sind. Viele Studien zeigen, dass niederaffine „natürliche” IgM-Antikörper gegen Oxidationsepitope im LDL negativ mit Arteriosklerose korrelieren, während hochaffine IgG-Antikörper positiv korrelieren (14). In diesem Beitrag fassen wir die adaptiven Immunmechanismen, die mit Arteriosklerose einhergehen und den Krankheitsverlauf modifizieren, zusammen.
LDL-Akkumulation löst die Entzündung der Gefäßwand aus
Arteriosklerose beginnt mit der Akkumulation von einigen Plasmalipoproteinen in der subendothelialen Intima in Gefäßbereichen mit gestörtem Blutflussmuster und endothelialer Dysfunktion. Dies ist am besten für LDL dokumentiert, dessen Akkumulation mit klassischen Risikofaktoren wie Rauchen, Bluthochdruck, metabolische Dysregulation bei Fettleibigkeit und Diabetes mellitus korreliert (15). In der Neointima wird LDL durch reaktive Sauerstoffderivative oxidiert, und dieses oxidierte LDL (oxLDL) wird dann von Makrophagen aufgenommen (16). oxLDL selbst löst weitere Entzündung der Arterienwand aus, indem es an TLR (Toll-like receptors) bindet, die zu den weitverbreiteten PRRs (pattern recognition receptors) gehören und entzündungsfördernde Signale auslösen (18). Makrophagen können auch unverändertes LDL durch Mikropinozytose oder in aggregierter Form als Cholesterinkomplexe oder Cholesterinkristalle durch Phagozytose aufnehmen. Die anhaltende Zufuhr von Cholesterin übersteigt irgendwann die metabolische Kapazität der Phagozyten, und es bilden sich intrazelluläre Fetttröpfchen. Solche cholesterinbeladenen Makrophagen imponieren mikroskopisch als Schaumzellen. Wahrscheinlich ruft die Cholesterinakkumulation eine Antwort der myeloiden Leukozyten hervor, die mit Zytokinsekretion, Makrophagenproliferation in situ und der Rekrutierung von myeloiden Leukozyten aus dem Blut einhergeht (20). Eine klinisch relevante Folge der Cholesterinakkumulation ist die Bildung von intrazellulären Cholesterinmikrokristallen, die das Inflammasom aktivieren, ein molekularer Komplex der NLRP3 (nucleotide binding domain and leucine-rich repeat) Familie, der Pro-Interleukin-1β in die aktive Form spaltet. IL-1β ist ein Hauptzytokin der Entzündung, das die Expression vieler proinflammatorischer Zytokine und auch CRP (C-reaktives Protein) verstärkt (22). Verminderte Cholesterinakkumulation oder erhöhter Cholesterinefflux kann die Entzündung im Plaque vermindern und sogar Plaqueregression bewirken (23). Die myeloide Antwort ist vom Einwandern von B- und T-Lymphozyten des adaptiven Immunsystems begleitet (24–25). Der Gehalt an myeloiden Leukozyten und Lymphozyten im Plaque korreliert mit klinischen Komplikationen und scheint den Patienten für spätere thromboembolische Ereignisse zu prädestinieren, die oft von unstabilen Plaques mit massiven Entzündungszellinfiltraten und dünner fibrotischer Kappe ausgehen (26,27).
Die Autoimmunantwort in der Arteriosklerose
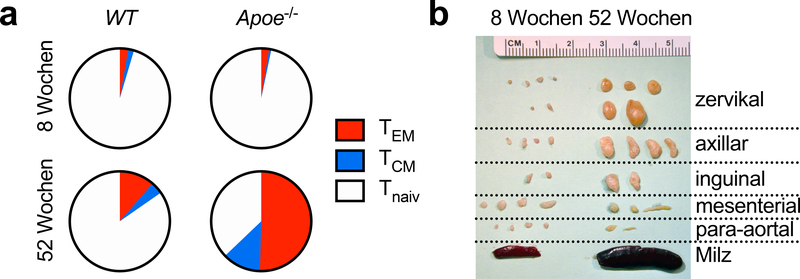
Nach der Entdeckung von T- und B-Lymphozyten in Plaques (28) wurde die Hypothese entwickelt, dass Arteriosklerose von einer Autoimmunantwort begleitet wird. Die adaptive Immunantwort bei Infektionen und Autoimmunität hat einen humoralen Arm, in dem Plasmazellen spezifische Antikörper gegen Antigen(e) produzieren, und einen zellulären Arm, in dem T-Lymphozyten einerseits B-Lymphozyten durch Kostimulation aktivieren und andererseits selbst in Effektor-T-Lymphozyten differenzieren, die pro- oder anti-inflammatorische Zytokine produzieren können (29). CD4- und CD8-T-Lymphozyten können nur dann eine Immunantwort auslösen, wenn die antigenen Peptide von MHC (Major Histocompatbility Complex)-I auf allen kernhaltigen Zellen beziehungsweise MHC-II auf antigenpräsentierenden Zellen (APCs) präsentiert werden. Die Immunantwort der T-Lymphozyten ist daher MHC-beschränkt, das heißt, eine Immunantwort erfolgt nur in Personen, die Versionen der MHC-Moleküle ausbilden, die die relevanten Peptidepitope binden können. Die Bindung eines spezifischen T-Zellrezeptors (TCR) und kostimulatorischer Moleküle von APCs aktiviert T-Lymphozyten und induziert ihre klonale Proliferation (30). In Mausmodellen der Arteriosklerose hat Zweiphotonenmikroskopie gezeigt, dass die Rate der Interaktionen zwischen CD4-T-Lymphozyten und APCs spezifisch durch Hypercholesterinämie gesteigert wird und zur Sekretion proinflammatorischer Zytokine führt (31). Diese Helfer-T-Lymphozyten zeigen verstärkte Reifung zu Effektor-Gedächtniszellen (TEM) und zentralen Gedächtniszellen (TCM) in Lymphknoten (Abb. 1A) und in arteriosklerotischen Plaques (28, 31). TCR-Sequenzierung zeigt, dass die T-Lymphozyten im Plaque oligoklonal sind (32, 33), was bedeutet, dass einige antigenspezifische T-Lymphozytenklone in Plaque aktiv proliferieren. Die verstärkte Aktivierung der T-Lymphozyten in älteren Apoe−/−-Mäusen wird von einer Schwellung der die arteriosklerotische Aorta drainierenden Lymphknoten begleitet (Abb. 1B). Die lokale und systemische Entzündungsantwort wird außerdem durch eine Hypercholesterinämie-erzeugende Ernährung verstärkt (34–36). Diese Befunde bestärken die Hypothese, dass bei Arteriosklerose spezifische Antigene die adaptive Immunantwort in der Aorta und den Lymphknoten hervorrufen.
Abb. 1:
Die Aktivierung von T-Zellen ist ein Kennzeichen der Arteriosklerose. A: Bei der Fütterung mit einer westlichen Diät (WD) bauen CD4+-T-Helferzellen aus arteriosklerosegefährdeten Apoe−/−-Mäusen ein signifikantes Immungedächtnis auf, wobei mehr als die Hälfte der T-Zellen die Marker CD62L− CD44+ für T-Effektor-Gedächtniszellen (TEM) und CD62L+ CD44+ für zentrale Gedächtniszellen (TCM) im Vergleich zu arteriosklerosefreien Wildtyp-(WT)-Mäusen exprimieren. B: Neben einer erhöhten T-Lymphozytenaktivierung nimmt die Größe der Lymphknoten, die die Aorta und die supra-aortalen Arterien (Halswirbelsäule, Achsellymphknoten) entwässern, massiv zu. Apoe: Apolipoprotein E
LDL: Ein Autoantigen im Plaque
Unter allen Kandidaten, die als B- und T-lymphozytenaktivierende Antigene in Frage kommen, zeigt LDL im Blutplasma und sein Hauptlipoprotein ApoB die stärkste klinische und kausale Verbindung mit Arteriosklerose beim Menschen (37). ApoB-enthaltende triglyzeridreiche Remnant-Partikel zeigen auch eine starke Korrelation mit kardiovaskulären Erkrankungen, Entzündung und Immunität (7). LDL als Autoantigen bei Arteriosklerose wurde schon 1959 von Gero et al. (38) entdeckt. Impfung von arterioskleroseanfälligen Kaninchen mit LDL verminderte die Arteriosklerose, was heißt, dass die Autoimmunantwort gegen LDL schützend wirken kann (39). Beim Menschen sind viele CD4-T-Lymphozyten im Plaque spezifisch für oxLDL (40) und binden an Peptidepitope von ApoB, die von MHC-Molekülen präsentiert werden (41, 42). Tetramere rekombinanter MHC-Moleküle, mit ApoB-Peptid beladen, können antigenspezifische Helfer-T-Lymphozyten in vivo identifizieren (43). Solche Tetramere markieren eine natürliche Population von CD4-Lymphozyten im menschlichen Blut, die spezifisch an das ApoB3036–3050 Peptid binden (42). Im Plasma arteriosklerotischer Patienten werden regelmäßig IgG-Antikörper gegen LDL, oxLDL und ApoB gefunden (42). Diese Befunde zeigen, dass LDL ein relevantes Autoantigen ist, das die Autoimmunantwort gegen Eigenproteine im arteriosklerotischen Plaque antreibt. Neben LDL und ApoB wurde auch gezeigt, dass HSPs (Heat Shock Proteins, 45–47) und einige Peptide von Pathogenen wie Zytomegalievirus (CMV), Hepatitis C virus (HCV), humanem Papillomviurus (HPV) und anderen arterioskleroserelevante Antigene sein könnten (48–50).
Helfer T-Lymphozyten-abhängige Immunität bei Arteriosklerose
Frühe immunhistochemische Befunde (28–51) und neue Daten von Einzelzell-RNA-Sequenzierungsexperimenten (24, 52) und massenspektrometrische Durchflusszytometrie (CyTOF, 24, 53) haben gezeigt, dass etwa 25 bis 35% aller Leukozyten in arteriosklerotischen Plaques von Mäusen und Menschen CD3+-T-Lymphozyten sind, wobei CD4-Helfer-T-Lymphozyten etwa 10% ausmachen. Die T-Lymphozyten werden bevorzugt in der fibrotischen Kappe arteriosklerotischer Plaques gefunden (28, 51), aber auch in der Adventitia älterer Läsionen (24, 54). Ihre Migration in den Plaque erfordert den Chemokinrezeptor CCR5 (C-C Chemokinrezeptor Typ 5), CXCR6 (C-X-C Chemokinrezeptor Typ 6) und andere Moleküle (55, 56). CD4-T-Lymphozyten sind entscheidend für die Regulierung der adaptiven Immunantwort und könnne in verschiedene Helfer-T-Lymphozytentypen differenzieren. Diese können einerseits die Immunantwort dämpfen oder andere T-Lymphozyten aktivieren, können entzündungsfördernde oder entzündungshemmende Effekte auf Gewebszellen haben, können B-Lymphozyten helfen, hochaffine IgG-Antikörper zu produzieren, oder können selbst zytolytisch sein (29, Abb. 2). Somit sind die Funktionen der Helfer-T-Lymphozyten facettenreich und hängen von den spezifischen Transkriptions- und Zyotokinsekretionsprogrammen ab, die die Arteriosklerose beschleunigen oder hemmen können. Frühe Experimente mit Rag1-defizienten Mäusen, die weder reife T- noch B-Lymphozyten produzieren können, zeigten eine pathogene Rolle der T- und B-Lymphozyten nur in der frühen Arteriosklerose bei mäßig erhöhten Cholesterinwerten, aber nicht in schwer hypercholestinämischen Apoe−/−-Mäusen (57, 58). Genetischer Mangel von T-Lymphozyten in athymischen nu/nu-Mäusen oder Depletion von CD4-T-Lymphozyten mittels CD4-Antikörper zeigte verminderte Entwicklung arteriosklerotischer Plaques (59). Nachdem APCs den T-Lymphozyten im Plaque spezifische Antigene präsentieren, differenzieren diese in funktionell unterschiedliche Untergruppen: Helfer Typ (TH) 1, 2 oder 17, regulatorische T-Lymphozyten (Treg), oder Typ1 regulatorische (TR1) Lymphozyten (60). Arteriosklerose wird als TH1 Erkrankung angesehen. Viele der CD4-T-Lymphozyten im Plaque sind entzündungsfördernd und produzieren die TH1-Zytokine Interferon-γ, IL-2, IL-3, TNF (Tumornekrosefaktor) und Lymphotoxin (LT), die Makrophagen, andere T-Lymphozyten und andere Zellen im Plaque aktivieren können und damit die Entzündungsantwort verschlimmern (61). T-Lymphozyten in Lymphknoten, die den Chemokinrezeptor CCR5 exprimieren, und T-Lymphozyten in arteriosklerotischen Plaques sezernieren Interferon-γ und exprimieren den TH1-definierenden Transkriptionsfaktor T-bet (55, 62). Entfernung von Interferon-γ, seinem Rezeptor, oder T-bet schützt die jeweiligen genetisch manipulierten Mäuse gegen Arteriosklerose (63–65). IFN-γ kann die Plaquestabilität direkt reduzieren, indem es die Proliferation glatter Muskelzellen hemmt (66), Makrophagen polarisiert, und kardiovaskuläre Risikofaktoren beeinflusst (67). Andererseits schützen regulatorische T-Lymphozyten (Tregs), die den Transkriptionsfaktor FoxP3 und den hochaffinen IL-2-Rezeptor CD25 exprimieren, vor Arteriosklerose. Tregs üben diese antiarteriosklerotischen Effekte durch Sekretion des entzündungshemmenden Zytokins IL-10 (70) und des plaquestabilisiernden Zytokins TGF-β (transforming growth factor-β, 71) sowie durch die Unterdrückung der Proliferation der entzündungsfördernden Effektor-T-Lymphozyten (72) aus. Anti-arteriosklerotische Effekte von Injektion von IL-2-Komplexen (73) oder Antikörpern gegen CD3 (74, 75) werden einer relative Zunahme von Tregs zugeschrieben. IL-10 wird auch von TR1-Lymphozyten sezerniert, die kein FoxP3, aber CD49b und Lag-3 exprimieren; dies kann Arteriosklerose vermindern (76, 77). In arteriosklerotischen Plaques exprimieren viele T-Lymphozyten mRNA für die TH2-Zytokine IL-4, IL-5 und IL-13 (24). Im Gegensatz zum abdominalen Aortenaneurysma, das als TH2-Krankheit angesehen wird (78), und der negative Korrelation zwischen IL-4 und Arteriosklerose, ist die Rolle der TH2-Lymphozyten in der Ateriosklerose unklar. Das TH2-Zytokin IL-4 blockiert TH1-Reaktionen. Injektion von IL-4 führte zu verminderten Plaques in einer Studie (80), aber in einer anderen Studie schützte Depletion von IL-4 vor Arteriosklerose (81). Die Rolle von TH17-Lymphozyten bei Arteriosklerose ist ebenfalls kontrovers: Genetische Deletion oder Neutralisierung des TH17-Zytokins IL-17 schützte vor Arteriosklerose (82–84), während andere Studien fanden, dass TH17-Lymphozyten einen stabileren Plaquephänotyp begünstigten und vor Arteriosklerose schützten (85–87). Follikuläre Helfer-T-Lymphozyten (TFH), die nötig sind, um B-Lymphozyten zum Wechsel der Immunglobulinproduktion von IgM zu IgG zu veranlassen, könnten proarteriosklerotisch sein (88) oder könnten vor Arteriosklerose schützen, indem sie die Produktion von Antikörpern veranlassen, die LDL oder ApoB senken oder neutralisieren (89). Die unterschiedlichen Befunde der verschiedenen Studien könnten auf unterschiedlicher, aber unbekannter Antigenspezifität der T-Lymphozyten beruhen. Es ist bemerkenswert, dass Antigenpräsentation die CD4-Helfer-Lymphozytenantwort bei Arteriosklerose sowohl induzieren als auch begrenzen kann. Die antigenspezifische T-Lymphozytenaktivierung erfolgt ausschließlich durch APCs, die Peptidantigene in MHC-Molekülen präsentieren (29). Wenn MHC-II während der Kostimulation oder auf den APCs blockiert wird, erfolgt keine CD4-T-Lymphozytenantwort (31, 90). Die T-Lymphozytenantwort beginnt typischerweise, wenn antigenbeladene dendritische Zellen in Lymphknoten erscheinen. Mehrere Zelltypen im Plaque können als APCs für Restimulation von antigenerfahrenen und Gedächtnis-T-Lymphozyten dienen: Makrophagen im Plaque, B-Lymphozyten in der Adventitia und konventionelle und plasmazytoide dendritische Zellen. Die Immunantwort kann tolerogen (immunsuppressiv) oder immunogen sein, was von der Natur der kostimulatorischen Moleküle und der von den APCs sezernierten Zytokinen abhängt (91, 92).
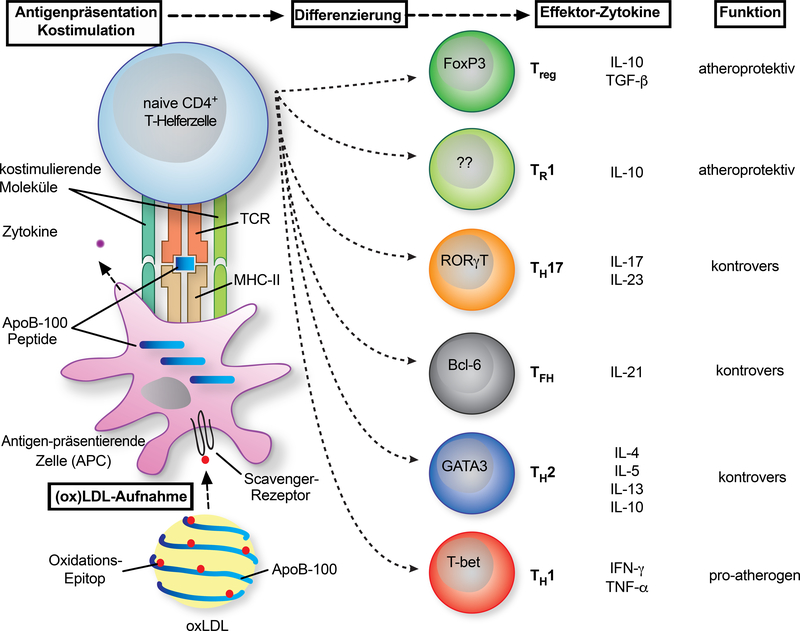
Abb. 2:
T-Zell-Polarisierung bei Arteriosklerose. Naive T-Helferzellen (TH) differenzieren zu Effektor-T-Lymphozyten im Plaque nach der Präsentation von antigenen Peptiden aus ApoB (Apolipoprotein B) durch antigenpräsentierende Zellen (APCs). Eine APC nimmt (oxidierte) LDL-Cholesterinpartikel auf, verarbeitet und präsentiert Peptide aus ApoB auf MHC (major histocompatibility complex)-II. Die T-Zelle erkennt diesen Komplex durch einen spezifischen T-Zell-Rezeptor (TCR). Dieser Prozess wird durch die Bindung von kostimulatorischen Liganden an die entsprechenden Rezeptoren auf T-Zellen gesteuert. Durch kostimulatorische Signale und von einer APC ausgeschüttete Zytokine exprimieren T-Zellen Transkriptionsfaktoren (in den Zellen markiert), die die Differenzierung in verschiedene TH-Typen antreiben. Diese exprimieren spezifische Zytokine, die entweder atheroprotektiv oder proatherogen wirken können. Die Relevanz für die Arteriosklerose bleibt für einige TH-Phänotypen umstritten. IL: Interleukin; TGF: transformierender Wachstumsfaktor
Die Rolle anderer T-Lymphoztenuntergruppen ist weniger gut bekannt. Möglicherweise tragen MHC-I-abhängige zytotoxische CD8-T-Lymphozyten zur Entzündung im Plaque und zum Wachstum des nekrotischen Kerns bei (93, 94), aber die Antigenspezifität dieser CD8-Lymphozyten ist noch nicht erforscht (95). Natürliche Killerlymphozyten (NK) können die antigenspezifische T-Lymphozyten-Immunität beeinflussen und infizierte oder Tumorzellen direkt abtöten. NK-Zellen kommen im Plaque in niedriger Konzentration vor und könnten Einfluss auf die Arteriosklerose haben (96). Im Gegensatz zu früheren Studien zeigten neure Arbeiten, dass natürliche Killerlymphozyten die Arteriosklerose nicht beeinflussen (97–100). Außerdem können CD1d-abhängige natürliche Killer-T-Lymphozyten (NKT) Glykolipidantigene erkennen. Einige NKT-Untergruppen können Arteriosklerose verschlimmern, aber die arterioskleroserelevanten Glykolipide, auf die diese NKT-Lymphozyten ansprechen, sind unbekannt (101–103).
Die Funktion von ApoB-spezifischen autoreaktiven Helfer-T-Lymphozyten
Lange Zeit war der Phänotyp der ApoB-spezifischen CD4-T-Lymphozyten, das heißt des kleinen Anteils von T-Lymphozyten, die einen TCR exprimieren, der ApoB-Peptide im MHC-II-Molekül erkennen kann, unbekannt. In Tiermodellen wurden ApoB-spezifische CD4-T-Lymphozyten durch Impfung gegen LDL oder ApoB oder in vitro expandiert. Der direkte Transfer solcher impfungsinduzierten T-Lymphozyten verschlimmerte Arteriosklerose in einer Studie (104). T-Lymphozyten, die ex vivo mit oxLDL stimuliert wurden, verschlimmerten ebenso die Arteriosklerose in einem Immundefizienzmodell (scid/Apoe−/−-Mäuse, 105). Neutralisation von durch oxLDL stimulierten T-Lymphozyten durch einen monoklonalen Antikörper gegen die TCR V31 Untereinheit schützte Mäuse vor Arteriosklerose (106), was auf eine arteriosklerosefördernde Funktion von ApoB-spezifischen T-Lymphozyten hindeutet. Andererseits zeigen neure Studien, in denen ApoB-spezifische T-Lymphozyten direkt in vivo untersucht wurden, das Gegenteil: die meisten ApoB-reaktiven CD4-T-Lymphozyten in Mäusen und Menschen sind immunsuppressive Tregs (42). Dieser Befund stimmt mit der jüngsten Arbeit von Gistera et al. (89) überein, in der ApoB-reaktive T-Lymphozyten von Mäusen mit einem transgenen TCR gegen oxLDL/ApoB die Empfängermäuse vor Arteriosklerose schützten. Diese unterschiedlichen Ergebnisse verschleiern das Verständnis der genauen Funktion antigen-spezifischer T-Lymphozyten. Wahrscheinlich hängt ihr Phänotyp von der Natur der präsentierten Peptide, der Mikroumgebung und dem Zytokinmilieu ab, die die T-Lymphozytenpolarisation beeinflussen können. Einige proarteriosklerotische antigenspezifische T-Lymphozyten wurden isoliert und dann in vitro kloniert (105, 106), ein Prozess, von dem bekannt ist, dass er TH1-Klone bevorzugt und Treg-Klone unterdrückt. Es scheint, dass die antigenspezifischen T-Lymphozyten multipotent sind und mehrer Helfer-T-Lymphozytentypen in vivo erzeugen können. Diese Idee ist konsistent mit unserer jüngsten Beobachtung, dass durch MHC-II-Tetramer ausgewählte ApoB-reaktive T-Lymphozyten mehrere TH-definiernde Transkriptionsfaktoren gleichzeitig exprimieren können (42).
Die Treg Umschalthypothese: Wie eine schützende zu einer pathogenen Antwort wird
Die Beobachtung, dass Arteriosklerose von einer Autoimmunantwort begleitet wird, fordert die Frage heraus, ob Arteriosklerose in Gesunden durch ApoB-spezifische Tregs aktiv verhütet wird (39). Tregs verhüten den Ausbruch von Autoimmunerkrankungen (107). Natürliche Tregs (nTregs) werden im Thymus produziert und periphere Tregs werden aus naiven T-Lymphozyten induziert (iTregs). Obwohl bekannt ist, dass die Gesamtpopulation von Tregs vor Arteriosklerose schützt (68, 60), war bis vor kurzem unbekannt, ob ApoB-spezifische Tregs exisitieren und wie sie den Krankheitsverlauf beeinflussen. Interssanterweise zeigen reiche klinische Daten eine starke inverse Beziehung zwischen Tregs und Arteriosklerose: die Zahl der Tregs und IL-10-exprimierenden T-Lymphozyten ist im Blut von Patienten mit Herzinfarkt erniedrigt (108, 109). Niedrige Treg-Zahlen sagen kardiovaskuläre Komplikationen voraus (110). Die Zahl der Tregs im Blut von Mäusen mit Arteriosklerose nehmen im späteren Krankheitsverlauf ab, während Effektor-T-Lymphozyten ansteigen (36, Abb. 3A). Anderseits korrleliert die Zahl der Tregs in Arteriosklerosepatienten positiv mit dem LDL-Spiegel (111). In Mäusen begünstigt Hypercholesterinämie zunächst die Differenzierung von Tregs (112), aber dies wird möglicherweise durch erhöhte Entzündung (36), intrazelluläre Lipidakkumulation (113) oder eine antigenspezifische Antwort unterdrückt. Die letztgenannte Hypothese wird von Beobachtungen unterstützt, dass die vom TCR in Gang gesetzten Signalvorgänge in hypercholesterinämischen Mäusen verstärkt ist (114). Möglicherweise reagiert eine Untergruppe von T-Lymphozyten auf Antigene, die mit erhöhtem LDL-Spiegel einhergehen, oder auf Komponenten von LDL selbst. Diese Daten deuten darauf hin, dass ApoB/LDL-reaktive Tregs TCRs exprimieren, die auf spezifische ApoB-Autopeptide reagieren. Diese Zellen werden aktiviert, wenn die respektiven Peptide von APCs in MHC-II-Molekülen präsentiert werden. Im vergangenen Jahr zeigten wir die Existenz solcher ApoB-reaktiven T-Lymphozyten direkt, indem wir sie mit MHC-II-Tetrameren, die mit dem humanen und sequenzidentischen Maus ApoB3036–3050 beladen waren. Mit diesen Tetrameren zeigten wir, dass zwei Drittel der ApoB3036–3050 reaktiven CD4 T-Lymphozyten in Patienten ohne nachweisbare kardiovaskuläre Erkrankung nur FoxP3 exprimierten, was zeigt das die Mehrzahl der ApoB-reaktiven Zellen Tregs sind. In Patienten mit subklinischer Arteriosklerose war der Anteil der FoxP3-einzelpositiven T-Lymphozyten auf etwa 30% reduziert. Stattdessen koexprimierte ein erheblicher Anteil der FoxP3-positiven Lymphozyten auch RORγt oder T-bet, die Transkriptionsfaktoren die TH17 beziehungsweise TH1-Helfer-T-Lymphozyten definieren (42). Diese Beobachtungen und die verringerte Zahl von Tregs mit fortgeschrittener Arteriosklerose in Patienten und Mäusen unterstützen die Hypothese, dass der immunsuppressive Phänotyp der Tregs verschwindet, wenn die Arteriosklerose voranschreitet. In der Tat exprimieren Tregs in älteren arteriosklerotischen Mäusen T-bet, verlieren ihre Fähigkeit zu regulieren und vor Arteriosklerose zu schützen, aber haben immer noch einige phänotypische Merkmale von Tregs, zum Beispiel erhaltene Expression von etwas FoxP3 (36, 55, 62). Gaddis et al. (88) zeigten vor kurzem, dass FoxP3-Expression verlorengeht und stattdessen der Transkriptionsfaktor Bcl-6 exprimiert wird, der TFH-Lymphozyten definiert. In Empfängermäuse injizierte ApoB+-Helfer-T-Lymphozyten wurden zu TFH (89). In anderen Autoimmunerkrankungen wie experimenteller Autoimmunenzephalitis oder Arthritis wurde gezeigt, dass Instabilität der FoxP3-Expression zu antigenspezifischen, aber nichtfunktionellen ehemaligen Tregs (exTregs) führt, die nicht mehr vor der Erkrankung schützen können (115–117). Die Instabilität von FoxP3 ist möglicherweise durch erhöhte Methylierung im FoxP3-Genlokus bedingt, die auch in Patienten mit kardiovaskulären Erkrankungen beobachtet wurden (118). Möglicherweise kann dies durch Veränderungen im Lipidmetabolismus oder Interventionen, die Zytokine blockieren, verhindert werden (88, 115). Die Funktion von FoxP3 kann zusätzlich durch alternative Spleißung beeinflusst werden. Die Spleißvariante kann bevorzugt zu pathogenen Transkriptionsprogrammen führen (119). Diese Befunde zeigen, dass die initial schützende Immunantwort durch Tregs im Verlauf der Arteriosklerose zu einer pathogenen Antwort wird (39, Abb. 3B und 3C).
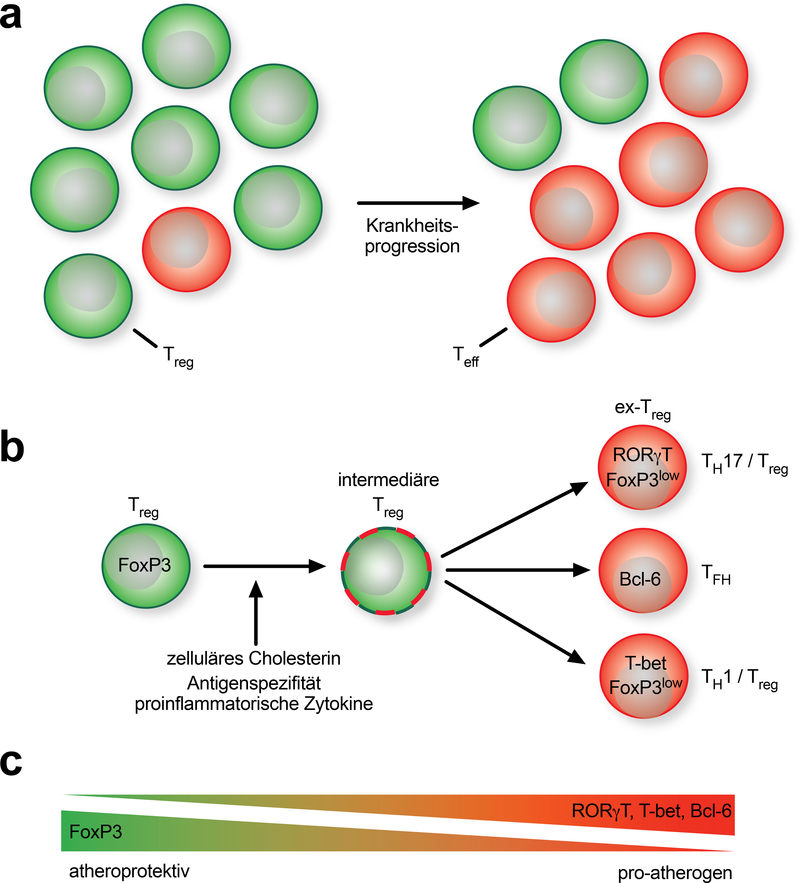
Abb. 3:
Rückgang der protektiven regulatorischen T-Lymphozyten (Treg) im Zuge der Arteriosklerose. A: Im Verlauf der Erkrankung wird der Pool der Treg-dominierten antigenspezifischen T-Zellen von Effektor-T-Zellen (Teff) mit einer vermutlich proatherogenen Funktion überwältigt. B: Im Laufe der Zeit beginnen Tregs, die den sie definierenden Transkriptionsfaktor FoxP3 exprimieren, alternative Transkriptionsfaktoren von T-Helferzellen (TH) wie RORγ-T (TH17), Bcl-6 (TFH) oder T-bet (TH1) zu exprimieren. FoxP3 wird entweder koexprimiert oder verschwindet. Wahrscheinlich kann dieser Wechsel in FoxP3 niedrigexprimierte oder FoxP3-negative exTregs durch die Antigenspezifität der T-Zelle, das Zytokin-Milieu in der atherosklerotischen Plaque oder die Beladung der T-Zelle mit intrazellulärem Cholesterin verursacht werden. C: Diese Beobachtungen sind Grundlage des Konzepts eines zunehmenden Ersatzes der protektiven Immunität durch eine arteriosklerosefördernde Reaktion.
B-Lymphozyten können die Arteriosklerose verschlimmern oder verbessern
Zwei klassische Typen von B-Lymphozyten sind bekannt: B1-Lymphozyten sind Teil des angeborenen Immunsystems und sezernieren IgM-Antikörper unabhängig von T-Lymphozyten. B2-Lymphozyten müssen von TFH aktiviert werden, um zu IgG-sezernierenden Plasmazellen zu reifen. Während einer Infektion oder nach einer Impfung gegen pathogene Organismen sezernieren Plasmazellen, die von B-Lymphozyten abstammen, IgG-Antikörper, die Bakterien und Viren neutralizieren oder opsonisieren (29). Außerdem sezernieren B-Lymphozyten mehrere Zytokine, die die Entzündungsreaktion beeinflussen. Beispielsweise produzieren IRA-B-Lymphozyten das arteriosklerosefördernde Zytokin GM-CSF, das myeloide Zellen aktiviert und eine TH1-Antwort fördert (120). Regulatorische B-Lymphozyten (Breg) sezernieren das entzündungshemmende Zytokin IL-10, induzieren arteriosklerosehemmende Tregs und können direkt entzündungshemmend sein (121), aber ihre Rolle in der Arteriosklerose wird kontrovers diskutiert (122). Die Rolle anderer zytokinsezernierender Effektor-B-Lymphozyten (Be) ist unklar. In arteriosklerotischen Plaques finden sich nur wenige B-Lymphozyten (24); mehr B-Lymphozyten sitzen in der Adventitia, insbesondere in älteren arteriosklerotischen Mäusen, in denen sich arterielle tertiäre Lymphorgane (ATLOs) bilden. B-Lymphozyten in der Milz sprechen auch auf eine hypercholesterinämieinduzierende Ernährung an (124), sodass bei Arteriosklerose sowohl lokale als auch systemische Effekte berücksichtigt werden müssen. Globale Funktionsgewinn- und Funktionsverlustexperimente zeigen, dass die vor Arteriosklerose schützende Rolle der B-Lymphozyten überwiegt (125, 126). Angeborene B1-Lymphozyten sind überwiegend arteriosklerosehemmend und adaptive B2-Lymphozyten sind überwiegend arteriosklerosefördernd (Abb. 4).
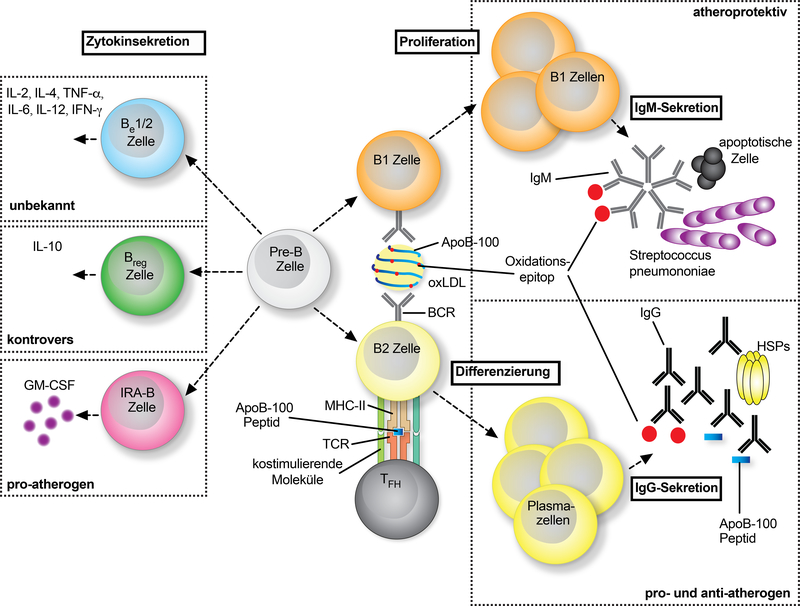
Abb. 4:
Rolle der B-Lymphozyten bei der Arteriosklerose. Aus sich entwickelnden B-Lymphozyten (Pre-B) werden angeborene B1-Lymphozyten oder adaptive, konventionelle B2-Lymphozyten (rechts). B1-Lymphozyten erkennen Epitope auf LDL- (Low-Density-Lipoprotein) und oxLDL-Partikeln, was zu ihrer Aktivierung und Expression von niederaffinen IgM-Antikörpern durch Proliferation führt. Häufig zeigen diese IgM-Antikörper eine Kreuzreaktivität mit Epitopen auf Bakterien wie Streptococcus pneumoniae oder auf apoptotischen Zellen. Die Störung der B1-Funktionalität verschlimmert die Arteriosklerose. B2-Zellen benötigen eine Kostimulation durch T-follikuläre Helferzellen (TFH-Zellen) durch MHC (major histocompatibility complex)-II:peptide:TCR (T-Zell-Rezeptor)-Interaktionen und kostimulatorische Signale, um sich zu Plasmazellen zu differenzieren, die hochaffine IgG-Antikörper gegen Arterioskleroseantigene wie ApoB, oxLDL oder HSP (Heat-Shock-Proteine) exprimieren. Die Neutralisierung von B2-Zellen ist atheroprotektiv, obwohl die Rolle der IgG-Antikörper mit den beschriebenen pro- und antiatherogenen Funktionen weiterhin umstritten ist. Unabhängig von der Klassifizierung von B1/2-Zellen wurde gezeigt, dass bestimmte B-Zell-Subgruppen Gruppen von Zytokinen exprimieren, die die Definition von zytokinsezernierenden B-Effektor (Be)-1 und −2-Zellen, regulatorischen B-Zellen (Bregs) und angeborenen Aktivator (IRA) B-Zellen (links) ermöglichen. ApoB: Apolipoprotein B; IL: Interleukin; IFN: Interferon; TNF: Tumornekrosefaktor
B1 Lymphozyten
B1-Lymphozyten stellen die erste Verteidigungslinie gegen weitverbreitete Pathogene dar. In Mäusen ist ihr Oberflächenphenotyp CD11b+CD43+CD23−B220niedrigCD19+. Sie können anhand von Oberflächenmarkern und Lokalisation weiter in B1a und B1b unterteilt werden (127). Die meisten B1-Lymphozyten finden sich in der Peritonealhöhle. In arteriosklerotischen Plaques findet man wenige CD11b+B220−CD19+ B1-ähnliche Lymphozyten, die mit zunehmender Arteriosklerose abnehmen (24). B1-Lymphozyten sezernieren IgM, das direkt von der genomischen Keimbahn-DNA stammt (nicht rearrangiert). IgM von B1-Lymphozyten bindet an Phosphocholingruppen, die sich in der Baketerienwand von Streptococcus pneumoniae finden. Die gleichen IgM-Klone binden an oxitationsspezifische Epitope in LDL und auf apoptotischen Zellen (128–130). Solche Oxidationsepitope werden bei steriler Entzündung auch in der Milz produziert (131). Bei kardiovaskulären Erkrankungen sind IgM-Spiegel, die Oxidationsepitope auf LDL oder ApoB erkennen, invers mit Arteriosklerose und ihren Komplikationen korreliert (132–138). IgM gegen oxLDL hemmt dessen Aufnahme in Makrophagen, was entzündungshemmend wirkt (139, 140). In vielen Funktionsgewinn- und Funktionsverluststudien wurde gezeigt, dass B1-Lymphozyten vor Arteriosklerose schützen (141–145).
B2 Lymphozyten
IgG-Antikörper werden von Plasmazellen sezerniert, die in Keimzentren mit Hilfe von TFH-Lymphozyten aus B-Lymphozyten reifen und von niederaffinem IgM auf hochaffine IgG-Antikörperproduktion umschalten (156). IgG-Antikörpertiter gegen natives und oxidiertes LDL sind in Mäusen und Menschen positiv mit Arterisosklerose korreliert (133, 147–149). Die Hemmung von B2-Lymphozyten schützt vor Arteriosklerose (150–152), während die Hemmung von Plasmazellen arteriosklerosefördernd wirkt (153). Die direkte Funktion der IgG-Antikörper bei Arteriosklerose ist kontrovers: IgGs gegen ApoB können Arteriosklerose verschlimmern (154) oder vor Arteriosklerose schützen (155, 156). In der klinischen Phase-II-Studie GLACIER (Goal of Oxidized LDL and Activated Macrophage Inhibition by Exposure to a Recombinant Antibody) wurde Teilnehmern ein monoklonaler IgG-Antikörper gegen ein humanes ApoB-Peptid verabreicht; dies zeigte nicht den erwarteten arteriosklerosehemmenden Effekt (157). Die Studie basierte auf Positronenemissionstomographie mit 8F-Fluorodeoxyglukose als Biomarker für die Entzündung im Plaque anstelle von klinischen kardiovaskulären Endpunkten. Dies, die kurze Beobachtungdauer von 85 Tagen und die geringe Anzahl von Teilnehmern haben möglicherweise zum Scheitern der Studie beigetragen.
Kann Arterioskleroseimpfung für die klinische Anwendung entwickelt werden?
Die Entdeckung der Autoimmunkomponente der Arteriosklerose hat zu der Idee geführt, dass Impfung mit LDL oder ApoB-Peptiden der Arteriosklerose vorbeugen kann, indem sie die schützende Komponente der Autoimmunität stärkt oder erhält. Schon vor fast 60 Jahren wurde gezeigt, dass Kaninchen, die subkutane Injektionen von LDL erhielten, kleinere arteriosklerotische Läsionen entwickelten (38). Dass Impfung mit LDL vor Arteriosklerose schützen kann wurde in mehreren Tiermodellen, mit verschiedenen LDL-Präparationen, Applikationsrouten und Adjuvanzien gezeigt (158–160). Mindestens sieben MHC-II restringierte Peptide von ApoB, das die immundominanten Epitope von LDL enthält, schützen vor Arteriosklerose, wenn Tiermodelle mit ihnen geimpft wurden: p3, p6, p101, p102, p103, p18 und p210 (42, 161–163). Unklar ist allerdings der Wirkmechanismus, dessen Entdeckung notwendig ist, um Impfstrategien für Anwendung beim Menschen zu entwickeln. Gegenwärtig werden hauptsächlich drei Wirkmechanismen diskutiert: Induktion von Tregs (42, 164–167), IL-10-Produktion (41, 42, 161, 167) oder impfinduzierte IgG-Antikörper – abhängig von der Dosis, Administrationsroute und Adjuvantien (44). Neuere Studien legen nahe, dass IgG-Antikörper nicht notwendig sind (168), sodass die Treg und IL-10-Hypothesen wahrscheinlicher werden (42). Ob Arterioskleroseimpfungen für die klinische Anwendung entwickelt werden können, ist noch unklar. Ein erster Schritt hierzu war die Entdeckung von ApoB-Peptidepitopen im humanen ApoB, die der Immunmodulation zugänglich sind (42, 169). In den meisten Mausstudien wurden die ApoB-Peptide in komplettem Freundschem Adjuvans (CFA) gegeben, einer Emulsion von inaktivierten Mykobakterien in Mineralöl, oder in inkomplettem Freundschem Adjuvans (IFA), das keine Mykobakterien enthält. Beide Adjuvanzien können nicht beim Menschen angewandt werden, da die subkutane oder intraperitoneale Injektion von CFA oder IFA starke unspezifische Entzündung induziert (170, 171). Dieses Problem wurde in einer neueren Studie gelöst, in der gezeigt wurde, dass ein Squalenöl, ein Adjuvans das bereits in klinischen Impfstoffen benutzt wird, mit ApoB-Peptiden gegeben werden kann und effektiv vor Arteriosklerose schützt (168). Derzeit ist außerdem unbekannt, ob Impfung von Nagetieren mit bereits bestehender Arteriosklerose wirkt, da die meisten Studien nur die prophylaktische Verhütung von Arteriosklerose untersucht haben.
Einschränkungen von Tiermodellen
Im Prinzip ist die zelluläre und humorale adaptive Immunantwort in Mausmodellen der Arteriosklerose bekannt. Die klinische CANTOS-Studie (Canakinumab Anti-Inflammatory Thrombosis Outcomes Study) hat gezeigt, dass entzündungshemmende Therapie die Arteriosklerose beim Menschen vermindern kann. Allerdings bestehen signifikante Probleme für die Übertragung von Tierstudienbefunden auf den Menschen. Erstens entwickeln Mäuse keine spontane Arteriosklerose, und die weitverbreiteten gendefizienten Mäuse entwickeln keine koronare Herzkrankheit. Arteriothrombotische Ereignisse wie Herzinfarkte oder Schlaganfälle treten in arteriosklerotischen Mäusen nicht auf. Außerdem sind die Blutlipidwerte in den genetischen Mausarteriosklerosemodellen sehr verschieden von denjenigen beim Menschen. Zweitens wurden die meisten Arteriosklerosestudien in einem einzigen Mausstamm durchgeführt (C57BL/6), der nicht die Breite der genetischen Heterogenität bei Menschen widerspiegeln kann. Es ist bekannt, dass die genetische Heterogenität enormen Einfluss auf die Immunantwort und die Arteriosklerose hat, mit einem weiten Spektrum von entzündungsfördernd bis entzündungshemmend (172, 173). Drittens sind manche Zytokine und Immunrezeptoren nicht gut von der Maus auf den Menschen übertragbar, da die Immunsysteme von Maus und Mensch mehr als andere Systeme starkem evolutionärem Druck unterliegen. Viertens ist die Antigenpräsentation und -erkennung bei Mäusen stark vereinfacht. Mäuse werden in spezifisch pathogenfreien Tierställen gehalten, was die pathogengetriebene Zellaktivierung, das Antigenrepertoire und die Differenzierung von Immunzellen vernachlässigt (174). C57BL/6 Mäuse exprimieren nur ein einzigen MHC-II-Allel (I-Ab), während Menschen mehrere Allele einer großen Zahl von verschiedenen MHC-II-Varianten mit mehr als 10.000 Varianten exprimieren. Diese extreme genetische Variabilität macht es schwierig, die humane Autoimmunantwort vorherzusagen.
Klinische Aspekte
Derzeit sind zwei fundamentale therapeutische Strategien verfügbar: Verminderung von LDL und Abschwächung der Entzündungsantwort. Die erfolgreichste kausale Medikation, gemessen in Personenjahren ohne Ereignis, sind die Inhibitoren der endogenen Cholesterinsynthese durch HMG-CoA-Reduktasehemmer (Statine; 175, 176), die einerseits das LDL-Cholesterin senken und anderseits vielfältige entzündungshemmende Effekte haben, die nachweislich über den Effekt der LDL-Cholesterinsenkung hinausgehen (177). Statine könne arteriosklerotische Plaques verhüten, vermindern und sogar zum Schrumpfen bringen (178). Monoklonale Antikörper gegen PCSK9 senken das LDL-Cholesterin noch dramatischer, indem sie den zellulären Abbau des LDL-Rezeptors blockieren (179, 180), offenbar ohne Einfluss auf den CRP-Spiegel zu haben (181), der ein Biomarker der systemischen Entzündung ist. Allerdings bleibt ein erhebliches Restrisiko, selbst wenn LDL mit Statinen und PCSK9-Inhibitoren erfolgreich gesenkt wurde (182). Dies zeigt die unterschiedliche, zum Teil überlappende Bedeutung des Entzündungsrisikos und des Lipidrisikos. Behandlung mit niedrig dosiertem Colchizin verhütete kardiovaskuläre Ereignisse in einer kleinen prospektiven Studie (183). Außerdem hat die CANTOS-Studie gezeigt, dass die Entzündungshemmung mit dem IL-1β-Antikörper Canakimumab kariovaskuläre Ereignisse in Patienten mit bestehender Arteriosklerose um 15% senken konnte (184). Diese Beobachtungen haben konzeptionell die Entzündungshypothese bestärkt, aber es ist unklar, welche Patienten von den neuen entzündungshemmenden Therapien profitieren: Erstens führte die Hemmung von IL-1β zu einer Zunahme letaler Infektionen (184). Zweitens verfehlte die neue CIRT (Cardiovascular Inflammation Reduction Trial)-Studie, die niedrigdosiertes Methotrexat in Patienten mit koronarer Herzkrankheit testete, ihre Endpunkte (185). Dieser Mangel an Wirksamkeit könnte zum Teil an der Inklusion von Patienten mit niedrigem Entzündungsrisiko liegen. Wenn zukünftige entzündungshemmende Arteriosklerosetherapien klinisch verfügbar sind, könnte eine personalisierte Risikostratifikation (Entzündungs- versus Lipidrisiko) hilfreich sein. Es ist derzeit unklar, ob unspezifische entzündungshemmende Therapien auch die Autoimmunkomponente der Arteriosklerose beeinflussen würden. Impfung und Immunmodulation könnten zukünftige antigenspezifische Therapieansätze darstellen, die die Immunabwehr wahrscheinlich unbeeinflusst lassen. Die erste Validierung von MHC-II-Tetrameren zum Nachweis von ApoB-reaktiven T-Lymphozyten (42) und die Messung von Autoantikörpern (186) im menschlichen Blut könnten Stratifizierungsstrategien sein, die Patienten mit hohem immunologischen Arterioskleroserisiko identifizieren.
Schlussfolgerungen
Arteriosklerose ist eine chronisch-entzündliche Erkrankung der Gefäßwand, die überwiegend von einer angeborenen Immunantwort von myeloiden Zellen wie Monozyten und Makrophagen getrieben wird. Die begleitende Autoimmunität gegen ApoB und andere Antigene wird von CD4 T-Lymphozyten getragen, die myeloide Zellen instruieren, und von Autoantikörpern, die möglicherweise das pathogene Potenzial dieser Antigene beeinflussen. Diese Autoimmunantwort ist im Menschen und in Tiermodellen nachweisbar. Während Autoimmunität klassischerweise als pathogen angesehen wird, zeigen neuere Ergebnisse, dass ApoB-spezifische CD4 T-Lymphozyten bereits in Menschen ohne klinische Arteriosklerose nachweisbar sind und überwiegend arteriosklerosehemmende Merkmale zeigen. Mit fortschreitender Arteriosklerose entwickelt sich die schützende Autoimmunantwort in eine pathogene. Es ist unbekannt, ob diese Umschaltung eine Ursache oder eine Folge der Arteriosklerose und Entzündung ist. Es ist jedoch klar, dass das adaptive Imunsystem entzündugsfördernde und -hemmende Auswirkungen haben kann und somit Arteriosklerose verstärken oder hemmen kann. Ein attraktives Konzept ist, dass das adaptive Immunsystem durch Impfung oder Immunmodulation beeinflusst werden kann. Die eingeschränkte Vorhersagekraft existierender Tiermodelle und ein Mangel an Verständnis der genauen Rolle von Autoantikörpern, B- und T-Lymphozyten stellen wesentliche Hürden für die klinische Entwicklung und Anwendung solcher Eingriffe dar.
Förderung
Unterstützt wurde diese Arbeit durch Stipendien an D. Wolf von der Deutschen Forschungsgemeinschaft (DFG WO1994/1). K. Ley wurde durch Zuschüsse HL115232, HL88093 und HL121697 des National Heart, Lung, and Blood Institute unterstützt.
Footnotes
Interessenkonflikt
K. Ley hat von der UBI Forschungsmittel für die Entwicklung einer Atherosklerose-Impfstoffformulierung erhalten. D. Wolf gibtan, dass keine Interessenkonflikte bestehen.
Literatur
- 1.Gallino A, Aboyans V, Diehm C et al. European Society of Cardiology Working Group on Peripheral Circulation. Non-coronary atherosclerosis. Eur Heart J. 2014;35:1112–1119. https://doi.org10.1093/eurheartj/ehu071 [DOI] [PubMed] [Google Scholar]
- 2.Ross R Atherosclerosis–an inflammatory disease. N Engl J Med. 1999;340:115–126. https://doi.org10.1056/NEJM199901143400207 [DOI] [PubMed] [Google Scholar]
- 3.Libby P Inflammation in atherosclerosis. Nature. 2002;420:868–874. https://doi.org10.1038/nature01323 [DOI] [PubMed] [Google Scholar]
- 4.Kruk ME, Gage AD, Joseph NT et al. Mortality due to low-quality health systems in the universal health coverage era: a systematic analysis of amenable deaths in 137 countries. Lancet. 2018;392:2203–2212. https://doi.org10.1016/S0140-6736(18)31668-4 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Herrington W, Lacey B, Sherliker P et al. Epidemiology of atherosclerosis and the potential to reduce the Global Burden of Atherothrombotic Disease. Circ Res. 2016;118:535–546. https://doi.org10.1161/CIRCRESAHA.115.307611 [DOI] [PubMed] [Google Scholar]
- 6.Braunwald E The treatment of acute myocardial infarction: the Past, the Present, and the Future. Eur Heart J Acute Cardiovasc Care. 2012;1:9–12. https://doi.org10.1177/2048872612438026 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Nordestgaard BG. Triglyceride-rich lipoproteins and atherosclerotic cardiovascular disease: new insights from epidemiology, genetics, and biology. Circ Res. 2016;118:547–563. https://doi.org10.1161/CIRCRESAHA.115.306249 [DOI] [PubMed] [Google Scholar]
- 8.Ross R, Harker L. Hyperlipidemia and atherosclerosis. Science. 1976;193:1094–1100. [DOI] [PubMed] [Google Scholar]
- 9.Ishibashi S, Brown MS, Goldstein JL et al. Hypercholesterolemia in low density lipoprotein receptor knockout mice and its reversal by adenovirus-mediated gene delivery. J Clin Invest. 1993;92:883–893. https://doi.org10.1172/JCI116663 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Zhang SH, Reddick RL, Piedrahita JA, Maeda N. Spontaneous hypercholesterolemia and arterial lesions in mice lacking apolipoprotein E. Science. 1992;258:468–471. [DOI] [PubMed] [Google Scholar]
- 11.Do R, Stitziel NO, Won HH et al. NHLBI Exome Sequencing Project. Exome sequencing identifies rare LDLR and APOA5 alleles conferring risk for myocardial infarction. Nature. 2015;518:102–106. https://doi.org10.1038/nature13917 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.McPherson R, Tybjaerg-Hansen A. Genetics of coronary artery disease. Circ Res. 2016;118:564–578. https://doi.org10.1161/CIRCRESAHA.115.306566 [DOI] [PubMed] [Google Scholar]
- 13.Kobiyama K, Ley K. Atherosclerosis. Circ Res. 2018;123:1118–1120. https://doi.org10.1161/CIRCRESAHA.118.313816 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Tsiantoulas D, Diehl CJ, Witztum JL, Binder CJ. B cells and humoral immunity in atherosclerosis. Circ Res. 2014;114:1743–1756. https://doi.org10.1161/CIRCRESAHA.113.301145 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Gimbrone MA Jr, García-Cardeña G. Endothelial Cell Dysfunction and the Pathobiology of Atherosclerosis. Circ Res. 2016;118:620–636. https://doi.org10.1161/CIRCRESAHA.115.306301 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Ley K, Miller YI, Hedrick CC. Monocyte and macrophage dynamics during atherogenesis. Arterioscler Thromb Vasc Biol. 2011;31:1506–1516. https://doi.org10.1161/ATVBAHA.110.221127 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.van der Valk FM, Bekkering S, Kroon J et al. Oxidized phospholipids on lipoprotein(a) elicit arterial wall inflammation and an inflammatory monocyte response in humans. Circulation. 2016;134:611–624. https://doi.org10.1161/CIRCULATIONAHA.116.020838 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Curtiss LK, Tobias PS. Emerging role of Toll-like receptors in atherosclerosis. J Lipid Res. 2009;50(suppl):S340–S345. https://doi.org10.1194/jlr.R800056-JLR200 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Senders ML, Que X, Cho YS et al. PET/MR imaging of malondialdehyde-acetaldehyde epitopes with a human antibody detects clinically relevant atherothrombosis. J Am Coll Cardiol. 2018;71:321–335. https://doi.org10.1016/j.jacc.2017.11.036 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Nahrendorf M Myeloid cell contributions to cardiovascular health and disease. Nat Med. 2018;24:711–720. https://doi.org10.1038/s41591-018-0064-0 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Duewell P, Kono H, Rayner KJ et al. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals. Nature. 2010;464:1357–1361. https://doi.org10.1038/nature08938 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Libby P Interleukin-1 beta as a target for atherosclerosis therapy: biological basis of CANTOS and beyond. J Am Coll Cardiol. 2017;70:2278–2289. https://doi.org10.1016/j.jacc.2017.09.028 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Tall AR, Yvan-Charvet L. Cholesterol, inflammation and innate immunity. Nat Rev Immunol. 2015;15:104–116. https://doi.org10.1038/nri3793 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Winkels H, Ehinger E, Vassallo M et al. Atlas of the immune cell repertoire in mouse atherosclerosis defined by single-cell RNAsequencing and mass cytometry. Circ Res. 2018;122:1675–1688. https://doi.org10.1161/CIRCRESAHA.117.312513 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Galkina E, Kadl A, Sanders J et al. Lymphocyte recruitment into the aortic wall before and during development of atherosclerosis is partially L-selectin dependent. J Exp Med. 2006;203:1273–1282. https://doi.org10.1084/jem.20052205 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Finn AV, Nakano M, Narula J et al. Concept of vulnerable/unstable plaque. Arterioscler Thromb Vasc Biol. 2010;30:1282–1292. https://doi.org10.1161/ATVBAHA.108.179739 [DOI] [PubMed] [Google Scholar]
- 27.Stone GW, Maehara A, Lansky AJ et al. A prospective natural-history study of coronary atherosclerosis. N Engl J Med. 2011;364:226–235. https://doi.org10.1056/NEJMoa1002358 [DOI] [PubMed] [Google Scholar]
- 28.Jonasson L, Holm J, Skalli O et al. Regional accumulations of T cells, macrophages, and smooth muscle cells in the human atherosclerotic plaque. Arteriosclerosis. 1986;6:131–138. [DOI] [PubMed] [Google Scholar]
- 29.Adler R Janeway’s immunobiology. Choice: Current Reviews for Academic Libraries. 2008;45:1793–1794. [Google Scholar]
- 30.Steinman RM. Decisions about dendritic cells: past, present, and future. Annu Rev Immunol. 2012;30:1–22. https://doi.org10.1146/annurev-immunol-100311-102839 [DOI] [PubMed] [Google Scholar]
- 31.Koltsova EK, Garcia Z, Chodaczek G et al. Dynamic T cell-APC interactions sustain chronic inflammation in atherosclerosis. J Clin Invest. 2012;122:3114–3126. https://doi.org10.1172/JCI61758 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Paulsson G, Zhou X, Törnquist E, Hansson GK. Oligoclonal T cell expansions in atherosclerotic lesions of apolipoprotein E-deficient mice. Arterioscler Thromb Vasc Biol. 2000;20:10–17. [DOI] [PubMed] [Google Scholar]
- 33.Lin Z, Qian S, Gong Y et al. Deep sequencing of the T cell receptor β repertoire reveals signature patterns and clonal drift in atherosclerotic plaques and patients. Oncotarget. 2017;8:99312–99322. https://doi.org10.18632/oncotarget.19892 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Centa M, Prokopec KE, Garimella MG et al. Acute loss of apolipoprotein E triggers an autoimmune response that accelerates atherosclerosis. Arterioscler Thromb Vasc Biol. 2018;38:e145–e158. https://doi.org10.1161/ATVBAHA.118.310802 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Caligiuri G, Nicoletti A, Zhou X et al. Effects of sex and age on atherosclerosis and autoimmunity in apoE-deficient mice. Atherosclerosis. 1999;145:301–308. [DOI] [PubMed] [Google Scholar]
- 36.Maganto-García E, Tarrio ML, Grabie N et al. Dynamic changes in regulatory T cells are linked to levels of dietinduced hypercholesterolemia. Circulation. 2011;124:185–195. https://doi.org10.1161/CIRCULATIONAHA.110.006411 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Colantonio LD, Bittner V, Reynolds K et al. Association of serum lipids and coronary heart disease in contemporary observational studies. Circulation. 2016;133:256–264. https://doi.org10.1161/CIRCULATIONAHA.115.011646 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Gero S, Gergely J, Jakab L et al. Inhibition of cholesterol atherosclerosis by immunisation with beta-lipoprotein. Lancet. 1959;2:6–7. [DOI] [PubMed] [Google Scholar]
- 39.Ley K 2015 Russell Ross memorial lecture in vascular biology: protective autoimmunity in atherosclerosis. Arterioscler Thromb Vasc Biol. 2016;36:429–438. https://doi.org10.1161/ATVBAHA.115.306009 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Stemme S, Faber B, Holm J et al. T lymphocytes from human atherosclerotic plaques recognize oxidized low density lipoprotein. Proc Natl Acad Sci USA. 1995;92:3893–3897. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Tse K, Gonen A, Sidney J et al. Atheroprotective vaccination with MHC-II restricted peptides from AopB-100. Front Immunol. 2013;4:493. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Kimura T, Kobiyama K, Winkels H et al. Regulatory cd4(+) t cells recognize MHC-II-restricted peptide epitopes of apolipoprotein b. Circulation. 2018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Moon JJ, Chu HH, Pepper M et al. Naive CD4(+) T cell frequency varies for different epitopes and predicts repertoire diversity and response magnitude. Immunity. 2007;27:203–213. https://doi.org10.1016/j.immuni.2007.07.007 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Kimura T, Tse K, Sette A, Ley K. Vaccination to modulate atherosclerosis. Autoimmunity. 2015;48:152–160. https://doi.org10.3109/08916934.2014.1003641 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Wick G, Jakic B, Buszko M et al. The role of heat shock proteins in atherosclerosis. Nat Rev Cardiol. 2014;11:516–529. https://doi.org10.1038/nrcardio.2014.91 [DOI] [PubMed] [Google Scholar]
- 46.Zhu J, Quyyumi AA, Rott D et al. Antibodies to human heat-shock protein 60 are associated with the presence and severity of coronary artery disease: evidence for an autoimmune component of atherogenesis. Circulation. 2001;103:1071–1075. [DOI] [PubMed] [Google Scholar]
- 47.George J, Afek A, Gilburd B et al. Cellular and humoral immune responses to heat shock protein 65 are both involved in promoting fatty-streak formation in LDL-receptor deficient mice. J Am Coll Cardiol. 2001;38:900–905. [DOI] [PubMed] [Google Scholar]
- 48.Lawson JS, Glenn WK, Tran DD et al. Identification of human papilloma viruses in atheromatous coronary artery disease. Front Cardiovasc Med. 2015;2:17 https://doi.org10.3389/fcvm.2015.00017 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Rosenfeld ME, Campbell LA. Pathogens and atherosclerosis: update on the potential contribution of multiple infectious organisms to the pathogenesis of atherosclerosis. Thromb Haemost. 2011;106:858–867. https://doi.org10.1160/TH11-06-0392 [DOI] [PubMed] [Google Scholar]
- 50.Pothineni NVK, Subramany S, Kuriakose K et al. Infections, atherosclerosis, and coronary heart disease. Eur Heart J. 2017;38:3195–3201. https://doi.org10.1093/eurheartj/ehx362 [DOI] [PubMed] [Google Scholar]
- 51.Hansson GK, Jonasson L, Lojsthed B et al. Localization of T lymphocyte et al. , Pelisek J, Winkels H, Ley K, Wolf D, Saliba AE, Zernecke A. Single-cell RNA-seq reveals the transcriptional landscape and heterogeneity of aortic macrophages n murine atherosclerosis. Circ Res. 2018;122:1661–1674. https://doi.org10.1161/CIRCRESAHA.117.312509 [DOI] [PubMed] [Google Scholar]
- 53.Cole JE, Park I, Ahern DJ et al. Immune cell census in murine atherosclerosis: cytometry by time of flight illuminates vascular myeloid cell diversity. Cardiovasc Res. 2018;114:1360–1371. https://doi.org10.1093/cvr/cvy109 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Gräbner R, Lötzer K, Döpping S et al. Lymphotoxin beta receptor signaling promotes tertiary lymphoid organogenesis in the aorta adventitia of aged ApoE−/− mice. J Exp Med. 2009;206:233–248. https://doi.org10.1084/jem.20080752 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Li J, McArdle S, Gholami A et al. CCR5+T-bet+FoxP3+ effector CD4 T cells drive atherosclerosis. Circ Res. 2016;118:1540–1552. https://doi.org10.1161/CIRCRESAHA.116.308648 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Galkina E, Harry BL, Ludwig A et la. CXCR6 promotes atherosclerosis by supporting T-cell homing, interferon-gamma production, and macrophage accumulation in the aortic wall. Circulation. 2007;116:1801–1811. https://doi.org10.1161/CIRCULATIONAHA.106.678474 [DOI] [PubMed] [Google Scholar]
- 57.Dansky HM, Charlton SA, Harper MM, Smith JD. T and B lymphocytes play a minor role in atherosclerotic plaque formation in the apolipoprotein E-deficient mouse. Proc Natl Acad Sci USA. 1997;94:4642–4646. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Song L, Leung C, Schindler C. Lymphocytes are important in early atherosclerosis. J Clin Invest. 2001;108:251–259. https://doi.org10.1172/JCI11380 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Emeson EE, Shen ML, Bell CG, Qureshi A. Inhibition of atherosclerosis in CD4 T-cell-ablated and nude (nu/nu) C57BL/6 hyperlipidemic mice. Am J Pathol. 1996;149:675–685. [PMC free article] [PubMed] [Google Scholar]
- 60.Wolf D, Zirlik A, Ley K. Beyond vascular inflammation–recent advances in understanding atherosclerosis. Cell Mol Life Sci. 2015;72:3853–3869. https://doi.org10.1007/s00018-015-1971-6 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Robertson AK, Hansson GK. T cells in atherogenesis: for better orfor worse? Arterioscler Thromb Vasc Biol. 2006;26:2421–2432. https://doi.org10.1161/01.ATV.0000245830.29764.84 [DOI] [PubMed] [Google Scholar]
- 62.Butcher MJ, Filipowicz AR, Waseem TC et al. Atherosclerosisdriven Treg plasticity results in formation of a dysfunctional subset of plastic IFNγ+ Th1/Tregs. Circ Res. 2016;119:1190–1203. https://doi.org10.1161/CIRCRESAHA.116.309764 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Buono C, Binder CJ, Stavrakis G et al. T-bet deficiency reduces atherosclerosis and alters plaque antigenspecific immune responses. Proc Natl Acad Sci USA. 2005;102:1596–1601. https://doi.org10.1073/pnas.0409015102 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Buono C, Come CE, Stavrakis G et al. Influence of interferon-gamma on the extent and phenotype of diet-induced atherosclerosis in the LDLR-deficient mouse.Arterioscler Thromb Vasc Biol. 2003;23:454–460. https://doi.org10.1161/01.ATV.0000059419.11002.6E [DOI] [PubMed] [Google Scholar]
- 65.Gupta S, Pablo AM, Jiang Xc et al. IFNgamma potentiates atherosclerosis in ApoE knock-out mice. J Clin Invest. 1997;99:2752–2761. https://doi.org10.1172/JCI119465 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Amento EP, Ehsani N, Palmer H, Libby P. Cytokines and growth factors positively and negatively regulate interstitial collagen gene expression in human vascular smooth muscle cells. Arterioscler Thromb. 1991;11:1223–1230. [DOI] [PubMed] [Google Scholar]
- 67.Rocha VZ, Folco EJ, Sukhova G et al. Interferon-gamma, a Th1 cytokine, regulates fat inflammation: a role for adaptive immunity in obesity. Circ Res. 2008;103:467–476. https://doi.org10.1161/CIRCRESAHA.108.177105 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.Ait-Oufella H, Salomon BL, Potteaux S et al. Natural regulatory T cells control the development of atherosclerosis in mice. Nat Med. 2006;12:178–180. https://doi.org10.1038/nm1343 [DOI] [PubMed] [Google Scholar]
- 69.Klingenberg R, Gerdes N, Badeau RM et al. Depletion of FOXP3+ regulatory T cells promotes hypercholesterolemia and atherosclerosis. J Clin Invest. 2013;123:1323–1334. https://doi.org10.1172/JCI63891 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.Pinderski Oslund LJ, Hedrick CC, Olvera T et al. Interleukin-10 blocks atherosclerotic events in vitro and in vivo. Arterioscler Thromb Vasc Biol. 1999;19:2847–2853. [DOI] [PubMed] [Google Scholar]
- 71.Robertson AK, Rudling M, Zhou X et al. Disruption of TGF-beta signaling in T cells accelerates atherosclerosis. J Clin Invest. 2003;112:1342–1350. https://doi.org10.1172/JCI18607 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.Foks AC, Lichtman AH, Kuiper J. Treating atherosclerosis with regulatory T cells. Arterioscler Thromb Vasc Biol. 2015;35:280–287. https://doi.org10.1161/ATVBAHA.114.303568 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.Dinh TN, Kyaw TS, Kanellakis P et al. Cytokine therapy with interleukin-2/anti-interleukin-2 monoclonal antibody complexes expands CD4+CD25+Foxp3+ regulatory T cells and attenuates development and progression of atherosclerosis. Circulation. 2012;126:1256–1266. https://doi.org10.1161/CIRCULATIONAHA.112.099044 [DOI] [PubMed] [Google Scholar]
- 74.Kita T, Yamashita T, Sasaki N et al. Regression of atherosclerosis with anti-CD3 antibody via augmenting a regulatory T-cell response in mice. Cardiovasc Res. 2014;102:107–117. https://doi.org10.1093/cvr/cvu002 [DOI] [PubMed] [Google Scholar]
- 75.Caligiuri G, Rudling M, Ollivier V et al. Interleukin-10 deficiency increases atherosclerosis, thrombosis, and low-density lipoproteins in apolipoprotein E knockout mice. Mol Med. 2003;9:10–17. [PMC free article] [PubMed] [Google Scholar]
- 76.Gagliani N, Magnani CF, Huber S et al. Coexpression of CD49b and LAG-3 identifies human and mouse T regulatory type 1 cells. Nat Med. 2013;19:739–746. https://doi.org10.1038/nm.3179 [DOI] [PubMed] [Google Scholar]
- 77.Mallat Z, Gojova A, Brun V et al. Induction of a regulatory T cell type 1 response reduces the development of atherosclerosis in apolipoprotein E-knockout mice. Circulation. 2003;108:1232–1237. https://doi.org10.1161/01.CIR.0000089083.61317.A1 [DOI] [PubMed] [Google Scholar]
- 78.Shimizu K, Shichiri M, Libby P et al. Th2-predominant inflammation and blockade of IFN-gamma signaling induce aneurysms in allografted aortas. J Clin Invest. 2004;114:300–308. https://doi.org10.1172/JCI19855 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.Engelbertsen D, Andersson L, Ljungcrantz I et al. T-helper 2 immunity is associated with reduced risk of myocardial infarction and stroke. Arterioscler Thromb Vasc Biol. 2013;33:637–644. https://doi.org10.1161/ATVBAHA.112.300871 [DOI] [PubMed] [Google Scholar]
- 80.Mallat Z, Taleb S, Ait-Oufella H, Tedgui A. The role of adaptive T cell immunity in atherosclerosis. J Lipid Res. 2009;50(suppl):S364–S369. https://doi.org10.1194/jlr.R800092-JLR200 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.King VL, Szilvassy SJ, Daugherty A. Interleukin-4 deficiency decreases atherosclerotic lesion formation in a site-specific manner in female LDL receptor−/− mice. Arterioscler Thromb Vasc Biol. 2002;22:456–461. [DOI] [PubMed] [Google Scholar]
- 82.Smith E, Prasad KM, Butcher M et al. Blockade of interleukin-17A results in reduced atherosclerosis in apolipoprotein E-deficient mice. Circulation. 2010;121:1746–1755. https://doi.org10.1161/CIRCULATIONAHA.109.924886 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 83.Gao Q, Jiang Y, Ma T et al. A critical function of Th17 proinflammatory cells in the development of atherosclerotic plaque in mice. J Immunol. 2010;185:5820–5827. https://doi.org10.4049/jimmunol.1000116 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 84.Nordlohne J, Helmke A, Ge S et al. Aggravated atherosclerosis and vascular inflammation with reduced kidney function depend on interleukin-17 receptor A and are normalized by inhibition of interleukin-17A. JACC Basic Transl Sci. 2018;3:54–66. https://doi.org10.1016/j.jacbts.2017.08.005 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 85.Danzaki K, Matsui Y, Ikesue M et al. Interleukin-17A deficiency accelerates unstable atherosclerotic plaque formation in apolipoprotein E-deficient mice. Arterioscler Thromb Vasc Biol. 2012;32:273–280. https://doi.org10.1161/ATVBAHA.111.229997 [DOI] [PubMed] [Google Scholar]
- 86.Gisterå A, Robertson AK, Andersson J et al. Transforming growth factor-β signaling in T cells promotes stabilization of atherosclerotic plaques through an interleukin-17-dependent pathway. Sci Transl Med. 2013;5:196ra100 https://doi.org10.1126/scitranslmed.3006133 [DOI] [PubMed] [Google Scholar]
- 87.Brauner S, Jiang X, Thorlacius GE et al. Augmented Th17 differentiation in Trim21 deficiency promotes a stable phenotype of atherosclerotic plaques with high collagen content. Cardiovasc Res. 2018;114:158–167. https://doi.org10.1093/cvr/cvx181 [DOI] [PubMed] [Google Scholar]
- 88.Gaddis DE, Padgett LE, Wu R et al. Apolipoprotein AI prevents regulatory to follicular helper T cell switching during atherosclerosis. Nat Commun. 2018;9:1095 https://doi.org10.1038/s41467-018-03493-5 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 89.Gisterå A, Klement ML, Polyzos KA et al. Low-density lipoprotein-reactive T cells regulate plasma cholesterol levels and development of atherosclerosis in humanized hypercholesterolemic mice. Circulation. 2018;138:2513–2526. https://doi.org10.1161/CIRCULATIONAHA.118.034076 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 90.Sage AP, Murphy D, Maffia P et al. MHC Class II-restricted antigen presentation by plasmacytoid dendritic cells drives proatherogenic T cell immunity. Circulation. 2014;130:1363–1373. https://doi.org10.1161/CIRCULATIONAHA.114.011090 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 91.Zernecke A Dendritic cells in atherosclerosis: evidence in mice and humans. Arterioscler Thromb Vasc Biol. 2015;35:763–770. https://doi.org10.1161/ATVBAHA.114.303566 [DOI] [PubMed] [Google Scholar]
- 92.Koltsova EK, Ley K. How dendritic cells shape atherosclerosis. Trends Immunol. 2011;32:540–547. https://doi.org10.1016/j.it.2011.07.001 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 93.Kyaw T, Winship A, Tay C et al. Cytotoxic and proinflammatory CD8+ T lymphocytes promote development of vulnerable atherosclerotic plaques in apoE-deficient mice. Circulation. 2013;127:1028–1039. https://doi.org10.1161/CIRCULATIONAHA.112.001347 [DOI] [PubMed] [Google Scholar]
- 94.Kolbus D, Ramos OH, Berg KE et al. CD8+ T cell activation predominate early immune responses to hypercholesterolemia in Apoe−(/)− mice. BMC Immunol. 2010;11:58 https://doi.org10.1186/1471-2172-11-58 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 95.Cochain C, Zernecke A. Protective and pathogenic roles of CD8+ T cells in atherosclerosis. Basic Res Cardiol. 2016;111:71 https://doi.org10.1007/s00395-016-0589-7 [DOI] [PubMed] [Google Scholar]
- 96.Winkels H, Ley K. Natural killer cells at ease: atherosclerosis is not affected by genetic depletion or hyperactivation of natural killer cells. Circ Res. 2018;122:6–7. https://doi.org10.1161/CIRCRESAHA.117.312289 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 97.Schiller NK, Boisvert WA, Curtiss LK. Inflammation in atherosclerosis: lesion formation in LDL receptor-deficient mice with perforin and Lyst(beige) mutations. Arterioscler Thromb Vasc Biol. 2002;22:1341–1346. [DOI] [PubMed] [Google Scholar]
- 98.Whitman SC, Rateri DL, Szilvassy SJ et al. Depletion of natural killer cell function decreases atherosclerosis in low-density lipoprotein receptor null mice. Arterioscler Thromb Vasc Biol. 2004;24:1049–1054. https://doi.org10.1161/01.ATV.0000124923.95545.2c [DOI] [PubMed] [Google Scholar]
- 99.Selathurai A, Deswaerte V, Kanellakis P et al. Natural killer (NK) cells augment atherosclerosis by cytotoxic-dependent mechanisms. Cardiovasc Res. 2014;102:128–137. https://doi.org10.1093/cvr/cvu016 [DOI] [PubMed] [Google Scholar]
- 100.Nour-Eldine W, Joffre J, Zibara K et al. Genetic depletion or hyperresponsiveness of natural killer cells do not affect atherosclerosis development. Circ Res. 2018;122:47–57. https://doi.org10.1161/CIRCRESAHA.117.311743 [DOI] [PubMed] [Google Scholar]
- 101.Aslanian AM, Chapman HA, Charo IF. Transient role for CD1drestricted natural killer T cells in the formation of atherosclerotic lesions. Arterioscler Thromb Vasc Biol. 2005;25:628–632. https://doi.org10.1161/01.ATV.0000153046.59370.13 [DOI] [PubMed] [Google Scholar]
- 102.Tupin E, Nicoletti A, Elhage R et al. CD1d-dependent activation of NKT cells aggravates atherosclerosis. J Exp Med. 2004;199:417–422. https://doi.org10.1084/jem.20030997 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 103.Li Y, Kanellakis P, Hosseini H et al. A CD1d-dependent lipid antagonist to NKT cells ameliorates atherosclerosis in ApoE−/− mice by reducing lesion necrosis and inflammation. Cardiovasc Res. 2016;109:305–317. https://doi.org10.1093/cvr/cvv259 [DOI] [PubMed] [Google Scholar]
- 104.Shaw MK, Tse KY, Zhao X et al. T-cells specific for a self-peptide of ApoB-100 exacerbate aortic atheroma in murine atherosclerosis. Front Immunol. 2017;8:95 https://doi.org10.3389/fimmu.2017.00095 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 105.Zhou X, Robertson AK, Hjerpe C, Hansson GK. Adoptive transfer of CD4+ T cells reactive to modified low-density lipoprotein aggravates atherosclerosis. Arterioscler Thromb Vasc Biol. 2006;26:864–870. https://doi.org10.1161/01.ATV.0000206122.61591.ff [DOI] [PubMed] [Google Scholar]
- 106.Hermansson A, Ketelhuth DF, Strodthoff D et al. Inhibition of T cell response to native low-density lipoprotein reduces atherosclerosis. J Exp Med. 2010;207:1081–1093. https://doi.org10.1084/jem.20092243 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 107.Sakaguchi S Naturally arising CD4+ regulatory t cells for immunologic selftolerance and negative control of immune responses. Annu Rev Immunol. 2004;22:531–562. https://doi.org10.1146/annurev.immunol.21.120601.141122 [DOI] [PubMed] [Google Scholar]
- 108.Mor A, Luboshits G, Planer D et al. Altered status of CD4(+)CD25(+) regulatory T cells in patients with acute coronary syndromes. Eur Heart J. 2006;27:2530–2537. https://doi.org10.1093/eurheartj/ehl222 [DOI] [PubMed] [Google Scholar]
- 109.George J, Schwartzenberg S, Medvedovsky D et al. Regulatory T cells and IL-10 levels are reduced in patients with vulnerable coronary plaques. Atherosclerosis. 2012;222:519–523. https://doi.org10.1016/j.atherosclerosis.2012.03.016 [DOI] [PubMed] [Google Scholar]
- 110.Wigren M, Björkbacka H, Andersson L et al. Low levels of circulating CD4+FoxP3+ T cells are associated with an increased risk for development of myocardial infarction but not for stroke. Arterioscler Thromb Vasc Biol. 2012;32:2000–2004. https://doi.org10.1161/ATVBAHA.112.251579 [DOI] [PubMed] [Google Scholar]
- 111.Guasti L, Maresca AM, Schembri L et al. Relationship between regulatory T cells subsets and lipid profile in dyslipidemic patients: a longitudinal study during atorvastatin treatment. BMC Cardiovasc Disord. 2016;16:26 https://doi.org10.1186/s12872-016-0201-y [DOI] [PMC free article] [PubMed] [Google Scholar]
- 112.Mailer RKW, Gisterå A, Polyzos KA et al. Hypercholesterolemia induces differentiation of regulatory T cells in the liver. Circ Res. 2017;120:1740–1753. https://doi.org10.1161/CIRCRESAHA.116.310054 [DOI] [PubMed] [Google Scholar]
- 113.Cheng HY, Gaddis DE, Wu R et al. Loss of ABCG1 influences regulatory T cell differentiation and atherosclerosis. J Clin Invest. 2016;126:3236–3246. https://doi.org10.1172/JCI83136 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 114.Mailer RKW, Gisterå A, Polyzos KA et al. Hypercholesterolemia enhances T cell receptor signaling and increases the regulatory T cell population. Sci Rep. 2017;7:15655 https://doi.org10.1038/s41598-017-15546-8 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 115.Bailey-Bucktrout SL, Martinez-Llordella M, Zhou X et al. Self-antigen-driven activation induces instability of regulatory T cells during an inflammatory autoimmune response. Immunity. 2013;39:949–962. https://doi.org10.1016/j.immuni.2013.10.016 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 116.Komatsu N, Okamoto K, Sawa S et al. Pathogenic conversion of Foxp3+ T cells into TH17 cells in autoimmune arthritis. Nat Med. 2014;20:62–68. https://doi.org10.1038/nm.3432 [DOI] [PubMed] [Google Scholar]
- 117.Korn T, Reddy J, Gao W et al. Myelin-specific regulatory T cells accumulate in the CNS but fail to control autoimmune inflammation. Nat Med. 2007;13:423–431. https://doi.org10.1038/nm1564 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 118.Jia L, Zhu L, Wang JZ et al. Methylation of FOXP3 in regulatory T cells is related to the severity of coronary artery disease. Atherosclerosis. 2013;228:346–352. https://doi.org10.1016/j.atherosclerosis.2013.01.027 [DOI] [PubMed] [Google Scholar]
- 119.Joly AL, Seitz C, Liu S et al. Alternative splicing of FOXP3 controls regulatory T cell effector functions and is associated with human atherosclerotic plaque stability. Circ Res. 2018;122:1385–1394. https://doi.org10.1161/CIRCRESAHA.117.312340 [DOI] [PubMed] [Google Scholar]
- 120.Hilgendorf I, Theurl I, Gerhardt LM et al. Innate response activator B cells aggravate atherosclerosis by stimulating T helper-1 adaptive immunity. Circulation. 2014;129:1677–1687. https://doi.org10.1161/CIRCULATIONAHA.113.006381 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 121.Sage AP, Nus M, Baker LL et al. Regulatory B cell-specific interleukin-10 is dispensable for atherosclerosis development in mice. Arterioscler Thromb Vasc Biol. 2015;35:1770–1773. https://doi.org10.1161/ATVBAHA.115.305568 [DOI] [PubMed] [Google Scholar]
- 122.Strom AC, Cross AJ, Cole JE et al. B regulatory cells are increased in hypercholesterolaemic mice and protect from lesion development via IL-10. Thromb Haemost. 2015;114:835–847. https://doi.org10.1160/TH14-12-1084 [DOI] [PubMed] [Google Scholar]
- 123.Srikakulapu P, Hu D, Yin C et al. Artery tertiary lymphoid organs control multilayered territorialized atherosclerosis B-cell responses in aged ApoE−/− mice. Arterioscler Thromb Vasc Biol. 2016;36:1174–1185. https://doi.org10.1161/ATVBAHA.115.306983 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 124.Nus M, Sage AP, Lu Y et al. Marginal zone B cells control the response of follicular helper T cells to a high-cholesterol diet. Nat Med. 2017;23:601–610. https://doi.org10.1038/nm.4315 [DOI] [PubMed] [Google Scholar]
- 125.Caligiuri G, Nicoletti A, Poirier B, Hansson GK. Protective immunity against atherosclerosis carried by B cells of hypercholesterolemic mice. J Clin Invest. 2002;109:745–753. https://doi.org10.1172/JCI7272 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 126.Major AS, Fazio S, Linton MF. B-lymphocyte deficiency increases atherosclerosis in LDL receptor-null mice. Arterioscler Thromb Vasc Biol. 2002;22:1892–1898. [DOI] [PubMed] [Google Scholar]
- 127.Srikakulapu P, McNamara CA. B cells and atherosclerosis. Am J Physiol Heart Circ Physiol. 2017;312:H1060–H1067. https://doi.org10.1152/ajpheart.00859.2016 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 128.Hosseini H, Li Y, Kanellakis P et al. Phosphatidylserine liposomes mimic apoptotic cells to attenuate atherosclerosis by expanding polyreactive IgM producing b1a lymphocytes. Cardiovasc Res. 2015;106:443–452. [DOI] [PubMed] [Google Scholar]
- 129.Chou MY, Fogelstrand L, Hartvigsen K et al. Oxidation-specific epitopes are dominant targets of innate natural antibodies in mice and humans. J Clin Invest. 2009;119:1335–1349. https://doi.org10.1172/JCI36800 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 130.Binder CJ, Hörkkö S, Dewan A et al. Pneumococcal vaccination decreases atherosclerotic lesion formation: molecular mimicry between Streptococcus pneumoniae and oxidized LDL. Nat Med. 2003;9:736–743. https://doi.org10.1038/nm876 [DOI] [PubMed] [Google Scholar]
- 131.Grasset EK, Duhlin A, Agardh HE et al. Sterile inflammation in the spleen during atherosclerosis provides oxidation-specific epitopes that induce a protective B-cell response. Proc Natl Acad Sci USA. 2015;112:E2030–E2038. https://doi.org10.1073/pnas.1421227112 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 132.Karvonen J, Päivänsalo M, Kesäniemi YA, Hörkkö S. Immunoglobulin M type of autoantibodies to oxidized low-density lipoprotein has an inverse relation to carotid artery atherosclerosis. Circulation. 2003;108:2107–2112. https://doi.org10.1161/01.CIR.0000092891.55157.A7 [DOI] [PubMed] [Google Scholar]
- 133.Tsimikas S, Brilakis ES, Lennon RJ et al. Relationship of IgG and IgM autoantibodies to oxidized low density lipoprotein with coronary artery disease and cardiovascular events. J Lipid Res. 2007;48:425–433. https://doi.org10.1194/jlr.M600361-JLR200 [DOI] [PubMed] [Google Scholar]
- 134.Hulthe J, Bokemark L, Fagerberg B. Antibodies to oxidized LDL in relation to intima-media thickness in carotid and femoral arteries in 58-yearold subjectively clinically healthy men. Arterioscler Thromb Vasc Biol. 2001;21:101–107. [DOI] [PubMed] [Google Scholar]
- 135.Dotevall A, Hulthe J, Rosengren A et al. Autoantibodies against oxidized low-density lipoprotein and C-reactive protein are associated with diabetes and myocardial infarction in women. Clin Sci (Lond). 2001;101:523–531. [PubMed] [Google Scholar]
- 136.Ravandi A, Boekholdt SM, Mallat Z et al. Relationship of IgG and IgM autoantibodies and immune complexes to oxidized LDL with markers of oxidation and inflammation and cardiovascular events: results from the EPIC-Norfolk Study. J Lipid Res. 2011;52:1829–1836. https://doi.org10.1194/jlr.M015776 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 137.Tsimikas S, Miyanohara A, Hartvigsen K et al. Human oxidation-specific antibodies reduce foam cell formation and atherosclerosis progression. J Am Coll Cardiol. 2011;58:1715–1727. https://doi.org10.1016/j.jacc.2011.07.017 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 138.Sjögren P, Fredrikson GN, Samnegard A et al. High plasma concentrations of autoantibodies against native peptide 210 of apoB-100 are related to less coronary atherosclerosis and lower risk of myocardial infarction. Eur Heart J. 2008;29:2218–2226. https://doi.org10.1093/eurheartj/ehn336 [DOI] [PubMed] [Google Scholar]
- 139.Gillotte-Taylor K, Boullier A, Witztum JL, Steinberg D, Quehenberger O. Scavenger receptor class B type I as a receptor for oxidized low density lipoprotein. J Lipid Res. 2001;42:1474–1482. [PubMed] [Google Scholar]
- 140.Hörkkö S, Bird DA, Miller E et al. Monoclonal autoantibodies specific for oxidized phospholipids or oxidized phospholipid-protein adducts inhibit macrophage uptake of oxidized low-density lipoproteins. J Clin Invest. 1999;103:117–128. https://doi.org10.1172/JCI4533 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 141.Lewis MJ, Malik TH, Ehrenstein MR et al. Immunoglobulin M is required for protection against atherosclerosis in low-density lipoprotein receptor-deficient mice. Circulation. 2009;120:417–426. https://doi.org10.1161/CIRCULATIONAHA.109.868158 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 142.Cesena FH, Dimayuga PC, Yano J et al. Immune-modulation by polyclonal IgM treatment reduces atherosclerosis in hypercholesterolemic apoE−/− mice. Atherosclerosis. 2012;220:59–65. https://doi.org10.1016/j.atherosclerosis.2011.10.002 [DOI] [PubMed] [Google Scholar]
- 143.Que X, Hung MY, Yeang C et al. Oxidized phospholipids are proinflammatory and proatherogenic in hypercholesterolaemic mice. Nature. 2018;558:301–306. https://doi.org10.1038/s41586-018-0198-8 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 144.Kyaw T, Tay C, Krishnamurthi S et al. B1a B lymphocytes are atheroprotective by secreting natural IgM that increases IgM deposits and reduces necrotic cores in atherosclerotic lesions. Circ Res. 2011;109:830–840. https://doi.org10.1161/CIRCRESAHA.111.248542 [DOI] [PubMed] [Google Scholar]
- 145.Rosenfeld SM, Perry HM, Gonen A et al. B-1b cells secrete atheroprotective IgM and attenuate atherosclerosis. Circ Res. 2015;117:e28–e39. https://doi.org10.1161/CIRCRESAHA.117.306044 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 146.Ait-Oufella H, Sage AP, Mallat Z, Tedgui A. Adaptive (T and B cells) immunity and control by dendritic cells in atherosclerosis. Circ Res. 2014;114:1640–1660. https://doi.org10.1161/CIRCRESAHA.114.302761 [DOI] [PubMed] [Google Scholar]
- 147.Tsimikas S, Palinski W, Witztum JL. Circulating autoantibodies to oxidized LDL correlate with arterial accumulation and depletion of oxidized LDL in LDL receptor-deficient mice. Arterioscler Thromb Vasc Biol. 2001;21:95–100. [DOI] [PubMed] [Google Scholar]
- 148.Ylä-Herttuala S, Palinski W, Butler SW et al. Rabbit and human atherosclerotic lesions contain IgG that recognizes epitopes of oxidized LDL. Arterioscler Thromb. 1994;14:32–40. [DOI] [PubMed] [Google Scholar]
- 149.Björkbacka H, Alm R, Persson M et al. Low levels of apolipoprotein B-100 autoantibodies are associated with increased risk of coronary events. Arterioscler Thromb Vasc Biol. 2016;36:765–771. https://doi.org10.1161/ATVBAHA.115.306938 [DOI] [PubMed] [Google Scholar]
- 150.Kyaw T, Tay C, Hosseini H et al. Depletion of B2 but not B1a B cells in BAFF receptor-deficient ApoE mice attenuates atherosclerosis by potently ameliorating arterial inflammation. PLoS One. 2012;7:e29371 https://doi.org10.1371/journal.pone.0029371 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 151.Kyaw T, Tay C, Khan A et al. Conventional B2 B cell depletion ameliorates whereas its adoptive transfer aggravates atherosclerosis. J Immunol. 2010;185:4410–4419. https://doi.org10.4049/jimmunol.1000033 [DOI] [PubMed] [Google Scholar]
- 152.Ait-Oufella H, Herbin O, Bouaziz JD et al. B cell depletion reduces the development of atherosclerosis in mice. J Exp Med. 2010;207:1579–1587. https://doi.org10.1084/jem.20100155 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 153.Sage AP, Nus M, Bagchi Chakraborty J et al. X-box binding protein-1 dependent plasma cell responses limit the development of atherosclerosis. Circ Res. 2017;121:270–281. https://doi.org10.1161/CIRCRESAHA.117.310884 [DOI] [PubMed] [Google Scholar]
- 154.Tay C, Liu YH, Kanellakis P et al. Follicular B cells promote atherosclerosis via T cell-mediated differentiation into plasma cells and secreting pathogenic immunoglobulin G. Arterioscler Thromb Vasc Biol. 2018;38:e71–e84. https://doi.org10.1161/ATVBAHA.117.310678 [DOI] [PubMed] [Google Scholar]
- 155.Schiopu A, Bengtsson J, Söderberg I et al. Recombinant human antibodies against aldehyde-modified apolipoprotein B-100 peptide sequences inhibit atherosclerosis. Circulation. 2004;110:2047–2052. https://doi.org10.1161/01.CIR.0000143162.56057.B5 [DOI] [PubMed] [Google Scholar]
- 156.Schiopu A, Frendéus B, Jansson B et al. Recombinant antibodies to an oxidized low-density lipoprotein epitope induce rapid regression of atherosclerosis in apobec-1(−/−)/low-density lipoprotein receptor(−/−) mice. J Am Coll Cardiol. 2007;50:2313–2318. https://doi.org10.1016/j.jacc.2007.07.081 [DOI] [PubMed] [Google Scholar]
- 157.Lehrer-Graiwer J, Singh P, Abdelbaky A et al. FDG-PET imaging for oxidized LDL in stable atherosclerotic disease: a phase II study of safety, tolerability, and anti-inflammatory activity. JACC Cardiovasc Imaging. 2015;8:493–494. https://doi.org10.1016/j.jcmg.2014.06.021 [DOI] [PubMed] [Google Scholar]
- 158.Palinski W, Miller E, Witztum JL. Immunization of low density lipoprotein (LDL) receptor-deficient rabbits with homologous malondialdehyde-modified LDL reduces atherogenesis. Proc Natl Acad Sci USA. 1995;92:821–825. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 159.Freigang S, Hörkkö S, Miller E et al. Immunization of LDL receptor-deficient mice with homologous malondialdehydemodified and native LDL reduces progression of atherosclerosis by mechanisms other than induction of high titers of antibodies to oxidative neoepitopes. Arterioscler Thromb Vasc Biol. 1998;18:1972–1982. [DOI] [PubMed] [Google Scholar]
- 160.Zhu L, He Z, Wu F et al. Immunization with advanced glycation end products modified low density lipoprotein inhibits atherosclerosis progression in diabetic apoE and LDLR null mice. Cardiovasc Diabetol. 2014;13:151 https://doi.org10.1186/s12933-014-0151-6 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 161.Kimura T, Tse K, McArdle S et al. Atheroprotective vaccination with MHCII-restricted ApoB peptides induces peritoneal IL-10-producing CD4 T cells. Am J Physiol Heart Circ Physiol. 2017;312:H781–H790. https://doi.org10.1152/ajpheart.00798.2016 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 162.Fredrikson GN, Söderberg I, Lindholm M et al. Inhibition of atherosclerosis in apoE-null mice by immunization with apoB-100 peptide sequences. Arterioscler Thromb Vasc Biol. 2003;23:879–884. https://doi.org10.1161/01.ATV.0000067937.93716.DB [DOI] [PubMed] [Google Scholar]
- 163.Honjo T, Chyu KY, Dimayuga PC et al. ApoB-100-related peptide vaccine protects against angiotensin II-induced aortic aneurysm formation and rupture. J Am Coll Cardiol. 2015;65:546–556. https://doi.org10.1016/j.jacc.2014.11.054 [DOI] [PubMed] [Google Scholar]
- 164.Wigren M, Kolbus D, Dunér P et al. Evidence for a role of regulatory T cells in mediating the atheroprotective effect of apolipoprotein B peptide vaccine. J Intern Med. 2011;269:546–556. https://doi.org10.1111/j.1365-2796.2010.02311.x [DOI] [PubMed] [Google Scholar]
- 165.Herbin O, Ait-Oufella H, Yu W et al. Regulatory T-cell response to apolipoprotein B100-derived peptides reduces the development and progression of atherosclerosis in mice. Arterioscler Thromb Vasc Biol. 2012;32:605–612. https://doi.org10.1161/ATVBAHA.111.242800 [DOI] [PubMed] [Google Scholar]
- 166.Klingenberg R, Lebens M, Hermansson A et al. Intranasal immunization with an apolipoprotein B-100 fusion protein induces antigen-specific regulatory T cells and reduces atherosclerosis. Arterioscler Thromb Vasc Biol. 2010;30:946–952. https://doi.org10.1161/ATVBAHA.109.202671 [DOI] [PubMed] [Google Scholar]
- 167.Hermansson A, Johansson DK, Ketelhuth DF et al. Immunotherapy with tolerogenic apolipoprotein B-100-loaded dendritic cells attenuates atherosclerosis in hypercholesterolemic mice. Circulation. 2011;123:1083–1091. https://doi.org10.1161/CIRCULATIONAHA.110.973222 [DOI] [PubMed] [Google Scholar]
- 168.Kobiyama K, Vassallo M, Mitzi J et al. A clinically applicable adjuvant for an atherosclerosis vaccine in mice. Eur J Immunol. 2018;48:1580–1587. https://doi.org10.1002/eji.201847584 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 169.Gisterå A, Hermansson A, Strodthoff D et al. Vaccination against T-cell epitopes of native ApoB100 reduces vascular inflammation and disease in a humanized mouse model of atherosclerosis. J Intern Med. 2017;281:383–397. https://doi.org10.1111/joim.12589 [DOI] [PubMed] [Google Scholar]
- 170.Wigren M, Bengtsson D, Dunér P et al. Atheroprotective effects of Alum are associated with capture of oxidized LDL antigens and activation of regulatory T cells. Circ Res. 2009;104:e62–e70. https://doi.org10.1161/CIRCRESAHA.109.196667 [DOI] [PubMed] [Google Scholar]
- 171.Khallou-Laschet J, Tupin E, Caligiuri G et al. Atheroprotective effect of adjuvants in apolipoprotein E knockout mice. Atherosclerosis. 2006;184:330–341. https://doi.org10.1016/j.atherosclerosis.2005.04.021 [DOI] [PubMed] [Google Scholar]
- 172.Buscher K, Ehinger E, Gupta P et al. Natural variation of macrophage activation as disease-relevant phenotype predictive of inflammation and cancer survival. Nat Commun. 2017;8:16041 https://doi.org10.1038/ncomms16041 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 173.Bennett BJ, Davis RC, Civelek M et al. Correction: genetic architecture of atherosclerosis in mice: a systems genetics analysis of common inbred strains. PLoS Genet. 2016;12:e1005913 https://doi.org10.1371/journal.pgen.1005913 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 174.Beura LK, Hamilton SE, Bi K et al. Normalizing the environment recapitulates adult human immune traits in laboratory mice. Nature. 2016;532:512–516. https://doi.org10.1038/nature17655 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 175.Mihaylova B, Emberson J, Blackwell L et al. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet. 2012;380:581–590. https://doi.org10.1016/S0140-6736(12)60367-5 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 176.Ridker PM, Danielson E, Fonseca FA et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 2008;359:2195–2207. https://doi.org10.1056/NEJMoa0807646 [DOI] [PubMed] [Google Scholar]
- 177.Schönbeck U, Libby P. Inflammation, immunity, and HMG-CoA reductase inhibitors: statins as antiinflammatory agents? Circulation. 2004;109:II18–II26. https://doi.org10.1161/01.CIR.0000129505.34151.23 [DOI] [PubMed] [Google Scholar]
- 178.Nicholls SJ, Ballantyne CM, Barter PJ et al. Effect of two intensive statin regimens on progression of coronary disease. N Engl J Med. 2011;365:2078–2087. https://doi.org10.1056/NEJMoa1110874 [DOI] [PubMed] [Google Scholar]
- 179.Robinson JG, Farnier M, Krempf M et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med. 2015;372:1489–1499. https://doi.org10.1056/NEJMoa1501031 [DOI] [PubMed] [Google Scholar]
- 180.Sabatine MS, Giugliano RP, Keech AC et al. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med. 2017;376:1713–1722. https://doi.org10.1056/NEJMoa1615664 [DOI] [PubMed] [Google Scholar]
- 181.Sahebkar A, Di Giosia P, Stamerra CA et al. Effect of monoclonal antibodies to PCSK9 on high-sensitivity C-reactive protein levels: a meta-analysis of 16 randomized controlled treatment arms. Br J Clin Pharmacol. 2016;81:1175–1190. https://doi.org10.1111/bcp.12905 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 182.Bohula EA, Giugliano RP, Leiter LA et al. Inflammatory and cholesterol risk in the FOURIER Trial. Circulation. 2018;138:131–140. https://doi.org10.1161/CIRCULATIONAHA.118.034032 [DOI] [PubMed] [Google Scholar]
- 183.Nidorf SM, Eikelboom JW, Budgeon CA, Thompson PL. Low-dose colchicine for secondary prevention of cardiovascular disease. J Am Coll Cardiol. 2013;61:404–410. https://doi.org10.1016/j.jacc.2012.10.027 [DOI] [PubMed] [Google Scholar]
- 184.Ridker PM, Everett BM, Thuren T et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease. N Engl J Med. 2017;377:1119–1131. https://doi.org10.1056/NEJMoa1707914 [DOI] [PubMed] [Google Scholar]
- 185.Ridker PM, Everett BM, Pradhan A et al. Low-dose methotrexate for the prevention of atherosclerotic events [published online November 10, 2018]. N Engl J Med. https://doi.org10.1056/NEJMoa1809798 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 186.Taleb A, Tsimikas S. Lipoprotein oxidation biomarkers for cardiovascular risk: what does the future hold? Expert Rev Cardiovasc Ther. 2012;10:399–402. https://doi.org10.1586/erc.12.32 [DOI] [PubMed] [Google Scholar]