Abstract
Periprosthetic joint infection (PJI) has devastating consequences on joint function and the morbidity and mortality rate of patients who are victims of this serious complication. Although early diagnosis is one of the consensuses with well-established importance, routine workup is still conducted on an empirical, inconsistent, and nonobjective basis in many centers around the world. The present article seeks to contextualize the current state of knowledge about the early diagnosis of PJIs, as well as to discuss the advances and perspectives, within a scenario of its routine use by the healthcare team responsible for managing this dreaded complication.
Keywords: hip prosthesis, biomarkers, microbiology, signs and symptoms
Introduction
Periprosthetic joint infection (PJI) is one of the most feared complications of total hip replacement (THR), both by surgeons and patients, since its occurrence can result in permanent joint functional deficits or even be life-threatening in more extreme situations. Although its incidence is progressively reducing, from a rate of up to 10%, in the 1960s, 1 to 0,5- 2% , in the current days, there is a growing increase in the absolute number of PJIs resulting from the higher demand for hip arthroplasty procedures, to the point in which PJI has become one of the 3 most frequent causes of revision THR surgeries in many centers. 2
Although significant advances have been achieved in antibiotic prophylaxis and in increased knowledge of the risk factors, of the pathophysiology, and of the role of biofilms in PJIs, the evidence is not yet shared in a consensual way in different parts of the world, or even in different regions of the same country. However, therapeutic controversies aside, there is a strong consensus regarding the absolute requirement for an early diagnosis.
Early diagnosis and intervention may mitigate the need for numerous repeated procedures, reduce functional sequelae, and, most notably, contribute to lower morbidity and mortality rates. Due to the absence of a single, gold standard test for the diagnosis of PJI, clinical findings, imaging, and combinations of various blood, synovial fluid (SF), and periprosthetic tissues biomarkers, as well as biomarkers from fluids obtained through the sonication of explants, and, more recently, genetic sequencing results, are considered. 3 However, the principles of early diagnosis are not applied consistently, uniformly, and objectively in several centers, thus contributing to an unacceptable failure of the therapeutic procedures performed subsequently.
The present paper aims to evaluate the current state of the knowledge regarding early PJI diagnosis, as well as to discuss the advances and perspectives, within a scenario of routine applicability, by the medical team responsible for managing this serious complication.
Definition of Periprosthetic Joint Infection
Although widely investigated today, there is still no universally accepted standard for the definition of PJI and, therefore, for its diagnosis ( Table 1 ). This is a very relevant aspect, since it can influence the early identification and the reported prevalence of PJI, as well as make it difficult to interpret and to compare findings from different clinical researches.
Table 1. Periprosthetic Joint Infection (PJI) Diagnostic Criteria.
| Diagnostic Criteria | Berbari et al (1998) 4 | Musculoskeletal Infection Society (MSIS) 5 | Infectious Diseases Society of America (IDSA) 6 | International Consensus on Periprosthetic Joint Infection (I ICM) 7 | ||||
|---|---|---|---|---|---|---|---|---|
| Major criteria | Minor criteria | Major criteria | Minor criteria | Major criteria | Minor criteria | Major criteria | Minor criteria | |
| Joint sinus tract | X | X | X | X | ||||
| ≥ 2 positive cultures from SF and/or PPT (identical MO) | X | X | X | X | ||||
| Periprosthetic pus accumulation | X | X | X | |||||
| Increased ESR and CRP in blood | X | X | ||||||
| Leukocytosis in SF | X | X | ||||||
| Neutrophilia in SF | X | X | ||||||
| Histology: PPT inflammation | X | X | X | X | ||||
| Single positive culture (SF or PPT) | X | X | X | |||||
Abbreviations: CRP, C-reactive protein; ESR, erythrocyte sedimentation rate; MO, microorganism; PPT, periprosthetic tissue; SF, synovial fluid.
Berbari et al 4 established the occurrence of cutaneous fistula with the prosthetic joint and/or the presence of two positive cultures with the identification of identical microorganisms (MOs), either in the SF or in the periprosthetic tissue, as definitive (major) criteria for the diagnosis and/or the presence of an acute inflammatory process in the periprosthetic tissue, as well as the observation of accumulation of periprosthetic pus. Although the accumulation of periprosthetic pus is considered a major criterion for the diagnosis of PJI in the previous version of the Musculoskeletal Infection Society (MSIS) document, 5 as well as by the Infectious Diseases Society of America (IDSA), 6 more recently, the International Consensus on Periprosthetic Joint Infections (CIAP-2013) 7 does not recognize this finding either as a major criterion or even as a minor diagnostic criterion. In fact, accumulation of periprosthetic pus can be observed in other noninfectious hip arthroplasty complications, such as in adverse local tissue reactions (ALTR), whether as an osteolysis reaction to polyethylene particles ( Fig. 1 ) or to metallic particles from the metal-on-metal prosthesis surface. Nevertheless, this finding has been reconsidered by many experts as a minor criterion to be evaluated.
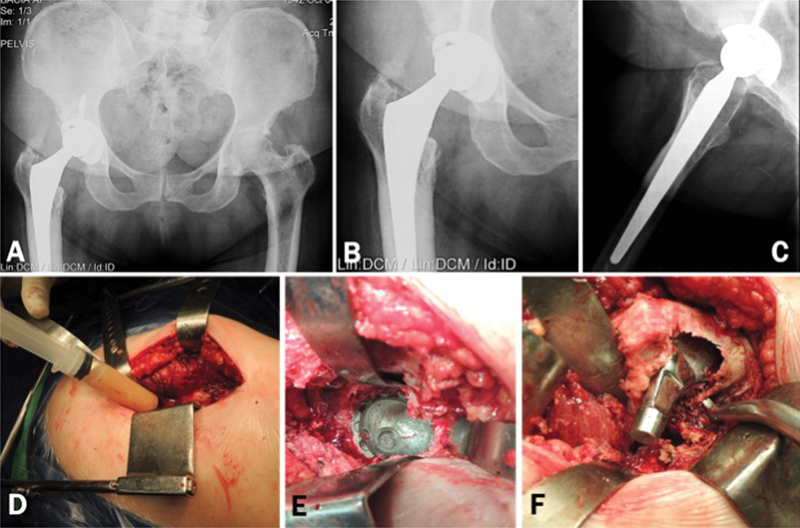
Fig. 1.
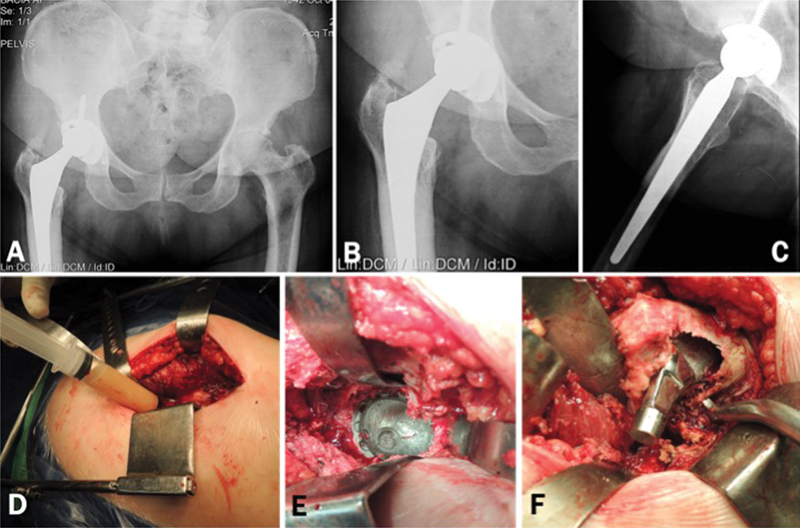
Asymptomatic patient submitted to total hip arthroplasty 4 years ago. Radiographically we observe the excessive wear of the polyethylene, not compatible with the period of service of the implants. ( Fig 1. A–C ). We performed revision surgery despite the absence of clinical manifestations or tests indicative of infection. Preoperative tests: ESR = 19mm, CRP = 29.2 mg/L, dimer D = 530 ng/mL Intraoperative aspiration of the hip revealed an abundant amount of purulent-looking liquid. ( Fig. 1-D ) We could not observe any signs of infected periprosthetic tissues, acetabular loosening or third body abrasion. ( Fig. 1-E ) Large area of osteolysis was observed in the posteromedial region of the proximal femur, which extended to the trochanteric region. After curetting the whitish and friable tissue, an extensive area of bone loss could be seen in the proximal femur. ( Fig. 1-F ) Intraoperative tests: Leukocyte esterase: +; Synovial leukocytes: 52,800; % Neutrophils: 50%. All cultures of periprosthetic tissue and 1 culture of synovial fluid (in blood culture medium) were negative after 8 days of incubation. Up to 18 months postoperatively, the patient was asymptomatic and without any changes in the serum markers for infection.
The most common definition currently used is the one proposed by the CIAP-2013, 7 according to which joint fistula or two positive cultures with phenotypically identical MOs are considered as major criteria, that is, sufficient by themselves to define and diagnose PJI. On the other hand, there must be at least three of the following minor criteria:
Erythrocyte sedimentation rate (ESR) > 30 mm for chronic infections, and C-reactive protein (CRP) level > 10 mg/L for chronic infections or > 100 mg/L for acute infections;
Leukocytes in the SF > 3,000/μL or leukocyte esterase +/++
Percentage of neutrophils in the SF > 80%
Histology of the periprosthetic tissue with more than 5 neutrophils in at least 5 fields at a magnification of 400x
A positive culture
Regarding the minor criteria, considering the current efforts to search for more sensitive and specific tests, it has not yet been possible to establish a gold standard. Thus, the clinical findings, as well as several different serum or SF markers have been proposed for the diagnosis of PJI. A first factor that may interfere with the results from these criteria is related to the clinical presentation and time of onset of PJI. 8 This aspect highlights the importance of the classification of periprosthetic infection in the process of early diagnosis.
Classification of Periprosthetic Joint Infection
Despite the numerous classifications described in the literature since the initial proposal by Coventry, 9 the Tsukayama classification 10 11 is the most frequently used in clinical research. This classification adds to the presentation (acute or chronic) the period of development of symptoms after the initial surgery (early or late), and it recognizes not only the mode of infestation by distant foci (hematogenic or endogenous) or by perioperative MO inoculation (exogenous), but also infections diagnosed by positive cultures from SF or from periprosthetic tissues in revision surgeries in patients with presumably aseptic arthroplasty failure ( Table 2 ). However, there are controversies as to the time interval for the definition of prosthetic infections. Zimmerli et al 12 proposed a classification considering the early type, such as during the 1 st 3 months after surgery, a delayed type, between 3 months and 2 years, and a late type, 2 years after the index procedure. The authors argue that this distinction correlates with important differences observed in the etiological agent, since more virulent microbes, such as Staphylococcus aureus , tend to cause earlier infections, whereas more indolent or fastidious agents, such as coagulase-negative Staphylococci or Cutibacterium acnes , account for delayed infections.
Table 2. Classification according to Tsukayama et al (2003) 11 .
| Infection type/features | I. Positive intraoperative culture | II. Early postoperative infection | III. Acute hematogenic infection | IV. Late chronic infection |
|---|---|---|---|---|
| Symptoms start after baseline surgery | ____ | Up to 4 weeks | After an asymptomatic period | After 4 weeks |
| Mechanism | ____ | Exogenous | Hematogenic | Exogenous or hematogenic |
| Most common etiological agent | Coagulase-negative Staphylococci (epidermidis) | Staphylococci (Coagulase-positive and negative), Gram-negative Bacilli | Coagulase-positive Staphylococci +, Streptococci | Staphylococci (Coagulase-positive and negative), Gram-negative Bacilli |
| Clinical presentation | Painful arthroplasty | Fever, inflammatory signs, persistent drainage, no sinus tract | Fever, inflammatory signs, no sinus tract | Fever, sinus tract, drainage, pus accumulation, local edema |
However, it is worth noting, that the Tsukayama classification fulfills several requirements for an adequate evaluation of the most important information for the characterization of PJI. At the same time, the 4-week limit for early acute infections delimits a postoperative recovery period in which wound healing and functional performance are still in progress, CRP levels approach baseline values, and there is no consolidation yet of the biofilm formation process for a possible infection. In addition, the cutoff values for blood and synovial biomarkers during the 1 st 4 weeks are different from subsequent cutoff levels. In this circumstance, more conservative treatment measures, such as retention of prosthetic implants, may be warranted. On the other hand, the development of infectious signs and symptoms after 4 weeks demonstrates the character of exogenous postoperative infections at a time in which functional rescue and the healing of soft parts should have already happened, while the necessary time has elapsed for complete biofilm establishment and maturation. As such, more radical therapeutic measures must be carried out. If we consider that the characterization of a hematogenous infection requires an asymptomatic postoperative period, the 4-week period is also enough to indicate if the recovery was adequate or not. Moreover, the clinical picture is different in acute or chronic patients, with different clinical presentations and marked quantitative differences in blood, SF, and periprosthetic tissues biomarkers.
Clinical Diagnosis of Periprosthetic Joint Infection (Signs and Symptoms)
Since there is no gold standard for the diagnosis of PJI, the clinical practice is based on guidelines and on consensuses using the clinical picture and blood or SF biomarkers (less invasive technique), periprosthetic tissue histology, and bacteriology to identify the etiological agent in the SF or in the periprosthetic tissue by pre- or intraoperative cultures, or even by molecular techniques. Thus, within the diagnostic context of PJI, the clinical practice has two different dimensions. The diagnosis of infection implies recognizing a syndromic picture of prosthetic infection that allows its differentiation from other causes of painful THR. that is, the differentiation of septic and aseptic causes, which allows for an earlier intervention. To do so, clinical information, biomarkers, and images are used. On the other hand, the diagnosis of prosthetic infection implies the recognition of the etiological agent or agents by periprosthetic fluid and tissue cultures and, more recently, by molecular techniques. The knowledge of the etiological agent will influence the decision-making process regarding the most effective treatment. Thus, a more detailed investigation that leads to the etiological diagnosis should follow the syndromic diagnosis.
Clinical information often presents low sensitivity and/or specificity for the diagnosis of PJI, especially when analyzed within a broader context, in which the period and presentation of the infectious condition are not considered. To facilitate the identification and the nature of the main signs and symptoms possibly indicating a septic origin for the prosthetic reconstruction defect, the following criteria were standardized: pain, fever, periprosthetic inflammation (joint effusion, edema, local heat, hyperemia), superficial disturbances of the surgical site (persistent nonpurulent drainage, delayed healing, or superficial and localized dehiscence of the surgical wound), or deep soft tissue involvement (cutaneous fistula involving the joint, suppuration or accumulation of pus, abscess, or extensive necrosis), and functional joint disorders in the form of stiffness or reduced range of motion. 13
Using this standardization of signs and symptoms, we performed recently a systematic review of the literature on the clinical findings of PJI, including 4,128 infected arthroplastic procedures. 13 We observed that pain is the most sensitive symptom, but with a low specificity for the clinical picture of PJI ( Table 3 ). Considering all types of PJI, pain alone has a predominant incidence, whereas early postoperative infection has a clinical picture characterized mainly by pain, superficial surgical site disturbances, periarticular inflammatory signs, and involvement of deeper planes. Fever has a lower incidence in this type of PJI, because hyperthermia is common during the 1 st 5 postoperative days, even though there is no underlying infectious process; it is, therefore, a manifestation of the response to the surgical trauma. 14 Joint functional disorders are underreported in the literature, which hampered its evaluation.
Table 3. Analysis of combined incidence and clinical findings for nonspecific and specific periprosthetic joint infections regarding presentation time and type 13 .
| (Combined) Clinical Findings | Analysis of the clinical findings for nonspecific PJIs | Incidence of the clinical findings for nonspecific and Specific PJIs. Average % (95%CI) |
||||||
|---|---|---|---|---|---|---|---|---|
|
N
o
AC/Controls
(N o PJIs THR/ TKR/ others) |
Sensitivity % (95%CI) | Specificity % (95%CI) | Accuracy % (95%CI) | Nonspecific PJI | Early postoperative PJI | Acute hematogenic PJI | Late chronic PJI | |
| Pain | 225/237 (77/18/ 0) | 57.9 (47.3–67.9) | 28.3 (22.6–34.5) | 36.7 (31.5–42.2) | 77.2 (74.5–79.9) | 54.7 (51.3–58.0) | 92.8 (89.1–96.6) | 82.9 (77.5–88.3) |
| Fever | 17/205 (62/3/ 0) | 13.8 (6.5–24.7) | 96.1 (92.5–98.3) | 76.3 (70.7–81.2) | 31.2 (28.2–34.1) | 32.5 (29.4–35.5) | 75.5 (71.3–79.7) | 14.0 (10.4–17.6) |
| Periarticular inflammation a | 113/716 (316/220/0) | 14.9 (11.9–18.4) | 94.7 (92.8–96.2) | 61.8 (59.0–64.6) | 35.9 (33.2–38.6) | 49.0 (44.8–53.3) | 69.7 (60.1–79.2) | 18.4 (14.9–22.0) |
| Superficial disturbances at the surgical site b | 487/1,771 (538/392/ 0) | 23.6 (21.3–26.1) | 88.6 (87,0–90.0) | 61.8 (59.9–63.5) | 40.4 (37.5–43.2) | 46.8 (40.6–53.0) | NR | 24.1 (17.9–30.2) |
| Deep soft parts involvement c | 24/62 (4/17/ 3) | 43.7 (29.5–58.8) | 100.0 (97.0–100.0) | 84.3 (78.0–89.4) | 38.8 (35.4–42.1) | 44.0 (40.7–47.4) | 11.0 (8.1–14.0) | 26.3 (21.8–30.9) |
| Joint dysfunction d | NR | NR | NR | NR | 74.4 (69.9–78.9) | NR | 20.5 (1 reference) | 41.7 (1 reference) |
|
Total number of included PJIs
(THR/ TKR/ others) |
976 (561/412/ 3) | __ | __ | __ | 2523 (1421/ 1071/ 31) | 902 (491/ 408/ 3) | 435 (152/ 274/ 9) | 607 (385/ 181/ 41) |
Abbreviations: N o AC: observed clinical findings - (True +) + (False +). CI, confidence interval; NR, not reported; PJI, periprosthetic joint infection; THR; total hip replacement; TKR, total knee replacement.
Combined for joint effusion/edema, heat and/or erythema.
Composite for delayed healing, persistent non-purulent drainage and/or superficial dehiscence.
Composite for deep sinus tract, purulent drainage, abscess and/or extensive necrosis.
Composite for rigidity and/or reduced range of joint motion.
Acute hematogenous infection, which begins after an asymptomatic period of prosthetic reconstruction, presents mainly with severe pain, fever, and periarticular inflammatory signs. Concurrent bacteremia accounts for systemic signs/symptoms of infection.
On the other hand, in late chronic infections, pain is the main symptom, accompanied by periarticular soft tissue disorders and joint dysfunction. It is not uncommon that painful arthroplasty, with no other marked manifestations, is the only indication of late chronic PJI caused by low virulence agents. This picture can be seen when positive intraoperative cultures are obtained in revision surgeries due to clinical suspicion of aseptic causes, especially if performed < 5 years after the index procedure, and if mechanical or functional causes could not be identified by conventional investigations. 15
It is always very useful to evaluate the risk factors for infection in patients with arthroplastic procedure failure, since these factors may be associated with a higher PJI prevalence; moreover, they are even used as scores for the construction of risk calculators. More recently, an analysis of 43,253 total arthroplasties, including 1,035 PJIs, identified as risk factors for infection, in decreasing order of incidence: prior joint surgery, injectable drug abuse, revision surgery, acquired immune deficiency syndrome (AIDS), coagulopathy, renal disease, congestive heart failure, psychoses, rheumatic diseases, knee arthroplasty, diabetes, anemia, male gender, liver disease, smoking, and body mass index (BMI). 16 The authors acknowledged that these conditions are independent risk factors for PJI.
Thus, based on the clinical suspicion of a syndromic condition, although not fully compatible with PJI, it is necessary to investigate serum markers and images.
Serum Biomarkers in the Diagnosis of Periprosthetic Joint Infection
Blood biomarkers are intended to quantitatively portray the response of the body to the underlying inflammatory/infective process, using an increasing number of more specific antimicrobial proteins and proinflammatory cytokines. Initially, serum markers are often preferable to SF markers because they are less invasive, less costly, and allow sequential measurements with no risk of iatrogenic joint infections.
The usefulness of leukocytes count as a PJI indicator is very restricted because of its low sensitivity (45%), except for acute hematogenic PJI associated with bacteremia, in which leukocytosis may be significant.
The serum markers most used as adjuncts in the preoperative diagnosis of PJI are the ESR and the CRP levels.
Since ESR expresses only the rate of precipitation of red blood cells, its specificity is low. Considering a cutoff level of 30 mm, it has 75% sensitivity and 70% specificity for chronic prosthetic infections. In acute infections, this test is considered inadequate because a cutoff level cannot be reliably assigned. 17 On average, the kinetics of ESR after uncomplicated primary elective arthroplasties show a return to baseline levels 3 months after the index procedure.
C-reactive protein is an acute phase protein, synthesized by proinflammatory cytokines, such as interleukin 6 (IL-6); however, its specificity is also restricted. When a cutoff value of 10 mg/L is considered, its sensitivity ranges from 68 to 82%, and its specificity ranges from 71 to 80% for chronic infections. 17 18 In acute infections, the cutoff level is 100 mg/L. On average, the kinetics of serum CRP levels after uncomplicated primary elective arthroplasties show a return to baseline values between 3 and 4 weeks after the index procedure.
It should be noted that both ESR and CRP levels may be elevated in inflammatory diseases (false-positive finding for infections) or normal (false-negative finding) in infections caused by low-virulence MOs. Even so, their use in screening to rule out PJI is mandatory, since the combined sensitivity and specificity of these markers are reported between 84 and 98% and between 47 and 96%, respectively. 17 18 19
The use of other serum biomarkers, such as IL-6 or interleukin 4 (IL-4), is not yet standardized. Serum IL-6 kinetics shows a peak elevation in 2 to 3 days, and a return to normal levels in ∼5 to 7 days after an uncomplicated prosthetic replacement, thus being an early indicator of PJI. Although its specificity ranges from 91 to 95% for a cutoff level of 10 pg/mL, its sensitivity varies greatly in different studies (from 47 to 97%) and, therefore, its use is not routine due to these discrepancies; moreover, this is a more costly test when compared with ESR and CRP. The same applies to α1 acid glycoprotein.
Other cytokine groups, which also have numerous proinflammatory actions, such as tumor necrosis factor alpha (TNF-α) and procalcitonin (PCT), which are secreted by monocytes, have been identified as important markers of infection, but the reported results are still conflicting; therefore, their routine clinical use has not yet been established. In addition, in the literature, there is no study with a level of evidence I or II that indicates its diagnostic superiority.
More recently, Shahi et al have reported a promising perspective on the use of D-dimer as a serum marker of the response to inflammatory stimuli, which promote elevated levels of fibrin degradation products in blood. 17 In a study evaluating 172 revision arthroplasty procedures (86 aseptic conditions and 86 PJIs), the authors found 89% sensitivity and 93% specificity for prosthetic infection diagnosis when a cutoff level of 860 ng/mL was used.
Clinical Diagnosis of Periprosthetic Joint Infection. Imaging Evaluation
Imaging tests usually have low specificity for the diagnosis of PJI and, therefore, their greatest utility is to rule out other noninfectious disorders as a cause of arthroplasty failure. Plain radiographs are usually normal and may eventually present some signs suggestive of PJI, such as periprosthetic loosening and/or osteolysis in arthroplasties performed < 5 five years before, subperiosteal elevation or transcortical fistula. Even so, the specificity of the radiological examination ranges from 50 to 67%, with an accuracy rate of 64%. 20 Similarly, ultrasound, computed tomography (CT) and magnetic resonance imaging (MRI) scans are not directly relevant to the diagnosis of PJI, but they can identify other causes for arthroplastic procedure failure.
Nuclear medicine scans, such as conventional bone scintigraphy, present high sensitivity, but very low specificity, which precludes its routine use in PJI investigation. 21 More recently, promising results have been reported with immunoscintigraphy using antigranulocyte antibodies and combined to traced leukocytes and bone marrow scintigraphy. Positron emission tomography (PET/CT) using fluorodeoxyglucose (18F-FDG) is also indicated in suspected cases of infection, although its major indication is in the oncological area. However, these tests are time-consuming, not always available, and costly.
Thus, the role of nuclear imaging in the diagnosis and treatment of PJI is still uncertain, 21 with more restricted use, since the methods described here for the diagnosis of syndromic infection are less invasive, inexpensive, and widely available.
Biomarkers from the Synovial Fluid and Periprosthetic Tissue Histology
The evaluation of SF biomarkers requires more invasive collection methods; moreover, it adds costs and risks of iatrogenic infection. In addition, up to 32% of aspiration procedures do not provide enough fluid for analysis. 22 Therefore, a surgical procedure guided by imaging techniques is recommended.
The most commonly used biomarkers from the SF for the diagnosis of PJI are: total leukocytes count, percentage of neutrophils (%N), leukocyte esterase (LE), CRP, and α-defensin. The following cutoff levels are considered: 3,000 leukocytes/μL, 80% N, ++, 6.9 mg/L (specific cutoff level not yet validated), and positive for the lateral flow test, respectively.
The α-defensin test, still with limited availability in Brazil, is very expensive. Considering its positivity at the lateral flow test, its sensitivity is 78%, and its specificity is 93%. Comparing it with the performance of total leukocyte count,% N, and EL, along with ESR and CRP, through the diagnostic odds ratio (DOR) method, which calculates the ratio between the chance of positivity in PJI and the chance of positivity in noninfected patients, Shahi et al noted that, for standard cutoff values, LE has the best performance (30.06 ± 0.27), followed by leukocyte count (29.45 ± 0.19), CRP (25.66 ± 0.14), neutrophils percentage (25.53 ± 0.19), and by ESR and PCR combined (23.33 ± 0.11). 23 When analyzed along with ESR and CRP, LE, if concordant with these tests, has 95% accuracy in confirming or ruling out the diagnosis of PJI. 24
It is noteworthy that the LE test has low cost, since detection uses urinalysis strips; for + or ++ positivity, it presents 75% sensitivity and 91% specificity. On the other hand, CRP measurement in SF is less frequently used because the calibration of the device for its dosage is different from the one employed for serum values. Similarly, IL-6 dosage in SF has not yet been routinely incorporated into the clinical practice.
Periprosthetic tissue histology, considered significant if > 5 neutrophils per field are detected in > 5 fields (400x magnification), requires specific collection and interpretation; therefore, its routine use is still questioned by some authors. However, in a recent study on the accuracy of freezing biopsy compared with permanent sections, it showed a 97.6% concordance. When evaluated directly regarding the diagnosis of PJI, freezing biopsy presented sensitivity, specificity and accuracy of 73.7% (95% confidence interval [CI]: 59.7–87.7%), of 98.8% (95%CI: 97.1–100.0%), and of 94.0% (95% CI: 90.7–97.3%), respectively. 25
Etiological Diagnosis of Periprosthetic Joint Infections
Culture and molecular techniques
Identification of the infectious MO (etiological diagnosis) is undoubtedly the most important procedure for the institution of the proper treatment and, consequently, for better outcomes. The performance of the conventional method of culture of periprosthetic fluids and tissues still does not meet the expectations of the medical team responsible for the treatment of PJIs, with a high rate of false-negative results, which is easily demonstrated by the 5 to 12% rate of PJIs referred to as culture-negative infections. 26
However, infections associated with prosthetic implants can be great diagnostic challenges, such as biofilm formation, defined by Hall-Stoodley as infections caused by pathogenic or opportunistic MO aggregates, encapsulated in an exopolysaccharide matrix and protected from host defense mechanisms and from antibiotic treatment. 27 As such, free (planktonic) bacteria in periprosthetic tissue are present in a smaller number, whereas bacteria in a mildly active metabolic state remain protected inside the biofilm. The explant sonication technique was proposed to release these “dormant” bacteria from the biofilm through mechanical agitation. More recently, seeding the sonicated liquid, or even periprosthetic tissue samples, in blood culture flasks, has been shown to be effective in increasing the sensitivity of this microbiological test by up to 40% when compared with the conventional technique in agar or thioglycolate broth (from 44.4 to 60.7%), 28 if the IDSA criteria for the diagnosis of PJI were considered. 6
Another major challenge for traditional cultures is the lack of standardization of collection, packaging, transport, and method techniques, as well as of incubation time of biological materials. Now, it is known that more indolent bacteria (coagulase-negative Staphylococci or C. acnes , for instance) may require up to 15 days of culture, in contrast with the traditional incubation of 3 to 5 days for more virulent MOs.
Nevertheless, the prevalence of culture-negative infections remains significant and, therefore, there is a great commitment to improve molecular techniques, especially the next generation sequencing (NGS) procedures. In a recent prospective study including infected hip or knee revisions, while cultures were positive in 60.7% of the cases (95%CI: 40.6–78.5%), NGS was positive in 89.3% of the cases (95%CI: 71.8–97.7%). 29 The authors conclude that NGS is useful in MO detection in culture-negative, as well as in detecting concomitant MOs that escape recognition in culture media. However, they point to the need for future studies to clarify the presence of MOs isolated from patients undergoing presumptive aseptic revision surgery.
Algorithm for the Diagnostic of Periprosthetic Joint Infection
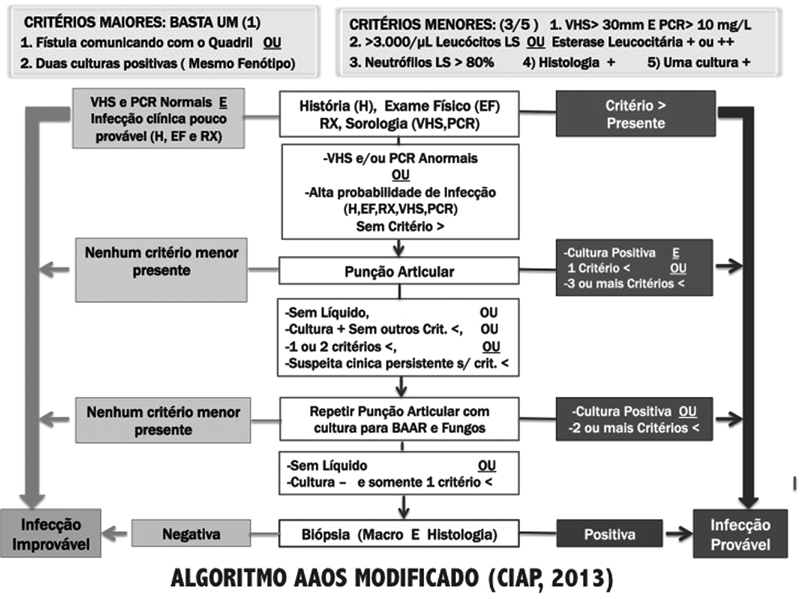
From the main tests presented here, the ICM-2013 proposed modifications in the algorithm presented by the American Academy of Orthopedic Surgeons (AAOS), 30 which guides, step-by-step, the indication and interpretation of the tests to be performed for the identification of PJI ( Fig. 2 ).
Fig. 2.
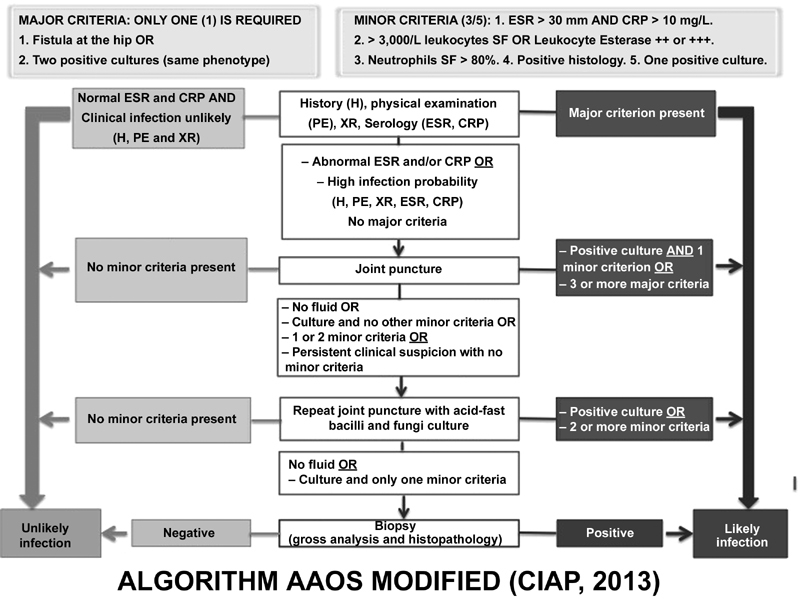
Modified American Academy of Orthopedic Surgeons algorithm (CIAP, 2013). Abbreviations: BAAR, Acid-alcohol-resistant bacilli, CRP, C-reactive protein; ESR, erythrocyte sedimentation rate; XR, X-ray; SF, synovial fluid.
Final Considerations
The lack of a gold standard for the diagnosis of PJIs of the hip poses innumerous challenges to the early recognition of this serious complication, which may result in a higher rate of treatment failure. Advances in the knowledge about PJIs indicate the absolute necessity of an adequate and systematic prevention and of an early diagnosis based on clinical findings, blood and SF biomarkers levels, periprosthetic tissue histopathology findings, and the identification of the infective MO through molecular cultures and techniques. These procedures should be carried out sequentially, routinely, and in a standardized form, in all centers dedicated to the treatment of PJIs.
Conflitos de Interesses Os autores declaram não haver conflitos de interesses.
Trabalho realizado na Pró-Reitoria de Pós-Graduação da Universidade Federal do Triângulo Mineiro, Uberaba, MG, Brasil.
Work performed at the Pró-Reitoria de Pós-Graduação of the Universidade Federal do Triângulo Mineiro, Uberaba, MG, Brazil.
Referências
- 1.Lidgren L. Joint prosthetic infections: a success story. Acta Orthop Scand. 2001;72(06):553–556. doi: 10.1080/000164701317268969. [DOI] [PubMed] [Google Scholar]
- 2.Ulrich S D, Seyler T M, Bennett D, Delanois R E, Saleh K J, Thongtrangan I et al. Total hip arthroplasties: what are the reasons for revision? Int Orthop. 2008;32(05):597–604. doi: 10.1007/s00264-007-0364-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Esposito S, Leone S. Prosthetic joint infections: microbiology, diagnosis, management and prevention. Int J Antimicrob Agents. 2008;32(04):287–293. doi: 10.1016/j.ijantimicag.2008.03.010. [DOI] [PubMed] [Google Scholar]
- 4.Berbari E F, Hanssen A D, Duffy M C, Steckelberg J M, Ilstrup D M, Harmsen W S et al. Risk factors for prosthetic joint infection: case-control study. Clin Infect Dis. 1998;27(05):1247–1254. doi: 10.1086/514991. [DOI] [PubMed] [Google Scholar]
- 5.Parvizi J, Zmistowski B, Berbari E F, Bauer T W, Springer B D, Della Valle C J et al. New definition for periprosthetic joint infection: from the Workgroup of the Musculoskeletal Infection Society. Clin Orthop Relat Res. 2011;469(11):2992–2994. doi: 10.1007/s11999-011-2102-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Osmon D R, Berbari E F, Berendt A R, Lew D, Zimmerli W, Steckelberg J M et al. Executive summary: diagnosis and management of prosthetic joint infection: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis. 2013;56(01):1–10. doi: 10.1093/cid/cis966. [DOI] [PubMed] [Google Scholar]
- 7.Parvizi J, Gehrke T, Chen A F. Proceedings of the international consensus on periprosthetic joint infection. Bone Joint J. 2013;95-B(11):1450–1452. doi: 10.1302/0301-620X.95B11.33135. [DOI] [PubMed] [Google Scholar]
- 8.Fernández-Sampedro M, Fariñas-Alvarez C, Garces-Zarzalejo C, Alonso-Aguirre M A, Salas-Venero C, Martínez-Martínez L et al. Accuracy of different diagnostic tests for early, delayed and late prosthetic joint infection. BMC Infect Dis. 2017;17(01):592. doi: 10.1186/s12879-017-2693-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Coventry M B. Treatment of infections occurring in total hip surgery. Orthop Clin North Am. 1975;6(04):991–1003. [PubMed] [Google Scholar]
- 10.Tsukayama D T, Estrada R, Gustilo R B. Infection after total hip arthroplasty. A study of the treatment of one hundred and six infections. J Bone Joint Surg Am. 1996;78(04):512–523. doi: 10.2106/00004623-199604000-00005. [DOI] [PubMed] [Google Scholar]
- 11.Tsukayama D T, Goldberg V M, Kyle R. Diagnosis and management of infection after total knee arthroplasty. J Bone Joint Surg Am. 2003;85-A 01:S75–S80. doi: 10.2106/00004623-200300001-00014. [DOI] [PubMed] [Google Scholar]
- 12.Zimmerli W, Trampuz A, Ochsner P E. Prosthetic-joint infections. N Engl J Med. 2004;351(16):1645–1654. doi: 10.1056/NEJMra040181. [DOI] [PubMed] [Google Scholar]
- 13.Gomes L SM, Zullo S S, Pereira G A. Response to question Q118 (Hip and Knee): What clinical findings (e.g. fever, erythema, reduced ROM) are most sensitive and specific for the diagnosis of PJI?
- 14.Ghosh S, Charity R M, Haidar S G, Singh B K. Pyrexia following total knee replacement. Knee. 2006;13(04):324–327. doi: 10.1016/j.knee.2006.05.001. [DOI] [PubMed] [Google Scholar]
- 15.Jacobs A ME, Bénard M, Meis J F, van Hellemondt G, Goosen J HM. The unsuspected prosthetic joint infection : incidence and consequences of positive intra-operative cultures in presumed aseptic knee and hip revisions. Bone Joint J. 2017;99-B(11):1482–1489. doi: 10.1302/0301-620X.99B11.BJJ-2016-0655.R2. [DOI] [PubMed] [Google Scholar]
- 16.Tan T, Maltenfort M, Chen A.Development and evaluation of a preoperative risk calculator for periprosthetic joint infectionIn: Paper 171 presented at the 2016 Annual Meeting of the AAOS, Orlando, Florida, 2016
- 17.Shahi A, Kheir M M, Tarabichi M, Hosseinzadeh H RS, Tan T L, Parvizi J. Serum D-Dimer Test Is Promising for the Diagnosis of Periprosthetic Joint Infection and Timing of Reimplantation. J Bone Joint Surg Am. 2017;99(17):1419–1427. doi: 10.2106/JBJS.16.01395. [DOI] [PubMed] [Google Scholar]
- 18.Pérez-Prieto D, Portillo M E, Puig-Verdié L, Alier A, Martínez S, Sorlí L et al. C-reactive protein may misdiagnose prosthetic joint infections, particularly chronic and low-grade infections. Int Orthop. 2017;41(07):1315–1319. doi: 10.1007/s00264-017-3430-5. [DOI] [PubMed] [Google Scholar]
- 19.Parvizi J, Fassihi S C, Enayatollahi M A. Diagnosis of periprosthetic joint infection following hip and knee arthroplasty. Orthop Clin North Am. 2016;47(03):505–515. doi: 10.1016/j.ocl.2016.03.001. [DOI] [PubMed] [Google Scholar]
- 20.Aryana K, Hootkani A, Sadeghi R, Davoudi Y, Naderinasab M, Erfani M et al. (99m) Tc-labeled ubiquicidin scintigraphy: a promising method in hip prosthesis infection diagnosis. Nucl Med (Stuttg) 2012;51(04):133–139. doi: 10.3413/Nukmed-0444-11-11. [DOI] [PubMed] [Google Scholar]
- 21.Verberne S J, Raijmakers P G, Temmerman O P. The Accuracy of Imaging Techniques in the Assessment of Periprosthetic Hip Infection: A Systematic Review and Meta-Analysis. J Bone Joint Surg Am. 2016;98(19):1638–1645. doi: 10.2106/JBJS.15.00898. [DOI] [PubMed] [Google Scholar]
- 22.Yee D KH, Chiu K Y, Yan C H, Ng F Y. Review article: Joint aspiration for diagnosis of periprosthetic infection. J Orthop Surg (Hong Kong) 2013;21(02):236–240. doi: 10.1177/230949901302100225. [DOI] [PubMed] [Google Scholar]
- 23.Shahi A, Tan T L, Kheir M M, Tan D D, Parvizi J.Diagnosing Periprosthetic Joint Infection: And the Winner Is? J Arthroplasty 201732(9S):S232–S235. [DOI] [PubMed] [Google Scholar]
- 24.Tarabichi M, Fleischman A N, Shahi A, Tian S, Parvizi J.Interpretation of Leukocyte Esterase for the Detection of Periprosthetic Joint Infection Based on Serologic Markers J Arthroplasty 201732(9S):S97, 100.e1 [DOI] [PubMed] [Google Scholar]
- 25.Kwiecien G, George J, Klika A K, Zhang Y, Bauer T W, Rueda C A. Intraoperative Frozen Section Histology: Matched for Musculoskeletal Infection Society Criteria. J Arthroplasty. 2017;32(01):223–227. doi: 10.1016/j.arth.2016.06.019. [DOI] [PubMed] [Google Scholar]
- 26.Peel T N, Dowsey M M, Aboltins C A, Daffy J R, Stanley P A, Buising K Let al. Culture negative prosthetic joint infection.- a description of current treatment and outcomes Clin Microbiol 2013202106. Doi: 10.4172/2327-5073.1000106 [Google Scholar]
- 27.Hall-Stoodley L, Stoodley P, Kathju S, Høiby N, Moser C, Costerton J W et al. Towards diagnostic guidelines for biofilm-associated infections. FEMS Immunol Med Microbiol. 2012;65(02):127–145. doi: 10.1111/j.1574-695X.2012.00968.x. [DOI] [PubMed] [Google Scholar]
- 28.Peel T N, Dylla B L, Hughes J G, Lynch D T, Greenwood-Quaintance K E, Cheng A C et al. Improved Diagnosis of Prosthetic Joint Infection by Culturing Periprosthetic Tissue Specimens in Blood Culture Bottles. MBio. 2016;7(01):e01776–e15. doi: 10.1128/mBio.01776-15. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Tarabichi M, Shohat N, Goswami K, Alvand A, Silibovsky R, Belden K et al. Diagnosis of periprosthetic joint infection: the potential of next-generation sequencing. J Bone Joint Surg Am. 2018;100(02):147–154. doi: 10.2106/JBJS.17.00434. [DOI] [PubMed] [Google Scholar]
- 30.Della Valle C, Parvizi J, Bauer T W, Dicesare P E, Evans R P, Segreti J et al. Diagnosis of periprosthetic joint infections of the hip and knee. J Am Acad Orthop Surg. 2010;18(12):760–770. doi: 10.5435/00124635-201012000-00006. [DOI] [PubMed] [Google Scholar]