Résumé
Objectif
Étudier le risque de mortalité présenté par l’obésité centrale chez les personnes de poids normal, déterminer une mesure clinique pour aider à dépister ce phénotype et examiner les moyens de réduire ce risque.
Qualité des données
La recherche n’a relevé que des études de cohorte prospectives (niveau II) ayant comparé des participants qui présentaient une obésité centrale et un poids normal à des participants dont l’indice de masse corporelle (IMC) était élevé. Des études de niveau I de bonne qualité ont démontré l’effet des interventions liées à l’alimentation et à l’exercice sur l’obésité centrale et la mortalité.
Message principal
Les participants centralement obèses malgré un IMC normal et qui sont atteints de dyslipidémie athérogène présentent un risque comparable, sinon supérieur, de mortalité que les participants qui sont centralement obèses en plus d’être en surpoids ou obèses selon l’IMC. Le rapport entre le tour de taille et la taille* serait la mesure clinique la plus pragmatique de l’obésité centrale. Le régime méditerranéen est une intervention efficace pour stopper la prise pondérale tout en réduisant la ceinture abdominale. Un faible niveau d’exercice réduit aussi le tour de taille. La perte pondérale ne doit pas constituer l’objectif.
Conclusion
Un rapport entre le tour de taille et la taille de plus de 0,5 malgré un IMC normal indique un risque élevé de mortalité par atteinte cardiométabolique. Ce risque serait équivalent, voire supérieur, au risque présenté par les patients centralement obèses en plus d’être en surpoids ou obèses. De légères interventions liées à l’alimentation et à l’exercice sont efficaces pour réduire ce risque.
L ’Organisation mondiale de la Santé définit l’obésité comme « l’accumulation anormale ou excessive de graisse pouvant nuire à la santé »1. Le présent document concède que l’indice de masse corporelle (IMC) n’est qu’un guide approximatif pour estimer le degré d’adiposité. La proportion de graisse corporelle chez les personnes dont l’IMC est normal peut dépasser les 30 %2. Si ce gras est principalement distribué dans l’abdomen ou autour des viscères, il est étroitement lié à un risque cardiométabolique3. La distribution et la fonction du tissu adipeux sont anormales chez ces personnes, et cette anomalie augmente le risque de diabète et de maladie cardiovasculaire. Les dépôts de graisse qui fonctionnent anormalement sont à l’origine de problèmes athérosclérotiques, dysmétaboliques et mécaniques qui détériorent la santé4, ce qui répond aux critères d’obésité de l’Organisation mondiale de la Santé.
En Amérique du Nord, le taux d’obésité continue de grimper depuis les années 1980. En 2015, 38,2 % de la population adulte des États-Unis (É.-U.) et 25 % de la population adulte du Canada était obèse5. Entre 1990 et 2015, le taux de maladie cardiaque ischémique a chuté de 55 % aux É.-U. et de 60 % au Canada5; toutefois, alors que le taux canadien poursuit sa chute, le déclin aux É.-U. a atteint un plateau en 20116,7. Parmi les pays membres de l’Organisation de coopération et de développement économiques, aux États-Unis seulement, l’espérance de vie a amorcé un déclin depuis quelques années7, en partie à cause de la hausse des cas d’obésité et de l’inégalité sociale8.
La prévalence du phénotype métaboliquement obèse malgré un poids normal, établie en mesurant directement la distribution des graisses ou les caractéristiques métaboliques, oscille entre 13 et 38 %9,10. La graisse distribuée dans le tronc, estimée par le tour de taille (TT), le rapport tour de taille-hanches (RTTH) ou le rapport entre le tour de taille et la taille (RTTT) (Tableau 1)11–15, est corrélée positivement aux anomalies métaboliques, alors que la graisse distribuée ailleurs sur la moitié inférieure du corps est corrélée négativement. La graisse sous-cutanée, surtout dans la région fémoro-fessière, s’inscrit comme un entrepôt qui aide à empêcher les lipides de se déposer dans les régions intra-abdominales et viscérales, où ils peuvent causer plus de dommages16–18. L’obésité abdominale, mesurée par le tour de taille, se répand plus rapidement que l’obésité générale, mesurée par l’IMC19,20.
Tableau 1.
Mesures anthropométriques de la distribution de graisse corporelle : Mesures A) basées sur la masse et B) basées sur la distribution.
| A) | ||
|---|---|---|
| MESURES BASÉES SUR LA MASSE | DÉFINITION | COMMENTAIRES |
| Indice de masse corporelle11 | Poids en kg, divisé par le carré de la taille en m | Ne fait pas la différence entre la masse maigre et la masse de tissu adipeux |
| • Insuffisance pondérale | < 18,5 kg/m2 | Associé à un taux élevé de mortalité |
| • Poids normal • Surpoids |
18,5–24,9 kg/m2 25,0–29,9 kg/m2 |
Ces catégories sont liées au taux le plus faible de mortalité |
| • Obésité de classe 1 | 30,0–34,9 kg/m2 | Aucun lien constant avec l’augmentation de la mortalité |
| • Obésité de classe 2 • Obésité de classe 3 |
35,0–39,9 kg/m2 ≥ 40,0 kg/m2 |
Lien direct avec l’augmentation de la mortalité |
| B) | ||
|---|---|---|
| MESURES BASÉES SUR LA DISTRIBUTION | VALEURS REPRÉSENTANT UNE HAUSSE DU RISQUE | MESURES SUBSTITUTS D’ADIPOSITÉ CENTRALE OU VISCÉRALE |
| Tour de taille | Femmes ≥ 80 cm Hommes ≥ 95 cm |
Les valeurs seuils varient en fonction de l’ethnicité, du sexe et de l’âge12 |
| Rapport tour de taille-hanches | Femmes ≥ 0,85 Hommes ≥ 0,95 |
Les valeurs seuils ne sont pas établies pour l’ethnicité13 |
| Rapport tour de taille-taille | Risque accru 0,50–0,60 Risque substantiel > 0,60 |
Les valeurs seuils sont les mêmes pour l’ethnicité, le sexe et l’âge12 Prédit le mieux la masse de graisse viscérale14,15 |
La présente revue vise les objectifs suivants :
quantifier le risque de mortalité posé par l’obésité centrale chez les personnes de poids normal;
décrire une mesure clinique pragmatique pour aider à identifier les personnes à risque;
examiner les moyens de réduire ce risque.
Qualité des données
La recherche initiale sur PubMed incluait les titres MeSH et les mots-clés anglais suivants : normal weight et central obesity (titre et résumé) ou visceral obesity (titre et résumé) ou visceral fat (titre et résumé) ou ectopic fat (titre et résumé) ou hypertriglyceridemic waist (titre et résumé) ou metabolically obese (titre et résumé) ou abdominal adiposity (titre et résumé) ou waist (titre et résumé) et mortality, mais pas cancer. La recherche a également porté sur les références des articles pertinents. Des recherches par mots-clés ont aussi été effectuées sur Google Scholar et dans la banque de données Cochrane. La recherche n’a relevé aucune étude de niveau I. Toutes les études incluses étaient observationnelles, et certaines revues systématiques ou études de cohorte prospectives pertinentes ont aussi été sélectionnées.
Message principal
L’obésité viscérale est particulièrement athérogène.
L’obésité centrale ou abdominale est contenue dans des compartiments séparés. La couche de graisse sous-cutanée est parfois considérable dans la région abdominale. La graisse viscérale intra-abdominale s’accumule dans l’épiploon, le mésentère, le foie et le pancréas. Cette graisse viscérale se retrouve aussi hors de l’abdomen, comme dans le péricarde, le myocarde et les muscles squelettiques21. La graisse rétropéritonéale contribue aussi à la ceinture abdominale. Le compartiment intra-abdominal, jumelé à la graisse ectopique des autres organes du corps et des muscles squelettiques, constitue la graisse viscérale métaboliquement active, qui se comporte très différemment de la graisse sous-cutanée22. Leurs différences sont résumées au Tableau 215–18,22–28.
Tableau 2.
Caractéristiques de la graisse sous-cutanée et viscérale
| VARIABLES | CARACTÉRISTIQUES | |
|---|---|---|
|
| ||
| GRAISSE SOUS-CUTANÉE | GRAISSE VISCÉRALE | |
| Mesure clinique | Indice de masse corporelle | Tour de taille, rapport tour de taille-taille rapport tour de taille-hanches |
| Association avec atteinte cardiométabolique16 | Le lien avec la mortalité n’est pas constant | Lien linéaire direct avec la mortalité |
| Fonction15,18 | Chute métabolique et entreposage d’énergie à plus long terme | Source d’énergie à court terme |
| Risque cardiaque23 | Modéré | Élevé |
| Risque métabolique24 | Modéré | Élevé |
| Inflammation22 | Modérée | Élevée |
| Réponse des catécholamines22 | Modérée | Rapide |
| Sensibilité à l’insuline17 | Modérée | Faible |
| Flux métabolique18 | Faible | Élevé |
| Tendance avec l’âge25 | Accrue jusqu’à 65 ans, puis réduite | Hausse graduelle |
| Durée de l’entreposage26 | Longue | Courte |
| Effet de l’exercice27 | Niveau élevé nécessaire pour modifier le poids | Faible niveau efficace pour obtenir des bienfaits cardiométaboliques |
| Effets indésirables des glucides raffinés28 | Modérés | Élevés |
On ignore toujours si une tendance populationnelle vers la hausse de l’hyperinsulinémie serait l’une des causes de l’obésité ou si l’obésité établie serait une cause d’hyperinsulinémie29. La hausse du contenu en sucre des aliments est un facteur fondamental. Mis à part le sucre ajouté durant la préparation à domicile, au Canada, 66 % des aliments emballés et des boissons sont édulcorés30. Cela provoque la libération d’insuline, qui pousse les lipides circulants dans les adipocytes aux fins d’entreposage sous forme de gras. En retour, l’augmentation de gras induit la résistance à l’insuline; il faut donc encore plus d’insuline pour pousser le glucose dans les cellules. Certaines personnes entreposent plus de gras en périphérie que d’autres, et à mesure que les dépôts sont emplis, le gras commence à s’accumuler sur les viscères, et à apparaître dans le foie, l’épiploon, les muscles squelettiques et les organes périphériques. L’insulinorésistance tend à accélérer la lipolyse, libérant des acides gras libres (AGL) dans la circulation. Les adipocytes viscéraux sont également très sensibles à la lipolyse induite par les catécholamines, libérant des AGL dans la circulation porte et amenant au foie des quantités accrues de lipides aux fins de traitement28. Le niveau de ces AGL est élevé dans la circulation des personnes qui font de l’obésité abdominale. Bien qu’ils puissent être utilisés comme substrats pour produire de l’énergie, ils contribuent également à la résistance à l’insuline en inhibant la capture du glucose par les muscles et les autres organes, ce qui contribue encore plus à l’hyperglycémie18.
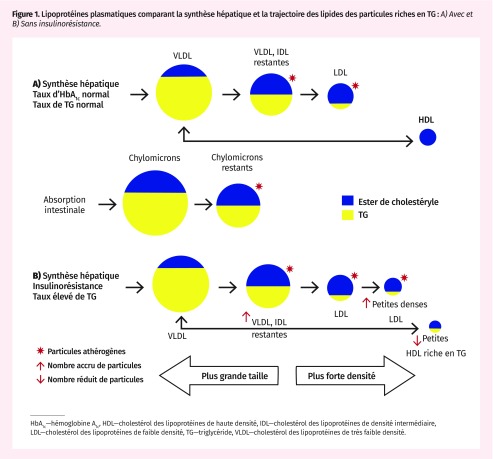
Les lipides acides gras libres se jumellent au glycérol pour former les triglycérides (TG); ils sont ensuite empaquetés par le foie en particules hydrosolubles de lipoprotéines de très faible densité (VLDL). Ces particules sont grosses et contiennent surtout des TG, de même que du cholestérol. Les triglycérides, à titre de substrats énergétiques, sont hydrolysés dans divers tissus, et ces particules deviennent graduellement plus petites et plus denses, et forment les particules de cholestérol des lipoprotéines de densité intermédiaire (IDL) et de cholestérol des lipoprotéines de faible densité (LDL)31. À mesure que la taille des particules diminue, la proportion de cholestérol s’accroît, mais le cholestérol n’est pas un substrat énergétique (Figure 1A).
Figure 1.
Lipoprotéines plasmatiques comparant la synthèse hépatique et la trajectoire des lipides des particules riches en TG : A) Avec et B) Sans insulinorésistance.
HbA1c—hémoglobine A1c, HDL—cholestérol des lipoprotéines de haute densité, IDL—cholestérol des lipoprotéines de densité intermédiaire, LDL—cholestérol des lipoprotéines de faible densité, TG—triglycéride, VLDL—cholestérol des lipoprotéines de très faible densité.
En présence de résistance à l’insuline et d’hypertriglycéridémie, les caractéristiques de ces particules changent. Les particules VLDL et IDL qui restent se multiplient, et les particules LDL deviennent encore plus petites, encore plus denses et beaucoup plus nombreuses. Toutes ces particules pénètrent facilement dans l’endothélium vasculaire, où elles deviennent intensément athérogènes. Simultanément, les particules de lipoprotéines de haute densité (HDL) qui interviennent dans le transport inverse du cholestérol ont tendance à s’enrichir en TG et à rapetisser, au point où certaines d’entre elles sont perdues dans l’urine. Résultat : un nombre réduit de particules HDL, qui sont incapables de contenir autant de cholestérol à éliminer des vaisseaux (Figure 1B)21,32.
Un patient qui présente ce profil métabolique aura probablement un taux élevé de TG, un taux faible et dysfonctionnel de HDL et un nombre accru de petites particules LDL, caractéristiques de la dyslipidémie athérogène33,34. Il ne faut pas se fier aux lipoprotéines de faible densité pour évaluer le risque, car une bonne partie du cholestérol pourrait se cacher dans les lipoprotéines VLDL, IDL et autres qui restent, y compris les restes de chylomicrons à l’état non à jeun. Ces particules sont au moins aussi puissantes que le LDL pour prédire les événements cardiovasculaires35. La caractéristique clinique la plus courante est l’accumulation de graisse viscérale, qui se manifeste par l’obésité centrale36.
Évaluation clinique de l’obésité centrale.
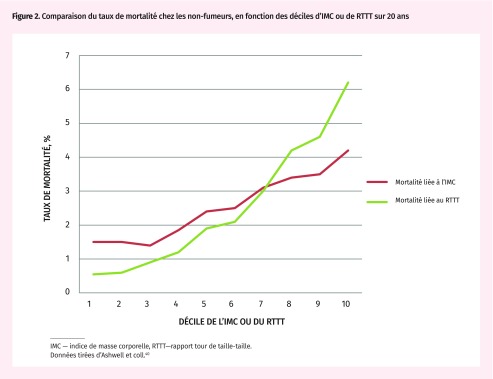
On convient que la mesure anthropométrique de l’obésité abdominale ou centrale est un meilleur prédicteur du risque cardiométabolique, du risque de diabète et de la mortalité de toutes causes que l’IMC, et qu’il pourrait être encore mieux de jumeler ces 2 indices. Habituellement, la courbe du risque de mortalité par rapport à l’IMC prend la forme d’un J, la mortalité étant accrue seulement chez les personnes dont le poids est insuffisant, et élevée dans les cas d’obésité de classes 1 à 3 (Tableau 1)11–15. L’embonpoint comporte toujours un risque plus faible de mortalité que le poids normal37. Si l’on élimine les autres causes de mortalité (tabagisme, comorbidités, âge avancé), la hausse vertigineuse disparaît dans la catégorie de poids insuffisant et déplace le nadir de mortalité dans la plage de l’IMC normal38. La relation entre l’IMC et la mortalité devient alors plus progressive et linéaire. Une courbe semblable de la mortalité par rapport au rapport tour de taille-hanches, au tour de taille ou au RTTT montre habituellement une relation linéaire à progression beaucoup plus raide, ce qui permet d’évaluer le risque de mortalité de façon plus approfondie (Figure 2)39,40. Dans la littérature scientifique, les opinions sont partagées quant à savoir quelles mesures de l’obésité centrale sont les meilleures, mais selon les revues systématiques et les méta-analyses ayant comparé les 3 mesures12,14,23,39, le RTTT a la cote. Il existe aussi des raisons purement pragmatiques pour utiliser le RTTT :
Un pèse-personne ou la référence aux catégories d’IMC ne sont pas nécessaires.
Le seuil du RTTT est 0,5, peu importe le sexe et l’origine ethnique, quoique plus d’études seraient nécessaires chez les enfants39.
Il est simple pour la surveillance à domicile. On peut dire aux patients : « Le tour de taille ne doit pas dépasser la moitié de la taille. »
Il est facile à utiliser dans un milieu austère avec peu d’équipement41. Une ficelle représentant la taille du patient est conservée, pliée en deux et périodiquement mesurée par rapport au tour de taille42.
Figure 2.
Comparaison du taux de mortalité chez les non-fumeurs, en fonction des déciles d’IMC ou de RTTT sur 20 ans
IMC — indice de masse corporelle, RTTT—rapport tour de taille-taille.
Données tirées d’Ashwell et coll.40
Risque de mortalité présenté par l’obésité centrale malgré un poids normal.
Le Tableau 3 présente les études prospectives ayant porté sur la mortalité de toutes causes associée à l’augmentation de l’obésité centrale à tous les IMC39,43–57. Ce qui saute aux yeux est que, à l’exception d’un cas51, le risque de mortalité chez les personnes centralement obèses malgré un IMC normal est semblable, voire supérieur au risque observé chez les personnes centralement obèses en plus d’être en surpoids ou obèses. Dans la plupart des cas, ces sujets de poids normal affichaient le taux le plus élevé de mortalité par rapport à toutes les autres combinaisons de groupes de masse corporelle et de distribution centrale de graisse. Dans certaines études, l’ampleur de cette différence était statistiquement significative46,52,54. Cela se répercute chez ces personnes de poids normal centralement obèses par un risque particulièrement élevé de mortalité de toutes causes.
Tableau 3.
Études d’observation prospectives, et RS et MA connexes d’études portant sur le lien entre l’obésité centrale malgré un poids normal et la mortalité
| ÉTUDE ET ANNÉE | TYPE D’ÉTUDE (DURÉE) | OBJECTIFS DE L’ÉTUDE | NBRE ET ÂGE DES PARTICIPANTS | RÉSULTATS | COMMENTAIRES |
|---|---|---|---|---|---|
| Coutinho et coll., 201343 | RS d’études d’observation prospectives et analyse concertée (0,5–7,4 ans) | Relation entre les mesures d’obésité centrale et la mortalité | 15 923 patients atteints de coronaropathie avérée Âge moyen (ET) 65,7 (11,5) ans |
La catégorie de mortalité la plus élevée associait l’IMC le plus bas au RTTH ou TT le plus fort; RRI = 1,7 | L’obésité centrale était associée à une hausse égale du risque de mortalité chez les patients maigres et obèses. La hausse de l’IMC était associée à une réduction du risque chez ces patients. |
| Kramer et coll., 201344 | MA d’études d’observation prospectives (3–30 ans) | Relation entre le risque cardiométabolique et les catégories d’IMC, et les MCV et la mortalité de toutes causes | 61 386 adultes de la population générale Fourchette d’âge moyen 44–60 ans | Le taux le plus élevé de mortalité ou de MCV était semblable chez les sujets de poids normal et métaboliquement malades et les sujets obèses; RRI = 2,65 par rapport aux sujets de poids normal et en santé métabolique | Ne s’est pas penchée précisément sur l’obésité centrale. La santé métabolique était basée sur l’absence d’éléments du syndrome métabolique, d’insulinorésistance ou de marqueurs de l’inflammation. |
| Carmienke et coll., 201339 | RS et analyse de méta-régression de cohortes prospectives (5–24 ans) | Relation entre les mesures des paramètres d’obésité abdominale et la mortalité | 689 465 adultes en bonne santé Âge ≥ 18 ans |
La catégorie de mortalité la plus élevée associait l’IMC le plus faible au RTTH ou TT le plus fort | L’association du RTTH, TT ou RTTT à l’IMC prédit le mieux la mortalité. Chez les sujets > 65 ans, on a observé un lien non significatif ou négatif entre la hausse de l’IMC, du TT et du RTTH |
| Folsom et coll., 200045 | Étude d’observation prospective (11–12 ans) | Relation entre l’IMC, le TT et le RTTH, et la mortalité, le cancer, le diabète, l’hypertension et les fractures | 31 702 Américaines en bonne santé Âge 55–69 ans |
La catégorie de mortalité la plus élevée associait l’IMC le plus faible au RTTH le plus fort | Le RTTH prédisait le mieux la mortalité |
| Pischon et coll., 200846 | Étude d’observation prospective (9,7 ans) | Association de la distribution de l’adiposité au risque de décès | 359 387 participants de la population européenne générale Âge 25–70 ans |
Le taux de mortalité le plus élevé était associé au percentile le plus bas d’IMC avec le TT ou RTTH le plus fort | L’association IMC et mortalité prend la forme d’un J. Les mesures d’obésité centrale ont montré un lien linéaire positif avec la mortalité après ajustement en fonction de l’IMC |
| Zhang et coll., 200847 | Étude d’observation prospective (16 ans) | Relation entre l’adiposité abdominale et le décès prématuré | 44 636 Américaines ayant participé à l’étude Nurses’ Health Study Âge 30–55 ans |
La catégorie de mortalité la plus élevée associait l’IMC le plus élevé au TT ou au RTTH le plus fort. Le risque n’était que légèrement plus faible pour l’IMC normal avec obésité centrale | Le TT et le RTTH étaient directement liés à la mortalité |
| Koster et coll., 200848 | Étude d’observation prospective (9 ans) | Relation entre le TT et la mortalité de toutes causes | 245 533 adultes américains Âge 51–72 ans |
Le poids normal avec fort TT augmentait la mortalité de 22 %. Seule l’obésité de classes 2 et 3 avec fort TT était plus élevée | TT utilisé comme mesure d’obésité centrale pour prédire la mortalité |
| Reis et coll., 200949 | Étude d’observation prospective (12 ans) | Relation ente l’IMC, le RTTT et le RTTC, et la mortalité | 13 065 participants de la population générale des É.-U. Âge 30–102 ans |
La catégorie de mortalité la plus élevée a associé l’IMC le plus bas au RTTT ou RTTC le plus fort | Le RTTT ou RTTC prédisait le mieux la mortalité. Aucun lien observé à > 65 ans |
| Romero-Corral et coll., 200950 | Étude d’observation prospective (8,8 ans) | Relation entre le pourcentage de graisse corporelle, et la mortalité CV et dérégulation métabolique chez des sujets dont l’IMC est normal | 6171 patients américains avec IMC normal et coronaropathie Âge ≥ 20 ans |
Un pourcentage élevé de graisse corporelle et un fort TT étaient liés à un risque accru de syndrome métabolique. La mortalité par MCV a augmenté chez les femmes obèses de poids normal (RRI = 2,20) p/r aux femmes non obèses | La graisse corporelle était mesurée par bioimpédance. Le pourcentage de graisse corporelle n’était pas corrélé à la mortalité de toutes causes chez les femmes ni chez les hommes de tout IMC. |
| Staiano et coll., 201251 | Étude d’observation prospective (13 ans) | Relation entre l’IMC, le TT et le RTTT, et la MCV et mortalité de toutes causes | 8061 adultes canadiens Âge 18–74 ans |
Pas de hausse de la mortalité p/r au TT chez les adultes de poids normal. Taux le plus élevé de mortalité dans les terciles supérieurs du TT des adultes obèses | Le lien était le plus fort entre le TT et la MCV, et la mortalité de toutes causes |
| Thomas et coll., 201352 | Étude d’observation prospective (moyenne [ET] 5,6 [2,4] ans) | Relation entre l’obésité mesurée par l’IMC ou le TT et la mortalité à différents âges | 119 010 Français avec IMC > 20 kg/m2 Âge 17–85 ans |
La mortalité à IMC de 20–25 kg/m2 et TT ≥ 102 cm était...
|
Le risque de mortalité est plus élevé dans les cas d’obésité centrale avec IMC normal que dans les cas d’obésité de classes 2 et 3. Le TT prédit le mieux la mortalité à < 65 ans. Le TT et l’IMC sont inutiles chez les personnes âgées. |
| Cerhan et coll., 201453 | Données groupées de 11 études d’observation prospectives (médiane 9 ans, maximum 21 ans) | Relation entre le TT et la mortalité dans toutes les catégories d’IMC | 650 386 adultes de race blanche non hispaniques Âge 20–83 ans |
Le taux le plus élevé de mortalité était associé aux IMC de < 20 et ≥ 35 kg/m2 avec TT le plus fort. La mortalité était plus élevée au TT le plus fort associé à l’IMC de 20–22,5 kg/m2 qu’en présence d’obésité de classe 1 avec TT le plus fort | Le TT doit être évalué en association avec l’IMC même chez les personnes dont l’IMC se situe dans l’intervalle normal. Le TT est directement lié à la mortalité, et ce, à tous les IMC. |
| Sahakyan et coll., 201554 | Étude d’observation prospective (14,3 ans) | Relation entre l’obésité centrale et la survie chez les adultes de poids corporel normal | 16 124 adultes américains dont l’IMC ≥ 18,5 kg/m2 Âge 18–90 ans |
Les hommes centralement obèses malgré un poids normal présentaient un risque plus élevé de mortalité que toute autre association IMC et RTTH. Les femmes de la même catégorie présentaient une hausse de 40 % et de 32 % du risque relatif p/r aux femmes en surpoids et obèses sans obésité centrale | Le RTTH était utilisé comme mesure d’obésité centrale pour prédire la mortalité |
| Klingberg et coll., 201555 | Étude d’observation prospective (moyenne 6 ans) | Relation entre le TT initial et la variation du TT, et la mortalité et la MCV | 2492 Danoises et Suédoises en bonne santé Âge 44–74 ans au départ |
Association entre la mortalité et un fort TT au départ et une hausse importante du TT dans le temps; le lien est particulièrement élevé chez les sujets dont l’IMC est de < 25 kg/m2 | Le TT était utilisé pour prédire la mortalité. La circonférence des hanches n’était pas liée à la mortalité. |
| Sharma et coll., 201656 | Étude d’observation prospective (moyenne 7,1 ans) | Relation entre le TT ou le RTTH et l’IMC et la mortalité chez les patients âgés atteints de MCV | 7057 patients âgés atteints de coronaropathie Âge moyen 73 ans |
Taux le plus élevé de mortalité chez les patients avec IMC normal et obésité centrale | Souligne l’importance d’inclure le TT ou le RTTH à l’IMC durant l’évaluation de la mortalité liée à l’adiposité |
| Hamer et coll., 201757 | Étude d’observation prospective (moyenne 9 ans) | Déterminer si le RTTH prédit mieux la mortalité que l’IMC | 42 702 adultes anglais Âge moyen 57,7 ans |
Le poids normal avec obésité centrale était associé au taux le plus élevé de mortalité; RRI = 1,22 pour le décès | Le RTTH était utilisé comme mesure d’obésité centrale pour prédire la mortalité |
É.-U. — États-Unis, IMC—indice de masse corporelle, MA —méta-analyse, MCV — maladie cardiovasculaire, p/r —par rapport, RRI — rapport de risques instantanés, RS —revue systématique, RTTT — rapport tour de taille-taille, RTTC —rapport tour de taille-cuisses, RTTH—rapport tour de taille-hanches, TT —tour de taille.
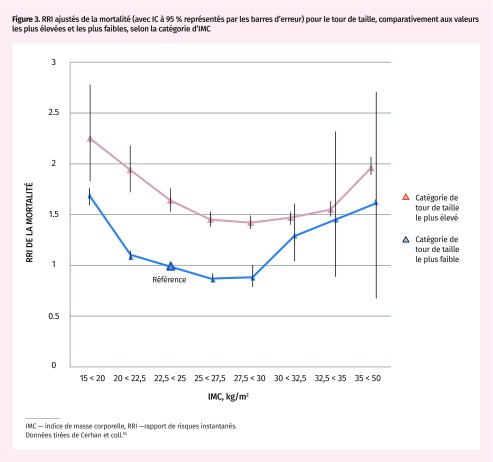
L’autre constatation uniforme qui est ressortie de ces études est que, en présence d’obésité centrale, la graisse sous-cutanée semble offrir une certaine protection. Les sujets centralement obèses qui se situent dans la plage d’IMC surpoids et obésité de classe I présentent en réalité un risque inférieur de mortalité que les sujets centralement obèses malgré un poids normal (Figure 3)46–49,51–54,57. La capacité limitée d’entreposer les lipides sous la peau pourrait entraîner un désavantage sur la mortalité, surtout chez les personnes dont le niveau de tissu adipeux viscéral est le plus élevé58.
Figure 3.
RRI ajustés de la mortalité (avec IC à 95 % représentés par les barres d’erreur) pour le tour de taille, comparativement aux valeurs les plus élevées et les plus faibles, selon la catégorie d’IMC
IMC — indice de masse corporelle, RRI —rapport de risques instantanés.
Données tirées de Cerhan et coll.53
Réduire le risque sans perte pondérale.
Il semble raisonnable de dire que les interventions ciblant la graisse viscérale doivent cibler les causes — principalement l’ingestion d’aliments transformés et riches en calories et un mode de vie sédentaire59. Il n’est pas nécessaire que la perte pondérale soit l’objectif. Dans une revue d’études randomisées et non randomisées ayant eu recours principalement à l’exercice pour maîtriser le poids, 11 études sur 29 ont montré une réduction significative de la graisse viscérale malgré l’absence de perte pondérale significative sur le plan clinique60. D’autres études61 laissent penser que la gestion du poids par l’exercice fait perdre préférentiellement la graisse viscérale chez les personnes ayant perdu peu de poids, alors que les catégories de perte pondérale plus importante ont montré une perte prédominante de graisse sous-cutanée.
En plus de réduire la graisse viscérale et certains facteurs de risque cardiométabolique, l’exercice est efficace pour préserver la masse musculaire et faciliter la mobilité60. Cela est particulièrement important chez les personnes âgées, qui ont de la difficulté à maintenir leur poids, mais ont tendance à accumuler la graisse viscérale et à perdre la masse musculaire et la masse de graisse sous-cutanée62,63. L’exercice est un élément essentiel pour réduire au minimum l’obésité centrale et maintenir la masse musculaire. Une méta-analyse d’études ayant duré 4 à 52 semaines27 a montré que lorsque le poids était stable, le tissu adipeux viscéral était réduit de 6,1 % avec l’exercice, mais d’à peine 1,1 % avec un régime alimentaire.
Chaque réduction du tour de taille de 5 cm est associée à une réduction de la mortalité atteignant 9 % sur 6,7 ans, et ce, à n’importe quel IMC64. Le risque d’invalidité et de mortalité peut être réduit par l’exercice bien en deçà des cibles actuellement recommandées19. Des études de cohorte d’envergure ont démontré une réduction de la mortalité liée à 15 minutes de marche par jour65 ou 5 à 10 minutes de jogging par jour66. Dans cette population, il faut s’attacher à réduire l’obésité centrale et empêcher la prise pondérale. Il faut mettre l’accent sur les petites modifications réalisables du comportement. L’activité physique plus énergique peut demeurer une option, puisque le désavantage mécanique de l’obésité n’est pas un problème chez ces patients.
Les éléments alimentaires peuvent avoir un effet sur la graisse viscérale. L’étude PREDIMED (Prevención con Dieta Mediterránea) était une étude à répartition aléatoire et contrôlée ayant comparé le régime méditerranéen à un régime faible en gras pendant 4,8 ans67; le régime méditerranéen a donné lieu à une réduction statistiquement significative de la mortalité. Malgré l’apport non restreint, on n’a observé aucune prise pondérale sous l’intervention. Une analyse secondaire68 a révélé que les sujets répartis au régime méditerranéen avaient significativement plus tendance à ne plus répondre aux critères d’obésité centrale que les sujets du groupe témoin (p < 0,001). Puisqu’un des objectifs consiste à éviter la prise pondérale et à réduire la graisse viscérale, le régime méditerranéen serait une option préférable chez les personnes centralement obèses malgré un poids normal, surtout parce qu’il est pauvre en glucides raffinés. Il importe de reconnaître que les bienfaits de l’exercice peuvent être annulés par de mauvais choix alimentaires69.
Selon les lignes directrices canadiennes, l’augmentation du tour de taille est une indication pour le traitement par statine chez les hommes de plus de 50 ans et les femmes de plus de 60 ans qui présentent toujours un risque de Framingham intermédiaire malgré l’adoption individuelle optimale des recommandations sur le mode de vie70.
Conclusion
L’obésité viscérale se répand dans la population nordaméricaine plus rapidement que l’obésité généralisée, et son effet sur la morbidité et la mortalité est plus profond. La mesure la plus simple et la plus valide de l’obésité centrale est le RTTT. Ce phénotype est étroitement lié à la dyslipidémie athérogène, laquelle prédispose la personne à déposer le cholestérol dans l’endothélium vasculaire, ce qui entraîne l’athérosclérose. Les personnes centralement obèses malgré un poids normal présentent un risque équivalent, sinon supérieur, au risque observé chez les personnes centralement obèses en plus d’être en surpoids ou obèses selon l’IMC.
Le régime méditerranéen réduit l’obésité centrale et stabilise le poids. L’exercice avec perte pondérale minimale fait fondre la graisse viscérale. De petits changements dans l’alimentation et l’exercice peuvent produire des bienfaits sur les plans cardiométabolique et de la mortalité.
Points de repère du rédacteur
▸ L’obésité viscérale se répand dans la population nord-américaine plus rapidement que l’obésité généralisée, et son effet sur la morbidité et la mortalité est plus profond. Les personnes qui ont un indice de masse corporelle normal et une obésité centrale présentent un risque équivalent, sinon supérieur, à celui des personnes qui sont centralement obèses en plus d’être en surpoids ou obèses selon l’indice de masse corporelle.
▸ La mesure la plus simple et la plus valide de l’obésité centrale est le rapport entre le tour de la taille et la taille.* Le seuil de 0,5 est le même, peu importe le sexe et l’origine ethnique. Très peu d’équipement est nécessaire pour mesurer le rapport. Une ficelle représentant la taille (hauteur) du patient est conservée, pliée en deux et périodiquement mesurée par rapport au tour de taille.
▸ Le régime méditerranéen peut réduire l’obésité centrale et stabiliser le poids. L’exercice avec perte pondérale minimale fait fondre la graisse viscérale. De petits changements dans l’alimentation et l’exercice peuvent produire des bienfaits sur les plans cardiométabolique et de la mortalité.
Footnotes
Par souci de précision, il importe de signaler que dans le présent article, taille désigne la mesure de la hauteur d’une personne et le tour de taille désigne la mesure de la circonférence au milieu du tronc.
Intérêts concurrents
Aucun déclaré
Cet article donne droit à des crédits d’autoapprentissage certifiés Mainpro+. Pour obtenir des crédits, rendez-vous sur www.cfp.ca et cliquez sur le lien Mainpro+.
Cet article a fait l’objet d’une révision par des pairs.
The English version of this article is available at www.cfp.ca on the table of contents for the June 2019 issue on page 399.
Références
- 1.Organisation mondiale de la Santé . Obesity and overweight. Genève, Suisse: Organisation mondiale de la Santé; 2018. Accessible à : www.wpro.who.int/mediacentre/factsheets/obesity/en/. Réf. du 22 janv. 2018. [Google Scholar]
- 2.Oliveros E, Somers VK, Sochor O, Goel K, Lopez-Jimenez F. The concept of normal weight obesity. Prog Cardiovasc Dis. 2014;56(4):426–33. doi: 10.1016/j.pcad.2013.10.003. Publ. en ligne du 5 oct. 2013. [DOI] [PubMed] [Google Scholar]
- 3.Després JP. Body fat distribution and risk of cardiovascular disease: an update. Circulation. 2012;126(10):1301–13. doi: 10.1161/CIRCULATIONAHA.111.067264. [DOI] [PubMed] [Google Scholar]
- 4.Jensen M. Normal weight obesity. CMR eJournal. 2008;2(1):22–30. Accessible à : www.myhealthywaist.org/cmrejournal/pdf/vol2/v2i1a5.pdf. Réf. du 22 janv. 2018. [Google Scholar]
- 5.OCDE . Panorama de la santé 2017. Surpoid et obésité chez les adultes : indicateurs de l’OCDE. Paris, Fr: OECD Publishing; 2017. Accessible à : https://www.oecd-ilibrary.org/fr/social-issues-migration-health/panorama-de-la-sante-2017_health_glance-2017-fr. Réf. du 22 janv. 2018. [Google Scholar]
- 6.Wilmot KA, O’Flaherty M, Capewell S, Ford ES, Vaccarino V. Coronary heart disease mortality declines in the United States from 1979 through 2011: evidence for stagnation in young adults, especially women. Circulation. 2015;132(11):997–1002. doi: 10.1161/CIRCULATIONAHA.115.015293. Publ. en ligne du 24 août 2015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Case A, Deaton A. Mortality and morbidity in the 21st century. Brookings Pap Econ Act. 2017;2017:397–476. doi: 10.1353/eca.2017.0005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Kontis V, Bennett JE, Mathers CD, Li G, Foreman K, Ezzati M. Future life expectancy in 35 industrialised countries: projections with a Bayesian model ensemble. Lancet. 2017;389(10076):1323–35. doi: 10.1016/S0140-6736(16)32381-9. Publ. en ligne du 22 févr. 2017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Karelis AD, St-Pierre DH, Conus F, Rabasa-Lhoret R, Poehlman ET. Metabolic and body composition factors in subgroups of obesity: what do we know? J Clin Endocrinol Metab. 2004;89(6):2569–75. doi: 10.1210/jc.2004-0165. [DOI] [PubMed] [Google Scholar]
- 10.Voulgari C, Tentolouris N, Dilaveris P, Tousoulis D, Katsilambros N, Stefanadis C. Increased heart failure risk in normal-weight people with metabolic syndrome compared with metabolically healthy obese individuals. J Am Coll Cardiol. 2011;58(13):1343–50. doi: 10.1016/j.jacc.2011.04.047. [DOI] [PubMed] [Google Scholar]
- 11.Flegal KM, Kit BK, Orpana H, Graubard B. Association of all-cause mortality with overweight and obesity using standard body mass index categories: a systematic review and meta-analysis. JAMA. 2013;309(1):71–82. doi: 10.1001/jama.2012.113905. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Ashwell M, Gunn P, Gibson S. Waist-to-height ratio is a better screening tool than waist circumference and BMI for adult cardiometabolic risk factors: systematic review and meta-analysis. Obes Rev. 2012;13(3):275–86. doi: 10.1111/j.1467-789X.2011.00952.x. Publ. en ligne du 23 nov. 2011. [DOI] [PubMed] [Google Scholar]
- 13.Lear SA, James PT, Ko GT, Kumanyika S. Appropriateness of waist circumference and waist-to-hip ratio cutoffs for different ethnic groups. Eur J Clin Nutr. 2010;64(1):42–61. doi: 10.1038/ejcn.2009.70. Publ. en ligne du 12 août 2009. [DOI] [PubMed] [Google Scholar]
- 14.Browning LM, Hsieh SD, Ashwell M. A systematic review of waist-to-height ratio as a screening tool for the prediction of cardiovascular disease and diabetes: 0·5 could be a suitable global boundary value. Nutr Res Rev. 2010;23(2):247–69. doi: 10.1017/S0954422410000144. [DOI] [PubMed] [Google Scholar]
- 15.Swainson MG, Batterham AM, Tsakirides C, Rutherford ZH, Hind K. Prediction of whole-body fat percentage and visceral adipose tissue mass from five anthropometric variables. PLoS One. 2017;12(5):e0177175. doi: 10.1371/journal.pone.0177175. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Vega GL, Adams-Huet B, Peshock R, Willett D, Shah B, Grundy SM. Influence of body fat content and distribution on variation in metabolic risk. J Clin Endocrinol Metab. 2006;91(11):4459–66. doi: 10.1210/jc.2006-0814. Publ. en ligne du 22 août 2006. [DOI] [PubMed] [Google Scholar]
- 17.McCarty MF. A paradox resolved: the postprandial model of insulin resistance explains why gynoid adiposity appears to be protective. Med Hypotheses. 2003;61(2):173–6. doi: 10.1016/s0306-9877(02)00238-4. [DOI] [PubMed] [Google Scholar]
- 18.Snijder MB, van Dam RM, Visser M, Seidell JC. What aspects of body fat are particularly hazardous and how do we measure them? Int J Epidemiol. 2006;35(1):83–92. doi: 10.1093/ije/dyi253. Publ. en ligne du 8 déc. 2005. [DOI] [PubMed] [Google Scholar]
- 19.Ross R, Blair S, de Lannoy L, Després JP, Lavie CJ. Changing the endpoints for determining effective obesity management. Prog Cardiovasc Dis. 2015;57(4):330–6. doi: 10.1016/j.pcad.2014.10.002. Publ. en ligne du 25 oct. 2014. [DOI] [PubMed] [Google Scholar]
- 20.Ford ES, Maynard LM, Li C. Trends in mean waist circumference and abdominal obesity among US adults, 1999–2012. JAMA. 2014;312(11):1151–3. doi: 10.1001/jama.2014.8362. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Tchernof A, Després JP. Pathophysiology of human visceral obesity: an update. Physiol Rev. 2013;93(1):359–404. doi: 10.1152/physrev.00033.2011. [DOI] [PubMed] [Google Scholar]
- 22.Bays H, Blonde L, Rosenson R. Adiposopathy: how do diet, exercise and weight loss drug therapies improve metabolic disease in overweight patients? Expert Rev Cardiovasc Ther. 2006;4(6):871–95. doi: 10.1586/14779072.4.6.871. [DOI] [PubMed] [Google Scholar]
- 23.Lee CM, Huxley RR, Wildman RP, Woodward M. Indices of abdominal obesity are better discriminators of cardiovascular risk factors than BMI: a meta-analysis. J Clin Epidemiol. 2008;61(7):646–53. doi: 10.1016/j.jclinepi.2007.08.012. Publ. en ligne du 21 mars 2008. [DOI] [PubMed] [Google Scholar]
- 24.Lemieux I, Poirier P, Bergeron J, Alméras N, Lamarche B, Cantin B, et al. Hypertriglyceridemic waist: a useful screening phenotype in preventive cardiology? Can J Cardiol. 2007;23(Suppl B):23B–31B. doi: 10.1016/s0828-282x(07)71007-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Thibault R, Pichard C. The evaluation of body composition: a useful tool for clinical practice. Ann Nutr Metab. 2012;60(1):6–16. doi: 10.1159/000334879. Publ. en ligne du 16 déc. 2011. [DOI] [PubMed] [Google Scholar]
- 26.Ross R, Dagnone D, Jones PJ, Smith H, Paddags A, Hudson R, et al. Reduction in obesity and related comorbid conditions after diet-induced weight loss or exercise-induced weight loss in men. A randomized, controlled trial. Ann Intern Med. 2000;133(2):92–103. doi: 10.7326/0003-4819-133-2-200007180-00008. [DOI] [PubMed] [Google Scholar]
- 27.Verheggen RJ, Maessen MF, Green DJ, Hermus AR, Hopman MT, Thijssen DH. A systematic review and meta-analysis on the effects of exercise training versus hypocaloric diet: distinct effects on body weight and visceral adipose tissue. Obes Rev. 2016;17(8):664–90. doi: 10.1111/obr.12406. Publ. en ligne du 23 mai 2016. [DOI] [PubMed] [Google Scholar]
- 28.Bremer AA, Mietus-Snyder M, Lustig RH. Toward a unifying hypothesis of metabolic syndrome. Pediatrics. 2012;129(3):557–70. doi: 10.1542/peds.2011-2912. Publ. en ligne du 20 févr. 2012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Lustig RH. Which comes first? The obesity or the insulin? The behavior or the bio-chemistry? J Pediatr. 2008;152:601–2. doi: 10.1016/j.jpeds.2008.01.021. [DOI] [PubMed] [Google Scholar]
- 30.Acton RB, Vanderlee L, Hobin EP, Hammond D. Added sugar in the packaged foods and beverages available at a major Canadian retailer in 2015: a descriptive analysis. CMAJ Open. 2017;5(1):E1–6. doi: 10.9778/cmajo.20160076. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Sniderman AD, Bergeron J, Frohlich J. Apolipoprotein B versus lipoprotein lipids: vital lessons from the AFCAPS/TexCAPS trial. CMAJ. 2001;164(1):44–7. [PMC free article] [PubMed] [Google Scholar]
- 32.Miller M, Cannon CP, Murphy SA, Qin J, Ray KK, Braunwald E, et al. Impact of triglyceride levels beyond low-density lipoprotein cholesterol after acute coronary syndrome in the PROVE IT-TIMI 22 trial. J Am Coll Cardiol. 2008;51(7):724–30. doi: 10.1016/j.jacc.2007.10.038. [DOI] [PubMed] [Google Scholar]
- 33.Chapman MJ, Ginsberg HN, Amarenco P, Anderotti F, Borén J, Catapano AL, et al. Triglyceride-rich lipoproteins and high-density lipoprotein cholesterol in patients at high risk of cardiovascular disease: evidence and guidance for management. Eur Heart J. 2011;32(11):1345–61. doi: 10.1093/eurheartj/ehr112. Publ. en ligne du 29 avr. 2011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Tenenbaum A, Fisman EZ. “The metabolic syndrome is dead”; these reports are an exaggeration. Cardiovasc Diabetol. 2011;10(1):11. doi: 10.1186/1475-2840-10-11. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Varbo A, Freiberg JJ, Nordestgaard BG. Extreme nonfasting remnant cholesterol vs extreme LDL cholesterol as contributors to cardiovascular disease and all-cause mortality in 90000 individuals from the general population. Clin Chem. 2015;61(3):533–43. doi: 10.1373/clinchem.2014.234146. Publ. en ligne du 20 janv. 2015. [DOI] [PubMed] [Google Scholar]
- 36.Ross R, Després JP. Abdominal obesity, insulin resistance, and the metabolic syndrome: contribution of physical activity/exercise. Obesity (Silver Spring) 2009;17(Suppl 3):S1–2. doi: 10.1038/oby.2009.381. [DOI] [PubMed] [Google Scholar]
- 37.Flegal KM, Kruszon-Moran D, Carroll MD, Fryar CD, Ogden CL. Trends in obesity among adults in the United States, 2005 to 2014. JAMA. 2016;315(21):2284–91. doi: 10.1001/jama.2016.6458. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Childers DK, Allison DB. The “obesity paradox”: a parsimonious explanation for relations among obesity, mortality rate and aging? Int J Obes (Lond) 2010;34(8):1231–8. doi: 10.1038/ijo.2010.71. Publ. en ligne du 4 mai 2010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Carmienke S, Freitag MH, Pischon T, Schlattmann P, Fankhaenel T, Goebel H, et al. General and abdominal obesity parameters and their combination in relation to mortality: a systematic review and meta-regression analysis. Eur J Clin Nutr. 2013;67(6):573–85. doi: 10.1038/ejcn.2013.61. Publ. en ligne du 20 mars 2013. [DOI] [PubMed] [Google Scholar]
- 40.Ashwell M, Mayhew L, Richardson J, Rickayzen B. Waist-to-height ratio is more predictive of years of life lost than body mass index. PLoS One. 2014;9(9):e103483. doi: 10.1371/journal.pone.0103483. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Thaikruea L, Thammasarot J. Prevalence of normal weight central obesity among Thai healthcare providers and their association with CVD risk: a cross-sectional study. Sci Rep. 2016;6:37100. doi: 10.1038/srep37100. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Ashwell M, Gibson S. A proposal for a primary screening tool: “keep your waist circumference to less than half your height.”. BMC Med. 2014;12:207. doi: 10.1186/s12916-014-0207-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Coutinho T, Goel K, Corrêa de Sá D, Carter RE, Hodge DO, Kragelund C, et al. Combining body mass index with measures of central obesity in the assessment of mortality in subjects with coronary disease: role of “normal weight central obesity.”. J Am Coll Cardiol 2013;61(5):553–60. Errata dans : J Am Coll Cardiol. 2013;62(3):261. doi: 10.1016/j.jacc.2012.10.035. [DOI] [PubMed] [Google Scholar]
- 44.Kramer CK, Zinman B, Retnakaran R. Are metabolically healthy overweight and obesity benign conditions? A systematic review and meta-analysis. Ann Intern Med. 2013;159(11):758–69. doi: 10.7326/0003-4819-159-11-201312030-00008. [DOI] [PubMed] [Google Scholar]
- 45.Folsom AR, Kushi LH, Anderson KE, Mink PJ, Olson JE, Hong CP, et al. Associations of general and abdominal obesity with multiple health outcomes in older women: the Iowa Women’s Health Study. Arch Intern Med. 2000;160(14):2117–28. doi: 10.1001/archinte.160.14.2117. [DOI] [PubMed] [Google Scholar]
- 46.Pischon T, Boeing H, Hoffmann K, Bergmann M, Schulze MB, Overvad K, et al. General and abdominal adiposity and risk of death in Europe. N Engl J Med. 2008;359(20):2105–20. doi: 10.1056/NEJMoa0801891. [DOI] [PubMed] [Google Scholar]
- 47.Zhang C, Rexrode KM, van Dam RM, Li TY, Hu FB. Abdominal obesity and the risk of all-cause, cardiovascular, and cancer mortality: sixteen years of follow-up in US women. Circulation. 2008;117(13):1658–67. doi: 10.1161/CIRCULATIONAHA.107.739714. Publ. en ligne du 24 mars 2008. [DOI] [PubMed] [Google Scholar]
- 48.Koster A, Leitzmann MF, Schatzkin A, Mouw T, Adams KF, van Eijk JT, et al. Waist circumference and mortality. Am J Epidemiol. 2008;167(12):1465–75. doi: 10.1093/aje/kwn079. Publ. en ligne du 15 avr. 2008. [DOI] [PubMed] [Google Scholar]
- 49.Reis JP, Macera CA, Araneta MR, Lindsay SP, Marshall SJ, Wingard DL. Comparison of overall obesity and body fat distribution in predicting risk of mortality. Obesity (Silver Spring) 2009;17(6):1232–9. doi: 10.1038/oby.2008.664. Publ. en ligne du 5 févr. 2009. [DOI] [PubMed] [Google Scholar]
- 50.Romero-Corral A, Somers VK, Sierra-Johnson J, Korenfeld Y, Boarin S, Korinek J, et al. Normal weight obesity: a risk factor for cardiometabolic dysregulation and cardiovascular mortality. Eur Heart J. 2010;31(6):737–46. doi: 10.1093/eurheartj/ehp487. Publ. en ligne du 20 nov. 2009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Staiano AE, Reeder BA, Elliott S, Joffres MR, Pahwa P, Kirkland SA, et al. Body mass index versus waist circumference as predictors of mortality in Canadian adults. Int J Obes (Lond) 2012;36(11):1450–4. doi: 10.1038/ijo.2011.268. Publ. en ligne du 17 janv. 2012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Thomas F, Pannier B, Benetos A, Vischer UM. Visceral obesity is not an independent risk factor of mortality in subjects over 65 years. Vasc Health Risk Manag. 2013;9:739–45. doi: 10.2147/VHRM.S49922. Publ. en ligne du 22 nov. 2013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Cerhan JR, Moore SC, Jacobs EJ, Kitahara CM, Rosenberg PS, Adami HO, et al. A pooled analysis of waist circumference and mortality in 650,000 adults. Mayo Clin Proc. 2014;89(3):335–45. doi: 10.1016/j.mayocp.2013.11.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Sahakyan KR, Somers VK, Rodriguez-Escudero JP, Hodge DO, Carter RE, Sochor O, et al. Normal-weight central obesity: implications for total and cardiovascular mortality. Ann Intern Med. 2015;163(11):827–35. doi: 10.7326/M14-2525. Publ. en ligne du 10 nov. 2015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Klingberg S, Mehlig K, Lanfer A, Björkelund C, Heitmann BL, Lissner L. Increase in waist circumference over 6 years predicts subsequent cardiovascular disease and total mortality in Nordic women. Obesity (Silver Spring) 2015;23(10):2123–30. doi: 10.1002/oby.21203. Publ. en ligne du 4 sept. 2015. [DOI] [PubMed] [Google Scholar]
- 56.Sharma S, Batsis JA, Coutinho T, Somers VK, Hodge DO, Carter RE, et al. Normal-weight central obesity and mortality risk in older adults with coronary artery disease. Mayo Clin Proc. 2016;91(3):343–51. doi: 10.1016/j.mayocp.2015.12.007. Publ. en ligne du 6 févr. 2016. [DOI] [PubMed] [Google Scholar]
- 57.Hamer M, O’Donovan G, Stensel D, Stamatakis E. Normal-weight central obesity and risk for mortality. Ann Intern Med. 2017;166(12):917–8. doi: 10.7326/L17-0022. Publ. en ligne du 25 avr. 2017. [DOI] [PubMed] [Google Scholar]
- 58.Porter SA, Massaro JM, Hoffmann U, Vasan RS, O’Donnel CJ, Fox CS. Abdominal subcutaneous adipose tissue: a protective fat depot? Diabetes Care. 2009;32(6):1068–75. doi: 10.2337/dc08-2280. Publ. en ligne du 24 févr. 2009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Ross R, Bradshaw AJ. The future of obesity reduction: beyond weight loss. Nat Rev Endocrinol. 2009;5(6):319–25. doi: 10.1038/nrendo.2009.78. [DOI] [PubMed] [Google Scholar]
- 60.Ross R, Janiszewski PM. Is weight loss the optimal target for obesity-related cardiovascular disease risk reduction? Can J Cardiol. 2008;24(Suppl D):25D–31D. doi: 10.1016/s0828-282x(08)71046-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Chaston TB, Dixon JB. Factors associated with percent change in visceral versus subcutaneous abdominal fat during weight loss: findings from a systematic review. Int J Obes (Lond) 2008;32(4):619–28. doi: 10.1038/sj.ijo.0803761. Publ. en ligne du 8 janv. 2008. [DOI] [PubMed] [Google Scholar]
- 62.Seidell JC, Pérusse L, Després JP, Bouchard C. Waist and hip circumferences have independent and opposite effects on cardiovascular disease risk factors: the Quebec Family Study. Am J Clin Nutr. 2001;74(3):315–21. doi: 10.1093/ajcn/74.3.315. [DOI] [PubMed] [Google Scholar]
- 63.Han TS, Tajar A, Lean ME. Obesity and weight management in the elderly. Br Med Bull. 2011;97:169–96. doi: 10.1093/bmb/ldr002. Publ. en ligne du 16 févr. 2011. [DOI] [PubMed] [Google Scholar]
- 64.Berentzen TL, Jakobsen MU, Halkjaer J, Tjønneland A, Overvad K, Sørensen TI. Changes in waist circumference and mortality in middle-aged men and women. PLoS One. 2010;5(9):e13097. doi: 10.1371/journal.pone.0013097. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.Wen CP, Wai JP, Tsai MK, Yang YC, Cheng TY, Lee MC, et al. Minimum amount of physical activity for reduced mortality and extended life expectancy: a prospective cohort study. Lancet. 2011;378(9798):1244–53. doi: 10.1016/S0140-6736(11)60749-6. Publ. en ligne du 16 août 2011. [DOI] [PubMed] [Google Scholar]
- 66.Lee DC, Pate RR, Lavie CJ, Sui X, Church TS, Blair SN. Leisure-time running reduces all-cause and cardiovascular mortality risk. J Am Coll Cardiol. 2014;64(5):472–81. doi: 10.1016/j.jacc.2014.04.058. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Estruch R, Ros E, Salas-Salvadó J, Covas MI, Corella D, Arós F, et al. Primary prevention of cardiovascular disease with a Mediterranean diet supplemented with extravirgin olive oil or nuts. N Engl J Med. 2018;378(25):e34. doi: 10.1056/NEJMoa1800389. Publ. en ligne du 13 juin 2018. [DOI] [PubMed] [Google Scholar]
- 68.Babio N, Toledo E, Estruch R, Ros E, Martínez-González MA, Castañer O, et al. Mediterranean diets and metabolic syndrome status in the PREDIMED randomized trial. CMAJ. 2014;186(17):E649–57. doi: 10.1503/cmaj.140764. Publ. en ligne du 14 oct. 2014. Expression de préoccupation dans : CMAJ 2018;190(26):E808. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.Malhotra A, Noakes T, Phinney S. It is time to bust the myth of physical inactivity and obesity: you cannot outrun a bad diet. Br J Sports Med. 2015;49(15):967–8. doi: 10.1136/bjsports-2015-094911. Publ. en ligne du 22 avr. 2015. [DOI] [PubMed] [Google Scholar]
- 70.Anderson TJ, Grégoire J, Pearson GJ, Barry AR, Couture P, Dawes M, et al. 2016 Canadian Cardiovascular Society guidelines for the management of dyslipidemia for the prevention of cardiovascular disease in the adult. Can J Cardiol. 2016;32(11):1263–82. doi: 10.1016/j.cjca.2016.07.510. Publ. en ligne du 25 juill. 2016. [DOI] [PubMed] [Google Scholar]