Abstract
目的
通过改良丙戊酸钠(VPA)小鼠自闭症模型,提高建模成功率,缩短实验周期,更好地模拟临床自闭症发病情况。
方法
将实验小鼠分为3组,对照组在小鼠孕12.5 d时腹腔注射等体积生理盐水;传统组在小鼠孕12.5 d时一次性腹腔注射VPA 600 mg/kg;改良组在小鼠孕10、12 d时,分别腹腔注射VPA 300 mg/kg。观测3组孕鼠给药后反应和6 h死亡率、流产率、临产子宫;观测仔鼠的形态与生长发育;观察仔鼠社会行为学,包括三腔实验、社交实验、青年玩耍实验和旷场实验等反映仔鼠自闭症样行为。
结果
改良组孕鼠死亡率和流产率低于传统组(P < 0.01);与正常组相比,传统组和改良组仔鼠均存在发育障碍(P < 0.05),但是改良组新生鼠死亡率明显低于传统组,弯尾高达100%(P < 0.001)。与正常组相比,改良组和传统组均出现了自闭症样行为,即社交障碍和重复刻板行为(P < 0.05)。
结论
改良后的给药方法,能更好的模拟人类自闭症发生的过程,同时降低了孕鼠和新生鼠的死亡率、流产率,缩短了实验周期,提高了实验效率。
Keywords: 自闭症, 丙戊酸钠, 动物模型, 改良
Abstract
Objective
To establish an improved mouse model of valproic acid (VPA)-induced autism that better mimics human autism.
Methods
We established mouse models of autism in female C57 mice by intraperitoneal injection of sodium valproate either at a single dose (600 mg/kg) on day 12.5 after conception (conventional group) or in two doses of 300 mg/kg each on days 10 and 12 after conception (modified group), and the control mice were injected with saline only on day 12.5. The responses of the mice to VPA injection, the uterus, mortality rate, and abortion rate were compared among the 3 groups. The morphology and development of the offspring mice were assessed, and their behavioral ontogeny was evaluated using 3- chambered social test, social test, juvenil play test, and open field test.
Results
The mortality and abortion rates were significantly lower in the modified model group than in the conventional group (P < 0.01). Compared with those in the control group, the offspring mice in both the conventional group and the modified group showed developmental disorders (P < 0.05). The mortality rate of the newborn mice was significantly lower in the modified group than in the conventional group with a rate of curvy tail of up to 100% (P < 0.001). The offspring mice in both the modified group and conventional group exhibited autism-like behavioral abnormalities, including social disorder and repetitive stereotyped behavior (P < 0.05).
Conclusion
The mouse model of autism established using the modified method better mimics human autism with reduced mortality and abortion rates of the pregnant mice and also decreased mortality rate of the newborn mice.
Keywords: autism, valproic acid, animal models, improvement
自闭症是一组起病于儿童发育早期,伴随终生的严重的先天中枢神经系统发育障碍性疾病,语言交流障碍、社会交往困难和重复刻板行为是典型的自闭症核心症状[1-4]。目前自闭症的病因和发病机制尚不清楚,尚无有效的治疗方法,为家庭和社会造成了严重的负担[5-7],因此建立一个良好的能模拟人类自闭症样临床特征的动物模型,对进一步阐明发病机制及临床治疗都有极大帮助。
目前已建立多种自闭症动物模型,如VPA模型[8]、抗体模型[9]、PPA模型[10]、病毒模型[11]、基因缺陷鼠[12]等,其中VPA模型是比较经典的一种[13-15]。但本课题组在采用VPA建模方式中发现孕鼠在给药后出现死亡率高、流产率高,建模成功率低等现象,其他学者的实验中也有相似发现[21-24]。因此传统建模方式需要改进,本研究更加注重VPA给药方式(剂量和时间)与建模效应间的关系。本研究将对小鼠孕12.5 d时一次性腹腔注射VPA 600 mg/kg,改为孕10 d和12 d分别腹腔给药VPA 300 mg/kg,比较孕鼠给药后反应、流产和生产情况,仔鼠生长发育以及自闭症样行为等,以筛选出更佳的建立自闭症模型鼠方法。
1. 材料和方法
1.1. 实验动物
本研究中成年C57鼠,雌鼠80只,雄鼠20只,体质量20~30 g,购于重庆医科大学实验动物中心,饲养于重庆医科大学清洁级动物房。
1.2. 模型制备
将购买的成年C57雄鼠和雌鼠于前一晚下午5点于重庆医科大学动物房(IVC2)进行合笼,次日9:00分笼,见阴栓记为孕半天。根据VPA(Sigma)给药方式将小鼠分为3组:正常组于孕12.5 d,注射等体积生理盐水;传统组于孕12.5 d,按600 mg/kg腹腔注射已配制好的VPA;改良组分别于孕10、12 d,按300 mg/kg腹腔注射已配制好的VPA。
1.3. 给药后孕鼠反应及死亡情况
腹腔给药后,轻轻放回饲养笼中,观察15 min内孕鼠的反应和6 h内孕鼠有无死亡现象。
1.4. 流产记录
合笼次日见阴栓,孕12.5 d体质量明显增加伴腹部隆起,孕19~20 d体质量突然下降,同时满足3项即为流产。流产率=各组流产孕鼠数/各组总怀孕孕鼠数× 100%。
1.5. 胎鼠观察
于孕18 d解剖孕鼠,观察并记录胎鼠情况。正常胎鼠为体形完整,颜色发红或粉红,胎盘大。
1.6. 生长发育记录
分别于出生后7、14、21、28 d记录小鼠体质量,尾长。体质量测量:将小鼠放于天平上静止2 s后读数,分别测量2次,算均数,单位毫克(mg)。
尾长测量:从尾巴根部开始,测取笔直状态下尾巴的长度,单位厘米(cm)。
1.7. 行为学检测
出生后28 d开始为期1周的行为学检测,出生后35 d取材。
1.7.1. 社交实验
(1)适应阶段:将受测小鼠轻轻放入装置(材质:亚克力玻璃,40 cm×40 cm×30 cm,铺2~3 cm厚的垫料),任其在内自由活动10 min。(2)测试阶段:取出刚适应好的受测小鼠,同时放入受测小鼠和互动小鼠(与受测小鼠性别相同、年龄相仿的未同笼饲养过的同品系小鼠),记录接下来10 min内,受测小鼠与互动小鼠发生攻击性行为、非攻击性行为的时间。攻击性行为包括:受测小鼠主动用爪子抓或用嘴咬互动小鼠、受测小鼠与互动小鼠互成类似站立样的“怒视”等行为;非攻击性行为包括:受测小鼠主动追逐、尾随、靠近互动小鼠并发生密切地身体接触等行为。测试结束后,取出受测小鼠和互动小鼠,并更换新的清洁垫料,待下一只小鼠进行测试。
1.7.2. 青年玩耍实验
(1)适应阶段:将受测小鼠轻轻放入装置内(材质:亚克力玻璃,40 cm×40 cm×30 cm),任其在内自由活动10 min。(2)测试阶段:取出刚适应好的受测小鼠,同时放入受测小鼠和互动小鼠(同前)。记录接下来的10 min内受测小鼠与互动小鼠间的一系列行为(包括:社交行为,自我捋毛及挖掘行为)的时间。其中社交行为包括:受测小鼠主动追逐、尾随、靠近、主动将前肢搭于互动小鼠身上、受测小鼠主动为互动小鼠捋毛、受测小鼠主动与互动小鼠发生鼻-鼻互触或鼻-体接触等行为;自我捋毛行为包括:受测小鼠用舌梳理自己全身任何部位的重复性动作;挖掘行为:受测小鼠用前肢挖掘垫料的行为。测试结束后,取出受测小鼠和互动小鼠,并更换新的清洁垫料,待下一只小鼠进行测试。
1.7.3. 旷场实验
(1)适应阶段:将受测小鼠轻轻放入装置中(材质:亚克力玻璃,40 cm×40 cm×30 cm),任其自由活动10 min。(2)测试阶段:记录接下来的10 min内受测小鼠跨中央格数的次数、跨周围格数的次数、站立数和攀墙数,并记录测试阶段受测小鼠大小便情况。装置总分为16格,中间4格即为中央格,周围12格即为周围格。跨格标准为:4肢均跨过格子边线。站立与攀墙标准:前2肢均离地,并保持2 s及以上。测试结束后,轻轻取出受测小鼠放回笼子,然后用75%的酒精溶液擦拭装置,待其干燥后进行下一只小鼠的测试。
1.7.4. 三腔室实验
(1)适应阶段:将受测小鼠放入装置中(材质:亚克力玻璃,120 cm×20 cm×22 cm),任其在3个连通的腔室中自由活动10 min,以适应环境。(2)测试阶段:取出适应好的受测小鼠,并在左右两侧腔室中分别放入空笼子和带有陌生小鼠(与测试小鼠性别相同、年龄相仿的未同笼饲养过的同品系小鼠)的笼子(左右随机放)。轻轻将之前适应好的受测小鼠由中间的腔室中放入使其在内活动10 min,结束后轻轻取出受测小鼠。向空笼子内放入另一只陌生小鼠,然后再次将受测小鼠轻轻放入中间的腔室内。记录接下来的10 min内,受测小鼠在3个腔室内分别停留的时间及分别与之前的陌生小鼠和新的陌生小鼠发生互动行为的时间。测试结束后依次取出受测小鼠及两侧空笼子中的陌生小鼠放回不同的笼中,并用75%的乙醇溶液清洗实验装置,待其干燥后进行下一受测小鼠的测试。
1.8. 统计学分析
采用SPSS 16.0软件进行统计学分析。所有数据均以均数±标准差表示,组间差异性比较采用独立样本t检验和χ2检验,以P < 0.05为差异有统计学意义。
2. 结果
2.1. 给药后孕鼠反应、死亡率及流产率
传统组孕鼠在给药后5 min内即出现四肢僵硬,行走困难,闭目瘫痪在鼠笼里;而改良组反应较传统组轻,四肢僵硬出现在给药后约12 min,在整个观察期的15 min内尚能行走。给药后6 h内,改良组死亡率为0%,传统组死亡率为10.53%(P=0.566)。流产率:改良组流产率较传统组低(0% vs 60.53%,P=0.002,表 1)。
1.
孕鼠生产情况比较
Comparison of fertility in pregnant mice (n, %)
| Group | Abortion | Mortality | Normal | Totality |
| P: Improved group vs traditional group. | ||||
| Control | 0 (0%) | 0 (0%) | 9 (100%) | 0 (0%) |
| Traditional | 23 (60.53%) | 4 (10.53%) | 11 (28.94%) | 38 (100%) |
| Improved | 0 (0%) | 0 (0%) | 10 (100%) | 10 (100%) |
| P | 0.002 | 0.566 | < 0.001 | |
2.2. 胎鼠比较
每组随机解剖1只孕鼠,发现改良组和正常组胎鼠体形完整,颜色发红或粉红,胎盘大。而传统组胎鼠中出现胎鼠体形畸形,颜色发白或发黑现象,传统组中存在畸胎及死胎(图 1)。
1.
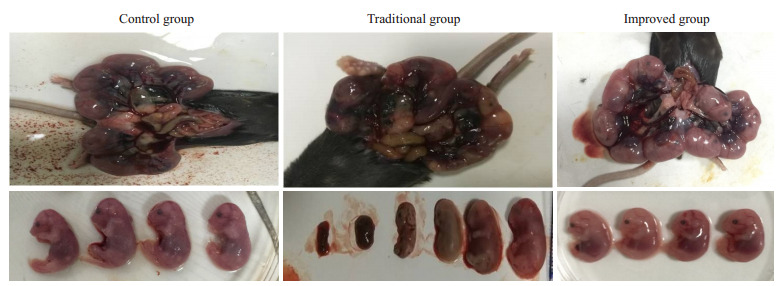
孕18 d小鼠子宫及胎鼠观察
Observation of the uterus and the fetal mice at 18 days of gestation.
2.3. 仔鼠形态及生长发育比较
传统组胎鼠死亡率约12.5%,对照和改良组未出现类似现象(表 2,图 2)。出生后7、14、21、28 d检测各组仔鼠体质量和尾长。改良组小鼠出生后7~28 d体质量均轻于对照组(P < 0.001);传统组则是从出生后21 d开始出现体质量低于对照组(P < 0.01)(图 3A)。改良组和传统组的尾长均短于对照组(P < 0.05,图 3B),传统组仔鼠出现过1次尾部弯曲现象,弯尾发生率4.27%,改良组所有仔鼠均存在尾部弯曲,弯尾发生率100%,两组差异有统计学意义(P < 0.001,表 2,图 4)。
2.
新生鼠死亡率及仔鼠弯尾率
Rates of stillbirth and curved tail in the offspring mice (n, %)
| Group | Stillbirth | Curved tail mice | Totality |
| P: Improved group vs traditional group. | |||
| Control | 0 (0%) | 0 (0%) | 13 (100%) |
| Traditional | 3 (12.5%) | 1 (4.27%) | 24 (100%) |
| Improved | 0 (0%) | 14 (100%) | 14 (100%) |
| P | 0.283 | 0.001 | |
2.
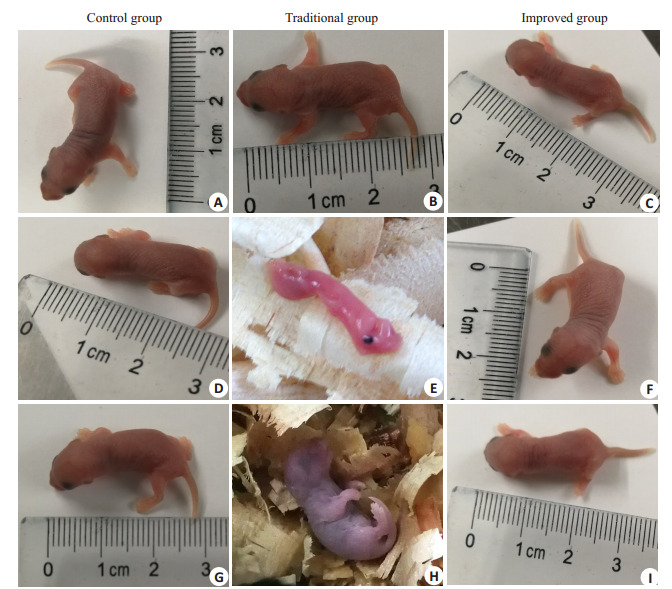
新生鼠观察
Observation of newborn mice. A: Control group; D-F: Traditional group; G-I: Improved group.
3.
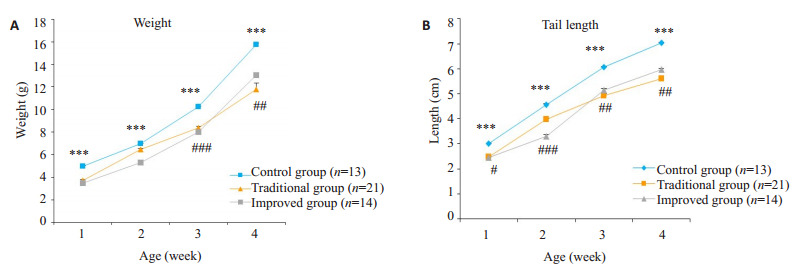
3组仔鼠体质量和尾长比较
Weight (A) and tail length (B) of the offspring mice in the 3 groups. ***P < 0.001, improved group vs control group, #P < 0.05, traditional group vs control group, ##P < 0.01, traditional group vs control group, ###P < 0.001, traditional group vs control group.
4.

仔鼠生后第10天的尾部
Tail of the offspring mice on day 10 after birth.
2.4. 三组仔鼠自闭症样行为学比较(图 5)
5.
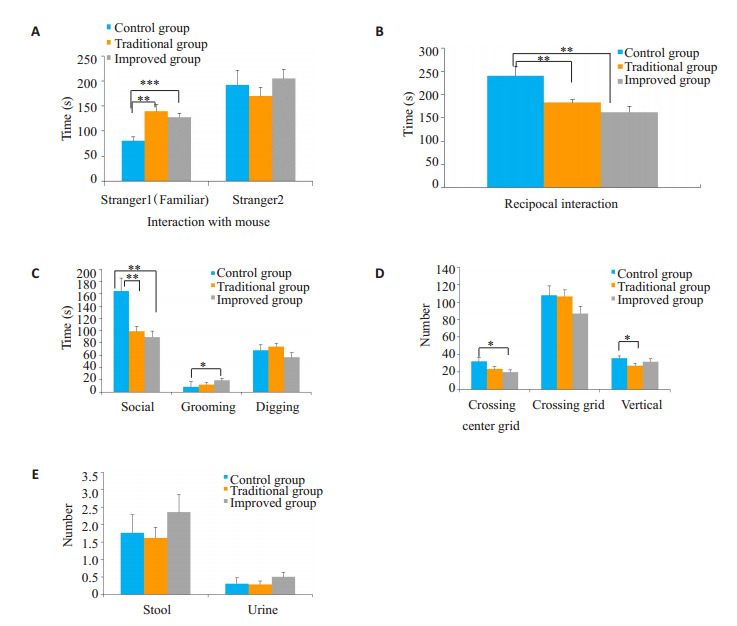
各组自闭症样行为比较
Behavior comparison of the offspring mice in the 3 groups. A: 3 chambered social test; B: social test; C: juvenil play; D, E: Open field test. *P < 0.05, **P < 0.01, ***P < 0.001.
2.4.1. 社交能力
三腔实验中,在测试阶段的第2个10 min内,传统组和改良组与熟悉鼠互动时间均高于正常组,差异具有统计学意义(P < 0.01)。社交实验中,传统组、改良组和对照组均没有发现攻击性行为,但在非攻击性行为上,传统组和改良组均与其它鼠间的交流互动行为均少于对照组(P < 0.001)。青年玩耍实验中,传统组与改良组的社交时间均少于对照组(P < 0.01)。
2.4.2. 重复刻板行为
青年玩耍实验中,改良组的捋毛时间多于对照组(P < 0.05),而传统组与对照组间差异无统计学意义(P > 0.05)。旷场实验中,改良组小鼠跨中央格数少于对照组(P < 0.05),而传统组与对照组之间差异无统计学意义(P > 0.05);传统组在直立鼠上少于对照组(P < 0.05),而改良组与对照组之间差异无统计学意义(P > 0.05)。
2.4.3. 焦虑
旷场实验中,传统组和改良组在大小便方面均与对照组之间差异无统计学意义(P > 0.05)。
3. 讨论
人胚发育的20~24 d是神经管关闭和神经元发育的初期,是多种原因所致神经系统发育障碍、孤独症发生的关键时间窗,流行病学研究发现,在这个关键时期内,服用抗癫痫药VPA的孕妇所生孩子自闭症的发病率升高[16-20]。鼠怀孕12.5 d也是这个关键时期,此时给实验鼠腹腔注射VPA,可建立自闭症动物模型,此模型与临床自闭症患者的解剖学、病理学、病因学和行为学等特征都极为相似。但本课题组在应用传统方法建立自闭症小鼠模型时发现此建模方法需要改进,同时给药方式与临床上孕期母亲多次低计量服用戊丙酸钠也存在较大差异。
本研究将对小鼠孕12.5 d时一次性腹腔注射VPA 600 mg/kg的传统给药方法,改为孕10 d和12 d分别腹腔给药VPA 300 mg/kg后,发现传统和改良方法都能诱发实验鼠出现典型的自闭症样行为。在三腔社交偏好实验、社交实验和青年玩耍实验中,改良组和传统组都出现了社交障碍,两组与同龄鼠互动时间都明显减少,都更喜欢与熟悉鼠待在一起,这与其他学者的实验结果一致[25-28];但改良组动物的捋毛行为明显高于传统组,这提示:改良组动物的刻板重复行为更明显,此模型对于研究重复刻板行为主的自闭症更加理想。分析其出现更明显的自闭症行为的原因是,改良的给药方式更贴近临床多次服用VPA后诱发自闭症发生的病理过程。临床上VPA用药的最大剂量是30 mg/kg,在用药后1~4 h完全吸收,并达到峰值,主要由肝脏代谢,肾排出代谢产物。改良给药方式能在神经系统发育的关键时间窗中出现2个高于最大剂量10倍的VPA吸收峰值,仔鼠脑发育受到双倍长时间的打击,造成了仔鼠脑发育受损更加严重。
本研究改良的给药方式能明显减轻孕鼠VPA给药后不良反应,虽然在给VPA后动物有一定程度的运动障碍,但出现较晚、持续时间短,反应较轻,未观察到四肢僵硬,瘫痪、无法行走等现象,明显减轻了动物的痛苦。本研究改良组未见孕鼠的死亡和流产现象发生,而传统组死亡率和流产率分别高达10.53%和60.53%。其他学者发现,VPA孕鼠生育率仅为33.33%左右[23]。本研究改良组仔鼠的体质量和尾部发育落后于传统组,改良组小鼠从出生开始体质量便小于正常组,传统组小鼠到出生21 d才出现体质量上的差异。尽管传统组和改良组小鼠尾长均较短,都有发育障碍,但更值得注意的是,改良组仔鼠弯尾发生率高达100%,传统组仅为4.27%,其他学者研究与传统组的结果相似[13, 29]。弯尾常被作为建模成功的一种标志,因为VPA除影响神经系统发育外,还影响骨骼发育,导致仔鼠出现弯尾、肢体畸形等现象发生[30],100%的弯尾率也从另一方面提示,改良后的方法能够更有效的建立自闭症模型。
Biography
郑文霞,硕士,E-mail: 790094502@qq.com
Funding Statement
重庆市基础科学与前沿技术研究专项项目(cstc2016jcyjA0037)
Contributor Information
郑 文霞 (Wenxia ZHENG), Email: 790094502@qq.com.
王 莎莉 (Shali WANG), Email: 63557408@qq.com.
References
- 1.Adler BA, Wink LK, Early M, et al. Drug-refractory aggression, self-injurious behavior, and severe tantrums in autism spectrum disorders:a chart review study. Autism. 2015;19(1):102–6. doi: 10.1177/1362361314524641. [DOI] [PubMed] [Google Scholar]
- 2.Ioana CA, Stefanachi EA. Autism, an overwhelming condition:history, etiopathogenesis, types, diagnosis, therapy and prognosis. http://cn.bing.com/academic/profile?id=f122f9c6fa3d7dabee06a6f5b59d6692&encoded=0&v=paper_preview&mkt=zh-cn. Rev Med Chir Soc Med Nat Iasi. 2013;117(3):654–61. [PubMed] [Google Scholar]
- 3.Gray K, Keating C, Taffe J, et al. Trajectory of behavior and emotional problems in autism. Am J Intellect Dev Disabil. 2012;117(2):121–33. doi: 10.1352/1944-7588-117-2.121. [DOI] [PubMed] [Google Scholar]
- 4.Das N, Dhanawat M, Shrivastava SK. An overview on antiepileptic drugs. http://cn.bing.com/academic/profile?id=34b797c1d59b8dc554aa956a353c69f3&encoded=0&v=paper_preview&mkt=zh-cn. Drug Discov Ther. 2012;6(4):178–93. [PubMed] [Google Scholar]
- 5.Mohiuddin S, Ghaziuddin M. Psychopharmacology of autism spectrum disorders:a selective review. Autism. 2013;17(6):645–54. doi: 10.1177/1362361312453776. [DOI] [PubMed] [Google Scholar]
- 6.Gomes PM, Lima LL, Bueno MG, et al. Autism in Brazil:a systematic review of family challenges and coping strategies. J Pediatr (Rio J) 2015;91(2):111–21. doi: 10.1016/j.jped.2014.08.009. [DOI] [PubMed] [Google Scholar]
- 7.Parish S, Thomas K, Rose R, et al. State insurance parity legislation for autism services and family financial burden. Intellect Dev Disabil. 2012;50(3):190–8. doi: 10.1352/1934-9556-50.3.190. [DOI] [PubMed] [Google Scholar]
- 8.Schneider T, Przewłocki R. Behavioral alterations in rats prenatally exposed to valproic acid:animal model of autism. Neuropsychopharmacology. 2005;30(1):80–9. doi: 10.1038/sj.npp.1300518. [DOI] [PubMed] [Google Scholar]
- 9.Singer HS, Morris C, Gause C, et al. Prenatal exposure to antibodies from mothers of children with autism produces neurobehavioral alterations:a pregnant dam mouse model. http://cn.bing.com/academic/profile?id=d8c60862246a1c4eac021d6ddd2715b9&encoded=0&v=paper_preview&mkt=zh-cn. J Neuroimmunol. 2009;211(1/2):39–48. doi: 10.1016/j.jneuroim.2009.03.011. [DOI] [PubMed] [Google Scholar]
- 10.Shultz SR, Macfabe DF, Martin SA, et al. Intracerebroventricular injections of the enteric bacterial metabolic product propionic acid impair cognition and sensorimotor ability in the long-evans rat:further development of a rodent model of autism. Behav Brain Res. 2009;200(1):33–41. doi: 10.1016/j.bbr.2008.12.023. [DOI] [PubMed] [Google Scholar]
- 11.WinterC, ReutimanTJ, Folsom TD, et al. Dopamine and seroton in levels following prenatal viral in fection in mouse-implications for psychiatric disorders such as schizophrenia and autism. Europ Neuropsychopharmacol. 2008;18(10):712–6. doi: 10.1016/j.euroneuro.2008.06.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Moy SS, Nonneman RJ, Young NB, et al. Impaired sociability and cognitive function in Nrcam-null mice. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=069a72b91a04a5a8aba02385b6814497. Behav Brain Res. 2009;205(1):0–131. doi: 10.1016/j.bbr.2009.06.021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Choi CS, Gonzales EL, Kim KC, et al. The transgenerational inheritance of autism-like phenotypes in mice exposed to valproic acid during pregnancy. http://cn.bing.com/academic/profile?id=d81f9c8b8d1cae24a632b0d2c8bf82fc&encoded=0&v=paper_preview&mkt=zh-cn. Sci Rep. 2016;6(12):36250–67. doi: 10.1038/srep36250. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Hou QL, Yan W, Li YB, et al. A developmental study of abnormal behaviors and altered GABAergic signaling in the VPA-treated rat model of Autism. http://cn.bing.com/academic/profile?id=f024147135c694664270b38653503237&encoded=0&v=paper_preview&mkt=zh-cn. Front Behav Neurosci. 2018;(12):182–91. doi: 10.3389/fnbeh.2018.00182. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Yang EJ, Ahn S, Lee K, et al. Early behavioral abnormalities and perinatal alterations of PTEN/AKT pathway in valproic acid autism model mice. http://cn.bing.com/academic/profile?id=c518b1054cabe70cbe17185099d9c491&encoded=0&v=paper_preview&mkt=zh-cn. PLoS One. 2016;11(4):298–307. doi: 10.1371/journal.pone.0153298. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Meador K, Reynolds MW, Crean S, et al. Pregnancy outcomes in women with epilepsy:A systematic review and meta-analysis of published pregnancy registries and cohorts. Epilepsy Res. 2008;81(1):1–13. doi: 10.1016/j.eplepsyres.2008.04.022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Meador KJ, Baker GA, Browning NA, et al. Cognitive function at 3 years of age after fetal exposure to antiepileptic drugs. N Engl J Med. 2009;360(16):1597–605. doi: 10.1056/NEJMoa0803531. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Meador KJ, Baker GA, Browning N, et al. Foetal antiepileptic drug exposure and verbal versus non-verbal abilities at three years of age. Brain. 2011;134(2):396–408. doi: 10.1093/brain/awq352. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Nadebaum C, Anderson V, Vajda F, et al. The Australian brain and cognition and antiepileptic drugs study:IQ in school-aged children exposed to sodium valproate and polytherapy. J Intern Neuropsychol Society. 2011;17(1):133–42. doi: 10.1017/S1355617710001359. [DOI] [PubMed] [Google Scholar]
- 20.Shallcross R, Bromley RL, Irwin B, et al. Child development following in utero exposure:levetiracetam vs sodium valproate. Neurology. 2011;76(4):383–9. doi: 10.1212/WNL.0b013e3182088297. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.李 天苏, 潘 娜娜, 杨 李, et al. Sprague-Dawley大鼠孤独症模型的建立及行为学特点分析. 安徽医学. 2013;34(7):865–8. doi: 10.3969/j.issn.1000-0399.2013.07.002. [DOI] [Google Scholar]
- 22.Escalona-Cardoso GN, Paniagua-Castro N, Pérez-Pastén R, et al. Spirulina(arthrospira) protects against valproic Acid-Induced neural tube defects in imprinting control region mice. J Med Food. 2012;15(12):1103–8. doi: 10.1089/jmf.2012.0057. [DOI] [PubMed] [Google Scholar]
- 23.雷 雨溪, 何 慕兰, 赖 茜, et al. 两种孤独症谱系障碍大鼠模型的构建及比较. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=cqykdxxb201809002 重庆医科大学学报. 2018;43(9):1132–9. [Google Scholar]
- 24.Sato M, Shirota M, Nagao T. Pantothenic acid decreases valproic acid-induced neural tube defects in mice. Teratology. 1995;52(3):143–8. doi: 10.1002/(ISSN)1096-9926. [DOI] [PubMed] [Google Scholar]
- 25.Al-Amin MM, Rahman MM, Khan FR, et al. Astaxanthin improves behavioral disorder and oxidative stress in prenatal valproic acid-induced mice model of autism. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=9efc4185ee70726b043b2e8043454b45. Behav Brain Res. 2015;286(2):112–21. doi: 10.1016/j.bbr.2015.02.041. [DOI] [PubMed] [Google Scholar]
- 26.Mony TJ, Lee JW, Dreyfus CA, et al. Valproic acid exposure during early postnatal gliogenesis leads to autistic-like behaviors in rats. Clin Psychopharmacol Neuros. 2016;14(4):338–44. doi: 10.9758/cpn.2016.14.4.338. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Hill DS, Robert C, Deeann WS, et al. Autism-Like behavior and epigenetic changes associated with autism as consequences ofr, in uteror, exposure to environmental pollutants in a mouse model. https://www.hindawi.com/journals/bn/2015/426263/ Behav Neurol. 2015;20(1):1–10. doi: 10.1155/2015/426263. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Coretti L, Cristiano C, Florio E, et al. Sex-related alterations of gut microbiota composition in the BTBR mouse model of autism spectrum disorder. http://cn.bing.com/academic/profile?id=3e6cc7768a99aca0ca25e3d9e0838f7c&encoded=0&v=paper_preview&mkt=zh-cn. Sci Rep. 2017;35(7):45356–67. doi: 10.1038/srep45356. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.侯倩伶. VPA孤独症大鼠发育特点和GABA能神经元在不同脑区的表达[D].重庆: 学重庆医科大学, 2017.http://cdmd.cnki.com.cn/Article/CDMD-10631-1017843641.htm
- 30.Rasalam AD, Hailey H, Williams JH, et al. Characteristics of fetal anticonvulsant syndrome associated autistic disorder. Dev Med Child Neurol. 2005;47(8):551–5. doi: 10.1017/S0012162205001076. [DOI] [PubMed] [Google Scholar]


