Abstract
目的
探讨H9c2心肌细胞发生氧化应激损伤时,线粒体膜上的线粒体通透性转换孔(mPTP)在天麻素抗氧化应激损伤的保护机制中所发挥的作用。
方法
本实验分为6组:正常组,过氧化氢组,天麻素+过氧化氢组,天麻素组,环孢菌素A组,环孢菌素A+天麻素+过氧化氢组。通过加入环孢菌素A(mPTP开放剂)观察天麻素的保护作用是否被抑制。用MTT法初步检测各组细胞存活率,采用Annexin V-FITC/PI双染法通过流式细胞仪观察细胞早期凋亡率,大鼠三磷酸腺苷(ATP)试剂盒检测ATP的含量,活性氧检测试剂盒检测细胞内活性氧(ROS)的含量,激光扫描共聚焦显微镜观察Jc-1标记的线粒体膜电位,Western blot检测细胞内细胞色素C(Cyt C)含量,Caspase-3活性检测试剂盒检测caspase-3的酶活性。
结果
环孢菌素A+天麻素+过氧化氢组线粒体的相对膜电位低于天麻素+过氧化氢组(1.98±0.18 vs 3.08±0.14),差异有统计学意义(P=0.014)。环孢菌素A可以阻断氧化应激时天麻素降低细胞内活性氧和相关凋亡因子的含量、抑制相关因子活性的作用(P < 0.05),并且在一定程度上阻断了天麻素的抗凋亡作用(5.77±0.75)% vs(1.97±0.82)%,两者差异有统计学意义(P < 0.001)。
结论
天麻素可以通过抑制心肌细胞发生氧化应激损伤时mPTP的开放,最终通过减少凋亡来发挥一定的抗氧化应激损伤的作用。
Keywords: 氧化应激损伤, 线粒体通透性转换孔, 天麻素, 环孢菌素A
Abstract
Objective
To explore the role of mitochondrial permeability transition pore (mPTP) in mediating the protective effect of gastrodin against oxidative stress damage in H9c2 cardiac myocytes.
Methods
H9c2 cardiac myocytes were treated with H2O2, gastrodin, gastrodin+H2O2, cyclosporin A (CsA), or CsA+gas+H2O2 group. MTT assay was used to detect the survival ratio of H9c2 cells, and flow cytometry with Annexin V-FITC/PI double staining was used to analyze the early apoptosis rate after the treatments. The concentration of ATP and level of reactive oxygen species (ROS) in the cells were detected using commercial kits. The mitochondrial membrane potential of the cells was detected with laser confocal microscopy. The expression of cytochrome C was detected with Western blotting, and the activity of caspase-3 was also assessed in the cells.
Results
Gastrodin pretreatment could prevent oxidative stress-induced reduction of mitochondrial membrane potential, and this effect was inhibited by the application of CsA. Gastrodin significantly lowered the levels of ROS and apoptosis-related factors in H2O2-exposed cells, and such effects were reversed by CsA. CsA significantly antagonized the protective effect of gastrodin against apoptosis in H2O2-exposed cells.
Conclusions
Gastrodin prevents oxidative stress-induced injury in H9c2 cells by inhibiting mPTP opening to reduce the cell apoptosis.
Keywords: oxidative stress injury, mitochondrial permeability transition pore, gastrodin, cyclosporin
氧化应激是引起心肌缺血再灌注损伤(MIRI)的重要机制之一,而线粒体损伤诱导的细胞凋亡又是心肌氧化应激损伤的主要诱因[1]。研究认为氧化应激可以诱发钙超载,活性氧(ROS)含量增加等现象,导致线粒体通透性转换孔(mPTP)的不可逆性开放[2-3],导致线粒体损伤,跨膜电位降低甚至消失[4],释放细胞色素C(Cyt C)和含半胱氨酸的天冬氨酸蛋白水解酶(Caspase-3)等一系列变化,进而启动细胞凋亡程序,引导细胞走向凋亡[5]。目前mPTP的具体组成虽尚不完全明确,但有研究认为mPTP主要由腺苷酸转运蛋白(ANT),电压依赖性阴离子通道(VDAC),亲环素D(Cyp D)三部分组合而成,并且有研究认为Cyp D是其重要的功能基团[6]。另有研究表明高剂量的免疫抑制剂环孢菌素A(CsA)[7]可以特异性与Cyp D结合,进而抑制Cyp D功能,导致mPTP的不可逆开放[8]。
天麻素为中药天麻的提取物,在大鼠MIRI以及细胞缺氧复氧过程中发挥一定的保护作用[9-10]。研究发现天麻素在氧化应激损伤模型中可以通过PI3K/Akt途径使mPTP的上游因子GSK-3β失活[11-13],认为天麻素可能是通过上调GSK-3β(Ser9)的磷酸化水平,从而抑制mPTP的开放,来发挥保护作用[10]。然而已有研究中只证实了PI3K/Akt信号通路在其调节过程中发挥了一定作用,且在该过程中观察到了mPTP的开放,却并未能直接证明天麻素是通过抑制mPTP开放来发挥的保护作用,因此本研究通过加入高剂量的CsA,特异性的作用于mPTP,使其发生不可逆开放,通过观察天麻素与线粒体膜电位变化间的关系,以及天麻素与线粒体相关凋亡通路中各因子间的关系,进而阐明天麻素的保护作用与mPTP开闭的直接关联性,并进一步研究相关作用是否与线粒体mPTP开放诱发的凋亡有关,以期为MIRI的研究提供新思路。
1. 材料和方法
1.1. 材料与试剂
实验材料:H9c2心肌细胞来自美国模式培养物集存库。
实验试剂:天麻素(纯度>99%)(百威灵),环孢菌素A(Santa Cruz Biotechnology),过氧化氢(Sigma),Cyt C抗体(Cell Signaling),Jc-1荧光探针、β-actin抗体、Caspase-3活性检测试剂盒、ROS检测试剂盒(Beyotime Biotechnology),Annexin V-FITC/PI凋亡试剂盒(LiankeBio),大鼠三磷酸腺苷(ATP)检测试剂盒(mlbio)。
1.2. 仪器与设备
激光扫描共聚焦荧光显微镜(FV1000)(Olympus),流式细胞分析仪(FACS Calibur)(BD),MX荧光读板机(Bio Tek)。
1.3. 方法
1.3.1. 实验分组及处理方法
本研究共有6个分组,分别为:①control组:H9c2细胞,完全培养基(DMEM培养基含10%胎牛血清和1%的青链霉素混合液),不予特殊处理;②H2O2组:650 μmol/L的H2O(2溶于完全培养基后作用于细胞)作用20 min后更换完全培养基[10];③天麻素+H2O2组:10 μmol/L的天麻素(溶于完全培养基后作用于细胞)预处理20 min后,换为650 μmol/L的H2O2处理20 min,之后更换完全培养基;④天麻素组:天麻素(10 μmol/L)处理20 min后更换完全培养基;⑤CsA组:10 μg/mL的CsA溶于二甲基亚砜(DMSO)后再溶于完全培养基至终浓度,处理4 h后更换完全培养基[14];⑥CsA+天麻素+H2O2组:CsA(10 μg/mL)处理4 h后,再用天麻素(10 μmol/L)处理20 min,最后过氧化氢(650 μmol/L)处理20 min,之后更换完全培养基。
1.3.2. 细胞相对存活率检测
选择生长状态良好的H9c2心肌细胞,传代至96孔板,每孔加入200 μL大约104个细胞的细胞悬液,生长至覆盖孔底70%左右后进行各分组处理,处理后弃去培养基并用磷酸盐缓冲液冲洗,之后每孔加入含MTT(500 μg/mL)的空白DMEM培养基200 μL,继续培养4 h后弃去培养基,每孔加入200 μL的二甲基亚砜,继续孵育至镜下无蓝紫色结晶物,测量570 nm处的光密度值。计算细胞的相对存活率=(各组光密度值/对照组光密度值)×100%。
1.3.3. 细胞早期凋亡率检测
H9c2心肌细胞贴壁面积达75%左右时按照各分组处理,并按照说明书进行检测,收集细胞,分析计算早期凋亡比例。
1.3.4. ATP含量检测
H9c2心肌细胞贴壁面积达80%左右时按照各组要求处理,按照说明书破碎细胞,提取样本,检测吸光度并制备标准曲线计算相应的浓度。
1.3.5. 检测ROS含量
H9c2心肌细胞先装载DCFHDA探针后按照各组要求处理,并按照说明书检测各组荧光强度。
1.3.6. 检测线粒体膜电位
H9c2心肌细胞重悬之后传入共聚焦小皿,待贴壁的H9c2心肌细胞长满小皿的50%时按照各组要求处理,之后弃去原培养基,PBS冲洗两次之后,加入含有Jc-1探针的空白培养基(1 μg/mL),培养箱内孵育15 min后,调节激发光波长为488 nm和543 nm,置于40倍物镜下观察成像,计算线粒体相对膜电位,线粒体相对膜电位=高电位时Jc-1聚合物的红色荧光强度/低电位时Jc-1单体的绿色荧光强度。
1.3.7. 检测Cyt C的表达情况
各组加药处理完成后用预冷的磷酸盐缓冲液冲洗,并用滤纸吸干残余液体,加入适量体积的裂解液与PMSF的混合液(100:1),置于4 ℃冰箱0.5 h后,收集蛋白,超声波破碎数秒,12000 r/min高速离心15 min后取上清液,BCA法定量后加入合适浓度及体积的加样缓冲液,调节蛋白浓度为2.5 μg/μL,之后高温100 ℃变性5 min。待冷却至室温后加样,进行恒压电泳并转膜,之后用8%的脱脂牛奶封闭90 min,按照1:1000稀释Cyt C和β-actin抗体,4 ℃孵育10 h后取出,Tris-HCl缓冲盐溶液(pH7.4)洗脱非特异性结合,循环3次,每次5 min,之后室温孵育二抗2 h,再次用Tris-HCl缓冲盐溶液洗脱3次,每次5 min,最后用Genshare超敏化学发光底物检测试剂盒进行显色,AI600化学发光成像仪采集图片,最终用Image J进行灰度扫描及定量分析。
1.3.8. Caspase-3活性检测
按说明书提取蛋白,Bradford法进行定量,并加入裂解液调节各组蛋白浓度为2 mg/mL后根据说明书进行检测,并计算相应的酶活力单位。
1.4. 统计学分析
实验数据分析采用SPSS 22.0软件。各个数据以均数±标准差的形式表示,各组之间采用one-way ANOVA进行比较,两组之间的比较采用LSD-t检验,P < 0.05为差异有统计学意义。
2. 结果
2.1. mPTP的开放对细胞相对存活率的影响
计算各组相对存活率,经方差分析后,差异有统计学意义(F=22.87,P < 0.001)。H2O2组(0.60±0.05)细胞相对存活率低于对照组,差异有统计学意义(P < 0.001);天麻素+H2O2组(0.81±0.11)其相对存活率显著高于H2O2组,差异有统计学意义(P < 0.001);而CsA+天麻素+ H2O2组(0.67±0.08)细胞相对存活率与天麻素+H2O2组相比显著下降,两组差异有统计学意义(P=0.011,图 1)。
1.
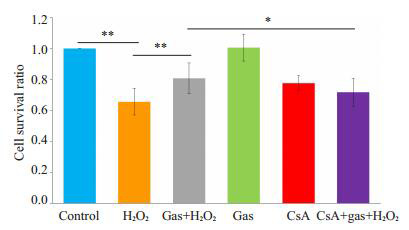
细胞相对存活率
Cell survival ratio in different groups (*P < 0.05; **P < 0.001 vs control) (n=6). Gas: Gastrodin.
2.2. mPTP的开放对细胞早期凋亡率的影响
流式细胞仪检测得到细胞早期凋亡率(图 2A),凋亡结果进行方差分析,结果显示差异有统计学意义(F= 16.25,P < 0.001)。其中control组凋亡率为(2.07 ± 0.07)%,H2O2组为(6.45±1.11)%,与对照组相比,H2O2组早期凋亡率升高,差异有统计学意义(P < 0.001);而天麻素+H2O2组早期凋亡率为(1.97±0.82)%,低于H2O2组,差异有统计学意义(P < 0.001);CsA+天麻素+H2O2组早期凋亡率为(5.77±0.75)%,高于天麻素+H2O2组,差异有统计学意义(P < 0.001,图 2B)。
2.
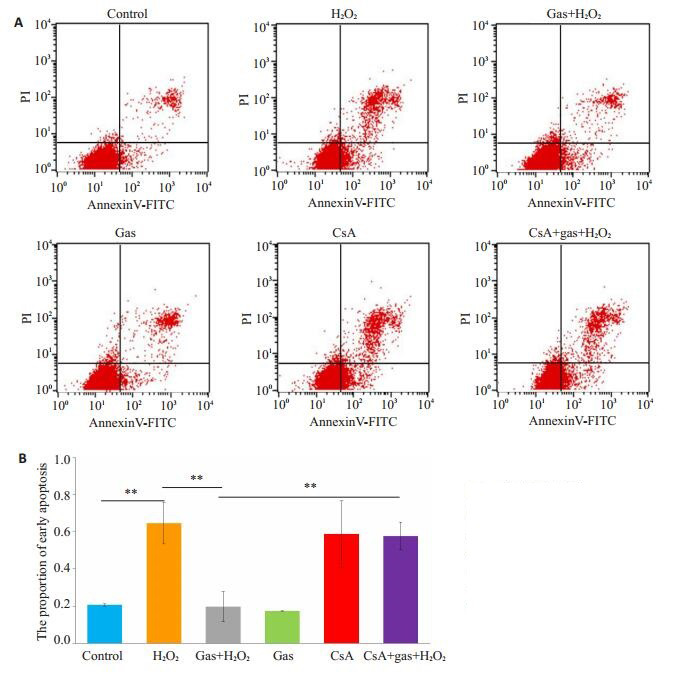
细胞早期凋亡
Early apoptosis rate in the cells with different treatments. A: Scatter diagram of early apoptosis; B: Comparison of the early apoptosis rates (n=3, **P < 0.001 vs control).
2.3. mPTP的开放对细胞产能的影响
用大鼠三磷酸腺苷试剂盒(ELISA)进行检测,进而绘制标准曲线并计算各组的ATP含量,经方差分析,差异有统计学意义(F=88.33,P < 0.001)。CsA+天麻素+ H2O2组ATP含量低天麻素+H2O2组ATP含量4869±146 nmol/L vs 6195±190 nmol/L(P < 0.001,图 3)。
3.
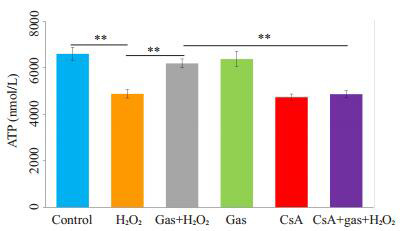
细胞内ATP含量
Comparison of ATP concentration in the cells with different treatments (**P < 0.001 vs control, n=6).
2.4. mPTP的开放对胞内ROS含量的影响
经试剂盒检测后,ROS的相对含量以DCF的荧光强度表示,经过方差分析后,差异有统计学意义(F= 34.72,P < 0.001)。CsA+天麻素+H2O2组DCF荧光强度高于天麻素+H2O2组的荧光强度(5900±304 vs 4144± 344,P < 0.001,图 4)。
4.
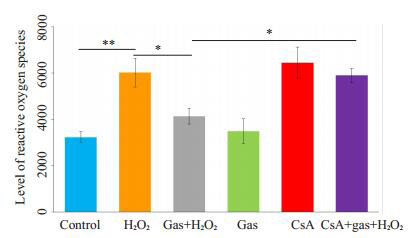
ROS相对含量
Comparison of the level of reactive oxygen species in the cells with different treatments (*P < 0.05; **P < 0.001 vs control, n=4).
2.5. mPTP开放对线粒体相对膜电位的影响
细胞导入Jc-1荧光探针后用激光扫描共聚焦显微镜观察各组荧光(图 5A),各组线粒体相对膜电位的比值经过方差分析后,其结果显示差异具有统计学意义(F=36.56,P < 0.001)。其中control(0 min)组与control(20 min)荧光强度比值分别为5.56 ± 0.22 vs 4.96 ± 0.10,两者相比无统计学差异(P=0.151);CsA+天麻素+ H2O2组的Jc-1荧光比值低于天麻素+H2O2组1.98±0.18 vs 3.08±0.14,P=0.014,图 5B)。
5.
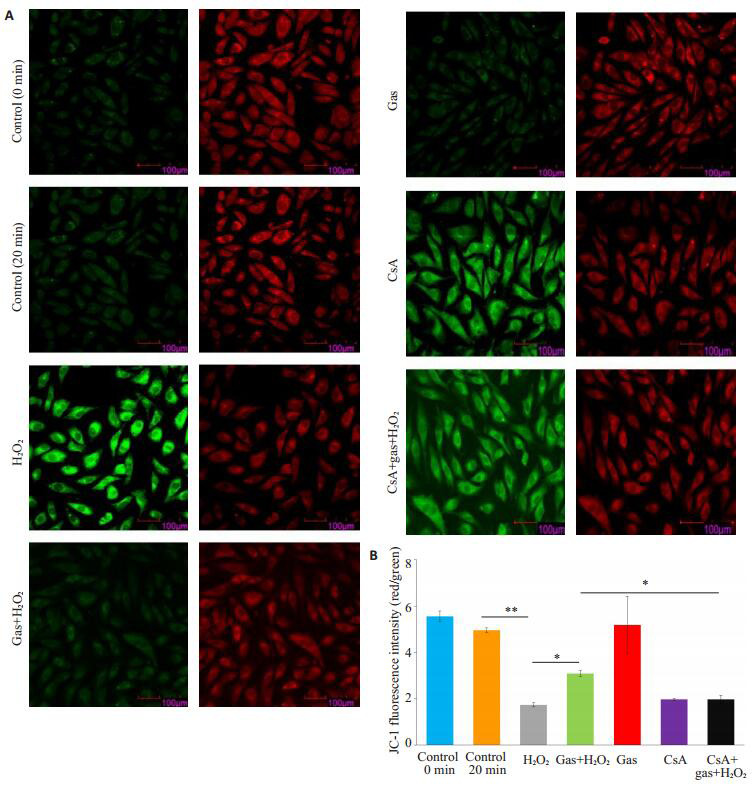
激光扫描共聚焦显微镜观察线粒体膜电位
Mitochondrial membrane potential in the cells with different treatments detected by laser confocal microscopy. A: Mitochondrial membrane potential; B: JC-1 fluorescence intensity (red/green) (*P < 0.05; **P < 0.001 vs control)(n=3).
2.6. mPTP的开放对Cyt C释放的影响
Western blot法检测Cyt C的表达(图 6A),结果经过分析后,差异有统计学意义(F=7.19,P=0.003)。以control组表达为标准,CsA+天麻素+H2O2组的表达(1.61±0.08)高于天麻素+H2O2组的表达(1.15±0.40),差异有统计学意义(P=0.016,图 6B)。
6.
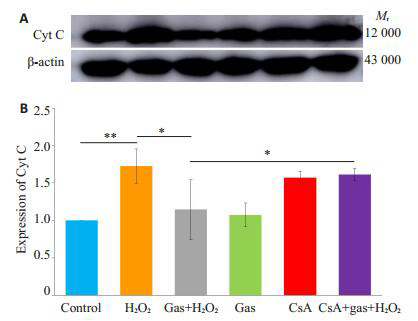
Western blotting法检测蛋白含量
Western blotting for protein expressions in the cells with different treatments. A: Expression of Cyt C; B: Relative expression of Cyt C (n=3)(*P < 0.05; **P < 0.001 vs control).
2.7. mPTP的开放对caspase-3活性的影响
经过caspase-3活性检测试剂盒检测,并计算相应的酶活力单位,经过分析各组差异有统计学意义(F= 15.77,P < 0.001)。CsA+天麻素+H2O2组caspase-3的活性(18.51 ± 5.11)高于天麻素+ H2O2组的活性(4.69 ± 1.53),差异有统计学意义(P < 0.001,图 7)。
7.
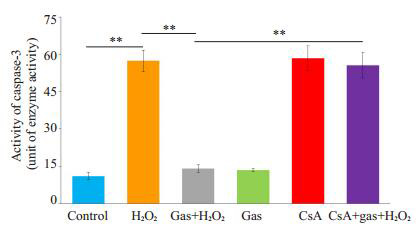
Caspase-3的活性(酶活力单位)
Activity of caspase-3 (unit of enzyme activity) in the cells (*P < 0.05; **P < 0.001 vs control)(n=3).
3. 讨论
氧化应激损伤是引起MIRI的重要因素[15],本研究中通过加入650 μmol/L的H2O2处理20 min来模拟细胞的氧化应激损伤,结果显示,细胞发生氧化应激时,胞内ROS含量显著增加[16-17],而天麻素预处理可以有效的降低胞内活性氧含量,减轻氧化应激损伤,而加入CsA特异性作用于mPTP后,天麻素的保护作用消失。
mPTP作为线粒体膜上的重要通道,在发生MIRI时发挥着重要的调控作用[18],CsA可以与mPTP中的重要成分Cyp D特异性结合,破坏其功能,导致mPTP不可逆开放[19-22],而mPTP作为线粒体膜上的通透性孔道,在维持线粒体膜电位方面发挥着重要作用,因此CsA作用后会直接导致膜电位下降[23-24],本研究应用Jc-1染色观察线粒体相对膜电位[25],发现氧化应激损伤可以导致线粒体膜电位显著下降,天麻素可以有效的抑制心肌细胞发生氧化应激时线粒体膜电位的下降,即有效的抑制了mPTP的开放,维持线粒体功能的相对稳定,而CsA与mPTP中的Cyp D作用之后可以发现线粒体相对膜电位下降,天麻素抑制mPTP开放的作用消失,因此我们认为天麻素确实是通过调控mPTP的开放来发挥心肌保护作用的。
线粒体的相对膜电位对维持细胞氧化磷酸化具有重要作用,一定的电位差是细胞氧化磷酸化的必要条件[26-27],在检测细胞中腺嘌呤核苷三磷酸(ATP)后发现,氧化应激损伤引起的膜电位降低,直接导致了胞内ATP含量的减少,而天麻素可以有效缓解细胞能量不足的情况,但是该作用可以被CsA特异性阻断。
线粒体同时在细胞凋亡途径中发挥着重要的功能,线粒体通透性改变会直接导致一些凋亡因子的释放和激活,例如当线粒体释放Cyt C到胞浆中后,在三磷酸脱氧腺苷存在条件下与凋亡因子1发生聚合形成凋亡小体,并激活caspase-9,通过级联反应继续激活下游因子caspase-3,其可以作用于胞内多种重要的结构和功能蛋白[28],最终导致细胞发生凋亡[1, 29],通过Western blot检测细胞内Cyt C的含量和caspase-3活性试剂盒检测caspase-3的活性发现,发生氧化应激时mPTP的不可逆性开放会增加线粒体膜的通透性,使线粒体内Cyt C等原本不能透过细胞膜的因子发生释放而使凋亡途径激活[30],并通过一系列级联反应激活caspase-3,作用于靶蛋白引起细胞凋亡,而天麻素可以通过抑制mPTP的开放而在一定程度上减少Cyt C的释放和caspase-3的激活,抑制凋亡的进程,发挥一定的抗凋亡作用,但是这种抗凋亡的作用可以被mPTP的开放剂所抵消,最后通过检测细胞的早期凋亡率以及存活率也都表明了,天麻素可以在一定程度上抑制mPTP的开放,保护线粒体功能,抑制凋亡途径的激活来发挥对心肌保护作用。
综上,在心肌氧化应激损伤模型中,天麻素通过激活mPTP上游的相关调节因子,作用于mPTP并抑制其开放,减轻线粒体膜电位的下降程度,缓解细胞能量供应的不足,减少凋亡因子Cyt C的释放以及caspase-3的激活,在一定程度上阻断凋亡的进程,减轻线粒体的损伤,进而对心肌细胞、心脏乃至机体发挥一定的抗氧化应激损伤保护作用。
Biography
韩学超,本科,E-mail:XuechaoHan001@163.com
Funding Statement
国家自然科学基金(81700324);河北省自然科学基金(H2018209378);河北省高等学校青年拔尖人才计划(BJ2018055);唐山市科技创新团队培养计划(15130212C); 华北理工大学2017年大学生创新创业训练计划(X2017353)
Supported by National Natural Science Foundation of China (81700324)
Contributor Information
韩 学超 (Xuechao HAN), Email: XuechaoHan001@163.com.
田 炜 (Wei TIAN), Email: twhzm@aliyun.com.
References
- 1.Dou C, Han M, Zhang B, et al. Chrysotoxene induces apoptosis of human hepatoblastoma HepG2 cells in vitro and in vivo via activation of the mitochondria-mediated apoptotic signaling pathway. Oncol Lett. 2018;15(4):4611–8. doi: 10.3892/ol.2018.7857. [Dou C, Han M, Zhang B, et al. Chrysotoxene induces apoptosis of human hepatoblastoma HepG2 cells in vitro and in vivo via activation of the mitochondria-mediated apoptotic signaling pathway [J]. Oncol Lett, 2018, 15(4): 4611-8.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.穆颍颍.甲基乙二醛诱导EA.hy926细胞线粒体膜通透性转换孔开放的机制[D].杨凌: 西北农林科技大学, 2016.http://cdmd.cnki.com.cn/Article/CDMD-10712-1016175277.htm
- 3.谢 宇曦, 王 红阳, 程 爱斌. 猴头菇提取物通过抑制线粒体膜通透性转移孔的开放对酒精性肝损害的保护作用. http://d.old.wanfangdata.com.cn/Periodical/zgmtgyyxzz201610018. 中国煤炭工业医学杂志. 2016;19(10):1469–71. [谢宇曦, 王红阳, 程爱斌.猴头菇提取物通过抑制线粒体膜通透性转移孔的开放对酒精性肝损害的保护作用[J].中国煤炭工业医学杂志, 2016, 19(10): 1469-71.] [Google Scholar]
- 4.Liu LF, Qian ZH, Qin Q, et al. Effect of melatonin on oncosis of myocardial cells in the myocardial ischemia/reperfusion injury rat and the role of the mitochondrial permeability transition pore. Genet Mol Res. 2015;14(3):7481–9. doi: 10.4238/2015.July.3.24. [Liu LF, Qian ZH, Qin Q, et al. Effect of melatonin on oncosis of myocardial cells in the myocardial ischemia/reperfusion injury rat and the role of the mitochondrial permeability transition pore[J]. Genet Mol Res, 2015, 14(3): 7481-9.] [DOI] [PubMed] [Google Scholar]
- 5.王 兆麒, 林 多茂, 薛 艳艳, et al. 线粒体膜通透性转换孔与心肌缺血-再灌注损伤的研究进展. http://d.old.wanfangdata.com.cn/Periodical/lcmzxzz201511026. 临床麻醉学杂志. 2015;31(11):1134–6. [王兆麒, 林多茂, 薛艳艳, 等.线粒体膜通透性转换孔与心肌缺血-再灌注损伤的研究进展[J].临床麻醉学杂志, 2015, 31(11): 1134-6.] [Google Scholar]
- 6.郭 姝, 彭 军. 亲环素D及其介导的调节性细胞坏死. 基础医学与临床. 2017;37(11):1625–8. doi: 10.3969/j.issn.1001-6325.2017.11.026. [郭姝, 彭军.亲环素D及其介导的调节性细胞坏死[J].基础医学与临床, 2017, 37(11): 1625-8.] [DOI] [Google Scholar]
- 7.王 维, 蔡 银燕, 陈 耀. 环孢菌素A的作用机制及临床应用. 海峡药学. 2007;(10):103–5. doi: 10.3969/j.issn.1006-3765.2007.10.057. [王维, 蔡银燕, 陈耀.环孢菌素A的作用机制及临床应用[J].海峡药学, 2007(10): 103-5.] [DOI] [Google Scholar]
- 8.Yarana C, Sripetchwandee J, Sanit J, et al. Calcium-induced cardiac mitochondrial dysfunction is predominantly mediated by cyclosporine A-dependent mitochondrial permeability transition pore. Arch Med Res. 2012;43(5):333–8. doi: 10.1016/j.arcmed.2012.06.010. [Yarana C, Sripetchwandee J, Sanit J, et al. Calcium-induced cardiac mitochondrial dysfunction is predominantly mediated by cyclosporine A-dependent mitochondrial permeability transition pore[J]. Arch Med Res, 2012, 43(5): 333-8.] [DOI] [PubMed] [Google Scholar]
- 9.位 凯, 王 飞, 张 瑾, et al. 天麻素预处理减轻大鼠心肌缺血再灌注损伤的可能机制. http://d.old.wanfangdata.com.cn/Periodical/ahykdxxb201406013. 安徽医科大学学报. 2014;49(6):756–8, 841. [位凯, 王飞, 张瑾, 等.天麻素预处理减轻大鼠心肌缺血再灌注损伤的可能机制[J].安徽医科大学学报, 2014, 49(6): 756-8, 841.] [Google Scholar]
- 10.郝 帅林, 张 媛, 魏 艳杰, et al. 天麻素抗心肌氧化应激损伤的作用机制研究. 中国现代医学杂志. 2017;27(9):1–7. doi: 10.3969/j.issn.1005-8982.2017.09.001. [郝帅林, 张媛, 魏艳杰, 等.天麻素抗心肌氧化应激损伤的作用机制研究[J].中国现代医学杂志, 2017, 27(9): 1-7.] [DOI] [Google Scholar]
- 11.马 金安, 刘 晓明, 邓 晋锋, et al. 栀子苷预处理对大鼠心肌缺血再灌注后PI3K/Akt信号通路的研究. 临床和实验医学杂志. 2018;17(20):2152–5. doi: 10.3969/j.issn.1671-4695.2018.20.007. [马金安, 刘晓明, 邓晋锋, 等.栀子苷预处理对大鼠心肌缺血再灌注后PI3K/Akt信号通路的研究[J].临床和实验医学杂志, 2018, 17(20): 2152-5.] [DOI] [Google Scholar]
- 12.Hausenloy DJ, Tsang A, Mocanu MM, et al. Ischemic preconditioning protects by activating prosurvival kinases at reperfusion. Am J Physiol Heart Circ Physiol. 2005;288(2):H971–6. doi: 10.1152/ajpheart.00374.2004. [Hausenloy DJ, Tsang A, Mocanu MM, et al. Ischemic preconditioning protects by activating prosurvival kinases at reperfusion [J]. Am J Physiol Heart Circ Physiol, 2005, 288(2): H971-6.] [DOI] [PubMed] [Google Scholar]
- 13.Efthymiou CA, Mocanu MM, Yellon DM. Atorvastatin and myocardial reperfusion injury: newpleiotmpic effect implicating multiple prosurvival sinaling. J cardiovasc Pharmac. 2005;45(3):247–52. doi: 10.1097/01.fjc.0000154376.82445.06. [Efthymiou CA, Mocanu MM, Yellon DM. Atorvastatin and myocardial reperfusion injury: newpleiotmpic effect implicating multiple prosurvival sinaling [J]. J cardiovasc Pharmac, 2005, 45(3): 247-52.] [DOI] [PubMed] [Google Scholar]
- 14.韩 磊. 环孢霉素A诱导H9c2类心肌细胞损伤与钙敏感受体的关系. http://d.old.wanfangdata.com.cn/Periodical/hebykdxxb201505005. 哈尔滨医科大学学报. 2015;49(5):397–400. [韩磊.环孢霉素A诱导H9c2类心肌细胞损伤与钙敏感受体的关系[J].哈尔滨医科大学学报, 2015, 49(5): 397-400.] [Google Scholar]
- 15.He Y, Li C, Ma Q, et al. Esculetin inhibits oxidative stress and apoptosis in H9c2 cardiomyocytes following hypoxia/reoxygenationinjury. Biochem Biophys Res Commun. 2018;501(1):139–44. doi: 10.1016/j.bbrc.2018.04.195. [He Y, Li C, Ma Q, et al. Esculetin inhibits oxidative stress and apoptosis in H9c2 cardiomyocytes following hypoxia/reoxygenationinjury [ J].Biochem Biophys Res Commun, 2018, 501(1):139-44.] [DOI] [PubMed] [Google Scholar]
- 16.张 雪岩, 彭 瑞云, 赵 黎, et al. 黄芪总苷, 赤芍总苷及丹参总酮对微波辐射后H9c2心肌细胞保护作用研究. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=ZTSX201802008&dbname=CJFD&dbcode=CJFQ. 中国体视学与图像分析. 2018;23(2):181–8. [张雪岩, 彭瑞云, 赵黎, 等.黄芪总苷, 赤芍总苷及丹参总酮对微波辐射后H9c2心肌细胞保护作用研究[J].中国体视学与图像分析, 2018, 23(2): 181-8.] [Google Scholar]
- 17.张普. Apelin-13通过抑制R0S介导的DNA损伤和调控MAPKs/Akt通路缓解顺铂诱导的心肌毒性[D].济南: 山东大学, 2018.
- 18.Ong SB, Samangouei P, Kalkhoran SB, et al. The mitochondrial permeability transition pore and its role in myocardial ischemia reperfusion injury. J Mol Cell Cardiol. 2015;78:23–34. doi: 10.1016/j.yjmcc.2014.11.005. [Ong SB, Samangouei P, Kalkhoran SB, et al. The mitochondrial permeability transition pore and its role in myocardial ischemia reperfusion injury [J]. J Mol Cell Cardiol, 2015, 78: 23-34.] [DOI] [PubMed] [Google Scholar]
- 19.李 向阳, 张 力, 卢 翔. 吉西他滨诱导的结肠癌细胞凋亡与MST1、CypD线粒体复合物的关系. http://d.old.wanfangdata.com.cn/Periodical/wcbxhgbxzz201507007. 胃肠病学和肝病学杂志. 2015;24(7):790–4. [李向阳, 张力, 卢翔.吉西他滨诱导的结肠癌细胞凋亡与MST1、CypD线粒体复合物的关系[J].胃肠病学和肝病学杂志, 2015, 24 (7): 790-4.] [Google Scholar]
- 20.Baines CP, Kaiser RA, Purcell NH, et al. Loss of cyclophilin D reveals a critical role for mitochondrial permeability transition in cell death. http://d.old.wanfangdata.com.cn/NSTLQK/10.1038-nature03434/ Nature. 2005;434(733):658–62. doi: 10.1038/nature03434. [Baines CP, Kaiser RA, Purcell NH, et al. Loss of cyclophilin D reveals a critical role for mitochondrial permeability transition in cell death [J]. Nature, 2005, 434(733): 658-62.] [DOI] [PubMed] [Google Scholar]
- 21.de Arriba G, Calvino M, Benito S, et al. Cyclosporine a-induced apoptosis in renal tubular cells is related to oxidative damage and mitochondrial fission. Toxicol Lett. 2013;218(1):30–8. doi: 10.1016/j.toxlet.2013.01.007. [de Arriba G, Calvino M, Benito S, et al. Cyclosporine a-induced apoptosis in renal tubular cells is related to oxidative damage and mitochondrial fission [J]. Toxicol Lett, 2013, 218(1): 30-8.] [DOI] [PubMed] [Google Scholar]
- 22.Li D, Li J, Li H, et al. Antioxidant properties of repaglinide and its protections against cyclosporine A-induced renal tubular injury. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=Doaj000004671509. Iran J Basic Med Sci. 2016;19(7):749–54. [Li D, Li J, Li H, et al. Antioxidant properties of repaglinide and its protections against cyclosporine A-induced renal tubular injury[J]. Iran J Basic Med Sci, 2016, 19(7): 749-54.] [PMC free article] [PubMed] [Google Scholar]
- 23.Grimm S, Brdiczka D. The permeability transition pore in cell death. Apoptosis. 2007;12(5):841–55. doi: 10.1007/s10495-007-0747-3. [Grimm S, Brdiczka D. The permeability transition pore in cell death [J]. Apoptosis, 2007, 12(5): 841-55.] [DOI] [PubMed] [Google Scholar]
- 24.安 志远, 丁 文一. 鲍曼不动杆菌Omp34经线粒体途径诱导HeLa细胞凋亡. http://www.cnki.com.cn/Article/CJFDTOTAL-SWJS201804004.htm. 生物技术. 2018;28(4):323–28. [安志远, 丁文一.鲍曼不动杆菌Omp34经线粒体途径诱导HeLa细胞凋亡[J].生物技术, 2018, 28(4): 323-28.] [Google Scholar]
- 25.Kim B, Takeuchi A, Koga O, et al. Mitochondria Na(+)-Ca (2 +) exchange in cardiomyocytes and lymphocytes. http://www.springerlink.com/content/fulltext.pdf?id=doi:10.1007/978-1-4614-4756-6_16. Adv Exp Med Biol. 2013;961(3):193–201. doi: 10.1007/978-1-4614-4756-6_16. [Kim B, Takeuchi A, Koga O, et al. Mitochondria Na(+)-Ca (2 +) exchange in cardiomyocytes and lymphocytes[J]. Adv Exp Med Biol, 2013, 961(3): 193-201.] [DOI] [PubMed] [Google Scholar]
- 26.Giorgio V, Bisetto E, Soriano ME, et al. Cyclophilin D modulates mitochondrial F0F1-ATP synthase by interacting with the lateral stalk of the complex. J Biol Chem. 2009;284(49):33982–8. doi: 10.1074/jbc.M109.020115. [Giorgio V, Bisetto E, Soriano ME, et al. Cyclophilin D modulates mitochondrial F0F1-ATP synthase by interacting with the lateral stalk of the complex [J]. J Biol Chem, 2009, 284(49): 33982-8.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.许 爱军, 陈 明兵. 小鼠心肌缺血再灌注早期线粒体氧化磷酸化功能变化. 实用医学杂志. 2015;31(17):2796–8. doi: 10.3969/j.issn.1006-5725.2015.17.010. [许爱军, 陈明兵.小鼠心肌缺血再灌注早期线粒体氧化磷酸化功能变化[J].实用医学杂志, 2015, 31(17): 2796-8.] [DOI] [Google Scholar]
- 28.Zamaraev AV, Kopeina GS, Prokhorova EA, et al. Post-translational modification of caspases: the other side of apoptosis regulation. Trends Cell Biol. 2017;27(5):322–39. doi: 10.1016/j.tcb.2017.01.003. [Zamaraev AV, Kopeina GS, Prokhorova EA, et al. Post-translational modification of caspases: the other side of apoptosis regulation[J]. Trends Cell Biol, 2017, 27(5): 322-39.] [DOI] [PubMed] [Google Scholar]
- 29.Tsujimoto Y, Nakagawa T, Shimizu S. Mitochondrial membrane permeability transition and cell death. http://d.old.wanfangdata.com.cn/Periodical/zwxb200604009. Biochim Biophys Acta. 2006;1757(9/10):1297–300. doi: 10.1016/j.bbabio.2006.03.017. [Tsujimoto Y, Nakagawa T, Shimizu S. Mitochondrial membrane permeability transition and cell death[J]. Biochim Biophys Acta, 2006, 1757(9/10): 1297-300.] [DOI] [PubMed] [Google Scholar]
- 30.任 会荣, 钱 令嘉. 线粒体通透性转换孔、细胞色素C与细胞凋亡. 生命的化学. 2002;22(4):316–8. doi: 10.3969/j.issn.1000-1336.2002.04.006. [任会荣, 钱令嘉.线粒体通透性转换孔、细胞色素C与细胞凋亡[J].生命的化学, 2002, 22(4): 316-8.] [DOI] [Google Scholar]


