Abstract
目的
研究半枝莲总黄酮(HF)对延缓秀丽隐杆线虫和人脐静脉内皮细胞(HUVECs)衰老的影响,并探讨可能的作用机制。
方法
将不同浓度的HF(30、50 mg/L)分别放于NGM和DMEM培养基中,研究对线虫的寿命、生殖能力、氧化应激、抗氧化酶活力、相关基因表达以及对HUVECs的抗氧化酶活力和相关基因表达的影响。
结果
HF能显著延长线虫的平均寿命和最大寿命,对其生殖能力没有损害,子代数目无统计学差异,35 ℃急性热应激下的平均生存时间显著延长;同时,HF均能提高秀丽线虫和人HUVECs中超氧化物歧化酶、过氧化氢酶的活性,并上调两种细胞中抗衰老基因daf-16、sir-2.1的表达。
结论
HF可能通过提高抗氧化酶活力和抗氧化基因的表达水平,能够延缓线虫衰老及急性热应激下的应激能力同时不损害生殖能力,并保护内皮细胞免受损伤。
Keywords: 半枝莲总黄酮, 秀丽隐杆线虫, 人脐静脉内皮细胞, 抗氧化酶, 衰老
Abstract
Objective
To explore the effects of Herba Scutellariae Barbatae flavonoids (HF) in delaying aging of Caenorhabditis elegans and human umbilical vein endothelial cells (HUVECs) in vitro.
Methods
The effects of 30 or 50 mg/L of HF on nematode life span, reproductive capacity, oxidative stress, and antioxidant enzyme activity of C. elegans were assessed, and the effects of HF on the expressions of the genes encoding antioxidant enzymes and the aging-related genes were analyzed using real-time RT-PCR in both C. elegans and cultured HUVECs.
Results
Compared with the blank control group, C. elegans with HF treatment showed significantly improved mean and maximum lifespan with a prolonged mean lifespan under acute heat stress at 35 ℃. HF treatment did not impair the reproductive capacity or cause significant changes in the offspring number of C. elegans. In addition, HF enhanced SOD and CAT activity and up-regulated the expression of daf-16 and sir-2.1 (SIRT1) genes in C. elegans and HUVECs.
Conclusions
HF may delay aging of C. elegans and enhance their resistance to acute heat stress without damaging their reproductive capacity possibly by up-regulating the activity of antioxidant enzymes and expressions of antioxidant genes. HF also may protect endothelial cells against oxidative damage.
Keywords: Herba Scutellariae Barbatae flavonoids, Caenorhabditis elegans, human umbilical vein endothelial cells, antioxidant enzymes, aging
中药半枝莲(Herba Scutellariae Barbatae)为唇形科(Labiatae)植物半枝莲(Scutellaria barbatae D. Don)的干燥全草。半枝莲性味辛、苦、寒,归肺、肝、肾经,是中医处方和成药中的常用中药,具有清热解毒、化瘀利尿的功效[1]。近代药理学研究表明半枝莲的药理作用广泛,主要表现在抗肿瘤、抗病毒和抗氧化衰老等方面。其中半枝莲的黄酮类(HF)化合物对氧自由基的清除作用的研究表明其具有较强的抗氧化性和抗衰老性[2]。
20世纪以来,随着人类平均寿命的不断提高,老龄化问题日益突出,人力资源缺乏及庞大的老年人医疗费用将成为摆在各国政府面前的难题,衰老及抗衰老研究被认为是解决这一难题的有效途径。中药可从调控衰老基因、调节氧化应激水平、抑制Aβ1-42沉积等方面抗衰老及治疗衰老相关疾病[3]。氧化应激是导致细胞衰老的重要原因,活性氧在内皮细胞产生增多并积聚,会导致内皮细胞损伤或者功能失调[4]。中医药在抗衰老研究中形成了许多学说[5],有很多学者通过研究中药干预秀丽线虫[9, 16],为中医药抗衰老理论提供分子生物学依据。但是这些研究都是只局限于低等动物秀丽线虫上,没有更进一步在高等哺乳动物身上进行验证研究。秀丽隐杆线虫是抗衰老实验的重要实验动物,代表着低等动物,而人脐静脉内皮细胞(HUVECs)是高等哺乳动物人的内皮细胞,代表着高等动物,故本研究选取秀丽线虫和人脐静脉内皮细胞(HUVECs)作为研究对象,希望从低等动物到高等哺乳动物的身上都能够验证HF通过调节相关基因的表达来调控机体的抗氧化能力,研究HF对两种来源的细胞SOD、CAT活性及抗衰老相关基因daf-16、sir-2.1(SIRT1)表达的影响,并初步探讨HF对两种来源的细胞衰老的影响及其作用机制。基于秀丽线虫和HUVECs研究工作可为以半枝莲黄酮为代表的中药抗衰老作用提供更广阔的应用前景。
1. 材料和方法
1.1. 材料
半枝莲(Herba Scutellariae Barbatae)购自广州致信中药饮片有限公司,经鉴定为唇形科(Labiatae)植物半枝莲(Scutellaria barbatae D. Don)的干燥全草。E. coli OP50、野生型秀丽隐杆线虫N2均由明尼苏达大学的秀丽隐杆线虫中心惠赠;5-氟尿嘧啶(5-Fu)、二甲基亚砜(DMSO)、琼脂粉、生理盐水等其他试剂均为国产;SOD、CAT试剂盒购自南京建成生物工程所;HUVECs购自上海中科院细胞库;胰蛋白酶(Invitrogen);牛血清白蛋白(BSA)、胎牛血清(FBS)和DMEM培养基均由美国Gibco公司提供;定量PCR试剂(AceQTMqPCR SYBR® Green Master Mix)购自Vazyme公司;Reverse Transcriptase M-MLV(RNase H-)购自TAKARA公司;RNase free EP管、RNase free吸头购自美国Thermo公司;八联管购自Axygen;实验用水为双蒸水;所用其它试剂均为分析纯。
1.2. 方法
1.2.1. HF的提取及测定
将半枝莲在60 ℃恒温烘干至质量恒定,粉碎,过50目(三号)筛。取半枝莲约50.0 g,精密称定,用滤纸包好。分置于索氏提取器中,用石油醚(60~90 ℃)水浴回流脱脂2次(2 h/次),弃去石油醚提取液。将半枝莲提取液用旋转蒸发仪浓缩、烘干,得到深褐色膏体。用丙酮、氯仿、乙醇等溶剂淋洗后,干燥、研磨后供进一步使用。
1.2.2. 线虫分组和培养
寿命测定实验中,动物分组为空白组,热量限制(CR)阳性对照组,HF高(50 mg/L)、低剂量组(30 mg/L);生殖能力测试中,动物分组为空白组、HF高剂量组;压力应激实验中,动物分组为空白组、HF高剂量组。在显微镜下挑取处于产卵期的单个雌雄同体的线虫转移到涂有E.coli OP50的线虫标准培养基(NGM)中,20 ℃下培养。
1.2.3. 寿命的测定
将雌雄同体成虫置于含或不含HF的NGM板中产卵0.5~1 h。受精卵48 h后发育为青年成虫,随机挑取60~70条转移到实验板中。从转移时刻起开始计算线虫存活天数,转移时刻当天为寿命实验的第0天(day 0)。隔天探视线虫,记录线虫生存、死亡及剔除出实验的条数。对线虫死亡判断标准:无移动及吞咽动作,轻触后仍无任何反应。剔除标准:逃离至平皿壁或盖上而干死;虫卵在体内孵化而成袋样虫;钻入琼脂培养板中。实验板中含10 mL NGM、12.5 mg 5-Fu及不同浓度HF。HF由DMSO助溶于ddH2O中,DMSO在实验中终浓度 < 1%。12.5 mg 5-Fu及低于1%浓度的DMSO不影响寿命实验。
1.2.4. 生殖能力的测定
参照Gruber J等[6]的方法,分为空白组和HF组,分别从寿命试验含或不含HF的NGM(孵育48 h后)中选取5条,单独将每条线虫转入NGM板,此时为生殖能力测试第1天。以后每24 h移至新的NGM板中让线虫产卵,直至线虫生殖能力消失。所有产卵板在20 ℃下孵化2 d后计数子代数目。线虫的生殖期一般为7 d,将每天所产子代数目相加便得到总子代数目。
1.2.5. 急性热应激实验
参照Kampkotter等[7]的方法,将同期化线虫培养到L4期,挑取一定数量的线虫到含或不含HF的NGM中,在20 ℃下培养。48 h后将两组NGM转移到35 ℃下继续培养,每隔1 h计数线虫存活、死亡、删失数目。
1.2.6. 人HUVECs细胞培养及药物处理
将HUVECs接种于25 cm2培养瓶中,培养液为含10%胎牛血清的高糖DMEM培养基中,至于37 ℃、5% CO2细胞孵育箱中培养,待细胞贴壁生长为单层时,用0.25%胰蛋白酶(含0.02% EDTA)消化细胞,每2~3 d更换1次培养液。待细胞单层长满,弃去上清液,用PBS洗涤两次,加入DMEM培养基,分为空白对照组(10%生理盐水和20%空白血清)、HF低(30 mg/L)、HF高(50 mg/L)剂量组,于37 ℃、5% CO2下培养24 h。
1.2.7. 抗氧化酶活力测定
将同期化2 d龄线虫在不同HF浓度的NGM培养基中培养5 d。把培养好的线虫和HUVECs细胞收集至EP管中,用生理盐水洗涤并加入9倍体积的生理盐水,冰水浴条件下,机械匀浆,制备成10%匀浆液,在离心机里3000 r/min离心10 min,用微量移液管吸取上清液,按照SOD、CAT试剂盒的操作要求检测SOD酶、CAT酶的活力及蛋白浓度,实验重复3次。
1.2.8. 基因表达水平的测定
将同期化的2 d线虫在不同HF浓度的NGM培养基中培养5 d,收集至EP管。生理盐水洗涤后放入-80 ℃冰箱备用。进行线虫RNA的提取,RNA纯度、完整度鉴定,合成cDNA,用Real-Time PCR方法监测线虫体内相关基因mRNA的表达水平。以gdp-1(看家基因)为内参,实验重复3次,表 1为mRNA表达水平测定用的PCR引物。
1.
秀丽线虫抗氧化基因real time PCR引物
Real-time PCR primers for antioxidant genes in Caenorhabditis elegans
| Gene | Login ID | Upstream primer 5'-3' | Downstream primer 5'-3' |
| Gpd-1 | NM-0638364_ | TCAAGGAGGAGCCAAGAAGG | CAGTGGTGCCAGACAGTTG |
| Daf-16 | NM-001264561.1 | TCAAGCCAATGCCACTACC | TGGAAGAGCCGATGAAGAAG |
| Sir-2.1 | NM-001268555.1 | ACTGAGATGCTCCATGACAATAAG | GCAAGACGAACCACACGAAC |
分组收集HUVECs细胞,加入1 mL Trizol提取总RNA,逆转录为cDNA,以GAPDH为内参,采用Applied Biosystems ViiA 7TM Real-Time PCR System检测各个基因的Ct值,所有反应均设3个复孔。根据Comparative Delta-delta Ct法△△Ct=(Ct基因-Ct内参基因)(-Ct基因-Ct内参基因)对照组,利用2-△△CT计算各个基因相对于对照组增加或减少的倍数。表 2为mRNA表达水平测定用的PCR引物。
2.
HUVECs抗氧化基因real time PCR引物
Real-time PCR primers for antioxidant genes in HUVECs cells
| Gene | Login ID | Upstream primers 5'-3' | Downstream primer 5'-3' |
| GAPDH | NM_001256799.2 | TCCACTGGCGTCTTCACCACCAT | GGAGGCATTGCTGATGATCTTGAGG |
| Daf-16 | NM_000574.4 | GCGGCGCGTCCTTGTTCTAA | CTTCCAAAGCTGGCTGGGCATT |
| SIRT1 | NM_012238.4 | GCTGGAACAGGTTGCGGGAATC | GGGCACCTAGGACATCGAGGAA |
1.2.9. 统计学方法
以上实验均重复3次,定量资料用均数±标准差表示,多组定量资料组间差异比较采用单因素方差分析。文中数据统计均由SPSS 20.0软件完成。P < 0.05为差异有统计学意义。
2. 结果
2.1. HF延长线虫的平均寿命和最大寿命
与空白组相比,HF低剂量组平均寿命延长(P < 0.05,图 1),HF高剂量组的平均寿命和最大寿命均显著延长(P < 0.05);与CR组比较,HF高剂量组平均寿命和最大寿命均显著延长(P < 0.05)。对线虫全程存活情况作生存曲线,如图 2所示,表明HF可使线虫的生存曲线右移,高剂量组更为明显,表明黄酮类化合物有抗衰老作用,提示半枝莲黄酮类药物具有独特的抗衰老潜力。
1.
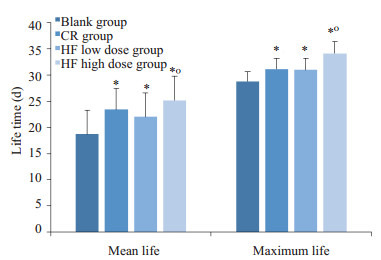
各组线虫寿命比较
Comparison of the lifespan of C. elegans with different treatments. The maximum lifespan is defined as the survival time of the last 10% C. elegans. *P < 0.05 vs blank control group; °P < 0.05 vs CR group.
2.
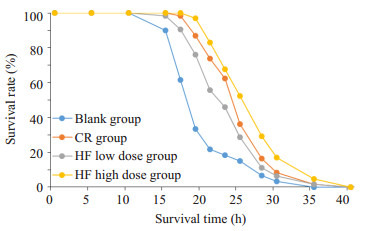
线虫生存曲线图
Survival curves of C.elegan in different groups.
2.2. HF不影响线虫的子代数目
空白组与HF高剂量组每天所产生的子代数目如下图所示,两组间差异无统计学意义(P > 0.05,图 3)。
3.
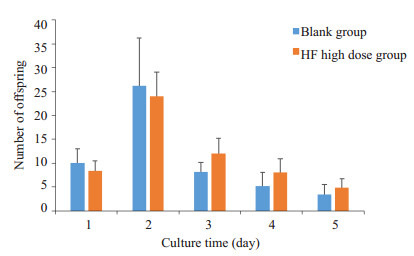
HF对线虫子代数目的影响
Effect of high-dose HF on offspring number of C. elegans.
2.3. HF延长线虫热应激下的平均生存时间
空白组与HF高剂量组的平均生存时间分别为6.00±1.86 h(n=23)和8.04±1.84 h(n=25),表明HF高剂量组能增强线虫的耐热能力,延长线虫在35 ℃时的平均生存时间(P < 0.01,图 4)。
4.
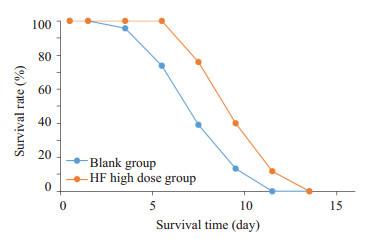
35 ℃下HF对线虫生存曲线的影响
Effect of high-dose HF on the survival rate of C. elegans.
2.4. HF促进线虫抗氧化酶活力
SOD、CAT是秀丽线虫机体内重要的抗氧化酶,分别清除线虫体内多余的超氧化物自由基和过氧化氢,有效地防止细胞结构损伤,它们的活性随着线虫的衰老而下降。测定它们的活性可反映线虫的衰老状况。HF处理线虫SOD和CAT酶活力均得到提高,且呈现剂量依赖关系。低剂量组使SOD和CAT酶活力分别提高了9.1%和22.3%,高剂量组使SOD和CAT酶活力分别提高了15.7%和39.3%(图 5)。
5.
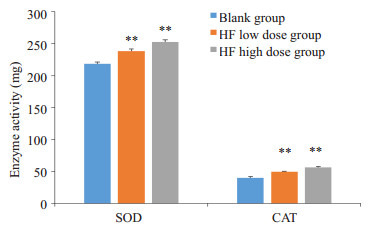
HF对线虫抗氧化酶活力的影响
Effect of HF on SOD and CAT activity in C. elegans. **P < 0.01 vs blank group.
2.5. HF上调线虫抗氧化基因的的表达
与空白组相比,HF饲喂后线虫体内的daf-16、sir-2.1基因表达量均有不同程度的提高,其中低剂量组的daf-16、sir-2.1基因表达水平分别提升了17%和49%,高剂量组的daf-16、sir-2.1基因表达水平分别提升了33%和90%(P < 0.05,图 6)。
6.
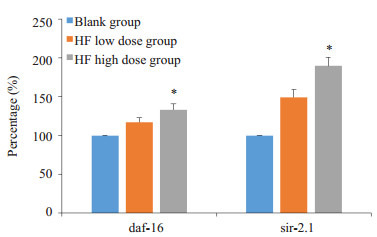
HF对线虫抗氧化基因的影响
Effect of HF on daf-16 and sir-2.1 expressions in C. elegans. *P < 0.05 vs blank group.
2.6. HF增加人HUVECs细胞抗氧化酶活力
SOD、CAT是人机体内重要的抗氧化酶,分别清除体内多余的超氧化物自由基和过氧化氢,有效地防止细胞结构损伤,它们的活性随着人的衰老而下降。测定它们的活性可反映人的衰老状况。如图 7所示,HF处理细胞后SOD和CAT酶活力均得到提高,且呈现剂量依赖关系。低剂量组使SOD和CAT酶活力分别提高了22.1%和119%,高剂量组使SOD和CAT酶活力分别提高了38.9%和299%。
7.
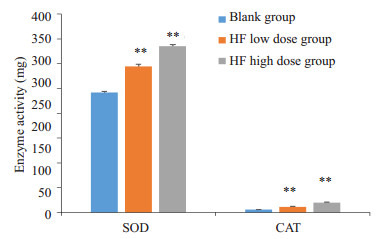
HF对HUVECs抗氧化酶活力的影响
Effect of HF on SOD and CAT activity in HUVECs cells. **P < 0.01 vs blank group.
2.7. HF上调人HUVECs细胞中抗氧化基因的表达
与空白组相比,HF作用于细胞后,其daf-16、SIRT1基因表达量均有不同程度的提高,其中低剂量组的daf-16、SIRT1基因表达水平分别提升了105%和61%,高剂量组的daf-16、SIRT1基因表达水平分别提升了241%和171%(P < 0.05,图 8)。
8.
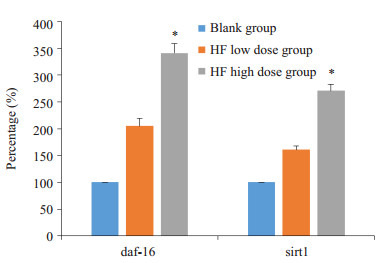
HF对HUVECs抗氧化基因的影响
Effect of HF on daf-16 and sir-2.1 mRNA expressions in HUVECs cells. *P < 0.05 vs blank group.
3. 讨论
衰老是随着时间推移功能逐渐丧失并伴随死亡率上升的过程,对于衰老及其相关的疾病的认识不仅是生物医学的难题,更是对于社会、经济等有深远影响。中医药抗衰老有明确疗效,其中半枝莲黄酮类化合物可以调控衰老基因、调节氧化应激水平,用于抗衰老及治疗衰老相关疾病[8]。有关衰老的假说和理论众多,其中自由基学说是目前公认的衰老学说之一[9]。在正常情况下,生物体处于氧化与抗氧化的动态平衡状态,从而保护机体免受损伤。随着年龄或者外界有害刺激,机体内活性氧自由基的数量会显著增多,造成脂质过氧化反应,引起机体内包括蛋白、核酸等的氧化伤害,对细胞功能和活性造成伤害,可以说衰老是自由基损伤性效应的综合结果[10]。所以寻找一种机制减少自由基对于抗衰老的研究尤为重要。衰老是心脑血管疾病发生的危险因素,内皮细胞的衰老引起的内皮细胞功能减退是心脑血管疾病随年龄增加的主要因素之一,例如高血压和冠心病。氧化应激是导致细胞衰老的重要原因,活性氧在内皮细胞产生增多并积聚,会导致内皮细胞损伤或者功能失调[11]。故本研究选取秀丽线虫和人脐静脉内皮细胞(HUVECs)作为研究对象,希望从低等动物到高等哺乳动物的身上都能够验证HF通过调节相关基因的表达来调控机体的抗氧化能力,从而延长寿命。
SOD和CAT作为线虫体内两类主要的抗氧化酶,分别清除线虫体内多余的超氧化物和过氧化氢,其酶活力的升高标志着线虫抗氧化能力的增强[13]。daf-16基因是编码转录调控因子中叉头(forkhoad)家族成员,能通过细胞自主性或非自主性的方式调节下游基因的表达,激活胰岛素/胰岛素样生长因子信号通路调控,从而影响衰老,其表达量的上调可以延长线虫寿命,并且诱导线虫产生休眠体以应对环境[14-15]。Zhang [16]曾研究发现齐墩果酸通过激活daf-16而引起线虫寿命的延长。sir-2.1是一个经典的长寿基因,能通过乙酰化直接激活Daf-16/FOXO通路[17],Berdichevsky团队研究表明[18],线虫体内过表达sir-2.1可增强对热刺激和氧化应激的抵抗,敲除sir-2.1的突变体对应激反应敏感。此外,过表达sir-2.1可增加daf-16靶基因sod-3的转录。实验结果表明,饲喂HF的线虫平均寿命和最大寿命与对照组相比明显延长,且随着HF浓度的增加效果越明显,延长寿命的同时并不损害生殖能力,并提高线虫在热应激下的平均生存时间,线虫体内SOD、CAT活力明显升高,线虫体内抗氧化相关基因daf-16、sir-2.1mRNA的表达水平显著上调,这与Zhang和Berdichevsky的研究结论相同。表明HF能通过胰岛素/胰岛素样生长因子信号通路调控相关抗氧化基因的表达,增加相关抗氧化酶的活力,增强对氧化应激的抵抗能力,使得线虫寿命得到延长。
SOD、CAT作为人体内的抗氧化酶活性物,能减少由于氧化应激而造成的糖尿病、损伤胰岛素细胞和动脉粥样硬化等疾病带来的危害,延缓人体衰老[19-20]。SIRTUINS家族与线虫的sir-2.1基因是同源基因,该蛋白家族是依赖NAD+的去乙酰化酶,在调节基因表达、细胞老化等过程中发挥重要作用[21-22]。哺乳动物中有7个成员(SIRT1-7),其中SIRT1可促进细胞存活,提示有可能有延长细胞寿命的作用[23]。研究表明,在氧化应激条件下SIRT1结合叉头蛋白类转录因子FOXO3将其去乙酰化,能增强细胞的抗氧化能力并减弱由FOXO3诱导的凋亡作用,从而促进细胞在氧化应激条件下的存活[24-25]。实验结果表明HF作用于HUVECs后,细胞的SOD、CAT活力明显升高,daf-16、SIRT1mRNA的表达水平显著上调,且呈现浓度依赖性,这与之前的研究结果一致。表明HF能通过调节相关抗氧化基因的表达,增强相关抗氧化酶的活力,提高人体细胞的抗氧化能力,减少内皮细胞衰老导致的功能障碍,预防和延缓心血管疾病患病的几率,从而延长寿命。
综上所述,本研究以秀丽线虫和人脐静脉内皮细胞为对象,评价了半枝莲总黄酮延缓线虫衰老的作用,结果表明半枝莲总黄酮能够显著提高线虫的平均寿命和最大寿命,并且其延缓衰老的作用不损害生殖能力。延缓线虫衰老的作用机理之一可能是线虫压力应激能力的提高。饲喂一定剂量的HF后,线虫和HUVECs可通过上调抗氧化基因mRNA表达水平,从而增加相关抗氧化酶的活力,有效减少体内活性氧自由基的含量,提高清除体内自由基的能力,增强对氧化应激的抵抗能力,有效延缓衰老,此研究在低等和高等动物身上都得到了验证,并在酶活性和基因水平上初步探讨其作用机制,为以后开发半枝莲总黄酮等天然抗衰老药物提供了科学依据。
Biography
周溦,硕士,E-mail: zhouwei-327@hotmail.com
Funding Statement
广东省自然科学基金(10151051501000029)
Contributor Information
周 溦 (Wei ZHOU), Email: zhouwei-327@hotmail.com.
林 敬明 (Jingming LIN), Email: linjm1231@163.com.
References
- 1.国家药典委员会. 中华人民共和国药典2010年版(一部)[S]. 北京: 中国医药科技出版社, 2010: 109-10.
- 2.石贤枝. 白花蛇舌草和半枝莲原药材及组分配伍对其抗氧化活性影响的研究[D]. 南昌: 南昌大学, 2010.
- 3.Wang Z, Yu J, Wu J, et al. Scutellarin protects cardiomyocyte ischemia-reperfusion injury by reducing apoptosis and oxidative stress. Life Sci. 2016;157:200–7. doi: 10.1016/j.lfs.2016.01.018. [Wang Z, Yu J, Wu J, et al. Scutellarin protects cardiomyocyte ischemia-reperfusion injury by reducing apoptosis and oxidative stress[J]. Life Sci, 2016, 157: 200-7.] [DOI] [PubMed] [Google Scholar]
- 4.寇 亮, 李 璐, 陆 丽娜, et al. 响应面法优化柠条锦鸡儿总黄酮超声提取工艺及其体外抗氧化性研究. http://www.cnki.com.cn/Article/CJFDTOTAL-SPKJ201617044.htm. 食品工业科技. 2016;37(17):225–31. [寇亮, 李璐, 陆丽娜, 等.响应面法优化柠条锦鸡儿总黄酮超声提取工艺及其体外抗氧化性研究[J].食品工业科技, 2016, 37(17): 225-31.] [Google Scholar]
- 5.Tao G, Balunas MJ. Current therapeutic role and medicinal potential of Scutellaria barbata in Traditional Chinese Medicine and Western research. J Ethnopharmacol. 2016;182:170–80. doi: 10.1016/j.jep.2016.02.012. [Tao G, Balunas MJ. Current therapeutic role and medicinal potential of Scutellaria barbata in Traditional Chinese Medicine and Western research[J]. J Ethnopharmacol, 2016, 182: 170-80.] [DOI] [PubMed] [Google Scholar]
- 6.Gruber J, Tang SY, Halliwell B. Evidence for a trade-off between survival and fitness caused by resveratrol treatment of Caenorhabditis elegans. Ann N Y Acad Sci. 2007;1100(1):530–42. doi: 10.1196/annals.1395.059. [Gruber J, Tang SY, Halliwell B. Evidence for a trade-off between survival and fitness caused by resveratrol treatment of Caenorhabditis elegans[J]. Ann N Y Acad Sci, 2007, 1100(1): 530-42.] [DOI] [PubMed] [Google Scholar]
- 7.Kampkötter A, Timpel C, Zurawski RF, et al. Increase of stress resistance and lifespan of Caenorhabditis elegans by quercetin. Comp Biochem Physiol B Biochem Mol Biol. 2008;149(2):314–23. doi: 10.1016/j.cbpb.2007.10.004. [Kampkötter A, Timpel C, Zurawski RF, et al. Increase of stress resistance and lifespan of Caenorhabditis elegans by quercetin[J]. Comp Biochem Physiol B Biochem Mol Biol, 2008, 149(2): 314-23.] [DOI] [PubMed] [Google Scholar]
- 8.董 欢欢, 曹 树稳, 余 燕影. 半枝莲、白花蛇舌草及其药对提取物抗氧化及清除自由基活性. http://cdmd.cnki.com.cn/Article/CDMD-11902-2009242216.htm. 天然产物研究与开发. 2008;20(5):782–6, 802. [董欢欢, 曹树稳, 余燕影.半枝莲、白花蛇舌草及其药对提取物抗氧化及清除自由基活性[J].天然产物研究与开发, 2008, 20(5): 782-6, 802.] [Google Scholar]
- 9.顾 闻, 陈 川. 基于秀丽隐杆线虫的中医药抗衰老研究. http://www.cnki.com.cn/Article/CJFDTOTAL-SHZD201405030.htm. 上海中医药大学学报. 2014;28(5):96–8. [顾闻, 陈川.基于秀丽隐杆线虫的中医药抗衰老研究[J].上海中医药大学学报, 2014, 28(5): 96-8.] [Google Scholar]
- 10.Donato AJ, Walker AE, Magerko KA, et al. Life-long caloric restriction reduces oxidative stress and preserves nitric oxide bioavailability and function in arteries of old mice. Aging Cell. 2013;12(5):772–83. doi: 10.1111/acel.2013.12.issue-5. [Donato AJ, Walker AE, Magerko KA, et al. Life-long caloric restriction reduces oxidative stress and preserves nitric oxide bioavailability and function in arteries of old mice[J]. Aging Cell, 2013, 12(5): 772-83.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Stress DO, aging, Adv Exp Med Biol 2003, et al. Inhibitory effects of Scutellaria barbata on human uterine leiomyomal smooth muscle cell proliferation through cell cycle analysis. Int Immunopharmacol. 2004;4(3):447–54. doi: 10.1016/j.intimp.2003.12.012. [Stress DO, aging, Adv Exp Med Biol 2003, et al. Inhibitory effects of Scutellaria barbata on human uterine leiomyomal smooth muscle cell proliferation through cell cycle analysis[J]. Int Immunopharmacol, 2004, 4(3): 447-54.] [DOI] [PubMed] [Google Scholar]
- 12.De A, Ghosh C. Basics of aging theories and disease related aging-an overview. http://journals.sagepub.com/doi/abs/10.1177/1559827608326125. Pharma Tutor. 2017;5(2):16–23. [De A, Ghosh C. Basics of aging theories and disease related aging-an overview[J]. Pharma Tutor, 2017, 5(2): 16-23.] [Google Scholar]
- 13.Terman A, Gustafsson B, Brunk UT. The lysosomal-mitochondrial axis theory of postmitotic aging and cell death. http://www.sciencedirect.com/science/article/pii/S0009279706000962. Chem Biol Interact. 2006;163(1/2):29–37. doi: 10.1016/j.cbi.2006.04.013. [Terman A, Gustafsson B, Brunk UT. The lysosomal-mitochondrial axis theory of postmitotic aging and cell death[J]. Chem Biol Interact, 2006, 163(1/2): 29-37.] [DOI] [PubMed] [Google Scholar]
- 14.Yoon AP, Daane SP, Toth BA, et al. Anti-Aging: An Overview. International Textbook of Aesthetic Surgery: Springer Berlin Heidelberg; 2016. pp. 1229–37. [Yoon AP, Daane SP, Toth BA, et al. Anti-Aging: An Overview[M]. International Textbook of Aesthetic Surgery: Springer Berlin Heidelberg, 2016, 1229-37.] [Google Scholar]
- 15.Cosentino F, Francia P, Camici GG, et al. Final common molecular pathways of aging and cardiovascular disease: role of the p66Shc protein. Arterioscler Thromb Vasc Biol. 2008;28(4):622–8. doi: 10.1161/ATVBAHA.107.156059. [Cosentino F, Francia P, Camici GG, et al. Final common molecular pathways of aging and cardiovascular disease: role of the p66Shc protein[J]. Arterioscler Thromb Vasc Biol, 2008, 28(4): 622-8.] [DOI] [PubMed] [Google Scholar]
- 16.Zhang J, Lu L, Zhou L. Oleanolic acid activates daf-16 to increase lifespan in Caenorhabditis elegans. Biochem Biophys Res Commun. 2015;468(4):843–9. doi: 10.1016/j.bbrc.2015.11.042. [Zhang J, Lu L, Zhou L. Oleanolic acid activates daf-16 to increase lifespan in Caenorhabditis elegans[J]. Biochem Biophys Res Commun, 2015, 468(4): 843-9.] [DOI] [PubMed] [Google Scholar]
- 17.王 轶菲, 陈 纯, 王 红, et al. 山楂提取物延缓秀丽隐杆线虫衰老作用的研究. http://www.cnki.com.cn/Article/CJFDTOTAL-YYXX201604029.htm. 营养学报. 2016;38(04):391–6. [王轶菲, 陈纯, 王红, 等.山楂提取物延缓秀丽隐杆线虫衰老作用的研究[J].营养学报, 2016, 38(04): 391-6.] [Google Scholar]
- 18.Berdichevsky A, Viswanathan M, Horvitz HR, et al. C. elegans SIR-2.1 interacts with 14-3-3 proteins to activate DAF-16 and extend Life span. Cell. 2006;125(6):1165–77. doi: 10.1016/j.cell.2006.04.036. [Berdichevsky A, Viswanathan M, Horvitz HR, et al. C. elegans SIR-2.1 interacts with 14-3-3 proteins to activate DAF-16 and extend Life span[J]. Cell, 2006, 125(6): 1165-77.] [DOI] [PubMed] [Google Scholar]
- 19.Santos-López JA, Garcimartín A, López-Oliva ME, et al. Chia Oil-Enriched restructured pork effects on oxidative and inflammatory status of aged rats fed high cholesterol/high fat diets. J Med Food. 2017 doi: 10.1089/jmf.2016.0161. [Santos-López JA, Garcimartín A, López-Oliva ME, et al. Chia Oil-Enriched restructured pork effects on oxidative and inflammatory status of aged rats fed high cholesterol/high fat diets [J]. J Med Food, 2017, [Epub ahead of print].] [DOI] [PubMed] [Google Scholar]
- 20.Lafargue A, Degorre C, Corre I, et al. Ionizing radiation induces long-term senescence in endothelial cells through mitochondrial respiratory complex Ⅱ dysfunction and superoxide Generation. http://www.sciencedirect.com/science/article/pii/S0891584917302228. Free Radic Biol Med. 2017 doi: 10.1016/j.freeradbiomed.2017.04.019. [Lafargue A, Degorre C, Corre I, et al. Ionizing radiation induces long-term senescence in endothelial cells through mitochondrial respiratory complex Ⅱ dysfunction and superoxide Generation[J]. Free Radic Biol Med, 2017, [Epub ahead of print].] [DOI] [PubMed] [Google Scholar]
- 21.Ribeiro TP, Fonseca FL, De Carvalho MD, et al. Metal-based superoxide dismutase and catalase mimics reduce oxidative stress biomarkers and extend Life span of Saccharomyces cerevisiae. Biochem J. 2017;474(2):301–15. doi: 10.1042/BCJ20160480. [Ribeiro TP, Fonseca FL, De Carvalho MD, et al. Metal-based superoxide dismutase and catalase mimics reduce oxidative stress biomarkers and extend Life span of Saccharomyces cerevisiae[J]. Biochem J, 2017, 474(2): 301-15.] [DOI] [PubMed] [Google Scholar]
- 22.Dai DF, Chiao YA, Martin GM, et al. Mitochondrial-Targeted catalase: extended longevity and the roles in various disease models. Prog Mol Biol Transl Sci. 2017;146:203–41. doi: 10.1016/bs.pmbts.2016.12.015. [Dai DF, Chiao YA, Martin GM, et al. Mitochondrial-Targeted catalase: extended longevity and the roles in various disease models [J]. Prog Mol Biol Transl Sci, 2017, 146: 203-41.] [DOI] [PubMed] [Google Scholar]
- 23.Cueno ME, Imai K, Tamura M, et al. Butyric acid-induced rat jugular blood cytosolic oxidative stress is associated with SIRT1 decrease. Cell Stress Chaperones. 2014;19(2):295–8. doi: 10.1007/s12192-013-0462-7. [Cueno ME, Imai K, Tamura M, et al. Butyric acid-induced rat jugular blood cytosolic oxidative stress is associated with SIRT1 decrease[J]. Cell Stress Chaperones, 2014, 19(2): 295-8.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Wang Y, Liang Y, Vanhoutte PM. SIRT1 and AMPK in regulating mammalian senescence: a critical review and a working model. FEBS Lett. 2011;585(7):986–94. doi: 10.1016/j.febslet.2010.11.047. [Wang Y, Liang Y, Vanhoutte PM. SIRT1 and AMPK in regulating mammalian senescence: a critical review and a working model[J]. FEBS Lett, 2011, 585(7): 986-94.] [DOI] [PubMed] [Google Scholar]
- 25.王 硕, 吴 迪, 刘 磊, et al. 丹参素通过SIRT1-SOD信号通路延缓大鼠主动脉内皮细胞老化. http://www.cnki.com.cn/Article/CJFDTOTAL-SLXU201405009.htm. 生理学报. 2014;66(5):575–82. [王硕, 吴迪, 刘磊, 等.丹参素通过SIRT1-SOD信号通路延缓大鼠主动脉内皮细胞老化[J].生理学报, 2014, 66(5): 575-82.] [PubMed] [Google Scholar]


