Abstract
目的
探讨双层人工皮对猪急性皮肤缺损创面的治疗效果及可能的作用机制。
方法
于6只藏猪背部正中线两侧分别由前向后切取3个5 cm×5 cm全层皮肤缺损创面。右侧3个创面为实验组,左侧3个创面为对照组。实验组创面移植Lando®双层人工皮肤,对照组创面应用凡士林纱布。两组创面均于伤后2周移植自体刃厚皮(实验组移植前揭下硅胶膜)。观察伤后3 d、2、10周的创面大体情况及创面收缩率。于各时相点切取创面中央组织标本,采用免疫组化法检测α-平滑肌肌动蛋白(α-SMA)、转化生长因子β1(TGF-β1)的表达水平,用RT-PCR法检测基质金属蛋白酶-1(MMP-1)及其组织抑制物(TIMP-1)mRNA的表达水平。
结果
两组伤后3 d各检测指标结果比较差异无统计学意义。实验组伤后2周肉芽组织鲜红、平整,创缘规则;伤后10周皮片收缩不明显。对照组伤后2周肉芽组织较为表浅,创缘不规则;伤后10周皮片收缩明显。伤后2周、10周实验组创面收缩率分别为(30.5±3.4)%、(39.2±2.8)%,均显著低于对照组[(51.8±2.6)%,t=-29.840,P=0.000;(60.7±2.2)%,t=-50.213,P=0.000]。伤后2周实验组组织α-SMA、TGF-β1 AOD(average optical density)值均显著高于对照组(t=15.921,P=0.000;t=29.995,P=0.000),伤后10周实验组组织α-SMA、TGF-β1 AOD值均显著低于对照组(t=-41.823,P=0.000;t=-99.777,P=0.000)。伤后2周实验组组织MMP-1 mRNA的表达低于对照组(t=-45.412,P=0.000),伤后10周则显著高于对照组(t=78.769,P=0.000)。伤后2、10周实验组组织TIMP-1 mRNA的表达均低于对照组(t=-27.064,P=0.000;t=-40.535,P=0.000)。
结论
创面应用Lando®真皮支架能够促进创面肉芽组织生长,可能与TGF-β1表达增强、MMP-1表达减弱有关;支架能够减轻创面收缩和愈合后的瘢痕增生及其挛缩,与创面愈合后α-SMA、TGF-β1、TIMP-1表达减弱及MMP-1表达增强有关。
Keywords: 人工皮肤, 皮肤移植, 创面愈合
Abstract
Objective
To investigate the efficacy of Lando® dermal scaffold for promoting repair of acute full-thickness skin defects in pigs and explore the possible mechanism.
Methods
Three 5 cm×5 cm full-thickness skin defects were created on the left dorsal skin (control group) and another 3 on the right dorsal skin (treatment group) of each of 6 Tibetan pigs. The wounds in the treatment group were covered with a bilayer artificial skin (Lando) and the control wounds with vaseline gauze. In both groups, autogenous split-thickness skin were grafted to the wounds 2 weeks later (with the silicone rubber membrane removed before grafting in the treatment group). At 3 days and 2 and 10 weeks after the injury, the wounds were assessed for general condition and contraction, and tissue samples were collected from the wounds to examine the expressions of α-smooth muscle actin (α-SMA) and transforming growth factor-β1 (TGF-β1) using immunohistochemistry and the expressions of MMP-1 and TIMP-1 mRNA using RT-PCR.
Results
At 3 days after the injury, the wounds in the 2 groups showed no significant differences in the results of any examinations. At 2 weeks after the injury, the wounds in the treatment group showed rich and more smooth granulation tissues with more regular wound edges compared with the control wounds. At 2 and 10 weeks after the injury, the wound contraction rates in the treatment group were (30.5±3.4)% and (39.2±2.8)%, respectively, significantly lower than the rates of (51.8±2.6)% (t=-29.840, P=0.000) and (60.7±2.2)% (t=-50.213, P=0.000) in the control group. At 2 weeks, the wound tissues in the treatment group expressed significantly higher levels of α-SMA (t=15.921, P=0.000) and TGF-β1 (t=29.995, P=0.000) than the control wounds, but at 10 weeks, the expressions of α-SMA (t=-41.823, P=0.000) and TGF-β1 (t=-99.777, P= 0.000) in the treatment group were significantly lower than those in the control group. Compared with those in the control group, the expression of MMP-1 mRNA in the treatment group was significantly lower at 2 weeks (t=-45.412, P=0.000) but significantly higher at 10 weeks (t=78.769, P=0.000), and the expression of TIMP-1 mRNA in the treatment group was significantly lower both at 2 weeks (t=-27.064, P=0.000) and at 10 weeks (t=-40.535, P=0.000).
Conclusions
Lando® dermal scaffold can promote granulation tissue growth possibly in relation with increased TGF-β1 and decreased MMP-1 expression in the wounds. This scaffold material also reduces wound contraction and lessens scar hyperplasia and contracture after wound healing, probably as a result of decreased α-SMA, TGF-β1, and TIMP-1 and increased MMP-1 expressions.
Keywords: artificial skin, skin graft, wound healing
各种急、慢性致伤因素,如机械损伤、烧伤、体表肿瘤切除、慢性溃疡等导致的皮肤组织缺损在临床上十分常见[1-2],皮肤移植常是治疗的关键。由于大面积烧伤患者自体皮源不足、同种异体皮来源有限等原因,人们一直在寻找理想的皮肤替代物。鉴于具有表皮和真皮的组织工程皮肤尚不理想,真皮在皮肤移植中起重要作用,真皮替代物(如Integra®人工皮肤)仍存在较大的临床需求,其临床应用范围亦在扩大,临床疗效满意[3-5]。
Lando®双层人工皮是运用组织工程技术新近开发的真皮支架材料,已获得中国国家发明专利,具有良好的生物相容性[6],其力学强度(拉伸强度、撕裂强度)高于Integra,更方便手术操作(如缝合固定等);其孔隙率与Integra相近,水蒸气透过率较Integra更接近正常人体皮肤,因此该产品在某些材料性能上较Integra具有一定的优越性。前期研究显示其移植于急性全层皮肤缺损创面可获得良好的血管化[7],本研究旨在进一步观察其二期植皮的局部外观及对创面α-平滑肌肌动蛋白(α-SMA)、转化生长因子β1(TGF-β1)及基质金属蛋白酶-1(MMP-1)、金属蛋白酶组织抑制剂-1(TIMP-1)mRNA表达的影响,以便为其今后的临床应用提供坚实的实验基础。
1. 材料和方法
1.1. 实验动物及模型制作
6只一级藏猪,雄雌不限,体质量30~35 kg,购自南方医科大学动物中心。术前12 h禁食,4 h禁水,称质量,将动物俯卧位固定于手术台上,采用3%戊巴比妥钠1 mL/kg腹腔注射、速眠新Ⅱ 0.1 mL/kg肌注联合麻醉。常规消毒、铺巾后,于每只猪背部正中线两侧分别由前向后切取3个5 cm×5 cm全层皮肤缺损创面,创面间距5 cm以上。右侧3个创面为实验组,左侧3个创面为对照组。创面彻底止血后,用每l00 mL含240 mg庆大霉素的0.9%氯化钠注射液反复冲洗。
1.2. 创面处理及标本留取
实验组创面移植预先用0.9%氯化钠注射液浸泡10 min后的Lando®双层人工皮肤(硅胶膜面朝上),与创缘皮肤间断缝合固定,无菌纱布打包包扎。对照组创面则以凡士林纱布作对照。两组创面均于伤后2周移植自体刃厚皮(实验组移植前揭下硅胶膜)。
分别于伤后3 d、2周(自体植皮术前)和10周(自体植皮术后8周)随机抽取2只动物,每组各6个创面。在创面中间切取5 mm×5 mm大小深至肌层的组织块(伤后第3天、2周实验组揭下硅胶膜留取标本)。
1.3. 观测指标
1.3.1. 大体观察
伤后3 d、2周、10周创面大体情况及创面收缩率,创面收缩率=(25-实测创面面积)÷ 25 × 100%。
1.3.2. 免疫组化观察组织α-SMA、TGF-β1的表达
组织标本常规固定、石蜡包埋、切片后,用免疫组化法分别检测组织α-SMA、TGF-β1的表达。兔抗猪α-SMA、TGF-β1抗体购自武汉博士德生物工程有限公司,HRP标记山羊抗兔鼠通用二抗购自DAKO公司,按试剂盒说明书进行实验操作。阴性对照采用磷酸缓冲盐溶液代替一抗。光镜下观察着棕色者为阳性染色。对每张切片随机选取5个完整而不重叠的阳性染色视野照像,采用Image Pro Plus 6.0软件计算积分光密度,求其均值作为该切片的AOD(average optical density)值。
1.3.3. RT-PCR测定MMP-1、TIMP-1 mRNA的表达
采用德国BM试剂公司的Tripure RNA提取试剂盒提取总RNA,美国Promega公司的RT-PCR试剂盒扩增MMP-1、TIMP-1,以β-actin为内参照。引物设计分别为:MMP-1,上游:ACA GAT CCT TTG GCT TCC CT,下游:AAC TTT GTT GCC AAT CCC AG;TIMP-1,上游:GCA ACT CCG ACC TTG TCA TC,下游:AGC GTA GGT CTT GGT GAA GC;β-actin,上游:GGA CTT CGA GCA GGA GAT GG,下游:GCA CCG TGT TGG CGT AGA GG。引物由上海生工生物工程有限公司合成。取PCR产物行2%琼脂糖凝胶电泳,采用MULITIMAGE凝胶图像分析仪进行吸光度扫描,计算目的mRNA与β-actin mRNA的吸光度比值。
1.4. 统计分析
采用SPSS 13.0进行分析,数据以均数±标准差表示,组间比较采用配对样本t检验,组内各时相点多重比较采用方差分析,P < 0.05为差异具有统计学意义。
2. 结果
2.1. 创面大体观察
两组创面伤后3 d均未见明显肉芽组织。实验组伤后2周可见整个真皮支架已被鲜红色肉芽组织填满,表面平整,创缘规则;伤后10周皮片收缩不明显。对照组伤后2周肉芽组织较为表浅,创缘不规则;伤后10周皮片收缩明显(图 1)。
1.
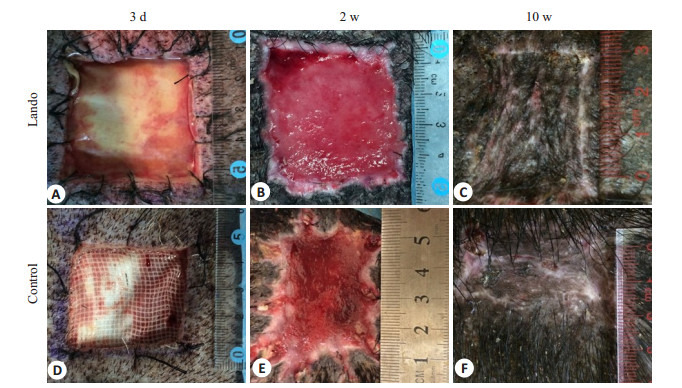
两组伤后不同时相点创面照片
Gross observation of the wounds in both groups at each time point after injury.
两组伤后3 d创面收缩率比较差异无统计学意义(t=-1.052,P=0.341),伤后2周、10周实验组创面收缩率明显低于对照组(t=-29.840,P=0.000;t=-50.213,P= 0.000),见表 1。
1.
伤后不同时相点两组创面收缩率
Wound contraction rates at different time points after injury in the two groups (n=6, %)
| Group | 3 d | 2 weeks | 10 weeks |
| *P=0.000 vs control. | |||
| Experimental | 22.5±1.9 | 30.5±3.4* | 39.2±2.8* |
| Control | 23.3±1.9 | 51.8±2.6 | 60.7±2.2 |
2.2. 组织α-SMA的表达
不同时相点两组组织α-SMA免疫组化染色照片见图 2。伤后3 d两组组织α-SMA AOD值比较差异无统计学意义(t=1.704,P=0.149),伤后2周实验组组织α-SMA AOD值显著高于对照组(t=15.921,P=0.000),伤后10周则显著低于对照组(t=-41.823,P=0.000)。实验组组织α-SMAAOD值伤后2周最高,伤后10周有所下降,稍高于伤后3 d,两者比较差异无统计学意义(P= 0.176),两者与伤后2周比较差异均有统计学意义(F= 210.665,P=0.000)。对照组组织α-SMA AOD值伤后2周最高,伤后10周有所下降,但仍高于伤后3 d,组内各时相点比较差异均有统计学意义(F=108.236,P=0.000,表 2)。
2.
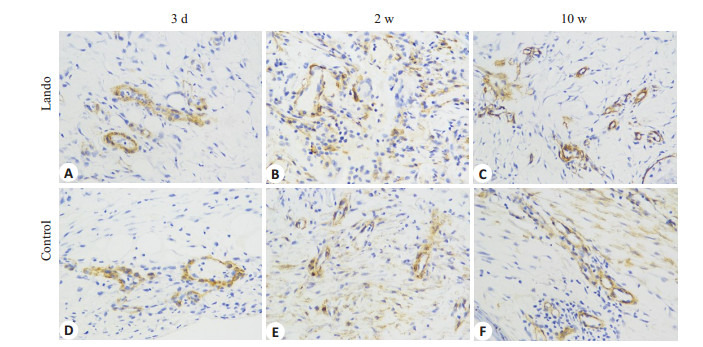
两组伤后不同时相点创面α-SMA的表达(×400)
The expression of α-SMA of the wound tissue in both groups at each time point after injury (×400). (a, d) 3 days, (b, e) 2 weeks and (c, f) 10 weeks after injury.
2.
伤后不同时相点两组组织α-SMA的表达
Expression of α-SMA in the wound tissue at different time points after injury in the two groups (n=6)
| Group | 3 d | 2 weeks | 10 weeks |
| *P=0.000 vs control. | |||
| Experimental | 1545±81 | 6764±510* | 1947±674* |
| Control | 1529±69 | 5863±644 | 2927±629 |
2.3. 组织TGF-β1的表达
不同时相点两组组织TGF-β1免疫组化染色照片见图 3。伤后3 d两组组织TGF-β1 AOD值比较差异无统计学意义(t=-0.806,P=0.457),伤后2周实验组组织TGF-β1 AOD值显著高于对照组(t=29.995,P=0.000),伤后10周则显著低于对照组(t=-99.777,P=0.000)。实验组组织TGF-β1 AOD值伤后2周最高,伤后10周有所下降,但仍高于伤后3 d,组内各时相点比较差异均有统计学意义(F=223.525,P=0.000)。对照组组织TGF-β1 AOD值则随伤后时间依次增高,组内各时相点比较差异均有统计学意义(F=133.232,P=0.000,表 3)。
3.
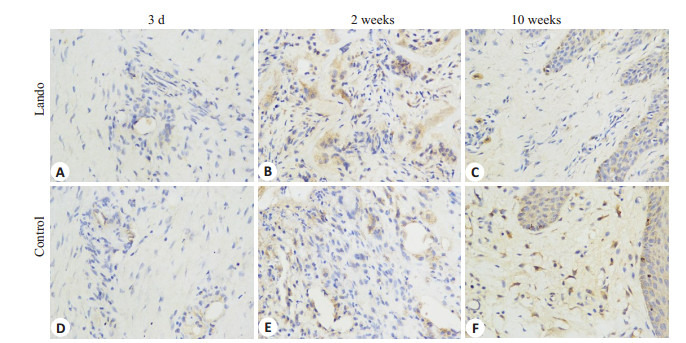
两组伤后不同时相点创面TGF-β1的表达
Expression of TGF-β1 in the wound tissue in the two groups at different time points after injury (× 400).
3.
伤后不同时相点两组组织TGF-β1的表达
Expression of TGF-β1 in the wound tissue in the two groups at different time points after injury (n=6)
| Group | 3 d | 2 weeks | 10 weeks |
| TGF-β1: Transforming growth factor-β1; *P=0.000 vs control. | |||
| Experimental | 860±63 | 7050±538* | 2991±709* |
| Control | 871±52 | 5073±695 | 6105±744 |
2.4. 组织MMP-1 mRNA的表达
伤后3 d两组组织MMP-1 mRNA的表达比较差异无统计学意义(t=-0.556,P=0.602),伤后2周实验组组织MMP-1 mRNA的表达低于对照组(t=-45.412,P= 0.000),伤后10周则显著高于对照组(t=78.769,P= 0.000)。实验组组织MMP-1 mRNA的表达随伤后时间依次增高,组内各时相点比较差异均有统计学意义(F=105.428,P=0.000)。对照组组织MMP-1 mRNA的表达伤后2周最高,伤后10周有所下降,但仍高于伤后3 d,组内各时相点比较差异均有统计学意义(F= 55.067,P=0.000,表 4)。
4.
伤后不同时相点两组组织MMP-1 mRNA的表达
Expression of MMP-1 mRNA in the wound tissue in the two groups at different time points after injury (n=6)
| Group | 3 d | 2 weeks | 10 weeks |
| MMP-1: Matrix metalloproteinase-1; *P=0.000 vs control. | |||
| Experimental | 1.233±0.079 | 1.652±0.098* | 2.038±0.109* |
| Control | 1.240±0.091 | 1.859±0.088 | 1.484±0.126 |
2.5. 组织TIMP-1 mRNA的表达
伤后3 d两组组织TIMP-1 mRNA的表达比较差异无统计学意义(t=-1.007,P=0.360),伤后2周、10周实验组组织TIMP-1 mRNA的表达均低于对照组(t=-27.064,P=0.000;t=-40.535,P=0.000)。两组组织TIMP-1 mRNA的表达随伤后时间依次增高,组内各时相点比较差异均有统计学意义(实验组:F=45.010,P=0.000;对照组:F=95.424,P=0.000,表 5)。
5.
伤后不同时相点两组组织TIMP-1 mRNA的表达
Expression of TIMP-1 mRNA in the wound tissue in the two groups at different time points after injury (n=6)
| Group | 3 d | 2 weeks | 10 weeks |
| TIMP-1: Tissue-inhibitor of metalloproteinase-1; *P=0.000 vs control. | |||
| Experimental | 1.562±0.098 | 1.765±0.094* | 2.134±0.123* |
| Control | 1.577±0.101 | 1.962±0.076 | 2.397±0.125 |
3. 讨论
病理性瘢痕是皮肤损伤愈合后最常见的并发症之一,它不但影响外观,其挛缩还可能影响功能,因此,预防或减轻病理性瘢痕的形成及其挛缩显得至关重要。
皮肤损伤后要获得良好的愈合质量,真皮的构建非常关键,良好的真皮结构能诱导成纤维细胞形成分布合理的新生胶原,防止瘢痕的增生[8]。Lando®真皮支架就是一种旨在构建良好真皮结构的组织工程产品,它是采用牛跟腱胶原与硫酸软骨素交联形成的三维多孔支架,厚约2 mm,孔隙率高,孔与孔之间相互连接成网状,可诱导受区成纤维细胞和血管内皮细胞长入支架[7],并有利于营养物质的进入及代谢产物的排出。
本实验研究采用同体对照设计是可行的。由于干预措施为“人工皮肤”,其真皮支架的降解需要2~3月,对照组相当于“空白对照组”,不存在药物干扰问题。另外本实验为防止创面间的干扰,实验组和对照组创面分别位于猪背的两侧,创面间距5 cm以上,且每个创面分别单独采取打包包扎。有人在胶原-壳聚糖真皮支架修复猪全层皮肤缺损的研究中也采用了类似的同体对照设计[9]。
本研究伤后2周大体观察结果显示,创面应用Lando®真皮支架能够促进创面肉芽组织生长。TGF-β1在创面愈合过程中可发挥重要作用,是促进肉芽组织生长的重要因素之一[10-11]。实验组伤后2周组织TGF-β1表达显著高于对照组,有利于二期植皮前创面肉芽组织的生长。MMPs和TIMPs间的平衡在创面愈合的过程中也很重要。MMPs的过度表达或TIMPs的过低表达都会导致创面延迟愈合[12-13]。本研究结果显示,伤后2周实验组组织MMP-1 mRNA的表达低于对照组,有利于细胞外基质的沉积,促进二期植皮前创面肉芽组织的生长;伤后2周对照组组织TIMP-1 mRNA的表达高于实验组,可能与MMP-1和TIMP-1间的反馈机制[14]有关。
有人在TGF-β1调节成纤维细胞分泌MMP-1及TIMP-1的研究中发现,TGF-β1可降低MMP-1的合成,但对TIMP-1无显著改变[15]。因此,本实验中伤后2周实验组组织MMP-1 mRNA的表达低于对照组,可能与实验组伤后2周TGF-β1的高表达有关。
α-SMA是成纤维细胞分化为肌成纤维细胞的特征性标志物[16-17],其表达的强弱很大程度代表着肌成纤维细胞的增殖活性和收缩功能[18-19],它能通过带动胶原纤维位置变化导致瘢痕挛缩[20-21],因此它在瘢痕形成及挛缩中均扮演重要角色。本研究结果显示,实验组伤后10周皮片收缩较对照组明显减轻,伤后2、10周创面收缩率明显低于对照组,伤后10周组织α-SMA表达显著低于对照组,差异均有统计学意义,提示创面应用Lando®真皮支架能够减轻创面收缩及愈合后的挛缩。
α-SMA还表达于创面愈合过程中成熟的血管平滑肌细胞(收缩型),在新生的血管平滑肌细胞(增殖型)表达甚微[22],本研究结果中伤后2周实验组组织α-SMA表达显著高于对照组,可能与实验组创面血管化过程中大量的新生血管成熟有关。
创面愈合后TGF-β1持续的高表达可促进瘢痕增生[23-24]。本研究结果显示,对照组组织TGF-β1表达随伤后时间依次增高,而实验组TGF-β1表达则是伤后2周最高,伤后10周及时回落,显著低于对照组,提示创面应用Lando®真皮支架二期植皮愈合后TGF-β1的表达受到明显抑制,有利于减轻瘢痕的增生。
目前普遍认为病理性瘢痕的形成主要表现为胶原代谢紊乱,而胶原代谢紊乱与MMPs和TIMPs间的失衡有着密切的关系。MMP-1表达的增高,可以促进瘢痕内胶原的降解,从而抑制瘢痕的增生,但有赖于其与TIMP-1的平衡,以保证MMP-1的活性。本研究结果显示,伤后10周实验组组织MMP-1 mRNA的表达显著高于对照组,TIMP-1 mRNA的表达则明显低于对照组,差异均有统计学意义,提示创面应用Lando®真皮支架二期植皮愈合后MMP-1表达增高,其活性抑制因素减弱,有利于促进瘢痕内胶原的降解,可能能够抑制瘢痕的增生。
综上所述,创面应用Lando®真皮支架能够促进创面肉芽组织生长,可能与TGF-β1表达增强、MMP-1表达减弱有关;能够减轻创面收缩;可能减轻愈合后的瘢痕增生及其挛缩,与创面愈合后α-SMA、TGF-β1、TIMP-1表达减弱及MMP-1表达增强有关。
References
- 1.Biedermann T, Boettcher-Haberzeth S, Reichmann E. Tissue engineering of skin for wound coverage. Eur J Pediatr Surg. 2013;23(5):375–82. doi: 10.1055/s-00000015. [Biedermann T, Boettcher-Haberzeth S, Reichmann E. Tissue engineering of skin for wound coverage[J]. Eur J Pediatr Surg, 2013, 23(5): 375-82.] [DOI] [PubMed] [Google Scholar]
- 2.Wang X, Li Q, Hu X, et al. Fabrication and characterization of poly (L-lactide-co-glycolide) knitted mesh-reinforced collagen-chitosan hybrid scaffolds for dermal tissue engineering. J Mech Behav Biomed Mater. 2012;8:204–15. doi: 10.1016/j.jmbbm.2012.01.001. [Wang X, Li Q, Hu X, et al. Fabrication and characterization of poly (L-lactide-co-glycolide) knitted mesh-reinforced collagen-chitosan hybrid scaffolds for dermal tissue engineering[J]. J Mech Behav Biomed Mater, 2012, 8: 204-15.] [DOI] [PubMed] [Google Scholar]
- 3.Yeong EK, Yu YC, Chan ZH, et al. Is artificial dermis an effective tool in the treatment of tendon-exposed wounds. J Burn Care Res. 2013;34(1):161–7. doi: 10.1097/BCR.0b013e3182685f0a. [Yeong EK, Yu YC, Chan ZH, et al. Is artificial dermis an effective tool in the treatment of tendon-exposed wounds[J]? J Burn Care Res, 2013, 34(1): 161-7.] [DOI] [PubMed] [Google Scholar]
- 4.Suzuki S, Morimoto N, Yamawaki S, et al. A case of giant naevus followed up for 22 years after treatment with artificial dermis. J Plast Reconstr Aesthet Surg. 2013;66(8):e229–e233. doi: 10.1016/j.bjps.2013.03.018. [Suzuki S, Morimoto N, Yamawaki S, et al. A case of giant naevus followed up for 22 years after treatment with artificial dermis[J]. J Plast Reconstr Aesthet Surg, 2013, 66(8): e229-e233.] [DOI] [PubMed] [Google Scholar]
- 5.Parren LJ, Ferdinandus P, Van Der Hulst R, et al. A novel therapeutic strategy for turban tumor: scalp excision and combined reconstruction with artificial dermis and split skin graft. Int J Dermatol. 2014;53(2):246–9. doi: 10.1111/ijd.12199. [Parren LJ, Ferdinandus P, Van Der Hulst R, et al. A novel therapeutic strategy for turban tumor: scalp excision and combined reconstruction with artificial dermis and split skin graft[J]. Int J Dermatol, 2014, 53(2): 246-9.] [DOI] [PubMed] [Google Scholar]
- 6.陈 丹丹, 彭 新洁, 李 彦红, et al. 双层人工皮肤的生物相容性研究. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_zhonggys201311017. 中国药事. 2013;27(11):1184–88, 1200. [陈丹丹, 彭新洁, 李彦红, 等.双层人工皮肤的生物相容性研究[J].中国药事, 2013, 27(11): 1184-88, 1200.] [Google Scholar]
- 7.王 桂芳, 邱 学文, 谭 荣伟, et al. Lando®双层人工皮对猪皮肤全层缺损创面血管化的影响. http://www.doc88.com/p-197579691463.html. 中华实验外科杂志. 2015;32(5):1012–15. [王桂芳, 邱学文, 谭荣伟, 等. Lando®双层人工皮对猪皮肤全层缺损创面血管化的影响[J].中华实验外科杂志, 2015, 32(5): 1012-15.] [Google Scholar]
- 8.张 瑾, 张 选奋, 郭 树忠. 真皮与创面再生或瘢痕愈合的关系. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zhzxsswk201604021. 中华整形外科杂志. 2016;32(4):315–8. [张瑾, 张选奋, 郭树忠.真皮与创面再生或瘢痕愈合的关系[J].中华整形外科杂志, 2016, 32(4): 315-8.] [Google Scholar]
- 9.徐 少骏, 黄 爱宾, 马 列, et al. 胶原-壳聚糖真皮支架原位诱导修复猪全层皮肤缺损的研究. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_zhwk200904019. 中华外科杂志. 2009;47(4):305–8. [徐少骏, 黄爱宾, 马列, 等.胶原-壳聚糖真皮支架原位诱导修复猪全层皮肤缺损的研究[J].中华外科杂志, 2009, 47(4): 305-8.] [Google Scholar]
- 10.张 连波, 李 健宁, 孙 颖. 大鼠慢性皮肤溃疡创面愈合中转化生长因子-β1、胶原Ⅰ、胶原Ⅲ的蛋白表达. http://d.wanfangdata.com.cn/Periodical_zhsywk201109016.aspx. 中华实验外科杂志. 2011;28(9):1445–47. [张连波, 李健宁, 孙颖.大鼠慢性皮肤溃疡创面愈合中转化生长因子-β1、胶原Ⅰ、胶原Ⅲ的蛋白表达[J].中华实验外科杂志, 2011, 28(9): 1445-47.] [Google Scholar]
- 11.Rallón NI, Barreiro P, Soriano V, et al. Elevated TGF-β1 levels might protect HCV/HIV-coinfeeted patients from liver fibrosis. Eur J Clin Invest. 2011;41(1):70–6. doi: 10.1111/eci.2010.41.issue-1. [Rallón NI, Barreiro P, Soriano V, et a1.Elevated TGF-β1 levels might protect HCV/HIV-coinfeeted patients from liver fibrosis[J]. Eur J Clin Invest, 2011, 41(1): 70-6.] [DOI] [PubMed] [Google Scholar]
- 12.张 静, 李 炳辉, 李 恭驰, et al. 基质金属蛋白酶-9及基质金属蛋白酶抑制剂-1在不同细菌负荷糖尿病创面组织的表达. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_zhsywk201702034. 中华实验外科杂志. 2017;34(2):281–4. [张静, 李炳辉, 李恭驰, 等.基质金属蛋白酶-9及基质金属蛋白酶抑制剂-1在不同细菌负荷糖尿病创面组织的表达[J].中华实验外科杂志, 2017, 34(2): 281-4.] [Google Scholar]
- 13.张 东萍, 曹 建春. 血竭生肌膏对糖尿病大鼠基质金属蛋白酶类表达的影响. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zgzx201606016&dbname=CJFD&dbcode=CJFQ. 中国中西医结合外科杂志. 2016;22(6):571–5. [张东萍, 曹建春.血竭生肌膏对糖尿病大鼠基质金属蛋白酶类表达的影响[J].中国中西医结合外科杂志, 2016, 22(6): 571-5.] [Google Scholar]
- 14.赵 雪莲, 苏 晓光, 张 锤, et al. 兔耳病理性瘢痕皮回植术后组织中基质金属蛋白酶-1及金属蛋白酶组织抑制剂-1表达的变化. http://med.wanfangdata.com.cn/Paper/Detail?id=PeriodicalPaper_zhyxmr201401017. 中华医学美学美容杂志. 2014;20(1):62–5. [赵雪莲, 苏晓光, 张锤, 等.兔耳病理性瘢痕皮回植术后组织中基质金属蛋白酶-1及金属蛋白酶组织抑制剂-1表达的变化[J].中华医学美学美容杂志, 2014, 20(1): 62-5.] [Google Scholar]
- 15.缪 泽, 群 宋韬. TGF-β1调节瘢痕疙瘩成纤维细胞分泌MMP-1及TIMP-1的研究. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=mala201306005&dbname=CJFD&dbcode=CJFQ. 中国麻风皮肤病杂志. 2013;29(6):373–5. [缪泽, 群宋韬. TGF-β1调节瘢痕疙瘩成纤维细胞分泌MMP-1及TIMP-1的研究[J].中国麻风皮肤病杂志, 2013, 29(6): 373-5.] [Google Scholar]
- 16.张 志, 况 芳, 刘 昌玲, et al. 沉默Smad泛素化调节因子2基因对人增生性瘢痕成纤维细胞功能的影响. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_zhsszz201703004. 中华烧伤杂志. 2017;33(3):145–51. [张志, 况芳, 刘昌玲, 等.沉默Smad泛素化调节因子2基因对人增生性瘢痕成纤维细胞功能的影响[J].中华烧伤杂志, 2017, 33(3): 145-51.] [Google Scholar]
- 17.钱 晓莺, 周 宇, 赵 春华, et al. 人真皮间充质干细胞防治中老年增生性瘢痕形成早期成纤维细胞的效果. http://mall.cnki.net/magazine/magadetail/ZLXZ201706.htm. 中国老年学杂志. 2017;37(6):1350–2. [钱晓莺, 周宇, 赵春华, 等.人真皮间充质干细胞防治中老年增生性瘢痕形成早期成纤维细胞的效果[J].中国老年学杂志, 2017, 37(6): 1350-2.] [Google Scholar]
- 18.Fink E, Biandom Bw, Torp KD. Heatstroke in the super-dized athlete. Pediatr Emerg Care. 2006;22(7):510–3. doi: 10.1097/01.pec.0000227388.91885.4b. [Fink E, Biandom Bw, Torp KD. Heatstroke in the super-dized athlete [J].Pediatr Emerg Care, 2006, 22(7):510-3.] [DOI] [PubMed] [Google Scholar]
- 19.张 文夺, 邓 呈亮, 郭 常敏, et al. 人真皮间充质干细胞对增生性瘢痕成纤维细胞α-SMA和DCN表达的影响. http://www.cnki.com.cn/Article/CJFDTotal-XDKF201445030.htm. 中华整形外科杂志. 2016;32(4):285–92. [张文夺, 邓呈亮, 郭常敏, 等.人真皮间充质干细胞对增生性瘢痕成纤维细胞α-SMA和DCN表达的影响[J].中华整形外科杂志, 2016, 32 (4): 285-92.] [PubMed] [Google Scholar]
- 20.Shi J, Wan Y, Shi S, et al. Expression, purification and characterization of scar tissue neovasculature endothelial cell-targeted rhIL10 in escherichia coli. Appl Biochem Biotechnol. 2015;175(1):625–34. doi: 10.1007/s12010-014-1316-1. [Shi J, Wan Y, Shi S, et al. Expression, purification and characterization of scar tissue neovasculature endothelial cell-targeted rhIL10 in escherichia coli[J]. Appl Biochem Biotechnol, 2015, 175(1): 625-34.] [DOI] [PubMed] [Google Scholar]
- 21.李 宗枝, 闫 丰华, 张 永臻. 曲尼司特对兔增生性瘢痕组织的抑制作用及其机制研究. 中国药房. 2017;28(7):919–22. doi: 10.6039/j.issn.1001-0408.2017.07.16. [李宗枝, 闫丰华, 张永臻.曲尼司特对兔增生性瘢痕组织的抑制作用及其机制研究[J].中国药房, 2017, 28(7): 919-22.] [DOI] [Google Scholar]
- 22.Regan CP, Adam PJ, Madsen CS, et al. Molecular mechanisms of decreased smooth muscle differentiation marker expression after vascular injury. J Clin Invest. 2000;106(9):1139–47. doi: 10.1172/JCI10522. [Regan CP, Adam PJ, Madsen CS, et al. Molecular mechanisms of decreased smooth muscle differentiation marker expression after vascular injury[J]. J Clin Invest, 2000, 106(9): 1139-47.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Penn JW, Grobbelaar AO, Rolfe KJ. The role of the TGF-β family in wound healing, burns and scarring: a review. http://www.ncbi.nlm.nih.gov/pubmed/22928164. Int J Burns Trauma. 2012;2(1):18–28. [Penn JW, Grobbelaar AO, Rolfe KJ. The role of the TGF-β family in wound healing, burns and scarring: a review[J]. Int J Burns Trauma, 2012, 2(1): 18-28.] [PMC free article] [PubMed] [Google Scholar]
- 24.王 芳, 钟 彬武, 聂 晶晶, et al. OPN与TGF-β1在瘢痕疙瘩中的表达及生物学功能. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zlxz201707013&dbname=CJFD&dbcode=CJFQ. 中国老年学杂志. 2017;37(7):1596–7. [王芳, 钟彬武, 聂晶晶, 等. OPN与TGF-β1在瘢痕疙瘩中的表达及生物学功能[J].中国老年学杂志, 2017, 37(7): 1596-7.] [Google Scholar]


