Abstract
目的
探讨腹腔镜下射频消融(LRFA)与经皮射频消融(PRFA)治疗原发性肝癌的疗效和安全性。
方法
回顾性分析2013年9月~2016年9月解放军总院海南分院肝胆外科60例HCC患者78个肿瘤结节,根据治疗方法不同分为LRFA组30例46个肿瘤结节,PRFA组30例32个肿瘤结节。LRFA组行LRFA治疗,PRFA组采用PRFA,术后随访3年,比较两组完全消融率、严重并发症、复发率及总生存率。
结果
LRFA组术后瘤体完全消融率为95.65%(44/46),PRFA组为93.75%(30/32),两组的完全消融率比较差异无统计学意义(P > 0.05)。两组严重并发症发生率LRFA组为0%(0/30),PRFA组为6.7%(2/30),两组严重并发症发生率比较差异有统计学意义(P < 0.05)。LRFA组复发率13.33%(4/30),复发时间为6~32月;PRFA组复发率23.33%(7/30),复发时间为4~34月,两组复发率比较差异有统计学意义(P < 0.05)。两组1、3年总生存率:LRFA组为96.15%、55.12%,PRFA组为93.73%、48.54%,两组1、3年总生存率比较差异无统计学意义(P > 0.05)。
结论
LRFA与PRFA都是治疗原发性肝癌的有效手段,但是LRFA的复发率和严重并发症的发生率较低,安全性更高,尤其在治疗特殊部位肝癌更具优势。
Keywords: 肝细胞癌, 腹腔镜检查, 射频消融
Abstract
Objective
To compared the efficacy of laparoscopy- assisted radiofrequency ablation (LRFA) and percutaneous radiofrequency ablation (PRFA) for the treatment of hepatocellular carcinoma (HCC).
Methods
Between September, 2013 and September, 2016, a total of 60 HCC patients with 78 tumor nodules underwent LRFA (30 cases with 46 tumor nodules) and PRFA (30 cases with 32 tumor nodules) in our hospital. The patients were followed up for 3 years to compare the complete ablation rate, serious complications, recurrence rate and long-term survival rate between the two groups.
Results
The patients receiving LRFA had a complete ablation rate of 95.65% (44/46), significantly higher than the rate of 93.75% (30/32) in PRFA group (P > 0.05). Significant differences were found between LRFA and PRFA groups in the incidence of serious complications [0 vs 6.7% (2/30), P < 0.05] and recurrence rate [13.33% (4/30) vs 23.33% (7/30), P < 0.05]. The 1-and 3-year overall survival rates of the patients were 96.15% and 55.12% in LRFA group and 93.73% and 48.54% in PRFA group, respectively (P > 0.05).
Conclusions
Both LRFA and PRFA are effective for HCC treatment, but is associated with a lower recurrence rate, fewer serious complications, a better treatment safety and a better applicability for tumor in difficult locations.
Keywords: hepatocellular carcinoma, laparoscopy, radiofrequency ablation
原发性肝癌是临床上最常见的恶性肿瘤,手术切除或肝移植被认为是根治原发性肝癌最有效方法,然而相当多的肝癌患者合并肝硬化、肿瘤多发等原因失去了手术机会。Rossi等[1]首先将射频消融治疗肝脏肿瘤应用于临床。射频消融已被公认为是治疗原发性肝癌的有效的微创手术,尤其治疗小肝癌,被认为是微创、安全、有效的治疗办法,甚至可达到彻底根治目标[2-3]。射频消融可采用经皮射频消融(PRFA)、腹腔镜下射频消融(LRFA)等几种治疗方式。然而目前不同射频消融治疗原发性肝癌的疗效尚未有较全面的研究,本研究将LRFA与PRFA两种术式治疗原发性肝癌的疗效比较,为临床手术方式的选择提供参考。
1. 资料和方法
1.1. 临床资料
回顾性分析2013年9月~2016年9月在解放军总院海南分院肝胆外科接受射频消融治疗的60例原发性肝癌患者78个肿瘤结节。其中男48例,女12例,年龄38~72岁,中位年龄52.5岁。病例入选标准:经影像学或术后病理确诊为原发性肝癌,且肝内肿物≤3个,肿瘤直径≤5 cm,肝功能Child-Pugh分级A或B级。排除标准:肝外转移、门静脉癌栓及难于纠正的凝血功能障碍不纳入本研究。按照治疗方法不同分为LRFA组:临近肝门区、胃肠区、胆囊区、膈顶和突出肝被膜等特殊部位的30例肝癌患者,术中常规使用LUS定位。PRFA组:PRFA30例肝癌患者。两组患者一般资料比较差异无统计学意义(P > 0.05)。
1.2. 手术方式
LRFA:全身麻醉,腹腔镜直视下结合超声确定瘤体分布、数量、大小,确定穿刺部位,根据肿瘤位置适当游离腹腔粘连和肝脏。美国Tyco Redionics Cool-Tip冷循环超能射频肿瘤治疗系统,25G 2.5或3 cm射频治疗针单针穿刺,在腹壁选择恰当的进针部位,尽量经过肝组织穿刺肿瘤。根据肿瘤大小、部位、射频波阻抗大小选择射频治疗时间,每次治疗时间10~15 min,治疗时保持瘤体温度 > 60 ℃,肿瘤直径 < 3 cm单点单次穿刺,直径≥3 cm的肿瘤采取多点、多次重叠穿刺。术中超声评估射频治疗效果,病灶回声增高,达到以覆盖肿瘤及周围0.5~1.0 cm的肝组织为良好治疗效果, 出针时加热凝固针道,碳化组织止血和预防窦道转移。PRFA:全身麻醉,体外肝脏探头,确定瘤体位置后采用穿刺支架进针,其余射频治疗方法同LRFA组。
1.3. 疗效评估
术后第1天查血常规、凝血功能、肝功能等指标,记录并发症。术后1月复查AFP、血常规、肝功能和腹部增强CT,以综合评价病灶消融效果。完全消融:术后1月CT增强扫描时病灶完全无强化及AFP较术前降至正常。术后患者门诊定期复查、电话随访,记录两组患者1、3年总生存率。
1.4. 统计学方法
应用SPSS17.0软件进行统计学处理,率的比较采用χ2检验;采用Kaplan-Meier及Log-rank检验进行生存分析。P < 0.05为差异有统计学意义。
2. 结果
2.1. 完全消融率
LRFA组术后瘤体完全消融率为95.65%(44/46),PRFA组为93.75%(30/32),两组的完全消融率比较差异无统计学意义(P > 0.05)。
2.2. 并发症
LRFA组1例继发少量出血,2例继发胆漏,保守治疗好转。30例患者均出现不同程度的转氨酶升高,8例患者术后少量腹水形成,6例位于膈顶区患者出现反应性胸腔积液,LRFA组无严重并发症。PRFA组出现1例肿瘤破裂出血、1例严重胆管损伤等严重并发症,两组严重并发症发生率差异有统计学意义(P < 0.05)。两组术中消融见图 1。
1.
射频消融治疗肝癌术中情况
Intraoperative radiofrequency ablation for hepatocellular carcinoma. A: Laparoscopic radiofrequency ablation; B: Pereutaneous radiofrequency ablation.
2.3. 复发率
LRFA组复发率13.33%(4/30),复发时间为6~32月;PRFA组复发率23.33%(7/30),复发时间为4~34月,两组复发率比较差异有统计学意义(P < 0.05,表 1)。
1.
两组患者射频消融治疗结果
Results of radiofrequency ablation therapy in the 2 groups
| Group | Complete ablation rate | Complication rate | Recurrence rate |
| PRFA | 93.75% | 6.70% | 23.33% |
| LRFA | 95.65% | 0% | 13.33% |
| P | 0.113 | 0.023 | 0.042 |
2.4. 总生存率
LRFA组1、3年无瘤生存率分别为96.15%、55.12%,PRFA组为1、3年无瘤生存率分别为93.73%、48.54%,两组1、3年总生存率比较差异无统计学意义(P值0.069)。生存曲线见图 2。
2.
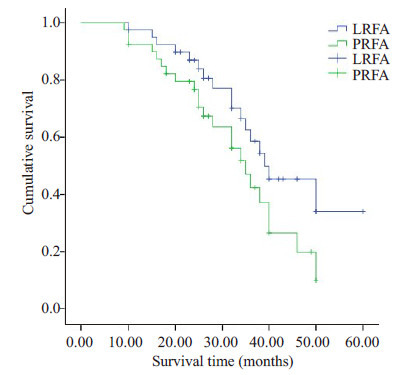
LRFA和PRFA两组患者生存曲线分析
Kaplan-Meier survival curves of LRFAand PRFA.
3. 讨论
原发性肝癌是我国常见的恶性肿瘤之一,我国肝癌患者多数合并乙肝肝硬化、肿瘤数目较多、肝储备功能降低等原因失去了手术切除机会。射频消融技术近年得到快速发展,因其微创、对周围肝组织损伤小、安全性相对较高,在不具备手术治疗的肝癌患者中广泛应用。针对直径 < 3 cm的小肝癌,射频消融可达到手术切除相似效果,而安全性更高[4]。肝癌伴肝硬化患者使用RFA治疗是安全有效的[1]。目前国际上已将RFA与手术切除及肝移植并列作为早期肝癌(巴塞罗那肝癌BCLC分期0期及A期)的治愈性治疗方法写入肝癌治疗指南,并被认为是不适宜切除及肝移植的早期肝癌患者的标准治疗策略[5-6]。
相比经皮超声射频消融,腹腔镜下射频消融在治疗过程中可在直视下对周围组织器官进行保护,使肿瘤定位与进针更准确。有研究报道,临近大胆管旁行腹腔镜射频消融治疗肝癌具有较高的安全性,无胆漏、胆道出血及大血管损伤等严重并发症发生[7]。本研究显示,对肝门区、胃肠区、胆囊区、膈顶和突出肝被膜等特殊部位的30例肝癌患者行LRFA治疗,无胆道出血及大血管损伤等严重并发症发生。当病灶位于胆囊旁时,可先行腹腔镜下胆囊切除术,再行肝癌射频消融,可以有效地防止因高温造成术后胆囊炎甚至胆囊穿孔的发生。而对于邻近胃、结肠或小肠的病灶,在腔镜下分离粘连组织,以分离钳或干纱布将周围器官与肿瘤分隔,同时直视下多角度判断进针的方向和深度,可以有效地避免损伤胃肠等严重并发症发生。PRFA组出现2例肿瘤破裂出血、1例严重胆管损伤等严重并发症,LRFA可在腹腔镜下对肝周围器官进行保护,提高治疗的安全性[8-9],进一步证实了LRFA并发症发生率更低,安全性更高。我们的经验显示LRFA具有如下优点:可视性,准确判断肿瘤的位置和数目,并能发现新的病灶,在穿刺过程中可以避开肠管、胆管及膈肌等重要脏器,避免副损伤;动态观察肝癌的损毁程度和范围,避免了体外超声的伪像和盲区;特殊位置的肝癌,腹腔镜下可更好选择进针点,通过探查钳等牵拉或按压,可以更好的避免副损伤。
在精确的超声定位下进行完全射频消融,可降低术后肿瘤残留、避免复发[10]。我们的研究显示,LRFA与PRFA两组完全消融率比较无统计学意义,治疗效果等同。但LRFA的复发率低于PRFA,治疗的彻底性优于后者。分析原因可能是LRFA可对肝脏进行全面、无死角的扫查,对肝内结节的分辨率大大提高,避免了遗漏的病灶,降低了局部复发率。另外,LRFA更强调手术医师操作的技巧性,要求更灵活的把握了进针的位置、方向、角度,提高完全消融率,降低局部复发率[11]。LRFA的术后局部复发率仍有0~12%[12-13],与本研究13.33%接近,局部复发的高危因素有肿瘤包膜不完整、血管侵犯、消融范围不够等。多个中心报道RFA治疗肝癌的3年生存率为40%~60%[14-15],与我们的研究结果相似。比较PRFA,LRFA并未能提高患者远期生存期,可能与射频消融一般在二维影像为基础引导下进行,往往形成三维空间的漏洞,致使病灶消融不完全,造成局部复发,影响患者的远期生存期,同时也可能与操作者的技术和经验、消融范围及治疗效果的评估密切相关[16],需要更进一步研究。
腹腔镜超声引导下射频消融治疗肝癌体现了精准、微创的治疗理念,具有良好的临床应用价值,在肝脏外科治疗领域内的应用愈加广泛,地位愈加重要。但腹腔镜超声下的操作需要外科医生较好的三维解剖、立体视觉技能,同时应具有较好的超声操作技巧[17-18]。术前三维重建及三维导航技术能够很好地融合腹腔镜手术、超声引导和射频消融治疗的优势,是我们下一研究的热点[19]。在肝癌多学科综合治疗及个体化治疗的背景下,射频消融在规范化临床应用,优化操作规程等方面,还需引入更多的循证医学研究[20]。
Biography
陈书德,主治医师,E-mail: chensd425@126.com
Contributor Information
陈 书德 (Shude CHEN), Email: chensd425@126.com.
王 宏光 (Hongguang WANG), Email: wanghongguang301@163.com.
References
- 1.Rossi S, Distasi M, Buscarini E, et al. Percutaneous RF interstitial thermal ablation in the treatment of hepatic cancer. Am J Roentgenol. 1996;167(3):759–68. doi: 10.2214/ajr.167.3.8751696. [Rossi S, Distasi M, Buscarini E, et al. Percutaneous RF interstitial thermal ablation in the treatment of hepatic cancer[J]. Am J Roentgenol, 1996, 167(3): 759-68.] [DOI] [PubMed] [Google Scholar]
- 2.Sotiropoulos GC, Lang H, Frilling A, et al. Resectability of hepatocellular carcinoma: evaluation of 333 consecutive cases at a single hepatobiliary specialty center and systematic review of the 1iterature. http://www.ncbi.nlm.nih.gov/pubmed/16795964/ Hepatogastroenterology. 2006;53(69):322–9. [Sotiropoulos GC, LangH, FrillingA, et al. Resectability of hepatocellular carcinoma: evaluation of 333 consecutive cases at a single hepatobiliary specialty center and systematic review of the 1iterature[J]. Hepatogastroenterology, 2006, 53(69): 322-9.] [PubMed] [Google Scholar]
- 3.Tateishi R, Shiina S, Teratani T, et al. Percutaneous radiofrequency ablation for hepatocellular carcinoma-an analysis of 1000 cases. Cancer. 2005;103(6):1201–9. doi: 10.1002/(ISSN)1097-0142. [Tateishi R, Shiina S, Teratani T, et al. Percutaneous radiofrequency ablation for hepatocellular carcinoma-an analysis of 1000 cases[J]. Cancer, 2005, 103(6): 1201-9.] [DOI] [PubMed] [Google Scholar]
- 4.Llovet JM. Updated treatment approach to hepatocellular carcinoma. J Gastroenterol. 2005;40(3):225–35. doi: 10.1007/s00535-005-1566-3. [Llovet JM. Updated treatment approach to hepatocellular carcinoma[J]. J Gastroenterol, 2005, 40(3): 225-35.] [DOI] [PubMed] [Google Scholar]
- 5.冯 凯, 马 宽生, 别 平. 射频消融技术在肝癌综合治疗中合理应用. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=QKC20162016070100036915. 中国实用外科杂志. 2016;36(6):621–3. [冯凯, 马宽生, 别平.射频消融技术在肝癌综合治疗中合理应用[J].中国实用外科杂志, 2016, 36(6): 621-3.] [Google Scholar]
- 6.Forner A, Llove JM, Bruix J. Hepatocellularcarcinoma. http://d.old.wanfangdata.com.cn/Periodical/zhyx200108006. Lancet. 2012;3739(9822):1245–55. doi: 10.1016/S0140-6736(11)61347-0. [FornerA, LloveJM, BruixJ. Hepatocellularcarcinoma[J]. Lancet, 2012, 3739(9822): 1245-55.] [DOI] [PubMed] [Google Scholar]
- 7.赵 鹏, 郑 加生, 张 洪海, et al. 肝动脉导管化疗栓塞联合CT引导精准微波消融治疗原发性肝癌的疗效及影响因素. 中华肿瘤杂志. 2016;38(2):138–45. doi: 10.3760/cma.j.issn.0253-3766.2016.02.012. [赵鹏, 郑加生, 张洪海, 等.肝动脉导管化疗栓塞联合CT引导精准微波消融治疗原发性肝癌的疗效及影响因素[J].中华肿瘤杂志, 2016, 38(2): 138-45.] [DOI] [Google Scholar]
- 8.Yi HM, Zhang W, Ai X, et al. Radiofrequency ablation versus surgical resection for the treatment of hepatocellular carcinoma conforming to the Milan criteria: systemic review and meta-analysis. Int J Clin Exp Med. 2014;7(10):3150–63. [Yi HM, ZhangW, Ai X, et al. Radiofrequency ablation versus surgical resection for the treatment of hepatocellular carcinoma conforming to the Milan criteria: systemic review and meta-analysis[J]. Int J Clin Exp Med, 2014, 7(10): 3150-63.] [PMC free article] [PubMed] [Google Scholar]
- 9.Mulier S, Ni Y, Jamart J, et al. Local recurrence after hepaticradiofrequency coagulation: multivariate meta-analysis and review ofcontributingfators. Ann Surg. 2005;242(2):158–71. doi: 10.1097/01.sla.0000171032.99149.fe. [MulierS, NiY, JamartJ, et al. Local recurrence after hepaticradiofrequency coagulation: multivariate meta-analysis and review ofcontributingfators[J].Ann Surg, 2005, 242(2): 158-71.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.翟 博, 陈 夷, 刘 晟, et al. 原发性肝癌射频消融后肿瘤残留分析. http://d.old.wanfangdata.com.cn/Periodical/zhgdwk200904005. 中华肝胆外科杂志. 2009;15(4):254–8. [翟博, 陈夷, 刘晟, 等.原发性肝癌射频消融后肿瘤残留分析[J].中华肝胆外科杂志, 2009, 15(4): 254-8.] [Google Scholar]
- 11.Santambrogio R, Costa M, Barabino M, et al. Laparoscopic radiofrequency of hepatocellular carcinoma using ultrasound-guided selective intrahepatic vascular occlusion. Surg Endosc. 2008;22(9):2051–5. doi: 10.1007/s00464-008-9751-0. [Santambrogio R, Costa M, Barabino M, et al. Laparoscopic radiofrequency of hepatocellular carcinoma using ultrasound-guided selective intrahepatic vascular occlusion[J]. Surg Endosc, 2008, 22(9): 2051-5.] [DOI] [PubMed] [Google Scholar]
- 12.Mazzaferro V, Battiston C, Perrone S, et al. Radiofrequencv ablationof smallhepatocellular carcinoma in cirrhotic patients awaiting livertransplantation: a prospective study. Ann Surg. 2004;240(5):900–9. doi: 10.1097/01.sla.0000143301.56154.95. [Mazzaferro V, BattistonC, PerroneS, et al. Radiofrequencv ablationof smallhepatocellular carcinoma in cirrhotic patients awaiting livertransplantation: a prospective study[J]. Ann Surg, 2004, 240(5): 900-9.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Pompili M, Mirante VG, Rondjnara G, et al. Percutaneous ahlation procedures in cirrhotic patients with hepatoce llular carcinoma submitted to liver transplantation: assessment of efficacy at explantanalysis and of safety for tumor recurrence. Liver Transpl. 2005;11(9):1117–26. doi: 10.1002/(ISSN)1527-6473. [PompiliM, MiranteVG, RondjnaraG, et al. Percutaneous ahlation procedures in cirrhotic patients with hepatoce llular carcinoma submitted to liver transplantation: assessment of efficacy at explantanalysis and of safety for tumor recurrence[J]. Liver Transpl, 2005, 11(9): 1117-26.] [DOI] [PubMed] [Google Scholar]
- 14.Li D, Kang J, Golas BJ, et al. Minimally invasive local therapies for liver cancer. http://www.ncbi.nlm.nih.gov/pubmed/25610708. Cancer Biol Med. 2014;11(4):217–36. doi: 10.7497/j.issn.2095-3941.2014.04.001. [Li D, Kang J, Golas BJ, et al. Minimally invasive local therapies for liver cancer[J]. Cancer Biol Med, 2014, 11(4): 217-36.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Hildebrand P, Kleemann M, Roblick U, et al. Laparoscopic radiofrequency ablation of unresectable hepatic malignancies: indication, limitation and results. http://www.ncbi.nlm.nih.gov/pubmed/11443478. Hepatogastroenterology. 2007;54(79):2069–72. [Hildebrand P, Kleemann M, Roblick U, et al. Laparoscopic radiofrequency ablation of unresectable hepatic malignancies: indication, limitation and results[J]. Hepatogastroenterology, 2007, 54(79): 2069-72.] [PubMed] [Google Scholar]
- 16.Eisele RM, Chopra SS, Glanemann M, et al. Risk of local failure after ultrasound guided irreversible electroporation of malignant liver tumors. http://www.ncbi.nlm.nih.gov/pubmed/25598987. Intervent Med&Appli Sci. 2014;6(4):147–53. doi: 10.1556/IMAS.6.2014.4.2. [Eisele RM, Chopra SS, Glanemann M, et al. Risk of local failure after ultrasound guided irreversible electroporation of malignant liver tumors[J]. Intervent Med&Appli Sci, 2014, 6(4): 147-53.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Hildehrand P, Kleemann M, Schlichting S, et al. Prototype of anonline navigation system for laparmscopicradiofrequenoy ablation. Hepatogastmenterology. 2009;56(96):1710–3. [HildehrandP, KleemannM, SchlichtingS, et al. Prototype of anonline navigation system for laparmscopicradiofrequenoy ablation[J]. Hepatogastmenterology, 2009, 56(96): 1710-3.] [PubMed] [Google Scholar]
- 18.Chopra SS, Schmidt SC, Wiltberger GA, et al. Laparoscopicradiofrequency ablation 0f livetumors: comparison of mrguidance versus conventionallaparoscopic ultrasound for needle positioning ina phanltom model. Mini Invas Allied Technol. 2011;20(4):212–7. doi: 10.3109/13645706.2010.534864. [Chopra SS, SchmidtSC, WiltbergerGA, et al. Laparoscopicradiofrequency ablation 0f livetumors: comparison of mrguidance versus conventionallaparoscopic ultrasound for needle positioning ina phanltom model[J]. Mini Invas Allied Technol, 2011, 20(4): 212-7.] [DOI] [PubMed] [Google Scholar]
- 19.张 雯雯, 王 宏光, 史 宪杰, et al. 腹腔镜超声引导下肝肿瘤射频消融治疗的研究进展. http://d.old.wanfangdata.com.cn/Periodical/jyjxxyxb201605027. 解放军医学学报. 2016;37(5):514–7. [张雯雯, 王宏光, 史宪杰, 等.腹腔镜超声引导下肝肿瘤射频消融治疗的研究进展[J].解放军医学学报, 2016, 37(5): 514-7.] [Google Scholar]
- 20.唐 喆, 马 宽生. 消融技术在肝癌外科治疗中的规范应用. 中华医学杂志. 2017;97(31):2407–10. doi: 10.3760/cma.j.issn.0376-2491.2017.31.003. [唐喆, 马宽生.消融技术在肝癌外科治疗中的规范应用[J].中华医学杂志, 2017, 97(31): 2407-10.] [DOI] [PubMed] [Google Scholar]


