Abstract
目的
探讨益气活血方(脑络欣通)对MCAO-R气虚血瘀证大鼠神经再生的影响及可能的作用机制。
方法
随机数字表法将大鼠分成4组:正常组、模型组、脑络欣通组、通心络组, 其中脑络欣通组和通心络组分别用脑络欣通溶液、通心络溶液灌胃。观察各组大鼠生命状态并进行神经功能缺损、气虚证和血瘀证评分, 运用激光多普勒仪动态监测局部脑血流量(rCBF), TTC染色检测脑梗死体积, 免疫组化结合免疫荧光染色检测脑组织Nestin和BrdU表达, 荧光定量PCR检测miRNA-124水平, Westernblotting检测Wnt3a、GSK3β和β-catenin蛋白表达水平。
结果
脑络欣通和通心络都能改善模型大鼠神经功能, 降低气虚证和血瘀证评分, 减少脑梗死体积, rCBF提高(P < 0.01);脑络欣通和通心络组BrdU表达增强, 与正常组比较, 其他3组阳性细胞数明显增多(P < 0.01), 与模型组比较, 脑络欣通和通心络组显著增多, Nestin表达明显增强(P < 0.01)。脑络欣通能抑制模型大鼠脑组织miRNA-124和Wnt3a应激性的高表达, 同时提高β-catenin的表达水平(P < 0.01)。但脑络欣通和通心络对模型大鼠GSK3β蛋白表达均无明显影响(P>0.05)。
结论
脑络欣通可能通过影响脑组织miRNA-124的表达而激活Wnt通路, 从而发挥对气虚血瘀型脑缺血的神经保护以及神经再生的作用。
Keywords: 气虚血瘀证, 脑缺血, 脑络欣通, 神经再生, miRNA-124, Wnt通路
Abstract
Objective
To investigate the effect of Yiqihuoxue prescription (NLXT) on nerve regeneration in MCAO-R rat models of qi deficiency and blood stasis syndrome and explore the underlying mechanisms.
Methods
The rats were randomized into 4 groups, namely the control group, model group, NLXT group and TXL group. The rats in NLXT group and TXL group were treated with gavage of NLXT and TXL solutions, respectively. The NFDS, QDSS and BSSS of the rats were evaluated. The regional cerebral blood flow (rCBF) were dynamically monitored with laser Doppler scanning, and the volume of cerebral infarction was detected with TTC-dye; the expression levels of nestin and BrdU were assayed with immunohistochemistry and mmunofluorescent staining. The expressions of miRNA-124, Wnt3a, GSK3β and β-catenin in the rat brain tissue were detected with PCR or Western blotting.
Results
NLXT and TXL both improved the neurological functions of the model rats, reduced NFDS, QDSS, and BSSS scores, decreased the volume of cerebral infarction, and promoted the recovery of the rCBF (P < 0.01). Nestin and BrdU expression levels were significantly increased in the rat brain tissue in NLXT group and TXL group. NLXT significantly inhibited high expressions of miRNA-124 and Wnt3a in response to stress, and increased β-catenin expression level (P < 0.01). NLXT and TXL produced no obvious effect on GSK3β expression in the model rats (P>0.05).
Conclusion
NLXT can activate Wnt signaling by affecting miRNA-124 expression to offer neuroprotection and promote nerve regeneration in rats with cerebral ischemia with qi deficiency and blood stasis syndrome.
Keywords: qi deficiency and blood stasis syndrome, cerebral ischemia, Naoluoxintong, nerve regeneration, miRNA-124, Wnt signaling
研究脑组织特异miRNA与NSC增殖分化之间的调控关系已成为神经科学的关注点[1-5]。脑组织特异miRNA与NSC增殖分化之间有密切联系,其表达对缺血后神经再生起到重要调控机制。研究表明miR-124在脑组织中特异表达且呈富集性,对保持海马及室管膜下区平衡至关重要,NSC增殖分化过程伴miR-124特异表达,其在分化或成熟的神经元中特异性高表达,通过抑制某些基因表达来维持分化[6-8]。研究表明,miR-15a,miR-30a,miR-124等通过时空特异性靶向作用于wnt3a和wnt5a而发挥对wnt通路的调控作用[9-10]。
益气活血法是缺血性中风治疗的重要方法,复方“脑络欣通”是新安王氏内科特色治法益气活血法代表方,有长期临床实践与药效实验基础,在前期研究中已发现其在缺血性中风防治中有明显作用,课题组在前期预实验发现脑络欣通可影响模型大鼠缺血脑组织miR-124及wnt通路相关信号分子的表达,同时发现NSC增殖分化与这一过程有一定相关度,具体干预机制尤其对wnt通路关键信号分子的调控机制尚不明确,本实验目的在于探索wnt通路调控神经再生的机制并探讨miR-124在这个过程中的可能调节靶点[11-13]。中医基本特点之一是辩证论治,本研究根据气血理论和脑缺血“气虚血瘀”病机学说,采用改良线栓法结合多因素复合模拟年老、饥饿、疲劳和低氧环境等制备大脑中动脉闭塞缺血再灌注(MCAO-R)气虚血瘀证大鼠模型用于实验研究。
1. 材料和方法
1.1. 材料
1.1.1. 动物及分组
清洁级SD大鼠48只,体质量280± 20 g,安徽省实验动物中心提供(许可证号:2011(皖)-002)。独立送风隔离笼具(IR60)饲养,笼温22± 1 ℃,相对湿度60%,随机数字表法分成正常组(Con)、模型组(Mod)、治疗组(脑络欣通NLXT)和对照组(通心络TXL),每组12只。
1.1.2. 药物制备及取材
脑络欣通方由黄芪、红花、三七、川芎、蜈蚣、当归和天麻七味药组成,院内制剂(安徽中医药大学第一附属医院制剂中心,院内批号:20150726)500 g加蒸馏水1500 mL自动煎药机中煎煮60 min,过滤,冷冻离心去滓,旋转蒸发仪低压低温( < 45 ℃)浓缩至197 mL,低温真空(-45 ℃, < 20 Pa)制成冻干粉共51.3 g,配制浓度为85.8 mg/mL溶液[14];通心络胶囊(以岭药业,国药准字Z19980015,批号:A1602024)0.26 g/粒)配制30 mg/mL溶液。造模后待苏醒后按脑络欣通858 mg/kg、通心络300 mg/kg体质量分别灌胃给药,连续7 d,最后1次给药后12 h进行神经功能缺损评分及气虚血瘀证评分,然后常规取材(低温新鲜取脑和心脏灌注内固定取脑各半,新鲜取脑低温快速分离大脑皮质部分-70 ℃保存;内固定脑经甲醛固定1周后取出,脱水、浸蜡、包埋、连续冠状切片6 μm,进行免疫组化及免疫荧光染色。)
1.1.3. 主要试剂
逆转录试剂盒(Thermo公司,批号:00330969);EzOmics一步法实时荧光定量PCR检测试剂盒(Biomics,Cat.No BK2100,Lot NoA140703);miRNA qPCR引物hsa-miR-21-5p(Biomics,Cat.No BK1010T0000076,Lot No20150722);SDS(货号:CAS: 151-21-3),Sigma提供;beta-Actin(批号:16AF0208)、山羊抗小鼠IgG(批号:124227)、山羊抗兔IgG(批号:125946),由北京中杉提供;Wnt3a(Bioworlde,货号:BS6191);β-catenin(abcam,货号:ab32572);BrdU、兔抗鼠BrdU单克隆抗体(bs-0489R)、兔抗鼠Nestin多克隆抗体(bs-0006R)、GSK3β单克隆抗体,北京奥博森提供;脂肪乳(每100 mL由猪油20 g、胆固醇10 g、胆盐2 g、吐温-80 20 mL、1,2-丙二醇20 mL等配制而成。)
1.1.4. 主要仪器
IKA-HB10旋转蒸发仪(郑州长城科工贸有限公司);FD-1C-50冷冻干燥机(北京博医康);PeriFlux5000激光多普勒仪(Perimed)。荧光定量PCR仪(Thermo,PIKOREAL 96);EPS 300型电泳仪、VE-186型转膜仪(Tanon);Gel Doc XR凝胶图像分析仪(Bio-RAD);Olympas PM-20型显微照相设备(奥林巴斯)。
1.2. 方法
1.2.1. 气虚血瘀证候复合因素模拟
(1)饥饿:按正常食量60%提供饲料。每日8:00予全天量2/3,20:00予剩余1/3。(2)疲劳:大鼠每日放入水桶(水深60 cm,水温37 ℃),木棒拨打强迫其不断游泳消耗体力,每次30 min。另外,保持24 h照明以影响大鼠睡眠。(3)低氧:将大鼠置于常压低氧装置内,外接氧气和氮气钢瓶。7.5 L/min流量通入氮气稀释控制氧浓度,自动测氧仪调控氧浓度(10±0.5)%,装置留一小孔与外界相通以确保舱内常压状态,观察大鼠生命状态,每天7 h [15-16]。(4)肥甘厚味:脂肪乳按10 mL/kg灌胃。以上方法连续进行10 d,进行气虚证评分,然后用线栓法制作MCAO-R模型。
1.2.2. 改良线栓法制作MCAO-R模型
(1)激光多普勒仪动态监测局部脑血流量(rCBF):分别在造模过程中插线后5 min、缺血再灌注2 h及造模后7 d监测大鼠rCBF。选取手术侧梗死灶及其周边组织作为监测区域。大鼠麻醉后俯卧,常规消毒沿颅骨正中偏右切开皮肤及皮下组织,钝性分离筋膜,暴露颅骨,定位头部右侧距矢状缝2 mm,冠状缝前1mm处,生物胶将激光多普勒仪的探头座固定于此,安装连接探头,常规调试仪器和校零[17]。
(2)模型制作方法:参照Longa EZ法[18]并加以改良。麻醉大鼠,将四肢及头部仰卧固定于消毒后木板上,头部后方木板开一小孔以连接激光多普勒仪探头;钝性分离,分离暴露颈总动脉、颈外动脉、颈内动脉,电凝颈外动脉分支,电凝翼腭动脉;从颈外动脉两结扎处中间剪断,向下拉颈外动脉使之与颈内动脉成直线,在颈外动脉近游离端斜剪“V”形切口并插入栓线,此时在颈外动脉近游离端连同栓线一起结扎但不系紧(以免调整角度后继续插入困难);调整角度和方向后继续将栓线插入颈内动脉约18.0±0.5 mm(至感觉有少许阻力为止)。2 h后拔出栓线少许(约5 mm)造成缺血再灌注损伤。
手术过程中用激光多普勒仪监测缺血区局部脑血流量,再灌注之前rCBF降低到开始水平的70%以上且同时满足以下条件方为“病证结合”模型制作成功:苏醒后(再灌注2 h后)神经功能缺损评分为2~3分,气虚证评分10~20分以及血瘀证评分10~20分[19-22]。
1.2.3. 模型生物学特征评分量化标准
(1)神经功能缺损评分(NFDS):在大鼠术后苏醒后进行神经功能缺损评分,评分标准:A-无神经功能缺损症状(0分);B-不能完全伸展对侧前爪(1分);C-行走时向对侧转圈(2分);D-站立或行走时向对侧倾倒(3分);E-不能自发行走,意识丧失(4分)。
(2)气虚证评分(QDSS):根据大鼠气虚证辩证量表:A-精神萎顿,四肢倦缩,活动性差(3分);倦怠嗜睡,精神萎顿(5分);对抗性行为减少或消失(7分);B-毛发干枯失去光泽(3分);毛结穗打卷(5分);毛发稀疏易落(7分);C-不思饮食,轻度大便稀溏(3分);不思饮食,中度大便稀溏(5分);不思饮食,重度大便稀溏或黄绿褐粘臭便(7分)。
(3)血瘀证评分(BSSS):根据大鼠血瘀证辩证量表:A-舌质黯淡(3分);舌质绛紫(5分);B-眼球由鲜红色转为淡红(3分);转为暗红(5分);C-尾部自尖至根部出现皮肤色泽暗淡(3分);略显瘀紫(5分)。
MCAO-R气虚血瘀证大鼠模型制作成功标准:① 神经功能缺损评分2~3分;② 气虚证评分10~20分;③ 血瘀证评分10~20分。
1.2.4. TTC染色测定脑梗死体积
取冰冻大脑从视交叉处由额极到枕极连续切2 mm厚冠状脑片,1% TTC溶液37 ℃孵育30 min。正常脑组织染成玫瑰色,梗死区现苍白色。10%甲醛缓冲液4 ℃固定24 h拍照,Image-ProPlus 6.0分析计算梗死体积百分比。公式V= t(A1+A2+···+An)计算梗死体积和大脑体积(V:体积;t:脑片厚度;A:面积;n:脑片数)。梗死体积=梗死面积×厚度。相对梗死体积(V%)=梗死体积/大脑体积×100%。
1.2.5. NSC增殖检测
巢蛋白(Nestin,神经干细胞特异性标记蛋白)、5-溴脱氧尿苷嘧啶(BrdU,标记脑内神经干细胞增殖),以Nestin、BrdU表达检测NSC及自我更新能力。
增殖活性细胞标记(BrdU标记法):BrdU用于标记S期新生细胞以确定增生细胞位置和数量。给药前配制浓度1.5%的BrdU溶液,220 μm滤膜滤过。于手术当天开始腹腔注射,每次50 mg/kg,4 h/次,共3次,术后第2天开始每天1次,每次50 mg/kg。
Nestin免疫组化显色(ABC):切片脱蜡至水,抗原修复,封闭,一抗37 ℃孵育,一抗为小鼠抗Nestin单克隆抗体(1:500),生物素标记羊抗鼠IgG孵育,37 ℃恒温1 h,加ABC(1:200),37 ℃恒温1 h,DAB显色。苏木素复染核,脱水,透明,封片。空白对照片一抗用0.01 mol PBS代替。
BrdU免疫荧光化学:切片脱蜡至水,抗原修复,DNA变性处理,封闭,一抗37 ℃孵育,4 ℃放置72 h。一抗为小鼠抗BrdU单克隆抗体(1:1000),Cy3标记羊抗鼠IgG孵育,37 ℃恒温1 h,封片。空白对照片一抗用0.01 MPBS代替。
1.2.6. 荧光定量PCR检测miR-124表达
Trizol试剂盒提取总RNA,一步法miRNA定量反应体系:2 × one-step qPCR mix 10 μL,上游引物(10 μmol)、下游引物(10 μmol)、RT primer(10 μmol)各0.4 μL,RNA模板100 ng,DEPC-H2O补足至20 μL,内参RT primer用DEPC-H2O代替。反应条件:反转录循环数1,温度37~ 42 ℃ 60 min,变形循环数1,95 ℃ 10 min,95 ℃ 20 s,扩增循环数35~45,62 ℃ 30 s,72 ℃ 30 s。2-△△Ct计算相对表达量。
1.2.7. Western blot检测Wnt3a、GSK3β和β-catenin蛋白表达
常规蛋白提取、电泳、转膜、封闭,一抗为1:500稀释兔抗鼠wnt3a、GSK3β、β-catenin单克隆抗体,1:10 000比例用二抗稀释液稀释辣根过氧化物酶(HRP)标记,显色、显影、定影、摄像。BANDSCAN软件条带分析,计算灰度值,以与β-actin灰度值比值作为相对表达量。
1.2.8. 图像采集与统计学分析
取灌注固定取材冠状切片,每张切片在额顶叶皮质部位均选取同倍3个不同视野,采用图象分析系统(倒置显微镜、照相装置、ImageJ软件)计算每个视野的免疫阳性细胞(BrdU +细胞、Nestin+细胞、BrdU/NSE细胞)数目、阳性细胞总面积或平均光密度,数据统计分析和制图应用SPSS21.0、Graphpad6.0,计量资料结果全部采用均数±标准差表示,采用单因素方差分析,正态性和方差齐性检验,方差齐时用最小显著法(LSD)进行两两较,方差不齐时用Games-Howell法,P < 0.05为差异具有统计学意义。
2. 结果
2.1. 神经功能缺损评分及气虚血瘀证评分比较
与正常组比较,模型组、脑络欣通组和通心络组大鼠神经功能缺损评分明显升高,差异有统计学意义(P < 0.01)。模型组气虚证评分明显升高,模型组、脑络欣通组和通心络组血瘀证评分明显升高(P < 0.01);与模型组比较,脑络欣通组和通心络组神经功能缺损评分、气虚证评分和血瘀证评分明显降低(P < 0.01);脑络欣通组和通心络组比较,差异均无统计学意义(P>0.05,表 1)。
1.
各组大鼠神经功能缺损评分、气虚证评分、血瘀证评分
NFDS, QDSS, and BSSS scores in 4 groups (Mean±SD, n=6)
| Group | NFDS | QDSS | BSSS |
| *P < 0.01 vs Con group. #P < 0.01 vs Mod group. Con: Control group; Mod: Model group; NLXT: Naoluoxintong group; TXL: Tongxinluo group. NFDS: Neural function defect score, QDSS: Qi deficiency syndrome score, BSSS: Blood stasis syndrome score. | |||
| Con | 0.00±0.00 | 9.38±1.19 | 7.46±0.94 |
| Mod | 2.75±0.46* | 18.00±0.76* | 16.70±1.23* |
| NLXT | 1.50±0.53*# | 8.88±1.25# | 7.85±0.83*# |
| TXL | 1.63±0.52*# | 8.87±0.83# | 8.84±0.76*# |
| F | 53.124 | 152.12 | 130.131 |
2.2. 脑梗死体积变化
正常大鼠脑组织被染成玫瑰色,而梗死区呈现苍白色。正常组大鼠脑组织无梗死变化,模型组、脑络欣通组和通心络组大鼠脑梗死体积明显变大;与模型组比较,脑络欣通组和通心络组大鼠脑梗死体积变小;脑络欣通组和通心络组比较,大鼠脑梗死体积无明显变化。
2.3. 局部脑血流量比较
与正常组比较,模型组大鼠在插线后5 min、缺血再灌注2 h和第7天rCBF明显降低,差异有统计学意义(P < 0.01)。脑络欣通组和通心络组大鼠在插线后5 min和缺血再灌注2 h rCBF降低(P < 0.01);与模型组比较,脑络欣通组和通心络组大鼠第7天rCBF明显升高(P < 0.01,表 2)。
2.
各组大鼠局部脑血流量
Regional cerebral blood flow (rCBF) in the 4 groups (Mean±SD, n=6, PU)
| Group | 5 min rCBF | 2 h rCBF | 7 d rCBF |
| ☆ P < 0.01 vs Con group. ▲ P < 0.01 vs Mod group. rCBF: Regional cerebral blood flow. | |||
| Con | 122.37±9.83 | 121.91±10.12 | 122.19±9.98 |
| Mod | 11.08±1.15☆ | 91.50±6.12☆ | 96.21±5.62☆ |
| NLXT | 11.06±1.08☆ | 91.40±5.87☆ | 117.11±9.71▲ |
| TXL | 11.07±1.10☆ | 90.45±3.55☆ | 115.77±9.74▲ |
| F | 987.184 | 40.63 | 13.013 |
2.4. 各组大鼠额顶叶皮质BrdU的表达
免疫荧光染色结果显示正常组额顶叶皮质BrdU少量表达,模型组阳性细胞核形态以圆形和椭圆为主,体积变大,有增多趋势。脑络欣通和通心络组BrdU表达进一步增强。与正常组比较,其他3组阳性细胞数明显增多,差异具有统计学意义(P < 0.01);与模型组比较,脑络欣通和通心络组显著增多(P < 0.01,图 1,表 3)。
1.
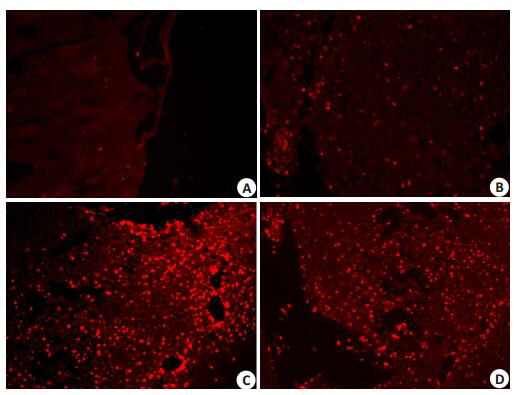
各组大鼠额顶叶皮质BrdU的表达,胞核呈红色荧光
Number of BrdU + cells in the cortex of rats in each group (Cy3, original magnification: ×200). A: Con; B: Mod. C: NLXT. D: TXL.
3.
各组大鼠额顶叶皮质BrdU阳性细胞数比较
Number of BrdU+ cells in cortex in 4 groups (Mean± SD, n=6)
| Group | BrdU+ |
| △P < 0.01 vs Con group. ▲P < 0.01 vs Mod group. | |
| Con | 12.17±2.32 |
| Mod | 61.50±5.09△ |
| NLXT | 214.33±9.03△▲ |
| TXL | 218.50±9.89△▲ |
| F | 1271.432 |
2.5. 各组大鼠额顶叶皮质Nestin的表达
与正常组比较,其他3组Nestin的表达明显增强,差异具有统计学意义(P < 0.01);与模型组比较,脑络欣通和通心络组Nestin的表达明显增强(P < 0.01,表 4,图 2)。
4.
各组大鼠额顶叶皮质Nestin平均光密度比较
A of nestin in cortex in 4 groups (Mean±SD, n=6)
| Group | Nestin(A) | ||
| △P < 0.01 vs Con group. ▲P < 0.01 vs Mod group. A: Absorbtion. | |||
| Con | 0.20±0.01 | ||
| Mod | 0.27±0.02△ | ||
| NLXT | 0.30±0.02△▲ | ||
| TXL | 0.32±0.02△▲ | ||
| F | 46.086 | ||
2.
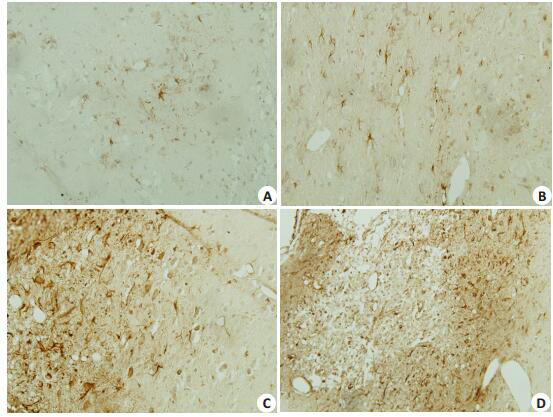
各组大鼠额顶叶皮质Nestin的表达,胞浆呈棕色
Expression level of nestin in the cortex of rats in each group (SABC, ×400). A: Con; B: Mod. C: NLXT. D: TXL.
2.6. 各组大鼠额顶叶皮质miR-124的表达
与正常组比较,其他3组大鼠额顶叶皮质miR-124相对表达量升高(P < 0.01或P < 0.05);与模型组比较,脑络欣通组和通心络组miR-124相对表达量明显降低(P < 0.01);与脑络欣通组比较,通心络组miR-124相对表达量降低(P < 0.01,表 5)。
5.
各组大鼠额顶叶皮质miR-124平均相对表达量
Relative level of miR-124 in cortex in 4 groups (Mean± SD, n=6)
| Group | miR-124 |
| △P < 0.01, ▲P < 0.05 vs Con group; ☆P < 0.01 vs Mod group; ★P < 0.01 vs NLXT group. | |
| Con | 0.7935±0.06 |
| Mod | 1.4221±0.13△ |
| NLXT | 1.1373±0.10△☆★ |
| TXL | 0.9278±0.07▲☆ |
| F | 51.118 |
2.7. 各组大鼠额顶叶皮质Wnt3a、GSK3β和β-catenin蛋白的表达
与正常组比较,其他3组的Wnt3a、GSK3β表达增多,模型组的β-catenin表达显著减少(P < 0.01);与模型组比较,脑络欣通组和通心络组Wnt3a表达减少,而β-catenin表达显著增多(P < 0.01);与脑络欣通组比较,通心络组Wnt3a表达减少(P < 0.01);值得一提的是,与模型组比较脑络欣通组和通心络组GSK3β表达无明显差异(P>0.05,表 6,图 3)。
6.
各组大鼠额顶叶皮质Wnt3a、GSK3β、β-catenin平均相对表达量
Relative level of Wnt3a、GSK3β、β-catenin in cortex in 4 groups (Mean±SD, n=6)
| Group | Wnt3a | GSK3β | β-catenin |
| △ P < 0.01 vs Con group; ▲ P < 0.01 vs Mod group; ☆ P < 0.01 vs NLXT group. | |||
| Con | 0.4450±0.03 | 0.8600±0.05 | 0.4750±0.04 |
| Mod | 0.9417±0.05△ | 1.2500±0.03△ | 0.2200±0.01△ |
| NLXT | 0.7350±0.04△▲ | 1.2517±0.03△ | 0.4867±0.03▲ |
| TXL | 0.6233±0.03△▲☆ | 1.2500±0.03△ | 0.4917±0.03▲ |
| F | 179.515 | 191.602 | 130.131 |
3.
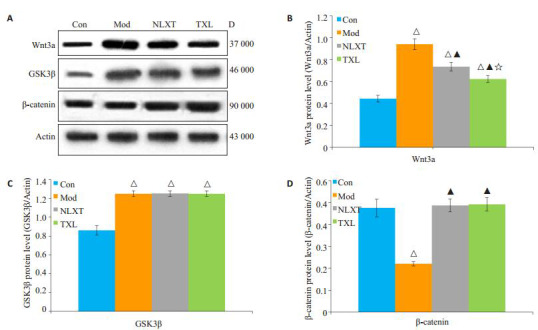
各组大鼠额顶叶皮质Wnt3a、GSK3β、β-catenin平均相对表达量
Relative level of Wnt3a, GSK3β and β-catenin in the cortex of rats in each group. A: Western boltting; B-D: Quantitative analysis of Wnt3a, GSK3β, andβ-catenin protein expressions. △P < 0.01 vs Con group. ▲P < 0.01 vs Mod group. ☆P < 0.01 vs NLXT group. Con: Control group; Mod: Model group; NLXT: Naoluoxintong group; TXL: Tongxinluo group.
3. 讨论
新安王氏内科是新安医学流派的重要一支,其特色治法及验方在临床实践中取得显著疗效[23-24],前期基础与临床研究中发现益气活血通络法在缺血性脑病的防治中有明显作用。“病证结合”是中西医结合研究的切入点,课题组致力于MCAO-R气虚血瘀病证结合模型的制作和应用研究。多因素模拟中医病因方面有理论和实验基础,“饥饿”因素模拟根据中医理论饥饿不能化生水谷精微则气血生化乏源;“疲劳”模拟根据“劳则气耗”理论;“低氧”模拟根据宗气生成理论,“清气”吸入不足则宗气不生,进而影响气血化生和运行[16-17]。研究表明[25-27],miR-124在脑组织中特异性表达且呈富集性,可调控NSC增殖分化过程。Wnt通路是一条多环节调控神经细胞增殖分化的关键途径。Wnt抑制GSK-3β活性使其失去结合β-catenin能力,从而阻断β-catenin被GSK-3β磷酸化的蛋白酶体降解,使β-catenin聚集,β-catenin异常积聚被认为是经典wnt通路激活的重要标志。研究发现,miR-124通过作用于基因wnt3a和wnt5a而发挥对Wnt/β-catenin信号通路的调控作用[28-30]。
本实验结果表明,脑络欣通可显著恢复模型大鼠神经功能,并且降低QDSS和BSSS,说明脑络欣通可以显著改善模型大鼠的气虚血瘀证候,在一定程度上减少脑梗死体积,局部脑血流量增加,结合激光多普勒仪检测结果,通过分析相关数据结果发现脑络欣通改善模型大鼠气虚血瘀证表现的作用与其提高局部脑血流量、改善神经功能缺损等存在正相关性(表 1、2),这其中恢复rCBF是重要途径之一,但是具体最佳时间窗的把握需要后续进一步研究,尤其在实验时间点的设置方面需要系统综合把握。免疫组化结果显示,脑络欣通可提高缺血脑组织nestin表达,模型组阳性细胞核形态以圆形和椭圆为主,体积变大,有增多趋势,脑络欣通BrdU表达进一步增强,结合BrdU免疫荧光实验结果,说明其对NSC增殖有促进作用。
在分子生物学实验方面,脑络欣通可降低miR-124在模型大鼠脑组织中的应激性高表达,继而影响和调控Wnt信号通路,最终促进β-catenin的表达而发挥对NSC增殖分化的调控作用。但是在实验中发现,脑络欣通对模型大鼠GSK-3β的表达并无显著影响(P>0.05,图 7C),这与经典Wnt信号通路的调控机制不完全相符,可能涉及到更复杂的基因调控机制,这也给课题组今后的研究提供了思路,如适当选择抑制剂对Wnt通路进行靶向性抑制,从而探讨脑络欣通通过影响miR-124表达而干预Wnt通路对NSC增殖的可能调控机制。同时,本实验尚缺少动态观察的实验资料,尤其随着时间的推移在自身修复作用和药物作用之间的相关性研究需要进一步探讨。由于中药复方成分复杂,目前观察多局限于效应本身或单一层次,缺乏系统研究,作用机制及有效成分较少深入探讨。
Biography
谭辉, 硕士, E-mail: tanhui185@163.com
Funding Statement
国家自然科学基金青年项目(81603523); 安徽省高校自然科学研究重点项目(KJ2016A404); 国家科技支撑计划(2012BAI26B00)
Supported by National Natural Science Foundation of China (81603523)
Contributor Information
谭 辉 (Hui TAN), Email: tanhui185@163.com.
王 键 (Jian WANG), Email: 13695602939@163.com.
References
- 1.Altintas O, Ozgen Altintas M, Kumas M, et al. Neuroprotective effect of ischemic preconditioning via modulating the expression ofcerebral miRNAs against transient cerebral ischemia in diabetic rats. Neurol Res. 2016;38(11):1003–11. doi: 10.1080/01616412.2016.1232013. [Altintas O, Ozgen Altintas M, Kumas M, et al. Neuroprotective effect of ischemic preconditioning via modulating the expression ofcerebral miRNAs against transient cerebral ischemia in diabetic rats[J]. Neurol Res, 2016, 38(11): 1003-11.] [DOI] [PubMed] [Google Scholar]
- 2.Min XL, Wang TY, Cao Y, et al. MicroRNAs: a novel promising therapeutic target for cerebral ischemia/reperfusion injury. Neural Regen Res. 2015;10(11):1799–808. doi: 10.4103/1673-5374.170302. [Min XL, Wang TY, Cao Y, et al. MicroRNAs: a novel promising therapeutic target for cerebral ischemia/reperfusion injury[J]. Neural Regen Res, 2015, 10(11): 1799-808.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Cai Q, Wang T, Yang WJ, et al. Protective mechanisms of microRNA-27a against oxygen-glucose deprivation-induced injuries in hippocampal neurons. Neural Regen Res. 2016;11(8):1285–92. doi: 10.4103/1673-5374.189194. [Cai Q, Wang T, Yang WJ, et al. Protective mechanisms of microRNA-27a against oxygen-glucose deprivation-induced injuries in hippocampal neurons[J]. Neural Regen Res, 2016, 11(8): 1285-92.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Li JA, Zan CF, Xia P, et al. Key genes expressed in different stages of spinal cord ischemia/reperfusion injury. Neural Regen Res. 2016;11(11):1824–9. doi: 10.4103/1673-5374.194754. [Li JA, Zan CF, Xia P, et al. Key genes expressed in different stages of spinal cord ischemia/reperfusion injury[J]. Neural Regen Res, 2016, 11(11): 1824-9.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Yu B, Zhou S, Yi S, et al. The regulatory roles of non-coding RNAsin nerve injury and regeneration. Prog Neurobiol. 2015;134:122–39. doi: 10.1016/j.pneurobio.2015.09.006. [Yu B, Zhou S, Yi S, et al. The regulatory roles of non-coding RNAsin nerve injury and regeneration[J]. Prog Neurobiol, 2015, 134: 122-39.] [DOI] [PubMed] [Google Scholar]
- 6.Zhu F, Liu JL, Li JP, et al. MicroRNA-124(miR-124) regulates Ku70 expression and is correlated with neuronal death induced by ischemia/reperfusion. J Mol Neurosci. 2014;52(1):148–55. doi: 10.1007/s12031-013-0155-9. [Zhu F, Liu JL, Li JP, et al. MicroRNA-124(miR-124) regulates Ku70 expression and is correlated with neuronal death induced by ischemia/reperfusion[J]. J Mol Neurosci, 2014, 52(1): 148-55.] [DOI] [PubMed] [Google Scholar]
- 7.Mucaj V, Lee SS, Skuli N, et al. MicroRNA-124 expression counteracts pro-survival stress responses in glioblastoma. Oncogene. 2015;34(17):2204–14. doi: 10.1038/onc.2014.168. [Mucaj V, Lee SS, Skuli N, et al. MicroRNA-124 expression counteracts pro-survival stress responses in glioblastoma[J]. Oncogene, 2015, 34(17): 2204-14.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Wang Z, Dai X, Chen Y, et al. MiR-30a-5p is induced by Wnt/ β-catenin pathway and promotes glioma cell invasion by repressing NCAM. Biochem Biophys Res Commun. 2015;465(3):374–80. doi: 10.1016/j.bbrc.2015.08.007. [Wang Z, Dai X, Chen Y, et al. MiR-30a-5p is induced by Wnt/ β-catenin pathway and promotes glioma cell invasion by repressing NCAM[J]. Biochem Biophys Res Commun, 2015, 465(3): 374-80.] [DOI] [PubMed] [Google Scholar]
- 9.Sun X, He Y, Huang C, et al. Distinctive microRNA signature associated of neoplasms with the Wnt/β-catenin signaling pathway. Cell Signal. 2013;25(12):2805–11. doi: 10.1016/j.cellsig.2013.09.006. [Sun X, He Y, Huang C, et al. Distinctive microRNA signature associated of neoplasms with the Wnt/β-catenin signaling pathway[J]. Cell Signal, 2013, 25(12): 2805-11.] [DOI] [PubMed] [Google Scholar]
- 10.Wu L, Liu T, Xiao Y, et al. Polygonatum odoratum lectin induces apoptosis and autophagy by regulation of microRNA-1290 and microRNA-15a-3p in human lung adenocarcinoma A549 cells. Int J Biol Macromol. 2016;85:217–26. doi: 10.1016/j.ijbiomac.2015.11.014. [Wu L, Liu T, Xiao Y, et al. Polygonatum odoratum lectin induces apoptosis and autophagy by regulation of microRNA-1290 and microRNA-15a-3p in human lung adenocarcinoma A549 cells[J]. Int J Biol Macromol, 2016, 85: 217-26.] [DOI] [PubMed] [Google Scholar]
- 11.何 玲, 王 键. 新安医家验方脑络欣通改善缺血性中风作用机制研究的思路与方法. http://www.cnki.com.cn/Article/CJFDTOTAL-BXYY201705007.htm. 中华中医药杂志. 2017;32(5):1921–5. [何玲, 王键.新安医家验方脑络欣通改善缺血性中风作用机制研究的思路与方法[J].中华中医药杂志, 2017, 32(5): 1921-5.] [Google Scholar]
- 12.杨 文明, 李 祥, 王 键, et al. 脑络欣通治疗脑梗死恢复期气虚血瘀证的临床研究. 中西医结合心脑血管病杂志. 2013;11(12):1424–6. doi: 10.3969/j.issn.1672-1349.2013.12.007. [杨文明, 李祥, 王键, 等.脑络欣通治疗脑梗死恢复期气虚血瘀证的临床研究[J].中西医结合心脑血管病杂志, 2013, 11(12): 1424-6.] [DOI] [Google Scholar]
- 13.谭 辉, 王 键, 尹 婷婷, et al. 脑络欣通方对脑缺血大鼠血管再生及局部脑血流量的影响. http://www.cnki.com.cn/Article/CJFDTOTAL-ZSFX201522010.htm. 中国实验方剂学杂志. 2015;21(22):21–5. [谭辉, 王键, 尹婷婷, 等.脑络欣通方对脑缺血大鼠血管再生及局部脑血流量的影响[J].中国实验方剂学杂志, 2015, 21(22): 21-5] [Google Scholar]
- 14.谭 辉, 王 键, 尹 婷婷, et al. 基于肝功能安全剂量选择的脑络欣通复方对脑缺血再灌注模型大鼠血管新生及局部脑血流量的影响. http://www.cnki.com.cn/Article/CJFDTOTAL-ZZYZ201614018.htm. 中医杂志. 2016;57(14):1231–6. [谭辉, 王键, 尹婷婷, 等.基于肝功能安全剂量选择的脑络欣通复方对脑缺血再灌注模型大鼠血管新生及局部脑血流量的影响[J].中医杂志, 2016, 57(14): 1231-6.] [Google Scholar]
- 15.Nakajima W, Ishida A, Takada G. Anoxic and hypoxic immature ratmodel for measurement of monoamine using in vivo microdialysis. Brain Res Brain Res Protoc. 1999;3(3):252–6. doi: 10.1016/S1385-299X(98)00046-4. [Nakajima W, Ishida A, Takada G. Anoxic and hypoxic immature ratmodel for measurement of monoamine using in vivo microdialysis[J]. Brain Res Brain Res Protoc, 1999, 3(3): 252-6.] [DOI] [PubMed] [Google Scholar]
- 16.胡 定煜, 李 浡, 戴 荣继, et al. 常压低氧下Wistar大鼠脑组织中HIF-1α表达与脑损伤. http://www.cnki.com.cn/Article/CJFDTOTAL-HXTB201011013.htm. 化学通报:印刷版. 2010;73(11):1030–4. [胡定煜, 李浡, 戴荣继, 等.常压低氧下Wistar大鼠脑组织中HIF-1α表达与脑损伤[J].化学通报:印刷版, 2010, 73(11): 1030-4.] [Google Scholar]
- 17.Du Y, Shi L, Li J, et al. Angiogenesis and improved cerebral blood flow in the ischemic boundary area were detected after electroacupuncture treatment to rats with ischemic stroke. Neurol Res. 2011;33(1):101–7. doi: 10.1179/016164110X12714125204317. [Du Y, Shi L, Li J, et al. Angiogenesis and improved cerebral blood flow in the ischemic boundary area were detected after electroacupuncture treatment to rats with ischemic stroke[J]. Neurol Res, 2011, 33(1): 101-7.] [DOI] [PubMed] [Google Scholar]
- 18.Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 1989;20(1):84–91. doi: 10.1161/01.STR.20.1.84. [Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91.] [DOI] [PubMed] [Google Scholar]
- 19.王 世全, 余 良, 郭 宁, et al. 白藜芦醇对大鼠局灶性脑缺血再灌注的治疗作用. http://www.cnki.com.cn/Article/CJFDTOTAL-SWCX201216016.htm. 现代生物医学进展. 2012;12(16):3057–9. [王世全, 余良, 郭宁, 等.白藜芦醇对大鼠局灶性脑缺血再灌注的治疗作用[J].现代生物医学进展, 2012, 12(16): 3057-9.] [Google Scholar]
- 20.米 海霞, 张 通, 缪 培, et al. 早期运动训练对大鼠局灶性脑缺血后运动功能及磁共振弥散张量成像的影响. http://www.cnki.com.cn/Article/CJFDTOTAL-ZKLS201601001.htm. 中国康复理论与实践. 2016;22(1):1–7. [米海霞, 张通, 缪培, 等.早期运动训练对大鼠局灶性脑缺血后运动功能及磁共振弥散张量成像的影响[J].中国康复理论与实践, 2016, 22(1): 1-7.] [Google Scholar]
- 21.邓 铁涛, 李 慧德. 中医证候规范. 广州: 广东科技出版社; 1990. pp. 145–7. [邓铁涛, 李慧德.中医证候规范[M].广州:广东科技出版社, 1990: 145-7.] [Google Scholar]
- 22.匡 调元, 王 庆其. 中医证候病理学. 上海: 上海科学普及出版社; 1995. p. 89. [匡调元, 王庆其.中医证候病理学[M].上海:上海科学普及出版社, 1995: 89.] [Google Scholar]
- 23.汪 瀚, 杨 文明, 李 祥, et al. 脑络欣通治疗颈动脉粥样硬化38例. http://www.cnki.com.cn/Article/CJFDTOTAL-AHZY201301011.htm. 安徽中医学院学报. 2013;32(1):28–30. [汪瀚, 杨文明, 李祥, 等.脑络欣通治疗颈动脉粥样硬化38例[J].安徽中医学院学报, 2013, 32(1): 28-30.] [Google Scholar]
- 24.陈 城, 鲁 德甫, 杨 文明. 脑络欣通颗粒对脑梗死急性期气虚血瘀证抗氧化低密度脂蛋白抗体和C反应蛋白的影响. http://www.cnki.com.cn/Article/CJFDTOTAL-AHLC201511031.htm. 中医药临床杂志. 2015;27(11):1580–3. [陈城, 鲁德甫, 杨文明.脑络欣通颗粒对脑梗死急性期气虚血瘀证抗氧化低密度脂蛋白抗体和C反应蛋白的影响[J].中医药临床杂志, 2015, 27(11): 1580-3.] [Google Scholar]
- 25.Zhu F, Liu JL, Li JP, et al. MicroRNA-124(miR-124) regulates Ku70 expression and is correlated with neuronal death induced by ischemia/reperfusion. J Mol Neurosci. 2014;52(1):148–55. doi: 10.1007/s12031-013-0155-9. [Zhu F, Liu JL, Li JP, et al. MicroRNA-124(miR-124) regulates Ku70 expression and is correlated with neuronal death induced by ischemia/reperfusion[J]. J Mol Neurosci, 2014, 52(1): 148-55.] [DOI] [PubMed] [Google Scholar]
- 26.Liu T, Im W, Mook-Jung I, et al. MicroRNA-124 slows down the progression of Huntington's disease by promoting neurogenesis in the striatum. Neural Regen Res. 2015;10(5):786–91. doi: 10.4103/1673-5374.156978. [Liu T, Im W, Mook-Jung I, et al. MicroRNA-124 slows down the progression of Huntington's disease by promoting neurogenesis in the striatum[J]. Neural Regen Res, 2015, 10(5): 786-91.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.吴 光勇, 李 亮, 廖 达光, et al. Apelin-13对大鼠局灶性脑缺血-再灌注损伤的保护作用. http://www.j-smu.com/oa/DArticle.aspx?type=view&id=2015091335. 南方医科大学学报. 2015;35(9):1335–9. [吴光勇, 李亮, 廖达光, 等. Apelin-13对大鼠局灶性脑缺血-再灌注损伤的保护作用[J].南方医科大学学报, 2015, 35(9): 1335-9.] [PubMed] [Google Scholar]
- 28.沈 兆星, 肖 谦, 赵 宇星, et al. Ghrelin对糖尿病大鼠海马DKK-1表达和学习记忆功能的影响. http://www.j-smu.com/oa/DArticle.aspx?type=view&id=201604500. 南方医科大学学报. 2016;36(4):500–5. [沈兆星, 肖谦, 赵宇星, 等. Ghrelin对糖尿病大鼠海马DKK-1表达和学习记忆功能的影响[J].南方医科大学学报, 2016, 36(4): 500-5.] [PubMed] [Google Scholar]
- 29.Huyghe A, Van Den Ackerveken P, Sacheli R, et al. MicroRNA-124 regulates cell specification in the cochlea through modulation of Sfrp4/5. Cell Rep. 2015;13(1):31–42. doi: 10.1016/j.celrep.2015.08.054. [Huyghe A, Van Den Ackerveken P, Sacheli R, et al. MicroRNA-124 regulates cell specification in the cochlea through modulation of Sfrp4/5[J]. Cell Rep, 2015, 13(1): 31-42.] [DOI] [PubMed] [Google Scholar]
- 30.Zhou S, Ding F, Gu X. Non-coding RNAs as emerging regulators of neural injury responses and regeneration. Neurosci Bull. 2016;32(3):253–64. doi: 10.1007/s12264-016-0028-7. [Zhou S, Ding F, Gu X. Non-coding RNAs as emerging regulators of neural injury responses and regeneration[J]. Neurosci Bull, 2016, 32(3): 253-64] [DOI] [PMC free article] [PubMed] [Google Scholar]


