Environ 18 % des adultes canadiens consomment du cannabis, ce qui représente une augmentation par rapport aux 14 % d’avant la légalisation de la marijuana à des fins récréatives1. Par ailleurs, moins de 2 % des Canadiens sont des utilisateurs inscrits de cannabis médical2,3. La douleur chronique motive fréquemment le recours au cannabis4,5. Parce que la douleur neuropathique, un sous-ensemble de la douleur chronique, affecte environ 8 % des patients et est difficile à contrôler adéquatement, tant pour les médecins que pour les patients, il est important de comprendre les thérapies aux cannabinoïdes (p. ex. cannabinoïdes d’ordonnance ou cannabis) (Encadré 1)6–9. Le présent article passe en revue les données probantes concernant les cannabinoïdes pour la douleur neuropathique réfractaire, et met en évidence des outils à l’intention des médecins de famille en quête de conseils pratiques pour recommander, autoriser, prescrire et surveiller les cannabinoïdes. Nous reconnaissons la diversité des points de vue sur le rôle des cannabinoïdes, et nous offrons de multiples facteurs à considérer.
Encadré 1. Aperçu et définitions.
Aperçu de la terminologie pertinente :
Cannabinoïde : tout composé qui active un récepteur cannabinoïde (p. ex. cannabinoïde d’ordonnance et cannabis). Les plus étudiés, mais encore mal compris, sont le THC et le CBD
Récepteurs cannabinoïdes : les récepteurs CB1 (principalement dans les systèmes nerveux central et périphérique) et les récepteurs CB2 (principalement dans le système immunitaire) font partie du système endocannabinoïde
Cannabinoïdes d’ordonnance : nabilone ou nabiximols (voir le Tableau 19 pour plus de détails)
Cannabis : marijuana; accessible légalement auprès d’un producteur ou d’un détaillant autorisé
Producteur autorisé : réglementé par Santé Canada; exige que les prescripteurs autorisent le cannabis médical au moyen d’un document médical
Détaillant autorisé : détaillant réglementé ou dispensaire autorisé; sous réglementation de chaque province ou territoire, en tant que boutique exploitée par le gouvernement, boutique privée autorisée ou en ligne. Une supervision médicale n’est pas exigée
CBD—cannabidiol, THC—tétrahydrocannabinol.
Description du cas : M. Wilson
M. Wilson, un homme de 81 ans qui vit de manière autonome avec sa conjointe, est l’un de vos patients depuis longtemps. Il y a 3 semaines, il s’est rendu à l’urgence en raison d’étourdissements qui ont presque provoqué une chute, et on lui a recommandé de faire un suivi auprès de son médecin de famille si les étourdissements persistaient.
Parmi ses antécédents médicaux figurent une douleur neuropathique secondaire à un diabète de type 2 de longue date, à l’arthrose lombaire et à une insomnie chronique. C’est un ex-fumeur. Le résumé du congé de l’urgence indique que les résultats de la tomodensitométrie du cerveau étaient normaux, et que les analyses en laboratoire révélaient que l’hémogramme complet, les tests de la fonction rénale, les dosages d’électrolytes et les tests aléatoires de glycémie se situaient tous dans la normale. Les mesures récentes de l’hémoglobine A1c étaient de 7,5 %. Sa pression artérielle était de 128/84 mm Hg, sans baisse orthostatique, et sa fréquence cardiaque de 72 battements/minute. On a procédé à des évaluations neurologiques et cardiaques sans trouver de maladie sous-jacente. Les constatations à la manœuvre de Dix-Hallpike étaient négatives.
Selon vos dossiers, M. Wilson prend actuellement 75 mg de prégabaline 2 fois par jour, 60 mg de duloxétine par jour, 850 mg de f metformine 2 fois par jour, 40 unités d’insuline glargine le soir, 20 mg de rosuvastatine par jour, 5 mg de ramipril par jour, 7,5 mg de zopiclone au coucher au besoin (2 ou 3 fois par semaine) et 1000 unités de vitamine D par jour. Vous vous rappelez l’échec d’un essai de nortriptyline il y a quelques années (en raison de la somnolence et de la constipation à une dose de 100 mg au coucher), mais après avoir changé pour la prégabaline, M. Wilson avait signalé une certaine amélioration. Il y a environ 1 an, vous aviez ajouté la duloxétine, et M. Wilson avait rapporté un plus grand soulagement de sa neuropathie diabétique. De plus, M. Wilson a antérieurement affirmé qu’il veut éviter les opioïdes « à tout prix ».
M. Wilson se sent encore étourdi et l’examen d’aujourd’hui révèle une pression artérielle et une fréquence cardiaque de 120/70 mm Hg et 68 battements/minute respectivement, sans hypotension positionnelle. Vous confirmez avec lui sa pharmacothérapie actuelle, sans changement depuis plusieurs mois. Par contre, lors de votre dépistage habituel de l’utilisation de cannabinoïdes, vous apprenez que le fils de M. Wilson lui a donné de l’huile de cannabidiol (CBD) il y a 3 mois pour l’aider à soulager sa douleur névralgique. Vous demandez à M. Wilson de répondre au questionnaire CUDIT-R (sigle en anglais pour identification d’un trouble de consommation de cannabis - révisé) (https://bpac.org.nz/BPJ/2010/June/docs/addiction_CUDIT-R.pdf), et son score est de 4, ce qui indique l’absence d’une utilisation problématique de cannabis10.
Importance du dépistage des cannabinoïdes
Étant donné la prévalence de l’utilisation du cannabis, son dépistage est important, même chez les adultes plus âgés. Les patients pourraient envisager l’automédication avec du cannabis pour diverses raisons, comme la croyance que le cannabis est une solution de rechange « naturelle » (donc « sécuritaire »), ou pour régler des problèmes médicaux qui ne sont pas suffisamment soulagés par leur pharmacothérapie actuelle9. Les renseignements sur les cannabinoïdes d’ordonnance (p. ex. nabiximols et nabilone), lorsqu’ils sont dispensés par une pharmacie communautaire, sont saisis dans les bases de données électroniques provinciales ou territoriales sur les ordonnances. L’information sur le cannabis échappe à ces bases de données, ce qui la rend facile à omettre à moins de questionner spécifiquement le patient à propos de sa consommation, comme c’était le cas avec M. Wilson. Lors du dépistage, il peut s’avérer utile de poser aux patients des questions distinctes sur le cannabis à des fins médicales ou récréatives (non médicales) ou sur la marijuana. De plus, il pourrait être utile de questionner spécifiquement les patients au sujet de produits particuliers, comme « l’huile de CBD » ou « le cannabis topique », parce que ces produits ne sont pas toujours considérés comme des médicaments par les patients.
De retour à M. Wilson
Médecin : Je suis désolé d’apprendre que vos douleurs névralgiques vous causent encore des problèmes. Je ne m’étais pas rendu compte à quel point elles vous dérangeaient. Je vous remercie de m’avoir parlé de l’huile de CBD, parce que cette information peut être utile dans votre évaluation. L’avez-vous avec vous?
M. Wilson : J’ai une photo du flacon sur mon téléphone. Le CBD m’aide vraiment. J’ai commencé par 1 goutte le soir et maintenant, j’en prends 16. Mon fils m’a dit que je pouvais en prendre sans danger jusqu’à 40, mais je n’en ai pas besoin d’autant. Il a choisi ce produit parce qu’il ne contient que du CBD. (L’étiquette indique CBD : 100 mg/mL.)
Médecin : Puis-je vous dire que, selon moi, il est possible que ce soit la cause de vos étourdissements? [M. Wilson opine de la tête.] J’ai bien peur que cette huile de CBD contribue à votre problème.
M. Wilson : Mais je croyais que le CBD était inoffensif parce qu’il n’est pas psychoactif.
Appliquer les données probantes à la pratique : effets indésirables des cannabinoïdes
Les cannabinoïdes peuvent causer de nombreux effets indésirables qui sont souvent sous-estimés par les patients ou leur famille, comme dans le cas de M. Wilson et son fils (Tableau 2)9. La plupart des études sur les cannabinoïdes portent sur des utilisateurs expérimentés, et excluent les adultes plus âgés et les personnes vieillissantes qui ont des comorbidités courantes 11,12. Fait intéressant, le risque d’effets indésirables pourrait être plus élevé chez les adultes plus âgés en raison de leur exposition plus grande aux cannabinoïdes (p. ex. métabolisme plus lent du cannabis et plus de tissus adipeux) par rapport aux adultes plus jeunes11. Le cannabis semble aussi augmenter le risque de visites à l’urgence. Dans une enquête auprès de 14 715 personnes de 50 ans ou plus, 30,9 % des consommateurs de cannabis s’étaient rendus à l’urgence contre 23,5 % chez les non-consommateurs (p < ,001)13. Les patients, surtout les adultes plus âgés, sont à risque d’effets indésirables liés aux cannabinoïdes, et ils devraient être informés des effets qu’il faut aussi surveiller.
Tableau 2.
Effets indésirables des cannabinoïdes à évaluer ou surveiller
| EFFET INDÉSIRABLE | TAUX DE L’EFFET AVEC CANNABINOÏDES, % | TAUX DE L’EFFET AVEC PLACEBO, % | NOMBRE NÉCESSAIRE POUR NUIRE |
|---|---|---|---|
| Effets indésirables dans l’ensemble | 81 | 62 | 6 |
| Cessation en raison des effets indésirables | 11 | 3 environ | 14 |
| Effet psychoactif | 35 | 3 | 4 |
| Sédation | 50 | 30 | 5 |
| Étourdissements | 32 | 11 | 5 |
| Troubles de l’élocution | 32 | 7 | 5 |
| Ataxie ou spasmes musculaires | 30 | 11 | 6 |
| Hypotension | 25 | 11 | 8 |
Données tirées d’Allan et coll.9.
Les thérapies aux cannabinoïdes peuvent causer des étourdissements. Une revue systématique a fait ressortir 3 revues systématiques comparant cet effet indésirable avec les cannabinoïdes et avec un placebo12. La plus grande revue systématique portait sur 41 études randomisées contrôlées (ERC) comptant 4243 participants, et faisait valoir un risque accru d’étourdissements (rapport de cotes de 5,09, IC à 95 % de 4,10 à 6,32)14. Une augmentation des étourdissements avec une thérapie aux cannabinoïdes a aussi été constatée par Wade et ses collègues (3 ERC portant sur 666 participants; 32 % c. 11 % ont ressenti des étourdissements; nombre nécessaire pour nuire de 5) et par Mücke et ses collègues (4 ERC comptant 823 patients) qui ont observé une augmentation en nombre, quoique non statistiquement significative, des étourdissements (différence dans le risque de 3 %, IC à 95 % de 2 à 8 %)15,16. De plus, les thérapies aux cannabinoïdes agissent dans le système nerveux central (SNC) et peuvent interagir avec d’autres médicaments actifs dans le SNC. Les critères Beers de l’American Geriatric Society recommandent d’éviter l’utilisation de 3 médicaments actifs dans le SNC ou plus17. M. Wilson prend actuellement 4 médicaments actifs dans le SNC (prégabaline, zopiclone, duloxétine, huile de cannabis), ce qui augmente son risque de préjudices, y compris les étourdissements.
Il n’existe pas d’étude visant à savoir si le CBD, à lui seul, cause des étourdissements; par contre, les étiquettes de toutes les huiles de cannabis achetées d’une source légitime au Canada (p. ex. producteurs ou détaillants autorisés) portent des renseignements sur les concentrations à la fois du CBD et du tétrahydrocannabinol (THC) (voir l’Encadré 2 pour les facteurs à considérer avec l’huile de cannabis)18. Par conséquent, il est probable que M. Wilson ait reçu une huile de cannabis illégale, parce que l’étiquette ne donne que la concentration de CBD, et que cette huile contienne effectivement une quantité non précisée de THC, même si l’étiquette n’en mentionne pas la concentration. En outre, les produits achetés d’une source légitime porteront un timbre d’assise sur l’emballage, de même qu’un symbole normalisé de cannabis (si le produit contient plus de 10 μg de THC par gramme), ce qui donne un autre indice de la source du cannabis19,20. Jusqu’à présent, tous les produits de cannabis légitimes au Canada contiennent à la fois du CBD et du TCH.
Encadré 2. Facteurs à considérer avec l’huile de cannabis.
La plupart des patients signaleront leur utilisation d’huile de cannabis sous forme de gouttes ou de millilitres par jour. Il importe toutefois de connaître la dose en milligrammes de CBD et de THC. La concentration (p. ex. mg/mL) en CBD et en THC devrait être indiquée sur l’étiquette du produit
- Calcul de la dose de cannabis prenant M. Wilson comme exemple :
- - L’étiquette sur le flacon d’huile de cannabis indique 100 mg/mL de CBD ; la concentration en THC n’est pas mentionnée
- - M. Wilson prend 16 gouttes par jour, ce qui représente environ 0,8 mL/j (règle empirique : environ 20 gouttes par mL)
- - M. Wilson prend environ 80 mg de CBD par jour
CBD—cannabidiol.
De retour à M. Wilson
Médecin : Il n’existe vraiment pas de type inoffensif de cannabis. De fait, 1 patient qui prend des médicaments à base de cannabinoïdes sur 5 aura des étourdissements. Ce qui m’inquiète surtout, c’est que le cannabis est combiné à vos autres médicaments, ce qui augmente le risque de chutes.
M. Wilson : Donc, vous voulez que je cesse l’huile de CBD? Mon mal de dos va-t-il revenir? Je ne suis pas vraiment à l’aise avec cette proposition.
Appliquer les données probantes à la pratique : prise en charge de la douleur neuropathique associée au diabète et thérapie aux cannabinoïdes
Avant d’envisager une thérapie aux cannabinoïdes, il importe de discuter des objectifs thérapeutiques avec M. Wilson et d’évaluer ses essais antérieurs de médicaments. Il est essentiel de comprendre les bienfaits de l’huile de cannabis que perçoit M. Wilson. Dans la prise en charge de la douleur chronique, il faut se concentrer sur les objectifs fonctionnels, c’est-à-dire les objectifs dont l’atteinte se mesure par des améliorations dans les activités de la vie quotidienne (p. ex. capacité de jouer avec ses petits-enfants, jardiner, faire l’épicerie), plutôt que se fier seulement aux scores de douleur6,21. Il est aussi important de se fixer des attentes réalistes concernant les bienfaits que peut procurer la pharmacothérapie. Par exemple, une réduction de 30 à 50 % de la douleur est un paramètre d’efficacité courant dans les ERC sur la douleur comme indicateur de réussite; toutefois, certains patients pourraient croire qu’une pharmacothérapie réduira leur douleur à zéro. Parce que M. Wilson a signalé certaines améliorations, tant avec la prégabaline qu’avec la duloxétine, mais a quand même poursuivi l’automédication avec du cannabis, il vaudrait la peine de discuter avec lui et d’établir des objectifs fonctionnels, tout en insistant sur le fait qu’une élimination complète de la douleur est irréaliste. En outre, même chez les patients qui pensent « avoir tout essayé », il est souvent encore possible d’optimiser les thérapies. Les lignes directrices recommandent des traitements non pharmacologiques comme l’exercice, la physiothérapie et les thérapies psychologiques chez tous les patients7. De plus, de nombreux patients ont l’impression qu’une pharmacothérapie a échoué, mais n’en ont pas fait un essai adéquat. Par exemple, la plupart des médicaments doivent être titrés jusqu’à l’obtention d’une dose efficace et être utilisés pendant au moins 6 semaines (et probablement 3 mois) pour procurer des bienfaits9. Il convient de signaler que les adultes plus âgés ont souvent besoin de doses plus faibles et d’un titrage plus lent que les adultes plus jeunes (consulter Geri-RxFiles, accessible à www.RxFiles.ca, pour plus d’information sur les dosages)22.
À l’heure actuelle, les cannabinoïdes sont considérés comme des choix de traitement de troisième ou quatrième intention pour la douleur neuropathique chronique, lorsque les patients n’ont pas pas répondu aux antidépresseurs tricycliques, aux gabapentinoïdes et aux inhibiteurs sélectifs de la recapture de la norépinéphrine7,9. Pour M. Wilson, les cannabinoïdes pourraient être une option de rechange raisonnable, puisqu’il a essayé la nortriptyline, la prégabaline et la duloxétine. Une métaanalyse par Cochrane en 2018 regroupant 10 ERC portant sur des patients (1586 participants) souffrant de douleur neuropathique chronique a révélé que les cannabinoïdes comparés au placebo augmentaient le nombre de patients constatant une réduction de 30 % et plus de leur douleur, situant le nombre de sujets à traiter à 11 (qualité modérée des données probantes)23. Toutefois, il n’y avait aucune différence chez les patients souffrant de neuropathie diabétique en se fondant sur l’analyse d’un sous-groupe de 2 ERC (327 participants)23. Cette revue a aussi tenté de faire la méta-analyse d’un paramètre fonctionnel, notamment l’impression globale de la douleur signalée par le patient, mais la qualité des données était faible, et d’autres études s’imposent à cet égard23.
Même si les cannabinoïdes ont fait l’objet d’études dans les cas de douleur neuropathique chronique comme on vient de l’expliquer, il existe d’importantes limitations. La majorité des ERC comptaient moins de 100 participants (de 20 à 339), âgés d’environ 25 à 60 ans (jusqu’à 70 ans), et évaluaient le nabiximols, un cannabinoïde d’ordonnance23. Aucune des ERC n’évaluait l’huile de cannabis23. Deux ERC étudiaient le nabilone (mais n’étaient pas incluses dans la méta-analyse)23. La plupart des ERC avaient une durée de 12 semaines (jusqu’à 26 semaines), et les bienfaits à long terme sont inconnus23. Cet aspect a été analysé plus en profondeur dans une revue systématique par Allan et ses collègues, qui ont fait valoir que des résultats positifs avaient été signalés dans les ERC de courte durée (jusqu’à 5 semaines), tandis que dans les ERC de plus longue durée (9 à 15 semaines), les résultats étaient neutres12. Par conséquent, les effets des cannabinoïdes, surtout à long terme, demeurent inconnus chez les adultes plus âgés, comme M. Wilson.
Approches possibles de prise en charge pour M. Wilson
La prise en charge de la douleur neuropathique réfractaire pose de grands défis; toutefois, il existe quelques interventions dont M. Wilson pourrait bénéficier. Il y aurait lieu de discuter des objectifs thérapeutiques en insistant sur l’aspect fonctionnel, et il faudrait rappeler à M. Wilson que la pharmacothérapie ne réduira probablement pas son degré de douleur à zéro. Les traitements non pharmacologiques sont utiles et devraient être explorés (p. ex. psychothérapie, physiothérapie, programme d’activité supervisé). Un aperçu de nombreuses thérapies non pharmacologiques se trouve en ligne, en anglais, à www.RxFiles.ca/painlinks.
Diverses approches pharmacologiques pour la douleur neuropathique réfractaire sont valables et dépendent de nombreuses variables, comme les caractéristiques et les valeurs du patient. Pour M. Wilson, il pourrait être approprié d’essayer une dose plus forte, soit de 90 mg de duloxétine par jour ou de 75 mg de prégabaline le matin et de 150 mg au coucher pendant 3 mois, tout en évaluant les possibilités de bienfaits et d’effets indésirables24,25. Puisque l’huile de cannabis de M. Wilson est probablement illicite et associée à l’apparition de ses étourdissements, il faudrait l’encourager à cesser de l’utiliser ou au moins d’en diminuer la dose (bien qu’il soit à noter que M. Wilson pourrait ne pas suivre les conseils de son médecin). La diminution progressive est recommandée lors de la cessation, car des symptômes de sevrage (p. ex. anxiété, sudation et troubles du sommeil) ont été signalés lorsque les cannabinoïdes avaient été utilisés quotidiennement pendant quelques semaines ou mois26. Même si le régime de sevrage progressif optimal est inconnu, chez des patients plus âgés non fragiles comme M. Wilson, une diminution de 25 % chaque semaine ou 2, selon la tolérance, semble raisonnable, tout en surveillant la disparition des étourdissements, les symptômes de sevrage du cannabis et les effets sur le fonctionnement27. Vous pourriez remettre à M. Wilson une brochure sur le cannabis à l’intention des patients, qui explique certains des mythes entourant le cannabis, de même que ses effets indésirables (accessible en anglais à www.RxFiles.ca)28.
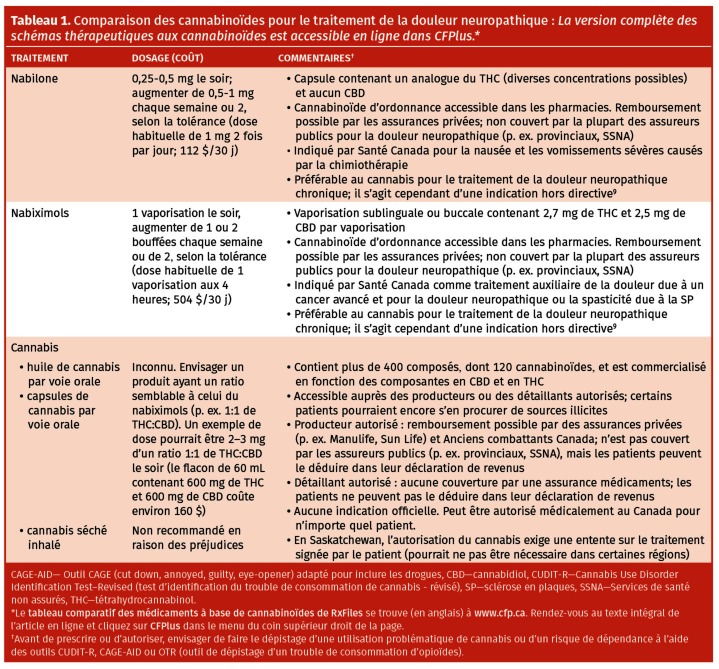
Si une autre thérapie aux cannabinoïdes est envisagée (consulter le Tableau 1 pour des renseignements détaillés sur les produits cannabinoïdes9; la version complète des schémas thérapeutiques aux cannabinoïdes se trouve en ligne, en anglais, dans CFPlus*), il faudrait probablement procéder à des ajustements posologiques pour cesser ou réduire la dose de duloxétine ou de prégabaline que prend M. Wilson pour minimiser les effets indésirables additionnels des agents actifs sur le SNC9. Les cannabinoïdes d’ordonnance sont préférables au cannabis, parce que la plupart des ERC ont évalué de tels produits, que des conseils sur le dosage sont accessibles, et que les bases de données électroniques provinciales et territoriales sur les ordonnances saisissent des données sur ces produits, ce qui facilite le dépistage des cannabinoïdes, et aussi parce que ces produits répondent aux normes de qualité pour les médicaments d’ordonnance. Par ailleurs, le coût peut être prohibitif, surtout pour le nabiximols. Il serait important de commencer le cannabinoïde à faible dose et de l’augmenter à intervalle de quelques jours ou à chaque semaine, et une durée d’essai raisonnable serait d’environ 3 mois.
Tableau 1.
Comparaison des cannabinoïdes pour le traitement de la douleur neuropathique : La version complète des schémas thérapeutiques aux cannabinoïdes est accessible en ligne dans CFPlus.*
Conclusion
Dans l’ensemble, il y a beaucoup d’inconnus et d’incertitudes quant au rôle optimal des cannabinoïdes chez des adultes plus âgés souffrant de douleur neuropathique réfractaire. Jusqu’à ce que des données plus convaincantes soient accessibles, il faut s’assurer que les autres traitements non pharmacologiques et pharmacothérapies sont optimisés, et que les patients n’ont pas répondu à au moins 3 autres agents avant d’amorcer une thérapie aux cannabinoïdes. Les patients pourraient être curieux et vouloir explorer une thérapie aux cannabinoïdes. Il importe donc de faire un dépistage de l’utilisation de cannabinoïdes, de surveiller les effets indésirables potentiels et d’entamer un dialogue avec les patients. De plus, il existe des outils pour la pratique qui portent sur les cannabinoïdes pour aider les médecins de famille en quête de conseils pratiques dans la prestation des soins aux patients.
Remerciements
Nous remercions Lynette Kosar et Loren Regier pour la révision de cet article.
Footnotes
Le tableau comparatif des médicaments à base de cannabinoïdes de RxFiles se trouve (en anglais) à www.cfp.ca. Rendez-vous au texte intégral de l’article en ligne et cliquez sur CFPlus dans le menu du coin supérieur droit de la page.
Intérêts concurrents
RxFiles et les auteurs qui y collaborent n’ont aucun intérêt concurrent de nature commerciale. Le Programme de formation continue en pharmacothérapie RxFiles est financé par l’intermédiaire d’une subvention du ministère de la Santé de la Saskatchewan à la Régie régionale de la santé de Saskatoon; les recettes « sans but lucratif ni perte de bénéfice » proviennent de la vente de livres et des abonnements en ligne. Aucune aide financière n’a été obtenue pour cette publication.
Cet article donne droit à des crédits d’autoapprentissage certifié Mainpro+. Pour obtenir des crédits, rendez-vous sur www.cfp.ca et cliquez sur le lien Mainpro+.
The English version of this article is available at www.cfp.ca on the table of contents for the November 2019 issue on page 807.
Références
- 1.National Cannabis Survey 1st quarter, 2019. Ottawa, ON: Statistique Canada; 2019. Accessible à : https://www150.statcan.gc.ca/n1/pub/11-627-m/11-627-m2019032-eng.htm. Réf. du 1er juill. 2019. [Google Scholar]
- 2.National Cannabis Survey, fourth quarter 2018. Ottawa, ON: Statistique Canada; 2018. Accessible à : https://www150.statcan.gc.ca/n1/daily-quotidien/190207/dq190207b-eng.htm. Réf. du 26 avr. 2018. [Google Scholar]
- 3.National Cannabis Survey, third quarter 2018. Ottawa, ON: Statistique Canada; 2018. Accessible à : https://www150.statcan.gc.ca/n1/daily-quotidien/181011/dq181011b-eng.htm. Réf. du 26 avr. 2018. [Google Scholar]
- 4.Baron EP, Lucas P, Eades J, Hogue O. Patterns of medicinal cannabis use, strain analysis, and substitution effect among patients with migraine, headache, arthritis, and chronic pain in a medicinal cannabis cohort. J Headache Pain. 2018;19(1):37. doi: 10.1186/s10194-018-0862-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Boehnke KF, Gangopadhyay S, Clauw DJ, Haffajee RL. Qualifying conditions of medical cannabis license holders In the United States. Health Aff (Millwood) 2019;38(2):295–302. doi: 10.1377/hlthaff.2018.05266. Erratum dans: Health Aff (Millwood) 2019;38(3):511. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Grinzi P. The inherited chronic pain patient. Aust Fam Physician. 2016;45(12):868–72. [PubMed] [Google Scholar]
- 7.Moulin D, Boulanger A, Clark AJ, Clarke H, Dao T, Finley GA, et al. Pharmacological management of chronic neuropathic pain: revised consensus statement from the Canadian Pain Society. Pain Res Manag. 2014;19(6):328–35. doi: 10.1155/2014/754693. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Torrance N, Smith BH, Bennett MI, Lee AJ. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. J Pain. 2006;7(4):281–9. doi: 10.1016/j.jpain.2005.11.008. [DOI] [PubMed] [Google Scholar]
- 9.Allan GM, Ramji J, Perry D, Ton J, Beahm NP, Crisp N, et al. Simplified guideline for prescribing medical cannabinoids in primary care. Can Fam Physician. 2018;64:111–20. (ang), e64–75 (fr). [PMC free article] [PubMed] [Google Scholar]
- 10.Adamson SJ, Kay-Lambkin FJ, Baker AL, Lewin TJ, Thornton L, Kelly BJ, et al. An improved brief measure of cannabis misuse: the Cannabis Use Disorders Identification Test–Revised (CUDIT-R) Drug Alcohol Depend. 2010;110(1–2):137–43. doi: 10.1016/j.drugalcdep.2010.02.017. Publ. en ligne du 26 mars 2010. [DOI] [PubMed] [Google Scholar]
- 11.Minerbi A, Häuser W, Fitzcharles MA. Medical cannabis for older patients. Drugs Aging. 2019;36(1):39–51. doi: 10.1007/s40266-018-0616-5. [DOI] [PubMed] [Google Scholar]
- 12.Allan GM, Finley CR, Ton J, Perry D, Ramji J, Crawford K, et al. Systematic review of systematic reviews for medical cannabinoids. Pain, nausea and vomiting, spasticity, and harms. Can Fam Physician. 2018;64:e78–94. Accessible à : www.cfp.ca/content/cfp/64/2/e78.full.pdf. Réf. du 23 sept. 2019. [PMC free article] [PubMed] [Google Scholar]
- 13.Choi NG, Marti CN, DiNitto DM, Choi BY. Older adults’ marijuana use, injuries, and emergency department visits. Am J Drug Alcohol Abuse. 2018;44(2):215–23. doi: 10.1080/00952990.2017.1318891. Publ. en ligne du 8 mai 2017. [DOI] [PubMed] [Google Scholar]
- 14.Whiting PF, Wolff RF, Deshpande S, Di Nisio M, Duffy S, Hernandez AV, et al. Cannabinoids for medical use: a systematic review and meta-analysis. JAMA. 2015;313(24):2456–73. doi: 10.1001/jama.2015.6358. Errata dans : JAMA 2015;314(5):520, JAMA 2015;314(8):837, JAMA 2015;314(21):2308, JAMA 2016;315(14):1522. [DOI] [PubMed] [Google Scholar]
- 15.Wade DT, Collin C, Stott C, Duncombe P. Meta-analysis of the efficacy and safety of Sativex (nabiximols), on spasticity in people with multiple sclerosis. Mult Scler. 2010;16(6):707–14. doi: 10.1177/1352458510367462. [DOI] [PubMed] [Google Scholar]
- 16.Mücke M, Carter C, Cuhls H, Prüẞ M, Radbruch L, Häuser W. Cannabinoids in palliative care: systematic review and meta-analysis of efficacy, tolerability and safety [article en allemand] Schmerz. 2016;30(1):25–36. doi: 10.1007/s00482-015-0085-2. [DOI] [PubMed] [Google Scholar]
- 17.2019 American Geriatrics Society Beers Criteria Update Expert Panel. American Geriatrics Society 2019 updated AGS Beers Criteria® for potentially inappropriate medication use in older adults. J Am Geriatr Soc. 2019;67(4):674–94. doi: 10.1111/jgs.15767. Publ. en ligne du 29 janv. 2019. [DOI] [PubMed] [Google Scholar]
- 18.Perry D, Ton J, Allan GM. Evidence for THC versus CBD in cannabinoids. Can Fam Physician. 2018;(64):519. [PMC free article] [PubMed] [Google Scholar]
- 19.Agence du revenu du Canada EDN54 general overview of the cannabis excise stamps. Ottawa, ON: gouvernement du Canada; 2018. Accessible à : www.canada.ca/en/revenue-agency/services/forms-publications/publications/edn54/general-over-view-cannabis-excise-stamps.html. Réf. du 1er juill. 2019. [Google Scholar]
- 20.Santé Canada . Standardized cannabis symbol. Ottawa, ON: Santé Canada; 2018. Accessible à : www.canada.ca/en/health-canada/services/drugs-medication/cannabis/laws-regulations/regulations-support-cannabis-act/standardized-symbol.html. Réf. du 1er juill. 2019. [Google Scholar]
- 21.Rosenquist EWK. Evaluation of chronic pain in adults. Waltham, MA: UpToDate; 2018. Accessible à : www.uptodate.com/contents/evaluation-of-chronic-pain-in-adults. Réf. du Réf. du 1er juill. 2019. [Google Scholar]
- 22.Geri-RxFiles. 3e éd. Saskatoon, SK: Université de la Saskatchewan; 2019. [Google Scholar]
- 23.Mücke M, Phillips T, Radbruch L, Petzke F, Häuser W. Cannabis-based medicines for chronic neuropathic pain in adults. Cochrane Database Syst Rev. 2018;(3):CD012182. doi: 10.1002/14651858.CD012182.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Lunn MP, Hughes RA, Wiffen PJ. Duloxetine for treating painful neuropathy, chronic pain or fibromyalgia. Cochrane Database Syst Rev. 2014;(1):CD007115. doi: 10.1002/14651858.CD007115.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Geri-RxFiles. 3e éd. Saskatoon, SK: Université de la Saskatchewan; 2019. Pain management in older adults. [Google Scholar]
- 26.Budney AJ, Hughes JR. The cannabis withdrawal syndrome. Curr Opin Psychiatry. 2006;19(3):233–8. doi: 10.1097/01.yco.0000218592.00689.e5. [DOI] [PubMed] [Google Scholar]
- 27.Geri-RxFiles. 3e éd. Saskatoon, SK: Université de la Saskatchewan; 2019. Tapering medications in older adults. [Google Scholar]
- 28.RxFiles . Cannabis. Questions about cannabis, and the answers that may surprise you. A booklet for people thinking about starting medical cannabis. Saskatoon, SK: Université de la Saskatchewan; 2019. Accessible à : www.rxfiles.ca/RxFiles/uploads/documents/Cannabis-Medical-Patient-Booklet.pdf. Réf. du 25 sept. 2019. [Google Scholar]