Durant l’exercice financier 2017–2018, le nombre de Canadiens autorisés à se procurer du cannabis médical (c.-à-d. des produits dérivés de la plante, plutôt que les cannabinoïdes pharmaceutiques nabilone et nabiximols) est passé de 174 503 à 296 702, et ce nombre continue d’augmenter1. Nous soutenons ici que les données factuelles étayant les bienfaits thérapeutiques du cannabis médical sont très limitées et qu’elles sont déformées par l’industrie qui en produit. Nous affirmons, en outre, que le manque de réglementation et de supervision des cliniques de cannabis médical par Santé Canada a permis aux cliniciens de prescrire des doses qui ne sont pas sécuritaires. Nous commentons l’influence qu’exerce l’industrie du cannabis médical sur la perception qu’a le public du cannabis, et nous examinons les effets de cette influence dans le contexte de la légalisation. Enfin, nous proposons des stratégies dont peuvent se servir les médecins de famille pour protéger leurs patients contre les préjudices causés par le cannabis.
Données probantes sur les bienfaits du cannabis médical
Les défenseurs du cannabis prétendent qu’il est efficace pour divers problèmes médicaux et psychiatriques; cependant, les seules affections pour lesquelles il existe des données crédibles sur de tels bienfaits sont la douleur neuropathique, la spasticité due à la sclérose en plaques et les vomissements induits par la chimiothérapie2.
En dépit du manque de preuves à l’appui, l’industrie du cannabis médical fait des affirmations exagérées à propos des bienfaits du cannabis. Un site web qui appartient à une chaîne de cliniques de cannabis dresse une liste de « problèmes courants traités avec du cannabis » qui incluent diverses affections pour lesquelles il existe peu ou pas de données probantes, et pour lesquelles les lignes directrices de pratique clinique ne recommandent pas le recours au cannabis. Parmi ces problèmes figurent la lombalgie, les céphalées, l’anxiété et le trouble du stress post-traumatique (TSPT)3. Prenons le TSPT pour exemple : on a fait la promotion du cannabis médical comme traitement viable sans que les bienfaits de son utilisation reposent sur un corpus raisonnable de données scientifiques. Une entreprise dominante sur le marché du cannabis médical affirme ce qui suit :
Nous avons entendu dire par un certain nombre de nos patients qui souffrent d’un TSPT qu’ils trouvent que le cannabis médical est très efficace pour aider à les soulager… Des études plus nombreuses et de plus grande envergure devraient être entreprises sur les effets du cannabis dans le traitement du TSPT, quoique de récentes études démontrent que cette forme de traitement est très prometteuse4.
L’entreprise fonde cette conclusion sur 2 études d’une pertinence douteuse par rapport au cannabis médical—l’une sur le nabilone5 et l’autre sur le tétrahydrocannabinol (THC)6 pur par voie orale — et sur des données anecdotiques tirées d’études alléguant que le cannabis améliore les symptômes du TSPT chez les anciens combattants4. Par ailleurs, ces études ne concordent pas avec le corpus de données plus large de la littérature scientifique. Une récente revue systématique7 de revues systématiques, et d’études cliniques et observationnelles avec groupes témoins a recensé 2 revues systématiques et 3 études principales sur le cannabis et le TSPT. Les 2 revues systématiques8,9 ont conclu que les données factuelles étaient insuffisantes pour tirer des conclusions au sujet de l’efficacité du cannabis dans le traitement du TSPT. L’une des 3 études principales, une étude de cohorte rétrospective portant sur plus de 2000 vétérans américains évalués avant et après un traitement en établissement pour un TSPT, a fait valoir que ceux qui avaient commencé ou continué à utiliser du cannabis avaient de pires symptômes du TSPT, un comportement plus violent et une plus grande consommation d’alcool par rapport à ceux qui avaient cessé d’utiliser ou n’avaient jamais consommé de cannabis10. Dans les 2 autres études, l’utilisation du cannabis n’était pas associée à la gravité des symptômes du TSPT11,12. Une autre revue portant sur le cannabis et le TSPT a conclu ce qui suit :
L’utilisation de marijuana a été liée à… la dépression, l’anxiété, la psychose et l’abus de substances. La consommation de marijuana est aussi associée à de pires résultats thérapeutiques dans des études naturalistes… Les risques connus de la marijuana l’emportent donc actuellement sur les bienfaits inconnus pour le TSPT13.
Une revue plus large de la littérature scientifique démontre que les données en faveur du cannabis comme traitement du TSPT sont loin d’être convaincantes, ce qui indique que les affirmations de l’entreprise de cannabis à propos des récentes études pointant vers des bienfaits prometteurs4 sont trompeuses et malhonnêtes.
En outre, lorsqu’on examine les données probantes en faveur du cannabis, il importe de faire la distinction entre les cannabinoïdes pharmaceutiques et les autres préparations : les partisans du cannabis ont tendance à dire que les bienfaits et l’innocuité du cannabis médical équivalent à ceux des cannabinoïdes pharmaceutiques, et pourtant, les 2 ont des profils différents d’efficacité. Les données en faveur du cannabis médical sont bien moins convaincantes que celles étayant les cannabinoïdes nabiximols et nabilone, en partie en raison de la difficulté de concevoir une étude de qualité suffisante sur le cannabis inhalé. Dans une revue systématique sur les cannabinoïdes en cas de douleur neuropathique, les critères d’inclusion étaient respectés par 10 études randomisées contrôlées (ERC) sur le nabiximols, 3 ERC sur le nabilone et le dronabinol, et seulement 2 sur le cannabis médical14. Dans une revue systématique de 11 revues systématiques de qualité modérée à élevée portant sur des ERC et des études observationnelles à long terme sur l’efficacité des cannabinoïdes (tant les cannabinoïdes pharmaceutiques que le cannabis) dans la prise en charge de la douleur15, aucune donnée probante n’a étayé de bienfaits procurés par le cannabis médical (et des données limitées de bienfaits ont été cernées pour le nabiximols dans le contrôle de la douleur neuropathique).
Les cannabinoïdes pharmaceutiques ont aussi un profil d’innocuité différent de celui du cannabis. Les adultes américains16 consomment le plus souvent du cannabis en le fumant, et la fumée de cannabis contient de multiples toxines, dont certaines sont cancérigènes et athérogènes. Le cannabis fumé envoie des concentrations très élevées de TCH au cerveau en quelques secondes, ce qui peut causer une déficience cognitive et augmenter le risque d’accidents de véhicules motorisés17. Fumer 2 g de cannabis contenant 20 % de THC, une concentration élevée, mais accessible auprès de producteurs de cannabis médical, achemine jusqu’à 400 mg de THC vers le cerveau (quoiqu’une partie du THC s’échappera dans la fumée secondaire), tandis que 12 vaporisations de nabiximols, la dose maximale quotidienne, ne produisent que 33 mg de THC. La prétention d’une équivalence entre ces 2 produits différents est trompeuse et contribue au manque de connaissances du public à propos des effets du cannabis médical.
Cannabis et opioïdes
Invoquant des considérations liées à la santé publique, des défenseurs du cannabis ont affirmé qu’il pouvait aider à prévenir ou à traiter un trouble de consommation d’opioïdes19. Cette affirmation se fonde sur une étude qui a fait valoir que, dans les États américains qui avaient légalisé le cannabis, il s’est produit une diminution des taux de surdoses d’opioïdes19. Par ailleurs, il s’agissait d’une étude écologique qui n’a pas analysé les données sur le plan individuel relatives à l’utilisation du cannabis et le risque de surdoses. D’autres facteurs sans lien avec les lois sur le cannabis pourraient avoir contribué à la réduction des taux de surdoses, comme les systèmes de surveillance des prescriptions ou le démantèlement des « usines à pilules ». Une récente analyse des tendances à long terme dans les décès par surdose dans l’ensemble des États-Unis a révélé que les États qui avaient légalisé le cannabis avaient des taux plus faibles de surdoses par opioïdes d’ordonnance avant la légalisation, et l’ajustement pour en tenir compte a éliminé cette association20.
Contrairement aux affirmations des défenseurs, des études observationnelles ont cerné une association positive entre l’utilisation du cannabis et le trouble de consommation d’opioïdes. Une revue d’études observationnelles a conclu que l’usage abusif d’opioïdes est plus fréquent chez les consommateurs de cannabis que chez ceux qui s’en abstiennent8, et une importante enquête épidémiologique aux États-Unis a fait valoir que l’utilisation du cannabis était associée à un usage non médical d’opioïdes d’ordonnance (rapport de cotes de 5,78, IC à 95 % de 4,23 à 7,90) et à un trouble de consommation d’opioïdes (rapport de cotes de 7,76, IC à 95 % de 4,95 à 12,16)21; d’autres études en sont venues à des conclusions semblables22.
Des utilisateurs de cannabis médical ont signalé euxmêmes que le cannabis les avait aidés à réduire leur consommation d’opioïdes d’ordonnance pour la douleur23, mais il n’existe pas de données objectives pour soutenir que le cannabis réduit le recours aux analgésiques opioïdes. Dans une étude de cohortes sur 4 ans en Australie qui portait sur 1500 patients prenant des opioïdes pour la douleur chronique, les utilisateurs fréquents de cannabis avaient des scores de douleur plus élevés, des scores plus élevés d’interférence en raison de la douleur et des scores plus faibles d’auto-efficacité face à la douleur; ils n’utilisaient pas des doses plus faibles d’opioïdes, et leurs taux de cessation des opioïdes n’étaient pas plus élevés24.
Réglementation et supervision de l’industrie du cannabis médical
Les pratiques cliniques des cliniques de cannabis médical manquent de transparence. À notre connaissance, les cliniques de cannabis canadiennes n’ont publié aucune indication, aucune contre-indication ni de protocole de dosage pour les produits qu’elles prescrivent. Le Collège des médecins de famille du Canada, dans son document d’orientation préliminaire de 201425, recommande de restreindre la prescription de cannabis séché aux patients souffrant de douleur neuropathique sévère et réfractaire à tous les médicaments de première intention. Il recommande aussi une dose quotidienne maximale de 700 mg de cannabis séché ayant une concentration de 9 % de THC. Par ailleurs, en 2017, la dose quotidienne moyenne prescrite de cannabis médical au Canada se situait à 2,3 g1, ce qui est bien supérieur à la dose maximale recommandée. La concentration moyenne de THC des produits prescrits n’a pas été signalée, mais de nombreux produits de l’industrie contiennent des concentrations bien supérieures aux 9 % préconisées dans le document d’orientation, et certaines concentrations dépassent les 20 % et plus. Pour décourager les ordonnances inappropriées, certains États américains ont imposé aux cliniques de cannabis des exigences médicales, comme une formation obligatoire sur la prescription de cannabis, des ordonnances dont la validité n’excède pas 30 jours, et l’obligation de faire un suivi rigoureux des patients pour assurer la sécurité et l’efficacité du cannabis prescrit26.
Les ordres de médecins provinciaux ont publié des énoncés de position sur le cannabis médical. Par exemple, la déclaration de principe du College of Physicians and Surgeons of Ontario27 conseille aux médecins de procéder à une évaluation exhaustive avant de prescrire du cannabis, et d’identifier les patients à risque élevé de préjudices liés au cannabis, comme la psychose ou les troubles de l’humeur. Le collège recommande aussi aux prescripteurs d’utiliser une faible dose et de surveiller les complications, comme le trouble de consommation de cannabis (TCC).
Toutefois, des données factuelles provenant des États-Unis indiquent que les médecins prescrivent fréquemment du cannabis médical à des patients qui ont des problèmes pour lesquels le cannabis est contre-indiqué, comme le TCC. Dans un sondage aux États-Unis, des médecins de famille ont signalé que 31 % de leurs patients à qui un autre médecin avait prescrit du cannabis médical souffraient d’une affection susceptible d’être aggravée par le cannabis28. Une autre étude épidémiologique de grande envergure a révélé que, sur un total de 3784 répondants ayant des antécédents de consommation de cannabis durant l’année précédente, 32 % des utilisateurs de cannabis médical avaient souffert d’un TCC durant cette période, par rapport à 25 % chez les utilisateurs de cannabis à des fins récréatives29. Dans une étude américaine portant sur des jeunes à risque à Denver et à San Francisco, on a constaté que le TCC était significativement (
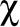 2 = 22,8, p < ,001) associé au fait d’avoir une fiche d’autorisation du cannabis médical30. Une revue des programmes de cannabis médical américains a permis de constater ce qui suit :
2 = 22,8, p < ,001) associé au fait d’avoir une fiche d’autorisation du cannabis médical30. Une revue des programmes de cannabis médical américains a permis de constater ce qui suit :
Dans de nombreux États, les personnes reçoivent une autorisation de se procurer de la marijuana à des fins médicales auprès d’un médecin qu’elles n’ont consulté qu’une seule fois… Des études initiales ont fait valoir que le patient typique qui prend de la marijuana à des fins médicales est jeune, de sexe masculin, sans indication précise d’en prendre pour des douleurs chroniques ou graves, et ayant des antécédents de consommation de marijuana à des fins récréatives26.
Santé Canada est responsable d’assurer que les produits pharmaceutiques sont sûrs et efficaces. Il approuve la mise en marché des produits après un examen rigoureux de leur innocuité et de leur efficacité, et il exige des entreprises de produire une monographie du produit précisant ses indications, ses contreindications et sa posologie. Les entreprises ne sont pas autorisées à faire la promotion d’usages « non indiqués sur l’étiquette » de leurs produits (c.-à-d. pour des problèmes pour lesquels ils ne sont pas indiqués). On s’attend des médecins qu’ils se conforment à la monographie du produit dans leurs prescriptions, de même qu’aux présentations éducatives à son sujet. Par contre, Santé Canada n’exige pas des entreprises de cannabis qu’elles produisent ou respectent une monographie du produit, ni qu’elles dressent la liste des indications, des contre-indications et des dosages de leurs produits. Par conséquent, les programmes d’information parrainés par l’industrie n’ont aucune restriction quant aux affirmations à propos de leurs produits. En outre, Santé Canada a permis à des entreprises de produire du cannabis contenant des concentrations de THC de 20 % ou plus. L’implication de l’industrie dans la mise en marché du cannabis médical et l’information à son sujet a un dangereux précédent : le marketing de l’OxyContin par Purdue.
Santé Canada a failli à ses obligations de protéger la population dans l’épidémie d’OxyContin. Santé Canada a approuvé la monographie du produit de Purdue, même si elle contenait des renseignements trompeurs et inexacts. Un affidavit, présenté devant le tribunal dans le cadre du recours collectif national gagné contre Purdue31, concluait que les monographies de 2009, 2010 et 2011 de l’OxyContin produites par Purdue contenaient des déclarations erronées qui encourageaient les médecins à prescrire de très fortes doses d’OxyContin à des patients à risque élevé de dépendance, de surdoses et d’autres préjudices. Les monographies laissaient entendre que l’OxyContin était indiqué pour toutes sortes de douleurs; elles ne précisaient pas de schémas thérapeutiques ni de limites de doses maximales; elles n’avertissaient pas les médecins que des doses élevées d’opioïdes sont associées à un risque accru de surdoses et de dépendance; et elles ne mettaient pas les médecins en garde que certains groupes de patients étaient à risque élevé de tels préjudices. Cette négligence a permis à Purdue, dans ses nombreuses publications, conférences et séances d’information, de dire aux médecins que l’OxyContin pouvait être « dosé selon son effet », sans limite maximale; qu’il était efficace pour tous les types de douleurs; et que la dépendance était rare chez les patients souffrant de douleurs. La campagne de Purdue a profondément changé les habitudes de prescription des médecins, et a causé directement ou indirectement la mort de plusieurs milliers de personnes en Amérique du Nord. Santé Canada a aussi autorisé Purdue à produire des comprimés contenant jusqu’à 80 mg d’oxycodone, soit 16 fois la quantité trouvée dans un comprimé d’acétaminophène-oxycodone, ce qui a fait en sorte que les médecins ont commencé à prescrire des doses élevées d’oxycodone, même pour des problèmes bénins de douleurs.
Même si le cannabis médical n’entraînera pas de décès par surdose, il pourrait potentiellement causer des préjudices et des incapacités à beaucoup de personnes. Santé Canada a imposé des limites strictes sur la publicité, et a fixé un âge minimum légal à 18 ans pour acheter du cannabis, mais il faudrait en faire beaucoup plus. Les Canadiens ont eu accès au cannabis médical en raison d’une décision de la Cour suprême, et non pas à la suite d’une approbation réglementaire par Santé Canada. Néanmoins, il a un pouvoir de réglementation et l’obligation, au chapitre de la santé publique, de régir le cannabis médical de la même manière qu’il le fait pour d’autres produits pharmaceutiques. Santé Canada devrait exiger de l’industrie qu’elle produise une monographie des produits, énonçant les indications, les précautions, les contre-indications et les protocoles posologiques fondés sur des données probantes pour le cannabis médical. Santé Canada devrait aussi empêcher l’industrie de fabriquer des produits contenant des degrés de concentration de THC supérieurs à ceux utilisés dans les études (c.-à-d. 9 %).
Légalisation
La légalisation du cannabis à des fins récréatives a suscité de l’incertitude entourant l’avenir du cannabis médical. L’Association médicale canadienne a recommandé l’élimination du programme du cannabis médical32. Par ailleurs, même si cela se produisait, le marketing du cannabis médical a donné davantage l’impression à la population que le cannabis est sécuritaire et bénéfique, ce qui, en retour, augmentera l’utilisation et les préjudices du cannabis à des fins récréatives. Les personnes qui ont été persuadées que le cannabis soulagera leur douleur, leur anxiété, leur insomnie ou leur TSPT achèteront du cannabis récréatif si elles n’ont pas accès à du cannabis médical. Elles seront aussi plus résistantes face aux inquiétudes de leur famille et de leurs amis concernant leur consommation de cannabis. Des données probantes étayent une association entre des attitudes sociales favorables au sujet du cannabis et son utilisation à l’échelle de la population. Le Canada a une attitude plus positive envers le cannabis et une utilisation par habitant plus élevée que la Suède et la Finlande33. L’exposition à la publicité sur le cannabis médical a été associée à une intention plus prononcée de la part d’étudiants de la 6e à la 8e année en Californie de consommer du cannabis34. Même si le Canada ne permet pas la publicité directe du cannabis, l’industrie et les cliniques sont en mesure de commercialiser leurs produits grâce à des reportages dans les médias, aux sites web, au marketing direct à l’égard des médecins et des « agents » qui donnent des conseils aux consommateurs sur la façon d’avoir accès à du cannabis.
Que le cannabis médical soit ou non encore accessible, la légalisation entraînera probablement une hausse globale des préjudices du cannabis à la santé publique. Au Colorado, où l’âge légal pour acheter du cannabis est de 21 ans, le nombre de visites aux services d’urgence par des adolescents pour des motifs en lien avec le cannabis est passé de 1,8 par 1000 visites en 2009 à 4,9 par 1000 visites en 201535.
Gérer les risques de la consommation de cannabis
Les médecins de famille peuvent contribuer à protéger leurs patients et la population contre les préjudices liés au cannabis en procédant comme suit.
Se conformer au document d’orientation du Collège des médecins de famille du Canada lorsqu’ils prescrivent du cannabis.
Recourir aux préparations pharmaceutiques (nabilone ou nabiximols) pour les patients souffrant de douleur neuropathique réfractaire à un essai d’une dose et d’une durée suffisantes de médicaments de première intention (inhibiteurs de la recapture de la sérotonine-norépinéphrine comme la duloxétine, antidépresseurs tricycliques et gabapentine ou prégabaline), et si un essai suffisant de nabilone ou de nabiximols est inefficace, envisager un essai de cannabis séché en vaporisation, ajusté lentement jusqu’à une dose maximale de 400 mg et contenant au plus 9 % de THC et au moins 9 % de cannabidiol25.
Pour les patients qui demandent une ordonnance de cannabis pour un problème pour lequel il n’est pas indiqué ou encore pour lequel il est contre-indiqué, insister sur le manque de données probantes étayant les bienfaits du cannabis pour ces problèmes, alors que des données convaincantes pointent vers des préjudices, y compris des accidents de véhicules motorisés36,37, la psychose38,39, l’aggravation de l’anxiété40, la déficience cognitive à long terme41 et le TCC.
Expliquer que le risque de ces préjudices est plus élevé chez les patients jeunes42–44, de même qu’avec des concentrations élevées de THC45.
Lorsque les patients utilisent déjà du cannabis pour le contrôle de symptômes, les évaluer pour dépister un TCC.
Le trouble de consommation de cannabis se caractérise par une utilisation fréquente ou quotidienne, beaucoup de temps à en consommer, un rendement médiocre à l’école ou au travail, la détérioration des relations sociales, l’anxiété, la dépression et la fatigue, de même que l’incapacité de réduire ou de cesser l’usage du cannabis46. Informer les patients qui ont un TCC que leur humeur et leur fonctionnement au quotidien s’amélioreront de manière remarquable grâce à un traitement et à la réduction ou à la cessation de la consommation de cannabis. Comme c’est le cas avec d’autres troubles de consommation de substances, le TCC est souvent précipité par un problème mental, en particulier le TSPT, l’anxiété et les troubles de l’humeur. Les médecins de famille devraient dépister ces problèmes chez les patients ayant un TCC suspecté, et procéder aux interventions et aux demandes de consultation appropriées.
Adopter une approche de réduction des préjudices chez les consommateurs de cannabis qui n’ont pas de TCC.
Les conseiller sur les mesures de sécurité suivantes, expliquées dans les lignes directrices sur la réduction des risques de la consommation de cannabis47, qui incluent :
S’abstenir de conduire pendant 6 à 8 heures après avoir consommé.
Utiliser un vaporisateur plutôt que de fumer le cannabis.
Ne pas prendre simultanément avec de l’alcool, des opioïdes ou d’autres sédatifs.
Éviter les concentrations élevées de THC puissant, surtout si la personne traitée a moins de 25 ans, est enceinte ou souffre d’un trouble psychiatrique actif.
Ne diriger les patients que vers les cliniques de cannabis qui se conforment à des lignes directrices publiées et fondées sur des données probantes, et ayant reçu l’aval d’au moins 1 organisation médicale impartiale.
Les lignes directrices devraient préciser les indications, les précautions et les contre-indications du cannabis médical, de même que le protocole de dosage2,25.
Conclusion
Les données probantes en faveur du cannabis médical sont très limitées, tandis que ses préjudices sont considérables. Santé Canada devrait exiger de l’industrie qu’elle produise une monographie des produits, fondée sur des données probantes, qui dresse la liste des indications, des contre-indications et des dosages du cannabis. Santé Canada devrait aussi imposer une limite n’excédant pas 9 % à la concentration de THC présente dans les produits du cannabis. Les médecins de famille ne devraient prescrire du cannabis qu’aux patients souffrant de douleur neuropathique, et ce, à une dose quotidienne maximale de 400 mg avec une concentration de 9 % de THC et une quantité équivalente de cannabidiol. Il faudrait évaluer les patients qui utilisent du cannabis régulièrement pour dépister un éventuel TCC, et leur donner des conseils sur la façon d’éviter des préjudices liés au cannabis. Il n’est pas trop tard pour imposer des normes de pratique et des lignes directrices fondées sur des données probantes pour aider à prévenir les prescriptions excessives de cannabis.
Footnotes
Intérêts concurrents
Aucun déclaré
Les opinions exprimées dans les commentaires sont celles des auteurs. Leur publication ne signifie pas qu’elles soient sanctionnées par le Collège des médecins de famille du Canada.
Cet article a fait l’objet d’une révision par des pairs.
This article is also in English on page 864.
Références
- 1.Gouvernement du Canada [site web] Market data under the Access to Cannabis for Medical Purposes Regulations. Ottawa, ON: gouvernement du Canada; 2018. Accessible à : https://www.canada.ca/en/health-canada/services/drugs-medication/cannabis/licensed-producers/market-data.html. Réf. du 16 oct. 2019. [Google Scholar]
- 2.Allan GM, Ramji J, Perry D, Ton J, Beahm NP, Crisp N, et al. Simplified guideline for prescribing medical cannabinoids in primary care. Can Fam Physician. 2018;64:111–20. (ang), e64–75 (fr). [PMC free article] [PubMed] [Google Scholar]
- 3.Apollo Cannabis Clinics [site web] Apollo’s medical cannabis guide. Toronto, ON: Apollo Cannabis Clinics; Accessible à : https://d2s2p4r6.stackpathcdn.com/wp-content/uploads/2019/07/medical_cannabis_guide_onepager2.pdf . Réf. du 16 oct. 2019. [Google Scholar]
- 4.How cannabis can help PTSD [blogue] CanniMed.ca. 2016. Juill. Accessible à : www.cannimed.ca/blogs/blog/cannabis-and-ptsd. Réf. du 16 oct. 2019.
- 5.Jetly R, Heber A, Fraser G, Boisvert D. The efficacy of nabilone, a synthetic cannabinoid, in the treatment of PTSD-associated nightmares: a preliminary randomized, double-blind, placebo-controlled cross-over design study. Psychoneuroendocrinology. 2015;51:585–8. doi: 10.1016/j.psyneuen.2014.11.002. Publ. en ligne du 8 nov. 2014. [DOI] [PubMed] [Google Scholar]
- 6.Roitman P, Mechoulam R, Cooper-Kazaz R, Shalev A. Preliminary, open-label, pilot study of add-on oral Δ9-tetrahydrocannabinol in chronic post-traumatic stress disorder. Clin Drug Investig. 2014;34(8):587–91. doi: 10.1007/s40261-014-0212-3. [DOI] [PubMed] [Google Scholar]
- 7.O’Neil ME, Nugent SM, Morasco BJ, Freeman M, Low A, Kondo K, et al. Benefits and harms of plant-based cannabis for posttraumatic stress disorder: a systematic review. Ann Intern Med. 2017;167(5):332–40. doi: 10.7326/M17-0477. Publ. en ligne du 15 août 2017. [DOI] [PubMed] [Google Scholar]
- 8.Wilkinson ST, Radhakrishnan R, D’Souza DC. A systematic review of the evidence for medical marijuana in psychiatric indications. J Clin Psychiatry. 2016;77(8):1050–64. doi: 10.4088/JCP.15r10036. [DOI] [PubMed] [Google Scholar]
- 9.Walsh Z, Gonzalez R, Crosby K, Thiessen MS, Carroll C, Bonn-Miller MO. Medical cannabis and mental health: a guided systematic review. Clin Psychol Rev. 2017;51:15–29. doi: 10.1016/j.cpr.2016.10.002. Publ. en ligne du 12 oct. 2016. [DOI] [PubMed] [Google Scholar]
- 10.Wilkinson ST, Stefanovics E, Rosenheck RA. Marijuana use is associated with worse outcomes in symptom severity and violent behavior in patients with posttraumatic stress disorder. J Clin Psychiatry. 2015;76(9):1174–80. doi: 10.4088/JCP.14m09475. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Johnson MJ, Pierce JD, Mavandadi S, Klaus J, Defelice D, Ingram E, et al. Mental health symptom severity in cannabis using and non-using veterans with probable PTSD. J Affect Disord. 2016;190:439–42. doi: 10.1016/j.jad.2015.10.048. Publ. en ligne du 28 oct. 2015. [DOI] [PubMed] [Google Scholar]
- 12.Ruglass LM, Shevorykin A, Radoncic V, Smith KM, Smith PH, Galatzer-Levy IR, et al. Impact of cannabis use on treatment outcomes among adults receiving cognitive-behavioral treatment for PTSD and substance use disorders. J Clin Med. 2017;6(2):E14. doi: 10.3390/jcm6020014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Steenkamp MM, Blessing EM, Galatzer-Levy IR, Hollahan LC, Anderson WT. Marijuana and other cannabinoids as a treatment for posttraumatic stress disorder: a literature review. Depress Anxiety. 2017;34(3):207–16. doi: 10.1002/da.22596. Publ. en ligne du 28 févr. 2017. [DOI] [PubMed] [Google Scholar]
- 14.Petzke F, Enax-Krumova EK, Häuser W. Efficacy, tolerability and safety of cannabinoids for chronic neuropathic pain: a systematic review of randomized controlled studies [article in German] Schmerz. 2016;30(1):62–88. doi: 10.1007/s00482-015-0089-y. Erratum dans: Schmerz 2017;31(6):619. [DOI] [PubMed] [Google Scholar]
- 15.Häuser W, Fitzcharles MA, Radbruch L, Petzke F. Cannabinoids in pain management and palliative medicine. An overview of systematic reviews and prospective observational studies. Dtsch Arztebl Int. 2017;114(38):627–34. doi: 10.3238/arztebl.2017.0627. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Steigerwald S, Wong PO, Cohen BE, Ishida JH, Vali M, Madden E, et al. Smoking, vaping, and use of edibles and other forms of marijuana among U.S. adults. Ann Intern Med. 2018;169(12):890–2. doi: 10.7326/M18-1681. Publ. en ligne du 28 août 2018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Asbridge M, Hayden JA, Cartwright JL. Acute cannabis consumption and motor vehicle collision risk: systematic review of observational studies and meta-analysis. BMJ. 2012;344:e536. doi: 10.1136/bmj.e536. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Lucas P. Rationale for cannabis-based interventions in the opioid overdose crisis. Harm Reduct J. 2017;14(1):58. doi: 10.1186/s12954-017-0183-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Bachhuber MA, Saloner B, Cunningham CO, Barry CL. Medical cannabis laws and opioid analgesic overdose mortality in the United States, 1999–2010. JAMA Intern Med. 2014;174(10):1668–73. doi: 10.1001/jamainternmed.2014.4005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Pohl RV. Time trends matter: the case of medical cannabis laws and opioid overdose mortality. SSRN. 2018. Juin. Accessible à : https://ssrn.com/abstract=3192703 . Réf. du 16 oct. 2019.
- 21.Olfson M, Wall MM, Liu SM, Blanco C. Cannabis use and risk of prescription opioid use disorder in the United States. Am J Psychiatry. 2018;175(1):47–53. doi: 10.1176/appi.ajp.2017.17040413. Publ. en ligne du 26 sept. 2017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.DiBenedetto DJ, Weed VF, Wawrzyniak KM, Finkelman M, Paolini J, Schatman ME, et al. The association between cannabis use and aberrant behaviors during chronic opioid therapy for chronic pain. Pain Med. 2018;19(10):1997–2008. doi: 10.1093/pm/pnx222. [DOI] [PubMed] [Google Scholar]
- 23.Boehnke KF, Litinas E, Clauw DJ. Medical cannabis use is associated with decreased opiate medication use in a retrospective cross-sectional survey of patients with chronic pain. J Pain. 2016;17(6):739–44. doi: 10.1016/j.jpain.2016.03.002. Publ. en ligne du 19 mars 2016. [DOI] [PubMed] [Google Scholar]
- 24.Campbell G, Hall WD, Peacock A, Lintzeris N, Bruno R, Larance B, et al. Effect of cannabis use in people with chronic non-cancer pain prescribed opioids: findings from a 4-year prospective cohort study. Lancet Public Health. 2018;3(7):e341–50. doi: 10.1016/S2468-2667(18)30110-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Collège des médecins de famille du Canada . Authorizing dried cannabis for chronic pain or anxiety. Preliminary guidance. Mississauga, ON: Collège des médecins de famille du Canada; 2014. [Google Scholar]
- 26.Williams AR, Olfson M, Kim JH, Martins SS, Kleber HD. Older, less regulated medical marijuana programs have much greater enrollment rates than newer ‘medicalized’ programs. Health Aff (Millwood) 2016;35(3):480–8. doi: 10.1377/hlthaff.2015.0528. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.College of Physicians and Surgeons of Ontario . Marijuana for medical purposes. Position statement no. 8–16. Toronto, ON: College of Physicians and Surgeons of Ontario; 2016. [Google Scholar]
- 28.Kondrad EC, Reed AJ, Simpson MJ, Nease DE. Lack of communication about medical marijuana use between doctors and their patients. J Am Board Fam Med. 2018;31(5):805–8. doi: 10.3122/jabfm.2018.05.170462. [DOI] [PubMed] [Google Scholar]
- 29.Choi NG, DiNitto DM, Marti CN. Nonmedical versus medical marijuana use among three age groups of adults: associations with mental and physical health status. Am J Addict. 2017;26(7):697–706. doi: 10.1111/ajad.12598. Publ. en ligne du 18 août 2017. [DOI] [PubMed] [Google Scholar]
- 30.Kim J, Coors ME, Young SE, Raymond KM, Hopfer CJ, Wall TL, et al. Cannabis use disorder and male sex predict medical cannabis card status in a sample of high risk adolescents. Drug Alcohol Depend. 2018;183:25–33. doi: 10.1016/j.drugalcdep.2017.11.007. Publ. en ligne du 2 déc. 2017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Mackay v Purdue Pharma Inc. 2017. ONSC No. 07-CV-343201CP.
- 32.Doctors’ group wants to scrap Canada’s medical cannabis program CBC Radio. 2018. Avr. Accessible à : www.cbc.ca/radio/quirks/scrap-medical-weed-women-in-space-and-more-1.4636793/doctors-group-wants-to-scrap-canada-s-medical-cannabis-program-1.4636810. Réf. du 23 oct. 2019.
- 33.Cunningham JA, Blomqvist J, Koski-Jannes A, Raitasalo K. Societal images of cannabis use: comparing three countries. Harm Reduc J. 2012;9(1):21. doi: 10.1186/1477-7517-9-21. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.D’Amico EJ, Miles JN, Tucker JS. Gateway to curiosity: medical marijuana ads and intention and use during middle school. Psychol Addict Behav. 2015;29(3):613–9. doi: 10.1037/adb0000094. Publ. en ligne du 1er juin 2015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Wang GS, Davies SD, Halmo LS, Sass A, Mistry RD. Impact of marijuana legalization in Colorado on adolescent emergency and urgent care visits. J Adolesc Health. 2018;63(2):239–41. doi: 10.1016/j.jadohealth.2017.12.010. [DOI] [PubMed] [Google Scholar]
- 36.Hartman RL, Huestis MA. Cannabis effects on driving skills. Clin Chem. 2013;59(3):478–92. doi: 10.1373/clinchem.2012.194381. Publ. en ligne du 7 déc. 2012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Ramaekers JG, Berghaus G, van Laar M, Drummer OH. Dose related risk of motor vehicle crashes after cannabis use. Drug Alcohol Depend. 2004;73(2):109–19. doi: 10.1016/j.drugalcdep.2003.10.008. [DOI] [PubMed] [Google Scholar]
- 38.Davis GP, Compton MT, Wang S, Levin FR, Blanco C. Association between cannabis use, psychosis, and schizotypal personality disorder: findings from the National Epidemiologic Survey on Alcohol and Related Conditions. Schizophr Res. 2013;151(1–3):197–202. doi: 10.1016/j.schres.2013.10.018. Publ. en ligne du 5 nov. 2013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Di Forti M, Morgan C, Dazzan P, Pariante C, Mondelli V, Marques TR, et al. High-potency cannabis and the risk of psychosis. Br J Psychiatry. 2009;195(6):488–91. doi: 10.1192/bjp.bp.109.064220. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Martin-Santos R, Crippa JA, Batalla A, Bhattacharyya S, Atakan Z, Borgwardt S, et al. Acute effects of a single, oral dose of d9-tetrahydrocannabinol (THC) and cannabidiol (CBD) administration in healthy volunteers. Curr Pharm Des. 2012;18(32):4966–79. doi: 10.2174/138161212802884780. [DOI] [PubMed] [Google Scholar]
- 41.Meier MH, Caspi A, Ambler A, Harrington H, Houts R, Keefe RS, et al. Persistent cannabis users show neuropsychological decline from childhood to midlife. Proc Natl Acad Sci U S A. 2012;109(40):E2657–64. doi: 10.1073/pnas.1206820109. Publ. en ligne du 27 août 2012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Dragt S, Nieman DH, Becker HE, van de Fliert R, Dingemans PM, de Haan L, et al. Age of onset of cannabis use is associated with age of onset of high-risk symptoms for psychosis. Can J Psychiatry. 2010;55(3):165–71. doi: 10.1177/070674371005500308. [DOI] [PubMed] [Google Scholar]
- 43.Crean RD, Crane NA, Mason BJ. An evidence based review of acute and long-term effects of cannabis use on executive cognitive functions. J Addict Med. 2011;5(1):1–8. doi: 10.1097/ADM.0b013e31820c23fa. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Brook JS, Lee JY, Brown EN, Finch SJ, Brook DW. Developmental trajectories of marijuana use from adolescence to adulthood: personality and social role outcomes. Psychol Rep. 2011;108(2):339–57. doi: 10.2466/10.18.PR0.108.2.339-357. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Hall W, Degenhardt L. Adverse health effects of non-medical cannabis use. Lancet. 2009;374(9698):1383–91. doi: 10.1016/S0140-6736(09)61037-0. [DOI] [PubMed] [Google Scholar]
- 46.American Psychiatric Association . Diagnostic and statistical manual of mental disorders. 5e éd. Arlington, VA: American Psychiatric Publishing; 2013. [Google Scholar]
- 47.Fischer B, Russell C, Sabioni P, van den Brink W, Le Foll B, Hall W, et al. Lower-risk cannabis use guidelines: a comprehensive update of evidence and recommendations. Am J Public Health. 2017;107(8):e1–12. doi: 10.2105/AJPH.2017.303818. [DOI] [PMC free article] [PubMed] [Google Scholar]


