RESUMEN
La exacerbación de la enfermedad pulmonar obstructiva crónica y la neumonía adquirida en la comunidad son las infecciones del tracto respiratorio inferior más frecuentes en la práctica clínica diaria. La selección del antibiótico es un componente crucial en su tratamiento y, en la mayoría de las ocasiones, se realiza de forma empírica. Las sociedades científicas elaboran recomendaciones terapéuticas basadas en la evidencia científica y/o recomendaciones de expertos que son de gran ayuda para los clínicos. Los betalactámicos, las fluoroquinolonas y los macrólidos son los fármacos más utilizados por vía oral. Desde un punto de vista práctico, existen tres claves para la adecuada elección del tratamiento antibiótico oral, que son la efectividad, la seguridad y el impacto ecológico en la microbiota del paciente, incluyendo el desarrollo de resistencias, que van a ser valoradas en profundidad en esta revisión.
Palabras clave: Neumonía, EPOC, Resistencia antimicrobiana, proceso de selección, resistencia colonizacion, daño colateral, cefditoreno
ABSTRACT
Exacerbation of chronic obstructive pulmonary disease and community-acquired pneumonia are the most frequent infections of the lower respiratory tract in daily clinical practice. Antibiotic selection is a crucial component in its treatment and, in most cases, it is performed empirically. Scientific societies make therapeutic recommendations based on scientific evidence and / or expert recommendations that are of great help to clinicians. Beta-lactams, fluoroquinolones and macrolides are the most commonly used drugs for oral administration. From a practical point of view, there are three keys to the appropriate choice of oral antibiotic treatment, which are the effectiveness, safety and the ecological impact on the patient’s microbiota, including the development of resistance, which will be assessed in depth in this review.
Key words: Pneumonia, COPD, antimicrobial resistance, selection process, colonization resistance, collateral damage, cefditoren
INTRODUCCIÓN
Las infecciones del tracto respiratorio inferior son la primera causa de consulta en atención primaria y en el ámbito de la especializada, provocando especialmente durante el periodo invernal una importante sobrecarga asistencial del sistema sanitario [1]. Un elevado porcentaje de casos son de origen vírico, incluida la gripe. La preocupación estriba en el diagnóstico y tratamiento de las posibles infecciones bacterianas, para las que se requiere una indicación adecuada y juiciosa del tratamiento antibiótico. Esta decisión implica realizar una prescripción exclusiva del mismo en los casos necesarios, eficaz para evitar el fracaso terapéutico y con la duración adecuada para no incrementar las resistencias bacterianas ni los efectos adversos en el huésped. Las dos infecciones respiratorias más frecuentes en la práctica clínica habitual que van a requerir una optimización del uso de antibióticos son la exacerbación de la enfermedad pulmonar obstructiva crónica (EPOC) y la neumonía adquirida en la comunidad (NAC).
La EPOC es una enfermedad crónica de alta prevalencia; aproximadamente el 9% en los mayores de 40 años, que cursa con frecuentes exacerbaciones, en particular cuando la enfermedad se encuentra en un estadio avanzado [2]. Representa una importante causa de morbi-mortalidad y conlleva un consumo importante de recursos del sistema de salud y una pérdida de productividad. La etiología de las exacerbaciones de la EPOC es habitualmente infecciosa, tanto vírica como bacte-riana. En general, la decisión del tratamiento antimicrobiano se realiza sin esperar los resultados microbiológicos, atendiendo a la gravedad del episodio y de la propia enfermedad [3].
La NAC, con una incidencia en el adulto de 5-11 casos por 1000 habitantes/año que aumenta en personas mayores de 65 años, es la primera causa de muerte de origen infeccioso en el mundo occidental y ocasiona altos costes al sistema sanitario. No obstante, la mayor parte de las NACs presentan un desenlace favorable y pueden manejarse de forma ambulatoria [4]. La elección adecuada del tratamiento antibiótico es fundamental, ya que se asocia a mejor pronóstico y menor fracaso terapéutico. En la NAC que no requiere ingreso, el tratamiento antibiótico se realiza de forma empírica por el desconocimiento del microorganismo causal. De hecho, hasta en el 50% de las NACs se desconoce su etiología, incluso si se implementa un adecuado y exhaustivo diagnóstico microbiológico.
Las sociedades científicas emiten recomendaciones terapéuticas, tanto para la exacerbación de la EPOC como la NAC, basadas en la evidencia científica disponible o en opiniones de expertos cuando ésta no existe. Los objetivos de estas recomendaciones, que requieren frecuentes actualizaciones, es reducir la heterogeneidad, proporcionar ayuda en la toma de decisiones clínicas para disminuir la morbi-mortalidad y desarrollar estrategias preventivas. Así, la elección del tratamiento antibiótico inicial y su vía de administración dependerá de las características del paciente y la gravedad del episodio. De forma general, la vía oral se emplea en pacientes no hospitalizados, que representan la mayor parte de los episodios de NAC y de exacerbaciones de los pacientes con EPOC. Además, los antibióticos orales se utilizan en la terapia secuencial tras el tratamiento endovenoso que, en la mayoría de las ocasiones, suele iniciarse en el propio hospital durante el ingreso [5].
En la elección del antimicrobiano deben considerarse las tasas de curación demostradas en la práctica clínica, la tolerabilidad y el posible impacto en la selección de mecanismos de resistencia, tanto sobre los patógenos infectantes como en los microorganismos que integran la microbiota en cualquier localización. Por todo ello, podemos considerar que existen tres claves para la adecuada selección de antibióticos orales en las infecciones respiratorias: la efectividad, los posibles efectos adversos y el impacto en la microbiota, incluyendo la emergencia y selección de resistencias.
PRIMERA CLAVE: EFECTIVIDAD
Microorganismos frecuentes en infecciones del tracto respiratorio inferior
Exacerbación de EPOC. Aproximadamente un tercio de las exacerbaciones se deben a infecciones víricas y un 20% son de origen mixto vírica y bacteriana (porcentaje que es superior en las exacerbaciones graves). En las exacerbaciones no graves, las bacterias más habituales son Haemophilus influenzae (20-30%), Streptococcus pneumoniae (10-15%) y Moraxella catarrhalis (10-15%) [6, 7]. En el caso de las exacerbaciones graves, hay un aumento de microorganismos gramnegativos entéricos y específicamente de Pseudomonas aeruginosa (tabla 1). Los factores de riesgo para la infección por P. aeruginosa, son la hospitalización reciente, la institucionalización, la administración de antibióticos en los 3 meses previos o más de 4 veces al año, la FEV1 <30%, el tratamiento previo con corticoides orales, la presencia de bronquiectasias y la colonización o aislamiento previo de P. aeruginosa [8].
Tabla 1.
Microorganismos más frecuentes en las vías respiratorias bajas en EPOC y en NAC
| MICROORGANISMOS | ANTIBIÓTICOS INDICADOS | |
|---|---|---|
| Exacerbación EPOC | ||
| Leve |
H. influenzae S. pneumoniae M. catarrhalis |
Amoxicilina-ácido clavulánico Cefditoreno Levofloxacinoa Moxifloxacinoa |
| Moderadab |
H. influenzae S. pneumoniae M. catarrhalis + S. pneumoniaeresistente a penicilina |
Amoxicilina-ácido clavulánico Cefditoreno Levofloxacinoa Moxifloxacinoa |
| Neumonía adquirida en la comunidad |
S. pneumoniae H. influenzae M. pneumoniae |
Amoxicilina + macrólido Cefditoreno + macrólido Levofloxacinoa Moxifloxacinoa |
| NAC en EPOC |
S. pneumoniae H. influenzae M. pneumoniae |
Amoxicilina-ácido clavulánico + macrólido Cefditoreno + macrólido Levofloxacinoa Moxifloxacinoa |
Ver texto respecto a la alerta de la EMA-FDA en relación al uso de las fluoroquinolonas
Considerar factores de riesgo de P. aeruginosa
Neumonía adquirida en la comunidad. Los microorganismos causales de la NAC dependen de forma primordial de la gravedad del episodio en cuestión, de la epidemiología del área geográfica y de las comorbilidades del paciente. De forma clásica, los microorganismos más frecuentes se han estudiado estratificando a los pacientes en: ámbito ambulatorio, con ingreso hospitalario y en la UCI [9, 10] (tabla 1).
Microorganismos habituales y eficacia de los antibióticos orales
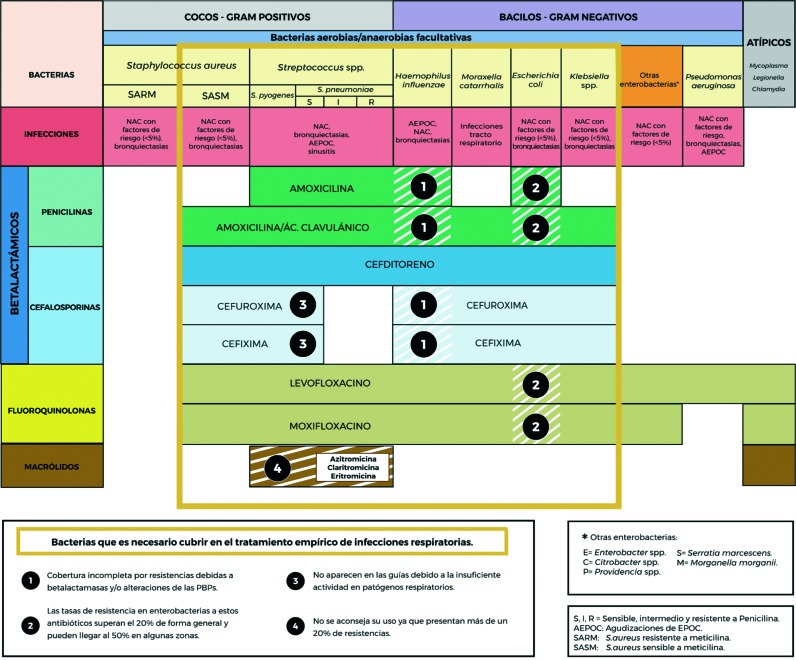
En la figura 1 se detalla de forma gráfica el espectro bacteriano de los distintos antibióticos orales frente a los microorganismos habituales en infecciones respiratorias.
Figura 1.
Representación esquematizada del espectro antimicrobiano de los principales antibióticos orales en el tratamiento de las infecciones respiratorias [143]
Streptococcus pneumoniae. La emergencia de resistencia a los antimicrobianos en este microorganismo ha sido motivo de preocupación y ha dado lugar a un considerable número de estudios para su vigilancia epidemiológica [11, 12]. Éstos también han sido propiciados por el interés derivado del uso de vacunas frente a S. pneumoniae para prevenir la infección neumocócica invasiva. El porcentaje de aislados con sensibilidad reducida a las penicilina en España en 2017, publicado en el informe del European Antimicrobial Resistance Surveillance Network (EARS-NET), fue de un 25% [13]. En la infección respiratoria y no meníngea, los puntos de corte para la penicilina que se utilizan son los del European Committee on Antimicrobial Susceptibility Testing (EUCAST) (sensible ≤0,06 mg/L) que difieren de los establecidos por el Clinical and Laboratory Standards Institute (CLSI) (sensible ≤2 mg/L) [14]. Frente a los macrólidos también se encuentra un elevado porcentaje de resistencia (21,8%) así como a penicilinas y macrólidos simultáneamente (12,4%). Domenech et al. [7], en aislados procedentes de pacientes con EPOC han encontrado una alta tasa de sensibilidad a penicilina (100%). De entre las cefalosporinas orales, cefditoreno tiene mayor actividad que cefaclor, cefuroxima y cefixima frente a neumococo [15]. De hecho, cefditoreno es la única cefalosporina oral incluida en las recomendaciones españolas para el manejo de la EPOC [3] y de la NAC [4].
Respecto a la actividad de los macrólidos frente a neumococo, la resistencia mediada por metilasas ribosomales es el mecanismo más frecuente y afecta a aquellos con anillos con una estructura con menos de 16 átomos (eritromicina, claritromicina y azitromicina).
Haemophilus influenzae. La resistencia de H. influenzae a ampicilina y amoxicilina oscila en España entre un 20-25%, debido tanto a un mecanismo de resistencia no mediado por betalactamasas como a la producción de estas enzimas. En cepas que presentan los mecanismos de resistencia anteriores, puede haber menor sensibilidad también a las cefalosporinas orales como cefaclor o cefuroxima, aunque no frente a cefditoreno. Las tasas de resistencia a cefalosporinas de 2ª generación (cefuroxima y cefaclor) varía entre 5-15% y es <1% para las de 3ª generación (ceftriaxona, cefotaxima y cefditoreno) y las fluoroquinolonas [16].
Moraxella catarrhalis. La mayoría de las cepas (75-95%) son productoras de betalactamasas (BRO-1 en el 90%, BRO-2 y BRO-3), por lo que son resistentes a las aminopenicilinas. Sin embargo, estos aislados son sensibles en un 99% a las fluoroquinolonas, amoxicilina-clavulánico y cefalosporinas de 3ª generación, porcentaje que es ligeramente inferior en las cefalosporinas de 2ª generación. En referencia a los macrólidos, la resistencia a claritromicina es menor que la de H. influenzae, teniendo azitromicina mejor actividad in vitro [16].
Tratamiento secuencial
La terapia secuencial surge para realizar la conversión del tratamiento endovenoso a la vía oral y puede hacerse con el mismo fármaco (sequential therapy), con otro antibiótico de la misma clase y equivalente (switch therapy) o bien con un antibiótico diferente (step-down therapy) [17]. En las exacerbaciones de la EPOC y NACs graves, la vía inicial de administración del fármaco es intravenosa, ya que proporciona un comienzo rápido del efecto del antibiótico y evita el paso del fármaco por el sistema gastrointestinal. Para que la terapia secuencial sea adecuada conviene que los antibióticos orales sean de la misma familia que los endovenosos [17] y de hecho, la mayoría de los antibióticos usados en la NAC y en la exacerbación de la EPOC disponen de formulación intravenosa y oral (tabla 2). En el caso de amoxicilina-clavulánico y fluoroquinolonas existen presentaciones del mismo antibiótico para ambas rutas. En el caso de las cefalosporinas intravenosas de 3ª generación, la terapia secuencial más adecuada es cefditoreno por presentar similar espectro y actividad intrínseca [18].
Tabla 2.
Tratamiento secuencial recomendado según antibiótico (modificado de [166])
| Antibiótico iv | Antibiótico ora | Biodisponibilidad (%) |
|---|---|---|
| Igual fármaco / similar AUC | ||
| Levofloxacino 500 mg/ 24 h | Levofloxacino 500 mg/ 24 h | 100 |
| Moxifloxacino 400 mg/ 24 h | Moxifloxacino 400 mg/ 24 h | 90 |
| Clindamicina 600-900 mg/ 8 h | Clindamicina 450-600 mg/ 8 h | 90 |
| Igual fármaco / menor AUC | ||
| Amoxicillina-clavulánico 1-2 g/125 mg/ 8 h | Amoxicilina-clavulánico 875 mg/125 mg/ 8 h | 75 |
| Claritromicina 500 mg/ 12 h | Claritromicina 500 mg/ 12 h | 50 |
| Azitromicina 500 mg/ 24 h | Azitromicina 500 mg/ 24 h | 40 |
| Diferente fármaco/ diferente AUC | ||
| Ceftriaxona 1-2 g/24 h | Cefditoreno 400 mg/ 12 h | - |
AUC: área bajo la curva
Los beneficios de la estrategia secuencial son directos tanto para el paciente (mayor confort, alta precoz y menor riesgo de infección nosocomial), como para el sistema sanitario (reducción de la estancia hospitalaria y de los costes) [17]. Para cumplir este doble objetivo es preciso asegurar varios puntos: similar espectro bacteriano, buena biodisponibilidad, tolerancia gastrointestinal y baja selección de mutantes resistentes en el tubo digestivo. No obstante, cuando se realiza un tratamiento secuencial es conveniente valorar la posibilidad de proceder a un desescalado (reducción del espectro antibacteriano) respecto al tratamiento empíricio inicial.
Athanassa et al. [19] realizaron un metaanálisis para evaluar la utilidad del tratamiento secuencial en la NAC hospitalizada con 6 ensayos aleatorizados (n=1.219 pacientes). Sus hallazgos muestran que no hay diferencias en los desenlaces cuando se realiza el paso a vía oral de forma precoz. Las diferencias se encuentran en menor número de días de estancia hospitalaria y de efectos adversos de los fármacos. Estos resultados se mantenían en pacientes con NAC grave. Como potenciales limitaciones están un número de pacientes no muy alto y la heterogeneidad de los estudios valorados.
Las sociedades científicas recomiendan pasar a tratamiento oral cuando el paciente ha alcanzado una estabilidad clínica o buena respuesta. En el Consenso Manejo Integral de la EPOC [3], se recomienda que los pacientes en tratamiento intravenoso con amoxicilina-clavulánico, fluoroquinolonas o macrólidos continúen con el mismo antibiótico vía oral y si recibían cefalosporinas endovenosas de 3ª generación, cefditoreno oral es el fármaco de elección al disponer de un espectro similar. Blasi et al. [20] compararon cefditoreno (5 días 200 mg/día) frente a levofloxacino (7 días 500 mg/día) en la exacerbación de EPOC, encontrando similar tasa de curación clínica, erradicación microbiológica y respuesta inflamatoria. Este estudio incluso señala que con el betalactámico los niveles de IL-6 descienden entre los días 6-9.
Recientemente, se ha evaluado el uso de un point-of-care de determinación de la proteína C reactiva (PCR) como herramienta para detectar la indicación del antibiótico en infecciones respiratorias en Urgencias, mostrándose seguro para su indicación apropiada, sin efectos adversos en la evolución. En este estudio, se prescribió un antibiótico en la visita inicial en el 47,7% de pacientes de la rama PCR frente a 69,7% en la rama de tratamiento indicado de forma habitual [21]. En una revisión de la Cochrane 2018 [22], los autores señalan que el uso de antibióticos en exacerbaciones leves puede reducir el fracaso terapéutico desde los 7 días hasta el mes de tratamiento. Tickoo et al. [23] encontraron que el uso de un panel diagnóstico de virus en las exacerbaciones leves /moderadas de la EPOC reducía el uso de antibióticos del 77 al 63% al alta de los pacientes.
En la recomendaciones de la NAC, consenso GNAC y en la NAC del anciano se recomienda entre los betaláctamicos orales amoxicilina, amoxicilina-clavulánico y cefditoreno [4, 24, 25].
Terapia combinada versus monoterapia
En la NAC el tratamiento empírico inicial recomendado para los pacientes que no requieren hospitalización plantea como dos opciones válidas, el uso de una fluoroquinolona en monoterapia o la asociación de un betalactámico y un macrólido. Esta son las recomendaciones SEPAR que se basan en la necesidad de ofrecer cobertura antibiótica frente a los microorganismos más frecuentes, que incluyen los patógenos intracelulares. En una revisión europea, los antibióticos betalactámicos son los más frecuentemente usados en monoterapia en el ámbito extrahospitalario [25b]. Esto obedece a que existen diferencias entre las distintas sociedades científicas en cuanto a las recomendaciones para el tratamiento, basadas sobre todo en patrones de resistencia locales, distintos porcentajes de microorganismos causales y/o causas epidemiológicas.
Existe cierta controversia en el uso de terapia combinada. La SEPAR y el consenso GNAC [24] realizado por varias sociedades coinciden en indicar la asociación de un betalactámico y un macrólido en lugar de monoterapia, tanto por las altas tasas de resistencia en nuestro país a los macrólidos, como por la prevalencia de bacterias atípicas y la mejor eficacia de esta asociación. El debate aún persiste. Un metaanálisis reciente [26] destaca el escaso efecto beneficioso de los macrólidos en el tratamiento de pacientes menos graves. Sin embargo, Asadi et al. [27] compararon los tratamientos con macrólido frente a una fluoroquinolona en 2.845 pacientes, encontrando menos ingresos hospitalarios y una menor mortalidad en el primer grupo (0,2% vs. 3,0%, P = 0,02).
En la neumonía grave, el efecto del macrólido se ha mostrado beneficioso y el aspecto más debatido se centra en la duración necesaria cuando se utiliza en terapia combinada. Por ello, si la respuesta clínica es adecuada, es suficiente con 5 días aunque podría acortarse dado que la azitromicina permanece mayor tiempo en tejido pulmonar [28, 29].
SEGUNDA CLAVE: SEGURIDAD DE LOS ANTIBIÓTICOS ORALES USADOS EN LAS INFECCIONES RESPIRATORIAS
La administración de antibióticos, como sucede con cualquier otro medicamento, puede conllevar la aparición de efectos adversos (EA). La incidencia no se conoce bien, aunque algunos trabajos indican que puede alcanzar el 20% [30, 31]. Los EA más comunes de los antibióticos son reacciones alérgicas y daños orgánicos, y en su desarrollo intervienen: 1) la asociación con otros fármacos, 2) el empleo de altas dosis, y 3) factores relacionados con el huésped, como la gravedad y la comorbilidad [31].
En este apartado se analizan los principales EA de los antibióticos orales más usados en el tratamiento de las infecciones respiratorias: betalactámicos, penicilinas asociadas o no a inhibidores de betalactamasas y cefalosporinas, fluoroquinolonas y macrólidos (tabla 3).
Tabla 3.
Principales efectos adversos de los antibióticos orales más usados en las infecciones respiratorias
| Efectos adversos | Betalactámicos | Macrólidos | Fluoroquinolonas |
|---|---|---|---|
| Reacciones alérgicas | ++ | + | + |
| Gastrointestinales | ++ | ++ | ++ |
| Hepatobiliares | ++a | + | + |
| Neurológicos | + | + | ++ |
| Nefrotoxicidad | + | + | ++ |
| Cardiacos | + | ++ | +++ |
| Hematológicos | + | + | + |
| Músculoesqueléticos | - | - | ++ |
| Óticos | - | + | - |
| Embarazo | - | + | + |
| Interacciones medicamentosas | - | ++ | - |
Amoxicilina-clavulánico
Efectos adversos de los antibióticos betalactámicos
Reacciones alérgicas. Las reacciones alérgicas son uno de los EA más habituales de los betalactámicos. Pueden deberse a cualquiera de los cuatro tipos inmunológicos conocidos, pero el tipo 4 es el más frecuente (tabla 4). El tipo 1, de repercusión más grave y presentación más rápida (<1 hora), suele desaparecer con el tiempo debido al descenso paulatino de los anticuerpos IgE. Esto es habitual en el caso de la penicilina, de tal forma que el 80% de los pacientes vuelven a tolerarla tras una década [32, 33]. Asimismo, las aminopenicilinas pueden producir exantemas, al menos en un 30% de los casos, cuando se administran a pacientes que tienen una mononucleosis infecciosa [34].
Tabla 4.
Tipos de reacciones alérgicos en los betalactámicos
| Tipo | Mediador | Tiempo inicio |
Manifestaciones |
|---|---|---|---|
| 1 2 3 4 |
IgE IgG, IgM y complemento Inmunocomplejos Linfocitos T |
<1 h >72 h >72 h >72 h |
Urticaria, angioedema, rinitis, bronespasmo y anafilaxia Anemia hemolítica y trombocitopenia Glomerulonefritis y enfermedad del suero Fiebre, exantema (maculopapular, morbiliforme, bulloso),erupción pustular, edema, síndrome de Stevens Johnson, necrolisis epidérmica tóxica, DRESS, nefritis, hepatitis, eosinofilia, … |
DRESS: Drug Reaction Eosinophilia and Systemic Symptoms
Con respecto a las penicilinas, el radical bencilpeniciloil es el principal responsable de la alergia en la penicilina natural [35], mientras que en las penicilinas semisintéticas se debe a metabolitos únicos procedentes de la cadena lateral [36], por lo que las reacciones cruzadas son raras entre ellas [32]. La tasa histórica del 10% de alergia a la penicilina, parece ser más baja en la realidad, ya que el 95% de los pacientes considerados alérgicos, la mayoría sin documentación, toleran la penicilina [37–39]. Por último, el menor el uso de penicilinas intravenosas ha producido un descenso de las reacciones alérgicas mediadas por IgE [40].
En el caso de las cefalosporinas, los principales determinantes son sus cadenas laterales [41, 42]. La historia autoinformada de alergia a las cefalosporinas es del 1-3% y las reacciones anafilácticas son mucho más raras (0,0001–0,1%) [43, 44]. El riesgo de reactividad cruzada entre cefalosporinas y entre cefalosporinas y penicilinas es bajo por la heterogeneidad de sus cadenas laterales [45]. En este último caso, la frecuencia es del 5%, y aún más baja con las cefalosporinas de 3ª o superior generación [33, 46]. Pero puede ocurrir cuando hay similitud entre cadenas laterales como sucede entre aminopenicilinas (ampicilina y amoxicilina) y aminocefalosporinas (cefalexina, cefaclor, cefadroxilo, cefprozilo) [32, 47–49] (tabla 5).
Tabla 5.
Posibles reacciones cruzadas de los betalactámicos orales debidas a similitudes en las cadenas laterals
| Penicilinas / cefalosporinas | Cefalosporinas / cefalosporinas | ||||
|---|---|---|---|---|---|
| Ampicilina Cefaclor Cefalexina |
Amoxicilina Cefradoxilo Cefprozilo |
Cefuroxima Cefoxitina |
Cefaclor Cefalexina |
Cefixima Cefdinir |
Cefditoreno Cefotaxima Ceftriaxona Ceftazidima |
La reactividad cruzada entre penicilinas y carbapenémicos es muy baja (<1%) [50, 51]. Hay pocos datos disponibles sobre reacciones cruzadas entre cefalosporinas y carbapenémicos [52, 53]. Lo mismo sucede entre aztreonam y otros betalactámicos, pero en general parece ser muy baja. La reactividad cruzada entre aztreonam y ceftazidima es esperable ya que comparten la misma cadena lateral, por lo que el historial comprobado de alergia en cualquiera de ellos debe impedir tratamiento con el otro [54].
Neurotoxicidad. La neurotoxicidad de los betalactámicos se ha relacionado con la degradación del anillo betalactámico, que desciende la concentración del GABA, induce la liberación de endotoxinas y citoxinas, y excita algunos receptores. Los EA pueden ser propiamente neurológicos o psiquiátricos. La encefalopatía en forma de convulsiones, psicosis, confusión, alteraciones de la personalidad, parkinsonismo, ataques de pánico y mioclonías son los más habituales. Su incidencia es desconocida, pero parece poco frecuente (< 1%) y es mayor en las edades extremas de la vida (recién nacidos y ancianos) y en caso de insuficiencia renal, enfermedades neurológicas preexistentes y administración concomitante con fármacos nefrotóxicos y anticonvulsivantes. Puede aparecer a los pocos segundos de la administración o tras más de 20 días, y normalmente es reversible con la retirada del fármaco o reducción de la dosis [55–57]. Las manifestaciones clínicas y la incidencia también dependen del betalactámico usado, y se han relacionado con los siguientes aspectos: peso molecular, lipofilia, unión a proteínas plasmáticas, bombas de flujo que lo devuelven al torrente sanguíneo (transportador de aniones de órganos), metabolismo en el sistema nervioso central y la presencia de meningitis que altera la permeabilidad de la barrera hematoencefálica, y la circulación del líquido cefalorraquídeo [55].
Gastrointestinales. Los betalactámicos orales, y en menor medida los intravenosos, producen con frecuencia náuseas, vómitos y diarrea de grado leve a moderado. Entre las penicilinas destaca ampicilina. Sin embargo, estos efectos se observan sobre todo con el ácido clavulánico, particularmente cuando se administra a dosis >250 mg, por lo que se recomienda no superar los 125 mg en cada dosis. Esta pauta queda comprometida si se necesita incrementar la dosis de amoxicilina por vía oral, ya que obliga a administrar amoxicilina y amoxicilina-clavulánico a la vez [32, 58]. Todos los betalactámicos se han relacionado con la aparición de diarrea asociada a Clostridioides difficile por la alteración que producen en la microbiota intestinal, particularmente la anaerobia, por lo que probablemente sea más acusada con fármacos con actividad frente a estos últimos patógenos (ampicilina y amoxicilina) [59, 60]. Los betalactámicos de administración parenteral han sido los más estudiados a este respecto [61–64].
Hepatobiliares. Amoxicilina-clavulánico es el medicamento más hepatotóxico. Produce una lesión mixta, hepatocelular y colestásica, retardada que aparece a los 15-30 días de iniciar el tratamiento y puede prolongarse bastante tiempo. Normalmente es de tipo reversible y no suele dejar secuelas. La edad avanzada y la duración del tratamiento han mostrado ser unos factores de riesgo [65, 66]. Se han propuesto varios mecanismos por los que los betalactámicos pueden causar alteraciones hepatobiliares: alérgicos, reacciones idiosincrásicas, daño directo sobre los hepatocitos y estasis por precipitación del fármaco [65]. Otros betalactámicos como penicilina G o V y las penicilinas isoxazólicas también pueden ocasionar este tipo de lesiones, sin embargo, son raras en las cefalosporinas [66].
Nefrotoxicidad. Los betalactámicos actuales son considerados poco nefrotóxicos y fundamentalmente producen nefritis intersticial que se relaciona con la concentración sérica del antibiótico [32, 60, 67]. La tasa de nefrotoxicidad de las cefalosporinas es muy baja (0,15%) y es mayor en los hombres que en las mujeres [68]. La combinación de vancomicina con piperacilina-tazobactam ha resultado ser más nefrotóxica que la vancomicina en monoterapia o con otro betalactámico [69].
Hematológicos. Las alteraciones hematológicas más frecuentes de los betalactámicos son agranulocitosis, neutropenia, anemia hemolítica inmunológica (mediada por IgG o complemento) y trombopenia. El 25% de las agranulocitosis se deben al uso de betalactámicos de mecanismo incierto [32]. La neutropenia se ha observado con más frecuencia con ceftarolina y piperacilina-tazobactam [70, 71], la anemia hemolítica inmunológica con las cefalosporinas y piperacilina-tazobactam [72–74], y la trombocitopenia tanto con las penicilinas como con las cefalosporinas, y suele aparecer a partir del 10º día de tratamiento [32].
Efectos adversos de los macrólidos
Los macrólidos más utilizados en la actualidad son claritromicina y azitromicina, que han desplazado a eritromicina por tener mejor posología y tolerancia.
Reacciones alérgicas. Las reacciones alérgicas con los macrólidos son raras e incluyen lesiones cutáneas, fiebre y eosinofilia. Los cuadros más graves, como el síndrome de Stevens-Johnson y la necrolisis epidérmica tóxica, son excepcionales. Suelen desaparecer con la retirada del fármaco y puede haber reacciones cruzadas entre ellos [75, 76].
Neurotoxicidad. Los efectos neurológicos son escasos y consisten fundamentalmente en cefalea y mareos. No obstante, también se han comunicado casos de delirio, alucinaciones, catatonia y movimientos coreiformes [77].
Gastrointestinales. Las alteraciones gastrointestinales (náuseas, vómitos, diarrea, dolor abdominal y alteración del gusto en el caso de claritromicina) son los EA más frecuentes de los macrólidos. Se deben a que inducen la liberación endógena de motilina con efecto procinético intestinal [78, 79].
Hepáticos. Los macrólidos sólo suelen producir elevaciones de las transaminasas leve-moderadas, generalmente reversibles y con predominio de la lesión hepatocelular sobre la colestásica [80, 81].
Hematológicos. Este tipo de EA son infrecuentes con los macrólidos. No obstante, con claritromicina se ha descrito leucopenia, agranulocitosis y trombopenia con púrpura en algunos casos [82, 83].
Cardiacos. La prolongación del intervalo QTc es un EA característico de los macrólidos. Se produce por el bloqueo de los canales del potasio localizados en el miocito. La consecuencia es un aumento del potasio intracelular con retraso de la repolarización celular que puede dar lugar a una taquicardia ventricular polimorfa (Torsade de Pointes). Cuando esta taquicardia se observa en un paciente en tratamiento con un macrólido, suele existir previamente algún otro factor de riesgo, como predisposición genética, cardiopatía estructural, arritmias, hipocalcemia, hipomagnesemia, edad avanzada y tratamiento concomitante con otros fármacos que prolongan el QTc, entre los que se encuentran los antiarrítmicos de los grupos Ia o III. Curiosamente, este aumento del QTc es más frecuente en la mujer que en el hombre. Esta alteración puede aparecer con independencia de la dosis, pero con azitromicina es más probable cuando se incrementa la misma. La incidencia de la prolongación del QTc aumenta según el macrólido utilizado en el siguiente orden creciente: eritromicina > claritromicina > azitromicina [84–87].
Ototoxicidad. La pérdida de audición y los tinnitus se han observado fundamentalmente con la administración prolongada de macrólidos a dosis elevadas, que puede llegar a ser irreversible. Parece que es debida a una disfunción transitoria de las células ciliadas en el oído interno [88].
Riesgo en el embarazo y lactancia. Claritromicina pertenece a la categoría de C de la FDA y por tanto no se recomienda durante el embarazo. Por el contrario, azitromicina está clasificada en la categoría B y no está contraindicada, ya que en estudios observacionales no se ha apreciado un mayor riesgo de malformaciones congénitas. Ambas, claritromicina y azitromicina se excretan en la leche materna [89].
Interacciones medicamentosas. Las interacciones medicamentosas son un problema habitual de los macrólidos por su capacidad para inhibir al citocromo P450 (grupo 3A4). Son menos relevantes con azitromicina. La coadministración de macrólidos con ciertos fármacos puede alterar su metabolismo y por tanto aumentar el riesgo de toxicidad [90, 91] (tabla 6).
Tabla 6.
Interacciones medicamentosas de macrólidos y fluoroquinolonas
| Macrólidos | Fluoroquinolonas |
|---|---|
| Digoxina Nelfinavir Ergotamina or dihidroergotamina Tacrolimus Terfenadina Ciclosporina Hexobarbital Estatinas Fenitoína Rifampicina Warfarina |
Olanzapina Haloperidol Amitriptilina Imipramina Duloxetina Verapamilo Propanolol Teofilina Cafeína |
Efectos adversos de las fluoroquinolonas
Las fluoroquinolonas más usadas por vía oral en nuestro entorno son ciprofloxacino, levofloxacino y moxifloxacino.
Neurológicos. Los EA localizados en el sistema nervioso periféricos suponen < 1%, su espectro clínico es muy amplio e incluye hipoestesia, hiperestesia, alodinia, paresia, síndrome de Guillain Barré y polineuropatía periférica aguda [92]. La afectación del sistema nervioso central puede llegar hasta el 2% y también es muy variada: ansiedad, inquietud, nerviosismo, euforia, alucinaciones, delirio, manía, psicosis, encefalopatía, disquinesia orofacial, mioclonía, ataxia, disartria, corea, mareo y convulsiones [92]. El efecto proconvulsionante de las fluoroquinolonas se debe al parecido de la estructura molecular de algunas de ellas con el GABA, al que desplaza y ocupa sus receptores, evitando su efecto inhibidor [93, 94]. Se ha propuesto otro mecanismo consistente en la elevación de los niveles cerebrales de glutamato y de óxido nítrico que aumenta el estrés oxidativo y nitrosativo [95]. Por último, también parece existir una predisposición genética en algunos pacientes [96].
Cutáneos. Las fluoroquinolonas se asocian con la aparición de diferentes lesiones cutáneas (eritemas, bullas, púrpura y pigmentaciones cutáneas) y fototoxicidad. Esta última está muy relacionada con la estructura de las fluoroquinolonas, en particular con la adición de un átomo de un halógeno en la posición 8 de la molécula, mientras que disminuye si la sustitución es un grupo metoxi. La probabilidad de fototoxicidad sigue este orden creciente: ciprofloxacino > levofloxacino > moxifloxacino [92, 97].
Digestivos. Los EA más frecuentes de las fluoroquinolonas son los digestivos: dispepsia, náuseas, vómitos y diarrea. Las náuseas y vómitos también pueden ser de origen central por neurotoxicidad [92]. Las alteraciones hepáticas consisten habitualmente en elevaciones leves de las transaminasas [66, 92]. Las fluoroquinolonas, como otros antibióticos, también son un factor de riesgo para la aparición de diarrea asociada a C. difficile [62]. Algunos estudios sugieren que es más común con moxifloxacino, probablemente debido a su actividad frente a anaerobios y mayor concentración en las heces al ser eliminada por vía biliar [97, 98].
Cardiovasculares. Las fluoroquinolonas producen un incremento del intervalo QTc por el mismo mecanismo que los macrólidos y con idénticas consecuencias, es decir aumentan el riesgo de arritmias ventriculares como la Torsade de Pointes, que puede conllevar un paro cardiaco e la incluso muerte. El riesgo del incremento del QTc varía según la fluoroquinolona (moxifloxacino > levofloxacino > ciprofloxacino) [97]. Los factores de riesgo son similares a los de los macrólidos: sexo femenino, cardiopatías previas, hipopotasemia, hipomagnesemia, dosis altas de fluoroquinolona y administración concomitante con otros fármacos que también incrementan el intervalo QTc como los antiarrítmicos de la clase Ia (quinidina) y III (amoidarona), entre otros [86, 99, 100].
Alteraciones del colágeno. El tratamiento con fluoroquinolonas se ha asociado tradicionalmente con un aumento del riesgo de condropatía y tendinopatía (tendinitis y rotura tendinosa, sobre todo del tendón de Aquiles) y más recientemente con el desprendimiento de retina, aneurismas de aorta torácicos y disección aguda de aorta [101]. Se han implicado varios mecanismos en la producción de estos EA, algunos de los cuales son comunes. La alteración del colágeno, presente en todas estas estructuras, parece el principal [101–105]. El colágeno supone el 70% de la composición de los tendones con predominio del tipo I (90%) sobre el tipo III (10%). En la aorta es un componente importante de la capa media, aunque la proporción de los tipos está invertida [102]. Las fluoroquinolonas alcanzan una gran concentración en el tejido conjuntivo y producen un incremento de la actividad proteolítica de un grupo de enzimas denominadas metalproteinasas dependientes del Zinc que de forma natural degradan el colágeno y la elastina [102–105]. Por otro lado, se han descubierto unas glucoproteínas transmembrana, llamadas β1 integrinas, localizadas en las células de los cartílagos y tendones, dependientes del magnesio, encargadas de la comunicación intercelular, entre células y la matriz, y de la activación de la mitogen-activated protein kinase (MAPK) que interviene en la diferenciación y supervivencia de los condrocitos. Las fluoroquinolonas, por su capacidad de fijar cationes divalentes con los que forman complejos, hace lo propio con el magnesio y consecuentemente alteran la función de estas integrinas β1, que favorece la destrucción tisular y la apoptosis celular, como se ha comprobado por el incremento de caspasa 3. Este déficit de magnesio es más notable en el cartílago y tendón que en otros tejidos ya que carecen de irrigación sanguínea y la compensación es más lenta. La adición de magnesio reduce este efecto deletéreo de las fluoroquinolonas [106–108]. Estás lesiones son más pronunciadas con ciprofloxacino que con levofloxacino y en presencia de esteroides [106, 108]. Hasta ahora, la condrotoxicidad de las fluoroquinolonas sólo se ha comprobado en cartílagos inmaduros de animales. La ausencia en humanos puede explicarse por la forma del crecimiento de su cartílago, lenta y con periodos de latencia, a diferencia de la de los animales usados en experimentación, más rápida y continua, y por el hecho de que las fluoroquinolonas sólo dañan el cartílago en evolución [108].
Los problemas tendinosos se observan preferentemente en adultos de más de 60 años, a diferencia de la condropatía, que acontece en las etapas de crecimiento, y su asociación con el uso de fluoroquinolonas ha sido plenamente aceptada por la comunidad médica. La tendinitis se suele manifestar con dolor, inflamación e hinchazón del tendón afecto, que pueden prolongarse durante semanas y acabar en una rotura del mismo. La rotura tendinosa puede ocurrir tras un periodo asintomático de latencia de semanas [108]. El riesgo de rotura del tendón de Aquiles es 4,1 veces mayor con la utilización de fluoroquinolonas y son más susceptibles los atletas y los pacientes de más de 60 años, con insuficiencia renal y en tratamiento con esteroides [109–113].
Varios estudios publicados en los últimos años, empleando diferentes métodos y poblaciones, y dos metaanálisis han mostrado una asociación significativa de las fluoroquinolonas con los aneurismas de aorta torácicos y la disección aórtica, aunque la relación causal definitiva no está todavía probada [101, 113–119]. Asimismo, se ha observado que el riesgo es mayor con el tratamiento actual que con el previo, con la duración > 14 días, la prescripción de antibióticos en los 60 días previos y con la edad > 70 años [113–115].
La relación entre las fluoroquinolonas y el desprendimiento de retina no es tan clara [101, 120–122]. En esta falta de asociación podrían intervenir el predominio del colágeno de tipo II en la interfase vitroretiniana en vez del I y III, y la ausencia de tensión a la que están sometidos los tendones y la aorta [113, 123].
Alteración de la glucemia. Las alteraciones de la glucemia, tanto por defecto como por exceso, también se han observado con el uso de las fluoroquinolonas, particularmente con moxifloxacino. La hipoglucemia parece ser debida al bloqueo de los canales de potasio en los islotes pancreáticos que libera insulina, y la hiperglucemia a la vacuolización de las células β pancreáticas que reducen su secreción de insulina y a la producción de epinefrina que es un regulador de la glucemia [92, 124, 125].
Interacciones medicamentosas. La absorción oral de las fluoroquinolonas puede verse afectada cuando se administran junto a antiácidos que contienen magnesio y aluminio con los que forman complejos, particularmente cuando se administran en las dos horas previas. Este efecto puede obviarse si los antiácidos se toman al menos dos horas después de la fluoroquinolona [92, 126]. Ciprofloxacino es un inhibidor del CYP1A2 y puede alterar el aclaramiento de algunos fármacos: olanzapina, haloperidol, amitriptilina, imipramina, duloxetina, verapamilo, propanolol, teofilina y cafeína. Levofloxacino se elimina mayoritariamente por vía renal inmodificado y moxifloxacino se glucuroniza en el hígado (tabla 6) [92, 127, 128].
Riesgo en el embarazo y lactancia. Las fluoroquinolonas, como los macrólidos, están incluidos en la categoría C de la FDA sobre el uso de fármacos en el embarazo, es decir esta agencia no recomienda su uso bajo esta circunstancia si hay otra alternativa disponible. Además, las fluoroquinolonas atraviesan la placenta y pueden ser detectadas en el líquido amniótico a bajas concentraciones. Sin embargo, hay varios estudios en los que el uso de fluoroquinolonas en el embarazo no se ha seguido de forma significativa de un aumento de abortos, malformaciones congénitas y recién nacidos con bajo peso, ni de un descenso de embarazos a término [129].
El conjunto de estos EA de las fluoroquinolonas antes descritos ha sido valorado a lo largo de estos últimos años por las principales agencias reguladoras de medicamentos (FDA y EMA), llegando a la conclusión de que algunos son incapacitantes, de larga duración y potencialmente permanentes.
En consecuencia, recomiendan a los médicos que no deben usar estos fármacos en las siguientes situaciones:
Tratamiento de infecciones autolimitadas o leves (faringitis, amigdalitis y bronquitis aguda)
Profilaxis de la diarrea del viajero o de las infecciones recurrentes de las vías urinarias bajas
Infecciones no bacterianas (prostatitis no bacteriana)
Infecciones leves o moderadas (cistitis no complicadas, exacerbaciones agudas de EPOC, rinosinusitis bacteriana aguda y otitis media aguda), a menos que no se puedan emplear otros antibióticos comúnmente recomendados
En pacientes con antecedentes de reacciones adversas graves tras la administración de este tipo de antibióticos
Asimismo, recomiendan una especial precaución del uso de fluoroquinolonas en pacientes con: edad avanzada, insuficiencia renal, trasplante de órganos sólidos o tratamiento concomitante con corticosteroides. Por último, aconsejan a los médicos que indiquen a los pacientes que interrumpan el tratamiento y acudan a un facultativo ante la aparición de los primeros signos/síntomas sugestivos de una reacción adversa como: tendinitis, rotura tendinosa, neuropatía periférica y efectos sobre el sistema nervioso central [130–133].
TERCERA CLAVE: ECOLOGÍA Y DESARROLLO DE RESISTENCIAS EN LA INFECCIÓN RESPIRATORIA EN LA COMUNIDAD
El uso de un antimicrobiano en cualquier tipo de infección tiene como objetivo la eliminación del microrganismo causante de la misma. No obstante, condicionado por un efecto darwiniano de selección, los antimicrobianos pueden determinar el desarrollo de resistencias, no solo en el propio microorganismo infectante sino también en los microrganismos que integran la microbiota del paciente. Ambas situaciones pueden producirse simultánea o separadamente durante el curso del tratamiento antimicrobiano.
Dado que las infecciones respiratorias constituyen una de las patologías más prevalentes y que la demanda de antimicrobianos en estas infecciones es elevada, sobre todo en números absolutos en el ámbito extrahospitalario, su potencial impacto en el desarrollo de resistencias es muy elevado [134]. Se ha documentado ampliamente el desarrollo de resistencia durante el tratamiento de procesos respiratorios crónicos como los que se incluyen en la denominada colonización o infección bronquial crónica. Es habitual que los pacientes con este tipo de infección, como la que se produce en el contexto de la EPOC, la bronquitis crónica o las bronquiectasias, precisen durante las exacerbaciones la utilización de diferentes ciclos de tratamiento con antimicrobianos [135, 136]. En la NAC el proceso de selección es menos probable y depende del tipo de antimicrobiano, la dosis o la duración del tratamiento [137].
En este apartado se revisarán algunos de los conceptos que marcan el desarrollo de resistencia a los antimicrobianos en relación a los patógenos bacterianos que producen infección respiratoria en los pacientes extrahospitalarios, así como su posible impacto sobre la microbiota del paciente y el diferente efecto que ejercen entre ellos.
Selección de mutantes resistentes en el foco de la infección, ventana de selección y concentración preventiva de mutantes
El desarrollo de resistencias a los antimicrobianos en el patógeno responsable de la infección está condicionado tanto por las características del antibiótico utilizado y el microorganismo causante de la infección en relación a los mecanismos de resistencia como por el lugar de la infección. En la infección respiratoria, sobre todo en situaciones asociadas a un proceso crónico, como la EPOC o el paciente con bronquiectasias, el inóculo bacteriano es elevado (107 ufc/ml), muy superior al que existe en el compartimento sanguíneo cuando se produce una bacteriemia (10-102 ufc/ml) [136]. Durante las exacerbaciones de la infección crónica que acontece en estas situaciones puede incrementarse aún más este inóculo y en este caso, la probabilidad de que existan mutantes resistentes dentro de la población bacteriana es muy elevada y lo que es más peligroso, su persistencia en el tiempo. El antibiótico, una vez que ha sido administrado y ha alcanzado el lugar de la infección, por ejemplo, la mucosa respiratoria o el líquido de revestimiento epitelial, ejercería su efecto inhibitorio o letal sobre la subpoblación sensible mayoritaria, pero no sobre la subpoblación resistente minoritaria que podría hacerse mayoritaria durante el curso del tratamiento antimicrobiano [138]. Se ha comprobado que la ausencia de erradicación bacteriana con el tratamiento antimicrobiano en las exacerbaciones en la EPOC o en la bronquitis crónica se asocia con una mayor probabilidad de desarrollo de resistencias [139].
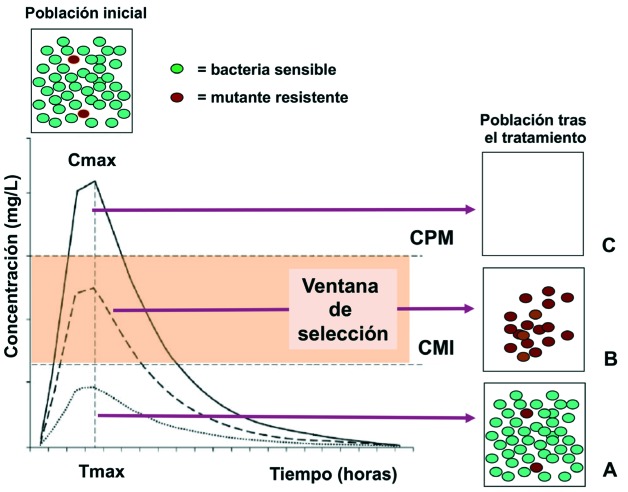
La selección de mutantes resistentes se produce típicamente en un rango de concentraciones denominado “ventana de selección”. Su límite inferior está delimitado por una concentración similar a la de la concentración mínima inhibitoria (CMI) y el límite superior por la denominada concentración preventiva de mutantes (CPM). Este último valor, sería la concentración mínima óptima de antimicrobiano que debería alcanzarse en el lugar de la infección para evitar que se seleccionen los mutantes resistentes, ya que a esta concentración o por encima de ella, los antimicrobianos podrían continuar ejerciendo su efecto inhibitorio o letal sobre estos mutantes [138]. La figura 2 ilustra la probabilidad de que esto ocurra en tres situaciones: cuando las concentraciones de antimicrobiano en el foco de infección se mantienen por debajo de la CMI, cuando se sitúan en valores correspondientes a la ventana de selección o cuando alcanzan valores por encima del valor de la CPM.
Figura 2.
Emergencia de mutantes resistentes en las poblaciones bacterianas durante el tratamiento antimicrobiano.
Se produce con mayor probabilidad cuando la concentración del antimicrobiano se encuentra por encima del valor de la concentración mínima inhibitoria (CMI) y por debajo de la concentración preventiva de mutantes (CPM) (ventana de selección) (B), siendo menor si se supera el valor de la MPC (C). Cuando la concentración está por debajo de la CMI (A), el efecto de selección sería bajo al no ejercerse un efecto deletéreo en la población bacteriana sensible o en la resistente.
Se ha comprobado en modelos in vitro que algunas fluoroquinolonas, como ciprofloxacino, tienen una ventana de selección amplia frente a S. pneumoniae o P. aeruginosa en comparación con la que presentan otras como levofloxacino [140]. En modelos animales o durante la administración de los antimicrobianos, la selección de los mutantes resistentes puede ser algo más compleja ya que estaría también relacionada con la farmacocinética del antibiótico en el lugar de la infección (por ejemplo la concentración en el líquido de revestimiento epitelial en la infección respiratoria), la duración del tiempo en el que se alcanzan concentraciones iguales o superiores a la CPM y la actividad intrínseca del antimicrobiano y su farmacodinamia (CMI y efecto bactericida o bacteriostático). Este hecho se complica por la compartimentalización del nicho ecológico del trato respiratorio ya que las concentraciones del antimicrobiano pueden no ser homogéneas en toda su extensión, así como el inóculo bacteriano, situación más evidente en la infección respiratoria crónica. Es por ello por lo que en la infección bronquial crónica pueden coexistir diferentes poblaciones de una misma cepa con expresión de diferentes valores de sensibilidad. Esta situación se ha estudiado ampliamente con P. aeruginosa en el paciente con fibrosis quística o con bronquiectasias [141].
Selección de mutantes resistentes en relación al mecanismo de resistencia: resistencia por mutaciones o ligadas a elementos de transferencia horizontal
Un aspecto que también ha de tenerse en cuenta es cómo se producen los propios mecanismos de resistencia a los antimicrobianos. El modelo de selección anteriormente explicado es fácilmente comprensible para aquellos mecanismos que se relacionan con mutaciones en genes cromosómicos, como las que confieren resistencia a las fluoroquinolonas, que se produce por mutaciones en las girasas o topoisomerasa, o a los betalactámicos, debido a mutaciones en las PBPs (proteínas fijadoras de penicilinas) o en los genes de regulación de los mecanismos de eflujo. Ejemplos de ello serían la resistencia a las fluoroquinolonas en S. pneumoniae, a la penicilina o a las cefalosporinas de 3ª generación (cefotaxima o ceftriaxona) en este mismo microorganismo o a la ampicilina no mediada por betalactamasas en H. influenzae y a algunos betalactámicos antipseudomónicos en P. aeruginosa.
En el caso de los mecanismos de resistencia adquiridos, por ejemplo, la producción de betalactamasas en H. influenzae o en M. catarrhalis ligadas a la adquisición de plásmidos (elementos extracromosómicos que pueden albergar genes de resistencia y que se transmiten entre las bacterias), la selección podría producirse una vez que el microorganismo adquiriese estos elementos de resistencia o, simplemente, cuando el paciente se infecta por un microorganismo con este mecanismo de resistencia, situación que impediría la acción adecuada del antimicrobiano.
Los mecanismos de resistencia por mutación y por transferencia de genes no son excluyentes entre sí en un mismo microorganismo y pueden afectar a un solo antimicrobiano, a antimicrobianos de la misma familia o a antimicrobianos de diferentes familias. En este sentido, la resistencia en H. influenzae está aumentando en algunas áreas geográficas no solo por la adquisición de genes relacionados con la producción de betalactamasa sino también por mutaciones en los genes cromosómicos de las PBPs (esencialmente el gen fstI que codifica la PBP3) [142]. Como consecuencia de ello se produce resistencia a las aminopenicilinas (ampicilina y amoxicilina) pero también a la asociación de amoxicilina con el ácido clavulánico y a las cefalosporinas de 1ª (cefaclor) y 2ª generación (cefuroxima). Estos aislados se denominan “betalactamasa positivo resistentes a amoxicilina-clavulánico” (BLPACR). Las cefalosporinas de tercera generación tendrían una afectación parcial e incluirá a cefotaxima y cefixima, siendo mucho más estable cefditoreno. Esta situación se ve reflejada en diferentes estudios epidemiológicos que recogen valores similares o escasamente incrementados de CMI90 en las cepas de H. influenzae “betalactamasa negativa” (≤0.0-0.06 mg/L) y de aquellas que producen betalactamasa “betalactamasa positivo” (≤0,03-0,06 mg/L), “resistentes a ampicilina no productoras de betalactamasas” (BLNAR) (0,03-0,06 mg/L) y BLPACR (0,06 mg/L). Los valores correspondientes de CMI90 para amoxicilina-clavulánico serían 1-8 mg/L, 2-4 mg/L, 4 mg/L y 8 mg/L, respectivamente, y para cefuroxima 1-8 mg/L, 2-8 mg/L, 2-16 mg/L y 16 mg/L, respectivamente [143].
La frecuencia de aislados de H. influenzae BLNAR con mutaciones en el gen ftsI que afectan a la PBP3 se ha incrementado en países como Japón en los que el uso de cefalosporinas orales es muy elevado [142]. En modelos in vitro en los que se favorece la trasformación (proceso por el que determinadas bacterias pueden adquirir fragmentos de DNA exógeno, incluyendo genes de resistencia) se ha comprobado que la ventana de selección de los transformantes con el gen ftsI mutado para las penicilinas es inferior a la de las cefalosporinas. Sin embargo, entre esta últimas existe una gran variación ya que el cefditoreno es la cefalosporina oral que previene el proceso de transformación con menor concentración (0.06-0.5 mg/L) siendo muy elevada la concentración que se precisaría en el caso de la cefuroxima (>16 mg/L) [144]. Las concentraciones de ceftditoreno que se alcanzan en el lugar de la infección impedirían esta trasformación y su efecto bactericida prevendría igualmente su emergencia [145–147].
Este tipo de estudios no se ha realizado hasta la fecha con cefalosporinas orales y S. pneumoniae. Sin embargo, se ha comprobado en modelos dinámicos in vitro con aislados con diferentes PBPs mutadas (pbp1a, pbp2x y pbp2b) que estas mutaciones afectan drásticamente a los valores de CMI de penicilina (2-4 mg/L), cefuroxima (4 mg/L), cefixima (16 mg/ml), cefaclor (64 mg/mL) y en menor medida al cefditoreno (0,5-1 mg/L), debido en parte a que este último antimicrobiano mantiene un efecto de reducción del inóculo bacteriano (>2 log10) frente a estos aislados a las 24 horas, efecto que no se llega a producir con amoxicilina y el resto de las cefalosporinas ensayadas. Este efecto se mantiene en poblaciones mixtas de aislados de S. pneumoniae con y sin mutaciones en las PBPs que mimetizarían escenarios en el que podrían emerger mutantes con genes de PBPs que se asocian con resistencia a la penicilina y las cefalosporinas [148]. Esta situación, unida nuevamente a la mejor actividad intrínseca del cefditoreno con respecto a otros betalactámicos, incluso en los mutantes resistentes que podrían emerger, abogaría por una menor posibilidad de selección in vivo de los mismos con el tratamiento con este antimicrobiano [149].
Un peligro futuro, no solo en la ecología de S. pneumoniae sino también en la de H. influenzae, es la emergencia y dispersión de aislados resistentes a las cefalosporinas de tercera generación. En S. pneumoniae está ampliamente documentada la existencia y dispersión de dichos aislados y su limitación en un futuro podría conseguirse con el aumento en el uso de las vacunas frente a serotipos de este microorganismo con resistencia elevada a penicilina y/o cefalosporinas y al uso de antimicrobianos, tal como se indicó en el párrafo anterior, con mayor actividad intrínseca frente a los aislados resistentes [12]. En H. influenzae, se ha documentado en algunos países (Francia, Japón) que la perdida de actividad de cefotaxima y ceftriaxona frente a este patógeno se debe a mutaciones adicionales (8350N, S357N, M377I y S385T) a las encontradas habitualmente (G555E y Y557H) en el gen ftsI [150, 151]. Estos aislados son poco frecuentes en España, pero debido a la globalización y situación geográfica de nuestro país podrían aumentar en un futuro [152].
Es por ello necesario conocer la epidemiología de los mecanismos de resistencia y su prevalencia tanto a nivel mundial como regional para poder adaptar las guías terapéuticas a la epidemiologia local [136, 153].
Efecto de los antimicrobianos sobre el microbioma: daño colateral y resistencia de colonización
El uso de los antimicrobianos puede también ejercer un efecto deletéreo sobre los microorganismos que forman parte de las comunidades bacterianas que colonizan de manera habitual y natural los diferentes territorios del organismo. En el caso de las infecciones respiratorias, debe evaluarse el efecto de los antimicrobianos tanto en la microbiota del trato respiratorio como en la de otras localizaciones, esencialmente en el tracto intestinal. Este hecho se denomina “daño colateral” e implica el efecto ecológico negativo de los antimicrobianos sobre la microbiota, incluyendo el desarrollo o emergencia de resistencia [154]. Ha sido medido mayoritariamente en el tracto intestinal, ya que es lugar donde existe un mayor número de bacterias integrando la microbiota y por ello donde es más fácil que se produzcan efectos deletéreos y selección de bacterias resistentes. También suele incluirse en el daño colateral la emergencia de infección por C. difficile (ICD) [155]. La aplicación de nuevas técnicas de secuenciación ha ampliado la visión del efecto ecológico que ejercen los antimicrobianos sobre la microbiota intestinal y su impacto a corto y medio plazo.
El efecto de las diferentes familias de antimicrobianos sobre la microbiota intestinal ha sido revisado con relativa frecuencia [156–159]. La tabla 7 recoge globalmente el impacto de distintas familias de antimicrobianos sobre diferentes grupos de microorganismos, la posible emergencia de mecanismos de resistencia y el efecto sobre C. difficile. El hecho de que estas situaciones puedan darse depende de la alteración del estado natural de la microbiota, denominado “resistencia de colonización”, por el cual determinados microorganismos o comunidades residentes integrantes de esta microbiota (en general anaerobios) evitan la sobrecolonización por microorganismos patógenos (en general aerobios) [160, 161]. Los antimicrobianos suelen determinar una reducción de la diversidad y abundancia de determinadas bacterias (en general de las enterobacterias y de los microorganismos anaerobios) haciendo que el nicho ecológico perturbado pueda ocuparse por bacterias resistentes seleccionadas por el propio antimicrobiano o que se adquieran fácilmente otras bacterias resistentes o patógenas como es el caso de C. difficile. Se pierde por tanto el estado natural de “resistencia de colonización” y el carácter resiliente de las comunidades bacterianas que ocupan de forma habitual el nicho ecológico [162].
Tabla 7.
Efecto ecológico de los antimicrobianos sobre la microbiota intestinal, incluyendo el desarrollo (emergencia) de resistencia (datos tomados de las referencias [53–56]).
| Agente | Impacto en microbiota | Emergencia de resistencia | Sobrecrecimientode C. difficile | ||||
|---|---|---|---|---|---|---|---|
| Grampositivos aerobios | Enterobacterias | Bacterias anaerobias | Enterococos | Enterobacterias | Bacteroides | ||
| Penicilinas | ↑ | ↑ | ↑↓ | - | + | - | (+) |
| Penicilina-inhibidores de betalactamasas | ↑ | ↑ | ↓ | - | + | + | - |
| Cefalosporinas | ↑ | ↓↓ | ↓ | - | (+) | - | (+) |
| Carbapenémicos | ↑ | ↓ | ↓ | - | - | - | - |
| Quinolonas | ↓ | ↓↓ | ↓ | - | + | (+) | + |
| Macrólidos | ↑↓ | ↓↓ | ↓ | (+) | + | + | - |
| Glucopéptidos | ↑↓ | ↑ | ↓ | + | - | - | - |
| Oxazolidinonas | ↓ | ↑ | ↓↓ | (+) | - | + | - |
| Cotrimoxazol | - | ↓↓ | - | - | (+) | - | - |
↑: aumento de las poblaciones; ↓: disminución de las poblaciones; +: emergencia de resistencia o sobrecrecimiento; (+): escasa emergencia de resistencia o sobrecrecimiento; -: ausencia de emergencia de resistencia o de sobrecrecimiento
La mayoría de los datos publicados en relación al daño colateral se ha realizado con antimicrobianos de amplio espectro utilizados en el ámbito hospitalario (cefalosporinas de tercera y cuarta generación y carbapenémicos), siendo menor, con la excepción de las asociaciones de penicilinas e inhibidores de betalactamasas (amoxicilina-clavulánico), fluoroquinolonas o clindamicina, con otros antimicrobianos como las cefalosporinas orales [156–159]. En general los antibióticos betalactámicos tienen un efecto perturbador bajo sobre los microorganismos anaerobios, pero pueden provocar la selección de enterobacterias productoras de betalactamasas de espectro extendido (BLEE) e incluso de las productoras de carbapenemasas, sobre todo en ambientes o países en las que por su elevada prevalencia constituyen un problema de salud pública [155]. También se asocian algunos de ellos, como las penicilinas o algunas cefalosporinas, con la emergencia de ICD (tabla 7). Las fluoroquinolonas afectan de manera importante a las enterobacterias y tiene un marcado efecto en el desarrollo de ICD, siendo mucho mayor en este último caso cuando se administra clindamicina [158].
Las asociaciones de betalactámicos, esencialmente penicilinas, e inhibidores de betalactamasas tiene un efecto elevado sobre las proporciones y abundancia de los microorganismos anaerobios (disminuyen por tanto la resistencia de colonización) y aumentan el número de enterobacterias, por lo que es sencillo el desarrollo de resistencias en este grupo de microorganismos [158, 159]. El efecto sobre las poblaciones anaerobias determina que con frecuencia aparezca diarrea como efecto secundario, llegando a producirse hasta casi en el 20% de los pacientes. Con las cefalosporinas este porcentaje se sitúa en torno 5%, como ha sido recogido para el cefditoreno [163].
Un caso particular sería el que se produce a nivel de la vía aérea. El tracto respiratorio inferior ha sido considerado tradicionalmente como un nicho estéril. Sin embargo, gracias al empleo de técnicas de secuenciación, se ha demostrado que existen comunidades bacterianas integradas por microorganismos anaerobios que cuando se administran antimicrobianos reducen su diversidad, favoreciéndose la colonización por microorganismos patógenos. La mayoría de los estudios se han realizado en pacientes con fibrosis quística o bronquiectasias, siendo menor con pacientes con EPOC o con neumonía aguda [164]. Lamentablemente, el impacto del tratamiento sobre la microbiota respiratoria únicamente ha sido estudiado con pocos pacientes y para un grupo reducido de antimicrobianos. También los resultados están influenciados por la situación basal de cada paciente y es por tanto difícil de establecer conclusiones generales más allá de la reducción de la biodiversidad y de la abundancia de los diferentes grupos de microorganismos. No obstante, parte de la microbiota es resiliente y permite su recuperación con el tiempo por lo que es complejo establecer concusiones generales [165]. En muchos casos los datos dependen de cada individuo y deben evaluarse de forma individual a lo largo del tiempo.
CONCLUSIONES
La efectividad, seguridad e impacto ecológico son, por razones obvias, los tres principios básicos o “claves” que deben regir la elección del antibiótico oral más apropiado en la exacerbación de la EPOC y la NAC. Los betalactámicos, particularmente cefditoreno, y las fluoroquinolonas (levofloxacino y moxifloxacino) son los que tiene el mejor espectro y mayor actividad intrínseca sobre los microorganismos más habituales de estas infecciones, incluidos los que expresan mecanismos de resistencia. Los betalactámicos son los más seguros y con menos interacciones medicamentosas. Las fluoroquinolonas por sus efectos sobre el colágeno han pasado a ser considerados una alternativa. Desde el punto de vista ecológico todos pueden debilitar la barrera de colonización, facilitar la diarrea asociada a C. difficile y seleccionar mutantes resistentes en la microbiota. Para disminuir este riesgo es conveniente evitar los que actúan sobre los microorganismos anaerobios y se eliminan por vía biliar, particularmente en pacientes con riesgo de desarrollar una diarrea asociada a C. difficile.
CONFLICTOS DE INTERÉS
Este manuscrito ha sido redactado exclusivamente por los autores firmantes como parte de un material de formación financiado por Meiji Pharma Spain, S.A.
References
- 1.Troeger CE, Blacker BF, Khalil IA, Zimsen SRM, Albertson SB, Abate D, et al. Mortality, morbidity, and hospitalisations due to influenza lower respiratory tract infections, 2017: an analysis for the Global Burden of Disease Study 2017. Lancet Respir Med 2019;7:69-89. doi: 10.1016/S2213-2600(18)30496-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Miravitlles M, Soler-Cataluña JJ, Calle M, Molina J, Almagro P, Quintano JA, et al. Guía española de la EPOC (GesEPOC). Actualiza-ción 2014. Arch Bronconeumol 2014;50:1-16. doi: 10.1016/s0300-2896(14)70070-5. [DOI] [Google Scholar]
- 3.González Del Castillo J, Candel FJ, de la Fuente J, Gordo F, Martín-Sánchez FJ, Menéndez R, et al. Manejo integral del paciente con exacerbación aguda de la enfermedad pulmonar obstructiva cróni-ca. Rev Esp Quimioter 2018;31:461-84. PMid: . [PMC free article] [PubMed] [Google Scholar]
- 4.Menéndez R, Torres A, Aspa J, Capelastegui A, Prat C, Rodríguez de Castro F. Neumonía adquirida en la comunidad. Nueva nor-mativa de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR). Arch Bronconeumol 2010;46:543-58. doi: 10.1016/j.ar-bres.2010.06.014. [DOI] [PubMed] [Google Scholar]
- 5.Cyriac JM, James E. Switch over from intravenous to oral thera-py: A concise overview. J Pharmacol Pharmacother 2014;5:83-7. doi: 10.4103/0976-500X.130042. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Wilson R, Sethi S, Anzueto A, Miravitlles M. Antibiotics for treatment and prevention ofexacerbations of chronic obstructi-ve pulmonary disease. J Infect 2013;67:497-515. doi: 10.1016/j.jinf.2013.08.010. [DOI] [PubMed] [Google Scholar]
- 7.Domenech A, Puig C, Martí S, Santos S, Fernández A, Calatayud L, et al. Infectious etiology of acute exacerbations insevere COPD patients. J Infect 2013;67:516-23. doi: 10.1016/j.jinf.2013.09.003. [DOI] [PubMed] [Google Scholar]
- 8.Gallego M, Pomares X, Espasa M, Castañer E, Solé M, Suárez D, et al. Pseudomonas aeruginosa isolates in severe chronic obstructive pulmonary disease: Characterization and risk factors. BMC Pulm Med 2014;14:103. doi: 10.1186/1471-2466-14-103. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Cillóniz C, Polverino E, Ewig S, Aliberti S, Gabarrús A, Menéndez R, et al. Impact of age and comorbidity on cause and outcome in community-acquired pneumonia. Chest 2013;144:999-1007. doi: 10.1378/chest.13-0062. [DOI] [PubMed] [Google Scholar]
- 10.Sahuquillo-Arce JM, Menéndez R, Méndez R, Amara-Elori I, Za-lacain R, Capelastegui A, et al. Age-related risk factors for bac-terial aetiology in community-acquired pneumonia. Respirology 2016;21:1472-9. doi: 10.1111/resp.12851. [DOI] [PubMed] [Google Scholar]
- 11.Fenoll A, Granizo JJ, Giménez MJ, Yuste J, Aguilar L. Secular trends (1990-2013) in serotypes and associated non-susceptibility of S. pneumoniae isolates causing invasive disease in the pre-/post-era of pneumococcal conjugate vaccines in Spanish regions without universal paediatric pneumococcal vaccination. Vaccine 2015;33:5691-9. doi: 10.1016/j.vaccine.2015.08.009. [DOI] [PubMed] [Google Scholar]
- 12.Fenoll A, Aguilar L, Giménez MJ, Vicioso MD, Robledo O, Granizo JJ, et al. Variations in serotypes and susceptibility of adult non-invasive Streptococcus pneumoniae isolates between the periods before (May 2000-May 2001) and 10 years after (May 2010-May 2011) introduction of conjugate vaccines for child immunisation in Spain. Int J Antimicrob Agents 2012;40:18-23. doi: 10.1016/j.ijantimicag.2012.03.001. [DOI] [PubMed] [Google Scholar]
- 13.European Centre for Disease Prevention and Control. Surveillance of antimicrobial resistance in Europe Annual report of the European Antimicrobial Resistance Surveillance Network (EARS-Net) 2017. 2018. doi: 10.2900/230516 https://www.ecdc.europa.eu›documents›AMR-surveillance-EARS-Net-2017 (accedido 20 noviembre 2019) [DOI]
- 14.Larrosa MN, Benito N, Cantón R, Canut A, Cercenado E, Fernández-Cuenca F, et al. From CLSI to EUCAST, a necessary step in Spanish laboratories. Enferm Infecc Microbiol Clin 2018. pii: . doi: 10.1016/j.eimc.2018.09.014. [DOI] [PubMed] [Google Scholar]
- 15.Cantón R, Morosini M, Loza E, Gomez G, de la Pedrosa EGG. Infec-ciones comunitarias. Patrones de sensibilidad a los antimicrobianos utilizados por vía oral de los microorganismos más comunes. Rev Clin Esp. 2008;208:S3-11. [Google Scholar]
- 16.Jimenez AJ, Candel Gonzalez FJ, Piñra Salmeron P, Gonzalez del Castillo J, Moya Mir M, Martinez Ortiz de Zarate M. Recomendacio-nes de INFURG-SEMES: Manejo de la infeccion respiratoria de vias bajas en urgencias. Rev Científica la Soc Española Med Urgencias y Emergencias 2009;3:23. [Google Scholar]
- 17.Menendez R, Montull B, Mendez R. Antibiotic choice, route and duration: Minimising the harm associated with antibiotics. Eur Respir Monogr 2014;63:155-67. doi: 10.1183/1025448x.10004113. [DOI] [Google Scholar]
- 18.Wedzicha JA, Miravitlles M, Hurst JR, Calverley PMA, Albert RK, An-zueto A, et al. Management of COPD exacerbations: A European Respiratory Society/American Thoracic Society guideline. Eur Res-pir J 2017;50:1600791. doi: 10.1183/13993003.791-2016. [DOI] [Google Scholar]
- 19.Athanassa Z, Makris G, Dimopoulos G, Falagas ME. Early switch to oral treatment in patients with moderate to severe community-acquired pneumonia: A meta-analysis. Drugs 2008;68:2469-81. doi: 10.2165/0003495-200868170-00005. [DOI] [PubMed] [Google Scholar]
- 20.Blasi F, Tarsia P, Mantero M, Morlacchi LC, Piffer F. Cefditoren versus levofloxacin in patients with exacerbations of chronic bronchitis: Serum inflammatory biomarkers, clinical efficacy, and microbiological eradication. Ther Clin Risk Manag 2013;9:55-64. doi: 10.2147/TCRM.S41131. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Butler CC, Gillespie D, White P, Bates J, Lowe R, Thomas-Jones E, et al. C-reactive protein testing to guide antibiotic prescribing for COPD exacerbations. N Engl J Med 2019;381:111-20. doi: 10.1056/NEJMoa1803185. [DOI] [PubMed] [Google Scholar]
- 22.Vollenweider DJ, Frei A, Steurer-Stey CA, Garcia-Aymerich J, Puhan MA. Antibiotics for exacerbations of chronic obstructive pulmo-nary disease. Cochrane Database Syst Rev 2018;2018:CD010257. doi: 10.1002/14651858.CD010257.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Tickoo M, Ruthazer R, Bardia A, Doron S, Andujar-Vazquez GM, Gardiner BJ, et al. The effect of respiratory viral assay panel on antibiotic prescription patterns at discharge in adults admitted with mild to moderate acute exacerbation of COPD: A retrospecti-ve before-after study. BMC Pulm Med 2019;19:118. doi: 10.1186/s12890-019-0872-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Torres A, Barberán J, Falguera M, Menéndez R, Molina J, Olaechea P, et al. Guía multidisciplinar para la valoración pronóstica, diag-nóstico y tratamiento de la neumonía adquirida en la comunidad. Med Clin (Barc) 2013;140:223.e1-223.e19. doi: 10.1016/j.med-cli.2012.09.034. [DOI] [PubMed] [Google Scholar]
- 25.González del Castillo J, Martín-Sánchez FJ, Llinares P, Menéndez R, Mujal A, Navas E, et al. Guía de consenso para el abordaje de la neumonía adquirida en la comunidad en el paciente ancia-no. Rev Esp Geriatr Gerontol 2014;49:279-91. doi: 10.1016/j.re-gg.2014.04.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25b.Torres A, Blasi F, Peetermans WE, Viegi G, Welte T. The aetiology and antibiotic management of community-acquired pneumonia in adults in Europe: a literature review-Eur J Clin Microbiol Infect Dis. 2014; 33(7): 1065–1079. doi: 10.1007/s10096-014-2067-1 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Pakhale S, Mulpuru S, Verheij TJM, Kochen MM, Rohde GGU, Bje-rre LM. Antibiotics for community-acquired pneumonia in adult outpatients. Cochrane Database Syst Rev 2014;2014:CD002109. doi: 10.1002/14651858.CD002109.pub4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Asadi L, Eurich DT, Gamble JM, Minhas-Sandhu JK, Marrie TJ, Ma-jumdar SR. Guideline adherence and macrolides reduced morta-lity in outpatients with pneumonia. Respir Med 2012;106:451-8. doi: 10.1016/j.rmed.2011.11.017. [DOI] [PubMed] [Google Scholar]
- 28.Arnold FW, Lopardo G, Wiemken TL, Kelley R, Peyrani P, Mattin-gly WA, et al. Macrolide therapy is associated with lower morta-lity in community-acquired bacteraemic pneumonia. Respir Med 2018;140:115-21. doi: 10.1016/j.rmed.2018.05.020. [DOI] [PubMed] [Google Scholar]
- 29.Feldman C, Richards G. Appropriate antibiotic management of bacterial lower respiratory tract infections. F1000Research 2018;7. doi: 10.12688/f1000research.14226.1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Shehab N, Patel PR, Srinivasan A, Budnitz DS. Emergency De-partment Visits for Antibiotic Associated Adverse Events. Clin In-fect Dis 2008;47:735-43. doi: 10.1086/591126. [DOI] [PubMed] [Google Scholar]
- 31.Tamma PD, Avdic E, Li DX, Dzintars K, Cosgrove SE. Association of adverse events with antibiotic use in hospitalized patients. JAMA Intern Med 2017;177:1308-15. doi: 10.1001/jamaintern-med.2017.1938. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Lagacé-Wiens P, Rubinstein E. Adverse reactions to β-lactam anti-microbials. Expert Opin Drug Saf 2012;11:381-99. doi: 10.1517/14740338.2012.643866. [DOI] [PubMed] [Google Scholar]
- 33.Trubiano JA, Franklin Adkinson N, Phillips EJ. Penicillin allergy is not necessarily forever. JAMA-J Am Med Assoc 2017;318:82-3. doi: 10.1001/jama.2017.6510. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Pavlos R, White KD, Wanjalla C, Mallal SA, Phillips EJ. Severe De-layed Drug Reactions: Role of Genetics and Viral Infections. Im-munol Allergy Clin North Am 2017; 37(4):785-815. doi: 10.1016/j.iac.2017.07.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Schafer JA, Mateo N, Parlier GL, Rotschafer JC. Penicillin aller-gy skin testing: What do we do now? Pharmacotherapy 2007; 27(4):542-5. doi: 10.1592/phco.27.4.542. [DOI] [PubMed] [Google Scholar]
- 36.Yates AB. Management of Patients with a History of Aller-gy to Beta-Lactam Antibiotics. Am J Med 2008; 121(7):572-6. doi: 10.1016/j.amjmed.2007.12.005. [DOI] [PubMed] [Google Scholar]
- 37.Sacco KA, Bates A, Brigham TJ, Imam JS, Burton MC. Clinical outco-mes following inpatient penicillin allergy testing: A systematic re-view and meta-analysis. Allergy Eur J Allergy Clin Immunol 2017; 72(9):1288-1296. doi: 10.1111/all.13168. [DOI] [PubMed] [Google Scholar]
- 38.Macy E, Contreras R. Health care use and serious infection pre-valence associated with penicillin «allergy» in hospitalized pa-tients: A cohort study. J Allergy Clin Immunol 2014; 133(3):790-6. doi: 10.1016/j.jaci.2013.09.021. [DOI] [PubMed] [Google Scholar]
- 39.Blumenthal KG, Shenoy ES, Huang M, Kuhlen JL, Ware WA, Par-ker RA, et al. The impact of reporting a prior penicillin allergy on the treatment of methicillin-sensitive Staphylococcus aureus bacteremia. PLoS One 2016;11:e0159406. doi: 10.1371/journal.po-ne.0159406. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Macy E, Schatz M, Lin C, Poon K. The falling rate of positive pe-nicillin skin tests from 1995 to 2007. Perm J 2009;13:12-8. doi: 10.7812/tpp/08-073. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Park MA, Li JTC. Diagnosis and management of penicillin allergy. Mayo Clin Proc 2005;80:405-10. doi: 10.4065/80.3.405. [DOI] [PubMed] [Google Scholar]
- 42.Moreno E, Macías E, Dávila I, Laffond E, Ruiz A, Lorente F. Hy-persensitivity reactions to cephalosporins. Expert Opin Drug Saf 2008;7:295-304. doi: 10.1517/14740338.7.3.295 [DOI] [PubMed] [Google Scholar]
- 43.Romano A, Guéant-Rodriguez RM, Viola M, Amoghly F, Gaeta F, Nicolas JP, et al. Diagnosing immediate reactions to cephalos-porins. Clin Exp Allergy 2005;122:521-7. doi: 10.1111/j.1365-2222.2005.02317.x. [DOI] [PubMed] [Google Scholar]
- 44.Macy E. Penicillin and Beta-Lactam Allergy: Epidemiology and Diagnosis. Curr Allergy Asthma Rep 2014;14:476. doi: 10.1007/s11882-014-0476-y. [DOI] [PubMed] [Google Scholar]
- 45.Solensky R. Allergy to β-lactam antibiotics. J Allergy Clin Immunol 2012;130:1442. doi: 10.1016/j.jaci.2012.08.021. [DOI] [PubMed] [Google Scholar]
- 46.Campagna JD, Bond MC, Schabelman E, Hayes BD. The use of cephalosporins in penicillin-allergic patients: A literature review. J Emerg Med 2012;45:612-20.. doi: 10.1016/j.jemermed.2011.05.035. [DOI] [PubMed] [Google Scholar]
- 47.Romano A, Gaeta F, Valluzzi RL, Maggioletti M, Zaffiro A, Caruso C, et al. IgE-mediated hypersensitivity to cephalosporins: Cross-reac-tivity and tolerability of alternative cephalosporins. J Allergy Clin Immunol 2015;136:685-91. doi: 10.1016/j.jaci.2015.03.012. [DOI] [PubMed] [Google Scholar]
- 48.Ledford DK. Cephalosporin Side Chain Cross-reactivity. J Allergy Clin Immunol Pract 2015;3:1006-7. doi: 10.1016/j.jaip.2015.08.014. [DOI] [PubMed] [Google Scholar]
- 49.Zagursky RJ, Pichichero ME. Cross-reactivity in β-lactam Aller-gy. J Allergy Clin Immunol Pract 2018;6:72-81. doi: 10.1016/j.jaip.2017.08.027. [DOI] [PubMed] [Google Scholar]
- 50.Kula B, Djordjevic G, Robinson JL. A systematic review: Can one prescribe carbapenems to patients with IgE-mediated allergy to penicillins or cephalosporins? Clin Infect Dis 2014;59:1113-22. doi: 10.1093/cid/ciu587. [DOI] [PubMed] [Google Scholar]
- 51.Wall GC, Nayima VA, Neumeister KM. Assessment of hypersensi-tivity reactions in patients receiving carbapenem antibiotics who report a history of penicillin allergy. J Chemother 2014;26:150-3. doi: 10.1179/1973947813Y.0000000127. [DOI] [PubMed] [Google Scholar]
- 52.Gaeta F, Valluzzi RL, Alonzi C, Maggioletti M, Caruso C, Romano A. Tolerability of aztreonam and carbapenems in patients with IgE-mediated hypersensitivity to penicillins. J Allergy Clin Immunol 2015;135:972-6. doi: 10.1016/j.jaci.2014.10.011. [DOI] [PubMed] [Google Scholar]
- 53.Noguerado-Mellado B, Pinto Fernández C, Pineda-Pineda R, Mar-tínez Lezcano P, Álvarez-Perea A, De Barrio Fernández M. Cross-reactivity between carbapenems: Two case reports. J Allergy Clin Immunol Pract 2014;2:816-7. doi: 10.1016/j.jaip.2014.06.015. [DOI] [PubMed] [Google Scholar]
- 54.Frumin J, Gallagher JC. Allergic cross-sensitivity between penicillin, carbapenem, and monobactam antibiotics: What are the chances? Ann Pharmacother 2009; 43:305-15. doi: 10.1345/aph.1L486. [DOI] [PubMed] [Google Scholar]
- 55.Deshayes S, Coquerel A, Verdon R. Neurological Adverse Effects At-tributable to β-lactam Antibiotics: A Literature Review. Drug Saf 2017;40:1171-98. doi: 10.1007/s40264-017-0578-2. [DOI] [PubMed] [Google Scholar]
- 56.Chow KM, Hui AC, Szeto CC. Neurotoxicity induced by beta-lactam antibiotics: From bench to bedside. Eur J Clin Microbiol Infect Dis 2005;24:649-53. doi: 10.1007/s10096-005-0021-y. [DOI] [PubMed] [Google Scholar]
- 57.Hornik CP, Benjamin DK, Smith PB, Pencina MJ, Tremoulet AH, Capparelli E V., et al. Electronic Health Records and Pharmacokinetic Modeling to Assess the Relationship between Ampicillin Exposure and Seizure Risk in Neonates. J Pediatr 2016. doi: 10.1016/j.jpeds.2016.07.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Bush LM, Johnson CC. Ureidopenicillins and beta-lactam/be-talactamase inhibitor combinations. Infect Dis Clin North Am 2000;14:409-33. DOI: 10.1016/s0891-5520(05)70255-5 [DOI] [PubMed] [Google Scholar]
- 59.Mavros MN, Alexiou VG, Vardakas KZ, Tsokali K, Sardi TA, Falagas ME, et al. Underestimation of Clostridium difficile infection among clinicians: An international survey. Eur J Clin Microbiol Infect Dis 2012;31:2439-44. doi: 10.1007/s10096-012-1587-9. [DOI] [PubMed] [Google Scholar]
- 60.Vardakas KZ, Kalimeris GD, Triarides NA, Falagas ME. An update on adverse drug reactions related to β-lactam antibiotics. Expert Opin Drug Saf 2018;17:499-508. doi: 10.1080/14740338.2018.1462334. [DOI] [PubMed] [Google Scholar]
- 61.Deshpande A, Pasupuleti V, Thota P, Pant C, Rolston DDK, Sferra TJ, et al. Community-associated Clostridium difficile infection antibio-tics: A meta-analysis. J Antimicrob Chemother 2013;68:1951-61. doi: 10.1093/jac/dkt129. [DOI] [PubMed] [Google Scholar]
- 62.Slimings C, Riley T V. Antibiotics and hospital-acquired Clostridium difficile infection: Update of systematic review and meta-analysis. J Antimicrob Chemother 2014;69:881-91. doi: 10.1093/jac/dkt477. [DOI] [PubMed] [Google Scholar]
- 63.Shiber S, Yahav D, Avni T, Leibovici L, Paul M. β-lactam/ β-lactamase inhibitors versus carbapenems for the treatment of sepsis: syste-matic review and meta-analysis of randomized controlled trial. J Antimicrob Chemother 2015;70:41-7. doi: 10.1093/jac/dku351 [DOI] [PubMed] [Google Scholar]
- 64.Vardakas KZ, Trigkidis KK, Boukouvala E, Falagas ME. Clostridium difficile infection following systemic antibiotic administration in randomised controlled trials: a systematic review and meta-analy-sis. Int J Antimicrob Agents 2016;48:1-10. doi: 10.1016/j.ijantimi-cag.2016.03.008 [DOI] [PubMed] [Google Scholar]
- 65.deLemos AS, Ghabril M, Rockey DC, Gu J, Barnhart HX, Fontana RJ, et al. Amoxicillin–Clavulanate-Induced Liver Injury. Dig Dis Sci 2016;61:2406-16. doi: 10.1007/s10620-016-4121-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Björnsson ES. Drug-induced liver injury due to antibiotics. Scand J Gastroenterol 2017;52:617-23. doi: 10.1080/00365521.2017.1291719. [DOI] [PubMed] [Google Scholar]
- 67.Imani S, Buscher H, Marriott D, Gentili S, Sandaradura I. Too much of a good thing: A retrospective study of β-lactam concentration-toxicity relationships. J Antimicrob Chemother 2017;72:2891-7. doi: 10.1093/jac/dkx209. [DOI] [PubMed] [Google Scholar]
- 68.Macy E, Contreras R. Adverse reactions associated with oral and parenteral use of cephalosporins: A retrospective population-based analysis. J Allergy Clin Immunol 2015;135:745-52. doi: 10.1016/j.jaci.2014.07.062. [DOI] [PubMed] [Google Scholar]
- 69.Hammond DA, Smith MN, Li C, Hayes SM, Lusardi K, Bookstaver PB. Systematic review and metaanalysis of acute kidney injury asso-ciated with concomitant vancomycin and piperacillin/tazobactam. Clin Infect Dis 2017;64:666-74. doi: 10.1093/cid/ciw811. [DOI] [PubMed] [Google Scholar]
- 70.Brigg Turner R, Erin Wilson D, Saedi-Kwon H, Chang E, Won R, Chan D, et al. Comparative analysis of neutropenia in patients re-ceiving prolonged treatment with ceftaroline. J Antimicrob Che-mother 2018;73:772-8. doi: 10.1093/jac/dkx452. [DOI] [PubMed] [Google Scholar]
- 71.Lemieux P, Grégoire JP, Thibeault R, Bergeron L. Higher risk of neu-tropenia associated with piperacillin-tazobactam compared with ticarcillin-clavulanate in children. Clin Infect Dis 2015;60:203-7. doi: 10.1093/cid/ciu780. [DOI] [PubMed] [Google Scholar]
- 72.Garratty G. Immune hemolytic anemia associated with drug the-rapy. Blood Rev 2010;24:143-50. doi: 10.1016/j.blre.2010.06.004. [DOI] [PubMed] [Google Scholar]
- 73.Garratty G, Arndt PA. Drugs that have been shown to cause drug-induced immune hemolytic anemia or positive direct antiglobulin tests: Some interesting findings since 2007. Immunohematology 2014;30:66-79. [PubMed] [Google Scholar]
- 74.Garbe E, Andersohn F, Bronder E, Klimpel A, Thomae M, Schre-zenmeier H, et al. Drug induced immune haemolytic anaemia in the Berlin Case-Control Surveillance Study. Br J Haematol 2011;154:644-53. doi: 10.1111/j.1365-2141.2011.08784.x. [DOI] [PubMed] [Google Scholar]
- 75.Mori F, Pecorari L, Pantano S, Rossi ME, Pucci N, De Martino M, et al. Azithromycin anaphylaxis in children. Int J Immunopathol Phar-macol 2014;27:121-6. doi: 10.1177/039463201402700116. [DOI] [PubMed] [Google Scholar]
- 76.Sriratanaviriyakul N, Nguyen LP, Henderson MC, Albertson TE. Drug reaction with eosinophilia and systemic symptoms syndrome (DRESS) syndrome associated with azithromycin presenting like septic shock: A case report. J Med Case Rep 2014. doi: 10.1186/1752-1947-8-332. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77.Bandettini Di Poggio M, Anfosso S, Audenino D, Primavera A. Clarithromycin-induced neurotoxicity in adults. J Clin Neurosci 2011;18:313-8. doi: 10.1016/j.jocn.2010.08.014. [DOI] [PubMed] [Google Scholar]
- 78.Periti P, Mazzei T, Mini E, Novelli A. Adverse Effects of Macrolide Antibacterials. Drug Saf 1993;9:346-64. doi: 10.2165/00002018-199309050-00004. [DOI] [PubMed] [Google Scholar]
- 79.Catnach SM, Fairclough PD. Erythromycin and the gut. Gut 1992;33:397-401. doi: 10.1136/gut.33.3.397. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 80.Martinez MA, Vuppalanchi R, Fontana RJ, Stolz A, Kleiner DE, Ha-yashi PH, et al. Clinical and histologic features of azithromycin-induced liver injury. Clin Gastroenterol Hepatol 2015;13:369-76. doi: 10.1016/j.cgh.2014.07.054. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Chalasani N, Bonkovsky HL, Fontana R, Lee W, Stolz A, Talwalkar J, et al. Features and outcomes of 899 patients with drug-indu-ced liver injury: The DILIN prospective study. Gastroenterology 2015;148:1340-52. doi: 10.1053/j.gastro.2015.03.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 82.Price T, Tuazon C. Clarithromycin-induced thrombocytopenia. Clin Infect Dis 1992;15:563-4. [DOI] [PubMed] [Google Scholar]
- 83.Jacobs P, Conforti A, Wood L, Kiuru A, Jones GO, Woolf D. Immune agranulocytosis and clarithromycin. Hematology 2004;9:291-6. do i: 10.1080/10245330410001714220. [DOI] [PubMed] [Google Scholar]
- 84.Svanström H, Pasternak B, Hviid A. Use of azithromycin and death from cardiovascular causes. N Engl J Med 2013;368:1704-12. doi: 10.1056/NEJMoa1300799. [DOI] [PubMed] [Google Scholar]
- 85.Chou HW, Wang JL, Chang CH, Lai CL, Lai MS, Chan KA. Risks of cardiac arrhythmia and mortality among patients using new-generation macrolides, fluoroquinolones, and β-lactam/ β-lactamase inhibitors: A Taiwanese nationwide study. Clin Infect Dis 2015;60:566-77. doi: 10.1093/cid/ciu914. [DOI] [PubMed] [Google Scholar]
- 86.Cornett E, Novitch MB, Kaye AD, Pann CA, Bangalore HS, Allred G, et al. Macrolide and fluoroquinolone mediated cardiac arrhyth-mias: clinical considerations and comprehensive review. Postgrad Med 2017;129:715-24. doi: 10.1080/00325481.2017.1362938. [DOI] [PubMed] [Google Scholar]
- 87.Wong AYS, Chan EW, Anand S, Worsley AJ, Wong ICK. Managing Cardiovascular Risk of Macrolides: Systematic Review and Meta-Analysis. Drug Saf 2017;40:663-77. doi: 10.1007/s40264-017-0533-2. [DOI] [PubMed] [Google Scholar]
- 88.Ress BD, Gross EM. Irreversible sensorineural hearing loss as a result of azithromycin ototoxicity. A case report. Ann Otol Rhinol Laryngol 2000. doi: 10.1177/000348940010900416. [DOI] [PubMed]
- 89.Bar-Oz B, Weber-Schoendorfer C, Berlin M, Clementi M, Di Gia-nantonio E, De Vries L, et al. The outcomes of pregnancy in women exposed to the new macrolides in the first trimester: A prospec-tive, multicentre, observational study. Drug Saf 2012;35:589-98. doi: 10.2165/11630920-000000000-00000. [DOI] [PubMed] [Google Scholar]
- 90.Periti P, Mazzei T, Mini E, Novelli A. Pharmacokinetic Drug Inte-ractions of Macrolides. Clin Pharmacokinet 1992;23:106-31. doi: 10.2165/00003088-199223020-00004. [DOI] [PubMed] [Google Scholar]
- 91.Gandhi S, Fleet JL, Bailey DG, McArthur E, Wald R, Rehman F, et al. Calcium-channel blocker-clarithromycin drug interactions and acute kidney injury. JAMA 2013;310:2544-53. doi: 10.1001/ja-ma.2013.282426. [DOI] [PubMed] [Google Scholar]
- 92.Douros A, Grabowski K, Stahlmann R. Safety issues and drug-drug interactions with commonly used quinolones. Expert Opin Drug Metab Toxicol 2015;11:1849-59. doi: 10.1517/17425255.2014.970166. [DOI] [PubMed] [Google Scholar]
- 93.Mandell L, Tillotson G. Safety of fluoroquinolones: An Update. Can J Infect Dis 2002;13:54-61. doi: 10.1155/2002/864789. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 94.Tomé AM, Filipe A. Quinolones: Review of psychiatric and neurological adverse reactions. Drug Saf 2011;34:465-88. doi: 10.2165/11587280-000000000-00000. [DOI] [PubMed] [Google Scholar]
- 95.Abdel-Zaher AO, Afify AHM, Kamel SM, Farghaly HM, El-Osely GM, El-Awaad EAM. Involvement of glutamate, oxidative stress and in-ducible nitric oxide synthase in the convulsant activity of cipro-floxacin in mice. Eur J Pharmacol 2012;685:30-7. doi: 10.1016/j.ejphar.2012.04.007. [DOI] [PubMed] [Google Scholar]
- 96.Bennett AC, Bennett CL, Witherspoon BJ, Knopf KB. An evaluation of reports of ciprofloxacin, levofloxacin, and moxifloxacin-asso-ciation neuropsychiatric toxicities, long-term disability, and aortic aneurysms/dissections disseminated by the Food and Drug Admi-nistration and the European Medicines Agency. Expert Opin Drug Saf 2019;18:1055-63. doi: 10.1080/14740338.2019.1665022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 97.Liu HH. Safety profile of the fluoroquinolones: Focus on levo-floxacin. Drug Saf 2010;33:353-69. doi: 10.2165/11536360-000000000-00000. [DOI] [PubMed] [Google Scholar]
- 98.Gaynes R, Rimland D, Killum E, Ken Lowery H, Johnson II TM, Kill-gore G, et al. Outbreak of Clostridium difficile Infection in a Long Term Care Facility: Association with Gatifloxacin Use . Clin Infect Dis 2004;38:640-5. doi: 10.1086/381551. [DOI] [PubMed] [Google Scholar]
- 99.Kang J, Wang L, Chen XL, Triggle DJ, Rampe D. Interactions of a series of fluoroquinolone antibacterial drugs with the hu-man cardiac K+ channel HERG. Mol Pharmacol 2001;59:122-6. doi: 10.1124/mol.59.1.122. [DOI] [PubMed] [Google Scholar]
- 100.Stahlmann R, Lode HM. Risks associated with the therapeutic use of fluoroquinolones. Expert Opin Drug Saf 2013;12:497-505. doi: 10.1517/14740338.2013.796362. [DOI] [PubMed] [Google Scholar]
- 101.Yu X, Jiang DS, Wang J, Wang R, Chen T, Wang K, et al. Fluoroqui-nolone Use and the Risk of Collagen-Associated Adverse Events: A Systematic Review and Meta-Analysis. Drug Saf 2019;42:1025-33. doi: 10.1007/s40264-019-00828-z. [DOI] [PubMed] [Google Scholar]
- 102.Carino D, Zafar MA, Singh M, Ziganshin BA, Elefteriades JA. Fluo-roquinolones and Aortic Diseases: Is There a Connection. AORTA 2019;7:35-41. doi: 10.1055/s-0039-1693468. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 103.Tsai WC, Hsu CC, Chen CPC, Chang HN, Wong AMK, Lin MS, et al. Ciprofloxacin up-regulates tendon cells to express matrix meta-lloproteinase-2 with degradation of type i collagen. J Orthop Res 2011;29:67-73. doi: 10.1002/jor.21196. [DOI] [PubMed] [Google Scholar]
- 104.Reviglio VE, Hakim MA, Song JK, O’Brien TP. Effect of topical fluo-roquinolones on the expression of matrix metalloproteinases in the cornea. BMC Ophthalmol 2003;3:10. doi: 10.1186/1471-2415-3-10. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 105.Guzzardi DG, Teng G, Kang S, Geeraert PJ, Pattar SS, Svystonyuk DA, et al. Induction of human aortic myofibroblast-mediated extracellular matrix dysregulation: A potential mechanism of fluoroquinolone-associated aortopathy. J Thorac Cardiovasc Surg 2019;157:109-19. doi: 10.1016/j.jtcvs.2018.08.079. [DOI] [PubMed] [Google Scholar]
- 106.Sendzik J, Shakibaei M, Schäfer-Korting M, Stahlmann R. Fluoro-quinolones cause changes in extracellular matrix, signalling prote-ins, metalloproteinases and caspase-3 in cultured human tendon cells. Toxicology 2005;212:24-36. doi: 10.1016/j.tox.2005.04.002. [DOI] [PubMed] [Google Scholar]
- 107.Shakibaei M, Schulze-Tanzil G, De Souza P, John T, Rahmanzadeh M, Rahmanzadeh R, et al. Inhibition of Mitogen-activated Protein Kinase Kinase Induces Apoptosis of Human Chondrocytes. J Biol Chem 2001;276:13289-94. doi: 10.1074/jbc.M010859200. [DOI] [PubMed] [Google Scholar]
- 108.Sendzik J, Lode H, Stahlmann R. Quinolone-induced arthropathy: an update focusing on new mechanistic and clinical data. Int J Antimicrob Agents 2009;33:194-200. doi: 10.1016/j.ijantimi-cag.2008.08.004. [DOI] [PubMed] [Google Scholar]
- 109.Corrao G, Zambon A, Bertù L, Mauri A, Paleari V, Rossi C, et al. Evi-dence of tendinitis provoked by fluoroquinolone treatment a case-control study. Drug Saf 2006;29:889-96. doi: 10.2165/00002018-200629100-00006. [DOI] [PubMed] [Google Scholar]
- 110.Schwald N, Debray-Meignan S. Suspected role of ofloxacin in a ca-se of arthalgia, myalgia, and multiple tendinopathy. Rev du Rhum (English Ed 1999;66:419-21. [PubMed] [Google Scholar]
- 111.Tsai WC, Yang YM. Fluoroquinolone-associated Tendinopathy. Chang Gung Med J 2011;34:461-7. [PubMed] [Google Scholar]
- 112.Bidell MR, Lodise TP. Fluoroquinolone-Associated Tendinopathy: Does Levofloxacin Pose the Greatest Risk? Pharmacotherapy 2016;36:679-93. doi: 10.1002/phar.1761. [DOI] [PubMed] [Google Scholar]
- 113.Daneman N, Lu H, Redelmeier DA. Fluoroquinolones and collagen associated severe adverse events: a longitudinal cohort study. BMJ Open 2015;5:e010077. doi: 10.1136/bmjopen-2015-010077. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 114.Lee CC, Lee MT, Chen YS, Lee SH, Chen YS, Chen SC, et al. Risk of aortic dissection and aortic aneurysm in patients taking oral fluo-roquinolone. JAMA Intern Med 2015;175:1839-47. doi: 10.1001/jamainternmed.2015.5389. [DOI] [PubMed] [Google Scholar]
- 115.Lee CC, Lee MG, Hsieh R, Porta L, Lee WC, Lee SH, et al. Oral Fluo-roquinolone and the Risk of Aortic Dissection. J Am Coll Cardiol 2018;72:1369-78. doi: 10.1016/j.jacc.2018.06.067. [DOI] [PubMed] [Google Scholar]
- 116.Pasternak B, Inghammar M, Svanström H. Fluoroquinolone use and risk of aortic aneurysm and dissection: Nationwide cohort study. BMJ 2018;360:k678. doi: 10.1136/bmj.k678. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 117.Meng L, Huang J, Jia Y, Huang H, Qiu F, Sun S. Assessing fluoroqui-nolone-associated aortic aneurysm and dissection: Data mining of the public version of the FDA adverse event reporting system. Int J Clin Pract 2019;73:e13331. doi: 10.1111/ijcp.13331. [DOI] [PubMed] [Google Scholar]
- 118.Singh S, Nautiyal A. Aortic Dissection and Aortic Aneurysms Associated with Fluoroquinolones: A Systematic Review and Meta-Analysis. Am J Med 2017;130:1449-57. doi: 10.1016/j.amj-med.2017.06.029. [DOI] [PubMed] [Google Scholar]
- 119.Noman AT, Qazi AH, Alqasrawi M, Ayinde H, Tleyjeh IM, Lindower P, et al. Fluoroquinolones and the risk of aortopathy: A systema-tic review and meta-analysis. Int J Cardiol 2019;274:299-302. doi: 10.1016/j.ijcard.2018.09.067. [DOI] [PubMed] [Google Scholar]
- 120.Chui CSL, Wong ICK, Wong LYL, Chan EW. Association between oral fluoroquinolone use and the development of retinal detachment: A systematic review and meta-analysis of observational studies. J Antimicrob Chemother 2014;70:971-8. doi: 10.1093/jac/dku507. [DOI] [PubMed] [Google Scholar]
- 121.Alves C, Penedones A, Mendes D, Batel Marques F. A systematic review and meta-analysis of the association between syste-mic fluoroquinolones and retinal detachment. Acta Ophthalmol 2016;94;e251-9. doi: 10.1111/aos.12931. [DOI] [PubMed] [Google Scholar]
- 122.Shin JY, Jeong S, Jeon HL, Byun S, Park KH, Jeong HE, et al. The risk profile of rhegmatogenous retinal detachment before and after using a fluoroquinolone: A 12 year nationwide self-contro-lled case series study. J Antimicrob Chemother 2018;73:3442-53. doi: 10.1093/jac/dky336. [DOI] [PubMed] [Google Scholar]
- 123.Ponsioen TL, Van Der Worp RJ, Van Luyn MJA, Hooymans JMM, Los LI. Packages of vitreous collagen (type II) in the human reti-na: An indication of postnatal collagen turnover? Exp Eye Res 2005;80:643-50. doi: 10.1016/j.exer.2004.11.014. [DOI] [PubMed] [Google Scholar]
- 124.Zünkler BJ, Claaßen S, Wos-Maganga M, Rustenbeck I, Holzgrabe U. Effects of fluoroquinolones on HERG channels and on pancrea-tic -cell ATP-sensitive K+ channels. Toxicology 2006;228:239-48. doi: 10.1016/j.tox.2006.09.002. [DOI] [PubMed] [Google Scholar]
- 125.Yip C, Lee AJ. Gatifloxacin-induced hyperglycemia: A case report and summary of the current literature. Clin Ther 2006;28:1857-66. doi: 10.1016/j.clinthera.2006.11.014. [DOI] [PubMed] [Google Scholar]
- 126.Höffken G, Borner K, Glatzel PD, Koeppe P, Lode H. Reduced enteral absorption of ciprofloxacin in the presence of antacids. Eur J Clin Microbiol 1985;4:345. doi: 10.1007/BF02013667. [DOI] [PubMed] [Google Scholar]
- 127.Antoniou T, Gomes T, Mamdani MM, Juurlink DN. Ciprofloxacin-induced theophylline toxicity: A population-based study. Eur J Clin Pharmacol 2011;67:521-6. doi: 10.1007/s00228-010-0985-0. [DOI] [PubMed] [Google Scholar]
- 128.Kennedy WK, Jann MW, Kutscher EC. Clinically significant drug in-teractions with atypical antipsychotics. CNS Drugs 2013;27:1021-48. doi: 10.1007/s40263-013-0114-6. [DOI] [PubMed] [Google Scholar]
- 129.Padberg S, Wacker E, Meister R, Panse M, Weber-Schoendorfer C, Oppermann M, et al. Observational cohort study of pregnan-cy outcome after first-trimester exposure to fluoroquinolones. Antimicrob Agents Chemother 2014;58:4392-8. doi: 10.1128/AAC.02413-14. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 130.European Medicines Agency Review of quinolone and fluoroquinolone-containing medicinal products. s. f. https://www.ema.europa.eu/en/medicines/human/referrals/quinolonefluoroquinolonecontai-ning-medicinal-products. (accedido 20 de noviembre de 2019).
- 131.European Commission Final Decision Disabling and potentially permanent side effects lead to suspension or restrictions on use of FQs. s. f. https://www.ema.europa.eu/en/documents/referral/qui-nolone-fluoroquinolonearticle-31-referral-disabling-potentially-permanent-side-effects-lead_en.pdf. (accedido 20 de noviembre de 2019).
- 132.FDA Drug Safety Communication FDA reinforces safety information about serious low blood sugar side effects and mental health side effects with FQs; requires label changes s. f. https://www.fda.gov/drugs/drug-safety-and-availability/fdareinforces-safety-information-about-serious-low-blood-sugar-levels-and-mental-healthside (accedido 20 de noviembre de 2019).
- 133.FDA Drug Safety Communication FDA warns about increased risk of ruptures or tears in the aortal blood vessel with FQs antibiotics in certain patients. s. f. https://www.fda.gov/drugs/drug-safety-and-availability/fda-warns-aboutincreased-risk-ruptures-or-tears-aorta-blood-vessel-fluoroquinolone-antibiotics (accedido 4 de noviembre de 2019).
- 134.Guitor AK, Wright GD. Antimicrobial Resistance and Respi-ratory Infections. Chest 2018;154:1202-12. doi: 10.1016/j.chest.2018.06.019. [DOI] [PubMed] [Google Scholar]
- 135.Miravitlles M. Exacerbations of chronic obstructive pulmonary di-sease: when are bacteria important? Eur Respir J 2002;36:9s-19s. DOI: 10.1183/09031936.02.00400302 [DOI] [PubMed] [Google Scholar]
- 136.Miravitlles M, Anzueto A. Chronic respiratory infection in patients with chronic obstructive pulmonary disease: What is the role of an-tibiotics? Int J Mol Sci 2017;18:E1344. doi: 10.3390/ijms18071344. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 137.Wunderink RG, Yin Y. Antibiotic Resistance in Community-Acquired Pneumonia Pathogens. Semin Respir Crit Care Med 2016;37:829-38. doi: 10.1055/s-0036-1593753. [DOI] [PubMed] [Google Scholar]
- 138.Cantón R, Morosini MI. Emergence and spread of antibiotic re-sistance following exposure to antibiotics. FEMS Microbiol Rev 2011;35:977-91. doi: 10.1111/j.1574-6976.2011.00295.x. [DOI] [PubMed] [Google Scholar]
- 139.Sethi S, Anzueto A, Miravitlles M, Arvis P, Alder J, Haverstock D, et al. Determinants of bacteriological outcomes in exacerbations of chronic obstructive pulmonary disease. Infection 2016;44:65-76. doi: 10.1007/s15010-015-0833-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 140.Cantón R, Lode H, Graninger W, Milkovich G. Respiratory tract infections: at-risk patients, who are they?: Implications for their management with levofloxacin. Int J Antimicrob Agents 2006;28:S115-27. doi: 10.1016/J.IJANTIMICAG.2006.06.001. [DOI] [PubMed] [Google Scholar]
- 141.López-Causapé C, Rojo-Molinero E, Mulet X, Cabot G, Moyà B, Figuerola J, et al. Clonal Dissemination, Emergence of Muta-tor Lineages and Antibiotic Resistance Evolution in Pseudomo-nas aeruginosa Cystic Fibrosis Chronic Lung Infection. PLoS One 2013;8:e71001. doi: 10.1371/journal.pone.0071001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 142.Heinz E. The return of Pfeiffer’s bacillus: Rising incidence of am-picillin resistance in Haemophilus influenzae. Microb genomics 2018;4. doi: 10.1099/mgen.0.000214. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 143.Giménez MJ, Aguilar L, Granizo JJ. Revisiting cefditoren for the treatment of community-acquired infections caused by human-adapted respiratory pathogens in adults. Multidiscip Respir Med 2018;13:1-13. doi: 10.1186/s40248-018-0152-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 144.Takahata S, Kato Y, Sanbongi Y, Maebashi K, Ida T. Comparison of the efficacies of oral β-lactams in selection of Haemophilus influenzae transformants with mutated ftsI genes. Antimicrob Agents Chemother 2008;52:1880-3. doi: 10.1128/AAC.00936-07. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 145.González N, Aguilar L, Sevillano D, Giménez MJ, Alou L, Cafini F, et al. Efficacy of simulated cefditoren versus amoxicillin-clavula-nate free concentrations in countering intrastrain ftsI gene diffu-sion in Haemophilus influenzae. Antimicrob Agents Chemother 2011;55:2788-94. doi: 10.1128/AAC.01719-10. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 146.Mezzatesta ML, Gona F, Marchese G, Nicolosi D, Toscano MA, Stefani S, et al. Cefditoren versus community-acquired respira-tory pathogens: Time-kill studies. J Chemother 2009;21:378-82. doi: 10.1179/joc.2009.21.4.378. [DOI] [PubMed] [Google Scholar]
- 147.González N, Aguilar L, Alou L, Giménez MJ, Sevillano D, Torrico M, et al. Influence of different resistance traits on the competi-tive growth of Haemophilus influenzae in antibiotic-free medium and selection of resistant populations by different β-lactams: An in vitro pharmacodynamic approach. J Antimicrob Chemother 2009;63:1215-22. doi: 10.1093/jac/dkp097. [DOI] [PubMed] [Google Scholar]
- 148.Cafini F, Aguilar L, Sevillano D, Giménez MJ, Alou L, Fenoll A, et al. Decrease in bacterial load versus resistance selection of pneumo-coccal subpopulations by β-lactam physiological concentrations over time: An in vitro pharmacodynamic simulation. Microb Drug Resist 2008;14:13-21. doi: 10.1089/mdr.2008.0783. [DOI] [PubMed] [Google Scholar]
- 149.Cafini F, Aguilar L, Alou L, Giménez MJ, Sevillano D, Torrico M, et al. Cidal activity of oral third-generation cephalosporins against Streptococcus pneumoniae in relation to cefotaxime intrinsic ac-tivity. Eur J Clin Microbiol Infect Dis 2008;27:679-83. doi: 10.1007/s10096-008-0493-7. [DOI] [PubMed] [Google Scholar]
- 150.Mizoguchi A, Hitomi S. Cefotaxime-non-susceptibility of Haemo-philus influenzae induced by additional amino acid substitutions of G555E and Y557H in altered penicillin-binding protein 3. J In-fect Chemother 2019;25:509-13. doi: 10.1016/j.jiac.2019.02.010. [DOI] [PubMed] [Google Scholar]
- 151.Deghmane AE, Hong E, Chehboub S, Terrade A, Falguières M, Sort M, et al. High diversity of invasive Haemophilus influenzae isola-tes in France and the emergence of resistance to third generation cephalosporins by alteration of ftsI gene. J Infect 2019;79:7-14. doi: 10.1016/j.jinf.2019.05.007. [DOI] [PubMed] [Google Scholar]
- 152.García-Cobos S, Arroyo M, Pérez-Vázquez M, Aracil B, Lara N, Oteo J, et al. Isolates of b-lactamase-negative ampicillin-resistant Hae-mophilus influenzae causing invasive infections in Spain remain susceptible to cefotaxime and imipenem. J Antimicrob Chemother 2014;69:111-6. doi: 10.1093/jac/dkt324. [DOI] [PubMed] [Google Scholar]
- 153.Musher D, Thorner AR. Community-Acquired Pneumonia. N Engl J Med 2014;371:1619-28.doi: 10.1056/NEJMra1312885. [DOI] [PubMed] [Google Scholar]
- 154.Paterson DL. “Collateral Damage” from Cephalosporin or Qui-nolone Antibiotic Therapy. Clin Infect Dis 2004;38:S341-5. doi: 10.1086/382690. [DOI] [PubMed] [Google Scholar]
- 155.Woerther PL, Lepeule R, Burdet C, Decousser JW, Ruppé É, Barbier F. Carbapenems and alternative β-lactams for the treatment of in-fections due to extended-spectrum β-lactamase-producing Ente-robacteriaceae: What impact on intestinal colonisation resistance? Int J Antimicrob Agents 2018;52:762-70. doi: 10.1016/j.ijantimi-cag.2018.08.026. [DOI] [PubMed] [Google Scholar]
- 156.Sullivan Å, Edlund C, Nord CE. Effect of antimicrobial agents on the ecological balance of human microflora. Lancet Infect Dis 2001;1:101-14. doi: 10.1016/s1473-3099(01)00066-4. [DOI] [PubMed] [Google Scholar]
- 157.Jernberg C, Löfmark S, Edlund C, Jansson JK. Long-term impacts of antibiotic exposure on the human intestinal microbiota. Microbio-logy 2010;156:3216-23. doi: 10.1099/mic.0.040618-0. [DOI] [PubMed] [Google Scholar]
- 158.Lange K, Buerger M, Stallmach A, Bruns T. Effects of Antibiotics on Gut Microbiota. Dig Dis 2016;34:260-8. doi: 10.1159/000443360. [DOI] [PubMed] [Google Scholar]
- 159.Langdon A, Crook N, Dantas G. The effects of antibiotics on the microbiome throughout development and alternative approaches for therapeutic modulation. Genome Med 2016;8:39. doi: 10.1186/s13073-016-0294-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 160.Vollaard EJ, Clasener HAL. Colonization resistance. Antimicrob Agents Chemother 1994;38:409-14. doi: 10.1128/AAC.38.3.409. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 161.Buffie CG, Pamer EG. Microbiota-mediated colonization resistance against intestinal pathogens. Nat Rev Immunol 2013;13:790-801. doi: 10.1038/nri3535. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 162.Sommer F, Anderson JM, Bharti R, Raes J, Rosenstiel P. The resilien-ce of the intestinal microbiota influences health and disease. Nat Rev Microbiol 2017;15:630-8. doi: 10.1038/nrmicro.2017.58. [DOI] [PubMed] [Google Scholar]
- 163.Poachanukoon O, Kitcharoensakkul M. Efficacy of cefditoren pi-voxil and amoxicillin/clavulanate in the treatment of pediatric patients with acute bacterial rhinosinusitis in Thailand: A randomi-zed, investigator-blinded, controlled trial. Clin Ther 2008;30:1870-9. doi: 10.1016/j.clinthera.2008.10.001. [DOI] [PubMed] [Google Scholar]
- 164.Monsó E. Microbiome in chronic obstructive pulmonary disease. Ann Transl Med 2017;5:251. doi: 10.21037/atm.2017.04.20. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 165.Palleja A, Mikkelsen KH, Forslund SK, Kashani A, Allin KH, Nielsen T, et al. Recovery of gut microbiota of healthy adults following antibiotic exposure. Nat Microbiol 2018;3:1255-6. doi: 10.1038/s41564-018-0257-9. [DOI] [PubMed] [Google Scholar]
- 166.Woodhead M, Blasi F, Ewig S, Huchon G, Leven M, Ortqvist A, et al. Guidelines for the management of adult lower respiratory tract infections. Eur Respir J 2005;26:1138-80. doi: 10.1183/09031936.05.00055705. [DOI] [PubMed] [Google Scholar]