Abstract
目的
研究环形RNA circRNA_005647对小鼠心肌成纤维细胞(CFs)纤维化表型的影响及分子机制。
方法
利用血管紧张素Ⅱ缓释泵[1.46 mg/(kg·d), 2周]诱导建立小鼠高血压心肌纤维化模型, 采用Masson染色观察心肌纤维化程度。实时荧光定量PCR检测发生纤维化的小鼠心肌及血管紧张素Ⅱ诱导的小鼠CFs中circRNA_005647的表达。利用放线菌素D和RNase R实验检测circRNA_005647的稳定性。利用重组circRNA_005647腺病毒(rAd-circRNA_005647)感染小鼠CFs, 检测CFs中纤维化相关基因Col1a1、Col3a1、Acta2的mRNA和蛋白表达变化。双荧光素酶报告基因实验、RNA反义纯化实验及RNA Pulldown实验验证circRNA_005647与微小RNA miR-27b-3p的结合作用。
结果
RT-qPCR结果显示, circRNA_005647在高血压诱导纤维化的小鼠心肌和Ang-Ⅱ处理的小鼠CFs中表达增强(P < 0.01)。放线菌素D和RNase R实验证实circRNA_005647比其宿主基因Myo9a mRNA具有更好的稳定性(P < 0.01)和抵抗RNase R的降解作用。过表达circRNA_005647可显著抑制小鼠CFs中纤维化相关基因Col1a1、Col3a1和Acta2表达(P < 0.05)。双荧光素酶报告基因实验、RNA反义纯化实验及RNA Pull down实验一致性地证实了circRNA_005647与miR-27b-3p之间存在特异结合作用, miR-27b-3p具有促进小鼠CFs的纤维化表型作用(P < 0.05), 并可减弱circRNA_005647对小鼠CFs中纤维化相关基因表达的抑制作用。
结论
CircRNA_005647在心肌纤维化中表达增强, 并通过结合miR-27b-3p发挥抑制心肌纤维化作用。
Keywords: 环形RNA, circRNA_005647, miR-27b-3p, 心肌纤维化, 心肌成纤维细胞
Abstract
Objective
To investigate the effect of circRNA_005647 on fibrotic phenotype of mouse cardiac fibroblasts (CFs) and explore its mechanism.
Methods
We used an angiotensin Ⅱ (Ang-Ⅱ) capsule pump (daily dose of 1.46 mg/kg for 2 weeks) to establish a mouse model of myocardial fibrosis in C57BL/6 mice. Masson staining was used to detect myocardial fibrosis in the myocardium. The expression of circRNA_005647 in the myocardium of Ang-Ⅱ-infused mice and in Ang-Ⅱ-treated CFs were detected with real-time PCR. Actinomycin D and RNase R exonuclease digestion were used to test the stability of circRNA_005647 in mouse CFs. Over- expression of circRNA_005647 was achieved in the CFs by infecting the cells with a recombinant circRNA_005647 adenovirus (rAd-circRNA_005647), and the expressions of Col1a1, Col3a1 and Acta2 were detected in the cells with real-time PCR and Western blotting. Dual luciferase reporter assay, RNA antisense purification and RNA Pull down assay were performed to identify the interaction between circRNA_005647 and miR-27b-3p.
Results
CircRNA_005647 was up- regulated in the myocardium of Ang-Ⅱ- infused mice and in Ang-Ⅱ-treated mouse CFs (P < 0.01). CircRNA_005647 was more stable than its host gene Myosin IXA (Myo9a) in response to actinomycin D (P < 0.01) and RNase R exonuclease treatment. The expressions of fibrosis-associated genes was down-regulated in the CFs over-expressing circRNA_ 005647 (P < 0.05). Dual luciferase reporter assay, RNA antisense purification and RNA Pull down assay revealed the interaction between miR-27b-3p and circRNA_005647. MiR-27b-3p obviously enhanced the fibrotic phenotype but reversed the inhibitory effect of circRNA_005647 on the expression of fibrosis associated genes in the CFs (P < 0.05).
Conclusion
CircRNA_005647 is upregulated in cardiac fibrosis and inhibits the expression of fibrosis-related genes through sponging miR-27b-3p in mouse CFs.
Keywords: circular RNA, circRNA_005647, miR-27b-3p, myocardial fibrosis, cardiac fibroblasts
高血压性心脏病是高血压并发症中最常见的临床表现, 心肌纤维化是高血压导致心肌重构的重要病理改变[1]。随着疾病进展, 由全身性高血压或主动脉瓣狭窄引起左心室压力超负荷从而导致进行性心肌间质和血管周围纤维化, 发展为高血压性心脏病[2]。心肌纤维化是发生心律失常的结构基础, 也是心力衰竭的潜在危险因素[3], 然而参与调控心肌纤维化病理生理过程相关的分子机制尚未完全阐明。
环形RNA(circRNA)通过外显子跳跃和内含子套索驱动环化形成, 其作为微小RNA的吸附"海绵", 可变剪接的调节因子, 甚至参与调节靶基因表达的作用[4]。已有研究显示circRNAs在心血管疾病中表达改变, 并参与疾病的发生发展过程, 有些circRNAs还可能成为心血管疾病潜在的生物标志物[5-6]。我们前期circRNA表达谱芯片检测发现circRNA_005647在纤维化的小鼠心肌中表达明显上调[7], 报道circRNA_000203在糖尿病性小鼠心肌组织中表达显著增强, 具有促心肌纤维化的作用[7]。CircRNA_005647与circRNA_000203均来源于相同的宿主基因Myosin IXA(Myo9a), circRNA_005647对心肌纤维化与否有调控作用, 尚不清楚。本文利用血管紧张素Ⅱ(AngⅡ)灌注诱导的小鼠心肌纤维化动物模型和Ang-Ⅱ诱导的小鼠心肌成纤维细胞, 试图探讨circRNA_005647对纤维化相关基因表达的调控作用。
1. 材料和方法
1.1. 实验动物
SPF级C57BL/6雄性小鼠16只, 10~12周龄, 体质量20~25 g, 购自广州中医药大学实验动物中心(实验动物合格证号:SCXK(粤)2013-0034)。SPF级动物房饲养, 本文的动物实验操作均已通过广东省人民医院动物实验伦理审批(审批编号:No.GDREC2010093A)。
1.2. 主要试剂
微量胶囊渗透性缓释泵(Alzet); Ang Ⅱ(Sigma); Masson三色染色试剂盒(北京索莱宝科技有限公司); DMEM/F12细胞培养基、特级澳洲胎牛血清、0.25% EDTA-胰蛋白酶(Gibco); 放线菌素D(生工); RNase R (广州吉赛); 限制性内切酶Xho Ⅰ、EcoR Ⅰ、Pac Ⅰ和Pme Ⅰ (NEB); BJ5183 E.coli、载体pAd-Track-cmv vector和pAd-Easy-Ⅰ(Coloncancer); 转染试剂Lipofectamine 2000和TRIzol试剂(Invitrogen); 逆转录试剂盒、2× SYBR Green Mix、4×SDS loading buffer和RNase free water (TaKaRa); miR-27b-3p mimic(广州锐博); SDSPAGE凝胶配置试剂盒(碧云天); GAPDH抗体、COL1A1抗体、COL3A1抗体(Protein Technology); α-平滑肌肌动蛋白(α-SMA)抗体(Abcam); BCA蛋白定量试剂盒(Thermo); Marker(Fermentas); ECL发光液(Millipore); PVDF膜(Whatman); 荧光素酶检测试剂盒(Promega); RNA反义纯化试剂盒(广州伯信); 链霉亲和素磁珠(NEB); 其他生化试剂均为进口分装或国产分析纯。所用引物由Invitrogen公司合成, 具体序列见表 1。
1.
PCR引物序列
Sequences of the primers for RT-qPCR
| Gene | Sequence (5'-3') | Product size (bp) |
| F:Forward primer; R:Reverse primer | ||
| Col1a1 | F, CTGGTCCTGTTGGAAGTCGT R, CAGATGCACCTGTTTCTCCA |
201 |
| Col3a1 | F, CAATGTAAAGAAGTCTCTGAAG R, CAAACAGGGCCAATGTCCAC |
240 |
| Acta2 | F, CTGTGCTATGTCGCTCTGGA R, ATAGGTGGTTTCGTGGATGC |
192 |
| Myo9a | F, TTTCTGGGATGACTGGCATT R, GACTGGGTGTTGGAGAAAGC |
191 |
| CircRNA_005647 | F, GTTAGCATTCCACCTTAAACAG R, CTTCCTCCATCACTTACATTCA |
200 |
| Gapdh | F, CAAGAAGGTGGTGAAGCAGG R, CCACCCTGTTGCTGTAGCC |
200 |
| miR-27b-3p | RT, GTCGTATCCAGTGCGTGTCGTGGAGT CGGCAATTGCACTGGATACGACGCAGAACTT F, GTCCGCTTCACAGTGGCTAAGTTCTGC |
65 |
| U6 | R, GTGCGTGTCGTGGAGTC F, GTCCGCGTGCTCGCTTCGGCAGC R, GTGCGTGTCGTGGAGTC |
160 |
1.3. 研究方法
1.3.1. Ang-Ⅱ灌注诱导的小鼠心肌纤维化模型
小鼠用数字耳钉编号后, 随机分为两组, 每组8只。根据小鼠体质量计算Ang-Ⅱ的剂量[1.46 mg/(kg · d), 2周], 用0.9%生理盐水将Ang-Ⅱ稀释至体积为200 μL, 载入Alzet胶囊渗透泵中, 另将200 μL 0.9%生理盐水载入Alzet胶囊渗透泵中作为假手术组, 具体手术方法详见参考文献[8]。14 d后留取心肌组织标本。
1.3.2. Masson三色染色
腹腔注射50 mg/kg戊巴比妥钠麻醉小鼠, 取左心室心肌组织, 4%甲醛固定, 逐步脱水、透明、浸蜡、包埋后制作4 μm厚度的连续石蜡切片, Masson胶原纤维染色, 观察心肌组织的胶原纤维沉积情况, 选择8个单独的视野(×400)计算心肌胶原纤维所占比例(CVF), CVF=胶原区域/总面积。
1.3.3. 心肌成纤维细胞的分离、培养和处理
从1~3 d龄的C57BL/6小鼠心脏中分离小鼠心肌成纤维细胞(CFs), 具体方法参考文献[9], 并有进行优化。利用不同的贴壁速度将CFs与心肌细胞分离, 接种于10 cm细胞培养皿中, 用含有10%胎牛血清、1%青霉素和1%链霉素的DMEM/F12培养基, 于37℃、5% CO2培养箱中培养。当细胞汇合度达到约90%时, 用0.25%含EDTA的胰酶消化传代, 传至P3代时用于后续实验。用10-5 mol/LAng-Ⅱ处理24 h以诱导纤维化表型。参照lipofectamine2000试剂说明书进行转染, 用100 nmol/L scramble阴性对照, miR-27b-3p mimic分别转染至CFs中, 并在37℃、5% CO2培养箱中继续培养24 h。CFs分别用以下重组腺病毒感染:rAd-GFP, rAd-CircRNA_005647腺病毒(MOI 10)。感染后于37℃、5% CO2培养箱中培养24 h, 随后收集细胞, 进行后续测定。
1.3.4. 重组circRNA_005647腺病毒的制备
circRNA_ 005647包含了Myo9a基因的外显子2~4序列。根据我们报道的方法[10], 将circRNA_005647的模板DNA定向插入pAd-Track-cmv载体中的多克隆位点。然后, 进一步将pAd-Track-cmv-circRNA_005647在BJ5183大肠杆菌中与pAd-Easy-Ⅰ骨架质粒进行重组。最后, 通过限制酶PmeⅠ将重组circRNA_005647腺病毒质粒线性化, 并转染到HEK293T细胞中包装circRNA_005647重组腺病毒。同时, 还制备了rAd-GFP作为对照腺病毒。
1.3.5. 实时定量PCR(RT-qPCR)
采用TRIzol法从心肌组织或CFs中提取总RNA, 取1.0 μg总RNA, 用oligo (dT)15和random primers逆转录出cDNA用于检测circRNA_005647以及纤维化相关基因的mRNA表达水平。用Gapdh作为检测circRNA_005647、纤维化相关基因表达的内参照。在vii A7 Quantitative PCR System(美国Applied Biosystems)进行PCR反应和数据分析。以2-ΔΔCT法计算circRNA_005647、纤维化相关基因的相对表达水平。
1.3.6. 环形RNA稳定性检测
用5 μg从CFs中提取的总RNA, 按试剂说明书配制反应体系, 经RNase R酶消化后, 进行RT-qPCR检测circRNA_005647和Myo9a mRNA水平。用2 μg/mL放线菌素D按0、4、8、12、24 h处理CFs, 提取细胞总RNA, 进行RT-qPCR检测circRNA_005647和Myo9a mRNA水平。
1.3.7. 双荧光素酶报告实验验证circRNA_005647与miR-27b-3p的结合作用
参照已报道方法[11]构建包含miR-27b-3p潜在结合序列的circRNA_005647重组萤光素酶报告质粒pGL3-circRNA_005647-761-781及包含突变了结合序列的重组质粒pGL3-circRNA_ 005647-761-781-MUT。利用HEK293细胞, 将HEK293细胞(细胞密度约为1×105每孔/12孔板)转染1.5 μg重组荧光素酶报告质粒, 100 nmol/L miR-27b-3p mimic以及10 ng pRL-TK(表达海肾荧光素酶的内参照质粒)。转染24 h后, 测定萤火虫荧光素酶及海肾荧光素酶强度, 两种荧光强度比值变化可反映circRNA_005647与miR-27b-3p结合的能力。
1.3.8. Western blot
在处理后的小鼠心肌成纤维细胞里, 加入RIPA蛋白裂解液, 冰上裂解, 于4℃ 12 000 r/min离心15 min, 取上清进行蛋白定量后分装。加入4× SDS loading buffer, 70℃加热10 min使蛋白质变性, 然后进行聚丙烯酰胺凝胶电泳。用PVDF膜转印蛋白, 5%脱脂奶粉封闭2 h, 分别用相应的抗体anti-COL1A1 (1:1000)、anti-COL3A1(1:5000)、anti-α-SMA(1:5000) 4℃孵育过夜。TBST洗膜, 加入二抗(1:5000)室温孵育1 h。ECL发光试剂盒显影, 以GAPDH(1:5000)为内参照, 扫描灰度值并分析蛋白表达相对含量。
1.3.9. RNA反义纯化实验
生物素标记的探针经过专门设计, 可与circRNA_005647的连接区域结合, 而寡核苷酸探针则作为对照。按100 μL磁珠/400 pmol探针的比例准备探针, 将1×107 CFs细胞用裂解缓冲液裂解, 并在室温下用垂直混匀器交联孵育5 h, 从而下拉生物素偶联的RNA复合物。磁珠用RNA洗脱缓冲液洗涤5次, 并使用Trizol试剂提取下拉复合物中结合的miRNA, 并通过RT-qPCR进行定量分析。
1.3.10. RNA Pull-down实验
提取100 μg腺病毒介导circRNA_005647过表达的CFs细胞总RNA; 将500 μg链霉亲和素磁珠与200 pmol生物素标记的miR-27b- 3p mimic结合, 加入RNA中, 室温轻混, 孵育30 min后, 加入洗脱缓冲液, 收集拉下的RNA复合物, 通过RTqPCR对circRNA_005647水平进行定量分析。
1.4. 统计学方法
用SPSS 25.0统计软件进行分析。计量资料以均数±标准差表示, 两组间比较采用t检验; 多组间比较采用单因素方差分析, 并用Bonferroni校正的t检验进行组间两两比较。P < 0.05为差异有统计学意义。
2. 结果
2.1. CircRNA_005647在纤维化小鼠心肌中表达上调
Masson染色的结果显示, 与假手术组(Sham)相比, Ang Ⅱ灌注组小鼠心肌血管周围和间质胶原沉积(蓝色)显著增加(P < 0.001), 出现明显的心肌纤维化(图 1A)。RT-qPCR显示, 与Sham组相比, AngⅡ灌注组小鼠心肌组织中circRNA_005647及宿主基因Myo9a的表达水平显著上升(图 1B)。CircRNA_005647由Myo9a的外显子2~4组成(图 1C), 针对其接头序列设计引物并检测circRNA_005647, DNA测序结果显示, PCR产物中包含的circRNA_005647接头序列正确(图 1D)。
1.
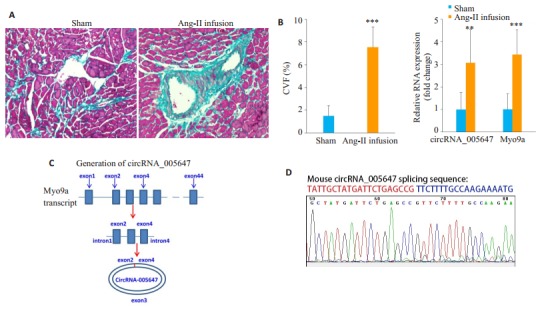
CircRNA_005647在AngⅡ灌注诱导纤维化的小鼠心肌中表达增强
Upregulation of circRNA_005647 in the myocardium of a mouse model of Ang-Ⅱ infusion-induced cardiac fibrosis. A: Masson trichrome staining (Scale bar:100 μm); B:Detection of circRNA_005647 and Myo9a mRNA in mouse myocardium by RT-qPCR assay; C:Generation of circRNA_005647; D:Identification of the junction site sequence of circRNA_005647 by Sanger DNA sequencing method. **P < 0.01, ***P < 0.001 vs Sham group.
2.2. CircRNA_005647在CFs中的表达及稳定性鉴定
利用Ang-Ⅱ处理CFs, 建立心肌纤维化细胞表型, Western blot显示纤维化相关蛋白COL1A1、COL3A1和α-SMA水平显著上调(图 2A)。RT-qPCR显示在Ang-Ⅱ诱导的CFs中, 纤维化相关基因、circRNA_ 005647及其宿主基因Myo9a表达均明显上调(P < 0.05, P < 0.01, 图 2B)。核质分离和RT-qPCR结果显示, circRNA_005647主要分布在细胞质中(图 2C)。分别利用RNase R和放线菌素D(Act D)处理鉴定CFs中circRNA_005647和Myo9a mRNA的稳定性。RT-qPCR检测显示RNase R处理后线性Myo9a mRNA降解剧烈, 但circRNA_005647水平相对较高(图 2D)。Act D可抑制CFs内RNA转录生成, 与线性的Myo9a mRNA相比, circRNA_005647在Act D处理24 h的CFs中仍然有较高的存在水平(图 2E)。
2.
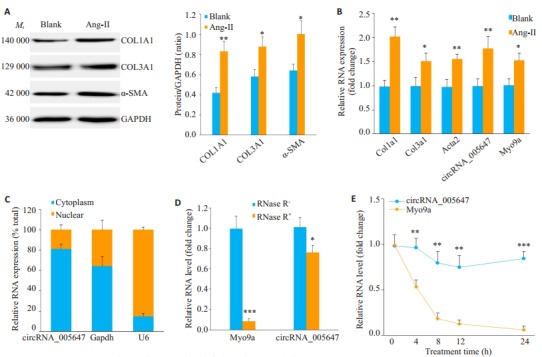
CircRNA_005647在心肌成纤维细胞中的表达、分布和稳定性鉴定
Expression, cellular distribution and stability of circRNA_005647 in mouse cardiac fibroblasts (CFs). A:Protein expression of fibrosis-related genes in Ang-Ⅱ-treated CFs; B:Expression of fibrosis-related genes, circRNA_005647 and Myo9a in Ang-Ⅱ-treated CFs by RT-qPCR assay; C:RT-qPCR showing abundant circRNA_005647 in the cytoplasm of the CFs; D:Resistance of circRNA_005647 against RNase R treatment by RT-qPCR assay; E:Detection of circRNA_005647 and Myo9a mRNA in the CFs after actinomycin D treatment. *P < 0.05, **P < 0.01, ***P < 0.001 (n=3).
2.3. CircRNA_005647抑制CFs中纤维化相关基因表达
重组腺病毒携带的绿色荧光蛋白表达显示, circRNA_005647重组腺病毒已充分感染CFs(图 3A)。RT-qPCR结果显示, 过表达circRNA_005647的CFs中纤维化相关基因表达均显著下调(P < 0.05), 而宿主基因Myo9a表达无显著变化(P>0.05, 图 3B)。Western blot结果显示, 过表达circRNA_005647的CFs中纤维化相关蛋白COL1A1、COL3A1和α-SMA表达显著降低(P < 0.05, P < 0.01, 图 3C)。
3.
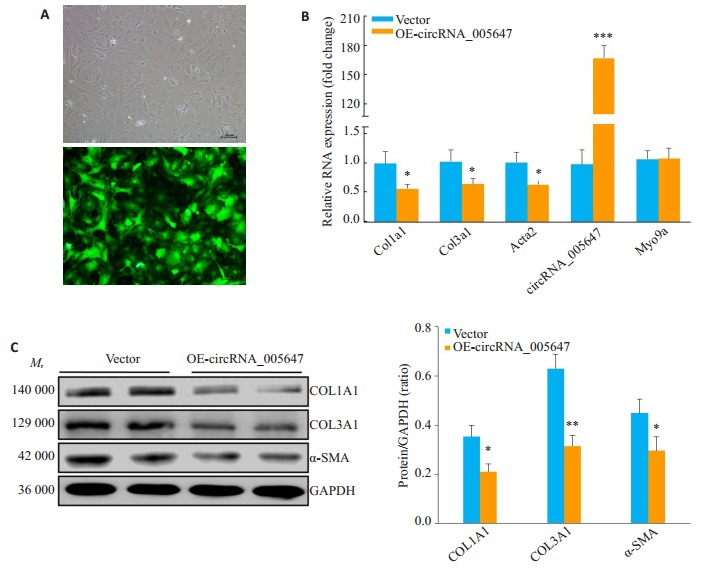
CircRNA_005647对纤维化相关基因表达的调控作用
Effect of rAd-circRNA_005647 on the expression of fibrosis-related genes in mouse CFs. A:Infection of the CFs with the recombinant circRNA_005647 adenovirus monitored by the co-expression of GFP marker (Scale bar: 100 μm); B:The mRNA expressions of fibrosis-related genes are suppressed in the CFs by circRNA_005647 overexpression; C:The protein expressions of fibrosis-related genes are suppressed in the CFs by circRNA_005647 overexpression. *P < 0.05, **P < 0.01, ***P < 0.001 vs vector group (n=3).
2.4. MiR-27b-3p介导circRNA_005647抑制CFs中纤维化相关基因表达
生物信息学分析显示, circRNA_005647的761~ 781碱基可能是miR-27b-3p的结合位点(图 4A)。双荧光素酶报告基因实验显示, 共转染pGL3_circRNA_ 005647质粒和miR-27b-3p mimics后, 萤光素酶活性显著下降(图 4B)。随后用RNA反义纯化实验和RNAPulldown实验进一步证实这两者的相互作用。RNA反义纯化实验中, 通过设计生物素标记的circRNA_005647探针与circRNA_005647特异结合, RT-qPCR验证探针结合circRNA_005647的特异性(P < 0.001, 图 4C), 用circRNA_005647特异结合的探针在CFs的total RNA中拉下miR-27b-3p并用磁珠富集, RT-qPCR检测显示与对照组相比, circRNA_005647探针拉下的miR-27b-3p明显增多(P < 0.01, 图 4C)。RNA Pull-down实验通过设计生物素标记的miR-27b-3p mimic, 用磁珠富集拉下的RNA, RT-qPCR结果证实相比无关对照组探针, miR-27b-3p mimic能特异结合circRNA_005647 (P < 0.01, 图 4D)。
4.
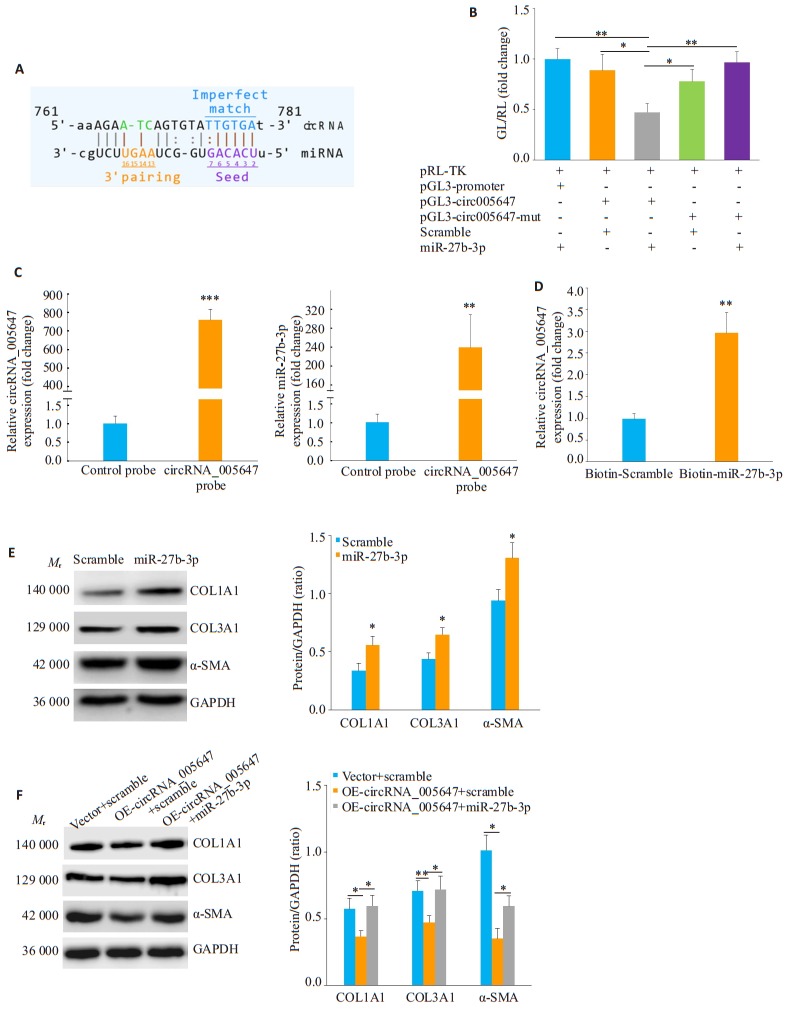
MiR-27b-3p介导circRNA_005647调控CFs中纤维化相关基因表达
miR-27b-3p mediates the effect of circRNA_005647 on the expressions of fibrosis-related genes in the CFs. A:The predicted binding sites of miR-27b-3p in circRNA_005647; B:Identification of the interaction between miR-27b-3p and circRNA_005647 by dual luciferase assay; C:miR-27b-3p is pulled down in CF lysate by biotin-labeled circRNA_005647 probe detected by RT-qPCR; D: Pulldown of circRNA_005647 by miR-27b-3p detected by RT-qPCR; E:miR-27b-3p enhances the protein expression of fibrosisrelated genes in the CFs; F:miR-27b-3p reverses the effect of circRNA_005647 on protein expression of fibrosis-related genes in the CFs. *P < 0.05, **P < 0.01, ***P < 0.001 (n=3).
Western blot结果证实, 转染miR-27b-3p mimic的CFs中纤维化相关蛋白COL1A1、COL3A1和α-SMA表达显著增加(P < 0.05, 图 4E)。为进一步明确miR-27b-3p对circRNA_005647抑制CFs纤维化表型的作用, 在过表达circRNA_005647的CFs中同时转染miR-27b-3p mimic, Western blot结果显示, miR-27b-3p可以阻断circRNA_005647抑制CFs中纤维化相关基因表达的作用(图 4F)。
3. 讨论
在高血压性心肌病的病理变化中, 左心室压力超负荷导致进行性心肌间质纤维化和血管周围纤维化, 纤维化区域中的间质胶原沉积会引起心电传导异质性增加并导致收缩和舒张功能障碍, 从而诱发慢性心力衰竭、恶性心律失常和猝死[12]。因此, 抑制心肌纤维化对于治疗高血压性心脏病具有积极意义。本研究发现circRNA_005647在Ang-Ⅱ诱导的小鼠心肌和心肌成纤维细胞中表达增强, 证实circRNA_005647可抑制小鼠心肌成纤维细胞中纤维化相关基因的表达, 为高血压性心肌纤维化的诊断和治疗研究提供科学依据。
CircRNA是由线性mRNA前体反向剪接形成的单链闭合环形RNA分子, 在哺乳动物细胞内大量存在且进化上高度保守[13], 与线性mRNA相比有更好的稳定性[14]。本研究通过放线菌素D和RNase R实验证实circRNA_005647比其宿主基因Myo9a mRNA具有更好的稳定性和抵抗RNase R的降解作用。CircRNA可在外周循环血液中稳定存在, 并且其动态变化可能与不同的疾病阶段相关, 因此可能是潜在的相关疾病的生物标志物[15]。已有研究发现一些circRNAs可通过特异吸附相应的miRNAs发挥生物学作用[16]。有研究发现小鼠心肌梗死后circRNA Cdr1as升高, 并通过抑制miR-7来促进细胞凋亡[17]。另外, 心脏相关的circRNA HRCR能通过结合miR-223来阻断异丙肾上腺素诱导的小鼠心肌细胞肥大[18]。有研究在颈动脉夹层患者的血清样本中, 发现circRNA-284和miR-221的含量存在相关性[19], 然而以上circRNAs对心血管疾病诊断和治疗的潜力仍有待进一步深入研究。我们前期研究发现在糖尿病性小鼠心肌中circRNA_000203表达上调, 在小鼠CFs中, circRNA_000203通过结合miR-26b-5p增加胶原蛋白的产生促进CFs的纤维化表型[7]。而本研究中circRNA_005647与circRNA_000203均来源于同一个宿主基因Myo9a, 但调控CFs的纤维化表型的作用却截然相反, 在CFs中过表达circRNA_005647, 可降低CFs中纤维化相关蛋白COL1A1、COL3A1和α-SMA的表达。这提示相同宿主基因来源的不同circRNAs在生物学功能上可以相互协调, 从而实现对相关基因表达的精细调控作用。
近年有很多研究报道miRNAs在心肌重塑和心脏功能障碍相关疾病中发挥关键作用[20-22]。有文献报道miR-27b转基因小鼠可出现明显心肌肥厚和心肌纤维化, 并伴有线粒体损伤[23]。有研究发现miR-27b在Smad4特异敲除的纤维化小鼠心肌中表达增强, 而在小鼠心衰模型中抑制miR-27b的功能可有效缓解心脏肥大和心功能障碍[24]。此外, miR-27b的失调与很多疾病相关, 例如, miR-27b在乳腺癌细胞中表达下调[25], miR-27b过度表达可抑制脂肪细胞中的脂肪形成[26], miR-27b通过靶向MDFI促进PSCs的肌肉生成[27]等。本研究在CFs中转染miR-27b-3p mimic, 观察到纤维化相关基因表达明显增加, 也证实了miR-27b-3p具有促进CFs纤维化表型的作用, 该结果与以往文献报道一致[24]。
鉴于circRNA_005647主要存在于CFs的胞质中, 本研究假设circRNA_005647可能通过结合某些miRNA来发挥抑制心肌纤维化的作用。生物信息学分析提示, miR-27b-3p与circRNA_005647上存在结合位点, 双荧光素酶报告基因实验、RNA反义纯化实验及RNA Pull down实验一致性地证实了两者之间的特异结合作用。进一步的功能实验证实miR-27b-3p可以有效减弱circRNA_005647对心肌纤维化的抑制作用。上述结果证实circRNA_005647可通过结合miR-27b-3p发挥抑制CFs中纤维化相关基因表达的作用。但参与介导circRNA_005647发挥抑制心肌纤维化作用的miR-27b-3p靶基因, 尚有待进一步研究。
综上所述, 本研究发现circRNA_005647在Ang-Ⅱ诱导的纤维化小鼠心肌和Ang-Ⅱ诱导的CFs中表达增强。CircRNA_005647可下调小鼠CFs中纤维化相关基因的表达, 而miR-27b-3p可以减弱circRNA_005647对CFs中相关纤维化基因表达的抑制作用。在后续研究中, 我们将继续探明miR-27b-3p介导circRNA_005647发挥抑制心肌纤维化作用的下游靶标, 以及在整体动物水平上进一步明确circRNA_005647对心肌纤维化的调控作用。
Biography
袁淑菁,在读硕士研究生,E-mail: shujingyuan94@163.com
Funding Statement
国家自然科学基金(91649109,81770264);广州市科技计划项目(201804010045)
Supported by National Natural Science Foundation of China (91649109, 81770264)
Contributor Information
袁 淑菁 (Shujing YUAN), Email: shujingyuan94@163.com.
单 志新 (Zhixin SHAN), Email: shanzhixin@gdph.org.cn.
References
- 1.Li H, Ge JB. Cardiovascular diseases in China: current status and future perspectives. https://www.sciencedirect.com/science/article/pii/S2352906714000694. Intern J Cardiol Heart Vasculat. 2015;6(2):25–31. doi: 10.1016/j.ijcha.2014.10.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Berk BC, Fujiwara K, Lehoux S. ECM remodeling in hypertensive heart disease. J Clin Invest. 2007;117(3):568–75. doi: 10.1172/JCI31044. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Kong P, Christia P, Frangogiannis NG. The pathogenesis of cardiac fibrosis. Cell Mol Life Sci. 2014;71(4):549–74. doi: 10.1007/s00018-013-1349-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Chen LL. The biogenesis and emerging roles of circular RNAs. http://cn.bing.com/academic/profile?id=3df1fc0f691adb0d88f38796109f1a57&encoded=0&v=paper_preview&mkt=zh-cn. Nat Rev Mol Cell Biol. 2016;17(4):205–11. doi: 10.1038/nrm.2015.32. [DOI] [PubMed] [Google Scholar]
- 5.Fan XM, Weng XY, Zhao YF, et al. Circular RNAs in cardiovascular disease: an overview. http://d.old.wanfangdata.com.cn/Periodical/gwyx-lcsw201902028. Biomed Res Int. 2017;51(6):1–9. doi: 10.1155/2017/5135781. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Gomes CP, Salgado-Somoza A, Creemers EE, et al. Circular RNAs in the cardiovascular system. Non-coding RNARes. 2018;3(1):1–11. doi: 10.1016/j.ncrna.2018.02.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Tang CM, Zhang M, Huang L, et al. CircRNA_000203 enhances the expression of fibrosis-associated genes by derepressing targets of miR-26b-5p, Col1a2 and CTGF, in cardiac fibroblasts. http://cn.bing.com/academic/profile?id=d0df08a880c2dad6e1ff4fc3b1cf2005&encoded=0&v=paper_preview&mkt=zh-cn. Sci Rep. 2017;7(1):1206–17. doi: 10.1038/srep40342. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Wu YA, Li YL, Zhang CC, et al. S100a8/a9 released by CD11b(+)Gr1 (+) neutrophils activates cardiac fibroblasts to initiate angiotensin Ⅲnduced cardiac inflammation and injury. Hypertension. 2014;63(6):1241–50. doi: 10.1161/HYPERTENSIONAHA.113.02843. [DOI] [PubMed] [Google Scholar]
- 9.Communal C, Singh K, Pimentel DR, et al. Norepinephrine stimulates apoptosis in adult rat ventricular myocytes by activation of the beta-adrenergic pathway. Circulation. 1998;98(13):1329–34. doi: 10.1161/01.CIR.98.13.1329. [DOI] [PubMed] [Google Scholar]
- 10.Liang Y, Lin Q, Zhu J, et al. The caspase-8 shRNA-modified mesenchymal stem cells improve the function of infarcted heart. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=bb68fe3df4a5c02400ef7d6b71758fdc. Mol Cell Biochem. 2014;397(1/2):7–16. doi: 10.1007/s11010-014-2165-5. [DOI] [PubMed] [Google Scholar]
- 11.Yuan W, Tang C, Zhu W, et al. CDK6 mediates the effect of attenuation of miR-1 on provoking cardiomyocyte hypertrophy. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=58ee5ee091cb30b2369c60982a5f7ed6. Mol Cell Biochem. 2016;412(1/2):289–96. doi: 10.1007/s11010-015-2635-4. [DOI] [PubMed] [Google Scholar]
- 12.Weber KT, Sun Y, Bhattacharya SK, et al. Myofibroblast-mediated mechanisms of pathological remodelling of the heart. Nat Rev Cardiol. 2013;10(1):15–26. doi: 10.1038/nrcardio.2012.158. [DOI] [PubMed] [Google Scholar]
- 13.Jeck WR, Sorrentino JA, Wang K, et al. Circular RNAs are abundant, conserved, and associated with ALU repeats. RNA. 2013;19(2):141–57. doi: 10.1261/rna.035667.112. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Chen I, Chen CY, Chuang TJ. Biogenesis, identification, and function of exonic circular RNAs. Wiley Interdiscip Rev RNA. 2015;6(5):563–79. doi: 10.1002/wrna.1294. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Bei YH, Yang TT, Wang LJ, et al. Circular RNAs as potential theranostics in the cardiovascular system. http://cn.bing.com/academic/profile?id=217e7ef419162300f6b26b41182e9d53&encoded=0&v=paper_preview&mkt=zh-cn. Mol Ther Nucleic Acids. 2018;13(3):407–18. doi: 10.1016/j.omtn.2018.09.022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Hansen TB, Jensen TI, Clausen BH, et al. Natural RNA circles function as efficient microRNA sponges. Nature. 2013;495(7441):384–8. doi: 10.1038/nature11993. [DOI] [PubMed] [Google Scholar]
- 17.Geng HH, Li R, Su YM, et al. The circular RNA Cdr1as promotes myocardial infarction by mediating the regulation of miR-7a on its target genes expression. PLoS One. 2016;11(3):e0151753–64. doi: 10.1371/journal.pone.0151753. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Wang K, Long B, Liu F, et al. A circular RNA protects the heart from pathological hypertrophy and heart failure by targeting miR-223. Eur Heart J. 2016;37(33):2602–11. doi: 10.1093/eurheartj/ehv713. [DOI] [PubMed] [Google Scholar]
- 19.Bazan HA, Hatfield SA, Brug A, et al. Carotid plaque rupture is accompanied by an increase in the ratio of serum circR-284 to miR- 221 levels. http://cn.bing.com/academic/profile?id=6755536807a0291ab2e3786efc9a05ee&encoded=0&v=paper_preview&mkt=zh-cn. Circ Cardiovasc Genet. 2017;10(4):117–28. doi: 10.1161/CIRCGENETICS.117.001720. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Cruz MS, da Silva AM, de Souza KS, et al. miRNAs emerge as circulating biomarkers of post-myocardial infarction heart failure. http://cn.bing.com/academic/profile?id=15759d78ef0dcb9a32f29aac48aa94eb&encoded=0&v=paper_preview&mkt=zh-cn. Heart Fail Rev. 2019;(6):10741–52. doi: 10.1007/s10741-019-09821-1. [DOI] [PubMed] [Google Scholar]
- 21.Lu DC, Thum T. RNA-based diagnostic and therapeutic strategies for cardiovascular disease. Nat Rev Cardiol. 2019;16(11):661–74. doi: 10.1038/s41569-019-0218-x. [DOI] [PubMed] [Google Scholar]
- 22.Nagy O, Barath S, Ujfalusi A. The role of microRNAs in congenital heart disease. http://cn.bing.com/academic/profile?id=71d99161c48aff981bc29ea726031203&encoded=0&v=paper_preview&mkt=zh-cn. eJIFCC. 2019;30(2):165–78. [PMC free article] [PubMed] [Google Scholar]
- 23.Hou N, Wang J, Li ZH, et al. Cardiomycyte overexpression of miR- 27b resulted in cardiac fibrosis and mitochondria injury in mice. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=yc201203009. Hereditas. 2012;34(3):326–34. doi: 10.3724/sp.j.1005.2012.00326. [DOI] [PubMed] [Google Scholar]
- 24.Wang J, Song Y, Zhang Y, et al. Cardiomyocyte overexpression of miR-27b induces cardiac hypertrophy and dysfunction in mice. http://d.old.wanfangdata.com.cn/OAPaper/oai_pubmedcentral.nih.gov_3292295. Cell Res. 2012;22(3):516–27. doi: 10.1038/cr.2011.132. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Li XN, Wu YM, Liu AH, et al. MiR-27b is epigenetically downregulated in tamoxifen resistant breast cancer cells due to promoter methylation and regulates tamoxifen sensitivity by targeting HMGB3. Biochem Biophys Res Commun. 2016;477(4):768–73. doi: 10.1016/j.bbrc.2016.06.133. [DOI] [PubMed] [Google Scholar]
- 26.Karbiener M, Fischer C, Nowitsch SA, et al. microRNA miR-27b impairs human adipocyte differentiation and targets PPAR gamma. Biochem Biophys Res Commun. 2009;390(2):247–51. doi: 10.1016/j.bbrc.2009.09.098. [DOI] [PubMed] [Google Scholar]
- 27.Hou LJ, Xu J, Jiao YR, et al. MiR-27b promotes muscle development by inhibiting MDFI expression. http://cn.bing.com/academic/profile?id=730bf2b983c3031c9ab15097b354b4a4&encoded=0&v=paper_preview&mkt=zh-cn. Cellul Physiol Biochem. 2018;46(6):2271–83. doi: 10.1159/000489595. [DOI] [PubMed] [Google Scholar]


