Abstract
目的
探讨哺乳动物雷帕霉素靶蛋白(mTOR)活化对薄荷醇诱导的人支气管上皮细胞(BEAS-2B)气道炎症相关因子表达的影响及其机制。
方法
将细胞分为4组:正常对照组、薄荷醇组、雷帕霉素组、薄荷醇+雷帕霉素组。用CCK-8法检测细胞存活率,实时荧光定量PCR检测瞬时受体电位蛋白-8(TRPM8)、肿瘤坏死因子(TNF)-α和白细胞介素(IL)-1β mRNA的表达,Western blot检测BEAS-2B中磷酸化的mTOR(p-mTOR)、TRPM8、TNF-α和IL-1β的蛋白表达。用流式细胞术检测胞内Ca2+荧光强度。
结果
与正常对照组相比,薄荷醇组中细胞TNF-α和IL-1β mRNA及蛋白表达升高,p-mTOR蛋白表达升高,胞内Ca2+浓度升高(P < 0.05)。与正常对照组相比,雷帕霉素组中细胞TNF-α和IL-1β mRNA及蛋白表达均无差异(P>0.05),p-mTOR蛋白表达降低(P < 0.05),胞内Ca2+浓度无差异(P>0.05)。与薄荷醇组相比,薄荷醇+雷帕霉素组中细胞TNF-α和IL-1β mRNA及蛋白表达降低,p-mTOR蛋白表达降低,胞内Ca2+浓度降低(P < 0.05)。
结论
薄荷醇可能通过活化mTOR诱导胞内Ca2+浓度升高,进而促进气道炎症相关因子IL-1β和TNF-α的表达。
Keywords: 人支气管上皮细胞, 薄荷醇, 瞬时受体电位蛋白-8, 哺乳动物雷帕霉素靶蛋白, 气道炎症
Abstract
Objective
To investigate the role of mammalian target of rapamycin (mTOR) activation in menthol-induced expression of airway inflammation- related factors in human bronchial epithelial cells and explore its mechanism.
Methods
Cultured human bronchial epithelial cells (BEAS-2B) were divided into normal control group, menthol group, rapamycin group, and menthol+rapamycin group with corresponding treatments. The cell viability was measured with CCK-8 method. The mRNA levels of transient receptor potential melastatin 8 (TRPM8), tumor necrosis factor (TNF)-α and interleukin (IL)-1β were detected by RT-PCR, and the protein expressions of phosphorylated mTOR (p-mTOR), TRPM8, TNF-α and IL-1β were determined using Western blotting. The intracellular Ca2+ fluorescence intensity was measured by flow cytometry.
Results
Compared with the normal control cells, menthol- treated cells showed significantly increased TNF-α, IL-1β, and p-mTOR expression and elevated intracellular Ca2+ concentration (P < 0.05), and the rapamycin-treated cells exhibited significantly decreased p-mTOR expression (P < 0.05). No significant difference was found in TNF-α, IL-1β or intracellular Ca2+ concentration between the normal control and rapamycin-treated cells (P>0.05). Compared with the menthol-treated cells, the cells treated with both menthol and rapamycin showed significantly decreased TNF- α, IL-1β, and p-mTOR expression and obviously lowered intracellular Ca2+ concentration (P < 0.05).
Conclusion
Menthol promotes the expressions of airway inflammationrelated factors IL-1β and TNF-α possibly by activating mTOR to cause the increase of intracellular Ca2+ concentration.
Keywords: human bronchial epithelial cells, menthol, transient receptor potential melastatin 8, mammalian target of rapamycin, airway inflammation
慢性气道炎症性疾病包括慢性阻塞性肺病(COPD)和支气管哮喘, 该类患者常常因受到冷空气刺激后出现病情的加重, 随后出现咳嗽、支气管痉挛等呼吸道症状[1-2], 并伴随炎症因子浸润及气道黏液分泌等病理改变[3-4]。如何控制上述患者受凉后病情进展是目前需要解决的问题。瞬时受体电位蛋白-8(TRPM8)作为特异的冷敏感受体在人支气管上皮细胞中表达[3, 5], 能被低温(低于25℃)及薄荷醇等凉性化合物激活, 激活后可引起细胞内Ca2+浓度升高[3, 6], 并进一步导致白细胞介素(IL)-4、IL-6、IL-8等多种炎症因子的产生[6-7]。哺乳动物雷帕霉素靶蛋白(mTOR)是细胞内重要的调控因子, 细胞通过mTOR相关信号通路感受各种外界因素如氧气浓度、生长因子、应激水平等[8-10], 并通过对下游信号的调控来调节基因转录、蛋白质翻译以及细胞自噬等生理过程, 维持机体和细胞的稳态平衡[11-13]。近几年研究也发现mTOR相关信号通路在气道炎症性疾病中具有重要的调控作用[12, 14]。但目前研究中mTOR相关信号通路是否参与气道中TRPM8受体被激动后炎症因子表达的调控尚无相关报道。本次实验中使用凉性化合物薄荷醇干预人支气管上皮细胞(BEAS-2B)来模拟人气道受冷刺激后的低温状态旨在探究薄荷醇干预后对mTOR活化、TRPM8蛋白表达、气道炎症相关因子IL-1β和肿瘤坏死因子(TNF)-α表达的影响, 以及薄荷醇是否通过mTOR的活化诱导胞内Ca2+浓度升高, 从而引起气道炎症相关因子表达变化。本研究有助于阐明TRPM8激动诱发气道炎症因子浸润的分子生物学机制, 为控制慢性气道炎症性疾病患者受凉后病情进展提供了新的实验依据。
1. 材料和方法
1.1. 试剂和材料
人正常支气管上皮细胞BEAS-2B(赛百慷); RPMI 1640培养基、胎牛血清(Gibco); 薄荷醇(阿拉丁); 兔抗人TNF-α单克隆抗体、兔抗人TRPM8单克隆抗体(Abcam); 兔抗人p-mTOR单克隆抗体、兔抗人mTOR单克隆抗体(Cell Signaling Technology); 兔抗人IL-1β单克隆抗体、山羊抗兔IgG(武汉三鹰); 兔抗人β-actin单克隆抗体(巴傲得); CCK-8试剂盒(同仁); 雷帕霉素(MCE); Fluo-3 AM(碧云天); RNA提取试剂购自(北京天根); 高效率逆转录试剂盒ReverTra Ace-α(上海东洋纺)。
1.2. 细胞培养和分组
BEAS-2B细胞贴壁生长于RPMI 1640培养基中(含10%胎牛血清、1×105 U/L青霉素、100 mg/L链霉素), 置于37℃、5%CO2的培养箱中培养, 每隔24 h更换培养基, 细胞密度达到80%时, 1:3传代。实验分组:正常对照组细胞置于37℃培养箱中常规培养。薄荷醇组细胞分别用薄荷醇(1 mmol/L)处理6、12、24 h。从中选择IL-1β、TNF-α和p-mTOR表达较高的时间组予以mTOR抑制剂雷帕霉素作为薄荷醇+雷帕霉素组, 在薄荷醇处理前予以雷帕霉素100 nmol/L干预处理30 min。
1.3. CCK-8法检测细胞活性
待BEAS-2B细胞增殖到对数期, 2.5 g/L胰酶消化30 s, 用血清终止细胞消化, 800 r/min, 离心5 min, 在细胞计数板上对细胞进行计数, 以1×104/mL的密度接种于96孔板上, 每组5个复孔, 每孔加入100 μL细胞悬液, 置于37℃、5%CO2培养箱培养24 h使细胞贴壁。CCK-8法分别检测四组的细胞活性, 正常对照组置于37℃培养箱中常规培养至设定时间。雷帕霉素组中, 用雷帕霉素100 nmol/L分别处理至0.5、1、3、6、12、24 h。在薄荷醇组中, 用薄荷醇1 mmol/L分别处理至0.5、1、3、6、12、24 h。在薄荷醇+雷帕霉素组中, 雷帕霉素100 nmol/L干预30 min后, 用薄荷醇1 mmol/L分别处理至0.5、1、3、6、12、24 h。结束后吸弃上清液, 每孔加入100 μL培养基及10 μL CCK-8溶液继续培养箱内孵育40 min, 待孔内的液体颜色变橙黄, 于酶标仪上450 nm处检测吸光度A(A450 nm)。细胞存活率(%)=[(A实验-A空白)(/A对照-A空白)]×100%。
1.4. 实时荧光定量PCR法检测TRPM8、IL-1β和TNF-α mRNA的表达
各组细胞培养至设定时间, 按Trizol法提取各组细胞总RNA, 参照高效率逆转录试剂盒说明书逆转录合成cDNA, 用PCR仪进行Real-time PCR扩增:95℃预变性30 s, 95℃变性5 s, 60℃退火30 s, 共40个循环。以β-actin作为参照基因, 采用2-△△Ct相对定量表示各组TRPM8、IL-1β和TNF-α mRNA的表达量(表 1)
1.
Real-time PCR引物序列
Sequences of primers for real-time PCR
| Name of genes | Sequences of primers (5'-3') | |
| Forward | Revers | |
| TRPM8 | CAGCGCTGGAGGTGGATATTC | CACACACAGTGGCTGGACTC |
| TNF-α | TGCCTCAGCCTCTTCTCATT | ATGAGAGGGAGCCCATTG |
| IL-1β | GCCAGTGAAATGATGGCTTATT | AGGAGCACTTCATCTGTTTAGG |
| β-actin | CCTGTACGCCACACAGTGC | ATACTCCTGCTTGCTGATCC |
1.5. Western blot检测p-mTOR、TRPM8、IL-1β和TNF-α蛋白表达
各组细胞培养至设定时间, 加入细胞裂解液(含1% PMSF和1%磷酸化蛋白酶抑制剂)于冰上吹打裂解30 min, 12 000 r/min离心15 min, 收集上清液, 提取细胞总蛋白。BCA法检测蛋白浓度后, 将蛋白样品与5×上样缓冲液以4:1的比例混合后, 100℃煮沸5 min。蛋白样品经SDS-聚丙烯酰胺凝胶电泳分离, 230 mA恒流电转至聚偏二氟乙烯膜, 把膜放在5%脱脂奶粉中, 室温封闭90 min, 加入稀释好的一抗:p-mTOR抗体(1:1500稀释)、mTOR抗体(1:1000稀释)、TRPM8抗体(1:1000稀释)、IL-1β抗体(1:800稀释)、TNF-α抗体(1:1000稀释)以及β-actin抗体(1:3000稀释)4℃孵育过夜; 1× TBST洗膜后, 加二抗山羊抗兔IgG(1:5000稀释), 室温孵育1 h。再次洗膜后ECL溶液显影, 应用Image Lab软件分析条带灰度值。
1.6. 流式细胞术检测细胞内钙离子荧光强度
在1.2小节实验分组基础上, 增设一组空白对照组, 其中空白对照组相较于其余四组, 不需要负载Fluo-3 AM探针。雷帕霉素在装载Fluo-3 AM探针前干预处理30 min。除空白对照组外的四组分别加入浓度为5 μmol/L的Fluo-3 AM, 37℃避光孵育30 min, 而后用PBS缓冲液洗涤3次。五组细胞消化后重悬于1 mL含Ca2+的缓冲液中, 其中薄荷醇组和薄荷醇+雷帕霉素组用薄荷醇1 mmol/L处理5 min。以上各组, 于流式细胞仪488 nm激发波长检测。
1.7. 统计学分析
采用SPSS23.0统计软件进行数据分析, 计量资料以均数±标准差来表示, 多样本均数间比较采用单因素方差分析, P < 0.05表示差异有统计学意义。
2. 结果
2.1. 细胞活性检测结果
CCK-8法检测各组细胞的细胞活性(图 1)。与对照组(0 h)比较, 雷帕霉素组细胞存活率在100 nmol/L雷帕霉素处理24 h后明显降低(P < 0.05)。短时间使用以100 nmol/L浓度雷帕霉素干预BEAS-2B细胞, 对细胞存活率无明显影响。干预时间逐渐延长, BEAS-2B细胞贴壁能力逐渐下降, 细胞存活率降低。用1 mmol/L薄荷醇处理24 h后, 与对照组(0 h)相比, 各时间点细胞存活率差异均无统计学意义(P>0.05)。薄荷醇组与薄荷醇+雷帕霉素组比较, 细胞存活率在各个时间点差异均无统计学意义(P>0.05)。
1.
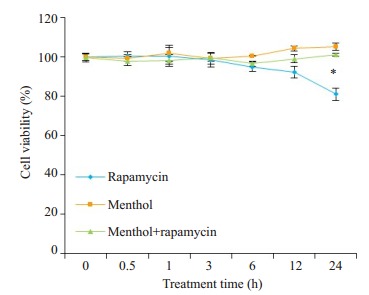
各组细胞存活率的比较
Comparison of cell viability among the groups. *P < 0.05 vs normal control group.
2.2. 薄荷醇对TRPM8、TNF-α和IL-1β mRNA表达的影响
基于细胞活性检测结果, 用薄荷醇1 mmol/L浓度处理BEAS-2B细胞6、12、24 h。实时荧光定量PCR检测结果显示, 和对照组相比, 薄荷醇组的TNF-α和IL-1β mRNA表达增加(P < 0.05, 图 2), TRPM8 mRNA表达无明显改变(P>0.05, 图 2)。
2.
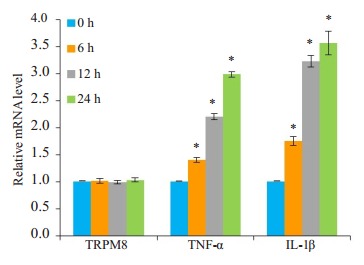
薄荷醇处理不同时间对TRPM8、TNF-α和IL-1β mRNA表达的影响
Effects of menthol treatment for different durations on mRNA expressions of TRPM8, TNF-α and IL-1β. *P < 0.05 vs normal control group.
2.3. 薄荷醇对p-mTOR、TRPM8、TNF-α和IL-1β蛋白表达的影响
Western blot检测结果显示, 和对照组相比, 薄荷醇组的p-mTOR、TNF-α和IL-1β蛋白表达增加(P < 0.05, 图 3), TRPM8蛋白表达无明显差异(P>0.05, 图 3)。
3.
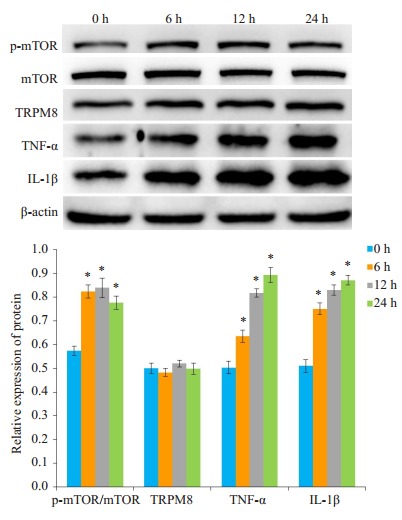
薄荷醇处理不同时间对p-mTOR、TRPM8、TNF-α和IL-1β蛋白表达的影响
Effects of menthol treatment for different durations on protein expressions of p-mTOR, TRPM8, TNF-α and IL-1β. *P < 0.05 vs normal control group.
2.4. 薄荷醇及mTOR的抑制剂雷帕霉素对TRPM8、TNF-α和IL-1β mRNA表达的影响
基于细胞活性检测结果, 本次实验中雷帕霉素预处理的时间为30 min。在薄荷醇时间梯度实验中, 在薄荷醇处理至12 h时, p-mTOR、TNF-α和IL-1β表达都较高, 因此选择12 h作为薄荷醇的处理时间。实时荧光定量PCR检测结果显示, 和对照组相比, 雷帕霉素组的TRPM8、TNF-α和IL-1β mRNA表达无明显差异(P>0.05, 图 4)。薄荷醇+雷帕霉素组中TNF-α和IL-1β mRNA表达较薄荷醇组降低(P < 0.05, 图 4)。
4.
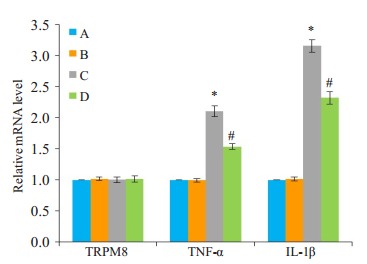
不同处理对TRPM8、TNF-α和IL-1β mRNA表达的影响
Effects of different treatment on mRNA expressions of TRPM8, TNF-α and IL-1β. A:Normal control group; B:Rapamycin group; C:Menthol group; D:Menthol+rapamycin group. *P < 0.05 vs normal control group; #P < 0.05 vs menthol group.
2.5. 薄荷醇及mTOR的抑制剂雷帕霉素对p-mTOR、TRPM8、TNF-α与IL-1β蛋白表达的影响
Western blot检测结果显示, 和对照组相比, 雷帕霉素组的p-mTOR蛋白表达明显减低(P < 0.05, 图 5), TRPM8蛋白表达无明显差异(P>0.05, 图 5)。薄荷醇+雷帕霉素组中p-mTOR、TNF-α和IL-1β蛋白表达较薄荷醇组明显降低(P < 0.05, 图 5)。
5.
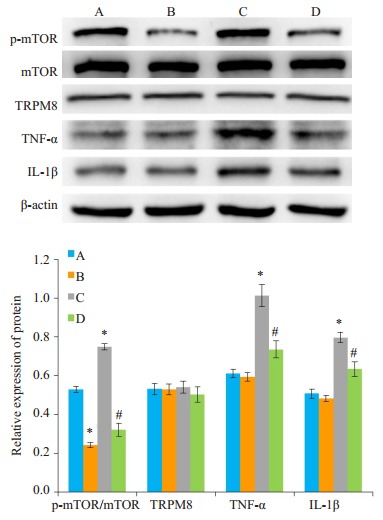
不同处理对p-mTOR、TRPM8、TNF-α和IL-1β蛋白表达的影响
Effects of different treatments on protein expressions of p-mTOR, TRPM8, TNF-α and IL-1β. A:Normal control group; B:Rapamycin group; C:Menthol group; D:Menthol + rapamycin group. *P < 0.05 vs normal control group; #P < 0.05 vs menthol group.
2.6. 胞内Ca2+荧光强度的变化
流式细胞术检测细胞内Ca2+荧光强度结果显示, 与空白对照组相比, 正常对照组胞内Ca2+荧光强度升高(P < 0.05, 图 6), 表明正常对照组中成功装载Fluo-3 AM钙离子探针。与正常对照组相比, 雷帕霉素组胞内Ca2+荧光强度无明显差异(P>0.05, 图 6), 雷帕霉素短时间干预不会引起胞内Ca2+荧光强度浓度的改变。与正常对照组相比, 薄荷醇组胞内Ca2+荧光强度升高(P < 0.05, 图 6)。与薄荷醇组相比, 薄荷醇+雷帕霉素组胞内Ca2+荧光强度降低(P < 0.05, 图 6)。
6.
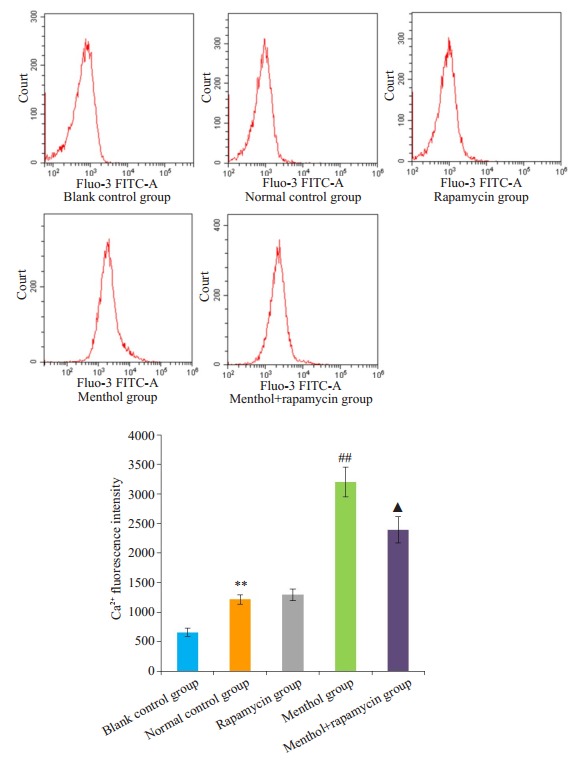
流式细胞术检测各组细胞Ca2+荧光强度
Fluorescence intensity of intracellular free calcium determined by flow cytometry. **P < 0.01 vs blank control group; ##P < 0.01 vs normal control group; ▲P < 0.05 vs menthol group.
3. 讨论
慢性气道炎症性疾病患者常因受冷刺激后出现病情的急性加重, 其中气道炎症因子浸润是其重要的病理生理特征, 涉及了调节固有免疫应答、调节适应性免疫应答、诱导细胞凋亡、直接杀伤靶细胞、促进损伤组织的修复等过程。本研究的IL-1β是IL-1配体家族的其中一种促炎亚型, 在调节先天性和适应性免疫应答中起重要作用[15-16], 气道内的IL-1β能增加多种细胞因子和血管粘附分子的表达并诱导趋化因子, 促使中性粒细胞等浸润到支气管黏膜, 同时还能诱导气道黏液高分泌, 上述病理变化共同促进气道炎症的发生发展[16-17]。TNF-α是机体重要的免疫防护介质, 参与机体的免疫病理损伤。在气道炎症反应中与其他细胞因子和趋化因子一起启动炎症级联反应, 并维持炎症反应[18-19]。本次实验中使用凉性化合物薄荷醇干预BEAS-2B细胞来模拟气道受冷刺激后的低温状态, 实验结果显示IL-1β和TNF-α在转录水平和蛋白水平表达均出现上调, 表明薄荷醇能诱导BEAS-2B细胞气道炎症相关因子IL-1β和TNF-α的表达, 上述实验结果与既往研究相符。
TRPM8受体是存在于细胞质膜或细胞器膜上的冷敏感受体, 是机体感受外界环境寒冷刺激的重要受体[20-21]。在香烟烟雾干预的小鼠气道上皮内TRPM8受体表达上调, 冷刺激使上述小鼠气道中的炎症因子显著升高[22]。已有研究证实COPD患者气道上皮细胞内高表达TRPM8受体[3], 上述结果提示TRPM8受体在气道上皮内表达上调, 可能与受凉后诱发COPD患者出现炎症因子浸润, 黏液高分泌等病理生理变化有关。本研究发现, 分别用薄荷醇和雷帕霉素干预BEAS-2B细胞对TRPM8表达无明显影响。
mTOR是细胞内重要的调控因子, 近几年研究发现mTOR相关信号通路在呼吸系统疾病中具有重要的调控作用。Hu等[12]的研究指出小鼠肺上皮细胞中mTOR的活化促进脂多糖诱导的炎症因子浸润并加重急性肺损伤。此外mTOR介导的自噬参与氯胺酮对过敏性气道炎症的保护作用[23]。Ca2+是细胞内重要的第二信使, 在激活人气道支气管上皮细胞基因表达中的起着重要作用[24]。相关研究证实, 当TRPM8受体激活后会引起人支气管上皮细胞内Ca2+浓度升高, 胞内Ca2+参与后续气道炎症相关因子表达的调控[6-7]。Marcolivier等[25]的研究指出在大鼠胰岛β细胞瘤细胞中mTOR参与调控三磷酸肌醇诱导的Ca2+释放。Jiang等[26]在大鼠脊索细胞中通过Ca2+依赖性AMPK/mTOR途径激活自噬。提示mTOR和Ca2+之间可能存在相互作用。本研究发现薄荷醇干预BEAS-2B细胞后mTOR活化, p-mTOR的蛋白表达升高, 胞内Ca2+荧光强度升高。而mTOR抑制剂雷帕霉素干预后, 薄荷醇诱导的胞内Ca2+荧光强度显著降低, IL-1β、TNF-α的表达降低。推测mTOR活化被抑制后, 可能通过降低薄荷醇诱导的胞内Ca2+释放, 从而减少了BEAS-2B细胞中气道炎症相关因子的产生。本次研究的不足之处在于TRPM8受体激活后通过何种机制引起mTOR的活化尚未明确, mTOR是否会通过其他的下游信号通路参与调控气道炎症相关因子的产生仍待进一步阐明。
综上所述, 本研究首次报道薄荷醇可引起BEAS-2B细胞中mTOR的活化, 后者可能通过调控薄荷醇诱导的胞内Ca2+释放, 继而影响BEAS-2B细胞中气道炎症相关因子的产生, 最终导致气道炎症浸润。本研究还发现上述过程中, 薄荷醇作用靶点TRPM8受体蛋白表达无显著变化。mTOR有可能成为新的靶点以减轻慢性气道炎症性疾病患者受凉后出现的气道炎症因子浸润, 为控制慢性气道炎症性疾病患者受凉后病情进展提供了新的思路。
Biography
陈海博,硕士研究生,E-mail: chanhibo@163.com
Funding Statement
国家自然科学基金(81270102);重庆市自然科学基金(cstc2012jjA10050);重庆市教委科学技术研究基金(KJ120301)
Supported by National Natural Science Foundation of China (81270102)
Contributor Information
陈 海博 (Haibo CHEN), Email: chanhibo@163.com.
李 敏超 (Minchao LI), Email: liminc66@aliyun.com.
References
- 1.Hyrkas H, Ikaheimo TM, Jaakkola JJ. Asthma control and cold weather-relatedrespiratory symptoms. https://www.ncbi.nlm.nih.gov/pubmed/27021573. RespirMed. 2016;113:1–7. doi: 10.1016/j.rmed.2016.02.005. [DOI] [PubMed] [Google Scholar]
- 2.Brzezińska-Pawłowska OE, Rydzewska AD, Łuczyńska M, et al. Environmental factors affecting seasonality of ambulance emergency service visits for exacerbations of asthma and COPD. http://cn.bing.com/academic/profile?id=54fd7fa83d13253dd6ce5449a3b84792&encoded=0&v=paper_preview&mkt=zh-cn. JAsthma. 2016;53(2):139–45. doi: 10.3109/02770903.2015.1075547. [DOI] [PubMed] [Google Scholar]
- 3.Li M, Li Q, Yang G, et al. Cold temperature induces mucin hypersecretion from normal human bronchial epithelial cells in vitro through a transient receptor potential melastatin 8 (TRPM8)- mediated mechanism. J Allergy Clin Immunol. 2011;128(3):626–34. doi: 10.1016/j.jaci.2011.04.032. [DOI] [PubMed] [Google Scholar]
- 4.Joo SY, Park MJ, Kim KH, et al. Cold stress aggravates inflammatory responses in an LPS-induced mouse model of acute lung injury. Int J Biometeorol. 2016;60(8):1217–25. doi: 10.1007/s00484-015-1116-5. [DOI] [PubMed] [Google Scholar]
- 5.Sabnis AS, Shadid M, Yost GS, et al. Human lung epithelial cells Express a functional cold-sensing TRPM8 variant. Am J Respir Cell Mol Biol. 2008;39(4):466–74. doi: 10.1165/rcmb.2007-0440OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Lin AH, Liu MH, Ko H, et al. Inflammatory effects of menthol vs. non-menthol cigarette smoke extract on human lung epithelial cells: a Double-Hit on TRPM8 by reactive Oxygen species and menthol. Front Physiol. 2017;8:263. doi: 10.3389/fphys.2017.00263. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Sabnis AS, Reilly CA, Veranth JM. Increased transcription of cytokine genes in human lung epithelial cells through activation of a TRPM8 variant by cold temperatures. Am J Physiol Lung Cell Mol Physiol. 2008;295(1):L194–200. doi: 10.1152/ajplung.00072.2008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Cosin-Roger J, Simmen S, Melhem H, et al. Hypoxia ameliorates intestinal inflammation through NLRP3/mTOR downregulation and autophagy activation. http://cn.bing.com/academic/profile?id=d021004ab907d616b6adb284de7e6a9b&encoded=0&v=paper_preview&mkt=zh-cn. Nat Commun. 2017;8(1):98. doi: 10.1038/s41467-017-00213-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Sengupta S, Peterson TR, Sabatini DM. Regulation of the mTOR complex 1 pathway by nutrients, growth factors, and stress. Mol Cell. 2010;40(2):310–22. doi: 10.1016/j.molcel.2010.09.026. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Saxton RA, Sabatini DM. mTOR signaling in growth, metabolism, and disease. Cell. 2017;168(6):960–76. doi: 10.1016/j.cell.2017.02.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Morrow JJ, Mendoza A, Koyen A, et al. mTOR inhibition mitigates enhanced mRNA translation associated with the metastatic phenotype of osteosarcoma cells in vivo. Clin Cancer Res. 2016;22(24):6129–41. doi: 10.1158/1078-0432.CCR-16-0326. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Hu YE, Lou J, Mao YY, et al. Activation of MTOR in pulmonary epithelium promotes LPS-induced acute lung injury. Autophagy. 2016;12(12):2286–99. doi: 10.1080/15548627.2016.1230584. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Blandino-Rosano M, Barbaresso R, Jimenez-Palomares M, et al. Loss of mTORC1 signalling impairs β-cell homeostasis and insulin processing. Nat Commun. 2017;8:16014. doi: 10.1038/ncomms16014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Wang Y, Liu J, Zhou JS, et al. MTOR suppresses cigarette SmokeInduced epithelial cell death and airway inflammation in chronic obstructive pulmonary disease. J Immunol. 2018;200(8):2571–80. doi: 10.4049/jimmunol.1701681. [DOI] [PubMed] [Google Scholar]
- 15.Pauwels NS, Bracke KR, Dupont LL, et al. Role of IL-1 alpha and the Nlrp3/caspase-1/IL-1 beta axis in cigarette smoke-induced pulmonary inflammation and COPD. Eur Respir J. 2011;38(5):1019–28. doi: 10.1183/09031936.00158110. [DOI] [PubMed] [Google Scholar]
- 16.Sims JE, Smith DE. The IL-1 family: regulators of immunity. Nat Rev Immunol. 2010;10(2):89–102. doi: 10.1038/nri2691. [DOI] [PubMed] [Google Scholar]
- 17.Wu S, Li H, Yu L, et al. IL-1β upregulates muc5ac expression via NF- κB-induced HIF-1α in asthma. Immunol Lett. 2017;192:20–6. doi: 10.1016/j.imlet.2017.10.006. [DOI] [PubMed] [Google Scholar]
- 18.Alnahas S, Hagner S, Raifer H, et al. IL-17 and TNF- alpha are key mediators of moraxella catarrhalis triggered exacerbation of Allergic airway inflammation. Front Immunol. 2017;8:1562. doi: 10.3389/fimmu.2017.01562. doi: 10.3389/fimmu.2017.01562. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Lee HS, Park HW, Song WJ, et al. TNF-alpha enhance Th2 and Th17 immune responses regulating by IL23 during sensitization in asthma model. Cytokine. 2016;79:23–30. doi: 10.1016/j.cyto.2015.12.001. [DOI] [PubMed] [Google Scholar]
- 20.Ghosh D, Pinto S, Danglot L, et al. VAMP7 regulates constitutive membrane incorporation of the cold-activated Channel TRPM8. http://cn.bing.com/academic/profile?id=54b25f72eb084c227fb9d7b127e220b2&encoded=0&v=paper_preview&mkt=zh-cn. Nat Commun. 2016:10489. doi: 10.1038/ncomms10489. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Toro CA, Eger S, Veliz LA, et al. Agonist-Dependent modulation of cell surface expression of the cold receptor TRPM8. J Neurosci. 2015;35(2):571–82. doi: 10.1523/JNEUROSCI.3820-13.2015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Li MC, Yang G, Zhou XD, et al. The pathophysiological mechanisms underlying mucus hypersecretion induced by cold temperatures in cigarette smoke-exposed rats. Int J Mol Med. 2014;33(1):83–90. doi: 10.3892/ijmm.2013.1535. [DOI] [PubMed] [Google Scholar]
- 23.Zou H, Wang LX, Wang M, et al. MTOR-mediated autophagy is involved in the protective effect of ketamine on allergic airway inflammation. http://cn.bing.com/academic/profile?id=c652e7c655ac49cfa3ce5d9259f9bd29&encoded=0&v=paper_preview&mkt=zh-cn. J Immunol Res. 2019:5879714. doi: 10.1155/2019/5879714. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Samanta K, Bakowski D, ParekhAB Key role for store-operated Ca2+ channels in activating gene expression in human airway bronchial epithelial cells. PLoS One. 2014;9(8):e105586. doi: 10.1371/journal.pone.0105586. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Frégeau MO, Régimbald-Dumas Y, Guillemette G. Positive regulation of inositol 1, 4, 5- trisphosphate-induced Ca2+ release by mammalian target of rapamycin(mTOR) in RINm5F cells. J Cell Biochem. 2011;112(2):723–33. doi: 10.1002/jcb.23006. [DOI] [PubMed] [Google Scholar]
- 26.Jiang LB, Cao L, Yin XF, et al. Activation of autophagy via Ca2+- dependent AMPK/mTOR pathway in rat notochordal cells is a cellular adaptation under hyperosmotic stress. Cell Cycle. 2015;14(6):867–79. doi: 10.1080/15384101.2015.1004946. [DOI] [PMC free article] [PubMed] [Google Scholar]


