Resumen
Objetivo
Describir la relación entre factores pronósticos, individuales o asociados en clasificaciones multidimensionales (BODE y ADO), y la calidad de vida relacionada con la salud (CVRS) de los pacientes con enfermedad pulmonar obstructiva crónica (EPOC).
Diseño
Estudio descriptivo transversal.
Emplazamiento
Atención primaria.
Participantes
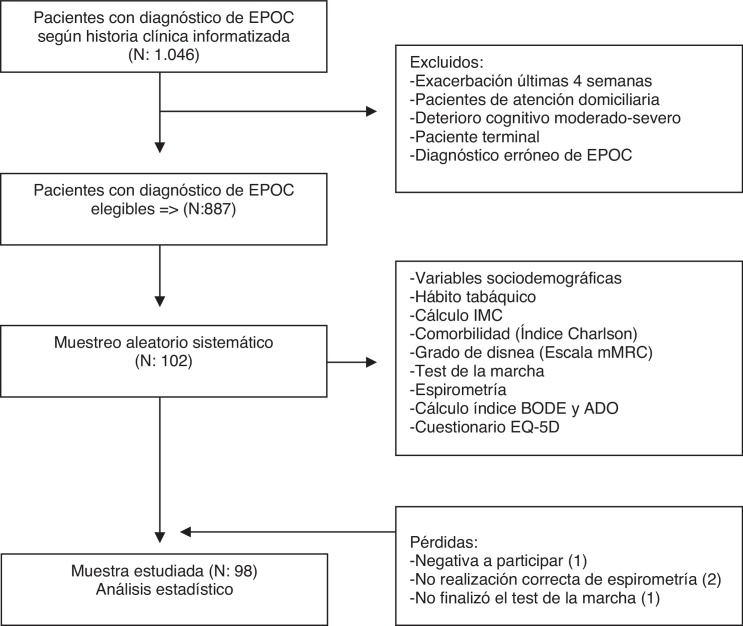
Muestreo aleatorizado sistemático de 102 pacientes diagnosticados de EPOC. Excluidos aquellos con exacerbación aguda, demencia, enfermedad terminal o los que reciben atención domiciliaria.
Mediciones principales
Datos demográficos, hábito tabáquico, índice de masa corporal y número de exacerbaciones. Comorbilidad. Grado de disnea. Prueba de función respiratoria. Capacidad de ejercicio. El índice BODE y ADO. Cuestionario EuroQol-5D (EQ-5D) y escala visual analógica (EVA).
Resultados
En EQ-5D: movilidad, 43,9%; cuidado personal, 13,3%; actividades cotidianas, 29,6%; dolor/malestar, 55,1%; ansiedad/depresión, 37,8%. El 34,7% EVA ≤ 60%.
Exacerbaciones: movilidad, OR: 1,85 (IC 95%: 1,08-3,20); cuidado personal, OR: 2,12 (IC 95%: 1,03-4,76); actividades cotidianas, OR: 2,35 (IC 95%: 1,17-4,71); EVA, coeficiente regresión: −3,50 (IC 95%: −6,31- −0,70). Disnea: movilidad, OR: 4,47 (IC 95%: 1,39-14,42); actividades cotidianas, OR: 7,71 (IC 95%: 2,03-12,34)]; EVA, coeficiente regresión: −7,15 (IC 95%: −11,71- −2,59).
BODE: movilidad, OR: 1,53 (IC 95%: 1,15-2,02); cuidado personal, OR: 2,08 (IC 95%: 1,40-3,11); actividades cotidianas, OR: 1,97 (IC 95%: 1,38-2,80); EVA, coeficiente regresión: −3,96 (IC 95%: −5,51- −2,42). ADO: movilidad, OR: 2,42 (IC 95%: 1,39-4,20); cuidado personal, OR: 3,21 (IC 95%: 1,67-6,18); actividades cotidianas, OR: 3,17 (IC 95%: 1,69-5,93); EVA, coeficiente regresión: −3,53 (IC 95%: −5,57- −1,49).
Conclusiones
Los índices BODE y ADO presentaron una importante asociación con la CVRS. Las exacerbaciones y la disnea fueron los factores individuales que mejor se relacionaron con la CVRS.
Palabras clave: Enfermedad pulmonar obstructiva crónica, Calidad de vida, Atención primaria de salud
Abstract
Objective
To describe the relationship between individual or combined prognostic factors in the multidimensional classifications (BODE and ADO), and health-related quality of life (HRQOL) in patients with chronic obstructive pulmonary disease (COPD).
Design
Cross-sectional descriptive study.
Setting
Primary care.
Participants
Systematic random sample of 102 patients diagnosed with COPD, excluding those patients with acute exacerbation, dementia, terminal illness or those who receive home care.
Main measurements
Demographics variables, smoking habits, body mass index and number of exacerbations. Comorbidity. Degree of dyspnea. Respiratory function tests. Exercise capacity. The BODE index and the ADO index. The EuroQol-5D questionnaire (EQ-5D), and visual analogue scale (VAS).
Results
EQ-5D: mobility: 43.9%; personal care: 13.3%; daily-life activities: 29.6%; pain/discomfort: 55.1%; anxiety/depression: 37.8%, and 34.7% VAS ≤ 60%.
Exacerbations: Mobility, OR: 1.85 (95%CI: 1.08-3.20); personal care, OR: 2.12 (95%CI: 1.3-4.76); daily-life activities, OR: 2.35 (95%CI: 1.17-4.71); VAS, regression coefficient: −3.50 (95%CI: 6.31- −0.70). Dyspnea: mobility, OR: 4.47 (95%CI: 1.39-14.42); daily-life activities, OR: 7.71 (95%CI: 2.03-12.34); VAS, regression coefficient: −7.15 (95%CI: 11.71- −2.59).
BODE: mobility, OR: 1.53 (95%CI: 1.15-2.02); personal care, OR: 2.08 (95%CI: 1.40-3.11); daily-life activities, OR: 1.97 (95%CI: 1.38-2.80); VAS, regression coefficient: −3.96 (95%CI: −5.51- −2.42). ADO: mobility, OR: 2.42 (95%CI: 1.39-4.20); personal care, OR: 3.21 (95%CI: 1.67-6.18); daily-life activities, OR: 3.17 (95%CI: 1.69-5.93); VAS, regression coefficient: −3.53 (95%CI: −5.57- −1.49).
Conclusions
The BODE index and the ADO index showed a significant association with HRQOL. Exacerbations and dyspnea were the best individual factors related to HRQoL.
Keywords: Pulmonary disease, Chronic obstructive; Quality of life; Primary health care
Introducción
La enfermedad pulmonar obstructiva crónica (EPOC) constituye un problema de salud de gran importancia debido a su elevada prevalencia y morbimortalidad asociada1, 2.
Para valorar la gravedad y el pronóstico de la EPOC se ha utilizado fundamentalmente el FEV1 (volumen de aire espirado en el primer segundo) y la disnea, pero también se han propuesto otros factores como el tabaquismo activo, el índice de masa corporal (IMC), las alteraciones nutricionales, las exacerbaciones, la comorbilidad3 o la prueba de ejercicio en 6 min4. Con ellos se pretende tener una estimación de la supervivencia, discriminar a los pacientes que tendrán una mayor tasa de ingresos hospitalarios por exacerbaciones o correlacionarlos con la calidad de vida relacionada con la salud (CVRS)2, 3.
Con el fin de mejorar la capacidad predictiva de estos factores pronósticos individuales se ha propuesto la utilización de clasificaciones multidimensionales que integran la sintomatología del paciente con su función pulmonar o con la afectación sistémica5. El índice BODE (Body mass index, Airflow obstruction, Dyspnea, Exercise capacity)) tiene una validez superior al FEV1 como variable pronóstica y, por lo tanto, una mejor capacidad para clasificar la gravedad de la enfermedad1,3,5. El índice ADO (Age, Dyspnea, Airflow obstruction) podría representar un índice más simplificado y más útil en atención primaria6.
La relación entre los factores clínicos tradicionales y la calidad de vida es pobre puesto que pacientes con FEV1 parecido pueden tener impactos sobre su CVRS muy dispares. La valoración de la CVRS puede ser de utilidad para demostrar beneficios en el tratamiento farmacológico cuando no se obtienen cambios en las mediciones fisiológicas tradicionales o para estudiar la falta de mejora del paciente cuando los datos objetivos sí la han demostrado7.
La CVRS puede medirse con cuestionarios específicos o genéricos. Los específicos valoran síntomas respiratorios que repercuten sobre la CVRS, esto los hace más sensibles, mientras que los genéricos valoran aspectos generales de CVRS que son comunes con otras enfermedades, reflejan mejor las interacciones de la comorbilidad y permiten establecer comparaciones con otras enfermedades8. Para el estudio se ha optado por el cuestionario genérico EuroQol-5D (EQ-5D) porque es sencillo, ampliamente utilizado y ha demostrado ser fiable, válido y sensible en diferentes enfermedades9.
El objetivo del estudio es examinar la relación entre diferentes factores pronósticos, individuales o asociados en clasificaciones multidimensionales (índices BODE y ADO), y la calidad de vida de los pacientes con EPOC que se atienden en las consultas de atención primaria y también conocer si estas clasificaciones multidimensionales pueden ser de utilidad en las consultas de atención primaria.
Población y métodos
Es un estudio descriptivo transversal en un equipo de atención primaria (EAP) de un núcleo urbano que atiende una población de aproximadamente 24.000 habitantes de L’Hospitalet de Llobregat, Barcelona (España).
Participantes
Se incluyó a pacientes diagnosticados de EPOC según historia clínica informatizada.
Los criterios de exclusión fueron: a) exacerbación en las 4 semanas previas a la inclusión; b) pacientes domiciliarios; c) diagnóstico erróneo de EPOC; d) deterioro cognitivo moderado-severo, y e) paciente terminal.
Se consideraron criterios de pérdida: a) negativa a participar; b) espirometría realizada de forma incorrecta; c) imposibilidad de realizar o no finalización del test de la marcha.
El tamaño de la muestra se calculó teniendo en cuenta la situación más desfavorable (p = q = 0,5) con un riesgo alfa del 5% y una precisión del 10%, estimándose que eran necesarios 102 pacientes, asumiendo una tasa de pérdidas del 15%.
Mediante el programa informático eCAP se obtuvo un listado de la población de pacientes EPOC elegibles tras aplicar los criterios de exclusión. Este listado se utilizó para seleccionar mediante un muestreo aleatorizado sistemático la muestra de 102 pacientes.
Tras citación telefónica, se solicitó a los pacientes seleccionados su participación en el estudio y aquellos que firmaron el consentimiento informado entraron a formar parte del mismo.
Recogida de datos
Los datos se recogieron entre 2007 y 2008. Las variables estudiadas fueron: edad, sexo, hábito tabáquico, IMC, número de exacerbaciones el año previo y la comorbilidad valorada mediante el índice de Charlson10 (versión no corregida por edad). Además se investigaron los antecedentes de trastorno de ansiedad o depresión.
Se realizó a todos los pacientes una espirometría forzada. Los resultados de la técnica se basaron en las recomendaciones de la SEPAR11.
Para conocer el grado de disnea se utilizó la escala modificada del Medical Research Council (mMRC)12: grado 0 (ausencia de disnea, excepto con ejercicio intenso); grado 1 (disnea al andar deprisa); grado 2 (incapacidad de mantener el paso de otra persona de la misma edad); grado 3 (la disnea obliga a descansar al caminar 100 m), y grado 4 (la disnea impide salir de casa).
Se les realizó la prueba de la marcha de 6 min siguiendo las indicaciones establecidas en la guía de la American Thoracic Society13.
Los pacientes fueron clasificados según su severidad mediante la actualización del año 2010 de la Global Initiative for Chronic Obstructive Lung Disease14: EPOC leve: FEV1 ≥ 80%; EPOC moderada: 50% ≤ FEV1 < 80%; EPOC severa: 30% ≤ FEV1 < 50%; EPOC muy severa: FEV1 < 30% o FEV1 < 50% e insuficiencia respiratoria crónica.
Para construir el índice BODE se utilizaron las variables independientes IMC (kg/m2) (> 21 = 0 puntos, ≤ 21 = 1 punto), el FEV1 (%) (≥ 65 = 0 puntos, 64-50 = 1 punto, 49-36 = 2 puntos y ≤ 35 = 3 puntos), la disnea según la escala mMRC (0-1 = 0 puntos, 2 = 1 punto, 3 = 2 puntos y 4 = 3 puntos) y el resultado obtenido en el test de la marcha en 6 min (m) (≥ 350 = 0 puntos, 349-250 = 1 punto, 249-150 = 2 puntos y ≤ 149 = 3 puntos). La puntuación en el índice BODE se obtiene de sumar los puntos correspondientes a cada variable5.
El índice ADO fue construido mediante la suma de la puntuación obtenida en las variables independientes edad (años) (40-49 = 0 puntos, 50-59 = 1 punto, 60-69 = 2 puntos, 70-79 = 3 puntos, 80-89 = 4 puntos, ≥ 90 = 5 puntos), la disnea según la escala mMRC (0-1 = 0 puntos, 2 = 1 punto, 3 = 2 puntos y 4 = 3 puntos) y el FEV1 (%) (≥ 65 = 0 puntos, 64-36 = 1 punto, ≤ 35 = 2 puntos)6.
La calidad de vida se evaluó con el cuestionario EQ-5D9. La primera parte del cuestionario valora el estado de salud en 5 dimensiones (movilidad, cuidado personal, actividades cotidianas, dolor/malestar y ansiedad/depresión). Cada dimensión se categoriza en 3 niveles medidos con una escala de Likert (1 = sin problemas, 2 = algunos problemas y 3 = muchos problemas). En la segunda parte, el paciente puntúa su estado de salud en el momento de la entrevista, mediante la escala visual analógica (EVA). Es una escala vertical milimetrada de 20 cm de longitud con los rótulos «peor estado de salud» y «mejor estado de salud» en las puntuaciones de 0 y 100, respectivamente. La EVA establece que por debajo de 50 el estado de salud es peor y por encima mejor.
El proceso de recogida de datos, la valoración del grado de disnea, la prueba de la marcha y el EQ-5D fueron realizados por médicos de atención primaria mientras que la técnica espirométrica la realizó una enfermera entrenada del EAP.
Análisis de los datos
Se realizó con el paquete estadístico SPSS versión 18.0 para Windows. Se realizó un análisis descriptivo y un análisis bivariante con todas las variables sociodemográficas y clínicas, aplicando en el caso de datos cualitativos la prueba de ji al cuadrado o test exacto de Fisher y en el caso de datos cuantitativos la t de Student y las pruebas no paramétricas (U de Mann-Whitney y K de Kruskal-Wallis) cuando fue necesario.
Posteriormente, para identificar los factores pronósticos individuales asociados a cada una de las 5 dimensiones del EQ-5D y a la EVA, se realizaron 5 análisis de regresión logística binaria (variables dependientes fueron las 5 dimensiones del EQ-5D que fueron recodificadas como variables binarias [0 = sin problemas; 1 = algunos problemas o muchos problemas]) y un análisis de regresión lineal múltiple (variable dependiente: puntuación en la EVA). Fue realizado el mismo análisis de regresión logística binaria y de regresión lineal múltiple con las 2 clasificaciones multidimensionales (índice BODE e índice ADO). Se aplicó el método de selección hacia atrás por pasos (Backward stepwise) y se comprobó el ajuste del modelo mediante el coeficiente de determinación R2 en el caso de regresión lineal múltiple y la prueba de Hosmer-Lemeshow y el índice de Nagelkerke en el caso de regresión logística. Los valores de p inferiores a 0,05 se consideraron estadísticamente significativos.
Esquema general del estudio: Estudio descriptivo transversal, para examinar la relación entre factores pronósticos y calidad de vida relacionada con la salud en pacientes con enfermedad pulmonar obstructiva crónica.
IMC: índice de masa corporal; Índice de Charlson: índice de valoración de comorbilidad; Escala mMRC: escala de valoración de la disnea, Índice BODE: Body mass index, Airflow obstruction, Dyspnea, Exercise capacity; Índice ADO: Age, Dysnea, Airflow obstruction; EQ-5D: cuestionario de calidad de vida EuroQol-5D.
Resultados
En la tabla 1 se exponen las características basales y los factores pronósticos individuales de los pacientes incluidos en el estudio en relación con la severidad de la EPOC según la clasificación GOLD 201014. La muestra estudiada fue de 98 pacientes (82 hombres y 16 mujeres) con una media de edad de 71 años. El 28,6% eran fumadores activos. La mayoría presentaron un grado de severidad moderada y una disnea grado 1. A medida que aumentaba el grado de severidad de la EPOC, el grado de disnea y el número de exacerbaciones se incrementaron, y los metros recorridos en el test de la marcha disminuyeron (p < 0,01). La puntuación media del índice de Charlson fue de 1,9. En el índice BODE la puntuación media obtenida fue de 1,9 y en el índice ADO de 3,7.
Tabla 1.
Características demográficas y basales de la muestra estudiada en relación con la severidad de la enfermedad pulmonar obstructiva crónica según la Global Initiative for Chronic Obstructive Lung Disease 201014 (n = 98)
| Severidad EPOC según GOLD 201014, n (%) |
||||||
|---|---|---|---|---|---|---|
| Leve n = 3 (3,1) | Moderado n = 63 (64,3) | Severo n = 25 (25,5) | Muy severo n = 7 (7,1) | Total n = 98 | p | |
| Edad, media (DE) | 73,6 (5,8) | 69,4 (11,9) | 74,5 (7,7) | 72,1 (6,4) | 71 (10,6) | NS |
| Varón, n (%) | 2 (66,7) | 52 (82,5) | 21 (84) | 7 (100) | 82 (83,7) | NS |
| Tabaquismo activo, n (%) | 1 (33,3) | 20 (31,7) | 6 (24) | 1 (14,3) | 28 (28,6) | NS |
| Disnea (escala mMCR), n (%) | ||||||
| 0 | 1 (33,3) | 16 (25,4) | 0 | 0 | 17 (17,3) | < 0,001 |
| 1 | 2 (66,7) | 39 (61,9) | 19 (76) | 3 (42,9) | 63 (64,3) | < 0,001 |
| 2 | 0 | 8 (12,7) | 4 (16) | 1 (14,3) | 13 (13,3) | < 0,001 |
| 3 | 0 | 0 | 2 (8) | 2 (28,6) | 4 (4,1) | < 0,001 |
| 4 | 0 | 0 | 0 | 1 (100) | 1 (1) | < 0,001 |
| IMC (kg/m2), media (DE) | 31,1 (2,3) | 28,3 (4,0) | 29,5 (5,9) | 28,4 (2,7) | 28,7 (4,5) | NS |
| Exacerbaciones, media (DE) | 0 | 0,6 (0,6) | 0,4 (0,5) | 1,1 (0,7) | 0,6 (0,6) | < 0,05 |
| Test marcha (m), media (DE) | 391,7 (1,1) | 334,4 (118,7) | 334,4 (118,7) | 282,9 (114,4) | 398,2 (135,2) | < 0,001 |
| Índice BODE, media (DE) | 0,3 (0,6) | 0,9 (0,9) | 3,4 (1,0) | 5,6 (1,8) | 1,9 (1,8) | < 0,001 |
| Índice ADO, media (DE) | 2,7 (0,6) | 3,1 (1,4) | 4,5 (1,1) | 5,9 (1,2) | 3,7 (1,6) | < 0,001 |
| Antecedentes de ansiedad y/o depresión, n (%) | 1 (6,3) | 11 (68,8) | 2 (12,5) | 2 (12,5) | 16 (16,3) | NS |
| Índice de Charlson, media (DE) | 1,7 (1,2) | 1,8 (1,6) | 2,0 (1,8) | 2,3 (1,9) | 1,9 (1,7) | NS |
Escala mMRC: escala de valoración de la disnea; GOLD: Global Initiative for Chronic Obstructive Lung Disease 2010; IMC: índice de masa corporal; Índice ADO: Age, Dysnea, Airflow obstruction;Índice BODE: Body mass index, Airflow obstruction, Dyspnea, Exercise capacity; Índice Charlson: índice de valoración de comorbilidad; NS: no significativo.
Las dimensiones del EQ-5D más afectadas de forma moderada-severa fueron (tabla 2): dolor/malestar (55,1%), movilidad (43,9%) y ansiedad/depresión (37,8%). En relación con el estado de salud actual comparado con respecto a los últimos 12 meses, el 74,5% se mantuvo estable. El 34,7% de los pacientes EPOC presentaron una puntuación ≤ 60% en la EVA (afectación importante-moderada de la calidad de vida).
Tabla 2.
Número y distribución (%) de problemas en las dimensiones del EroQol-5D (n = 98)
| EuroQol-5D | Ninguno, n (%) | Moderado, n (%) | Severo, n (%) |
|---|---|---|---|
| Problemas de movilidad | 55 (56,1) | 42 (42,9) | 1 (1) |
| Problemas de cuidado personal | 85 (86,7) | 13 (13,3) | 0 (0) |
| Problemas en las actividades cotidianas | 69 (70,4) | 28 (28,6) | 1 (1) |
| Dolor/malestar | 44 (44,9) | 53 (54,1) | 1 (1) |
| Ansiedad/depresión | 61 (62,2) | 32 (32,7) | 5 (5,1) |
| Mejor, n (%) | Igual, n (%) | Peor, n (%) | |
|---|---|---|---|
| Estabilidad respecto a los 12 meses previos | 8 (8,2) | 73 (74,5) | 17 (17,3) |
| Escala visual analógica (EVA: 0-100) | EVA > 60%, n (%) | EVA 60-30%, n (%) | EVA < 30%, n (%) |
|---|---|---|---|
| Media (DE): 68,8 (15,3) | 64 (65,3) | 31 (31,6) | 3 (3,1) |
| Estado de salud ideal (no afectación de ninguna dimensión del EuroQol-5D), n (%) | 19 (19,4) | ||
En el análisis multivariante (Tabla 3, Tabla 4, Tabla 5, Tabla 6) se observó que las exacerbaciones y la disnea, entre los factores individuales, y ambas clasificaciones multidimensionales (BODE y ADO) condicionaron diversas dimensiones del EQ-5D y la EVA.
Tabla 3.
Análisis de regresión logística entre las 5 dimensiones del EuroQol-5D y los factores pronósticos individuales (n = 98)
| Variable dependiente | Variables independientes | B | EE | OR (IC 95%) | p |
|---|---|---|---|---|---|
|
Problemas de movilidad Hosmer-Lemeshow, p = 0,92 R2 de Nagelkerke: 0,47 |
Edad (años) Mujer (sí/no) IMC (kg/m2) Tabaquismo activo (sí/no) Disnea (escala mMRC) FEV1 (% valor referencia) Exacerbaciones (n.o último año) Test de la marcha (m) Índice de Charlson (puntuación) Ansiedad/depresión (sí/no) |
0,04 0,53 0,17 1,27 1,50 –0,03 0,62 0,001 –0,12 –0,09 |
0,04 0,88 0,07 0,74 0,60 0,02 0,28 0,003 0,18 0,74 |
1,05 (0,97-1,13) 1,70 (0,30-9,53) 1,18 (1,02-1,37) 3,54 (0,84-14,99) 4,47 (1,39-14,42) 0,97 (0,94-1,01) 1,85 (1,08-3,20) 1,00 (0,96-1,01) 0,89 (0,63-1,25) 0,91 (0,22-3,88) |
NS NS < 0,05 NS < 0,05 NS < 0,05 NS NS NS |
|
Problemas de cuidado personal Hosmer-Lemeshow, p = 0,31 R2 de Nagelkerke: 0,49 |
Edad (años) Mujer (sí/no) IMC (kg/m2) Tabaquismo activo (sí/no) Disnea (escala mMRC) FEV1 (% valor referencia) Exacerbaciones (n.o último año) Test de la marcha (m) Índice de Charlson (puntuación) Ansiedad/depresión (sí/no) |
0,03 0,35 0,11 1,43 0,74 –0,09 0,75 0,001 –0,26 0,76 |
0,06 1,28 0,09 1,12 0,60 0,04 0,41 0,005 0,34 1,32 |
1,04 (0,92-1,17) 1,41 (0,11-17,49) 1,11 (0,93-1,34) 4,19 (0,47-17,55) 2,09 (0,64-6,78) 0,91 (0,85-0,98) 2,12 (1,03-4,76) 1,00 (0,99-1,01) 0,77 (0,40-1,50) 1,96 (0,15-6,76) |
NS NS NS NS NS < 0,05 < 0,05 NS NS NS |
|
Problemas actividades cotidianas Hosmer-Lemeshow, p = 0,97 R2 de Nagelkerke: 0,59 |
Edad (años) Mujer (sí/no) IMC (kg/m2) Tabaquismo activo (sí/no) Disnea (escala mMRC) FEV1 (% valor referencia) Exacerbaciones (n.o último año) Test de la marcha (m) Índice de Charlson (puntuación) Ansiedad/depresión (sí/no) |
0,05 0,65 –0,05 2,58 2,04 –0,02 0,85 –0,001 0,06 0,78 |
0,04 1,08 0,08 0,59 0,52 0,02 0,36 0,003 0,23 1,00 |
1,05 (0,96-1,14) 1,91 (0,23-15,87) 0,95 (0,82-1,11) 13,30 (2,29-17,30) 7,71 (2,03-12,34) 0,98 (0,93-1,02) 2,35 (1,17-4,71) 1,01 (0,99-1,02) 1,06 (0,68-1,65) 2,17 (0,31-15,50) |
NS NS NS < 0,05 < 0,05 NS < 0,05 NS NS NS |
|
Problemas de dolor/malestar Hosmer-Lemeshow, p = 0,76 R2 de Nagelkerke: 0,19 |
Edad (años) Mujer (sí/no) IMC (kg/m2) Tabaquismo activo (sí/no) Disnea (escala mMRC) FEV1 (% valor referencia) Exacerbaciones (n.o último año) Test de la marcha (m) Índice de Charlson (puntuación) Ansiedad/depresión (sí/no) |
0,05 1,91 –0,04 0,79 0,1 –0,01 0,28 0,000 0,04 1,19 |
0,03 0,79 0,06 0,61 0,38 0,07 0,25 0,002 0,15 0,67 |
1,05 (0,99-1,11) 6,75 (1,44-21,72) 0,96 (0,86-1,07) 2,21 (0,66-7,34) 1,01 (0,48-2,12) 0,99 (0,96-1,02) 1,33 (0,81-2,16) 1,00 (0,99-1,00) 1,04 (0,77-1,41) 3,38 (0,89-12,17) |
NS < 0,05 NS NS NS NS NS NS NS NS |
|
Problemas de ansiedad/depresión Hosmer-Lemeshow, p = 0,26 R2 de Nagelkerke: 0,29 |
Edad (años) Mujer (sí/no) IMC (kg/m2) Tabaquismo activo (sí/no) Disnea (escala mMRC) FEV1 (% valor referencia) Exacerbaciones (n.o último año) Test de la marcha (m) Índice de Charlson (puntuación) Ansiedad/depresión (sí/no) |
0,001 0,94 –0,04 0,50 0,62 0,02 0,26 –0,003 –0,32 2,09 |
0,03 0,79 0,06 0,67 0,42 0,02 0,25 0,002 0,21 0,72 |
1,01 (0,95-1,07) 2,55 (0,61-10,69) 0,97 (0,86-1,08) 1,65 (0,44-6,14) 1,87 (0,83-4,21) 1,02 (0,98-1,06) 1,30 (0,80-2,10) 0,99 (0,96-1,00) 0,73 (0,49-1,1) 8,15 (1,91-14,85) |
NS NS NS NS NS NS NS NS NS < 0,05 |
B: coeficiente B; EE: error estándar; FEV1: volumen de aire espirado en el primer segundo; Hosmer-Lemeshow: prueba de Hosmer-Lemeshow; IC 95%: intervalo de confianza del 95%; IMC: índice de masa corporal; OR: odds ratio; NS: no significativo; R2 de Nagelkerke: índice de Nagelkerke.
Tabla 4.
Análisis de regresión lineal múltiple entre la escala visual analógica y los factores pronósticos individuales (n = 98)
| Variable dependiente | Variables independientes | C. regresión (IC 95%) | EE | Beta | p |
|---|---|---|---|---|---|
|
Escala visual analógica R2 ajustado: 0,26 |
Edad (años) Mujer (sí/no) IMC (kg/m2) Tabaquismo activo (sí/no) Disnea (escala mMRC) FEV1 (% valor referencia) Exacerbaciones (n.o último año) Test de la marcha (m) Índice de Charlson (puntuación) Ansiedad/depresión (sí/no) |
0,06 (–0,29-0,40) 0,04 (–8,31-8,38) –0,30 (–0,96-0,36) –0,34 (–7,71-7,03) –7,15 (–11,71- –2,59) 0,11 (–0,09-0,30) –3,50 (–6,31- –0,70) 0,01 (–0,02-0,04) 1,04 (–0,82-2,91) 4,39 (–3,33-12,11) |
0,18 4,20 0,33 3,71 2,30 0,10 1,41 0,01 0,94 3,89 |
0,04 0,001 –0,09 –0,10 –0,35 0,12 –0,23 0,09 0,12 0,11 |
NS NS NS NS < 0,05 NS < 0,05 NS NS NS |
Beta: coeficiente de regresión estandarizado; C. regresión: coeficiente de regresión no estandarizado; EE: error estándar; FEV1: volumen de aire espirado en el primer segundo; IC 95%: intervalo de confianza al 95%; IMC: índice de masa corporal; NS: no significativo; R2 ajustado: coeficiente de determinación ajutado.
Tabla 5.
Análisis de regresión logística entre las cinco dimensiones del EuroQol-5D y los índices BODE y ADO respectivamente (n = 98)
| Variable dependiente | Variables independientes | B | EE | ORa (IC 95%) | p | R2 Nagelkerke | H-L, p |
|---|---|---|---|---|---|---|---|
| Problemas de movilidad | Índice BODE (puntuación) Índice ADO (puntuación) |
0,42 0,88 |
0,14 0,28 |
1,53 (1,15-2,02) 2,42 (1,39-4,20) |
< 0,05 < 0,05 |
0,30 0,33 |
0,45 0,27 0,27 |
| Problemas de cuidado personal | Índice BODE (puntuación) Índice ADO (puntuación) |
0,73 1,17 |
0,20 0,33 |
2,08 (1,40-3,11) 3,21 (1,67-6,18) |
< 0,001 < 0,001 |
0,40 0,37 |
0,37 0,42 |
| Problemas en las actividades cotidianas | Índice BODE (puntuación) Índice ADO (puntuación) |
0,68 1,15 |
0,18 0,32 |
1,97 (1,38-2,80) 3,17 (1,69-5,93) |
< 0,001 < 0,001 |
0,49 0,48 |
0,86 0,44 |
| Problemas de dolor/malestar | Índice BODE (puntuación) Índice ADO (puntuación) |
0,15 0,11 |
0,13 0,22 |
1,16 (0,90-1,50) 1,11 (0,73-1,70) |
NS NS |
0,18 0,17 |
0,66 0,20 |
| Problemas de ansiedad/depresión | Índice BODE (puntuación) Índice ADO (puntuación) |
0,20 0,24 |
0,13 0,23 |
1,22 (0,94-1,58) 1,27 (0,81-1,98) |
NS NS |
0,27 0,26 |
0,59 0,27 |
B: coeficiente B; EE: error estándar; H-L: prueba de Hosmer y Lemeshow; IC 95%: intervalo de confianza del 95%; Índice ADO: Age, Dysnea, Airflow obstruction; Índice BODE: Body mass index, Airflow obstruction, Dyspnea, Exercise capacity; NS: no significativo; OR: odds ratio; R2 Nagelkerke: índice de Nagelkerke.
Ajustado por edad, sexo, tabaquismo activo, exacerbaciones, índice de Charlson, ansiedad/depresión.
Tabla 6.
Análisis de regresión lineal múltiple entre la escala visual analógica y los índices BODE y ADO respectivamente (n = 98)
| Variable dependiente | Variables independientes | C. Regresióna (IC 95%) | EE | Beta | p | R2 ajustado |
|---|---|---|---|---|---|---|
| Escala visual analógica | Índice BODE (puntuación) Índice ADO (puntuación) |
–3,96 (–5,51- –2,42) –3,53 (–5,57- –1,49) |
0,78 1,03 |
–0,47 –0,36 |
< 0,001 < 0,001 |
0,25 0,16 |
Beta: coeficiente regresión estandarizado; C. regresión: coeficiente de regresión no estandarizado; EE: error estándar; IC 95%: intervalo de confianza 95%; Índice ADO: Age, Dysnea, Airflow obstruction; Índice BODE: Body mass index, Airflow obstruction, Dyspnea, Exercise capacity; R2 ajustado: coeficiente de determinación ajustado.
Ajustado por edad, sexo, tabaquismo activo, exacerbaciones, índice de Charlson, ansiedad/depresión.
Las exacerbaciones (3 dimensiones y la EVA): movilidad, OR: 1,85 (IC 95%: 1,08-3,20); cuidado personal, OR: 2,12 (IC 95%: 1,03-4,76); actividades cotidianas, OR: 2,35 (IC 95%: 1,17-4,71); EVA, coeficiente de regresión: −3,50 (IC 95%: −6,31- −0,70). La disnea (2 dimensiones y la EVA): movilidad, OR: 4,47 (IC 95%: 1,39-14,42); actividades cotidianas, OR: 7,71 (IC 95%: 2,03-12,34); EVA, coeficiente regresión: −7,15 (IC 95%: −11,71- −2,59).
El índice BODE (3 dimensiones y la EVA): movilidad, OR: 1,53 (IC 95%: 1,15-2,02); cuidado personal, OR: 2,08 (IC 95%: 1,40-3,11); actividades cotidianas, OR: 1,97 (IC 95%: 1,38-2,80); EVA, coeficiente de regresión: −3,96 (IC 95%: −5,51- −2,42). El índice ADO (3 dimensiones y la EVA): movilidad, OR: 2,42 (IC 95%: 1,39-4,20); cuidado personal, OR: 3,21 (IC 95%: 1,67-6,18); actividades cotidianas, OR: 3,17 (IC 95%: 1,69-5,93); EVA, coeficiente de regresión: −3,53 (IC 95%: −5,57- −1,49).
Discusión
Las exacerbaciones y la disnea fueron los principales factores individuales que condicionaron las dimensiones del EQ-5D. Otros factores como el FEV1, el tabaquismo activo, el IMC, los antecedentes de ansiedad y/o depresión y el sexo femenino condicionaron solamente una de las 5 dimensiones del EQ-5D. Rutten-van Mölken et al.15 también utilizaron el EQ-5D en la valoración de la CVRS de los pacientes EPOC y encontraron que las exacerbaciones, el FEV1, el género, el IMC y la comorbilidad presentaban una asociación independiente con el EQ-5D.
El papel destacado de la disnea y las exacerbaciones encontrado en nuestro trabajo está en consonancia con otros estudios. La disnea es considerada el factor que presenta mayor relación con la CVRS16, 17. Además, se ha encontrado que las exacerbaciones sucesivas limitan la recuperación de la calidad de vida18.
El FEV1 presentó una pobre asociación con la CVRS ya que solo condicionó una de las dimensiones del EQ-5D (cuidado personal). La mayoría de los estudios ponen de manifiesto una baja relación del FEV1 con respecto a la CVRS y en cambio recalcan la importancia de la disnea en la valoración de la CVRS19.
En nuestro estudio el tabaquismo activo sólo condicionó una dimensión del EQ-5D (actividades cotidianas), pero es destacable que la OR fuera superior a otros factores como la disnea o las exacerbaciones. Algunos estudios previos destacan la influencia negativa del tabaquismo activo en la CVRS20, 21.
Con respecto al IMC solamente presentó asociación con una dimensión (problemas de movilidad). La relación entre el IMC y la CVRS es algo controvertida dado que algunos trabajos apuntan hacia un peor estado de salud en pacientes con bajo peso22, 23 mientras que otros lo relacionan tanto con el bajo peso como con el sobrepeso23, 24. Una de las explicaciones sería que tanto la desnutrición como el sobrepeso se relacionan con peores niveles de disnea y este factor, como se ha constatado antes, es uno de los que contribuye en mayor medida a la CVRS de la EPOC23.
La mayoría de los estudios han observado una peor CVRS en mujeres con EPOC que en hombres22, 25. Nuestros resultados muestran que las mujeres presentaron mayor afectación de la dimensión (dolor/malestar) pero no hubo diferencias en el resto de dimensiones del EQ-5D.
Con respecto a las valoraciones multidimensionales (índice BODE e índice ADO) presentaron una relación estadísticamente significativa con la EVA y 3 de dimensiones del EQ-5D (problemas de movilidad, cuidado personal y actividades cotidianas). Morchón et al.26 también encontraron una buena correlación entre el índice BODE y el EQ-5D. Diversos estudios indican que el índice BODE evalúa mejor el estado de la CVRS de los pacientes EPOC que los criterios de clasificación de severidad basados únicamente en el FEV127, 28. Con respecto al índice ADO y la CVRS no hemos encontrado ninguna referencia en la literatura científica. De todas maneras, las clasificaciones multidimensionales son más complejas de utilizar en atención primaria puesto que consumen mucho más tiempo que otras variables como el FEV1, el interrogatorio de la disnea o del número de exacerbaciones.
Un metaanálisis29 exploró los factores que podrían tener un efecto negativo sobre la CVRS de la EPOC. La disnea fue el factor que presentó una correlación más fuerte con la CVRS. Otros factores como la tolerancia al ejercicio, la ansiedad y la depresión presentaron una correlación alta-moderada mientras que la correlación fue moderada-débil para el FEV1 y las exacerbaciones. El índice BODE presentó una correlación alta-moderada.
Algunas limitaciones pueden haber influido en los resultados de este estudio. Todos los pacientes fueron seleccionados desde atención primaria por lo que los resultados no pueden ser extrapolables a todos los pacientes con EPOC. Además la muestra incluyó una baja representación de pacientes con estadio de severidad leve, probablemente debido al infradiagnóstico de la EPOC, así como de mujeres.
Posteriormente a la inclusión de pacientes en nuestro estudio se desarrolló el COPD Assessment Test (CAT). Sería interesante investigar si ofrece ventajas adicionales, con respecto al EQ-5D, puesto que se trata de un cuestionario breve y sencillo que también valora el impacto de la EPOC en la CVRS de los pacientes30.
Por último, hubiera sido interesante tener en cuenta los fenotipos clínicos de la EPOC. La guía GesEPOC2 propone cuatro fenotipos: a) no agudizador, con enfisema o bronquitis crónica; b) mixto EPOC-asma; c) agudizador con enfisema, y d) agudizador con bronquitis crónica. Cuando se inició el estudio no estaban incluidos en las principales guías de práctica clínica y por ese motivo no se tuvieron en cuenta.
En conclusión, este estudio reafirma el impacto de la EPOC en la CVRS de los pacientes y que tanto la disnea y las exacerbaciones, como factores individuales, o los índices BODE y ADO, como clasificaciones multidimensionales, se relacionan mejor con la CVRS que el grado de severidad de la EPOC valorado por el FEV1. Estos resultados estarían en consonancia con las estrategias actuales en la valoración de los pacientes EPOC, mediante clasificaciones multidimensionales para evaluar la gravedad y el pronóstico de la enfermedad, y podrían apoyar también su utilidad en la valoración de la CVRS.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Footnotes
Institución donde se ha realizado el estudio: Equipo de Atención Primaria Florida Sud. Unitat Docent Multiprofessional d’Atenció Familiar i Comunitària Costa de Ponent. Institut Català de la Salut. L’Hospitalet de Llobregat. Barcelona. España.
Bibliografía
- 1.Ministerio de Sanidad y Política Social. Plan de Calidad para el Sistema Nacional de Salud. Estrategia en EPOC del Sistema Nacional de Salud. Sanidad 2009. Ministerio de Sanidad y Política Social [consultado 4 Mar 2013]. Disponible en: http://www.msc.es/organizacion/sns/planCalidadSNS/docs/EstrategiaEPOCSNS.pdf
- 2.Grupo de Trabajo de GesEPOC Guia de Practica Clinica para el Diagnostico y Tratamiento de Pacientes con Enfermedad Pulmonar Obstructiva Cronica (EPOC) - Guia Española de la EPOC (GesEPOC) Arch Bronconeumol. 2012;48(Supl 1):S2–S58. [Google Scholar]
- 3.Grupo de trabajo de la guía de práctica clínica sobre Atención Integral al paciente con enfermedad pulmonar obstructiva crónica (EPOC). Desde la atención primaria a la especializada. Sociedad Española de Medicina de Familia (semFYC) y Sociedad Española de Neumología y Cirugía Torácica (SEPAR); 2010. [consultado 8 Mar 2013]. Disponible en: http://www.semfyc.es/es/biblioteca/virtual/detalle/Atencion_Integral_Paciente_Epoc/
- 4.Oga T., Nishimura K., Tsukino M., Sato S., Hajiro T. Analysis of the factors related to mortality in chronic obstructive pulmonary disease: Role of exercise capacity and health status. Am J Respir Crit Care Med. 2003;167:544–549. doi: 10.1164/rccm.200206-583OC. [DOI] [PubMed] [Google Scholar]
- 5.Celli B.R., Cote C.G., Marin J.M., Casanova C., Montes de Oca M., Mendez R.A. The body-mass index, airflow obstruction, dyspnea, and exercise capacity index in chronic obstructive pulmonary disease. N Engl J Med. 2004;350:1005–1012. doi: 10.1056/NEJMoa021322. [DOI] [PubMed] [Google Scholar]
- 6.Puhan M.A., Garcia-Aymerich J., Frey M., Ter Riet G., Antó J.M., Agustí A.G. Expansion of the prognostic assessment of patients with chronic obstructive pulmonary disease: the updated BODE index and the ADO index. Lancet. 2009;374:704–711. doi: 10.1016/S0140-6736(09)61301-5. [DOI] [PubMed] [Google Scholar]
- 7.Güell MR, Morante F. Conceptos generales. En: Manual SEPAR de procedimientos. Módulo 12. Herramientas para la medida de la calidad de vida relacionada con la salud. Barcelona: Publicaciones Permanyer; 2007. p. 5-7.
- 8.Martín Escudero J.C. Calidad de vida y EPOC. Rev Clin Esp. 2009;209:59–60. doi: 10.1016/s0014-2565(09)70626-5. [DOI] [PubMed] [Google Scholar]
- 9.Badia X., Roset M., Monserrat S., Herdman M., Segura A. La versión española del EuroQol: descripción y aplicaciones. Med Clin (Barc) 1999;112(Supl 1):S79–S86. [PubMed] [Google Scholar]
- 10.Charlson M.E., Pompei P., Ales K.L., MacKenzie C.R. A new method of classifying prognostic comorbidity in longitudinal studies: Development and validation. J Chronic Dis. 1987;40:373–383. doi: 10.1016/0021-9681(87)90171-8. [DOI] [PubMed] [Google Scholar]
- 11.Casán P., Burgos F., Barberá J.A., Ginés J. Espirometría. In: Puente L., editor. Vol. 5. Luzán; Barcelona: 2002. pp. 4–15. (Manual SEPAR de procedimientos. Módulo 3. Procedimientos de evaluación de la función pulmonar). [Google Scholar]
- 12.Bestall J.C., Paul E.A., Garrod R., Garnham R., Jones P.W., Wedzicha J.A. Usefulness of the Medical Research Council (MRC) dyspnoea scale as a measure of disability in patients with chronic obstructive pulmonary disease. Thorax. 1999;54:581–586. doi: 10.1136/thx.54.7.581. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.American Thoracic Society ATS statement: Guidelines for the six-minute walk test. Am J Respir Crit Care Med. 2002;166:111–117. doi: 10.1164/ajrccm.166.1.at1102. [DOI] [PubMed] [Google Scholar]
- 14.Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2010 [consultado 8 Mar 2013]. Disponible en: http://www.goldcopd.org/
- 15.Rutten-van Mölken M.P., Oostenbrink J.B., Burkhart D.P., Burkhart D., Monz B.U. Does quality of life of COPD patients as measured by the generic EuroQol five-dimension questionnaire differentiate between COPD severity stages? Chest. 2006;130:1117–1128. doi: 10.1378/chest.130.4.1117. [DOI] [PubMed] [Google Scholar]
- 16.Miravitlles M., Molina J., Naberan K., Cots J.M., Ros F., Llor C. EVOCA study. Factors determining the quality of life of patients with COPD in primary care. Ther Adv Respir Dis. 2007;1:85–92. doi: 10.1177/1753465807086097. [DOI] [PubMed] [Google Scholar]
- 17.Jones P.W., Brusselle G., Dal Negro R.W., Ferrer M., Kardos P., Levy M.L. Patient-centred assessment of COPD in primary care: Experience from a cross-sectional study of health-related quality of life in Europe. Prim Care Respir J. 2012;21:329–336. doi: 10.4104/pcrj.2012.00065. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Spencer S., Jones P.W. GLOBE Study Group. Time course of recovery of health status following an infective exacerbation of chronic bronchitis. Thorax. 2003;58:589–593. doi: 10.1136/thorax.58.7.589. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Gonzalez E., Herrejon A., Inchaurraga I., Blanquer R. Determinants of health-related quality of life in patients with pulmonary emphysema. Respir Med. 2005;99:638–644. doi: 10.1016/j.rmed.2004.09.019. [DOI] [PubMed] [Google Scholar]
- 20.Izquierdo J.L., Barcina C., Jiménez J., Muñoz M., Leal M. Study of the burden on patients with chronic obstructive pulmonary disease. Int J Clin Pract. 2009;63:87–97. doi: 10.1111/j.1742-1241.2008.01936.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Wilson D., Parsons J., Wakefied M. The health-related quality-of-life of never smokers, ex smokers, and light, moderate, and heavy smokers. Prev Med. 1999;29:139–144. doi: 10.1006/pmed.1999.0523. [DOI] [PubMed] [Google Scholar]
- 22.Carrasco Garrido P., De Miguel Díez J., Rejas Gutiérrez J., Centeno A.M., Gobartt Vázquez E., Gil de Miguel A. Negative impact of chronic obstructive pulmonary disease on the health-related quality of life of patients. Results of the EPIDEPOC study. Health Qual Life Outcomes. 2006;4:31. doi: 10.1186/1477-7525-4-31. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Shoup R., Dalsky G., Warner S., Davies M., Connors M., Khan M. Body composition and health-related quality of life in patients with obstructive airways disease. Eur Respir J. 1997;10:1576–1580. doi: 10.1183/09031936.97.10071576. [DOI] [PubMed] [Google Scholar]
- 24.Moy M.L., Reilly J.J., Ries A.L., Mosenifar Z., Kaplan R.M., Lew R., National Emphysema Treatment Trial Research Group Multivariate models of determinants of health-related quality of life in severe chronic obstructive pulmonary disease. J Rehabil Res Dev. 2009;46:643–654. doi: 10.1682/JRRD.2008.09.0127. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.De Torres J.P., Casanova C., Hernández C., Abreu J., Montejo de Garcini A., Aguirre-Jaime A. Gender associated differences in determinants of quality of life in patients with COPD: a case series study. Health Qual Life Outcomes. 2006;4:72. doi: 10.1186/1477-7525-4-72. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Morchón-Simón D., Martín-Escudero J.C. Relationship between the BODE index and the EuroQol-5D in patients hospitalized with COPD. Arch Bronconeumol. 2009;45:620–623. doi: 10.1016/j.arbres.2009.03.005. [DOI] [PubMed] [Google Scholar]
- 27.Medinas Amorós M., Mas-Tous C., Renom-Sotorra F., Rubí-Ponseti M., Centeno-Flores M.J., Gorriz-Dolz M.T. Health-related quality of life is associated with COPD severity: A comparison between the GOLD staging and the BODE index. Chron Respir Dis. 2009;6:75–80. doi: 10.1177/1479972308101551. [DOI] [PubMed] [Google Scholar]
- 28.Lin Y.X., Xu W.N., Liang L.R., Pang B.S., Nie X.H., Zhang J. The cross-sectional and longitudinal association of the BODE index with quality of life in patients with chronic obstructive pulmonary disease. Chin Med J (Engl) 2009;122:2939–2944. [PubMed] [Google Scholar]
- 29.Tsiligianni I., Kocks J., Tzanakis N., Siafakas N., Van der Molen T. Factors that influence disease-specific quality of life or health status in patients with COPD: a review and meta-analysis of Pearson correlations. Prim Care Respir J. 2011;20:257–268. doi: 10.4104/pcrj.2011.00029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Jones P.W., Harding G., Berry P., Wiklund I., Chen W.H., Kline Leidy N. Development and first validation of the COPD assessment test. Eur Respir J. 2009;34:648–654. doi: 10.1183/09031936.00102509. [DOI] [PubMed] [Google Scholar]