Resumen
Objetivo
Analizar la prevalencia y severidad de los síntomas de disfunción intestinal inducida por opioides (DIO).
Diseño
Estudio epidemiológico, observacional y transversal.
Emplazamiento
Seis hospitales españoles.
Participantes
Trescientos diecisiete pacientes en régimen ambulatorio con diagnóstico de dolor oncológico o dolor crónico no oncológico tratados con un único opioide mayor.
Mediciones principales
La prevalencia de los síntomas de DIO y su severidad se midió usando una escala visual analógica (EVA: 0-100) y el estreñimiento se valoró también mediante el índice de función intestinal (BFI). Se registró el tratamiento para los síntomas gastrointestinales y se comparó su frecuencia según el tratamiento opioide. Finalmente, se estudió la calidad de vida.
Resultados
La tasa de prevalencia de al menos un trastorno gastrointestinal potencialmente relacionado con la DIO fue del 94,6%, siendo el estreñimiento el síntoma más frecuente (BFI: 91,6%; EVA: 90,2%) y casi la mitad de los pacientes (49,8%) presentaron 3 o más síntomas con un EVA ≥ 4. No se detectaron diferencias significativas en la prevalencia de los síntomas entre los distintos tratamientos opioides. Se detectó una afectación en la calidad de vida de los pacientes relacionada con la presencia de síntomas gastrointestinales de moderada a severa.
Conclusiones
En pacientes con tratamiento opioide se constata una elevada frecuencia de trastornos gastrointestinales posiblemente relacionados con la DIO, lo que subraya la necesidad de nuevas estrategias para su tratamiento.
Palabras clave: Dolor abdominal, Analgésicos, Opioides, Estreñimiento, Prevalencia
Abstract
Objective
To analyze the prevalence and severity of the opioid-induced bowel dysfunction (OBD) symptoms.
Design
Epidemiological, observational and cross-sectional study.
Location
Six Spanish centers participated.
Participants
A total of 317 outpatients with a diagnosis of cancer pain or non-cancer pain treated with a unique opioid were recruited.
Main measurements
The prevalence of OBD symptoms was measured using a visual analog scale (VAS: 0-100), and constipation was also assessed by the Bowel Function Index (BFI). The treatment for gastrointestinal symptoms was recorded, and the frequency of symptoms between different opioid treatments was compared. Finally, quality of life was evaluated.
Results
The prevalence of OBD with at least one gastrointestinal disorder was 94.6%, with constipation being the most frequent symptom (BFI: 91.6%; VAS: 90.2%) and nearly half of the patients showed three or more symptoms with a VAS ≥ 4. No significant differences were detected in the prevalence of symptoms between the opioid groups. A decrease in the wellbeing of patients was detected related to moderate to severe gastrointestinal symptoms.
Conclusions
A high rate of gastrointestinal disorders probably related to OBD have been confirmed in patients on opioid therapy, highlighting the need for new drug strategies.
Keywords: Abdominal pain, Analgesics, Opioids, Constipation, Prevalence
Introducción
Según un estudio realizado en 16 países europeos, uno de cada 5 adultos convive con dolor crónico diariamente1. El tratamiento del dolor, cuando es de origen oncológico, se fundamenta en la utilización adecuada de la escalera de la OMS2. Los opioides conforman la principal estrategia para atajar el dolor de moderado a intenso y también pueden utilizarse en dolor crónico no oncológico, cuando su intensidad lo requiere, evaluando siempre los riesgos asociados al abuso de opiáceos y su adicción3, 4, 5. La morfina por vía oral ha sido el opioide mayor de elección en el tratamiento del dolor oncológico, pero recientes revisiones realizadas por la Asociación Europea de Cuidados Paliativos, incluyendo las recomendaciones de 2012, indican como alternativa la oxicodona e hidromorfona6, 7, mientras que el tratamiento con metadona o fentanilo, si bien ha demostrado similar eficacia y seguridad, se ve limitado por la dificultad en la adecuación de unos niveles plasmáticos estables6. Por su parte, las recomendaciones de la Sociedad Española de Oncología Médica coinciden en que las alternativas eficaces en el tratamiento del dolor oncológico severo son hidromorfona y oxicodona, pudiendo esta última combinarse con naloxona para evitar la aparición de estreñimiento8.
Estas sustancias actúan mediante la unión a receptores opioides, situados mayoritariamente en el sistema nervioso central9, pero también a nivel periférico en el tracto gastrointestinal (GI), cuya activación se traduce en la disminución de la motilidad y la secreción digestivas, causando una complicación habitual conocida como disfunción intestinal provocada por opioides (DIO)10, 11. La DIO se caracteriza por presentar reducción del vaciamiento gástrico, retortijones, hinchazón, dificultad en el tránsito intestinal y endurecimiento excesivo de las heces, siendo el estreñimiento el síntoma más frecuente10, 12, 13. No obstante, dado que los pacientes frecuentemente conviven con otras comorbilidades que pueden igualmente estar asociadas a la aparición de estreñimiento, como alteraciones metabólicas (hipercalcemia, uremia, diabetes), neuropatías de la médula espinal, depresión y disminución en la movilidad, es difícil diferenciar la DIO del estreñimiento ocasionado por otros factores14.
Aunque los laxantes son el tratamiento más habitual para el estreñimiento, y pueden ser de gran utilidad (junto a otras medidas) cuando este está causado por otros orígenes, no siempre logran un alivio óptimo en los pacientes con DIO, al no bloquear el modo de acción de los opioides en el intestino. Su efecto, por el contrario, puede llegar a inducir hinchazón, flatulencia y sensación de distensión abdominal por sí mismos, lo que limita la utilización de esta estrategia12. Debido a la falta de consenso en cuanto al mejor tratamiento para el estreñimiento, en 2008 se elaboraron unas guías en las que se recomendaba aplicar los principios generales de prevención (dieta alimenticia, ejercicio físico, etc.) y, en caso necesario, pautar además un laxante con efecto estimulante al que se le combina un surfactante con el fin de evitar los cólicos producidos por la peristalsis15. En cualquier caso, se debe estudiar bien cada caso y escoger el tipo de laxante de manera individualizada según las características del estreñimiento y del propio paciente15.
Al ser el estreñimiento el efecto más común y debilitante de la DIO, la mayoría de los cálculos sobre prevalencia se basan únicamente en la frecuencia de este síntoma primario12. El objetivo principal de este trabajo es analizar, en un grupo de pacientes con dolor crónico, la prevalencia de los síntomas GI y la DIO potencialmente asociados a la terapia analgésica con un opioide mayor, y su impacto en la calidad de vida, comparando además la frecuencia de los trastornos GI según el opioide.
Pacientes y métodos
Se realizó un estudio epidemiológico, observacional y transversal en 6 hospitales del territorio español, en el que participaron una unidad de cuidados paliativos, 2 servicios de oncología médica y 3 unidades de dolor. El estudio se realizó en la observancia de la legislación española en vigor y bajo los requerimientos expresados en las normas internacionales relativas a la realización de este tipo de estudios, las International Guidelines for Ethical Review of Epidemiological Studies y la Declaración de Helsinki. Todos los participantes en el estudio proporcionaron su consentimiento informado por escrito previamente a la recogida de los datos médicos.
Población de estudio
Se incluyeron en el estudio todos los pacientes que acudieron en régimen ambulatorio entre marzo y junio de 2009 y que cumplían los siguientes criterios de inclusión: edad ≥ 18 años, presentar dolor oncológico, independientemente del tiempo de evolución, o dolor crónico no oncológico de ≥ 3 meses de evolución, y estar en tratamiento de base, en ambos casos, con un único opioide mayor durante un periodo ≥ 1 mes. Se excluyeron los pacientes en tratamiento con opioides menores como analgésico de base, aquellos con diagnóstico de fibromialgia y los pacientes con trastorno psiquiátrico o neurológico que en opinión del investigador pudiera sesgar su participación en el estudio.
A fin de evitar sesgos de inclusión en función del tratamiento de los pacientes, el protocolo del estudio estableció que se incluyeran los 50 primeros pacientes según acudieran a la consulta de los investigadores desde el inicio del periodo de inclusión.
Variables
Se recogieron, en una única visita, los datos demográficos y clínicos referentes a la etiología del dolor, la utilización de tratamientos analgésicos y no analgésicos, así como los antecedentes generales de estreñimiento.
La variable principal de estudio fue la prevalencia de los trastornos GI característicos de la DIO: estreñimiento, problemas al defecar, flatulencia, dolores al defecar, hinchazón, ruidos GI, pérdida de apetito, dolor abdominal, retortijones, náuseas, eructos y vómitos. Estos síntomas se seleccionaron con base en 2 grandes estudios16, 17. Se usó una escala visual analógica (EVA) de 0 a 100, y se tomaron como síntomas moderados aquellos con una puntuación ≥ 40 y como graves los valores ≥ 70. Además, se utilizó el índice de función intestinal (BFI), cuestionario validado que evalúa el estreñimiento inducido por opioides en pacientes oncológicos y no oncológicos18, 19, y que consta de 3 preguntas referidas a los 7 últimos días: a) facilidad de evacuación (de 0, fácil/no difícil, a 100, mucha dificultad); b) sensación de evacuación incompleta (de 0, ninguna en absoluto, a 100, muy intensa); c) juicio personal del paciente respecto al estreñimiento (de 0, ninguno en absoluto, a 100, muy intenso). El índice BFI se obtuvo de la media aritmética de los resultados obtenidos en las 3 preguntas anteriores, considerando que los valores ≤ 30 indican función intestinal normal y que una diferencia ≥ 12 puntos se relaciona con una sintomatología clínicamente relevante19.
Se pidió al paciente y al investigador que evaluasen la relación de los trastornos GI con la medicación opioide mediante un cuestionario de autorrespuesta en una escala de 0 (ninguna relación) a 10 (completamente relacionado). Además, se preguntó sobre la historia previa de estreñimiento y su empeoramiento con el uso de opioides.
La intensidad del dolor se evaluó mediante una escala centesimal (EVA) de 0 a 100 (valores de 1-39: leves; 40-69: moderados; 70-100: graves). La misma escala se utilizó para determinar el impacto de los trastornos GI sobre 6 ítems: estado de ánimo, calidad de vida, actividades de la vida diaria, relaciones sociales, calidad del sueño y trabajo.
Se analizó la posible relación de la presencia de estreñimiento moderado-severo con los siguientes factores: sexo, edad (< 65 y ≥ 65 años), tipo de dolor (oncológico, no oncológico), origen del dolor (mixto, neuropático, somático, visceral), si estaba o no en tratamiento con opioides (mayores o menores) antes del tratamiento actual, presencia de otros trastornos GI, uso de laxantes, duración del dolor (< 12 y ≥ 12 meses), duración del tratamiento actual con el opioide (< 3 y ≥ 3 meses), toma de opioides de rescate, otros tratamientos crónicos concomitantes, presencia de estreñimiento previo a la toma de opioide, puntuación del BFI (≤ 30 y > 30) e impacto de los trastornos GI en la calidad de vida, calidad del sueño, relaciones sociales, estado de ánimo, trabajo y actividades de la vida diaria (EVA ≥ 40).
Análisis estadístico
La descriptiva general de las variables cualitativas se realizó con frecuencias absolutas y relativas, y la de las cuantitativas con la mediana, rango y rango intercuartílico (RIC).
Para el análisis se utilizó el software SPSS Versión 13.0. Las pruebas de hipótesis fueron bilaterales y con un nivel de significación de 0,05. Para las variables que no se ajustaron a la distribución normal se utilizaron las pruebas de Mann-Whitney o de Wilcoxon. En el análisis de tablas de contingencia, así como para la comparación de proporciones y/o distribuciones de frecuencias, se utilizó el test de ji al cuadrado (o el exacto de Fischer cuando procedía).
Esquema general del estudio:
Resultados
Características de los pacientes
Se incluyeron 319 pacientes, 100 en las 2 unidades de oncología médica, 50 en la de cuidados paliativos y 169 en las 3 unidades de dolor. Se excluyeron del análisis 2 pacientes por incumplir al menos un criterio de selección (tomaban 2 opioides mayores como tratamiento de base), por lo que el número total de pacientes evaluables fue 317.
En la tabla 1 se recogen sus características basales. La causa del dolor fue oncológico en un 56,9% de los pacientes, mayoritariamente en neoplasia de pulmón (38,0%) y mama (13,4%), mientras que se registró dolor no oncológico en un 43,1%, mayoritariamente de origen osteomuscular (89,4%), muchas veces asociado a artrosis o artritis (57,1%) y neuropatía (36,8%). El 71,2% de los pacientes estudiados completó su terapia analgésica con un fármaco del primer escalón según recomendaciones de la OMS2, que fue generalmente un antiinflamatorio no esteroideo (AINE) (67,1%) y/o paracetamol (47,4%).
Tabla 1.
Características y manejo terapéutico del dolor
| Total pacientes | 317 |
| Características | |
| Sexo, mujer, N (%) | 167 (52,6) |
| Edad, años, mediana (rango) | 66 (29-93) |
| Tipo de dolor | |
| Tipo, N (%) | 313 (98,7) |
| Oncológico | 178 (56,9) |
| No oncológico | 135 (43,1) |
| Duración, meses | 301 (94,9) |
| ≤ 3 | 53 (17,6) |
| ≤ 6 | 56 (18,6) |
| ≤ 12 | 50 (16,6) |
| ≤ 24 | 44 (14,6) |
| > 24 | 98 (32,6) |
| Tratamiento previo | |
| Tratamiento analgésico anterior | 300 (94,6) |
| Opioides menores | 190 (60,1) |
| Opioides mayores | 110 (38,2) |
| Tratamiento actual | |
| Opioides mayores actualmente | 317 (100) |
| Fentanilo | 158 (49,8) |
| Dosis media ± DE | 55,7 ± 36,8 cada 3 días |
| Oxicodona LC | 107 (33,8) |
| Dosis media ± DE | 23,2 ± 17,0 cada 12 h |
| Morfina LC | 31 (9,8) |
| Dosis media ± DE | 35,2 ± 29,3 cada 12 h |
| Buprenorfina | 13 (4,1) |
| Dosis media ± DE | 38,8 ± 17,0 cada 3 días |
| Otros | 8 (2,5) |
| Coadyuvante | 205 (67,0) |
| Anticonvulsionantes | 141 (71,9) |
| Antidepresivos tricíclicos | 67 (34,2) |
| Benzodiazepinas | 96 (49,0) |
| Otros | 33 (16,8) |
| Opioide de rescate | 126 (40,4) |
| Oxicodona | 49 (38,9) |
| Morfina | 39 (31,0) |
| Fentanilo | 34 (27,0) |
Manejo del estreñimiento
Según la anamnesis, el 58,5% de los pacientes habían presentado estreñimiento antes de tomar el opioide y, de estos, 7 de cada 10 (71,6%) reportaron un empeoramiento del mismo tras iniciar la terapia opioide (tabla 2). La frecuencia de estreñimiento fue del 90,2% según la EVA y del 91,6% según el BFI.
Tabla 2.
Datos sobre el estreñimiento y manejo terapéutico de los trastornos gastrointestinales, N (%)
| Estreñimiento antes del opioide | 185 (58,5) |
| Empeoramiento del estreñimiento tras el opioide | 131 (71,6) |
| Estreñimiento | |
| EVA cualquier grado | 90,2% |
| BFI >30 | 91,6% |
| Duración, meses | |
| < 1 | 6 (2,0) |
| 1-3 | 81 (27,5) |
| 3-6 | 41 (13,9) |
| 6-12 | 34 (11,5) |
| > 12 | 94 (31,9) |
| Laxantes | 229 (72,2) |
| Frecuencia | |
| Diariamente | 158 (70,2) |
| ≥2 veces/semana | 23 (10,2) |
| < 2 veces/semana | 10 (4,4) |
| Esporádicamente | 34 (15,1) |
| Tipo de laxante | |
| Lactulosa | 78 (34,1) |
| Lactitol | 51 (22,3) |
| Plantago ovata | 35 (15,3) |
| Bisacodilo | 11 (4,8) |
| Picosulfato | 22 (9,6) |
| Macrogol | 18 (7,9) |
| Glicerol | 17 (7,4) |
| Senósido | 15 (6,6) |
| Sulfato de magnesio | 15 (6,6) |
| Parafina/picosulfato | 8 (3,5) |
| Otros laxantes | 16 (7,0) |
| Combinación de laxantes | |
| 1 laxante | 179 (78,2) |
| 2 laxantes | 46 (20,1) |
| 3 laxantes o más | 4 (1,7) |
| Enemas | 71 (22,7) |
| Frecuencia | |
| Diariamente | 6 (8,5) |
| ≥ 2 veces por semana | 8 (11,3) |
| < 2 veces por semana | 12 (16,9) |
| Esporádicamente | 45 (63,4) |
| Antieméticos | 90 (28,5) |
| Frecuencia | |
| Diariamente | 33 (37,5) |
| ≥ 2 veces por semana | 9 (10,2) |
| < 2 veces por semana | 8 (9,1) |
| Esporádicamente | 38 (43,2) |
| Combinación de terapias | 116 (36,5) |
| Laxante + antiemético | 48 (15,1) |
| Laxante + enema | 41 (12,9) |
| Laxante + enema + antiemético | 27 (8,5) |
La información sobre los antecedentes de estreñimiento se recogió de la anamnesis e historia clínica del paciente.
El uso de laxantes y enemas estaba muy extendido entre los pacientes evaluados (72,2 y 22,7%, respectivamente) y, de éstos, el 20,1% tomaban una combinación de 2 laxantes (tabla 2).
Prevalencia de los trastornos gastrointestinales
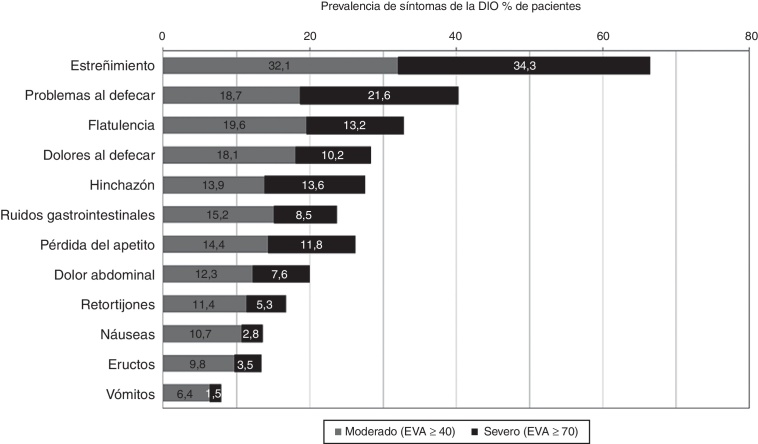
En general, el 94,6% de los pacientes sufrieron al menos un trastorno GI de cualquier grado potencialmente relacionado con la terapia con opioides, y la mitad (49,8%) comunicaron 3 o más síntomas con intensidad moderada o severa. Los más prevalentes (fig. 1) fueron estreñimiento (66,4%), problemas al defecar (40,3%) y flatulencia (32,8%), que se consideraron severos en más del 10% de la población en estudio.
Figura 1.
Tasa de prevalencia de los síntomas moderados (EVA ≥ 40) y severos (EVA ≥ 70) más frecuentes derivados de la DIO en los pacientes del estudio.
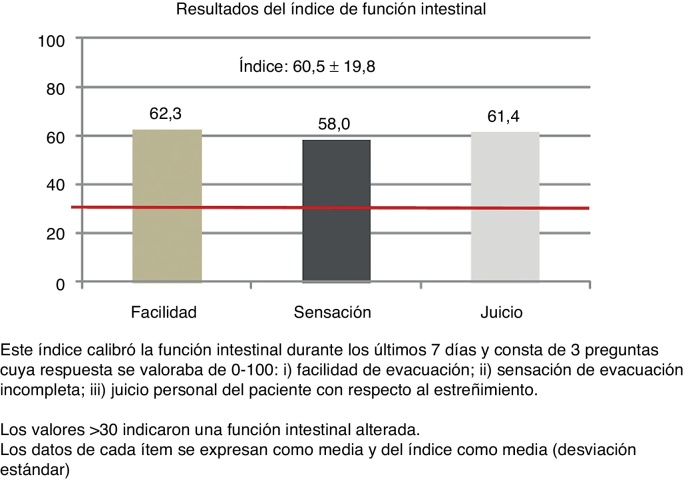
El 52,4% de los pacientes completaron el cuestionario BFI y, de ellos, el 91,6% obtuvieron valores > 30 (media: 60,5; desviación estándar: 19,8; mediana: 63,3; RIC: 43,3-76,6) (fig. 2).
Figura 2.
Resultados del índice de disfunción intestinal (BFI).
Los trastornos GI moderados estuvieron presentes en más del 25% de los pacientes, aunque no hubo diferencias significativas entre los principales opioides utilizados.
En la valoración del paciente y el investigador en cuanto a la causalidad de los trastornos GI, el 85,7 y el 88,4%, respectivamente, consideró que había alguna relación con el agente opioide administrado, y en un 47,0 y 54,5%, respectivamente, que era muy marcada (puntuación ≥ 7).
Intensidad de dolor e impacto de los trastornos gastrointestinales en la calidad de vida
En general, la intensidad del dolor fue moderada, situándose en una mediana de 50 (RIC: 30-70), con una mediana de duración de 12,0 meses (RIC: 4,2-36,0).
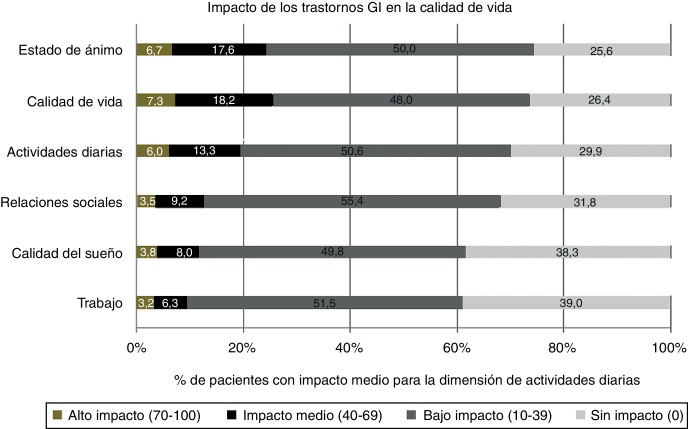
Se observó un impacto negativo de los trastornos GI en las dimensiones de calidad de vida y estado de ánimo, con índices ≥ 40 en el 25,5 y el 24,3% de los pacientes, respectivamente (fig. 3). Los pacientes que reportaron trastornos GI moderados reflejaron un detrimento de moderado a severo en su bienestar, especialmente sobre los aspectos de calidad de vida, estado de ánimo y actividades de la vida diaria.
Figura 3.
Dimensiones de la calidad de vida según su impacto en los pacientes, evaluado en una escala centesimal donde 0 indica ausencia y 100, intensidad extrema.
Factores asociados a los trastornos gastrointestinales
Los pacientes con dolor no oncológico presentaron mayor estreñimiento moderado-severo (p < 0,05), al igual que los pacientes en tratamiento previo con opioides mayores y/o menores, los que estaban en tratamiento con laxantes y con otros trastornos GI (p < 0,05). El empeoramiento en algunas categorías de la calidad de vida, como relaciones sociales, estado de ánimo, trabajo o actividades de la vida diaria fueron factores relacionados con la aparición de estreñimiento.
El análisis multivariante reveló que los factores asociados a una mayor presencia de estreñimiento eran: impacto de los trastornos GI en la calidad de vida (odds ratio [OR]: 2,99; p < 0,05), otros trastornos GI (OR: 6,38; p < 0,001) y toma de laxantes (OR: 9,5; p < 0,001). Los factores asociados a una mayor presencia de trastornos GI moderados-severos fueron: dolor durante 12 meses o más (OR: 3,26; p < 0,005), tratamiento con laxantes (OR: 6,43; p < 0,001), y afectación de la calidad de vida (OR: 19,55; p < 0,005).
Discusión
El presente trabajo analiza la prevalencia de los trastornos derivados de la DIO en pacientes con dolor moderado-severo en tratamiento con un único opioide, seleccionando los síntomas GI definidos en 2 grandes estudios16, 17 y que son objetivo de valoración en otros trabajos9, 11, 12. Asignar la causalidad de estos trastornos al uso de opioides es complicado, ya que estos pacientes habitualmente conviven con otras enfermedades, están polimedicados y frecuentemente presentan dificultades de movilidad, o están cercanos a la muerte14, por lo que el estreñimiento y, en general, los síntomas GI estudiados podrían no ser secundarios selectivamente a la DIO.
Si bien las investigaciones sobre el mecanismo de acción de los opioides ha dado lugar a la caracterización de 3 tipos de receptores opioides (mu, delta y kappa) responsables de la acción periférica y central de estos fármacos, el receptor mu se considera el responsable de la inhibición de la motilidad intestinal10. No obstante, incluso con la dificultad a la hora de interpretar la causalidad de estos trastornos, consideramos que es importante cuantificar el impacto de la DIO en los pacientes con dolor crónico, ya que permitirá entender las dimensiones del problema y mejorar así su manejo clínico.
La identificación de los síntomas GI es complicada desde el punto de vista clínico ya que a menudo la experiencia del paciente puede diferir con respecto a la percepción que el médico obtiene a través del criterio de menos de 3 movimientos intestinales por semana13. El paciente puede experimentar sensación de presentar estreñimiento cuando presenta dificultad a la hora de defecar o endurecimiento de las heces. Por eso es importante aplicar métodos sencillos de diagnóstico en los que sea el propio paciente quien haga una valoración subjetiva15. En nuestro estudio, se utilizó una EVA que, según la Asociación Europea de Cuidados Paliativos, es una de las 4 escalas más ampliamente utilizada en la evaluación del estreñimiento15, aunque algunos pacientes podrían tener dificultades a la hora de utilizar una escala numérica20. Al no ser una escala validada, se utilizó también el índice BFI, que se aplica de forma sencilla y rápida junto al facultativo, mediante preguntas cerradas que facilitan la comprensión de los pacientes; lo que podría ser una ventaja respecto a otras escalas disponibles. Nuestros datos pusieron en evidencia una buena correlación entre ellas a la hora de identificar este trastorno.
Cerca del 95% de la población estudiada había presentado al menos un síntoma GI y el 66% sufría estreñimiento moderado-severo. Una encuesta realizada en España y otros 5 países de nuestro entorno en 322 pacientes en tratamiento con un opioide oral de base, reveló que el 98% sufrían al menos un trastorno GI, siendo el más común el estreñimiento (81%) y en muchos casos severo (48%)16. En general, los resultados disponibles en la bibliografía en relación con la prevalencia de DIO son muy variables, incluso cuando se estudian individualmente los pacientes con dolor oncológico y no oncológico. El estreñimiento en los pacientes con dolor no oncológico presenta un rango que varía entre el 15 y el 90%21, 22, 23, y en los pacientes oncológicos entre el 23 y el 63%24, 25. Esta variabilidad podría estar relacionada con la metodología de cada estudio y las características de la población y del tratamiento aplicado, aunque en nuestro trabajo no se detectaron diferencias significativas en relación con el tipo de opioide usado. Sí se observó una tendencia a la disminución de trastornos GI en el grupo de oxicodona, similar al obtenido por Rosti et al. para el estreñimiento26.
En la literatura especializada se encuentran datos mayoritariamente sobre estreñimiento y escasa información acerca de otros trastornos GI. En el presente análisis, además del estreñimiento, se detectó una incidencia clínicamente relevante de problemas al defecar (40,3%) y flatulencia (32,8%) y de otros síntomas con prevalencias entre el 10 y el 30%. Bell et al. obtuvo resultados similares, con una frecuencia de problemas al defecar del 58%, de flatulencia del 34% o de hinchazón del 33%16. En una encuesta vía correo electrónico realizada en 2.913 sujetos, se estudió la incidencia de un abanico amplio de síntomas (acidez 17%, regurgitación 17%, náuseas 10%, hinchazón 35%, estreñimiento 6-35%, diarrea 8-40% o dolor abdominal 4-50%), aunque estos datos en realidad provienen de una muestra muy pequeña (n = 52), que eran los sujetos que declararon estar en tratamiento crónico con opioides27. Otros datos disponibles sobre náuseas o dolor abdominal describen una prevalencia del 11 y 13%, respectivamente, similares a nuestros resultados28.
La valoración del paciente y el investigador en cuanto a la causalidad mostró una elevada relación entre el uso de opioides y los trastornos GI (85,7 y el 88,4%, respectivamente). De la anamnesis obtuvimos que el 41,5% de los pacientes en estudio no presentaba estreñimiento antes de la terapia con el opioide y, del 58,5% de los pacientes en estudio que presentaba estreñimiento antes de la terapia con el opioide, el 71,6% refirió haber empeorado tras su uso. Somos conscientes de que incluso con estas determinaciones es difícil asegurar la etiología de estos trastornos, aunque sí nos acerca a la autopercepción que el paciente tiene de la relación de los trastornos GI con su tratamiento de opioides.
Aunque el objetivo de uso de los opioides es mejorar la calidad de vida de los pacientes, los efectos secundarios asociados a esta medicación limitan a veces su beneficio13, por lo que es importante minimizar la probabilidad de que estos ocurran. De hecho, el 60-75% de los pacientes de este estudio reportaron algún grado de impacto negativo de los efectos GI en aspectos como el trabajo, calidad del sueño, relaciones sociales, actividades diarias y, sobre todo, en la calidad de vida y estado de ánimo generales, porcentaje similar al observado en la bibliografía16.
Las náuseas y vómitos son los principales efectos adversos al inicio del tratamiento con opioides, sin embargo, el estreñimiento destaca como el motivo más frecuente de abandono del tratamiento a largo plazo29. La aparición de acontecimientos adversos puede ser motivo de rotación del opioide30. Se ha publicado que solo el 46% de los pacientes tratados con opioides consideraba satisfactorio el resultado con laxantes durante la mitad de las veces que los usó12. En nuestro estudio, pese al alto porcentaje de pacientes en tratamiento laxante (72%), su efectividad fue baja, con una tasa con algún grado de estreñimiento del 90%, aunque cabe destacar que solamente un 20% tomaban combinaciones de laxantes tal y como recomiendan las guías15. Además, el hecho de que esta sintomatología tenga una etiología multifactorial podría también estar relacionado con el fracaso de los laxantes. En una encuesta a más de 2.000 pacientes en tratamiento con opioides, el 57% declaró haber presentado estreñimiento al menos una vez, y el 84% usaba laxantes con o sin prescripción médica27.
Los pacientes de nuestro estudio presentaron estreñimiento durante los 12 meses de duración media del tratamiento con el opioide, lo que apoyaría el hecho de que este síntoma no desarrolla tolerancia con el tiempo13, lo que podría hacerse extensible a otros trastornos GI asociados a la DIO. Los análisis multivariantes demostraron una asociación positiva entre la presencia de estreñimiento y otros trastornos GI, el uso de laxantes y el empeoramiento en la calidad de vida. Por ello, el riesgo de presentar estreñimiento parece depender de la presencia de otros síntomas GI, y estos, a su vez, dependen de la duración del dolor, siendo más probable en los pacientes con dolor crónico de 12 meses de duración o más.
En resumen, nuestros resultados aportan información adicional que respalda la evidencia descrita en la bibliografía sobre el uso de opioides y su relación con la presencia o empeoramiento de algunos síntomas GI negativos. No obstante, los profesionales de la salud habitualmente subestiman e infravaloran el impacto de la DIO en estos pacientes24, 29. En la actualidad, existen nuevos agentes comercializados, como oxicodona/naloxona y metilnaltrexona, que son antagonistas de los receptores opioides con acción periférica, lo que focaliza su acción en la etiología de la DIO y no como paliativo de los síntomas.
La alta frecuencia de estreñimiento y alteraciones del tracto GI, unida a la escasa investigación disponible sobre la eficacia y seguridad de los distintos laxantes en este tipo de pacientes, hace indispensable que los especialistas individualicen las terapias según las necesidades particulares de cada paciente y sigan las recomendaciones disponibles sobre el manejo sintomático de la DIO. Todo ello, con el fin de mejorar la calidad de vida de los pacientes.
Lo conocido sobre el tema
-
•
Gran prevalencia de estreñimiento en pacientes con dolor crónico.
-
•
Frecuente uso de laxantes para combatir el estreñimiento.
-
•
Los opioides se administran con el fin de mejorar la calidad de vida de los pacientes con dolor crónico.
Qué aporta este estudio
-
•
Existen, además, otro síntomas GI potencialmente relacionados con la DIO muy prevalentes (problemas al defecar, flatulencias, etc.).
-
•
A pesar de ello, existe una alta prevalencia de estreñimiento en los pacientes en tratamiento con laxantes y solo el 20% recibió una combinación de 2 laxantes.
-
•
Los trastornos asociados a la DIO pueden afectar de forma significativa en su calidad de vida.
Financiación
El presente trabajo ha sido financiado por Mundipharma Pharmaceuticals S.L.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Los autores quieren agradecer a Pilar Frontelo e Irantzu Izco-Basurko su colaboración en la redacción científica del presente artículo. También a Beatriz Roldán por la realización del análisis estadístico y a Mundipharma Pharmaceuticals S.L. por la financiación de este trabajo.
Footnotes
Este trabajo se ha presentado en el VIII Congreso de la Sociedad Española del Dolor y IX Reunión Ibero-Americana, así como en el 6.o Congreso de la European Association for Palliative Care en 2010.
Bibliografía
- 1.Breivik H., Collett B., Ventafridda V., Cohen R., Gallacher D. Survey of chronic pain in Europe: Prevalence, impact on daily life, and treatment. Eur J Pain. 2006;10:287–333. doi: 10.1016/j.ejpain.2005.06.009. [DOI] [PubMed] [Google Scholar]
- 2.Organización Mundial de la Salud (OMS), 1996. Documento de Ginebra. 2.a ed. Alivio del dolor en el cáncer [consultado 3 Dic 2012]. Disponible en: http://whqlibdoc.who.int/publications/9243544829.pdf
- 3.Ballantyne J.C., Mao J. Opioid therapy for chronic pain. N Engl J Med. 2003;349:1943–1953. doi: 10.1056/NEJMra025411. [DOI] [PubMed] [Google Scholar]
- 4.Colvin L., Forbes K., Fallon M. Difficult pain. BMJ. 2006;332:1081–1083. doi: 10.1136/bmj.332.7549.1081. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Chou R., Fanciullo G.J., Fine P.G., Adler J.A., Ballantyne J.C., Davies P. Clinical guidelines for the use of chronic opioid therapy in chronic noncancer pain. J Pain. 2009;10:113–130. doi: 10.1016/j.jpain.2008.10.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Caraceni A., Pigni A., Brunelli C. Is oral morphine still the first choice opioid for moderate to severe cancer pain?. A systematic review within the European Palliative Care Research Collaborative guidelines project. Palliat Med. 2011;25:402–409. doi: 10.1177/0269216310392102. [DOI] [PubMed] [Google Scholar]
- 7.Caraceni A., Hanks G., Kaasa S., Bennett M.I., Brunelli C., Cherny N. Use of opioid analgesics in the treatment of cancer pain: Evidence-based recommendations from the EAPC. Lancet Oncol. 2012;13:58–68. doi: 10.1016/S1470-2045(12)70040-2. [DOI] [PubMed] [Google Scholar]
- 8.Virizuela J.A., Escobar Y., Cassinello J., Borrega P. Treatment of cancer pain: Spanish Society of Medical Oncology (SEOM) recommendations for clinical practice. Clin Transl Oncol. 2012;14:499–504. doi: 10.1007/s12094-012-0831-1. [DOI] [PubMed] [Google Scholar]
- 9.Warfield C., Bajwa Z. McGraw-Hill; New York: 2004. Principles and practice of pain medicine. [Google Scholar]
- 10.Kurz A., Sessler D.I. Opioid-induced bowel dysfunction: Pathophysiology and potential new therapies. Drugs. 2003;63:649–671. doi: 10.2165/00003495-200363070-00003. [DOI] [PubMed] [Google Scholar]
- 11.Coluzzi F., Pappagallo M. Opioid therapy for chronic noncancer pain: Practice guidelines for initiation and maintenance of therapy. Minerva Anestesiol. 2005;71(7-8):425–433. [PubMed] [Google Scholar]
- 12.Pappagallo M. Incidence, prevalence, and management of opioid bowel dysfunction. Am J Surg. 2001;182(5 A Suppl):S11–S18. doi: 10.1016/s0002-9610(01)00782-6. [DOI] [PubMed] [Google Scholar]
- 13.Panchal S.J., Müller-Schwefe P., Wurzelmann J.I. Opioid-induced bowel dysfunction: Prevalence, pathophysiology and burden. Int J Clin Pract. 2007;61:1181–1187. doi: 10.1111/j.1742-1241.2007.01415.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Davis M.P. Cancer constipation: are opioids really the culprit? Support Care Cancer. 2008;16:427–429. doi: 10.1007/s00520-007-0386-9. [DOI] [PubMed] [Google Scholar]
- 15.Larkin P.J., Sykes N.P., Centeno C., Ellershaw J.E., Elsner F., Eugene B. The management of constipation in palliative care: Clinical practice recommendations. Palliat Med. 2008;22:796–807. doi: 10.1177/0269216308096908. [DOI] [PubMed] [Google Scholar]
- 16.Bell T.J., Panch al S.J., Miaskowski C., Bolge S.C., Milanova T., Williamson R. The prevalence, severity, and impact of opioid-induced bowel dysfunction: Results of a US and European Patient Survey (PROBE 1) Pain Med. 2009;10:35–42. doi: 10.1111/j.1526-4637.2008.00495.x. [DOI] [PubMed] [Google Scholar]
- 17.Uberall M.A., Mueller-Schwefe G. Opioid-induced constipation - A frequent and distressing side effect in daily practice affecting oral and transdermal opioid applications. Eur J Pain. 2006;10(Suppl 1):S172. [Google Scholar]
- 18.Rentz A.M., van Hanswijck de Jonge P., Leyendecker P., Hopp M. Observational, nonintervention, multicenter study for validation of the Bowel Function Index for constipation in European countries. Curr Med Res Opin. 2011;27:35–44. doi: 10.1185/03007995.2010.535270. [DOI] [PubMed] [Google Scholar]
- 19.Ducrotté P., Caussé C. The Bowel Function Index: A new validated scale for assessing opioid-induced constipation. Curr Med Res Opin. 2012;28:457–466. doi: 10.1185/03007995.2012.657301. [DOI] [PubMed] [Google Scholar]
- 20.Huskisson E.C. Measurement of pain. Lancet. 1974;2:1127–1131. doi: 10.1016/s0140-6736(74)90884-8. [DOI] [PubMed] [Google Scholar]
- 21.Kalso E., Edwards J.E., Moore R.A., McQuay H.J. Opioids in chronic non-cancer pain: Systematic review of efficacy and safety. Pain. 2004;112:372–380. doi: 10.1016/j.pain.2004.09.019. [DOI] [PubMed] [Google Scholar]
- 22.Moore R.A., McQuay H.J. Prevalence of opioid adverse events in chronic non-malignant pain: Systematic review of randomised trials of oral opioids. Arthritis Res Ther. 2005;7:R1046–R1051. doi: 10.1186/ar1782. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Allan L., Hays H., Jensen N.H., de Waroux B.L., Bolt M., Donald R. Randomised crossover trial of transdermal fentanyl and sustained release oral morphine for treating chronic non-cancer pain. BMJ. 2001;322:1154–1158. doi: 10.1136/bmj.322.7295.1154. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.McMillan S.C. Assessing and managing opiate-induced constipation in adults with cancer. Cancer Control. 2004;11:3–9. doi: 10.1177/10732748040110S302. [DOI] [PubMed] [Google Scholar]
- 25.Meuser T., Pietruck C., Radbruch L., Stute P., Lehmann K.A., Grond S. Symptoms during cancer pain treatment following WHO-guidelines: a longitudinal follow-up study of symptom prevalence, severity and etiology. J Pain. 2001;93:247–257. doi: 10.1016/S0304-3959(01)00324-4. [DOI] [PubMed] [Google Scholar]
- 26.Rosti G., Gatti A., Costantini A., Sabato A.F., Zucco F. Opioid-related bowel dysfunction: prevalence and identification of predictive factors in a large sample of Italian patients on chronic treatment. Eur Rev Med Pharmacol Sci. 2010;14:1045–1050. [PubMed] [Google Scholar]
- 27.Choung R.S., Locke G.R., 3rd, Zinsmeister A.R., Schleck C.D., Talley N.J. Opioid bowel dysfunction and narcotic bowel syndrome: A population-based study. Am J Gastroenterol. 2009;104:1199–1204. doi: 10.1038/ajg.2009.71. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Cook S.F., Lanza L., Zhou X., Sweeney C.T., Goss D., Hollis K. Gastrointestinal side effects in chronic opioid users: Results from a population-based survey. Aliment Pharmacol Ther. 2008;27:1224–1232. doi: 10.1111/j.1365-2036.2008.03689.x. [DOI] [PubMed] [Google Scholar]
- 29.Thorpe D.M. Management of opioid-induced constipation. Curr Pain Headache Rep. 2001;5:237–240. doi: 10.1007/s11916-001-0037-7. [DOI] [PubMed] [Google Scholar]
- 30.Cherny N., Ripamonti C., Pereira J., Davis C., Fallon M., McQuay H. Strategies to manage the adverse effects of oral morphine: An evidence-based report. J Clin Oncol. 2001;19:2542–2554. doi: 10.1200/JCO.2001.19.9.2542. [DOI] [PubMed] [Google Scholar]