RESUMEN
Objetivos
Analizar los factores predictivos de bacteriemia en los pacientes atendidos en el servicio de urgencias (SU) por un episodio de infección.
Pacientes y métodos
Estudio observacional, retrospectivo, descriptivo y analítico de todos los hemocultivos extraídos en un SU en los pacientes adultos (≥ 18 años) atendidos por infección desde el 1-1-2018 hasta el 1-7-2018. Se realizó seguimiento durante 30 días. Se analizaron 38 variables independientes (epidemiológicas, de comorbilidad, funcionales, clínicas y analíticas) que pudieran predecir la existencia de bacteriemia. Se realizó un estudio univariado y multivariante mediante regresión logística.
Resultados
Se incluyeron 1.425 episodios de hemocultivos extraídos. De ellos se consideraron como bacteriemias verdaderas 179 (12,6 %) y como HC negativos 1.246 (87,4 %). Entre los negativos, 1.130 (79,3%) no tuvieron crecimiento y 116 (8,1%) se consideraron contaminados. Cinco variables se asociaron de forma significativa como predictoras de bacteriemia verdadera: procalcitonina (PCT) sérica ≥ 0,51 ng/ml [odds ratio (OR): 4,52; intervalo de confianza (IC) al 95%: 4,20-4,84; p <0,001], temperatura > 38,3°C [OR: 1,60; IC al 95%: 1,29-1,90; p <0,001], presión arterial sistólica (PAS) < 100 mmHg [OR: 3,68; IC al 95%: 2,78-4,58; p <0,001], shock séptico [OR: 2,96; IC al 95%: 1,78-4,13; p <0,001] y la existencia de neoplasia [OR: 1,73; IC al 95%: 1,27-2,20; p <0,001].
Conclusiones
. Existen varios factores disponibles tras una primera valoración en el SU, entre ellos la PCT sérica, la temperatura, la hipotensión con/sin criterios de shock séptico y la existencia de neoplasia, que predicen la existencia de bacteriemia verdadera.
Palabras clave: Servicio de Urgencias, Bacteriemia, Hemocultivos, Biomarcadores, Procalcitonina, Proteína C Reactiva, Factores predictores
ABSTRACT
Objectives
The aim of the study was to analyze predictive factors of bacteraemia in patients seen in the emergency department (ED) for an episode of infectious disease.
Patients and methods
Observational, retrospective and descriptive analytical study of all blood cultures extracted in an ED in adult patients (≥ 18 years) seen in ED due to infectious disease from 1-1-2019 to 1-7-2019. The follow-up was carried out during 30 days. Thirty-eight variables for predicting bacteraemia were assessed. They covered epidemiological, comorbidity, functional, clinical and analytical factors. Univariate and multivariate logistic regression analysis was performed.
Results
A total of 1,425 blood cultures were finally enrolled in the study. Of those were considered true bacteremia 179 (12.6 %) and as negative blood cultures 1,246 (87.4 %). Amongst negatives, 1,130 (79.3%) without growth and 116 (8.1%) as contaminants blood cultures. Five variables were significantly associated with true bacteraemia: serum procalcitonin (PCT) ≥ 0.51 ng/ml [odds ratio (OR): 4.52; 95% confidence interval (CI): 4.20-4.84, P <.001], temperature > 38.3°C [OR:1.60; 95% CI:1.29-1.90, P <.001], systolic blood pressure (SBP) < 100 mmHg [OR:3.68; 95% CI:2.78-4.58, P <.001], septic shock [OR:2.96; 95% CI:1.78-4.13, P <.001] and malignancy [OR:1.73; 95% CI:1.27-2.20, P <.001].
Conclusions
Several factors evaluated in an initial assessment in the ED, including serum PCT, temperature, hypotension (with/without septic shock) and being malignancy, were found to predict true bacteraemia.
Keywords: Emergency Department, Bacteraemia, Blood cultures, Biomarkers, Procalcitonin, C-reactive protein, Predictive factors
INTRODUCCIÓN
Alrededor del 15% de los pacientes que se atienden en los servicios de urgencias (SU) son diagnosticados de un proceso infeccioso. En su valoración se obtienen muestras para estudios microbiológicos en el 43% de éstos, donde predomina la extracción de hemocultivos (HC) que se lleva a cabo en el 14,6% de los pacientes con infección [1].
Se define como bacteriemia la presencia de bacterias en la sangre que se pone de manifiesto por el aislamiento de éstas en los HC [2]. A pesar de las nuevas técnicas de detección rápida (del ADN del patógeno o por aplicación de espectrometría de masas), los HC permiten el diagnóstico etiológico de la infección, aportan información sobre la sensibilidad del microorganismo aislado y favorecen la optimización del tratamiento antimicrobiano [2-5].
La rentabilidad diagnóstica de los HC obtenidos en los SU es muy variable (2-20%) [3], mientras que los considerados “HC contaminantes”, aunque sería deseable que fuesen menos del 3% [2,3], en realidad pueden alcanzar tasas muy superiores [6, 7]. Además, los HC con aislamiento significativo de los pacientes que son dados de alta (la llamada bacteriemia oculta) suponen del 3-5% de los extraídos en el SU [3, 8]. Estos hechos representan verdaderos problemas, al conllevar un incremento de las pruebas diagnósticas realizadas, de la estancia hospitalaria, de los costes y la administración de tratamientos antibióticos innecesarios o, en su caso, altas improcedentes en los casos de “bacteriemias ocultas” [2, 3, 9, 11].
La incidencia de bacteriemia comunitaria ha aumentado hasta 1-2/1.000 atenciones en los SU y a 6-10 episodios/1.000 ingresos hospitalarios desde dicho servicio [3, 12]. La etiología se debe a bacterias grampositivas en un 30-35%, gramnegativas en un 65-70% y anaerobios sobre el 1% [3, 6, 7, 12]. Esta proporción puede cambiar, si la incidencia de HC contaminantes fuera excesiva, a favor de las grampositivas [7]. En relación a las bacteriemias verdaderas (BV) o significativas, en cuanto al foco, la infección del tracto urinario con el 45-55% y el foco respiratorio (10-25%) son los más frecuentes. Mientras que la bacteriemia con foco desconocido se sitúa alrededor del 10% en el SU [3, 6, 7, 12]. De forma global, las bacterias aisladas con mayor frecuencia son Escherichia coli, Staphylococcus aureus y Streptococcus pneumoniae [3, 7, 12].
La mortalidad a los 30 días de los pacientes con HC positivos se ha cifrado entre 10-25% [3]. Ésta, se relaciona con la gravedad de la situación clínica (existencia de sepsis-shock séptico), el foco primario y las características de los pacientes (edad, comorbilidad, etc.) [3, 10-13].
Por todo ello, es muy importante la sospecha y confirmación de la BV, ya que ésta tiene un relevante significado diagnóstico, pronóstico y obligaría a cambiar algunas de las decisiones más importantes a tomar en el SU. Entre otras, indicar el alta o ingreso, extraer HC, administrar el antimicrobiano adecuado y precoz, etc. [1, 13]. En este sentido, conocer los factores predictivos de BV identificables en los SU que ayuden a evitar altas improcedentes e ingresos innecesarios, y sus consecuencias, se ha convertido en el objetivo de muchos autores [14, 17], que incluyen en sus estudios distintas variables clínicas, epidemiológicas y analíticas. Y, entre estas últimas, los biomarcadores de respuesta inflamatoria e infección (BMRII), ya que se ha demostrado que aumentan significativamente el rendimiento diagnóstico de los modelos predictivos propuestos inicialmente [18-21].
El objetivo de este estudio fue determinar qué factores identificables, de los que habitualmente son utilizados en la primera valoración en el SU, se relacionan con la predicción de bacteriemia en los HC extraídos en los pacientes atendidos por infección.
PACIENTES Y MÉTODOS
Diseño y sitio del estudio. Estudio observacional, retrospectivo, descriptivo y analítico de todos los HC extraídos en un SU de los pacientes adultos (≥18 años) atendidos por algún proceso infeccioso y que tras un seguimiento durante 30 días mantuvieron el diagnóstico de infección. Se realizó en un Hospital Universitario de tercer nivel de 786 camas perteneciente al Servicio de Salud de Castilla La Mancha (SESCAM).
Periodos del estudio y población incluida. Desde el 1 de enero de 2018 al 1 de julio de 2018 se incluyeron de forma consecutiva todos aquellos HC de pacientes diagnosticados clínicamente de un proceso infeccioso en el SU en los que también se habían registrado los signos vitales y muestras de analítica para realizar hemograma, bioquímica básica y BMRII [procalcitonina (PCT) y proteína C reactiva (PCR)]. Se excluyeron los pacientes de pediatría y de obstetricia-ginecología. La indicación de la solicitud de HC se llevó a cabo según el criterio del médico responsable.
Definiciones, técnicas y métodos establecidos para las muestras. La extracción de los HC se realizó por la técnica estándar por venopunción percutánea. En cada paciente se realizaron dos extracciones separadas entre sí en el tiempo (y asegurando que los sitios de venopunción eran diferentes). En el caso de sospecha de endocarditis se obtuvieron 3 parejas de HC. Por cada extracción (HC) se inocularon dos botellas (BD BACTEC®): una al medio aerobio y otra al anaerobio. Los HC se transportaron manualmente al servicio de microbiología para su procesamiento inmediato con el sistema automático de lectura Bactec/Alert® (BioMérieux, Durham, NC, EE.UU). El tiempo de incubación de los HC fue de 5-7 días, excepto en los casos de sospecha de endocarditis, brucelosis o a petición del médico responsable donde se prolongó hasta 30 días. Se definió como “bacteriemia verdadera (o significativa)” el aislamiento de bacterias habitualmente patógenas en uno o los dos HC con un cuadro clínico compatible. Y como “HC contaminado” ante el aislamiento en una sola botella de HC de Staphylococcus coagulasa-negativo , Bacillus spp , Streptococcus viridans, Micrococcus spp , Propionibacterium spp , Corynebacterium spp, y otros bacilos grampositivos cuando se interpretó la ausencia de significado clínico en estos casos (confirmado según la historia y/o el criterio del médico responsable y/o Microbiología). En otros casos, al existir 2 HC positivos y una significación clínica atribuida a ellos (especialmente en inmunodeprimidos o en portadores de catéteres vasculares o tras pruebas invasivas), sí se consideró BV y se trató con antibióticos.
Para los BMRII se adoptaron como valores de referencia los de nuestro laboratorio. Para la PCR de 0-8 mg/L y se determinó con un Método de inmunoanálisis enzimático cuantitativo (Slides VITROS CRP®) con una sensibilidad de 1 mg/L. Para la PCT se utilizaron como valores de referencia de la normalidad concentraciones <0,5 ng/mL, con método de inmunoanálisis cuantitativo de electroquimioluminiscencia ELECSYS (BRAHMS PCT®), que ofrece una sensibilidad de 0,02 ng/mL.
Variables recogidas. Se registraron sociodemográficas (edad, sexo, institucionalización), la toma de antibióticos en las 72 horas previas y/o los 3 meses anteriores, el ingreso en los 3 meses previos y la existencia de comorbilidades (enfermedad tumoral sólida u oncohematológica, hepatopatía, nefropatía, diabetes, enfermedad cardiaca crónica o cerebrovascular, enfermedad pulmonar obstructiva crónica, arterial periférica o del tejido conectivo e infección por el virus de la inmunodeficiencia humana). Se calculó el índice de Charlson [22] ponderado por la edad (y dicotomizado ≥3 puntos) y la situación funcional (índice de Barthel [23] y dicotomizado ≤60).
Se registraron datos clínicos y de gravedad: temperatura (Tª) en grados centígrados (°C), alteración de la consciencia definida con <15 puntos en la escala del coma de Glasgow (ECG), presión arterial sistólica (PAS), criterios de sepsis, sepsis grave o shock séptico y las variables que los definen según la conferencia de expertos de sepsis de 2001 [24]. También se aplicaron los criterios de selección pronóstica de pacientes en las definiciones del quick Sepsis Related Organ Failure Assessment (qSOFA) ≥2 y las variables que la constituyen según la tercera conferencia de consenso de sepsis (SEPSIS-3) [25]. Se incluyeron variables de evolución y destino: días de clínica previa, destino inicial de los pacientes, días de estancia hospitalaria, reconsulta en el SU en los 30 días posteriores y la mortalidad hospitalaria y a 30 días. En relación a las analíticas se registró el recuento de leucocitos (así como leucocitosis >12.000/mm3, leucopenia <4.000/mm3 o cayados >10%), concentración de PCR en mg/L (y dicotomizado para ≥9 mg/L y para ≥21 mg/L ) y la de PCT en ng/mL (y dicotomizado para ≥0,5 ng/mL, para ≥1 ng/mL y para el punto de corte obtenido con mejor rendimiento según el índice de Youden).
Análisis estadístico. Para la asociación entre la confirmación de bacteriemia verdadera y las variables independientes se utilizaron medias y sus desviaciones estándar (DE) para las cuantitativas y porcentajes para las cualitativas. Se utilizaron las pruebas de ji al cuadrado o exacta de Fisher, la t de Student y la U de Mann-Whitney, según fueran aplicables, para investigar la relación entre la existencia de BV frente a HC negativos (contaminados y los que no tuvieron ningún aislamiento) y las variables independientes (y aquellas que se dicotomizaron). Se consideró significativo un valor de p<0,05, los contrastes fueron bilaterales. Se realizó un análisis descriptivo (números absolutos y porcentajes) de ambos grupos (BV frente a HC negativos) en relación al tipo de patógeno encontrado globalmente y un análisis diferenciado según fuera el aislamiento de bacterias grampositivas, gramnegativas o anaerobias. Así como en función del foco o diagnóstico clínico realizado en el SU.
El estudio multivariante se realizó por un modelo de regresión logística (se eligió el método “introducir”, que fuerza la inclusión de todas las variables elegidas del modelo que fueron aquellas que tuvieron significación estadística en el modelo univariable). Los resultados de las comparaciones se expresaron por los valores de p y las odds ratio (OR) con su intervalo de confianza del 95% (IC 95%), aceptándose como significativo un valor de p <0,05 o cuando el IC 95% de la OR excluye el valor 1.
La eficacia y capacidad de las variables independientes significativas y con interés clínico para predecir la existencia de BV frente a los HC negativos se estudió mediante el análisis de las curvas Receiver Operating Characteristic (ROC) con el intervalo de confianza (IC) del 95% del área bajo la curva (ABC) de la curva ROC y se comparó frente al valor neutro (0,5). Los errores estándar de las ABC se calcularon por métodos no paramétricos. Asimismo, se determinaron los puntos de corte en los valores de PCR y PCT con mayor capacidad diagnóstica que maximizaba la diferencia entre la tasa de verdaderos positivos y falsos positivos mediante el índice de Youden. Se valoró el rendimiento diagnóstico de las pruebas con los cálculos de la sensibilidad (S), la especificidad (E), el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN), el coeficiente de probabilidad positivo (CP+) y negativo (CP–) para cada resultado estudiado, así como sus IC 95% por métodos binomiales exactos y por el de Taylor para los CP. El análisis estadístico se realizó con el paquete IBM-SPSS® Statistics 22 para Windows.
Consideraciones éticas. El estudio ha seguido todos los protocolos y normas de nuestro centro e internacionales (Declaración de Helsinki) para la utilización de los datos de los pacientes que se codificaron para asegurar la confidencialidad de los mismos. Se revisó la historia clínica informatizada y de atención primaria cuando se requirió. El estudio fue evaluado y aprobado por el Comité Ético de Investigación Clínica del Complejo Hospitalario Universitario de Toledo (referencia número 0398).
RESULTADOS
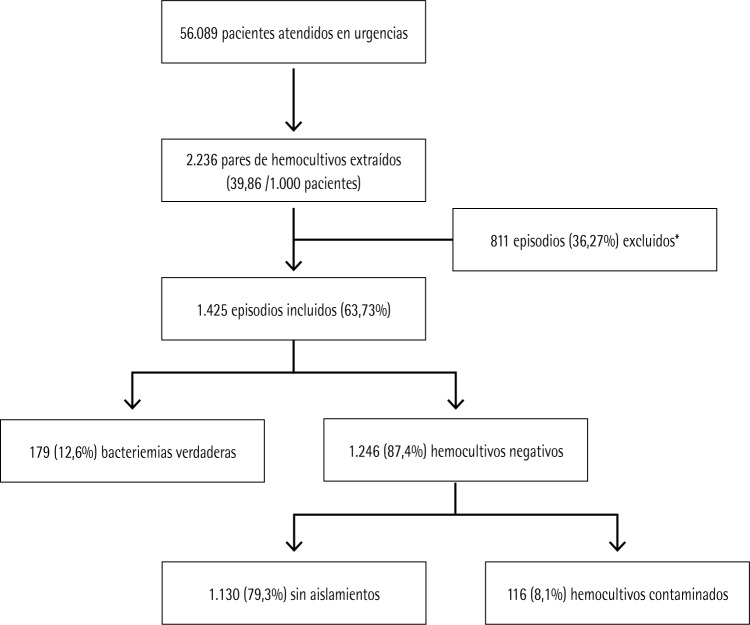
Durante el periodo de estudio se atendieron en el SU a 56.089 pacientes. Se realizaron 2.236 extracciones de HC, lo que supone 39,86 HC por cada 1.000 pacientes atendidos en el SU. De estos, finalmente sólo se incluyeron por oportunidad en el estudio a los 1.425 casos (63,73%), que cumplían con los criterios de inclusión señalados anteriormente. La edad media de los pacientes en los que se obtuvieron HC fue de 53 (DE 19) años con un rango entre 18 y 96 años. El 30,5% (434) tenían más de 65 años y el 53,3% eran mujeres (759). Del total de episodios, se consideraron como bacteriemias verdaderas 179 (12,56%) (6 de ellas polimicrobianas) y como HC negativos 1.246 (87,4%). Entre los considerados HC negativos se confirmaron 116 HC contaminados (8,14%). El diagrama de flujo de inclusión de episodios se muestra en la figura 1. Finalmente, cabe señalar que el 4,46% (8 casos) de las BV fueron dadas de alta desde el SU (“Bacteriemias ocultas”).
Figura 1.
Diagrama de flujo de la inclusión de casos
*Excluidos: Al no tener recogidos en la historia clínica las concentraciones de procalcitonina y proteína C reactiva obtenidas en el servicio de urgencias.
La etiología agrupada y por microorganismos de las BV y de los HC contaminados se expone en la tabla 1. Entre los gramnegativos, el aislamiento más frecuente fue E. coli en 61 ocasiones (20,7%) y, por parte de los grampositivos, S. pneumoniae en 35 (11,9%). Asimismo, E. coli en 7 ocasiones (87,5%) también fue el patógeno más frecuente de las 8 bacteriemias ocultas. En relación con los HC contaminados los más frecuentes fueron Staphylococcus coagulasa-negativo (80 episodios, 27,2%).
Tabla 1.
Características microbiológicas de la muestra global en función del tipo de aislamiento (bacteriemia verdadera frente a hemocultivos contaminados)
| Tipo de microorganismos | Total (N=295) |
BACTERIEMIA VERDADERA [N=179 (61,1%)] |
HEMOCULTIVOS CONTAMINADOS [N=116 (38,9%)] |
|---|---|---|---|
| Bacterias gramnegativas [98 (33,4 %)] | |||
| Escherichia coli[n (%)] | 61 (20,7) | 61 (34,1) | 0 (0,0) |
| Pseudomonas aeruginosa[n (%)] | 8 (2,7) | 8 (4,5) | 0 (0,0) |
| Proteusspp [n (%)] | 7 (2,4) | 7 (3,9) | 0 (0,0) |
| Klebsiella pneumoniae[n (%)] | 5 (1,7) | 5 (2,8) | 0 (0,0) |
| Klebsiellaspp [n (%)] | 4 (1,4) | 4 (2,2) | 0 (0,0) |
| Salmonellaspp [n (%)] | 3 (1) | 3 (1,7) | 0 (0,0) |
| Serratiaspp [n (%)] | 3 (1) | 3 (1,7) | 0 (0,0) |
| Enterobacterspp [n (%)] | 3 (1) | 3 (1,7) | 0 (0,0) |
| Otras gramnegativasa[n (%)] | 4 (1,4) | 4 (2,2) | 0 (0,0) |
| Bacterias grampositivas [187 (63,1 %)] | |||
| Streptococcus pneumoniae[n (%)] | 35 (11,9) | 35 (19,6) | 0 (0,0) |
| Staphylococcus coagulasa-negativo [n (%)] | 80 (27,2) | 3 (1,7) | 77 (66,5) |
| Propionibacterium spp [n (%)] | 15 (5,1) | 0 (0,0) | 15 (12,9) |
| Micrococcus spp [n (%)] | 14 (4,7) | 0 (0,0) | 14 (12,1) |
| Enterococcus spp [n (%)] | 8 (2,7) | 8 (4,5) | 0 (0,0) |
| Staphylococcus aureus [n (%)] | 8 (2,7) | 8 (4,5) | 0 (0,0) |
| SARM [n (%)] | 6 (2) | 6 (3,4) | 0 (0,0) |
| Otras grampositivas [n (%)] | 21 (7,1) | 11 (6,1) | 10 (8,6) |
| Bacterias anaerobias [10 (3,4 %)] | |||
| Bacterioides spp [n (%)] | 4 (1,4) | 4 (2,2) | 0 (0,0) |
| Clostridium spp [n (%)] | 2 (0,7) | 2 (1,1) | 0 (0,0) |
| Otras bacterias anaerobiasc [n (%)] | 4 (1,4) | 4 (2,2) | 0 (0,0) |
%: tanto por ciento (proporción referida a las columnas)
SARM Staphylococcus aureus resistente a meticilina
Otras gramnegativas (4): Haemophilus influenzae (2) y Neisseria meningitidis (2)
Otros grampositivos (11 bacteriemias verdaderas): Streptococcus spp (10) y Listeria monocytogenes.
Otros grampositivos (10 contaminantes): Streptococcus grupo viridans, Staphylococcus hominis, Staphylococcus capitis, Staphylococcus capitis-capitis y Corynebacterium spp.
Otras bacterias anaerobias (4): Prevotella spp, Fusobacterium spp y Veillonella spp.
El foco u origen clínico de presunción en el SU de las bacteriemias verdaderas y de los HC negativos se muestra en la tabla 2.
Tabla 2.
Foco/diagnóstico clínico de presunción en el servicio de urgencias de la muestra global en función de la existencia o no aislamientos en los hemocultivos
| Foco/diagnóstico clínico | Total (N=1.425) |
BACTERIEMIA VERDADERA [N=179 (12,6%)] |
HEMOCULTIVOS NEGATIVOSa [N=1.246 (87,4%)] |
|---|---|---|---|
| Infección del tracto urinario [n (%)] | 470 (33,0) | 88 (49,2) | 382 (30,7) |
| Infección respiratoria [n (%)] | 435 (30,5) | 41 (22,9) | 394 (31,6) |
| Fiebre sin foco claro [n (%)] | 175 (12,3) | 12 (6,7) | 163 (13,1) |
| Infección abdominal [n (%)] | 153 (10,7) | 12 (6,7) | 141 (11,3) |
| Infección piel y partes blandas [n (%)] | 99 (6,9) | 13 (7,3) | 86 (6,9) |
| Infección del sistema nervioso central [n (%)] | 47 (3,3) | 7 (3,9) | 40 (3,2) |
| Otros focos [n (%)] | 46 (3,2) | 6 (3,4) | 40 (3,2) |
%: tanto por ciento (proporción referida a las columnas)
Otros focos: Ginecológico, sospecha de endocarditis, por dispositivos externos.
Hemocultivos negativos: incluye los 1.130 sin aislamiento y los 116 definidos como contaminados
En la tabla 3 se muestran las características sociodemográficas, epidemiológicas, las comorbilidades, funcionales, clínicas, de gravedad, de evolución y destino de los pacientes. Al comparar los pacientes con BV y con HC negativos, solo se encontraron diferencias significativas en la edad, en la existencia de neoplasia sólida, enfermedad arterial periférica y el índice de Charlson ponderado y dicotomizado (Índice de Charlson ≥3). También se encontraron diferencias significativas en la proporción de pacientes que habían tomado antibióticos en las 72 horas previas, así como en el antecedente de ingreso previo en los 3 meses anteriores, en ambos casos superior en los episodios de BV (p<0,05).
Tabla 3.
Características clínico-epidemiológicas, de evolución y destino de la muestra global y estudio univariable en función de la existencia o no de aislamientos en los hemocultivos
| Total (N=1.425) |
Valores perdidos | BACTERIEMIA VERDADERA [N=179 (12,6%)] |
HEMOCULTIVOS NEGATIVOSa [N=1.246 (87,4%)] |
Valor p | |
|---|---|---|---|---|---|
| Datos demográficos-epidemiológicos | |||||
| Edad (años), media (DE) | 52,76 (19,04) | 0 (0,0) | 56,20 (16,99) | 52,27 (19,28) | 0,010 |
| Edad > 65 años [n (%)] | 434 (30,5) | 0 (0,0) | 57 (31,8) | 377 (30,3) | 0,362 |
| Género femenino [n (%)] | 759 (53,3) | 0 (0,0) | 91 (50,8) | 668 (53,6) | 0,269 |
| Institucionalizado [n (%)] | 108 (7,6) | 0 (0,0) | 18 (10,1) | 90 (7,2) | 0,119 |
| Toma de AB en 3 meses previos [n (%)] | 409 (28,8) | 0 (0,0) | 59 (34,1) | 350 (28,1) | 0,062 |
| Toma de AB en 72 horas previas [n (%)] | 286 (29,2) | 0 (0,0) | 47 (27,2) | 239 (19,2) | 0,020 |
| Ingreso en 3 meses previos [n (%)] | 229 (16,1) | 0 (0,0) | 40 (22,3) | 189 (15,2) | 0,017 |
| Comorbilidades | |||||
| Neoplasia sólida [n (%)] | 73 (5,1) | 3 (0,2) | 23 (12,8) | 50 (4) | 0,001 |
| Leucemia/Linfoma [n (%)] | 42 (2,9) | 3 (0,2) | 8 (4,5) | 34 (2,7) | 0,147 |
| Enfermedad hepática [n (%)] | 40 (2,8) | 3 (0,2) | 4 (2,2) | 36 (2,9) | 0,422 |
| Enfermedad cardiaca crónica [n (%)] | 151 (10,6) | 3 (0,2) | 20 (11,2) | 131 (10,5) | 0,435 |
| Enfermedad renal crónica [n (%)] | 106 (7,4) | 3 (0,2) | 17 (9,5) | 89 (7,1) | 0,165 |
| Enfermedad cerebrovascular [n (%)] | 44 (3,1) | 3 (0,2) | 4 (2,2) | 40 (3,2) | 0,334 |
| EPOC [n (%)] | 157 (11) | 5 (0,4) | 12 (6,7) | 145 (11,7) | 0,055 |
| Diabetes [n (%)] | 217 (15,2) | 3 (0,2) | 32 (17,9) | 185 (14,8) | 0,172 |
| Enfermedad arterial periférica [n (%)] | 45 (3,2) | 8 (0,6) | 12 (6,7) | 33 (2,7) | 0,009 |
| Enfermedad tejido conectivo [n (%)] | 19 (1,3) | 8 (0,6) | 3 (1,7) | 16 (1,3) | 0,436 |
| VIH [n (%)] | 22 (1,6) | 4 (0,3) | 3 (1,7) | 19 (1,5) | 0,530 |
| Índice de Charlsonb [media (DE)] | 2,10 (2,30) | 8 (0,6) | 2,55 (2,35) | 2,04 (2,28) | 0,008 |
| Índice de Charlson ≥3 [n (%)] | 482 (34) | 8 (0,6) | 79 (44,6) | 403 (32,5) | 0,002 |
| Índice de Barthelc [media (DE)] | 93,50 (15,46) | 12 (0,8) | 93,45 (15,73) | 93,51 (15,42) | 0,962 |
| Índice de Barthel ≤60 [n (%)] | 80 (5,7) | 12 (0,8) | 7 (3,9) | 73 (6,0) | 0,272 |
| Datos clínicos y de gravedad | |||||
| Temperatura en grados C [media (DE)] | 38,11 (0,64) | 0 (0,0) | 38,35 (0,65) | 38,06 (0,63) | 0,015 |
| Temperatura > 38,3°C [n (%)] | 389 (27,3%) | 0 (0,0) | 90 (50,3) | 299 (24,0) | <0,001 |
| FC en lpm [media (DE)] | 92,09 (12,13) | 4 (0,30) | 100,66 (16,83) | 90,85 (11,05) | <0,001 |
| FC > 90 lpm [n (%)] | 707 (49,6) | 4 (0,30) | 131 (73,2) | 576 (46,2%) | <0,001 |
| FR en rpm [media (DE)] | 22,00 (5,02) | 73 (5,29) | 27,57 (6,19) | 21,24 (4,32) | <0,001 |
| FR ≥22 rpm [n (%)] | 636 (44,9) | 73 (5,29) | 135 (75,4%) | 501 (40,4) | <0,001 |
| Alteración de la consciencia ECG<15 [n(%)] | 80 (5,7) | 22 (1,54) | 20 (11,3) | 60 (4,9) | 0,002 |
| PAS en mmHg [media (DE)] | 123,4 (19,8) | 0 (0,0) | 117,9 (21,3) | 124,2 (19,5) | 0,257 |
| PAS < 100 mmHg [n (%)] | 86 (6) | 0 (0,0) | 20 (11,2) | 66 (5,3) | 0,004 |
| Criterios de sepsis (SRIS ≥2) [n (%)] Criterios de sepsis grave [n (%)] |
806 (56,6) 103 (7,2) |
8 (0,60) 8 (0,60) |
150 (83,8) 25 (14,0) |
656 (52,6) 78 (6,3) |
<0,001 0,001 |
| Criterios de shock séptico [n (%)] | 12 (20,8) | 8 (0,60) | 7 (3,9) | 5 (0,4) | <0,001 |
| qSOFA ≥2 [n (%)] | 112 (8,0) | 76 (5,33) | 33 (18,6) | 79 (6,5) | <0,001 |
| Datos de evolución y destino | |||||
| Días desde inicio de la clínica [media (DE)] | 2,31 (1,29) | 58 (4,1) | 3,53 (1,50) | 2,13 (1,15) | <0,001 |
| Destino inicial de los pacientes [n (%)] | 1425 (100,0) | 0 (0,0) | <0,001 | ||
| Alta | 580 (40,7) | 0 (0,0) | 8 (4,5) | 572 (45,9) | |
| Observación | 418 (29,3) | 0 (0,0) | 49 (27,4) | 369 (29,6) | |
| Planta de hospitalización | 390 (27,4) | 0 (0,0) | 104 (58,1) | 286 (23,0) | |
| Quirófano (Cirugía urgente) | 22 (1,5) | 0 (0,0) | 12 (6,7) | 10 (0,8) | |
| Unidad de Cuidados Intensivos | 15 (1,1) | 0 (0,0) | 6 (3,4) | 9 (0,7) | |
| Estancia hospitalaria en días [media (DE)] | 2,86 (4,94) | 0 (0,0) | 10,87 (5,09) | 1,71 (3,70) | <0,001 |
| Reconsulta tras alta desde Urgencias [n (%)] | 90 (6,3) | 0 (0,0) | 29 (16,2) | 61 (4,9) | <0,001 |
| Mortalidad intrahospitalaria [n (%)] | 52 (3,6) | 0 (0,0) | 23 (12,8) | 29 (2,3) | <0,001 |
| Mortalidad a los 30 días [n (%)] | 71 (5,0) | 0 (0,0) | 31 (17,3) | 40 (3,2) | <0,001 |
%: tanto por ciento (proporción referida a las columnas); DE: desviación estándar; n: número; AB: antibióticos; h: horas; m: meses; EPOC: Enfermedad pulmonar obstructiva crónica; VIH: virus de la inmunodeficiencia humana; C: centígrados; FC: frecuencia cardiaca; lpm: latidos por minuto; FR: frecuencia respiratoria; rpm: respiraciones por minuto;
Hemocultivos negativos: incluye los 1.130 sin aislamiento y los 116 definidos como contaminados
Índice de Charlson: ponderado por la edad (se añade un punto al valor del índice de Charlson por cada década a partir de los 50 años) (referencia 22)
Índice de Barthel (referencia 23)
Criterios de sepsis (SRIS ≥2) según conferencia de Consenso de 2001 (referencia 24)
Criterios de sepsis (qSOFA ≥2) según la tercera conferencia de consenso (Sepsis-3) (referencia 25)
En relación con los datos de presentación clínica, tanto la Tª en °C (y dicotomizada >38,3°C), la frecuencia cardiaca (FC) (y >90 latidos por minuto), la frecuencia respiratoria(FR) (y ≥22 respiraciones por minuto) y la PAS <100 mmHg, junto con la existencia de los criterios clásicos de sepsis (dos o más criterios de síndrome de respuesta inflamatoria sistémica: SRIS ≥2), sepsis grave y shock séptico, además de un qSOFA ≥2, fueron significativamente superiores en los casos de BV.
En relación a la comparación de los valores analíticos (tabla 4) se encontraron diferencias significativas en el recuento absoluto de leucocitos, ante la existencia de una leucocitosis >12.000/mm3 y una proporción >10% de cayados. Para la PCR existieron diferencias con mayores concentraciones medias en las BV y con puntos de corte ≥9 mg/L y ≥21 mg/L. Por último, al comparar los valores en los casos de BV con los HC negativos, para la PCT se obtuvieron las mayores diferencias entre concentraciones y también tanto con el punto de corte ≥0,43 ng/mL, como con un punto de corte ≥0,51 ng/mL y con PCT ≥1 ng/mL.
Tabla 4.
Características analíticas de la muestra global y estudio univariable en función de la existencia o no aislamientos en los hemocultivos
| Hallazgos de laboratorio | Total (N=1.425) |
Valores perdidos | BACTERIEMIA VERDADERA [N=179 (12,6%)] |
HEMOCULTIVOS NEGATIVOSa [N=1.246 (87,4%)] |
Valor p |
|---|---|---|---|---|---|
| Leucocitos por mm3 [media (DE)] | 11.348 (7.795) | 0 (0,0) | 16.198 (19.513) | 10.652 (3.345) | <0,001 |
| Leucocitosis > 12.000/ mm3 [n (%)] | 460 (32,3) | 0 (0,0) | 108 (60,3) | 352 (28,3) | <0,001 |
| Leucocitos < 4.000/ mm3 [n (%)] | 62 (4,4) | 0 (0,0) | 2 (1,1) | 60 (4,8) | 0,038 |
| Cayados (bandas) > 10% [n (%)] | 295 (20,7) | 0 (0,0) | 70 (39,1) | 225 (18,1) | <0,001 |
| Plaquetas por mm3 [media (DE)] | 206.841 (99.522) | 0 (0,0) | 216.917 (103.266) | 205.393 (98.931) | 0,148 |
| Trombopenia < 100.000/mm3[n (%)] | 107 (7,5) | 0 (0,0) | 12 (6,7) | 95 (7,6) | 0,399 |
| Procalcitonina en ng/ml [media (DE)] | 0,74 (3,09) | 0 (0,0) | 3,27 (5,92) | 0,37 (0,22) | <0,001 |
| Procalcitonina ≥0,43 ng/ml [n (%)] | 332 (23,3) | 0 (0,0) | 164 (91,6) | 168 (13,5) | <0,001 |
| Procalcitonina ≥0,5 ng/ml [n (%)] | 275 (19,3) | 0 (0,0) | 158 (88,3) | 117 (9,4) | <0,001 |
| Procalcitonina ≥1 ng/ml [n (%)] | 158 (11,1) | 0 (0,0) | 125 (69,8) | 33 (2,6) | <0,001 |
| Proteína C reactiva en mg/l [media (DE)] | 30,47 (28,71) | 0 (0,0) | 46,37 (40,95) | 28,19 (25,71) | < 0,001 |
| Proteína C reactiva ≥9 mg/l [n (%)] | 1101 (77,3) | 0 (0,0) | 159 (88,8) | 942 (75,6) | < 0,001 |
| Proteína C reactiva ≥21 mg/l [n (%)] | 681 (47,8) | 0 (0,0) | 123 (68,7) | 558 (44,8) | < 0,001 |
%: tanto por ciento (proporción referida a las columnas)
DE: desviación estándar; n: número
Hemocultivos negativos: incluye los 1.130 sin aislamiento y los 116 definidos como contaminados
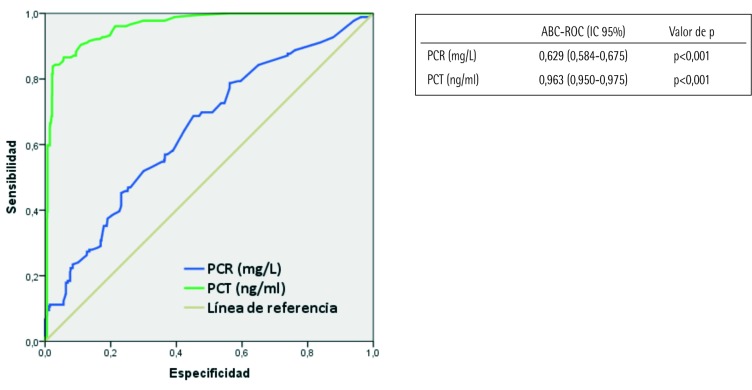
En la figura 2 se muestran las ABC-ROC de los BMRII (PCR y PCT). El ABC-ROC obtenida por la PCR para la predicción de bacteriemia fue de 0,629 (IC 95%: 0,584-0,675; p<0,01), siendo el punto de corte con mejor rendimiento diagnóstico encontrado cuando la PCR ≥21 mg/L, que consigue una S de 68,7%, E de 55,2%, VPP de 18,06%, VPN de 92,47%, CP+ de 1,53 y CPde 0,56. Asimismo, el ABC-ROC obtenida por la PCT para la predicción de bacteriemia es de 0,963 (IC 95%: 0,9500,975; p<0,001), siendo el punto de corte con mejor rendimiento diagnóstico PCT ≥ 0,51 ng/ml que consigue una S de 88,2%, E de 90,6%, VPP de 57,4%, VPN de 98,1%, CP+ de 9,38 y CPde 0,13.
Figura 2.
Capacidad predictiva de bacteriemia de los biomarcadores
ABC-ROC: Area Bajo la Curva – Receiver Operating Characteristic
IC 95%: intervalo de confianza al 95%
PCR: proteína C reactiva
PCT: procalcitonina
En la tabla 5 se muestran los resultados de las OR de las variables independientes significativas y con interés clínico para predecir la existencia de BV frente a los HC negativos en el estudio univariado y las que finalmente mantuvieron la significación estadística en el análisis multivariado, que fueron: la existencia de neoplasia sólida, una Tª > 38,3°C, una PAS < 100 mmHg, la existencia de criterios de shock séptico clásicos y una PCT ≥0,51 ng/ml.
Tabla 5.
Se muestran los resultados de las Odds Ratio de las variables significativas en el estudio univariado y mutivariado
| ANÁLISIS UNIVARIADO | ANÁLISIS MULTIVARIADO | |||
|---|---|---|---|---|
| Variable | OR (IC 95%) | Valor p | OR (IC 95%) | Valor p |
| AB en los 3 días previos | 1,572 (1,093-2,261) | 0,006 | ||
| Ingreso en los 3 meses previos | 1,609 (1,096-2,363) | 0,015 | ||
| Neoplasia sólida | 3,527 (2,094-5,939) | <0,001 | 1,738 (1,271-2,205) | <0,001 |
| Enfermedad arterial periférica | 2,653 (1,344-5,238) | 0,008 | ||
| Índice de Charlson ≥3 | 1,674 (1,217-2,304) | 0,002 | ||
| Temperatura > 38,3°C | 3,203 (2,324-4,413) | <0,001 | 1,600 (1,299-1,901) | <0,001 |
| PAS < 100 mmHg | 2,249 (1,328-3,809) | 0,004 | 3,684 (2,785-4,583) | <0,001 |
| FC > 90 lpm | 3,175 (2,239-4,500) | <0,001 | ||
| FR > 22 rpm | 4,520 (3,157-6,469) | <0,001 | ||
| ECG < 15 puntos | 2,476 (1,453-4,218) | 0,001 | ||
| Criterios de sepsis (SRIS ≥2) | 4,652 (3,079-7,030) | <0,001 | ||
| Criterios de sepsis grave | 2,431 (1,503-3,932) | <0,001 | ||
| Criterios de shock séptico | 10,101 (3,171-32,179) | <0,001 | 2,961 (1,783-4,139) | 0,012 |
| qSOFA ≥2 | 3,307 (2,126-5,143) | <0,001 | ||
| Leucocitosis > 12.000/ mm3 | 3,863 (2,795-5,341) | <0,001 | ||
| Cayados (bandas) > 10% | 2,914 (2,089-4,066) | <0,001 | ||
| Procalcitonina ≥0,43 ng/ml | 70,156 (40,350-121,978) | <0,001 | ||
| Procalcitonina ≥0,51 ng/ml | 72,602 (44,325-118,916) | <0,001 | 4,523 (4,206-4,840) | <0,001 |
| Procalcitonina ≥1 ng/ml | 80,735 (50,540128,970) | <0,001 | ||
| Proteína C reactiva ≥9 mg/l | 2,566 (1,583-4,157) | <0,001 | ||
| Proteína C reactiva ≥21 mg/l | 2,708 (1,937-3,786) | <0,001 | ||
OR: Odds ratio; IC 95%: intervalo de confianza del 95%; C: centígrados; PAS: presión arterial sistólica; FC: frecuencia cardiaca; FR: frecuencia respiratoria; ECG: escala del coma de Glasgow; SRIS: síndrome de respuesta inflamatoria sistémica; qSOFA: quick Sepsis Related Organ Failure Assessment
La mortalidad cruda de los pacientes que ingresaron con BV a los 30 días fue del 17,3% (31 fallecidos), superior (p<0,001) a la de los casos de HC negativos del 3,2% (40 casos).
Finalmente, en los casos de bacteriemia oculta (8) la mortalidad a los 30 días fue del 50%, significativamente mayor al resto. Todos ellos reconsultaron en el SU con ingreso posterior: 7 casos habían sido vistos por infección del tracto urinario (con aislamiento de E. coli) y uno por neumonía (S. pneumoniae). Cabe destacar que se objetivó en 3 de ellos (37,5%) la existencia de neoplasia sólida y una concentración de PCT > 0,51 ng/ ml en los 8 episodios.
DISCUSIÓN
Si bien la técnica de extracción de los HC está bien estandarizada y protocolizada [2, 3, 6], todavía hay importantes controversias en relación a las indicaciones de cuándo hacerlo [1, 13, 17]. Comparadas con el resto de pruebas habituales que se realizan en los SU, requieren un mayor tiempo para su obtención, una buena técnica para evitar contaminaciones y carecen de utilidad diagnóstica definitiva inmediata [2, 3]. A pesar de ello, la obtención de HC es una práctica creciente en la valoración inicial de los pacientes con sospecha de infección en el SU [1, 3]. En ellos, la sospecha y confirmación de bacteriemia en el SU tiene un importante significado diagnóstico, pronóstico y terapéutico. Pero, además, los HC también se obtienen en el SU como garantía de continuidad asistencial, ya que del conocimiento de sus resultados dependerá el manejo posterior del paciente en su destino final. Porque, sin esta información obtenida al inicio de su atención, la evolución del enfermo podría ser distinta e incluso su mortalidad mayor [1, 19, 26].
Según los resultados de nuestro estudio, podemos confirmar que tras la valoración inicial urgente de los pacientes adultos con sospecha de infección grave, se han identificado distintos factores independientes relacionados significativamente con la confirmación de bacteriemia. Estos son: una concentración de PCT ≥0,51 ng/ml, la existencia de neoplasia sólida, una Tª >38,3°C, una PAS <100 mmHg o cuando se cumplen los criterios definitorios de shock séptico. Estos 5 factores, cuyo análisis y valoración se realiza fácil y habitualmente en los SU, constituyen una evidente aproximación predictiva de BV, por lo que al considerarlos, ayudarían a una mejor indicación de extracción de los HC, adecuación del tratamiento antibiótico y atención del paciente con sospecha de infección grave [1, 10, 17].
En este escenario clínico, en la última década, se ha acentuado el estudio de los factores predictores de bacteriemia [27] y se han propuesto distintos modelos predictivos para los SU de distinta complejidad [14-16, 28-32]. Cabe destacar el papel que los BMRII, y en especial la PCT, han adquirido en los últimos años como factores predictores independientes de bacteriemia [33, 34], con una capacidad diagnóstica incluso mayor que la de algunos modelos [19].
Shapiro et al. [15] publicaron su propuesta de modelo que clasifica el riesgo de bacteriemia en bajo (<1%), moderado (79%) y alto (15-26%) en función de unos criterios mayores (Tª >39,4°C, presencia de catéter vascular o sospecha de endocarditis) y de unos criterios menores (Tª >38,3°C, edad >65 años, escalofríos, vómitos, PAS<90 mmHg, leucocitosis >18.000/mm3, >5% cayados, trombopenia <150.000/mm3 o creatinina >2 mg/dl). Éste, se ha convertido durante años, y tras ser validado [16], en una de las referencias más importantes para los SU [19]. Según este modelo de decisión, estaría indicada la extracción de HC cuando se cumpliera un criterio mayor o, al menos, dos menores. El modelo consigue una S del 94% y una E del 48%, con un ABC-ROC de 0,83. Sin duda, se trata de una escala con un rendimiento muy relevante, pero resulta laboriosa para su realización sistemática en los SU y no tiene en cuenta la indudable aportación que podrían hacer los BMRII [19]. Así, otra propuesta más sencilla, de Tudela et al. [14], que relacionó variables clínicas, analíticas y el índice de comorbilidad de Charlson, define dos variables significativas (índice de Charlson ≥2 y una PCT>0,4 ng/ml) con 1 y 2 puntos, respectivamente. Con ellas, se establecieron 4 grupos de probabilidad creciente de bacteriemia y obtenía un ABC de 0,80 y un VPN del 95,3% para “descartar” la existencia de bacteriemia. En este sentido, recientemente Contenti et al. [33] consiguen la misma ABCROC del modelo de Shapiro (0,83) con solo una variable de las definidas en nuestro estudio, la PCT, pero elevando el punto de corte de la PCT a concentraciones mayores de 2,25 ng/ml. También en esta línea, Tudela et al. [20] con un punto de corte >1 ng/ml de PCT consigue una ABC-ROC de 0,80 y S: 64%, E: 84% y un VPN de 94%. Es decir, que la inclusión de la PCT en cualquier modelo o como factor individual, hoy en día, debería ser considerada en los SU [10, 18-21, 33, 34]. En nuestro estudio, la PCT es el factor que mayor peso predictivo consigue con una OR de 4,52 (4,21-4,84) y una ABC-ROC de 0,96 con un punto de corte de PCT ≥0,51 ng/ml, así como un VPN de bacteriemia del 98%.
Otros modelos recientes, que incluyen algunos de los factores identificados en nuestro estudio, aunque útiles, no consiguen alcanzar el rendimiento del modelo de Shapiro [15]. Pero algunos de ellos son más fáciles de evaluar e implementar en el SU [28, 32]. Precisamente, que el modelo o los factores evaluados sean sencillos y rápidos de realizar en el SU, ha sido señalado en recientes metaanálisis y revisiones [29, 30]. Aunque, paradójicamente, se ha comprobado que ninguno de los 15 modelos de dichas revisiones se han implementado en la práctica clínica diaria por sus respectivos autores [30].
Un estudio multicéntrico define un modelo que incluye Tª ≥38°C, plaquetas <150.000/mm3 y una puntuación <15 de la ECG. Con él se obtiene un ABC de 0,68 [32]. En otro estudio, Su et al. [28], incluye como variables la Tª ≥38,3°C, taquicardia ≥120 lpm, linfopenia <500/mm3 y otros datos analíticos. Entre ellos, una PCT >0,5 ng/ml (ésta con OR de 3,14, algo menor a nuestros datos, pero de las más importantes del modelo). Este modelo de Su et al. consigue un ABC-ROC de 0,85 [28].
Por contra, otro metaanálisis [29] que revisa 35 estudios no ha sido capaz de identificar los factores independientes predictores de bacteriemia. Por ello, en él no se recomienda la extracción de HC sistemáticamente solo con fiebre y leucocitosis. Y sugiere que se debe continuar buscando un modelo ideal que incorpore otras variables como los BMRII y la valoración clínica de la gravedad del paciente (con los signos vitales: Tª, FC, FR, PAS y nivel de consciencia) [19, 29].
Precisamente, la Tª >38,3°C, la PAS<100 mmHg, la existencia de shock séptico (hipotensión que no remonta con fluidoterapia y precisa agentes vasoactivos) son, junto a la existencia de neoplasia sólida, los factores identificados por nuestro estudio junto con la PCT. Por ello, creemos que la confección de un sencillo modelo con ellos y/o la consideración de aquellos pacientes con Tª>38,3°C, hipotensión y/o una PCT ≥0,51 ng/ml, debería hacer al clínico plantearse la existencia de una BV. Y, consecuentemente, indicar la obtención de HC junto con el tratamiento adecuado a cada paciente.
Nuestro estudio tiene distintas limitaciones que hay que señalar. En primer lugar, se trata de un estudio unicéntrico y retrospectivo, donde la indicación de conseguir HC se realiza según las decisiones del médico responsable. Por ello, junto a esta variabilidad clínica, hay que recordar que un 36,27% de los HC no se registraron por no cumplir los criterios de inclusión (al no tener datos de la PCR y PCT), todo ello podría suponer un sesgo de selección al no haber sido considerados todos los episodios. Además, la selección de variables clínicas podría haber sido más completa (no se incluyeron variables como escalofríos, tiritona, náuseas-vómitos, etc.) [25, 26, 35]. También hay que señalar la importante tasa de HC contaminantes (8,14%), lo que no supone un obstáculo para analizar nuestros resultados, como ya ha sido publicado previamente [7]. No obstante, a pesar de estas limitaciones, creemos que los resultados representan un fiel reflejo de la realidad y epidemiología de nuestro SU, pero no se pueden extrapolar y carecen de validez externa. De manera que sería necesario realizar un estudio multicéntrico y prospectivo para poder confirmar estos hallazgos.
En conclusión, en el paciente con sospecha de infección grave en el SU, la existencia de concentraciones de PCT ≥0,51 ng/ml (como se ha sugerido recientemente [19]) junto con una temperatura >38,8°C y la valoración de la gravedad clínica (hipotensión y/o ante la existencia de criterios de shock séptico), nos obligaría a descartar la existencia de una BV (independientemente del foco). Y así, a obtener HC y aplicar el tratamiento adecuado y precoz que precise el enfermo. Además, en los casos donde exista el antecedente de neoplasia sólida, deberíamos ser menos restrictivos para indicar la extracción de los HC ante el mayor riesgo de bacteriemia.
FINANCIACIÓN
Los autores declaran que no han recibido financiación para la realización de este trabajo.
CONFLICTO DE INTERESES
AJJ ha participado en reuniones científicas organizadas por Bayer, Boehringer, Esteve, GSK, Lilly, MSD, Pfizer, Tedec Meiji, Roche, Thermo Scientific Biomarkers, B.R.A.H.M.S. AG y Biomerieux.
Los autores declaran la ausencia de conflictos de intereses en relación con el presente artículo.
References
- 1.Julián-Jiménez A, Supino M, López Tapia JD, Ulloa González C, Var-gas Téllez LE, González del Castillo J, et al. Puntos clave y contro-versias sobre la sepsis en los servicios de urgencias: propuestas de mejora para Latinoamérica. Emergencias 2019; 31:123-135. PMid: [PubMed] [Google Scholar]
- 2.Guna Serrano MR, Larrosa Escartín N, Marín Arriaza M, Rodríguez Díaz JC. Diagnóstico microbiológico de la bacteriemia y fungemia: hemocultivos y métodos moleculares. Enferm Infecc Microbiol Clin. 2019; 37:335-40. DOI: 10.1016/j.eimc.2018.03.005 [DOI] [PubMed] [Google Scholar]
- 3.Cisneros-Herreros JM, Cobo-Reinoso J, Puyol-Rojo M, Rodríguez-Baño J, Salavert-Lleti M. Guía para el diagnóstico y tratamiento del paciente con bacteriemia. Guías de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC). En-ferm Infecc Microbiol Clin. 2007; 25:111-30. DOI: 10.1016/S0213-005X(07)74242-8 [DOI] [PubMed] [Google Scholar]
- 4.Ortega Romero M. Uso de antimicrobianos en urgencias: ¿hay margen de mejora? Emergencias 2018; 30:292-4. PMid: [PubMed] [Google Scholar]
- 5.Yunquera-Romero L, Márquez-Gómez I, Henares-López A, Mora-les-Lara MJ, Gallego Fernández C, Asensi-Díez R. Adecuación de las prescripciones antimicrobianas realizadas en el área de urgencias de un hospital de tercer nivel. Rev Esp Quimioter. 2018; 31(3):209-16. PMid: [PMC free article] [PubMed] [Google Scholar]
- 6.De Dios García B, Lladò Maura Y, Val-Pérez JV, Arévalo Rupert JM, Company Barceló J, Castillo-Domingo L, et al. Efectividad de un programa formativo para disminuir los hemocultivos contamina-dos. Enferm Clin. 2014; 24:111-7. DOI: 10.1016/j.enfcli.2013.10.004 [DOI] [PubMed] [Google Scholar]
- 7.Zafar Iqbal-Mirza S, Serrano Romero de Ávila V, Estévez-González R, Rodríguez-González D, Heredero-Gálvez E, Julián-Jiménez A. Ca-pacidad de la procalcitonina para diferenciar bacteriemia verdadera de los hemocultivos contaminados en el servicio de urgencias. En-ferm Infecc Mocrobiol Clin. 2019; 37 (9): 560-568. DOI: 10.1016/j.eimc.2019.01.012 [DOI] [PubMed] [Google Scholar]
- 8.Villamil Cajoto I, Rodríguez Otero L, Villaicián Vicedo MJ, Van den Eynde Collado A, García-Zabarte Casal MA. Bacteriemia en pacien-tes dados de alta en el servicio de urgencias. Emergencias. 2005; 17:62-6. [Google Scholar]
- 9.Oltra Hostalet F, Núñez-Núñez M, Portillo Cano MM, Navarro Bus-tos C, Rodríguez-Baño J, Retamar Gentil P. Análisis de la calidad de uso de antimicrobianos en el servicio de urgencias de un hospital de tercer nivel. Emergencias 2018; 30:297-302. PMid: [PubMed] [Google Scholar]
- 10.Tudela P, Giménez M, Mòdol JM, Prat C. Hemocultivos en los servi-cios de urgencias, ¿hacia un nuevo enfoque? Med Clin (Barc). 2016; 146:455-9. DOI: 10.1016/j.medcli.2015.11.026 [DOI] [PubMed] [Google Scholar]
- 11.Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving Sepsis Campaign: International Guidelines for Ma-nagement of Sepsis and Septic Shock: 2016. Intensive Care Med. 2017; 43:304–77. DOI: 10.1007/s00134-017-4683-6 [DOI] [PubMed] [Google Scholar]
- 12.Ferreras Amez JM, Arribas Entrala B, Aspiroz C, Ezpeleta Galindo A, Boned Juliani B. Estacionalidad de las bacteriemias en urgencias. Emergencias. 2019; 31:399-403 [PubMed] [Google Scholar]
- 13.Long B, Koyfman A. Best Clinical Practice: Blood Culture Utility in the Emergency Department. J Emerg Med. 2016; 51:529-39. DOI: 10.1016/j.jemermed.2016.07.003 [DOI] [PubMed] [Google Scholar]
- 14.Tudela P, Lacoma A, Pract C, Mòdol J M, Giménez M, Barallat J, et al. Predicción de bacteriemia en los pacientes con sospecha de infección en urgencias. Med Clin (Barc) 2010; 135: 685-90. DOI: 10.1016/j.medcli.2010.04.009 [DOI] [PubMed] [Google Scholar]
- 15.Shapiro N I, Wolfe R E, Wright S B, Moore R, Bates D W. Who ne-eds a blood culture? A prospectively derived and validated predic-tion rule. J Emerg Med 2008; 35: 255-64. DOI: 10.1016/j.jemer-med.2008.04.001 [DOI] [PubMed] [Google Scholar]
- 16.Jessen MK, Mackenhauer J, Hvass AMW, Ellermann-Eriksen S, Skibs-ted S, Kirkegaard H, et al. Prediction of bacteremia in the emergen-cy department: An external validation of a clinical decision rule. CONSIDER Sepsis Network. Eur J Emerg Med. 2016; 23: 44–9. DOI: 10.1097/MEJ.0000000000000203 [DOI] [PubMed] [Google Scholar]
- 17.Julián-Jiménez A. Rubio-Díaz R. Hemocultivos en el servicio de urgencias: ¿podemos predecir las bacteriemias? Emergencias. 2019;31:375-376 [PubMed] [Google Scholar]
- 18.Hoeboer SH, van der Geest PJ, Nieboer D, Groeneveld AB. The diag-nostic accuracy of procalcitonin for bacteraemia: A systematic review and meta-analysis. Clin Microbiol Infect. 2015; 21:474–81. DOI: 10.1016/j.cmi.2014.12.026 [DOI] [PubMed] [Google Scholar]
- 19.Julián-Jiménez A, Candel González FJ, González del Castillo J. Utili-dad de los biomarcadores para predecir bacteriemia en los pacien-tes con infección en urgencias. Rev Esp Quimioter. 2017; 30:245-56. PMid: [PubMed] [Google Scholar]
- 20.Tudela P, Prat C, Lacoma A, Mòdol JM. Biomarcadores y sospecha de infección en los servicios de urgencias. Med Clin (Barc). 2012; 139: 33-7. DOI: 10.1016/j.medcli.2011.09.018 [DOI] [PubMed] [Google Scholar]
- 21.Julián-Jiménez A, Candel-González FJ, González del Castillo J. Uti-lidad de los biomarcadores de inflamación e infección en los servi-cios de urgencias. Enferm Infecc Microbiol Clin. 2014; 32:177-90. DOI: 10.1016/j.eimc.2013.01.005 [DOI] [PubMed] [Google Scholar]
- 22.Charlson M, Pompei P, Ales KL, McKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: De-velopment and validation. J Chron Dis. 1987; 40:373–83. DOI: 10.1016/0021-9681(87)90171-8 [DOI] [PubMed] [Google Scholar]
- 23.Mahoney FI, Barthel DW. Functional evaluation: The Barthel Index. Md State Med J. 1965; 14:61–5. PMid: [PubMed] [Google Scholar]
- 24.Levy MM, Fink MP, Marshall JC, Abraham E, Angus D, Cook D et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med. 2003; 31: 1250-6. DOI: 10.1097/01.CCM.0000050454.01978.3B [DOI] [PubMed] [Google Scholar]
- 25.Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016; 315:801-10. DOI: 10.1001/jama.2016.0287 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Candel FJ, Borges Sa M, Belda S, Bou G, Del Pozo JL, Estrada O, et al. Current aspects in sepsis approach. Turning things around. Rev Esp Quimioter. 2018; 31(4):298-315. PMid: [PMC free article] [PubMed] [Google Scholar]
- 27.Sante L, Lecuona M, Aguirre Jaime A, Arias A. Factores de riesgo en bacteriemias nosocomiales secundarias a ITU en un hospital tercia-rio. Rev Esp Quimioter. 2019; 32(4)311-6. PMid: [PMC free article] [PubMed] [Google Scholar]
- 28.Su CP, Chen TH, Chen SY, Ghiang WC, Wu GH, Sun HY, et al. Pre-dictive model for bacteremia in adult patients with blood cultures performed at the emergency department: a preliminary report. J Microbiol Immunol Infect. 2011; 44:449-55. DOI: 10.1016/j.jmii.2011.04.006 [DOI] [PubMed] [Google Scholar]
- 29.Coburn B, Morris A.M, Tomlinson G, Detsky AS. Does This Adult Pa-tient With Suspected Bacteremia Require Blood Cultures? JAMA. 2012; 308:502-511. DOI: 10.1001/jama.2012.8262 [DOI] [PubMed] [Google Scholar]
- 30.Eliakim-Raz N, Bates DW, Leibovici L. Predicting bacteraemia in va-lidated models—a systematic review. Clin Microbiol Infect. 2015; 21: 295–301. DOI: 10.1016/j.cmi.2015.01.023 [DOI] [PubMed] [Google Scholar]
- 31.Ching-Chi L, Chi-Jung W, Chih-Hsien C, Nan-Yao L, Po-Lin C, Hsin-Chun L, et al. Prediction of community-onset bacteremia among febrile adults visiting an emergency department: rigor matters. Diagn Microbiol Infect Dis. 2012; 73(2):168-73. DOI: 10.1016/j.diagmicrobio.2012.02.009. [DOI] [PubMed] [Google Scholar]
- 32.Cuervo A, Correa J, Garcés D, Ascuntar J, León A, Jaimes F A. De-sarrollo y validación de un modelo predictor para bacteriemia en pacientes hospitalizados por el servicio de urgencias con sospecha de infección. Rev Chilena Infectol 2016; 33: 150-8. DOI: 10.4067/S0716-10182016000200004 [DOI] [PubMed] [Google Scholar]
- 33.Contenti J, Occelli C, Lemoel F, Ferrari P, Levraut J. Capacidad diagnóstica de presepsina comparada con otros biomarcadores para predecir sepsis y shock séptico en pacientes con infección, basada en la definición de Sepsis-3 (estudio PREDI). Emergencias. 2019. 31:311-7. PMid: . [PubMed] [Google Scholar]
- 34.Julián-Jiménez A, Timón-Zapata J, Laserna-Mendieta EJ, Parejo R, Flores-Chacartegui M, Gallardo P. Capacidad de la procalcitonina para predecir bacteriemia en pacientes con neumonía adquirida en la comunidad. Med Clin (Barc). 2014; 142: 285-92. DOI: 10.1016/j.medcli.2013.05.046. [DOI] [PubMed] [Google Scholar]
- 35.Komatsu T, Takahashi E, Mishima K, Toyoda T, Saitoh F, Matsuoka J, et al. A Simple Algorithm for Predicting Bacteremia Using Food Consumption And Shaking Chills: A Prospective Observational Stu-dy. J Hosp Med. 2017; 12(7):510-5. DOI: 10.12788/jhm.2764 [DOI] [PubMed] [Google Scholar]