Summary
The fragile X‑associated tremor/ataxia syndrome (FXTAS) is a neurodegenerative disease associated with the repetition of CGG triplets (55–200 CGG repetitions) in the FMR1 gene. The premutation of the FMR1 gene, contrasting with the full mutation (more than 200 CGG repetitions), present an increased production of messenger and a similar or slightly decreased production of FMRP protein. FXTAS affects 40% of men and 16% of women carriers of the premutation. It presents with a wide constellation of neurological signs such as intention tremor, cerebellar ataxia, parkinsonism, executive function deficits, peripheral neuropathy and cognitive decline leading to dementia among others. In this review, we present what is currently known about the molecular mechanism, the radiological findings and the pathology as well as the complexity of the diagnosis and management of FXTAS.
Resumen
El síndrome de temblor y ataxia asociado al X frágil (FXTAS) es una enfermedad neurodegenerativa relacionada con la premutación del gen FMR1. Los alelos con premutación (55–200 repeticiones de CGG), al contrario de los alelos con mutación completa (más de 200 repeticiones CGG), tienen una producción excesiva de ARN mensajero y unos niveles normales o reducidos de proteína. El FXTAS afecta al 40% de los hombres y al 16% de las mujeres portadores de la premutación del FMR1. Se presenta con una amplia constelación de signos neurológicos como temblor de intención, ataxia cerebelosa, parkinsonismo, déficit en la función ejecutiva, neuropatía periférica y deterioro cognitivo que conduce a la demencia entre otros. En esta revisión presentamos lo que hasta ahora se conoce del mecanismo molecular, los hallazgos radiológicos y la patología, así como también la complejidad del diagnóstico y manejo del FXTAS.
Keywords: X frágil, FMR1, FMRP, inclusión, alteración motora, degeneración
INTRODUCCIÓN
El síndrome de temblor y ataxia asociado al X frágil (FXTAS) - por sus siglas en inglés - es un síndrome neurodegenerativo relacionado con la premutación (55–200 repeticiones de CGG) del gen FMR1. El síndrome de X frágil (FXS), la condición de mayor prevalencia asociada a mutación génica, se produce por la mutación completa del gen FMR1, en el que se presenta la repetición anormal de tripletes CGG (más de 200 repeticiones). La mutación completa produce ausencia de ARN mensajero y de proteína FMRP y la consecuente pérdida de la función del gen causando discapacidad intelectual en los pacientes con FXS (1). Los alelos con premutación, al contrario de los alelos con mutación completa, tienen una producción excesiva de ARN mensajero y unos niveles normales o reducidos de proteína. La prevalencia de la premutación es de 1– 400 hombres y 1–200 mujeres (2), sin embargo, solo el 40% de los hombres y 16% de las mujeres portadoras de la premutación desarrollan FXTAS (3–5). La edad media de inicio de síntomas del FXTAS está entre los 55 y 65 años (4, 6–8). Sin embargo, la exposición crónica a factores ambientales neurotóxicos, precipitan la degeneración neuronal produciendo la aparición temprana de la sintomatología (1, 9). Además de la aparición de FXTAS, los portadores también pueden presentar dificultades emocionales en la infancia, fobia social, rasgos obsesivos compulsivos (10), trastornos del espectro autista (10, 11), convulsiones en solo 8% (12, 13), insuficiencia ovárica prematura asociada al X frágil (FXPOI) (14) y desordenes neuropsiquiatricos que incluyen ansiedad, depresión, déficit de atención e hiperactividad, dolor crónico y desordenes autoinmunes (1); estos recientemente se han agrupado para reconocerlos como FXAND (15).
OBJECTIVO
El objetivo de esta revisión es aportar al conocimiento que se tiene hasta el momento del síndrome de temblor/ataxia asociado al frágil X (FXTAS). Actualmente a pesar de existir amplia información en la literatura el síndrome es comúnmente desconocido en la práctica clínica mundial. Como autores consideramos importante la difusión de la información científica en español, con el fin de alcanzar un número mayor de lectores con interés científico, procurando un pronto diagnóstico y óptimo tratamiento de los pacientes con FXTAS.
DESARROLLO
Presentación clínica
La presentación clínica del FXTAS es variable y puede incluir temblor de intención, parkinsonismo, debilidad proximal en las extremidades inferiores, deterioro cognitivo y neuropatía periférica (8, 16). Adicionalmente, entre un 40% y 50% de pacientes con FXTAS presentan síntomas de depresión y ansiedad antes de presentar manifestaciones neurológicas (17–19). A medida que progresa el compromiso neuronal se presenta la aparición de ataxia cerebelosa que conlleva caídas frecuentes en los afectados (1) y aproximadamente el 40% desarrollan demencia. Aunque aún no se ha elucidado la razón ni los factores de riesgo que predisponen a los afectados a presentarla, se ha descrito una asociación entre la aparición del déficit cognitivo y el número de repeticiones de tripletes CGG (20, 21). El síndrome fue presentado por primera vez en el 2001 por Hagerman y colaboradores, quienes describieron cinco casos de adultos mayores portadores de la premutación en FMR1 que presentaban temblor de aparición progresiva asociado a déficit cognitivo y atrofia cerebral generalizada. Introdujeron la hipótesis que establece que la causa de la degeneración neuronal es debida a la toxicidad inducida por la elevación del ARN mensajero en el gen FMR1 (7). Posteriormente Jacquemont y colaboradores publicaron una serie de casos de portadores mayores de 50 años, delineando los primeros criterios mayores y menores para el diagnóstico de FXTAS (8). Los criterios han sido modificados posteriormente para incluir nuevos hallazgos tanto clínicos como radiológicos (22, 23) y patológicos (3). El criterio molecular es requerido y actualmente incluye todos los tipos reconocidos de mutación en el gen FMR1, incluyendo la zona gris (41–54 repeticiones de CGG) (tabla 1) (24). Para confirmar el diagnóstico se requiere que exista la premutación en FMR1, un hallazgo radiológico o patológico mayor y un signo clínico mayor. Un diagnostico probable requiere de un hallazgo radiológico mayor y un signo clínico menor o de dos signos clínicos mayores. Un diagnóstico posible se basa en un hallazgo radiológico menor y un signo clínico mayor (tabla 1) (1, 8). Adicionalmente, según el deterioro funcional, FXTAS se clasifica en estadios, donde 0 equivale al funcionamiento normal; 1 = problema sutil o cuestionable de balance y/o temblor; 2 = problema menor pero claramente detectable de balance y/o temblor que no interfiere con las actividades diarias; 3 = problema moderado de balance y/o temblor que interfiere significativamente con las actividades diarias y el reporte de caídas ocasionales; 4 = problema severo de balance y/o temblor que requiere el uso de caminador o bastón; 5 = uso diario de silla de ruedas para la movilización; 6 = postración (25). El tiempo de supervivencia oscila entre los 5 y los 25 años desde la aparición de los signos de compromiso motor (1). Varios reportes han resaltado que la exposición a insultos neurotóxicos tales como el consumo crónico de alcohol y opioides (9, 26, 27) la exposición a pesticidas (28) y el uso de algunos anestésicos (29), contribuyen a la aparición más temprana de los síntomas y a la rápida progresión del síndrome. Adicionalmente, la coexistencia de otras patologías neurodegenerativas como la enfermedad de Alzheimer, la demencia de cuerpos de Lewy y la esclerosis múltiple contribuyen al rápido deterioro funcional de los afectados (20, 30, 31).
Tabla 1 –
FXTAS criterios diagnósticos
|
Signos
Clínicos Mayores: • Temblor de intención • Ataxia cerebelosa Menores: • Parkinsonismo • Neuropatia • Déficit de memoria (moderado a severo) • Déficit ejecutivo de la función cognitiva |
Hallazgos Radiológicos
(MRI) Mayores: • Lesiones de la sustancia blanca en los pedunculos cerebelares medios y/o en el tallo cerebral (signo MCP) Menores: • Lesiones de la sustancia blanca cerebral • Lesiones de la sustancia blanca en el esplenio del cuerpo calloso • Atrofia cerebral de moderada a generalizada |
|
Molecular Requerido: • Mutación del gen FMR1 incluyendo la zona gris |
Neuropatológico Mayor: • Inclusiones intranucleares positivas para ubicuitina |
Adaptado de Jacquemont et al. 2003 & Tassone & Hall 2016 chapter 1
Como consecuencia del parkinsonismo descrito en la sintomatología del FXTAS (4), muchos de los afectados son inicialmente diagnosticados con enfermedad de Parkinson. Adicionalmente, se han descrito casos de portadores de la premutación en FMR1 que presentan bradiquinesia, temblor de reposo, rigidez y/o inestabilidad postural característicos del Parkinson y que no cumplen con los criterios clínicos y radiológicos para el diagnóstico del FXTAS (32, 33); por lo que en la actualidad se reconoce la posibilidad de que el FXTAS tenga una asociación causal con el Parkinson, sin embargo, esta asociación no ha sido elucidada aún.
El número de repeticiones en el rango de la premutación está relacionado con la cantidad e intensidad de los síntomas en los portadores; y específicamente en aquellos con FXTAS el número de CGG está relacionado con la presencia de signos clínicos, la aparición de inclusiones intranucleares, anormalidades en MRI, y la edad de aparición de los síntomas (9, 34–36). Leehey et al. 2008 describieron la asociación entre el número de repeticiones CGG y la deficiencia motora y ataxia en los portadores y portadoras respectivamente (37). En concordancia con la menor prevalencia del FXTAS en mujeres portadoras, los síntomas neurológicos se manifiestan generalmente con menor severidad y con progresión menos acelerada que en los hombres. Esto debido presuntamente a la protección variable otorgada por la expresión del gen FMR1 en el cromosoma X no afectado (38, 39). La diferencia encontrada en la clínica puede ser confirmada por el menor compromiso del pedúnculo cerebelar medio y la menor reducción del volumen cerebelar reportado en las imágenes radiológicas (40).
Existen dos variantes especiales en la mutación del gen llamadas mosaicos. El primero consiste en que el mismo afectado presenta algunas líneas celulares con mutación completa y otras con premutación, en diferentes proporciones dependiendo del tejido (ej: sangre, fibroblastos). En el caso de los portadores el mosaico consiste en la presentación de líneas celulares con premutacion y otras con función normal del gen. El segundo se refiere a individuos con mutación completa pero que presentan solo un porcentaje de los alelos con metilación – causa del silenciamiento del gen (41, 42). En estos casos los pacientes pueden presentar tanto el fenotipo atenuado de la mutación completa (43) como las patologías asociadas a la premutación, incluyendo desordenes psiquiátricos y FXTAS.
Hallazgos radiológicos
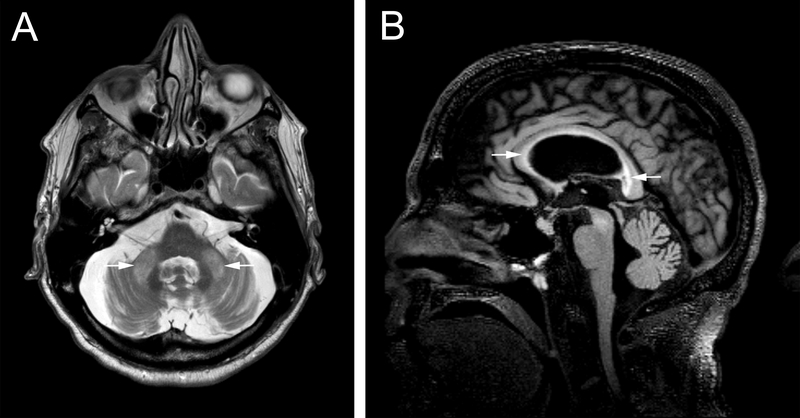
FXTAS es una enfermedad neurodegenerativa. Dentro de los hallazgos radiológicos se encuentran: hiperintensidades de la sustancia blanca en el tallo cerebral, los pedúnculos cerebelares medios - signo MCP aproximadamente en el 60% de los afectados - o el esplenio del cuerpo calloso, atrofia cerebral generalizada y lesiones corticales en la sustancia blanca (figura 1) (22, 23). Los cambios radiológicos pueden ser detectados mucho antes de la aparición de los síntomas (44, 45). Recientemente se reportó una serie de casos en los que se describe el principal criterio radiológico (tabla 1) sin que se encuentren signos clínicos del FXTAS (46). La investigación continúa avanzando en búsqueda de marcadores radiográficos específicos; actualmente, Shelton y colaboradores proponen la reducción del ancho de los pedúnculos cerebelares medios como potencial marcador de riesgo de FXTAS (47).
Figura 1.
A. Vista axial del cerebro de un paciente con premutacion y diagnostico confirmado de FXTAS en la que se muestran las hiperintensidades del signo MCP. B. Vista sagital donde se evidencia la atrofia cerebral y el compromiso del cuerpo, la rodilla y el esplenio del cuerpo calloso.
Patología
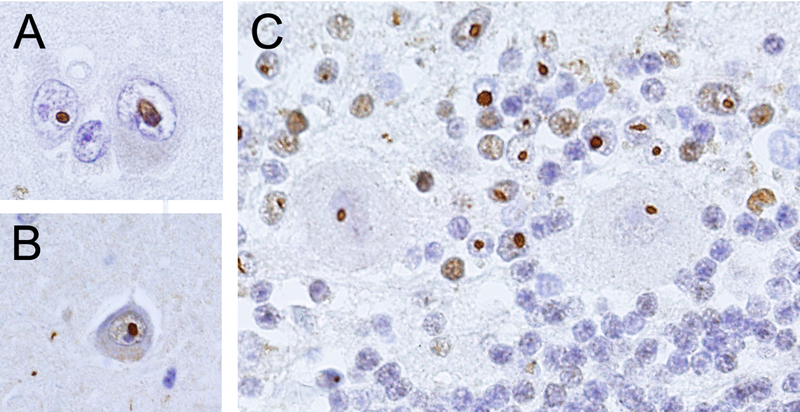
El único criterio patológico para el diagnóstico del FXTAS es la presencia de inclusiones intranucleares. Estas están presentes en neuronas y astrocitos pero no en otros tipos celulares (30, 31, 48). Las inclusiones intranucleares están presentes prácticamente en todos los órganos cerebrales y también en el sistema nervioso periférico y autonómico, así como en estructuras no nerviosas, incluidas la tiroides, la pituitaria, los ovarios y los testículos (49). Las inclusiones intranucleares en hematoxilina/eosina (H/E) son discretas, hialinas, eosinófilas y tienen una morfología esférica u oval. Miden alrededor de los 2–5 μm de diámetro y son únicas, excepto en el caso de las células de Purkinje en el cerebelo en las que a veces hay dos y se conocen como inclusiones gemelas (48). Las inclusiones intranucleares son negativas para PAS (periodic acid-Schiff) y Tau, pero positivas para ubicuitina (figura 2). La patología del FXTAS se presenta con daño generalizado de la sustancia blanca del cerebro y cerebelo, atrofia de moderada a severa de la corteza cerebral y ventriculomegalia. También presenta con atrofia del tronco, especialmente del puente. Las áreas de daño de la sustancia blanca muestran espongiosis, degeneración axonal y pérdida de mielina. El pedúnculo cerebelar medio muestra palidez de la sustancia blanca en H/E y en LFB-PAS (luxol fast blue/periodic acid-Schiff). La mitad de los casos de FXTAS presentan con gran número de microglía activada, mientras que la otra mitad de los casos la microglía es senescente (50). Los capilares, células de microglía y oligodendrocitos acumulan grandes cantidades de hierro que se detectan con tinción de Perl (51). El estroma del plexo coroideo también acumula hierro, y presenta una alteración de la expresión de proteínas de regulación y de secuestro de hierro (52). Algunos casos de FXTAS también se presentan con micro-hemorragias en la sustancia blanca (46).
Figura 2.
Inclusiones intranucleares positivas para ubicuitina. A. Corteza cerebral. B. Hipocampo. C. Cerebelo. Flechas en A y B señalan inclusiones en neuronas. Flecha en C indica inclusión en una neurona de Purkinje, punta de flecha indica una inclusión en un astrocito. Barra es igual a 25 μm.
Hipótesis molecular del FXTAS
El producto del gen FMR1 es la proteína FMRP. FMRP es una proteína citoplasmática de unión a ARN mensajero que facilita el transporte de este ARN a lo largo de las proyecciones neuronales para participar en la regulación de la transducción en los compartimentos sinápticos. FMRP juega un papel en muchos procesos celulares, particularmente en el desarrollo y el funcionamiento de dendritas y sinapsis (53).
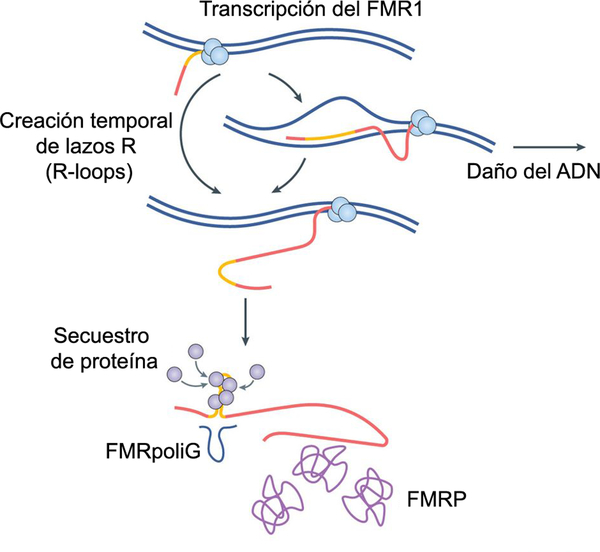
El mecanismo molecular del FXTAS no se conoce, pero se han propuesto al menos tres modelos de acción. El modelo primero sugiere que los ARN mensajeros con tripletes CGG en exceso se unen a una serie de proteínas bloqueando su función. Entre estas proteínas se encuentra el complejo DGCR8-Drosha, que regula la producción de micro-ARN (54). En este modelo el ARN mensajero de FMR1 se uniría al complejo DGCR8-Drosha, reduciendo los niveles de micro-ARN e incrementando los niveles de sus ARN precursores. El segundo modelo se basa en la “traducción RAN” del ARN mensajero de FMR1. Esto ocurre cuando los tripletes CGG permiten el inicio de la traducción en ausencia del codón AUG, produciendo error y el cese prematuro de la traducción (55). El péptido resultante conocido como FMRpolyG contiene una secuencia de poliglicinas que se cree son tóxicas para el cerebro (56–58) (figura 3). El tercer mecanismo se basa en el incremento de daño del ADN al nivel de los tripletes CGG, lo que produce la formación de lazos R (R-loops). Estos lazos producen que la cadena de ARN mensajero que se forma tenga un marco de lectura desplazado (1). Cómo uno o la combinación de estos posibles mecanismos inducen neurodegeneración no se conoce.
Figura 3.
Adaptado de Hagerman y Hagerman 2016. La transcripción de la región 5’ rica en tripletes CGG puede inducir la formación de lazos R (R loops), que incrementan la susceptibilidad de daño del ADN. El exceso de ARN mensajero del FMR1 puede formar estructuras secundarias a través de los tripletes CGG en la región no traducida. Estas estructuras pueden promover el secuestro de proteínas de unión a ARN e impedir la iniciación correcta de la traducción. La iniciación fuera de marco de la traducción crea péptidos ricos en poliglicina (poli-G). Estos tres mecanismos de acción son todavía una hipótesis y pueden ser únicos o complementarios.
El número de tripletes CGG del gen FMR1 tiende a incrementar de madre a hijo/a, produciendo una primera y/o segunda generación de portadores de la premutación y que por tanto pueden desarrollar FXTAS o FXPOI, y una segunda o tercera generación de portadores de la mutación completa y con FXS. El mecanismo detrás de este incremento generacional en el número de tripletes se desconoce, pero se hipotetiza que puede ser debido a un proceso anormal de replicación y/o a una alteración de reparación del ADN.
Zona gris - intermedia
Los alelos con hasta 55 repeticiones de CGG se consideran normales; sin embargo, existe un rango entre 41–54 repeticiones que se considera la zona gris o intermedia. No solo es posible la expansión del alelo en zona gris a premutación y mutación completa en las siguientes generaciones debido a la inestabilidad conocida de estos alelos (59) sino que también hay evidencia significativa de que estos alelos representan un factor de riesgo para presentar parkinsonismo tanto en hombres como en mujeres (60, 61) con algunos casos confirmados de FXTAS (62).
TRATAMIENTO
Desafortunadamente aún no hay reportes de ensayos clínicos controlados que demuestren eficacia completa en el tratamiento o reducción en la progresión de los síntomas del FXTAS. En 2014 Seritan y colaboradores reportaron que Memantina (antagonista del receptor NMDA), un medicamento aprobado en Estados Unidos para el tratamiento de la enfermedad de Alzheimer, no demostró eficacia en el tratamiento del temblor de intención o el déficit de la función ejecutiva en FXTAS (63); sin embargo, Yang et al. encontraron mejoría en la memoria de trabajo y la atención medida por potenciales de respuesta cerebral a estímulos sensoriales, cognitivos y motores (ERP) (64, 65). Del mismo modo, alopregnanolona, demostró una mejoría discreta de la función ejecutiva, el aprendizaje y la memoria en algunos de los pacientes (66); aún no se descarta su eficacia.
Para el manejo del temblor de intención se ha encontrado que los medicamentos usados en el tratamiento para temblor esencial como los anticonvulsivos primidona y levetiracetam, así como el beta bloqueador propanolol, tienen eficacia moderada en la mejoría del temblor en FXTAS (67, 68). Otros como topiramato, gabapentina, alprazolam, clonazepam también han sido estudiados con modestos resultados en muestras pequeñas (69–71). Otros bloqueadores beta como sotalol y atenolol pudieran también tener eficacia en el tratamiento. Sin embargo, son muchas las contraindicaciones y los efectos secundarios que deben contemplarse con el uso de estos medicamentos en adultos mayores de 50 años (24).
El parkinsonismo es reportado aproximadamente por el 60% de los pacientes; estos pueden beneficiarse del manejo farmacológico con carbidopa/levodopa obteniendo una mejoría similar a la que se describe en los pacientes con enfermedad de Parkinson. Sin embargo se han descrito efectos adversos como el empeoramiento del control motor, síntomas cognitivos y autonómicos, alucinaciones y letargia en individuos con FXTAS (24).
Las recomendaciones actuales también incluyen prevención y el manejo de los problemas médicos más comunes que contribuyen al deterioro y progresión de la patología neurológica; es por esa razón la importancia del diagnóstico de la premutación antes de la aparición de los signos patológicos del FXTAS. Los cambios en estilo de vida incluyendo actividad física y alimentación saludable, incluyendo el consumo de antioxidantes (Ej: té verde, omega-3) y suplementos vitamínicos para evitar deficiencias son considerados beneficiosos para la neurogénesis y la reducción del estrés oxidativo (1, 72). La prevención del déficit cognitivo incluye el manejo óptimo de los problemas médicos asociados a la premutación como hipertensión, migrañas, apnea del sueño y desórdenes tiroideos (tabla 2). Por otra parte, debe evitarse la exposición a neurotóxicos como el consumo crónico de alcohol y drogas recreativas, el contacto prolongado con pesticidas, el uso de anestésicos volátiles: como isoflurano y sevoflurano y el uso de opioides para el manejo del dolor crónico (9, 26–29) con el fin de evitar una aparición precoz de la patología y acelerar el desarrollo de la disfunción cognitiva, como se detalló anteriormente.
Tabla 2 –
Problemas de salud comunes en portadores de la premutación
| Diagnóstico | Prevalencia | Diagnóstico | Prevalencia |
|---|---|---|---|
| Déficit de memoria de trabajo | Sin | Problemas autoinmunes | |
| determinar | Sin FXTAS | 45–50% | |
| Con FXTAS | 72% | ||
| Autismo | 19% | Fibromialgia | |
| Mujeres Sin FXTAS | 8% | ||
| Mujeres Con FXTAS | 43% | ||
| Problemas de atención | Insuficiencia Ovárica | ||
| Hombres | 45–90% | Prematura asociada al X-frágil | |
| Mujeres | 20% | (FXPOI) | 20% |
| Mujeres | |||
| Discapacidad del desarrollo | 33% | Dolor crónico | |
| Mujeres sin FXTAS | 25% | ||
| Mujeres con FXTAS | 76% | ||
| Convulsiones | Apnea del sueño | ||
| Hombres | 11% | Sin FXTAS | 9% |
| Mujeres sin FXTAS | 1% | Con FXTAS | 31% |
| Mujeres con FXTAS | 22% | ||
| Desordenes de Ansiedad | 70% | Cefalea migrañosa | |
| Fobia Social | Hombres | 27% | |
| Desorden de ansiedad generalizada | Mujeres | 54% | |
| Desorden obsesivo-compulsivo | |||
| Desorden de Depresión Mayor | Hipertensión | ||
| Sin FXTAS | 40% | Sin FXTAS | 16–42% |
| Con FXTAS | 65% | Con FXTAS | 65 % |
| Neuropatía periférica | Deficit olfativo | Sin | |
| Hombres con FXTAS | 88% | determinar | |
| Mujeres con FXTAS | 53% | ||
El manejo de la patología psiquiátrica asociada es de suma importancia ya que su coexistencia también contribuye a progresión acelerada de la sintomatología del FXTAS. El trastorno de depresión mayor y/o ansiedad se diagnostica en aproximadamente el 50% de los portadores antes de la aparición del síndrome (73, 74). Los inhibidores selectivos de la recaptación de serotonina han demostrado eficacia en el manejo de depresión y ansiedad en estos pacientes (72, 74).
Se han reportado algunas técnicas de estimulación cerebral profunda, como la estimulación bilateral del tálamo ventral intermedio (75) y radiocirugía Gamma Knife (GK) (76, 77) que han demostrado eficacia parcial en la reducción del temblor sin mejoría en la ataxia. Sin embargo son inevitables los riesgos asumidos con dichas intervenciones. La investigación continúa tanto en el campo clínico como quirúrgico con el objetivo de mejorar la calidad de vida de los afectados y prolongar la supervivencia.
CONCLUSION
La naturaleza heterogénea del FXTAS convierte al síndrome en una patología tanto de difícil diagnóstico como tratamiento.. Es frecuente encontrar pacientes que han sido diagnosticados con otras patologías pero que presentan síntomas neurológicos comunes al FXTAS. Debe procurarse el tamizaje genético de los miembros de la familia inmediata al encontrar historia familiar de mutación en FMR1; también debe tenerse en cuenta como diagnóstico diferencial en pacientes que presentan ataxia cerebelosa, temblor de intención, parkinsonismo o demencia de causa desconocida o si hay hallazgos radiológicos compatibles con los criterios diagnósticos de FXTAS. La etiología es la base del consejogenético y de la valoración del riesgo de padecer FXTAS, FXPOI and FXAND en portadores de la premutación.
Acknowledgments
Conflictos de interés (o su inexistencia)
RH ha recibido fondos de Roche, Novartis, Neuren, Marinus y Alcobra para llevar a cabo estudios de tratamiento en pacientes con síndrome de X frágil. También ha consultado con Fulcrum, Ovid y Zynerba sobre estudios de tratamiento en individuos con síndrome de X frágil. Los demás autores declaran no tener conflictos de interés.
Ayudas o fuentes de financiación total o parcial
Esta investigación fue apoyada por el Instituto Nacional de Desordenes Neurológicos y Accidente Cerebrovascular (NINDS) – Grant 1NS107131, el Instituto Nacional de Salud Mental (NIMH) - Grant MH094681, el Instituto Nacional de Salud Infantil y Desarrollo Humano (NICHD) - Grants R01 HD036071 y U54 HD079125, el Instituto Médico de Investigación del Neurodesarrollo (MIND) de la Universidad de California, Davis y el Hospital Infantil Shriners. El contenido de este trabajo es responsabilidad exclusiva de los autores y no representa necesariamente las opiniones oficiales del NINDS o del NICHD. Además, dichas agencias no respaldan la compra de ningún producto o servicio comercial mencionado en la publicación.
BIBLIOGRAFÍA
- 1.Hagerman RJ, Hagerman P. Fragile X-associated tremor/ataxia syndrome - features, mechanisms and management. Nat Rev Neurol. 2016;12(7):403–12. [DOI] [PubMed] [Google Scholar]
- 2.Tassone F, Iong KP, Tong TH, Lo J, Gane LW, Berry-Kravis E, et al. FMR1 CGG allele size and prevalence ascertained through newborn screening in the United States. Genome Med. 2012;4(12):100. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Hagerman RJ, Leavitt BR, Farzin F, Jacquemont S, Greco CM, Brunberg JA, et al. Fragile-X-associated tremor/ataxia syndrome (FXTAS) in females with the FMR1 premutation. Am J Hum Genet. 2004;74(5):1051–6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Jacquemont S, Hagerman RJ, Leehey MA, Hall DA, Levine RA, Brunberg JA, et al. Penetrance of the fragile X-associated tremor/ataxia syndrome in a premutation carrier population. JAMA. 2004;291(4):460–9. [DOI] [PubMed] [Google Scholar]
- 5.Rodriguez-Revenga L, Madrigal I, Pagonabarraga J, Xuncla M, Badenas C, Kulisevsky J, et al. Penetrance of FMR1 premutation associated pathologies in fragile X syndrome families. Eur J Hum Genet. 2009;17(10):1359–62. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Tassone F, Hagerman RJ, Taylor AK, Gane LW, Godfrey TE, Hagerman PJ. Elevated levels of FMR1 mRNA in carrier males: a new mechanism of involvement in the fragile-X syndrome. Am J Hum Genet. 2000;66(1):6–15. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Hagerman RJ, Leehey M, Heinrichs W, Tassone F, Wilson R, Hills J, et al. Intention tremor, parkinsonism, and generalized brain atrophy in male carriers of fragile X. Neurology. 2001;57(1):127–30. [DOI] [PubMed] [Google Scholar]
- 8.Jacquemont S, Hagerman RJ, Leehey M, Grigsby J, Zhang L, Brunberg JA, et al. Fragile X premutation tremor/ataxia syndrome: molecular, clinical, and neuroimaging correlates. Am J Hum Genet. 2003;72(4):869–78. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Martinez-Cerdeno V, Lechpammer M, Lott A, Schneider A, Hagerman R. Fragile X-Associated Tremor/Ataxia Syndrome in a Man in His 30s. JAMA Neurol. 2015;72(9):1070–3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Schneider A, Johnston C, Tassone F, Sansone S, Hagerman RJ, Ferrer E, et al. Broad autism spectrum and obsessive-compulsive symptoms in adults with the fragile X premutation. Clin Neuropsychol. 2016;30(6):929–43. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Farzin F, Perry H, Hessl D, Loesch D, Cohen J, Bacalman S, et al. Autism spectrum disorders and attention-deficit/hyperactivity disorder in boys with the fragile X premutation. J Dev Behav Pediatr. 2006;27(2 Suppl):S137–44. [DOI] [PubMed] [Google Scholar]
- 12.Chonchaiya W, Au J, Schneider A, Hessl D, Harris SW, Laird M, et al. Increased prevalence of seizures in boys who were probands with the FMR1 premutation and co-morbid autism spectrum disorder. Hum Genet. 2012;131(4):581–9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Bailey DB Jr., Raspa M, Olmsted M, Holiday DB. Co-occurring conditions associated with FMR1 gene variations: findings from a national parent survey. Am J Med Genet A. 2008;146A(16):2060–9. [DOI] [PubMed] [Google Scholar]
- 14.Sherman SL. Premature ovarian failure in the fragile X syndrome. Am J Med Genet. 2000;97(3):189–94. [DOI] [PubMed] [Google Scholar]
- 15.Hagerman R, Protic D, Rajaratnam A, Salcedo-Arellano MJ, Aydin EY, Schneider A. Fragile X-associated Neuropsychiatric Disorders (FXAND). Frontiers in Psychiatry. 2018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Grigsby J, Brega AG, Jacquemont S, Loesch DZ, Leehey MA, Goodrich GK, et al. Impairment in the cognitive functioning of men with fragile X-associated tremor/ataxia syndrome (FXTAS). J Neurol Sci. 2006;248(1–2):227–33. [DOI] [PubMed] [Google Scholar]
- 17.Bourgeois JA, Coffey SM, Rivera SM, Hessl D, Gane LW, Tassone F, et al. A review of fragile X premutation disorders: expanding the psychiatric perspective. J Clin Psychiatry. 2009;70(6):852–62. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Roberts JE, Bailey DB Jr., Mankowski J, Ford A, Sideris J, Weisenfeld LA, et al. Mood and anxiety disorders in females with the FMR1 premutation. Am J Med Genet B Neuropsychiatr Genet. 2009;150B(1):130–9. [DOI] [PubMed] [Google Scholar]
- 19.Seritan AL, Bourgeois JA, Schneider A, Mu Y, Hagerman RJ, Nguyen DV. Ages of Onset of Mood and Anxiety Disorders in Fragile X Premutation Carriers. Curr Psychiatry Rev. 2013;9(1):65–71. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Seritan AL, Nguyen DV, Farias ST, Hinton L, Grigsby J, Bourgeois JA, et al. Dementia in fragile X-associated tremor/ataxia syndrome (FXTAS): comparison with Alzheimer’s disease. Am J Med Genet B Neuropsychiatr Genet. 2008;147B(7):1138–44. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Seritan AL, Kim K, Benjamin I, Seritan I, Hagerman RJ. Risk Factors for Cognitive Impairment in Fragile X-Associated Tremor/Ataxia Syndrome. J Geriatr Psychiatry Neurol. 2016;29(6):328–37. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Apartis E, Blancher A, Meissner WG, Guyant-Marechal L, Maltete D, De Broucker T, et al. FXTAS: new insights and the need for revised diagnostic criteria. Neurology. 2012;79(18):1898–907. [DOI] [PubMed] [Google Scholar]
- 23.Hall DA, Robertson E, Shelton AL, Losh MC, Mila M, Moreno EG, et al. Update on the Clinical, Radiographic, and Neurobehavioral Manifestations in FXTAS and FMR1 Premutation Carriers. Cerebellum. 2016;15(5):578–86. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Tassone F, Hall D. FXTAS, FXPOI, and Other Premutation Disorders. Second ed New York City: Springer International Publishing Switzerland; 2016. [Google Scholar]
- 25.Niu YQ, Yang JC, Hall DA, Leehey MA, Tassone F, Olichney JM, et al. Parkinsonism in fragile X-associated tremor/ataxia syndrome (FXTAS): revisited. Parkinsonism Relat Disord. 2014;20(4):456–9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Muzar Z, Adams PE, Schneider A, Hagerman RJ, Lozano R. Addictive substances may induce a rapid neurological deterioration in fragile X-associated tremor ataxia syndrome: A report of two cases. Intractable Rare Dis Res. 2014;3(4):162–5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Muzar Z, Lozano R, Schneider A, Adams PE, Faradz SM, Tassone F, et al. Methadone use in a male with the FMRI premutation and FXTAS. Am J Med Genet A. 2015;167(6):1354–9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Saldarriaga W, Salcedo-Arellano MJ, Rodriguez-Guerrero T, Rios M, Fandino-Losada A, Ramirez-Cheyne J, et al. Increased Severity of Fragile X Spectrum Disorders in the Agricultural Community of Ricaurte, Colombia. Int J Dev Neurosci. 2018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Ligsay A, El-Deeb M, Salcedo-Arellano MJ, Schloemerkemper N, Grayson JS, Hagerman R. General Anesthetic Use in Fragile X Spectrum Disorders. J Neurosurg Anesthesiol. 2018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Greco CM, Hagerman RJ, Tassone F, Chudley AE, Del Bigio MR, Jacquemont S, et al. Neuronal intranuclear inclusions in a new cerebellar tremor/ataxia syndrome among fragile X carriers. Brain. 2002;125(Pt 8):1760–71. [DOI] [PubMed] [Google Scholar]
- 31.Greco CM, Berman RF, Martin RM, Tassone F, Schwartz PH, Chang A, et al. Neuropathology of fragile X-associated tremor/ataxia syndrome (FXTAS). Brain. 2006;129(Pt 1):243–55. [DOI] [PubMed] [Google Scholar]
- 32.Louis E, Moskowitz C, Friez M, Amaya M, Vonsattel JP. Parkinsonism, dysautonomia, and intranuclear inclusions in a fragile X carrier: a clinical-pathological study. Mov Disord. 2006;21(3):420–5. [DOI] [PubMed] [Google Scholar]
- 33.Hall DA, Howard K, Hagerman R, Leehey MA. Parkinsonism in FMR1 premutation carriers may be indistinguishable from Parkinson disease. Parkinsonism Relat Disord. 2009;15(2):156–9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Berry-Kravis E, Abrams L, Coffey SM, Hall DA, Greco C, Gane LW, et al. Fragile X-associated tremor/ataxia syndrome: clinical features, genetics, and testing guidelines. Mov Disord. 2007;22(14):2018–30, quiz 140. [DOI] [PubMed] [Google Scholar]
- 35.Cohen S, Masyn K, Adams J, Hessl D, Rivera S, Tassone F, et al. Molecular and imaging correlates of the fragile X-associated tremor/ataxia syndrome. Neurology. 2006;67(8):1426–31. [DOI] [PubMed] [Google Scholar]
- 36.Tassone F, Adams J, Berry-Kravis EM, Cohen SS, Brusco A, Leehey MA, et al. CGG repeat length correlates with age of onset of motor signs of the fragile X-associated tremor/ataxia syndrome (FXTAS). Am J Med Genet B Neuropsychiatr Genet. 2007;144B(4):566–9. [DOI] [PubMed] [Google Scholar]
- 37.Leehey MA, Berry-Kravis E, Goetz CG, Zhang L, Hall DA, Li L, et al. FMR1 CGG repeat length predicts motor dysfunction in premutation carriers. Neurology. 2008;70(16 Pt 2):1397–402. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Berry-Kravis E, Potanos K, Weinberg D, Zhou L, Goetz CG. Fragile X-associated tremor/ataxia syndrome in sisters related to X-inactivation. Ann Neurol. 2005;57(1):144–7. [DOI] [PubMed] [Google Scholar]
- 39.Jacquemont S, Orrico A, Galli L, Sahota PK, Brunberg JA, Anichini C, et al. Spastic paraparesis, cerebellar ataxia, and intention tremor: a severe variant of FXTAS? J Med Genet. 2005;42(2):e14. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Adams JS, Adams PE, Nguyen D, Brunberg JA, Tassone F, Zhang W, et al. Volumetric brain changes in females with fragile X-associated tremor/ataxia syndrome (FXTAS). Neurology. 2007;69(9):851–9. [DOI] [PubMed] [Google Scholar]
- 41.Pretto D, Yrigollen CM, Tang HT, Williamson J, Espinal G, Iwahashi CK, et al. Clinical and molecular implications of mosaicism in FMR1 full mutations. Front Genet. 2014;5:318. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Pretto DI, Mendoza-Morales G, Lo J, Cao R, Hadd A, Latham GJ, et al. CGG allele size somatic mosaicism and methylation in FMR1 premutation alleles. J Med Genet. 2014;51(5):309–18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Rajaratnam A, Shergill J, Salcedo-Arellano M, Saldarriaga W, Duan X, Hagerman R. Fragile X syndrome and fragile X-associated disorders. F1000Res. 2017;6:2112. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Hashimoto R, Javan AK, Tassone F, Hagerman RJ, Rivera SM. A voxel-based morphometry study of grey matter loss in fragile X-associated tremor/ataxia syndrome. Brain. 2011;134(Pt 3):863–78. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Hashimoto R, Srivastava S, Tassone F, Hagerman RJ, Rivera SM. Diffusion tensor imaging in male premutation carriers of the fragile X mental retardation gene. Mov Disord. 2011;26(7):1329–36. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Famula JL, McKenzie F, McLennan YA, Grigsby J, Tassone F, Hessl D, et al. Presence of Middle Cerebellar Peduncle Sign in FMR1 Premutation Carriers Without Tremor and Ataxia. Front Neurol. 2018;9:695. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Shelton AL, Wang JY, Fourie E, Tassone F, Chen A, Frizzi L, et al. Middle Cerebellar Peduncle Width-A Novel MRI Biomarker for FXTAS? Front Neurosci. 2018;12:379. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Ariza J, Rogers H, Monterrubio A, Reyes-Miranda A, Hagerman PJ, Martinez-Cerdeno V. A Majority of FXTAS Cases Present with Intranuclear Inclusions Within Purkinje Cells. Cerebellum. 2016;15(5):546–51. [DOI] [PubMed] [Google Scholar]
- 49.Hunsaker MR, Greco CM, Spath MA, Smits AP, Navarro CS, Tassone F, et al. Widespread non-central nervous system organ pathology in fragile X premutation carriers with fragile X-associated tremor/ataxia syndrome and CGG knock-in mice. Acta Neuropathol. 2011;122(4):467–79. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Martínez-Cerdeño V, Hong T, Amina S, Lechpammer M, Ariza J, Tassone F, et al. Microglial cell activation and senescence are characteristic of the pathology FXTAS. Movement Disorders. 2018;In press. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Rogers H, Ariza J, Monterrubio A, Hagerman P, Martinez-Cerdeno V. Cerebellar Mild Iron Accumulation in a Subset of FMR1 Premutation Carriers with FXTAS. Cerebellum. 2016;15(5):641–4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Ariza J, Steward C, Rueckert F, Widdison M, Coffman R, Afjei A, et al. Dysregulated iron metabolism in the choroid plexus in fragile X-associated tremor/ataxia syndrome. Brain Res. 2015;1598:88–96. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Dockendorff TC, Labrador M. The Fragile X Protein and Genome Function. Mol Neurobiol. 2018. [DOI] [PubMed] [Google Scholar]
- 54.Sellier C, Freyermuth F, Tabet R, Tran T, He F, Ruffenach F, et al. Sequestration of DROSHA and DGCR8 by expanded CGG RNA repeats alters microRNA processing in fragile X-associated tremor/ataxia syndrome. Cell Rep. 2013;3(3):869–80. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Green KM, Linsalata AE, Todd PK. RAN translation-What makes it run? Brain Res. 2016;1647:30–42. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Hukema RK, Buijsen RA, Schonewille M, Raske C, Severijnen LA, Nieuwenhuizen-Bakker I, et al. Reversibility of neuropathology and motor deficits in an inducible mouse model for FXTAS. Hum Mol Genet. 2015;24(17):4948–57. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Todd PK, Oh SY, Krans A, He F, Sellier C, Frazer M, et al. CGG repeat-associated translation mediates neurodegeneration in fragile X tremor ataxia syndrome. Neuron. 2013;78(3):440–55. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Oh SY, He F, Krans A, Frazer M, Taylor JP, Paulson HL, et al. RAN translation at CGG repeats induces ubiquitin proteasome system impairment in models of fragile X-associated tremor ataxia syndrome. Hum Mol Genet. 2015;24(15):4317–26. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Nolin SL, Brown WT, Glicksman A, Houck GE Jr., Gargano AD, Sullivan A, et al. Expansion of the fragile X CGG repeat in females with premutation or intermediate alleles. Am J Hum Genet. 2003;72(2):454–64. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Loesch DZ, Tassone F, Lo J, Slater HR, Hills LV, Bui MQ, et al. New evidence for, and challenges in, linking small CGG repeat expansion FMR1 alleles with Parkinson’s disease. Clin Genet. 2013;84(4):382–5. [DOI] [PubMed] [Google Scholar]
- 61.Loesch DZ, Tassone F, Mellick GD, Horne M, Rubio JP, Bui MQ, et al. Evidence for the role of FMR1 gray zone alleles as a risk factor for parkinsonism in females. Mov Disord. 2018;33(7):1178–81. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Hall D, Tassone F, Klepitskaya O, Leehey M. Fragile X-associated tremor ataxia syndrome in FMR1 gray zone allele carriers. Mov Disord. 2012;27(2):296–300. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Seritan AL, Nguyen DV, Mu Y, Tassone F, Bourgeois JA, Schneider A, et al. Memantine for fragile X-associated tremor/ataxia syndrome: a randomized, double-blind, placebo-controlled trial. J Clin Psychiatry. 2014;75(3):264–71. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Yang JC, Niu YQ, Simon C, Seritan AL, Chen L, Schneider A, et al. Memantine effects on verbal memory in fragile X-associated tremor/ataxia syndrome (FXTAS): a double-blind brain potential study. Neuropsychopharmacology. 2014;39(12):2760–8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.Yang JC, Rodriguez A, Royston A, Niu YQ, Avar M, Brill R, et al. Memantine Improves Attentional Processes in Fragile X-Associated Tremor/Ataxia Syndrome: Electrophysiological Evidence from a Randomized Controlled Trial. Sci Rep. 2016;6:21719. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Wang JY, Trivedi AM, Carrillo NR, Yang J, Schneider A, Giulivi C, et al. Open-Label Allopregnanolone Treatment of Men with Fragile X-Associated Tremor/Ataxia Syndrome. Neurotherapeutics. 2017;14(4):1073–83. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Hall DA, Berry-Kravis E, Hagerman RJ, Hagerman PJ, Rice CD, Leehey MA. Symptomatic treatment in the fragile X-associated tremor/ataxia syndrome. Mov Disord. 2006;21(10):1741–4. [DOI] [PubMed] [Google Scholar]
- 68.Saponara R, Greco S, Proto G, Trubia T, Domina E. Levetiracetam improves intention tremor in fragile x-associated tremor/ataxia syndrome. Clin Neuropharmacol. 2009;32(1):53–4. [DOI] [PubMed] [Google Scholar]
- 69.Connor GS. A double-blind placebo-controlled trial of topiramate treatment for essential tremor. Neurology. 2002;59(1):132–4. [DOI] [PubMed] [Google Scholar]
- 70.Ondo W, Hunter C, Vuong KD, Schwartz K, Jankovic J. Gabapentin for essential tremor: a multiple-dose, double-blind, placebo-controlled trial. Mov Disord. 2000;15(4):678–82. [DOI] [PubMed] [Google Scholar]
- 71.Zesiewicz TA, Elble RJ, Louis ED, Gronseth GS, Ondo WG, Dewey RB Jr., et al. Evidence-based guideline update: treatment of essential tremor: report of the Quality Standards subcommittee of the American Academy of Neurology. Neurology. 2011;77(19):1752–5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.Polussa J, Schneider A, Hagerman R. Molecular Advances Leading to Treatment Implications for Fragile X Premutation Carriers. Brain Disord Ther. 2014;3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.Bourgeois JA, Seritan AL, Casillas EM, Hessl D, Schneider A, Yang Y, et al. Lifetime prevalence of mood and anxiety disorders in fragile X premutation carriers. J Clin Psychiatry. 2011;72(2):175–82. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 74.Besterman AD, Wilke SA, Mulligan TE, Allison SC, Hagerman R, Seritan AL, et al. Towards an Understanding of Neuropsychiatric Manifestations in Fragile X Premutation Carriers. Future Neurol. 2014;9(2):227–39. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 75.Weiss D, Mielke C, Wachter T, Bender B, Liscic RM, Scholten M, et al. Long-term outcome of deep brain stimulation in fragile X-associated tremor/ataxia syndrome. Parkinsonism Relat Disord. 2015;21(3):310–3. [DOI] [PubMed] [Google Scholar]
- 76.Higuchi Y, Matsuda S, Serizawa T. Gamma knife radiosurgery in movement disorders: Indications and limitations. Mov Disord. 2017;32(1):28–35. [DOI] [PubMed] [Google Scholar]
- 77.Alster P, Koziorowski DM, Za Bek M, Dzierzecki S, Ma Dry J, Duszynska-Wa SK, et al. Making a Difference-Positive Effect of Unilateral VIM Gamma Knife Thalamotomy in the Therapy of Tremor in Fragile X-Associated Tremor/Ataxia Syndrome (FXTAS). Front Neurol. 2018;9:512. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.Coffey SM, Cook K, Tartaglia N, Tassone F, Nguyen DV, Pan R, et al. Expanded clinical phenotype of women with the FMR1 premutation. Am J Med Genet A. 2008;146A(8):1009–16. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.Hamlin A, Liu Y, Nguyen DV, Tassone F, Zhang L, Hagerman RJ. Sleep apnea in fragile X premutation carriers with and without FXTAS. Am J Med Genet B Neuropsychiatr Genet. 2011;156B(8):923–8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 80.Jalnapurkar I, Rafika N, Tassone F, Hagerman R. Immune mediated disorders in women with a fragile X expansion and FXTAS. Am J Med Genet A. 2015;167A(1):190–7. [DOI] [PMC free article] [PubMed] [Google Scholar]