Abstract
Objectifs :
L’étiopathogénie du trouble bipolaire (TB) demeure non encore bien élucidée. Récemment, il a été prouvé que la 25-hydroxy-vitamine D(25OHD) a un rôle anti-inflammatoire et neuroprotecteur.
Nos objectifs étaient de mesurer les concentrations plasmatiques de la 25OHD chez des patients atteints de TB en décompensation aigue et de les comparer à celles de patients souffrant de schizophrénie (SCZ) ou de trouble schizo-affectif (TSA) et à celles de témoins sains
Méthodes :
Il s’agissait d’une étude transversale de type cas-témoins qui a inclus des patients de sexe masculin hospitalisés pour une décompensation de leur maladie et chez qui les diagnostics de TB, SCZ, ou de TSA ont été retenus selon les critères du (DSM-5). Le groupe témoin a été constitué de sujets sains non apparentés, appariés selon l’age et le sexe.
Résultats :
La concentration de la 25OHD était significativement plus élevée uniquement chez les patients atteints de TB par rapport aux témoins. la 25OHD était aussi corrélée positivement à l’échelle PANSS (r = 0.282, p < 0.001) et aux différents scores de l’échelle MOCA (r = 0.326, p = 0.006) ainsi qu’aux dimensions concernant la capacité d’abstraction, d’attention et la mémoire .
A l’analyse multivariée, la décompensation aigue du TB était liée de manière indépendante à l’élévation de la 25OHD plasmatique (p = 0.012; OR = 1.157, [1.032 -1.297]).
Conclusion :
Notre étude a montré que la décompensation aigue des TB était associée à une élévation de la synthèse de la 25OHD plasmatique. Toutefois, la pertinence du dosage de la vitamine D comme biomarqueur de cette maladie mérite d’être vérifiée par d’autres études.
Keywords: vitamine D, CRP ultrasensible, trouble bipolaire, schizophrénie, biomarqueur
Abstract
Objectives:
Bipolar disorder (BD) etiopathogenesis is still not well elucidated. It has recently been proven that 25-hydroxy vitamin D (25OHD) has an anti-inflammatory and neuroprotective role. Our objectives were to measure 25OHD plasma levels in patients with BD in acute decompensation and compare them with patients with schizophrenia (SCZ) or schizoaffective disorder (SAD) and with healthy controls.
Methods:
This is a cross-sectional case-control study including male inpatients with a decompensation of their disease who were diagnosed with BD, SCZ or SAD according to DSM-5 criterias. The control group was constituted by unrelated healthy subjects, age-and-sex matched.
Results:
The 25OHD level was significantly higher only in patients with BD compared to controls. 25OHD was also positively correlated to the PANSS scale (r = 0.282, p < 0.001) and to different MOCA scores (r = 0.326, p = 0.006) as well as aspects related to abstraction, attention and memory capacity. Multivariate analysis found that BD acute decompensation was independently related to the rise in plasma 25OHD (p = 0.012; OR =1.157, [1.032 -1.297]).
Conclusion:
Our study shows that BD acute decompensation is associated with the rise in plasma 25OHD synthesis. However, the vitamin D dosage relevance as a biomarker of this disease warrants a verification in other studies.
Keywords: vitamine D, CRP ultrasensible, trouble bipolaire, schizophrenie, biomarqueur
Introduction
Le trouble bipolaire (TB) est un des troubles mentaux les plus sévères que l’OMS situe au sixième rang des pathologies les plus invalidantes.1 Des progrès considérables ont été réalisés dans la compréhension de sa physiopathologie et son traitement. Pourtant, trop nombreux sont encore les patients qui n’en bénéficient pas, faute d’un diagnostic précoce.2 En effet, la prévalence du trouble bipolaire serait encore largement sous-estimée au profit de celles de la schizophrénie et de la dépression unipolaire.2
L’identification de biomarqueurs pour ce trouble pourrait être d’un grand apport pour le dépistage et la prévention.3
Des études épidémiologiques et expérimentales récentes ont permis d’identifier de nombreux sites d’action de la vitamine D (25-hydroxy-vitamine D: 25OHD), dont en particulier les système musculaire, cardiovasculaire, immunitaire et, tout récemment sur le système nerveux central (SNC).4,5
La 25OHD et sa protéine porteuse, la vitamin D Binding protein (VDBP), ont été impliquées dans la physiopathologie de certaines maladies neurodégénératives comme la sclérose en plaque, et de certains troubles psychiatriques tels que la dépression.6,7 Dans une étude récente menée par Petrov et al. en Amérique du nord, les taux plasmatiques de ces deux marqueurs étaient plus élevés chez des patients suivis pour trouble bipolaire (TB) par rapport à des témoins.8 Vu que la latitude compte parmi les facteurs qui déterminent le taux de vitamine D,9 il serait intéressant de reproduire cette étude dans d’autres zones géographiques, notamment la région MENA (Middle East-North Africa: MENA) qui constitue l’une des zones où les taux de vitamine D sont les plus bas.10 A ce sujet, certains auteurs11 ont fait remarquer qu’aucun des guidelines disponibles concernant les taux sériques recommandés et la supplémentation de vitamine D ne s’est basé sur une revue systématique rigoureuse dans la région MENA. Ils se sont plutôt basés sur des avis d’experts et des revues d’études occidentales. Selon ces études, l’évaluation du statut vitaminique D est aisément réalisée par le dosage de la forme circulante, de réserve, qui est la 25-hydroxy-vitamine D plasmatique.12 La concentration optimale recommandée de 25OHD par un panel d’experts, depuis 2010, est de de 30 ng/mL à 70 ng/mL (75 à 175 nmol/L). Au-dessous de ce seuil, l’hypovitaminose D est alors retenue.12–14
Dans ce travail, nous nous sommes proposés de mesurer les concentrations plasmatiques de la 25OHD chez des patients tunisiens atteints de TB en décompensation aigue et de les comparer à celles de patients souffrant de SCZ ou de trouble schizo-affectif (TSA) décompensés ainsi qu’à celles d’une population de témoins sains.
Méthodes
Notre étude était transversale, de type cas-témoins. Elle a été menée durant 26 mois (Juin 2016 – juillet 2018) à Sfax en Tunisie, au service de psychiatrie C du Centre Hospitalo-Universitaire (CHU) HédiChaker à Sfax, en collaboration avec le Laboratoire de Biochimie du Centre Hospitalo-Universitaire Habib Bourguiba à Sfax, en Tunisie.
– Patients
Critères D’inclusion
L’étude a porté sur des patients de sexe masculin qui ont été hospitaliés pour une décompensation de leur maladie et chez qui les diagnostics de TB, SCZ, ou de TSA ont été retenus selon les critères du Diagnostic And Statistical Manual Of Mental Disorders, 5ème édition (DSM-5).15,16
Ont été exclus de cette étude:
■ Les patients ayant reçu un médicament psychotrope durant les trois mois précédant l’hospitalisation.
■ Les patients ayant des antécédents d’accident vasculaire cérébral ou un traumatisme crânien, et ceux atteints de déficience intellectuelle ou une démence.
■ Les patients en état d’agitation extrême ayant nécessité la mise immédiate sous traitement antipsychotique avant le prélèvement biologique.
Nous avons retenu pour l’étude exhaustivement les 100 premiers malades qui remplissaient les critères requis.
Pour chaque patient, une fiche préétablie au cours d’une entrevue individuelle a été remplie. Elle comportait des items relatifs:
■ à certaines données sociodémographiques;
■ aux antécédents personnels et familiaux;
■ à certaines caractéristiques de la maladie;
■ à l’examen physique.
– Témoins
Des témoins « en bonne santé physique et mentale », non apparentés, ont été choisis après avoir réalisé un entretien psychologique et un examen clinique. Les témoins ont été appariés avec les patients selon l’âge et le sexe.
Outils Psychométriques
⋄ Evaluation de la sévérité des symptômes psychotiques
Elle a été réalisée à l’aide de l’échelle Positive and Negative Syndrome Scale (PANSS).17 Elle permet de calculer les scores de trois dimensions syndromiques: échelle des symptômes positive (en 7 items), échelles des symptômes négatifs (en 7 items) et échelle de psychopathologie générale (en=16 items).
⋄ Evaluation de la manie
Elle a été réalisée à l’aide de l’échelle de manie de Bech et Rafaelsen (MAS).18 Elle comprend 11 items coté chacun de 0 à 4 avec un score total de 0 à 44. Selon l’étude de Bech P et al.19, on a divisé l’échelle MAS en deux catégories selon le score total comme suit:
■ Episode maniaque d’intensité modérée: MAS ≤ 21.
■ Episode maniaque d’intensité marquée à sévère: MAS > 21.
⋄ Evaluation de la dépression
Elle a été réalisée à l’aide du « Montgomery-AsbergDepression Rating Scale » (MADRS).17
L’échelle comporte 10 items cotés de 0 à 6. Le patient est considéré:
* Sain: si score < 6 points;
* En dépression légère: si score entre 7 et 19 points;
* En dépression moyenne: si score entre 20 et 34 points;
* En dépression sévère: si score > 34 points.
⋄ Evaluation cognitive
Elle a été réalisée à l’aide du Montreal Cognitive Assessment (MoCA).17 Le temps d’exécution est de dix minutes approximativement. un score supérieur ou égal à 26 est considéré normal.20
Exploration Biologique
A l’admission, chaque patient a bénéficié d’un prélèvement sanguin après au moins 12 heures de jeûne, avant tout traitement antipsychotique, à 8 h du matin. Si l’état du patient nécessitait une contention chimique durant la période précédant le prélèvement, dans ce cas une benzodiazépine (diazépam ou clonazépam) était prescrite de façon ponctuelle.
Les différents dosages ont été effectués au laboratoire de Biochimie du CHU Habib Bourguiba, Sfax.
Le bilan biologique a compris un:
– Bilan métabolique
Le bilan métabolique comportait: glycémie, acide urique (AUR), lactate déshydrogénase (LDH), créatine phosphokinase (CPK), urée, créatinine, Aspartate Aminotransférase (ASAT), Alanine Aminotransférase (ALAT), protidémie totale (PT), calcémie, phosphorémie, phosphatase alcalines (PAL), triglycéridémie (TG), cholestérol total (CT), high densitylipoprotein cholestérol (HDL-C), lowdensitylipoprotein cholestérol (LDL-C) et la protéine C réactive ultrasensible (CRP us).
Le LDL-C a été estimé par la formule de Friedewald21:
LDL-C(mmol/l) = CT–(HDL-C+TG/2.2) en mmol/l (si TG ≤4.56 mmol/l).
La clairance de la créatinine (CCR) a été calculée par la formule de Modification of Diet in RenalDisease (MDRD)22 pour estimer le débit de la filtration glomérulaire (DFG):
DFG = 175 x Créatinine -1,154 x âge -0,203 (mL/min)
La fonction rénale est considérée comme normale lorsque le DFG ≥ 90 mL/min
Les échantillons ont été rapidement acheminés au laboratoire, centrifugés et conservés à – 20°C. Le plasma a été conservé à -20°C jusqu’au jour de dosage.
Le dosage des différents paramètres biochimiques a été réalisé sur COBAS C 6000 (module C501), Roche Diagnostics, Allemagne.
– Dosage de la 25OH D plasmatique
Le dosage de la 25OHD plasmatique a été effectué par technique électrochimiluminescence (ECLIA), Cobas 6000, Roche®
L’analyse Statistique
L’analyse statistique a été réalisée avec le logiciel: Statistical Package for Social Science (SPSS) de Windows (version 20.0).
Les variables quantitatives ont été exprimées en moyennes ± écart type, comparées par le test de Student pour les échantillons non appariés, et corrélées par le test de Pearson si la distribution est gaussienne. Les comparaisons de groupes multiples ont été réalisées par le test ANOVA complété, en cas de résultat significatif, par une étude post HOC (test de Tukey).
On a considéré que lorsque l’effectif était grand (n ≥ 30), la variable suit la loi normale.23 Le seuil de 0,05 a été utilisé pour juger la significativité des tests statistiques. Les variables qualitatives ont été exprimées sous forme de fréquences et de pourcentages. Elles ont été analysées par le test de Khi2 ou par le test exact de Fisher chaque fois que l’un des effectifs est faible.
L’étude multivariée a été réalisée par le test de régression logistique binaire. L’adéquation du modèle final a été vérifiée selon le test de Hosmer et Lemeshow. Les résultats du risque ont été exprimés par les Odds Ratio ajustés (OR) avec leurs intervalles de confiance à 95% (IC 95%). La différence était considérée comme significative si p < 0,05.
Résultats
Cent patients ont été inclus dans l’étude: 45 cas de SCZ, 34 cas de TB (type 1, n = 30; type 2, n = 3; non spécifié, n = 1) et 21 cas de TSA (type bipolaire, n = 19; type dépressif, n = 3).
Tous les patients ont été admis suite à une décompensation aigue de leur trouble qui a nécessité leur hospitalisation, c’est-à-dire soit des troubles graves du comportement soit un risque suicidaire élevé. Par rapport aux témoins, la plupart des patients étaient d’origine rurale, de niveau socio-économique plus bas, moins scolarisés, moins actifs sur le plan professionnel et leur soutien familial était moins bon (Tableau 1). En particulier, l’origine rurale était plus fréquente chez les patients atteints de schizophrénie (44%; n = 20) que chez ceux souffrant de trouble bipolaire (32%; n = 11, Tableau S1).
Tableau 1.
Caractéristiques Sociodémographiques Chez les Patients par Rapport aux Témoins.
| Caractéristiques sociodémographiques | Patients N=100 |
Témoins N=100 |
P | |
|---|---|---|---|---|
| Age moyen | 35.21 ± 11.08 | 33.09 ± 9.48 | 0.147 | |
| Origine géographique | Rurale | 38 (38%) | 0 | <0,001 |
| Urbaine | 55 (55%) | 100 (100%) | ||
| Non précisé | 7 (7%) | -- | ||
| Statut marital | Non marié | 84 (84%) | 51 (51%) | <0,001 |
| Marié | 16 (16%) | 49 (49%) | ||
| Soutient familial | Bon | 69 (69%) | 100 (100%) | <0,001 |
| Mauvais | 22 (22%) | 0 | ||
| Non précisé | 9 (9%) | -- | ||
| Niveau socio- économique | Bas | 59 (59%) | 1 (1%) | <0,001 |
| Moyen | 27 (27%) | 92 (92%) | ||
| Elevé | 3 (3%) | 7 (7%) | ||
| Non précisé | 11 (11%) | -- | ||
| Niveau scolaire | Non scolarisé | 15 (15%) | 0 | <0,001 |
| Primaire | 33 (33%) | 17 (17%) | ||
| Secondaire | 33 (33%) | 18 (18%) | ||
| Universitaire | 19 (19%) | 65 (65%) | ||
| Statut professionnel | Actif | 32 (32%) | 96 (96%) | <0,001 |
| Inactif | 68 (68%) | 4 (4%) | ||
L’âge moyen des patients était de 35,47 ± 11,32 ans avec des extrêmes de 18 ans et 70 ans. Il n’y avait pas de différence significative concernant l’âge entre l’ensemble des patients et les témoins (Tableau 2).
Tableau 2.
Profils Anthropométrique et Métabolique des Groupes Étudiés.
| Paramètres | SCZ n = 45 |
TB n=34 |
TSA n=21 |
Témoins n=100 |
p |
|---|---|---|---|---|---|
| Age (ans) | 37,38 ± 11,28 | 37,03 ± 12,62 | 28,86 ± 5,82 | 32,83 ± 9,62 | 0.371 |
| IMC (Kg/m2) | 22,83 ± 4,42 | 22,59 ± 4,66 | 22,94 ± 5,78 | 23,81 ± 2,35 | 0,363 |
| Glucose (mmol/L) | 4,63 ± 0,92 | 5,20 ± 1,01 | 5,00 ± 1,27 | 5,31 ± 0,81 | 0,393 |
| CT (mmol/L) | 3,77 ± 0,71a | 3,55 ± 0,73b | 3,94 ± 0,53c | 4,25 ± 0,94 | <0,001 |
| TG (mmol/L) | 1,11 ± 0,58 | 0,93 ± 0,37 | 0,85 ± 0,25 | 1,17 ± 0,61 | 0,059 |
| HDL-C (mmol/L) | 1,14 ± 0,43 | 1,19 ± 0,27 | 1,18 ± 0,39 | 1,12 ± 0,27 | 0,792 |
| LDL-C (mmol/ml) | 2,14 ± 0,65a | 1,92 ± 0,70b | 2,36 ± 0,51 | 2,65 ± 0,76 | <0,001 |
| Urée(µmol/L) | 4,62 ± 1,66 | 4,33 ± 1,25 | 4,98 ± 2,12 | 5,07 ± 1,38 | 0,351 |
| Créatinine (µmol/L) | 66,37 ± 14,85a | 70,20 ± 13,58b | 70,23 ± 8,30c | 76,83 ± 11,09 | <0,001 |
| CCR (mL/min) | 136,32 ± 46,64a | 123,78 ± 26,57b | 140,79 ± 35,22c | 109,52 ± 19,39 | <0,001 |
| ASAT (UI/L) | 33,74 ± 23,54a | 35,24 ± 23,23b | 32,71 ± 16,00c | 22,21 ± 6,92 | <0,001 |
| ALAT (UI/L) | 18,72 ± 14,01 | 21,57 ± 20,82 | 22,49 ± 16,94 | 20,66 ± 11,13 | 0,706 |
| CPK (UI/L) | 790,97 ± 1015,11a | 961,41 ± 1167,16b | 793,90 ± 798,20c | 167,05 ± 132,69 | <0,001 |
| LDH (UI/L) | 253,74 ± 124,43 | 238,82 ± 119,52 | 284,95 ± 219,30c | 205,99 ± 73,74 | 0,014 |
| CRP us (mg/L) | 6,28 ± 16,45 | 8,87 ± 17,04b | 6,28 ± 17,44 | 1,77 ± 1,86 | 0,012 |
| AUR (µmol/L) | 282,5 ± 67,8a | 299,1 ± 49,9 | 270,0 ± 72,3c | 316,2 ± 64,2 | 0,004 |
| PT (mg/ml) | 67,75 ± 8,99a | 68,87 ± 7,17 | 65,09 ± 10,00c | 72,31 ± 9,91 | <0,001 |
| Calcémie (mmol/L) | 2.19 ± 0.26a | 2.29 ± 0.22 | 2.27 ± 0.24 | 2.33 ± 0.14 | 0.007 |
| Phosphorémie (mmol/L) | 0.96 ± 0.17a | 1.02 ± 0.23 | 1.04 ± 0.17 | 1.07 ± 0.16 | 0.014 |
| PAL(UI/L) | 75.8 ± 29.5 | 68.67 ± 19.4 | 67.8 ± 1.9 | 67.4 ± 15.3 | 0.198 |
| 25OHD (ng/mL) | 22.4 ± 10.7 | 26.43 ± 11.14 b | 23.39 ± 9.82 | 19.87 ± 7.19 | 0.005 |
a: différence significative entre Témoins et SCZ, b: différence significative entre Témoins et TB, c: différence significative entre Témoins et TSA, IMC: indice de masse corporelle, AUR: acide urique, LDH: lactate déshydrogénase, CPK: créatine phosphokinase, ASAT: Aspartate Aminotransférase, ALAT: Alanine Aminotransférase, PT: protidémie totale, PAL: phosphatase alcalines, TG: triglycéridémie, CT: cholestérol total, HDL-C: high densitylipoprotein cholestérol, LDL-C: lowdensitylipoprotein cholestérol, CRP us: protéine C réactive ultrasensible.
Les comparaisons des paramètres anthropométriques et métaboliques entre les différentes populations de notre étude sont résumées dans le Tableau 2. Il n’y avait pas de différence significative entre les différents groupes et entre les malades et les témoins concernant l’IMC, la glycémie, le taux de TG ou HDL-C.
Les taux de CT, du LDL-C, de l’AUR et des PT étaient significativement plus bas chez les patients par rapport aux témoins (Tableau 2). La CRP us était plus élevée chez l’ensemble des malades par rapport aux témoins et significativement plus élevée chez les bipolaires comparativement aux témoins (Tableau 2) .
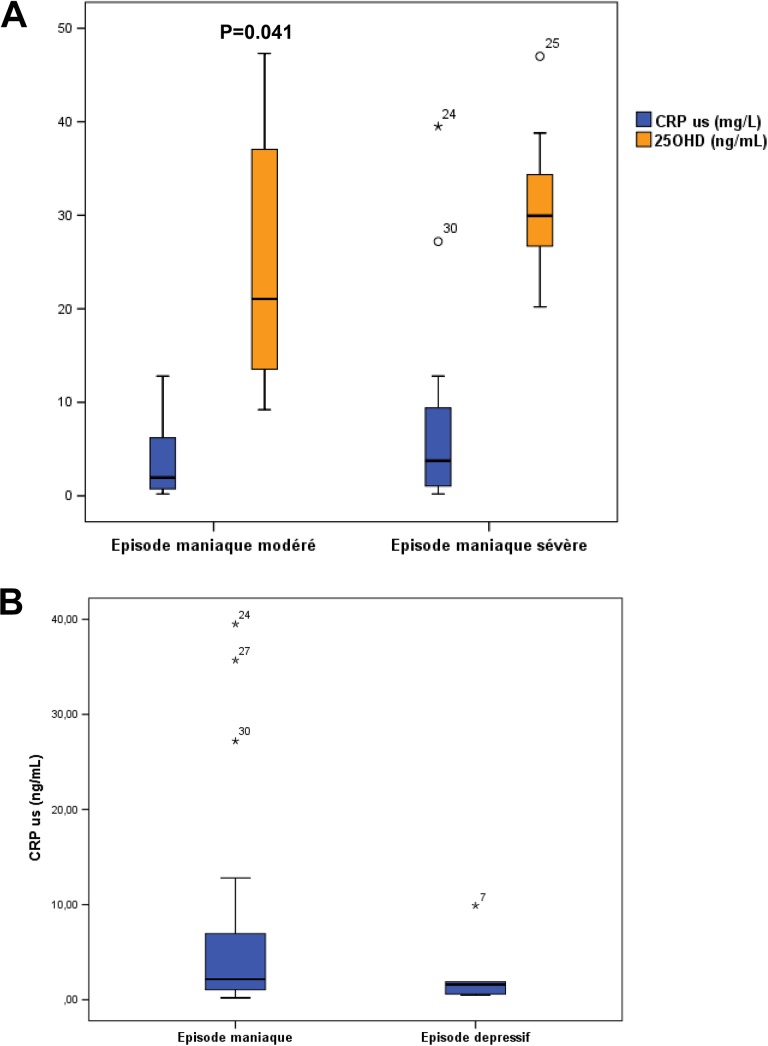
La concentration de la 25OHD était significativement plus élevée chez les patients atteints de TB par rapport aux témoins (Tableau 2). Elle était significativement plus élevée chez les patients en épisode maniaque d’intensité marquée à sévère (en se basant sur le score MAS > 21; n = 12) par rapport à ceux en épisode maniaque modéré (score MAS ≤21; n = 13) (25OHD: 31.16 ± 7.46 ng/mL vs 23.8 ± 11.9 ng/mL, p = 0.041; Figure 1A). Par contre, il n’y avait pas de différence significative entre les bipolaires en épisode maniaque (n = 29) et ceux en épisode dépressif (n = 5) (25OHD: 26.19 ± 8.85 ng/mL vs 26.93 ± 12.9 ng/mL, p = 0.840). Les patients en épisode maniaque avaient des taux de CRP us plus élevés par rapport aux patients en épisode dépressif (7.43 ± 11.04 mg/L vs 2.90 ± 3.96 mg/L, p = 0.435, Figure 1B).
Figure 1.
A: Variation de la concentration de la 25OHD et de la CRP us chez les patients TB en épisode manique modéré par rapport à ceux en épisode maniaque modéré à intense selon l’échelle de manie de Bech et Rafaelsen (MAS); B: Variation de la concentration de la CRP us chez les patients TB à l’admission selon la nature de l’épisode maniaque ou dépressif.CRP us: CRP ultrasensible, 25OHD: vitamine D, SCZ: schizophrénie, TB: trouble bipolaire, TSA: trouble schizoaffectif.
La 25OHD était aussi corrélée positivement à l’échelle PANSS (r = 0.282, p < 0.001, Tableau 3) et aux différents scores de l’échelle MOCA (Tableau 3) ainsi qu’aux dimensions concernant la capacité d’abstraction (r = 0,245; p = 0,041), d’attention (r = 0.256, p = 0.032) et la mémoire (r = 0,242; p = 0.04, Tableau 3).
Tableau 3.
Matrice de Corrélation des Paramètres Métaboliques, de la Vitamine D et les Différentes Échelles Psychométriques Chez la Population D’étude.
| Age (ans) | IMC (kg/m2) | CRP us (mg/L) | 25OHD (ng/mL) | Abstraction | Attention | Mémoire | PANSS | MOCA | ||
|---|---|---|---|---|---|---|---|---|---|---|
| Age (ans) | r | |||||||||
| p | ||||||||||
| IMC (kg/m2) | r | 0,228* | ||||||||
| p | 0,004 | |||||||||
| CRP us (mg/L) | r | 0,048 | 0,006 | |||||||
| p | 0,498 | 0,939 | ||||||||
| 25OHD (ng/mL) | r | 0,026 | −0,012 | −0,019 | ||||||
| p | 0,732 | 0,884 | 0,800 | |||||||
| Abstraction | r | −0,017 | 0,052 | −0,112 | 0,245* | |||||
| p | 0,883 | 0,713 | 0,339 | 0,041 | ||||||
| Attention | r | 0,182 | 0,153 | −0,143 | 0,256* | 0,487** | ||||
| p | 0,115 | 0,275 | 0,222 | 0,032 | <0.001 | |||||
| Mémoire | r | −0,042 | 0,194 | −0,095 | 0,242* | 0,523** | 0,483** | |||
| p | 0,721 | 0,164 | 0,419 | 0,040 | <0.001 | <0,001 | ||||
| PANSS | r | 0,032 | −0,214* | 0,085 | 0,282** | −0,223 | −0,287* | −0,238* | ||
| p | 0,661 | 0,007 | 0,240 | <0.001 | 0,056 | 0,013 | 0,042 | |||
| MOCA | r | 0,098 | 0,185 | −0,165 | 0,326* | 0,661** | 0,830** | 0,767** | −0,208 | |
| p | 0,401 | 0,184 | 0,157 | 0,006 | <0,001 | <0,001 | <0,001 | 0,076 | ||
IMC: indice de masse corporel, 25OHD: vitamine D, CRP us: protéine C réactive ultrasensible. MoCA: Montreal Cognitive Assessment, PANSS: Positive and Negative Syndrome Scale,
En utilisant la régression logistique binaire et en choisissant comme variable dépendante la décompensation aigue au cours du TB et comme covariables: l’âge, le niveau socio-économique, le niveau éducationnel, la consommation de tabac, la consommation d’alcool, la concentration plasmatique de la CRPus et la 25OHD, la survenue d’une décompensation aigue a été liée d’une manière indépendante au niveau socio-économique, au niveau éducationnel et à la concentration plasmatique en 25OHD (Tableau 4).
Tableau 4.
Régression Logistique Binaire Étudiant L’association Entre la Décompensation Aigue au Cours du TB et la Concentration Plasmatique de la Vitamine D.
| Variable | OR ajusté | IC 95% | p |
|---|---|---|---|
| Age | 1,038 | [0,969 -1.12] | 0,290 |
| Niveau socio-économique | 357.38 | [5.093-25077.4] | 0.007 |
| Niveau éducationnel | 3.340 | [0.342-32.65] | 0,300 |
| Consommation de tabac | 3.166 | [0,543-18.447] | 0.200 |
| Consommation d’alcool | 95.92 | [8.336-1103.74] | < 0.001 |
| 25OHD | 1.157 | [1.032 -1.297] | 0,012 |
| CRPus | 1.281 | [0.936 -1.753] | 0,122 |
OR: odds ratio, IC: intervalle de confiance 95%, 25OHD: vitamine D, CRP us: protéine C réactive ultrasensible.
Discussion
Notre étude a montré que la décompensation aigue du TB était associée à un état inflammatoire à bas grade et à une élévation de la synthèse de la 25OHD plasmatique par rapport aux témoins sains.
Plusieurs pistes étiopathogéniques du TB ont récemment enrichi la littérature, dont la piste immuno-inflammatoire.24
Des études récentes ont montré, chez des patients souffrant de dépression bipolaire, une élévation anormale des taux d’interleukines, de chémokines et de molécules d’adhésion cellulaires qui, par leurs effets, pourraient induire une altération de la barrière hématoencéphalique, du renouvellement des cellules gliales et des neurotransmetteurs (comme la noradrénaline ou la sérotonine), et une perturbation de la transduction du signal synaptique, à côté de la dysrégulation de l’axe hypothalamo-hypophysaire.25
Les cytokines les plus étudiées dans ce sens sont l’IL1, IL6 et le TNF-α.26 Nous n’avons pas dosé ces marqueurs de l’inflammation, mais plutôt la CRP us. Cette dernière était, tout comme la vitamine D, significativement plus élevée chez les patients souffrant de TB par rapport aux témoins, avec une cinétique évolutive comparable à celle de la vitamine D. A ce sujet, T. Huang et F.C. Lin ont rapporté que les patients maniaques avaient des moyennes de CRPus plus élevées que les patients présentant un épisode dépressif majeur et que les témoins.27 Dickerson F et al, ont trouvé une corrélation entre les taux de CRP et la sévérité de l’épisode maniaque mesurée par l’échelle YMRS28
Bulut M et al. ont relevé que la CRP us était significativement plus élevée chez les patients en état manique réfractaire par rapport aux patients répondeurs au traitement et par rapport à des témoins.29
La CRP us à l’admission pourrait être considérée donc dans ce contexte comme biomarquer pronostique interessant permettant de renseigner sur la sévérité de la maladie et orienter ainsi la prise en charge.
Au cours des phénomènes neuroinflammatoires, Spach et Hayes ont souligné que les macrophages activés étaient capables de produire de la vitamine D active dans le SNC.30 Actuellement, il a été démontré que la vitamine D exerce une action hormonale neurostéroïde au niveau du SNC.31
La vitamine D possède des propriétés anti-inflammatoires et neuro-protectrices.32 Ces propriétés seraient tributaires de la diminution de l’expression des cytokines inflammatoires.33,34
Dans notre étude, nous avons trouvé des taux de vitamine D plus élevés chez les malades par rapport aux témoins, avec une différence significative pour les patients bipolaires (Tableau 2). Ce résultat soulève la question de son rapport avec l’origine géographique; puisque l’origine rurale, où l’exposition au soleil serait plus importante,9 était plus fréquente chez les patients que chez les témoins (Tableau 1). La réponse à cette question peut être fournie par la comparaison entre les patients atteints de schizophrénie et les bipolaires: l’origine rurale était plus fréquente chez les premiers que chez les seconds (Tableau S1); alors que les taux de vitamine D chez les schizophrènes n’étaient pas significativement plus élevés que chez les témoins (Tableau 2). Ainsi, l’origine géographique ne suffit pas pour expliquer la différence des taux de vitamine D entre les patients, en particulier les bipolaires, et les témoins de notre étude.
Une association entre un niveau socio-économique bas et une baisse du taux de vitamine D a été rapportée dans la littérature.9 Une telle association n’a pas été retrouvée dans notre étude.
Nous avons relevé, chez nos patients, des corrélations positives entre le taux de vitamine D et le score global de l’échelle MOCA ainsi que les scores des dimensions relatives à l’abstraction, à l’attention et à la mémoire. Ce résultat rejoint celui rapporté dans la littérature concernant l’identification de récepteurs hormonaux pour la vitamine D (VDR) au niveau des neurones et des cellules gliales de l’hippocampe, de l’hypothalamus, du cortex et du sous-cortex, qui sont des régions cérébrales impliquées dans le fonctionnement cognitif.35
Récemment, Petrov et al. ont trouvé des taux de VDBP, qui est la protéine de transport de la vitamine D, significativement plus élevés chez les patients TB d’origine afro-américaine par rapport aux sujets de « race blanche ».8 Concernant cette protéine, il est établi que le complexe 25OHD-VDBP ne peut pas passer la barrière hémato encéphalique.36 Cependant, selon une étude récente,37 en cas de pathologies neuro inflammatoires, la VDBP peut passer au LCR et elle a été proposée comme biomarqueur pronostique de la sclérose en plaque.37 La VDBP aurait un rôle épurateur: elle permettrait d’épurer les fibres d’actines et des débris cellulaires accumulés lors des processus de neurodégénerescence et empêcherait de ce fait leur aggrégation et polymérisation.37 Dans le TB, Calabrese et al. ont montré qu’il existait également une perturabtion du cytosquelette et une polymérisation des fibres d’actines.38
Certes, la vitamine D peut avoir un effet neuroprotecteur. Cependant, Altunsoy et al. ont souligné que la dose neuroprotectrice de vitamine D n’était pas encore connue, et ce d’autant plus que le SNC serait capable de convertir la 25OHD en calcitriol et que le taux sérique de 25OHD pourrait retentir sur la synthèse de vitamine D active au niveau du cerveau.39 Ceci soulève la question de l’étendue des effets positifs de la 25OHD sur le SNC.
Les résultats de l’étude de Golan et al.40 relativisent l’effet positif de la vitamine D sur le SNC. Ces auteurs ont étudié 40 patients suivis pour sclérose en plaques. Leur objectif était d’évaluer les effets d’une supplémentation en vitamine D sur la secrétion de mélatonine. Ils leur ont donné une supplémentation de vitamine D comme suit: forte dose (4370 UI/jour) pour 19 patients et faible dose (800 UI/jour) pour 21 patients. Ils ont surveillé l’évolution des taux sériques de vitamine D et des taux du métabolite urinaire nocturne de la mélatonine: le 6-sulphatoxy-mélatonine (6-SMT). Après trois mois, ils ont constaté que les taux sériques de 25OHD ont augmenté et ceux de 6-SMT ont diminué significativement pour le groupe de supplémentation à forte dose, mais pas pour celui de supplémentation à faible dose de vitamine D. Ils ont alors émis l’hypothèse que la 25OHD pourrait apporter « un message de lumière » à la glande pinéale qui, par conséquent, diminuerait la synthèse de mélatonine.
Cette hypothèse nous parait intéressante au regard de nos résultats. En effet, la vitamine D et la mélatonine sont lumière-dépendantes et ont en commun certaines propriétés immunomodulatrices.40 Des mécanismes homéostatiques pourraient exister entre ces deux médiateurs au niveau du SNC.40 En effet, les récepteurs VDR sont exprimés dans plusieurs régions du cerveau.35 En outre, la 1 α-hydroxylase, enzyme responsable de la formation de la vitamine D active, est présente particulièrement dans le noyau supra-chiasmatique de l’hypothalamus,41 le « pacemaker » circadien, à travers lequel des informations photiques sont transmises de la rétine jusqu’à la glande pinéale. Cette glande secrète la mélatonine selon un modèle circadien dans les conditions d’obscurité alors que la lumière inhibe sa production. La sensibilité de la mélatonine à la lumière est un endophénotype circadien qui a été proposé comme utile dans le TB, et ce d’autant plus que cette sensibilité est plus fréquente chez ceux ayant une forte charge génétique pour ce trouble.42 Kennedy et al. ont trouvé que les taux de mélatonine étaient plus bas chez les patients bipolaires que chez les témoins, et ceci indépendamment de la nature de l’épisode thymique. Ils ont émis l’hypothèse que la production diminuée de mélatonine serait un marqueur-trait et non pas un marqueur-état du trouble bipolaire.43
Ainsi, le modèle physiopathologique du TB qu’on propose est comme suit: le primum movens serait la survenue d’un état inflammatoire. En réponse à cela, l’organisme va augmenter la synthèse de vitamine D. Cette dernière, au delà d’un certain seuil, va envoyer un message de lumière à la glande pinéale. Vu la sensibilité de la mélatonine à la lumière chez les patients souffrant de ce trouble,42 il y aurait une baisse de la secrétion de cette hormone. Ce modèle semble adapté aux caractéristiques cliniques de l’épisode maniaque où les prodromes les plus classiques correspondent à la diminution du besoin de sommeil.44
Points Forts et Limites de L’étude
Points forts de l’étude:
– Il s’agit de la première étude qui évalue le taux plasmatique de 25OHD chez des patients suivis pour trouble bipolaire en Afrique du nord
– Les patients inclus étaient en arrêt de tout traitement psychotrope depuis au moins trois mois. Ainsi, les perturbations biologiques retrouvées chez eux reflètent de manière fidèle les modifications physiopathologiques dans le trouble bipolaire.
– Le ratio témoins/patients bipolaires dans notre étude est presque égal à trois, ce qui constitue un bon ratio. En effet, plus le ratio témoins/patients se rapproche de quatre, moins les résultats seront biaisés.45
Limite:
– La secrétion de mélatonine n’a pas été étudiée (le 6-sulphatoxy-mélatonine).
Conclusion
Notre étude a montré que la décompensation aigue du TB était associée à un état inflammatoire à bas grade et à une élévation de la synthèse de la 25OHD plasmatique. Toutefois, la pertinence du dosage de vitamine D comme biomarqueur de cette maladie mérite d’être étudiée de façon plus approfondie.
Comme perspectives d’avenir, nous proposons de doser le 6-sulphatoxy- mélatonine, les cytokines proinflammatoires et la VDBP chez la population d’étude comparativement aux témoins.
Supplemental Material
870513_Supplement for Vulnérabilité au Trouble Bipolaire: La Piste de la Vitamine D by Manel Naifar, Manel Maalej Bouali, Wassim Guidara, Ahmed Slim Ellouze, Khalil Jmal, Sana Omri, Meriam Messedi, Lobna Zouari, Aida Elleuch, Mohamed Maalej, Khansa Chaabouni, Nada Charfi, Mouna Turki, Ben Thabet Jihène and Fatma Ayadi in The Canadian Journal of Psychiatry
Footnotes
Declaration of Conflicting Interests: The author(s) declared no potential conflicts of interest with respect to the research, authorship, and/or publication of this article.
Financement: Ce travail de recherche a été financé par l’unité de recherche 12ES17, Faculté de Médecine de Sfax, Université de Sfax. Cette unité de recherche est financée par le Ministère de l’enseignement supérieur et de la recherche scientifique en Tunisie.
Remerciements: Les auteurs remercient le personnel paramédical, du service de psychiatrie « C » du CHU HédiChaker à Sfax et du laboratoire de biochimie du CHU Habib Bourguiba à Sfax en Tunisie, pour avoir veillé à ce que les analyses sanguines soient réalisées conformément aux recommandations.
Supplemental Material: Supplemental material for this article is available online.
ORCID iD: Manel Naifar  https://orcid.org/0000-0001-5644-678X
https://orcid.org/0000-0001-5644-678X
References
- 1. Coppola F, Courtet P, Olié E. Neuropsychological Profile and working memory in bipolar disorder. Can J Psychiatry Rev Can Psychiatr. 2018;63(5):314–321. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. Douki S, Nacef F, Triki T, Dalery J. Les aspects culturels du trouble bipolaire : résultats d’une étude comparative entre des patients français et tunisiens. L’Encéphale. 2012;38(3):194–200. [DOI] [PubMed] [Google Scholar]
- 3. Kahn RS, Sommer IE, Murray RM. et al. Schizophrenia. Nat Rev Dis Primer. 2015;1:15067. [DOI] [PubMed] [Google Scholar]
- 4. Salle B, Duhamel JF, Souberbielle J. Statut vitaminique, rôle extra osseux et besoins quotidiens en vitamine D. Rapp Conclus Recomm Académie Natl Médecine. 2012;196(4-5):40. [Google Scholar]
- 5. Souberbielle JC, Prié D, Courbebaisse M. et al. Actualité sur les effets de la vitamine D et l’évaluation du statut vitaminique D. Ann Endocrinol. 2008;69(6):501–510. [DOI] [PubMed] [Google Scholar]
- 6. Jamilian H, Amirani E, Milajerdi A. et al. The effects of vitamin D supplementation on mental health, and biomarkers of inflammation and oxidative stress in patients with psychiatric disorders: a systematic review and meta-analysis of randomized controlled trials. Prog Neuropsychopharmacol Biol Psychiatry. 2019;94:109651. [DOI] [PubMed] [Google Scholar]
- 7. Gowda U, Mutowo MP, Smith BJ, Wluka AE, Renzaho AM. Vitamin D supplementation to reduce depression in adults: meta-analysis of randomized controlled trials. Nutrition. 2015;31(3):421–429. [DOI] [PubMed] [Google Scholar]
- 8. Petrov B, Aldoori A, James C. et al. Bipolar disorder in youth is associated with increased levels of vitamin D-binding protein. Transl Psychiatry. 2018;8(1):61. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Bassil D, Rahme M, Hoteit M, Fuleihan GH. Hypovitaminosis D in the Middle East and North Africa: prevalence, risk factors and impact on outcomes. Dermatoendocrinol. 2013;5(2):274–298. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Hoteit M, Al-Shaar L, Yazbeck C, Bou Sleiman M, Ghalayini T, Fuleihan GH. Hypovitaminosis D in a sunny country: time trends, predictors, and implications for practice guidelines. Metabolism. 2014;63(7):968–978. [DOI] [PubMed] [Google Scholar]
- 11. Chakhtoura M, Rahme M, Chamoun N, El-Hajj Fuleihan G. Vitamin D in the middle east and North Africa. Bone Rep. 2018;8:135–146. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Benhamou CL, Souberbielle JC, Cortet B, Fardellone P, Gauvain JB, Thomas T, pour le Groupe de recherche et d’information sur les ostéoporoses (GRIO). La vitamine D chez l’adulte : recommandations du GRIO. Presse Médicale. 2011;40(7–8):673–682. [Google Scholar]
- 13. Adams JS, Hewison M. Update in vitamin D. J Clin Endocrinol Metab. 2010;95(2):471–478. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Souberbielle JC, Body JJ, Lappe JM. et al. Vitamin D and musculoskeletal health, cardiovascular disease, autoimmunity and cancer: Recommendations for clinical practice. Autoimmun Rev. 2010;9(11):709–715. [DOI] [PubMed] [Google Scholar]
- 15. Biedermann F, Fleischhacker WW. Psychotic disorders in DSM-5 and ICD-11. CNS Spectr. 2016;21(4):349–354. [DOI] [PubMed] [Google Scholar]
- 16. de Dios C, Goikolea JM, Colom F, Moreno C, Vieta E. Bipolar disorders in the new DSM-5 and ICD-11 classifications. Rev Psiquiatr Salud Ment. 2014;7(4):179–185. [DOI] [PubMed] [Google Scholar]
- 17. Kay SR, Fiszbein A, Opler LA. The positive and negative syndrome scale (PANSS) for schizophrenia. Schizophr Bull. 1987;13(2):261–276. [DOI] [PubMed] [Google Scholar]
- 18. Schwartz MW, Seeley RJ, Zeltser LM. et al. Obesity pathogenesis: an endocrine society scientific statement. Endocr Rev. 2017;38(4):267–296. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Bech P, Baastrup PC, de Bleeker E, Ropert R. Dimensionality, responsiveness and standardization of the Bech-Rafaelsen Mania Scale in the ultra-short therapy with antipsychotics in patients with severe manic episodes. Acta Psychiatr Scand Juill. 2001;104(1):25–30. [DOI] [PubMed] [Google Scholar]
- 20. Smith T, Gildeh N, Holmes C. The montreal cognitive assessment: validity and utility in a memory clinic setting. Can J Psychiatry. 2016;52(5):329–332. [DOI] [PubMed] [Google Scholar]
- 21. Obesity: preventing and managing the global epidemic. Report of a WHO consultation. World Health Organ Tech Rep Ser. 2000;894:i–xii, 1–253. [PubMed] [Google Scholar]
- 22. Levey AS, Coresh J, Greene T. et al. Expressing the Modification of Diet in Renal Disease Study equation for estimating glomerular filtration rate with standardized serum creatinine values. Clin Chem. 2007;53(4):766–772. [DOI] [PubMed] [Google Scholar]
- 23. Dart T, Chatellier G. Comment décrire la distribution d’une variable ? Rev Mal Respir. 2003;20(6):946–951. [PubMed] [Google Scholar]
- 24. Doukhan R, Tamouza R, Leboyer M. et al. 44. Hypothèses Immuno-Inflammatoires Dans le Trouble Bipolaire In: Bourgrois M-L, Gay C, Henry C, Masson M, eds. Les troubles bipolaires. Cachan: Lavoisier; 325–335. [Google Scholar]
- 25. Milenkovic VM, Stanton EH, Nothdurfter C, Rupprecht R, Wetzel CH. The role of chemokines in the pathophysiology of major depressive disorder. Int J Mol Sci. 2019;20(9):pii: E2283 Epub ahead of print May 9, 2019 doi: 10.3390/ijms20092283. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. Muneer A. Bipolar disorder: role of inflammation and the development of disease biomarkers. Psychiatry Investig. 2016;13(1):18–33. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27. Huang TL, Lin FC. High-sensitivity C-reactive protein levels in patients with major depressive disorder and bipolar mania. Prog Neuropsychopharmacol Biol Psychiatry. 2007;31(2):370–372. [DOI] [PubMed] [Google Scholar]
- 28. Dickerson F, Stallings C, Origoni A, Boronow J, Yolken R. Elevated serum levels of C-reactive protein are associated with mania symptoms in outpatients with bipolar disorder. Prog Neuropsychopharmacol Biol Psychiatry. 2007;31(4):952–955. [DOI] [PubMed] [Google Scholar]
- 29. Bulut M, Çatı S, Güneş M, Kaya MC, Kaplan İ, Özkan M. Evaluation of serum inflammatory markers in treatment-resistant manic patients and adequate responder manic patients. Psychiatry Res. 2019;272:73–79. [DOI] [PubMed] [Google Scholar]
- 30. Spach KM, Hayes CE. Vitamin D3 confers protection from autoimmune encephalomyelitis only in female mice. J Immunol Baltim Md. 1950 2005;175(6):4119–4126. [DOI] [PubMed] [Google Scholar]
- 31. Berridge MJ. Vitamin D and Depression: cellular and regulatory mechanisms. Pharmacol Rev. 2017;69(2):80–92. [DOI] [PubMed] [Google Scholar]
- 32. Anjum I, Jaffery SS, Fayyaz M, Samoo Z, Anjum S. The role of vitamin d in brain health: a mini literature review. Cureus. 2018;10(7):e2960. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33. Lima LAR, Lopes MJP, Costa RO. et al. Vitamin D protects dopaminergic neurons against neuroinflammation and oxidative stress in hemiparkinsonian rats. J Neuroinflammation. 2018;15(1):249. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34. Yamini P, Ray RS, Chopra K. Vitamin D3 attenuates cognitive deficits and neuroinflammatory responses in ICV-STZ induced sporadic Alzheimer’s disease. Inflammopharmacology. 2018;26(1):39–55. [DOI] [PubMed] [Google Scholar]
- 35. Annweiler C, Brugg B, Peyrin JM, Bartha R, Beauchet O. Combination of memantine and vitamin D prevents axon degeneration induced by amyloid-beta and glutamate. Neurobiol Aging. 2014;35(2):331–335. [DOI] [PubMed] [Google Scholar]
- 36. Pardridge WM, Sakiyama R, Coty WA. Restricted transport of Vitamin D and A derivatives through the rat blood-brain barrier. J Neurochem. 1985;44(4):1138–1141. [DOI] [PubMed] [Google Scholar]
- 37. Perga S, Giuliano Albo A, Lis K. et al. Vitamin D Binding Protein Isoforms and Apolipoprotein E in cerebrospinal fluid as prognostic biomarkers of multiple sclerosis. PLoS One. 2015;10(6):e0129291. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38. Calabrese B, Halpain S. Lithium prevents aberrant NMDA-induced F-actin reorganization in neurons. Neuroreport. 2014;25(17):1331–1337. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39. Altunsoy N, Yüksel RN, Cingi Yirun M, Kılıçarslan A, Aydemir Ç. Exploring the relationship between vitamin D and mania: correlations between serum vitamin D levels and disease activity. Nord J Psychiatry. 2018;72(3):221–225. [DOI] [PubMed] [Google Scholar]
- 40. Golan D, Staun-Ram E, Glass-Marmor L. et al. The influence of vitamin D supplementation on melatonin status in patients with multiple sclerosis. Brain Behav Immun. 2013;32:180–185. [DOI] [PubMed] [Google Scholar]
- 41. Harms LR, Burne THJ, Eyles DW, McGrath JJ. Vitamin D and the brain. Best Pract Res Clin Endocrinol Metab. 2011;25(4):657–669. [DOI] [PubMed] [Google Scholar]
- 42. Maruani J, Anderson G, Etain B, Lejoyeux M, Bellivier F, Geoffroy PA. The neurobiology of adaptation to seasons: relevance and correlations in bipolar disorders. Chronobiol Int. 2018;35(10):1335–1353. [DOI] [PubMed] [Google Scholar]
- 43. Kennedy SH, Kutcher SP, Ralevski E, Brown GM. Nocturnal melatonin and 24-hour 6-sulphatoxymelatonin levels in various phases of bipolar affective disorder. Psychiatry Res. 1996;63(2–3):219–222. [DOI] [PubMed] [Google Scholar]
- 44. Gold A, Sylvia L. The role of sleep in bipolar disorder. Nat Sci Sleep. 2016;8:207–214. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45. Linden A, Samuels SJ. Using balance statistics to determine the optimal number of controls in matching studies: optimal number of controls in matching studies. J Eval Clin Pract. 2013;19(5):968–975. n/a-n/a [DOI] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.
Supplementary Materials
870513_Supplement for Vulnérabilité au Trouble Bipolaire: La Piste de la Vitamine D by Manel Naifar, Manel Maalej Bouali, Wassim Guidara, Ahmed Slim Ellouze, Khalil Jmal, Sana Omri, Meriam Messedi, Lobna Zouari, Aida Elleuch, Mohamed Maalej, Khansa Chaabouni, Nada Charfi, Mouna Turki, Ben Thabet Jihène and Fatma Ayadi in The Canadian Journal of Psychiatry