Resumen
Objetivo
Estudiar la validez de una técnica de diagnóstico antigénico rápido (TDAR) del estreptococo betahemolítico del grupo A para el diagnóstico de la faringitis aguda en comparación con el cultivo del exudado faríngeo.
Diseño
Estudio observacional en una serie consecutiva de pacientes.
Emplazamiento
Dos centros de atención primaria del área metropolitana de Barcelona.
Participantes
Niños entre 1–14 años que presentaban dolor faríngeo de menos de 5 días de evolución y que acudían a las consultas de pediatría.
Mediciones principales
A todos los participantes se les recogieron 2 muestras de la faringe posterior y del área tonsilar, una para la realización de la TDAR y otra para el cultivo.
Resultados
En 211 pacientes estudiados la prevalencia de faringitis estreptocócica fue del 34,1%. La sensibilidad de la prueba fue del 90,3% (IC del 95%: 81,0–96,0) y la especificidad fue del 78,4% (IC del 95%: 70,6–84,9). El porcentaje de falsos negativos fue del 9,7% y el porcentaje de falsos positivos fue del 21,6%. Se observó un sesgo del espectro en el que la sensibilidad de la TDAR se incrementó con los criterios de Centor.
Conclusiones
El valor diagnóstico de la TDAR para la faringitis estreptocócica en pacientes de pediatría atendidos en las consultas de atención primaria fue alto. Sin embargo, el porcentaje de falsos positivos y negativos fue muy alto y mostró una baja sensibilidad en pacientes con una clínica menos grave, por lo que la TDAR debe complementarse con la realización del cultivo, que además nos aportará información sobre la sensibilidad antibiótica.
Palabras clave: Faringitis, Estreptococos, Técnica de diagnóstico antigénico rápido, Atención primaria
Abstract
Objective
To determine the validity of the rapid antigen test for the diagnoses of acute pharyngitis caused by group A beta-haemolytic Streptococcus (GABHS) compared with culture.
Design
Observational study of a consecutive sample of paediatric patients.
Setting
Two primary care centres (PCC) from the metropolitan area of Barcelona.
Participants
Children aged 1–14 years with sore throat of no more than 5 days duration were chosen at PCC.
Principal measurements
Oropharyngeal samples were collected from tonsillar bed and posterior pharynx. A rapid diagnostic test was performed, as well as a throat culture.
Results
A total of 211 patients were studied. The overall prevalence of pharyngitis due to Streptococcus was 34.1%. Compared with the throat culture, the sensitivity of the rapid test was 90.3% (95% CI: 81.0–96.0), the specificity was 78.4% (95% CI: 70.6–84.9). The percentage of false negatives was 9.7% and the false positives was 21.6%. Spectrum bias was present, inasmuch as the rapid test sensitivity increased with Centor scores.
Conclusions
The diagnostic value of a rapid antigen test for the diagnosis of streptococcal pharyngitis in paediatric patients at PCC is high. However, the percentage of false positives and negatives is too high, and also the sensitivity is too low in patients with fewer symptoms to support the use of rapid antigenic test without culture confirmation and bacterial sensitivity test.
Keywords: Pharyngitis, Streptococcus, Rapid antigen test, Primary health care
Introducción
La faringoamigdalitis producida por los estreptococos del grupo A es la infección bacteriana más común de la orofaringe y afecta principalmente a niños entre 5–15 años1. El diagnóstico etiológico de esta enfermedad es de gran importancia para poder administrar tratamiento antibiótico con el objetivo de prevenir las complicaciones, tanto las supurativas como las no supurativas2, 3, 4. Un tratamiento antibiótico adecuado permite disminuir la transmisión del estreptococo dentro de la comunidad y minimiza los efectos adversos del uso inapropiado de antibióticos, incluidas las resistencias5, 6.
Las faringitis estreptocócicas son clínicamente indistinguibles de las producidas por otros microorganismos. Se han creado diversas escalas clínicas para su diagnóstico etiológico y la más utilizada es la de Centor, que evalúa7: a) la presencia de exudado tonsilar; b) la presencia de adenopatías anteriores cervicales; c) la ausencia de tos, y d) la presencia de fiebre. Apareció una modificación posterior, en el año 2004, en la que se añadía un punto a los niños con edades entre 3–14 años8. Desafortunadamente, el diagnóstico etiológico, basado únicamente en criterios clínicos, ha dado pobres resultados, por lo que diferentes guías proponen una confirmación microbiológica del diagnóstico clínico9, 10.
Entre las pruebas de confirmación microbiológica existen los cultivos de exudados faríngeos y las técnicas de diagnóstico antigénico rápido (TDAR)11, 12. Aunque el cultivo faríngeo es la prueba de oro, las TDAR que se han ido desarrollando en los últimos años ofrecen la ventaja de su fácil realización, ya que en apenas 10 min se pueden obtener los resultados. No obstante, las guías de práctica clínica aconsejan siempre que, antes de implantarse, se debería valorar su validez en la población en las que se van a implantar.
Recientemente se ha publicado un artículo en el que se evaluaba la validez de la TDAR en la población adulta13, pero hasta nuestro conocimiento, no hay estudios en nuestro medio que evalúen la validez de estas técnicas en la población infantil.
El objetivo de nuestro estudio es evaluar la validez de una TDAR comparada con el cultivo de exudado faríngeo para el diagnóstico de faringitis estreptocócicas en niños de 1–14 años que acudieron a 2 centros de atención primaria por dolor faríngeo.
Métodos
Se trata de un estudio observacional, con una comparación prospectiva y a ciegas de una TDAR con un estándar de referencia, en este caso el cultivo del frotis faríngeo, en una serie consecutiva de niños que acudían a las consultas de pediatría con dolor faríngeo. La selección de los pacientes se realizó entre marzo de 2008 y abril de 2009. El estudio se realizó en 2 centros de atención primaria de Castelldefels, en el área metropolitana de Barcelona. Se incluyó a todos los niños entre 1–14 años que acudieron a las consultas de pediatría con dolor faríngeo de menos de 5 días de evolución. Se excluyó a los pacientes con una enfermedad crónica grave, con enfermedad valvular cardíaca, amigdalectomizados, con faringoamgidalitis recidivantes y los que habían tomado antibióticos en los últimos 15 días. Se calculó que el tamaño de la muestra necesario era de 194 individuos para una precisión del 7% y una proporción esperada de faringitis por estreptococos del 35%, IC del 95%, asumiendo que en la población estudiada había unos 9.000 niños y estimando una tasa de pérdidas del 10% (cálculos realizados con GRANMO 6.0). Se informó a todos los padres y se solicitó su consentimiento.
Recogieron las muestras 9 pediatras de los 2 equipos de atención primaria. Tras recibir un entrenamiento previo, tomaron 2 muestras de exudado de cada paciente de la faringe posterior y del área tonsilar, una para la realización de la prueba de diagnóstico rápido del laboratorio Genzyme (OSOM Strep A) y la otra se envió al laboratorio de referencia para su cultivo. Se procedió a la siembra en agar sangre de carnero, incubación a 37 °C en atmósfera del 5% de CO2 durante 18–24 h, y se valoró el crecimiento de cualquier número de colonias betahemolíticas. Los cultivos negativos se reincubaron y se leyeron a las 48 h. La identificación se realizó mediante las técnicas habituales del laboratorio: las colonias betahemolíticas correspondientes a cocos grampositivos, catalasa negativa, sensibles a bacitracina, seguidas de tipado mediante técnica de coaglutinación (Phadebact®, Bactus AB), y se identificaron como Streptococcus pyogenes.
En una hoja de datos estandarizada se recogieron el sexo y la edad, las alergias medicamentosas, los 5 criterios modificados de Centor8, el tratamiento realizado y los resultados de la TDAR (positiva/negativa) y del cultivo (positivo/negativo).
Para el análisis estadístico se utilizaron las pruebas de la χ2 para el análisis de las variables cualitativas, y el test de la t-Student para las variables cuantitativas. Se calculó la sensibilidad, la especificidad, el valor predictivo positivo (VPP), el valor predictivo negativo (VPN), el coeficiente de probabilidad positivo (CPP) y el coeficiente de probabilidad negativo (CPN). Se realizó una curva ROC y se calculó el área bajo la curva. Se consideraron diferencias estadísticamente significativas los valores de p<0,05. Se utilizó el programa estadístico STATA versión 9.3.
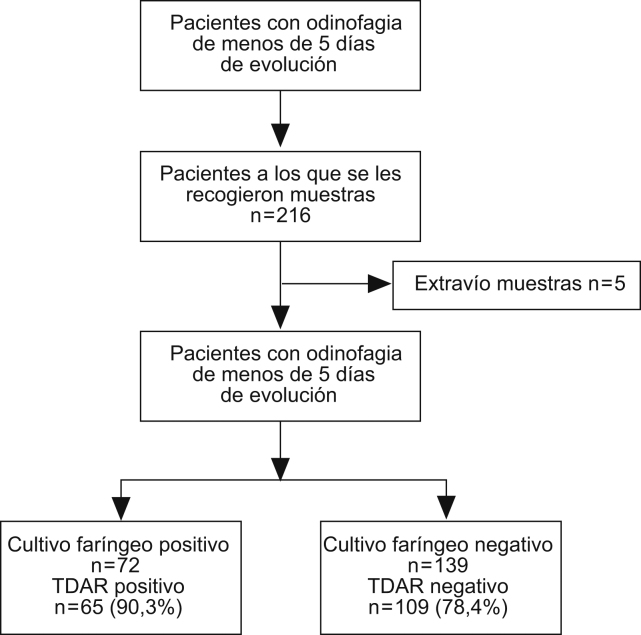
Esquema general del estudio.
Estudio observacional de la validez de una técnica de diagnóstico antigénico rápido del estreptococo betahemolítico del grupo A para el diagnóstico de la faringitis aguda en comparación con el cultivo del exudado faríngeo en una serie consecutiva de pacientes
Resultados
Acudieron de forma consecutiva a las consultas de pediatría con clínica de faringitis aguda 216 niños. Cinco de las muestras se extraviaron y no se enviaron a cultivar, por lo que finalmente se estudió a 211 niños. La edad media de los participantes fue de 6,6 años (DE: 3,8 años) y 120 (55,8%) fueron niñas. El microorganismo que más frecuentemente se aisló cuando el cultivo fue positivo fue S. pyogenes (estreptococo betahemolítico del grupo A) (87,5%), seguido del Streptococcus pneumoniae (5,6%).
No se encontraron diferencias en las características clínicas y demográficas según los resultados de los cultivos (tabla 1), pero sí entre los resultados obtenidos en la TDAR y los del cultivo faríngeo (p<0,001).
Tabla 1.
Características demográficas y clínicas de los 211 niños estudiados según el resultado del cultivo del exudado faríngeo
| Característica | Cultivo positivo⁎(n=72) | Cultivo negativo⁎(n=139) | p |
|---|---|---|---|
| Mujeres, n (%) | 34 (47,9) | 82 (59,0) | 0,13 |
| Edad, media (DE) | 7,1 (3,6) | 6,3 (3,9) | 0,15 |
| Criterios de Centor | |||
| Fiebre, n (%) | 63 (87,5) | 123 (88,5) | 0,83 |
| Adenopatías, n (%) | 52 (72,2) | 93 (66,9) | 0,43 |
| Exudado, n (%) | 60 (83,3) | 102 (73,4) | 0,11 |
| Ausencia de tos, n (%) | 55 (76,4) | 101 (72,7) | 0,56 |
| Edad entre 3–14 años | 63 (87,5) | 112 (80,6) | 0,21 |
| Resultados de la TDAR | |||
| Positivo, n (%) | 65 (90,3) | 30 (21,6) | |
| Negativo, n (%) | 7 (9,7) | 109 (78,4) | <0,001 |
TDAR: técnica de diagnóstico antigénico rápido.
Para Streptococcus pyogenes.
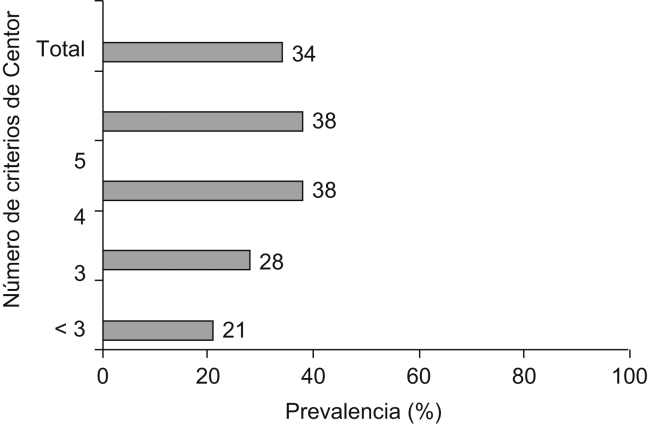
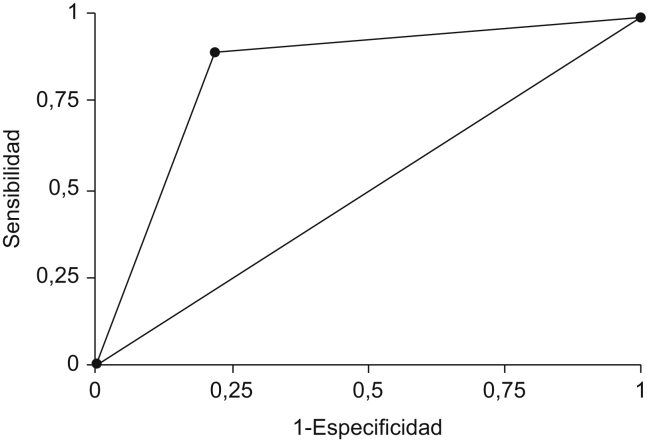
La prevalencia de faringitis estreptocócica fue del 34,1% (fig. 1) y la prueba presentó una sensibilidad del 90,3% (IC del 95%: 81,0–96,0), una especificidad del 78,4% (IC del 95%: 70,6–84,9), un VPP del 68,4% (IC del 95%: 58,1–77,6) y un VPN del 94,0% (IC del 95%: 88,0–97,5) (tabla 2). La sensibilidad de la prueba se fue incrementando a medida que aumentaba el número de criterios de Centor positivos. Se encontró 4 veces más probable que un test positivo proviniera de un individuo con faringitis estreptocócica que de un individuo con faringitis de diferente etiología (CPP=4,2). El área bajo de la curva ROC fue de 0,84 (IC del 95%: 0,79–0,89) (fig. 2).
Figura 1.
Prevalencia de faringitis estreptocócica según el número de criterios de Centor positivos.
Tabla 2.
Validez de la técnica antigénica rápida según el número de criterios de Centor
| Criterios de Centor positivos | Sensibilidad (%[IC del 95%]) | Especificidad (%[IC del 95%]) | VPP (%[IC del 95%]) | VPN (%[IC del 95%]) |
|---|---|---|---|---|
| Todos los participantes (n=211) | 90,3 (81,0 – 96,0) | 78,4 (70,6 – 84,9) | 68,4 (58,1 – 77,6) | 94,0 (88,0 – 97,5) |
| ≤2 (n=19) | 75,0 (19,4 – 99,4) | 86,7 (59,5 – 98,3) | 60,0 (14,7 – 94,7) | 92,9 (66,1 – 99,8) |
| 3 (n=54) | 86,7 (59,5 – 98,3) | 82,1 (66,5 – 92,5) | 65,0 (40,8 – 84,6) | 94,1 (80,3 – 99,3) |
| 4 (n=60) | 91,3 (72,0 – 98,9) | 86,5 (71,2 – 95,5) | 80,8 (60,6 – 93,4) | 94,1 (80,3 – 99,3) |
| 5 (n=78) | 93,3 (77,9 – 99,2) | 66,7 (51,6 – 79,6) | 63,6 (47,8 – 77,6) | 94,1 (80,3 – 99,3) |
| CPP (%[IC del 95%]) | CPN (%[IC del 95%]) | Área bajo curva (%[IC del 95%]) | ||
| Todos los participantes (n=211) | 4,18 (3,02 – 5,79) | 0,12 (0,06 – 0,25) | 0,84 (0,79 – 0,89) | |
| ≤2 (n=19) | 5,63 (1,37 – 23) | 0,29 (0,05 – 1,59) | 0,80 (0,55 – 1,00) | |
| 3 (n=54) | 4,83 (2,40 – 9,72) | 0,19 (0,04 – 0,59) | 0,84 (0,73 – 0,95) | |
| 4 (n=60) | 6,76 (2,96 – 15,5) | 0,10 (0,03 – 0,38) | 0,89 (0,81 – 0,97) | |
| 5 (n=78) | 2,8 (1,86 – 4,22) | 0,10 (0,02 – 0,38) | 0,80 (0,72 – 0,88) |
CPN: coeficiente de probabilidad negativo; CPP: coeficiente de probabilidad positivo; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Figura 2.
Curva ROC.
De los 72 cultivos positivos, en 63 casos (87,5%) se aisló S. pyogenes y en 7 casos fue resistente a la eritromicina. Se aislaron 4 individuos con S. pneumoniae, que en todos los casos fueron resistentes a la eritromicina y en 3 casos también a la eritromicina (tabla 3).
Tabla 3.
Resultados de los cultivos positivos y sensibilidad antibiótica
|
Eritromicina |
Clindamicina |
|||||
|---|---|---|---|---|---|---|
| Resistente | Sensible | Total | Resistente | Sensible | Total | |
| Streptococcus pyogenes | 7 | 54 | 61 | 0 | 63 | 63 |
| Streptococcus pneumoniae | 3 | 1 | 4 | 3 | 0 | 3 |
| Streptococcus del grupo C | 2 | 2 | 4 | 0 | 4 | 4 |
| Streptococcus del grupo G | 2 | 1 | 3 | 0 | 2 | 2 |
Discusión
Las estrategias que incorporan las TDAR ofrecen la posibilidad de tratar a los pacientes de forma inmediata, con una mayor adecuación del tratamiento antibiótico, lo que puede prevenir sus efectos adversos, incluidas las resistencias a los antibióticos14. En nuestro estudio, la TDAR presentó un VPP del 68,4% (IC del 95%: 58,1–77,6), con un porcentaje de falsos positivos del 31,6%. El estudio presentó un CPP de 4,28 (IC del 95%: 3,02–5,79) y un CPN de 0,12 (IC del 95%: 0,06–0,25). Desde el punto de vista clínico, las pruebas con un CPP entre 5 – 10 o con un CPN entre 0,1 – 0,2 tienen una utilidad moderada, por lo que deben complementarse con otra prueba diagnóstica, que en este caso sería el cultivo del frotis faríngeo que, además, aporta información sobre la sensibilidad antibiótica. Nuestro estudio presentó un VPN del 94,0% (IC del 95%: 88,0–97,5). Mayes et al indicaron que las TDAR podían reemplazar a los cultivos faríngeos si el porcentaje de falsos negativos era del 2,4%15. En nuestro estudio, este porcentaje fue del 9,7% (7/72) cuando se analizó toda la muestra. Aunque este porcentaje es menor que el encontrado en otros estudios16, 17, los resultados de la TDAR deberían confirmarse con el cultivo de muestras faríngeas.
Encontramos una prevalencia global del 34,1%, muy similar a la encontrada en otros estudios8, 18 y algo mayor que en el estudio de Fontes et al, en el que fue del 23,5%19. Observamos que la prevalencia de faringitis fue más elevada entre los individuos que presentaban más criterios de Centor positivos, lo que confirmaría la capacidad de estos criterios clínicos para clasificar a los niños en grupos en los que se incrementa la probabilidad de tener una faringitis estreptocócica. Estos criterios se han utilizado en la elaboración de diferentes guías de práctica clínica que, además, proponen una confirmación microbiológica11, 12. Estas guías de práctica clínica ofrecen diversas propuestas de indicación de tratamiento según los criterios clínicos junto con la confirmación microbiológica, y aconsejan la realización de TDAR a partir de 2 o más criterios de Centor positivos.
La TDAR presentó una mayor sensibilidad en el grupo de pacientes con manifestaciones clínicas más graves, lo que se conoce como sesgo del espectro20, 21. La sensibilidad más baja corresponde a los niños con 3 o menos criterios de Centor positivos, y fue del 75,0% mayor a la descrita en otros estudios22, 23. En el estudio de Di-Matteo et al22, la sensibilidad se incrementó del 61% en pacientes con 0 o 1 criterio de Centor positivos al 97% en los individuos con los 4 criterios positivos. En el estudio de Hall et al23, la sensibilidad encontrada con 0 criterios de Centor fue del 47%, con una sensibilidad del 90% con 4 criterios de Centor positivos. Un estudio realizado por Dagnelie et al18 presentó una sensibilidad que oscilaba entre el 59% cuando se encontraron 0 a 2 criterios positivos y del 83% cuando presentaban los 4 criterios positivos. Las causas de este sesgo del espectro son desconocidas. Una de las principales hipótesis es que la cantidad de bacterias presentes en la faringe pueden ser mayores entre los pacientes con manifestaciones clínicas más graves, lo que incrementaría la probabilidad de tener un resultado positivo en el test. Estos resultados confirman las actuales recomendaciones de no realizar las TDAR a pacientes con una sintomatología compatible con una enfermedad viral.
Entre las limitaciones del estudio encontramos los problemas inherentes al estándar de referencia utilizado, ya que es bien conocido que el cultivo es una prueba imperfecta a pesar de tener un rango de sensibilidad de entre el 90 – 95%. Otra limitación es que, dado que en el estudio participaron 9 pediatras, a pesar de que se los instruyó en la realización de las TDAR, puede existir una variabilidad entre ellos, que no se midió pero que no deja de ser un reflejo de la práctica clínica diaria.
Entre los puntos fuertes destacamos que es el primer estudio de validación de una TDAR en pacientes pediátricos realizado en nuestro medio y que la muestra de sujetos que se ha estudiado incluyó un espectro adecuado de pacientes con diferentes estadios de la enfermedad y con un amplio rango de edades (1 – 14 años, ambos inclusive). Aunque algunas de las guías recomiendan realizar las TDAR a partir de los 3–4 años, en nuestro estudio se incluyeron niños a partir de un año para tener un espectro adecuado de pacientes y para poder comparar los resultados con otros estudios17, 19.
Las faringitis producidas por los estreptococos no se pueden distinguir clínicamente de las faringitis producidas por otros gérmenes, por lo que la utilización de este tipo de test rápidos, junto con la combinación de los criterios clínicos, puede ser de gran utilidad para los pediatras de las consultas de atención primaria para la prescripción precoz de antibióticos. Sin embargo, dado los resultados obtenidos en la validación de la TDAR, que han presentado un alto porcentaje de falsos positivos y negativos con unos coeficientes de probabilidad bajos y que demuestran una utilidad moderada de la prueba, recomendamos que las TDAR se complementen con la realización del cultivo. Éste, además, nos puede aportar información sobre la sensibilidad antibiótica, especialmente importante en aquellos casos en que no puedan administrarse antibióticos betalactámicos y, por otra parte, nos va a permitir identificar otras etiologías bacterianas menos frecuentes, como estreptococos betahemolíticos de los grupos C y G o Arcanobacterium haemolyticum.
Puntos clave
Lo conocido sobre el tema
-
•
La faringitis por estreptococos del grupo A es la infección bacteriana más común de la orofaringe, afecta a niños de entre 5–14 años.
-
•
Las escalas clínicas para el diagnóstico etiológico de los estreptococos del grupo A han mostrado pobres resultados, por lo que son necesarias pruebas microbiológicas para su diagnóstico.
Qué aporta este estudio
-
•
La técnica de diagnóstico rápido mostró ser una prueba válida, con una sensibilidad del 90,3% y una especificidad del 78,4%.
-
•
La técnica de diagnóstico rápido presentó un sesgo del espectro, con una mayor sensibilidad en los pacientes con una clínica más grave.
-
•
La prevalencia de faringitis estreptocócica se incrementó con los criterios de Centor, lo que confirma la capacidad de estos criterios clínicos para clasificar a los niños en grupos con una mayor probabilidad de tener una faringitis estreptocócica.
-
•
La técnica de diagnóstico rápido es una herramienta útil para instaurar un tratamiento antibiótico precoz; no obstante, debe complementarse con la realización del cultivo que pueda aportar información sobre la sensibilidad antibiótica.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- 1.Romero V.J., Rubio A.M., Corral O., Pacheco S., Agudo E., Picazo J.J. Estudio de las infecciones respiratorias extrahospitalarias. Enferm Infecc Microbiol Clin. 1997;15:289–298. [PubMed] [Google Scholar]
- 2.Carapetis J.R., McDonald M., Wilson N.J. Acute rheumatic fever. Lancet. 2005;366:155–168. doi: 10.1016/S0140-6736(05)66874-2. [DOI] [PubMed] [Google Scholar]
- 3.Massell B.F., Honikman L.H., Amezcua J. Rheumatic fever following streptococcal vaccination. Report of three cases. JAMA. 1969;207:1115–1119. [PubMed] [Google Scholar]
- 4.Massell B.F., Chute C.G., Walker A.M., Kurland G.S. Penicillin and the marked decrease in morbidity and mortality from rheumatic fever in the United States. N Engl J Med. 1988;318:280–286. doi: 10.1056/NEJM198802043180504. [DOI] [PubMed] [Google Scholar]
- 5.Alos J.I., Aracil B., Oteo J., Torres C., Gómez-Garces J.L., Spanish Group for the Study of Infection in the Primary Health Care Setting High prevalence of erythromycin-resistant, clindamycin/miocamycin-susceptible (M phenotype) Streptococcus pyogenes: Results of a Spanish multicentre study in 1998. J Antimicrob Chemother. 2000;45:605–609. doi: 10.1093/jac/45.5.605. [DOI] [PubMed] [Google Scholar]
- 6.Orden B., Martínez R., López de los Mozos A., Franco A. Antibiotic resistance to erythromycin, clindamycin and tetracycline of 573 strains of Streptococcus pyogenes (1992–1994) Enferm Infecc Microbiol Clin. 1996;14:86–89. [PubMed] [Google Scholar]
- 7.Centor R.M., Witherspoon J.M., Dalton H.P., Brody C.E., Link K. The diagnosis of strep throat in adults in the emergency room. Med Decis Making. 1981;1:239–246. doi: 10.1177/0272989X8100100304. [DOI] [PubMed] [Google Scholar]
- 8.McIsaac W.J., Kellner J.D., Aufricht P., Vanjaka A., Low D.E. Empirical validation of guidelines for the management of pharyngitis in children and adults. JAMA. 2004;291:1587–1595. doi: 10.1001/jama.291.13.1587. [DOI] [PubMed] [Google Scholar]
- 9.Attia M., Zaoutis T., Eppes S., Klein J., Meier F. Multivariate predictive models for group A beta-hemolytic streptococcal pharyngitis in children. Acad Emerg Med. 1999;6:8–13. doi: 10.1111/j.1553-2712.1999.tb00087.x. [DOI] [PubMed] [Google Scholar]
- 10.Bisno A.L. Diagnosing strep throat in the adult patient: Do clinical criteria really suffice? Ann Intern Med. 2003;139:150–151. doi: 10.7326/0003-4819-139-2-200307150-00015. [DOI] [PubMed] [Google Scholar]
- 11.Bisno A.L., Gerber M.A., Gwaltney J.M., Jr, Kaplan E.L., Schwartz R.H. Practice guidelines for the diagnosis and management of group A streptococcal pharyngitis. Infectious Diseases Society of America. Clin Infect Dis. 2002;35:113–125. doi: 10.1086/340949. [DOI] [PubMed] [Google Scholar]
- 12.Dajani A., Taubert K., Ferrieri P., Peter G., Shulman S. Treatment of acute streptococcal pharyngitis and prevention of rheumatic fever: A statement for health professionals. Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease of the Council on Cardiovascular Disease in the Young, the American Heart Association. Pediatrics. 1995;96:758–764. [PubMed] [Google Scholar]
- 13.Llor C., Hernández A.S., Gómez Bertomeu F.F., Santamaria Puig J.M., Calvino D.O., Fernández P.Y. Validación de una técnica antigénica rápida en el diagnóstico de la faringitis por estreptococo betahemolítico del grupo A. Aten Primaria. 2008;40:489–494. doi: 10.1157/13127228. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Worrall G., Hutchinson J., Sherman G., Griffiths J. Diagnosing streptococcal sore throat in adults: Randomized controlled trial of in-office aids. Can Fam Physician. 2007;53:667–671. 666. [PMC free article] [PubMed] [Google Scholar]
- 15.Mayes T., Pichichero M.E. Are follow-up throat cultures necessary when rapid antigen detection tests are negative for group A streptococci? Clin Pediatr (Phila) 2001;40:191–195. doi: 10.1177/000992280104000402. [DOI] [PubMed] [Google Scholar]
- 16.Santos O., Weckx L.L., Pignatari A.C., Pignatari S.S. Detection of Group A beta-hemolytic Streptococcus employing three different detection methods: Culture, rapid antigen detecting test, and molecular assay. Braz J Infect Dis. 2003;7:297–300. doi: 10.1590/s1413-86702003000500003. [DOI] [PubMed] [Google Scholar]
- 17.Attia M.W., Zaoutis T., Klein J.D., Meier F.A. Performance of a predictive model for streptococcal pharyngitis in children. Arch Pediatr Adolesc Med. 2001;155:687–691. doi: 10.1001/archpedi.155.6.687. [DOI] [PubMed] [Google Scholar]
- 18.Dagnelie C.F., Bartelink M.L., van der G.Y., Goessens W., de Melker R.A. Towards a better diagnosis of throat infections (with group A beta-haemolytic streptococcus) in general practice. Br J Gen Pract. 1998;48:959–962. [PMC free article] [PubMed] [Google Scholar]
- 19.Fontes M.J., Bottrel F.B., Fonseca M.T., Lasmar L.B., Diamante R., Camargos P.A. Early diagnosis of streptococcal pharyngotonsillitis: Assessment by latex particle agglutination test. J Pediatr (Rio J) 2007;83:465–470. doi: 10.2223/JPED.1695. [DOI] [PubMed] [Google Scholar]
- 20.Ransohoff D.F., Feinstein A.R. Problems of spectrum and bias in evaluating the efficacy of diagnostic tests. N Engl J Med. 1978;299:926–930. doi: 10.1056/NEJM197810262991705. [DOI] [PubMed] [Google Scholar]
- 21.Willis B.H. Spectrum bias--why clinicians need to be cautious when applying diagnostic test studies. Fam Pract. 2008;25:390–396. doi: 10.1093/fampra/cmn051. [DOI] [PubMed] [Google Scholar]
- 22.Dimatteo L.A., Lowenstein S.R., Brimhall B., Reiquam W., Gonzáles R. The relationship between the clinical features of pharyngitis and the sensitivity of a rapid antigen test: Evidence of spectrum bias. Ann Emerg Med. 2001;38:648–652. doi: 10.1067/mem.2001.119850. [DOI] [PubMed] [Google Scholar]
- 23.Hall M.C., Kieke B., Gonzáles R., Belongia E.A. Spectrum bias of a rapid antigen detection test for group A beta-hemolytic streptococcal pharyngitis in a pediatric population. Pediatrics. 2004;114:182–186. doi: 10.1542/peds.114.1.182. [DOI] [PubMed] [Google Scholar]