Resumen
Objetivo
Conocer la viabilidad de la realización de la exploración oftalmológica básica de la patología ocular del paciente diabético desde el ámbito de la Atención Primaria de Salud (APS).
Diseño
Estudio transversal observacional prospectivo y multicéntrico.
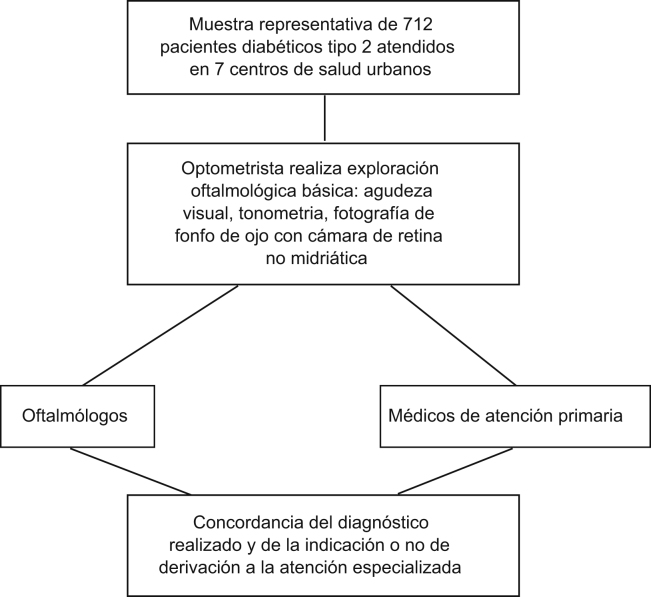
Participantes y método
Muestra de 712 diabéticos tipo II. Intervenciones: realización, por parte de un optometrista, de una exploración de la agudeza visual, medición de la presión intraocular y fotografía de fondo de ojo con cámara de retina no midriática. Interpretación de los resultados e indicación de derivación realizada, a doble ciego, por oftalmólogos y médicos APS.
Resultados
Alteración agudeza visual: médico APS 43,7%, oftalmólogo 36,1%, concordancia 70%; sospecha glaucoma: médico APS 8,8%, oftalmólogo 7,6%, concordancia 94%; retinopatía diabética: médico APS 28,2%, oftalmólogo 13,4%, concordancia 78%. Derivación Servicios Oftalmología: médico APS 56,8%, oftalmólogo 41,3% (p=0,001).
Conclusiones
El nivel de concordancia en los diagnósticos entre médico APS y oftalmólogo hace fiable la exploración oftalmológica del paciente diabético desde el ámbito de la APS. A pesar del supradiagnóstico y del 16% de derivación no justificada realizada por parte del médico APS, se evita la derivación a las consultas de oftalmología, de cerca de la mitad de los pacientes diabéticos.
Palabras clave: Oftalmopatía en la diabetes mellitus, Diagnóstico, Retinopatía diabética, Cámara no midriática, Atención Primaria
Abstract
Objective
To study the feasibility of a basic ophthalmological examination for the eye disease in diabetic patients by Primary Health Care (PHC).
Patients and methods
A multi-centre prospective study. A sample of 712 type 2 diabetics.
Interventions
Visual acuity examination, intraocular pressure measurement and the eye fundus photograph with a non-mydriatic camera taken by an optometrist. The interpretation and subsequent referral to an ophthalmology department by ophthalmologists and general practitioners (GP).
Results
Visual acuity deficiency: GP, 43.7%; ophthalmologist, 36.1%; concordance, 70%; glaucoma suspicion: GP, 8.8%; ophthalmologist, 7.6%; concordance, 94%; diabetic retinopathy: GP, 28.2%; ophthalmologist, 13.4%; concordance, 78%. Ophthalmology Department referral: GP, 56.8%; ophthalmologist, 41.3% (P=0.001).
Conclusions
Agreement between GP and ophthalmologist leads to a reliable ophthalmological examination of the diabetic patient in PHC. Despite an over-diagnosis and 16% of non-justified referrals by the GP, Ophthalmology Department referral is avoided in almost half of the diabetic patients.
Keywords: Eye disease in diabetes mellitus, Diagnosis, Diabetic retinopathy, Non-mydriatic camera, Primary health care
Introducción
La diabetes es una de las principales causas de ceguera en los países desarrollados1, 2 y sus manifestaciones a nivel ocular van más allá de la retinopatía diabética (RD). La visión del diabético puede verse agravada por la mayor frecuencia de cataratas, glaucoma y neurooftalmopatía3, 4, 5, 6, por ello la exploración oftalmológica debería incluir la agudeza visual, medición de presión intraocular (PIO) y exploración del fondo ojo.
La cobertura de exploración oftalmológica del paciente diabético es baja, con más de un 30% de pacientes no explorados nunca7, 8, 9, 10 e incluso con un elevado número de pacientes con riesgo conocido de RD potencialmente grave y tratable no controlados periódicamente8.
La fotografía de fondo de ojo con cámara no midriática es un método de detección de RD seguro, eficaz, fácil de utilizar, barato y accesible al paciente11, 12, 13, 14, 15, 16, 17 que permite, también, explorar el nervio óptico y realizar, junto con la medición de la PIO, el cribado de glaucoma. La medición de PIO desde la Atención Primaria de Salud (APS) puede realizarse, por un optometrista, mediante un tonómetro de chorro de aire, que se ha demostrado útil y válido para el cribado del glaucoma en diabéticos18. Dicho técnico puede realizar, también, la exploración de agudeza visual y la fotografía de retina completando la exploración oftalmológica del paciente diabético. Después un oftalmólogo puede interpretar los resultados.
Este estudio parte de la hipótesis de que un médico de APS, previamente formado, puede realizar la interpretación de esta exploración oftalmológica derivando a la Atención Especializada exclusivamente los pacientes con resultados patológicos.
El objetivo del presente estudio es conocer la viabilidad de la realización de la exploración oftalmológica básica del paciente diabético desde la APS valorando el grado de fiabilidad en el diagnóstico entre médico APS y oftalmólogo, utilizando un índice de concordancia.
Métodos
Ámbito-sujetos estudio: población diabética mayor de 14 años atendida en 7 centros de salud urbanos del Sector Sanitario de Terrassa-Rubí-Sant Cugat situado en el Vallés Occidental (Barcelona), pertenecientes al Consorci Sanitari de Terrassa, Mútua de Terrassa e Institut Català de la Salut.
Diseño: estudio transversal observacional prospectivo y multicéntrico.
Selección muestra: muestra representativa de 1.217 pacientes diagnosticados de diabetes mellitus tipo II, seleccionados del registro informatizado de los centros de salud y estratificado por edad, sexo y centro participante. Criterios utilizados para calcular la muestra: universo 9.185; IC del 95%; precisión 3%; prevalencia de RD 28% según datos de la literatura (13) y pérdidas 30%.
Recursos humanos: un optometrista que realizó la exploración de agudeza visual, PIO y fotografía fondo de ojo, y un equipo seleccionado de 11 médicos APS que realizaron la interpretación de resultados y la indicación de derivación o no al Servicio de Oftalmología. La interpretación por los médicos APS se inició después de un curso de formación de la patología a estudio con una parte teórica y una práctica.
De los centros hospitalarios de referencia, se seleccionaron 3 oftalmólogos que formaron a los médicos APS y realizaron la interpretación de la exploración oftalmológica y la indicación de derivación.
Recursos materiales: para la agudeza visual se utilizaron optotipos de visión lejana y agujeros multiestenopeicos. Las fotografías se realizaron con una cámara no midriática Canon CR6-45NM con digitalizador incorporado modelo MV300. La PIO se determinó con un tonómetro de chorro de aire Nidek AF 13358.
Exploración: para la agudeza visual se utilizó un optotipo de proyección. Si el paciente utilizaba lentes correctoras se indicó su colocación. Si se objetivaba una disminución de agudeza visual, esta era comprobada mediante la utilización de un agujero multiestenopeico. El valor registrado de PIO fue la media de 3 determinaciones consecutivas. En cuanto al fondo de ojo, se realizó como mínimo una fotografía de cada ojo repitiéndose las veces que el optometrista consideró oportuno.
Interpretación exploración: la interpretación de la exploración oftalmológica y la indicación de derivación fue de doble ciego, realizada por un oftalmólogo y un médico APS seleccionados, de los participantes, a través de un programa informático. La interpretación del oftalmólogo se consideró de referencia.
Criterios diagnósticos
Agudeza visual: se consideró patológica cualquier disminución de aparición en los últimos 6 meses, no conocida o no percibida por el paciente.
Sospecha glaucoma: una o varias de las siguientes alteraciones: 1) PIO superior o igual a 22 mmHg; 2) presencia de hemorragias papilares; 3) asimetría entre excavación papilar superior o igual al 20%; 4) irregularidad excavación papilar
Sospecha diagnóstico RD: 1) fondo ojo normal; 2) RD fondo leve-moderada sin afectación macular; 3) RD fondo severa-muy severa o RD pre-proliferativa; 4) RD proliferativa, y 5) edema macular clínicamente significativo.
Calidad fotografías: grados: 1. calidad excelente; 2. definición mayoría detalles de retina; 3. definición limitada; 4. visualización exclusiva grandes detalles; 5. detalles no visibles. En las fotografías grado 4–5 el optometrista registró los motivos de calidad deficiente (miosis, cataratas, nistagmus, parpadeo, ptosis palpebral, no colaboración del paciente).
Criterios derivación
Diferida (menos de 30 días): agudeza visual inferior a 0,5, PIO entre 22–29 mmHg sin alteración papilar, PIO entre 22–25 mmHg con alteración papilar, RD fondo leve-moderada sin maculopatía y fondo de ojo no visible.
Preferente (7–30 días): agudeza visual inferior a 0,15, PIO superior a 30 mmHg sin alteración papilar, PIO entre 26–29 mmHg con alteración papilar, RD fondo severa-muy severa, RD proliferativa y edema macular clínicamente significativo.
Urgente (menos de 7 días): PIO superior a 35 mmHg.
No derivación: normalidad exploraciones y/o controles periódicos con oftalmólogo.
El médico APS de cada paciente recibió un informe escrito con los resultados de las exploraciones y la derivación o no al servicio de oftalmología.
Definición de falsos positivos y falsos negativos
Falsos positivos: son los casos en los que el diagnóstico concreto del médico de APS no es dado por el oftalmólogo (o bien porque no hay patología o porque el diagnóstico es diferente).
Falsos negativos: son los casos en los que el diagnóstico concreto del oftalmólogo no es dado por el médico de APS.
Análisis estadístico
Se realizó una descripción de la población a estudio presentando los resultados de las variables cualitativas con las frecuencias absolutas y relativas y de las variables cuantitativas con la media, desviación estándar y los correspondientes IC del 95%.
Se estudió la posible relación entre diagnóstico de RD y glaucoma utilizando para la comparación la prueba de contraste de hipótesis de la chi-cuadrado.
La concordancia entre 2 medidas de una misma variable cualitativa, obtenidas por 2 observadores, se midió por el índice de kappa.
El nivel de significación estadística considerado fue del 5%.
Esquema general del estudio.
Estudio transversal observacional prospectivo y multicéntrico, para conocer la viabilidad de la realización de la exploración oftalmológica básica del paciente diabético desde la APS, valorando el grado de concordancia en el diagnóstico de la patología oftalmológica entre el médico de Atención primaria y el oftalmólogo de referencia
Resultados
De los 1.217 pacientes diabéticos citados se incluyeron en el estudio 712 (pérdidas 41,5%). Los pacientes estudiados tenían una edad media de 66±13 años y eran hombres un 52,8%.
Los antecedentes oftalmológicos previos conocidos fueron un 43,6% alteración de agudeza visual, un 33,3% antecedentes de cataratas (un 56,6% tratados quirúrgicamente), un 8,4% glaucoma (un 91,6% tratamiento farmacológico) y un 8,6% RD (un 95% antecedentes laserterapia).
Realizaban algún tipo de control oftalmológico el 74,6% (530) de estos pacientes.
Con la cámara no midriática, se realizaron fotografías al 94,7% de pacientes. Las principales causas de no realización fueron: la opacidad de medios (38,7%), la miosis refractaria a la oscuridad (33%), la no colaboración del paciente (10,6%), la ptosis palpebral (3,5%), el parpadeo continuado (1,7%) y el nistagmus (0,4%).
Por problemas técnicos, en relación al tonométro de aire, la tonometría no se pudo realizar en 42 pacientes (5,9%). Después de la realización de las fotografías se objetivaron problemas informáticos, sin relación con la visibilidad del fondo de ojo, que impidieron la valoración de 46 fotografías del ojo derecho y 42 del ojo izquierdo.
La calidad de las fotografías fue adecuada en un 86,8% de los casos según el médico de APS (un 29% grado 1 o excelente, un 42,1% grado 2 o de definición de la mayoría de detalles de la retina y un 15,7% grado 3 o definición limitada) y en un 88,6% según el oftalmólogo (un 34,4% grado 1 o excelente, un 36,3% grado 2 o definición de la mayoría de detalles de la retina y un 17,9% grado 3 o definición limitada). El grado 4 o de visualización exclusiva de grandes detalles se consideró en un 5,6% de los casos por el médico APS y en un 4,5% por el oftalmólogo. Por último, la calidad de las fotografías fue de grado 5 o de detalles no visibles en un 7,6% de los casos según el médico APS y en un 6,8% según el oftalmólogo. No se observaron diferencias significativas, en cuanto a la determinación del grado de calidad, entre la interpretación realizada por uno u otro facultativo.
En la tabla 1 se muestran los resultados de los diagnósticos según el médico de APS y el oftalmólogo, con el grado de significación estadística.
Tabla 1.
Diagnósticos efectuados por los médicos APS y los oftalmólogos, de las complicaciones oculares del paciente diabético tipo II
| Médico Atención Primaria |
Oftalmólogo |
p | |||
|---|---|---|---|---|---|
| n | % | n | % | ||
| Alteración de agudeza visual | 311 | 43,7 | 257 | 36,1 | 0,007 |
| Sospecha de glaucoma⁎ | 59 | 8,8 | 51 | 7,6 | 0,523 |
| Presión intraocular elevada⁎⁎ | 47 | 7,0 | 45 | 6,7 | 0,501 |
| Hemorragias papilares⁎ | 11 | 1,6 | 4 | 0,6 | 0,137 |
| Asimetría de la excavación papilar⁎ | 14 | 2,1 | 34 | 5,1 | 0,014 |
| Irregularidad papilar⁎ | 27 | 4,0 | 26 | 3,9 | 0,903 |
| Retinopatía diabética (RD)⁎ | |||||
| No RD | 416 | 62,5 | 489 | 73,4 | 0,015 |
| RD de fondo leve-moderada | 139 | 20,9 | 64 | 9,6 | 0,001 |
| RD de fondo severa | 29 | 4,3 | 10 | 1,5 | 0,003 |
| RD proliferativa | 4 | 0,6 | 0 | 0,044 | |
| EMCS⁎⁎⁎ | 16 | 2,4 | 15 | 2,2 | 0,528 |
| Total RD | 188 | 28,2 | 89 | 13,4 | 0,001 |
| Fondo de ojo no visible⁎ | 62 | 9,3 | 88 | 13,2 | 0,021 |
Sobre un total de 666 pacientes explorados.
Sobre un total de 670 pacientes explorados.
Edema macular clínicamente significativo.
La concordancia de diagnósticos entre el médico de APS y el oftalmólogo en la agudeza visual fue del 70% (índice kappa 0,41; IC 0,33–0,48), en la sospecha de glaucoma del 94% (índice kappa 0,74; IC 0,66–0,81) y en el diagnóstico de RD del 78% (índice kappa 0,42; IC 0,33–0,50). Los falsos positivos y falsos negativos y los diferentes diagnósticos de RD quedan referidos en las Tabla 2, Tabla 3.
Tabla 2.
Diagnóstico de agudeza visual y glaucoma: porcentajes de concordancia, falsos negativos y falsos positivos entre los diagnósticos del médico de Atención primaria y del oftalmólogo
| Concordancia | Falso negativo | Falso positivo | |
|---|---|---|---|
| Alteración de agudeza visual | 70% | 10% | 20% |
| Sospecha de glaucoma | 94% | 2% | 4% |
| Presión intraocular elevada | 98,7% | 0,3% | 1% |
| Hemorragias papilares | 99,4% | 0,2% | 0,4% |
| Asimetría de la excavación papilar | 98,2% | 1,2% | 0,6% |
| Irregularidad papilar | 96,4% | 1,5% | 2,1% |
Tabla 3.
Retinopatía diabética: falsos positivos y falsos negativos del médico de Atención primaria en los diferentes diagnósticos
| Falsos positivos |
Falsos negativos |
||
|---|---|---|---|
| Diagnóstico médico Atención Primaria | Diagnóstico oftalmólogo | Diagnóstico oftalmólogo | Diagnóstico médico Atención Primaria |
| 85 RD fondo leve | 115 no retinopatía | 10 RD fondo leve | 33 no RD |
| 12 RD severa | diabética (RD) | 2 EMCS | |
| 9 EMCS | 21 no visible | ||
| 9 no visible | |||
| 96 RD fondo leve | 85 no RD | 10 no RD | 20 RD fondo leve |
| 3 RD severa | 6 RD severa | ||
| 1 EMCS | 2 EMCS | ||
| 7 no visible | 2 no visible | ||
| 22 RD de fondo moderada–severa | 11 no RD | 3 RD fondo leve | 4 RD fondo moderada–severa |
| 6 RD fondo leve | 1 RD proliferativa | ||
| 5 EMCS | |||
| 4 RD proliferativa | 1 RD severa | – | – |
| 2 EMCS | |||
| 1 no visible | |||
| 11 EMCS | 9 no RD | 2 no RD | 10 EMCS |
| 2 RD fondo leve | 1 RD fondo leve | ||
| 5 RD severa | |||
| 2 RD proliferativa | |||
| 20 no RD | 28 fondo de ojo no visible | 7 no RD | 9 fondo de ojo no visible |
| 7 RD fondo leve | 2 RD fondo leve | ||
| 1 RD proliferativa | |||
| Concordancia de diagnóstico de retinopatía diabética 78% | |||
EMCS: edema macular clínicamente significativo.
La tabla 4 muestra las diferencias en la proporción de diagnósticos de oftalmopatía en pacientes diabéticos realizados por los diferentes médicos APS en relación con su oftalmólogo de referencia. Las mayores diferencias entre observadores, se produjeron en la valoración de la alteración de agudeza visual.
Tabla 4.
Proporción de diagnósticos de oftalmopatía en la diabetes mellitus realizados por los diferentes médicos de Atención Primaria (MAP) en relación con el oftalmólogo de referencia
| Alteración de agudeza visual (%) |
Sospecha de glaucoma (%) |
Sospecha de retinopatía diabética (%) |
|||||||
|---|---|---|---|---|---|---|---|---|---|
| Oftalmólogo | MAP | p | Oftalmólogo | MAP | p | Oftalmólogo | MAP | p | |
| MAP 1 | 50 | 49 | 0,860 | 6 | 12 | 0,403 | 30 | 34 | 0,399 |
| MAP 2 | 39 | 77 | 0,001 | 6 | 5 | 0,757 | 19 | 10 | 0,002 |
| MAP 3 | 27 | 58 | 0,003 | 9 | 24 | 0,112 | 11 | 35 | 0,039 |
| MAP 4 | 18 | 48 | 0,001 | 6 | 8 | 0,936 | 23 | 33 | 0,502 |
| MAP 5 | 31 | 56 | 0,002 | 9 | 13 | 0,421 | 12 | 28 | 0,076 |
| MAP 6 | 38 | 50 | 0,236 | 14 | 13 | 0,985 | 23 | 22 | 0,992 |
| MAP 7 | 36 | 20 | 0,056 | 4 | 4 | 1,000 | 18 | 45 | 0,020 |
| MAP 8 | 26 | 23 | 0,802 | 7 | 7 | 1,000 | 19 | 32 | 0,522 |
| MAP 9 | 36 | 57 | 0,005 | 5 | 6 | 0,877 | 8 | 56 | 0,001 |
| MAP 10 | 53 | 12 | 0,001 | 6 | 0 | 0,206 | 10 | 12 | 0,900 |
| MAP 11 | 39 | 13 | 0,004 | 14 | 6 | 0,431 | 11 | 35 | 0,066 |
Las derivaciones a la atención especializada se exponen en la tabla 5. En el caso de derivaciones preferentes por RD solo se alcanzó significación estadística en el edema macular clínicamente significativo (EMCS), no en la RD severa ni en la RD proliferativa.
Tabla 5.
Tipos de derivación al servicio de oftalmología de referencia
| Médico Atención Primaria |
Oftalmólogo |
p | |||
|---|---|---|---|---|---|
| n | % | n | % | ||
| Derivación diferida | 328 | 46,1 | 259 | 36,4 | 0,001 |
| Alteración de agudeza visual | 116 | 16,3 | 113 | 15,9 | 0,039 |
| Sospecha de glaucoma | 40 | 6,0 | 32 | 4,8 | 0,443 |
| Retinopatía diabética | 132 | 19,8 | 64 | 9,6 | 0,047 |
| Fondo de ojo no visible | 71 | 10,7 | 114 | 17,1 | 0,001 |
| Otras causas⁎ | 71 | 10,6 | 32 | 4,8 | 0,003 |
| Derivación preferente | 76 | 10,7 | 35 | 4,9 | 0,001 |
| Alteración de agudeza visual | 39 | 5,5 | 12 | 1,7 | 0,046 |
| Sospecha de glaucoma | 2 | 0,3 | 3 | 0,4 | 0,529 |
| Retinopatía diabética | 59 | 8,8 | 29 | 4,3 | 0,020 |
| Otras causas⁎ | 13 | 1,8 | 7 | 1,0 | 0,501 |
| Derivación urgente | 0 | 0 | |||
| Presión intraocular superior a 35 mmHg | 0 | 0 | |||
| Otras causas⁎ | 0 | 0 | |||
Derivación realizada por causas no relacionadas con las patologías estudiadas.
La concordancia en la derivación diferida fue del 90% (índice kappa 0,80; IC del 95%: 0,76–0,84), y en la derivación preferente del 94% (índice kappa 0,60; IC del 95%: 0,48–0,72).
Discusión
La incorporación de la cámara no midriática en la APS incrementa la exploración de fondo de ojo del paciente diabético y el cribado de la RD19, 20, 21, 22 y del glaucoma mediante el estudio de la papila23, 24, 25, 26, 27. El estudio completo de la oftalmopatía en la diabetes requiere también la determinación de agudeza visual y la PIO. En la APS, un optometrista podría realizar estas exploraciones y un médico APS, previamente formado, interpretar los resultados28.
La exploración oftalmológica realizada se puede considerar eficiente ya que más del 90% de los pacientes estudiados pudieron ser explorados de forma completa, y en cerca de un 90% de los casos la calidad de las fotografías permitió realizar el diagnóstico.
Analizando los resultados obtenidos de la exploración de la agudeza visual se observaron diferencias significativas entre la valoración del médico de APS y del oftalmólogo. El médico de APS realizó un supradiagnóstico de patología a pesar del cual la concordancia del 70% podría considerarse aceptable. Llama la atención que en la interpretación de datos exclusivamente numéricos y protocolizados se puedan observar estas diferencias lo cual nos hace pensar que la experiencia del oftalmólogo puede ser un factor subjetivo añadido en la interpretación final realizada.
Durante el periodo de formación, para el diagnóstico de sospecha de glaucoma, los médicos de APS valoraron como de dificultad elevada la interpretación de las alteraciones de papila especialmente la asimetría de excavación papilar y la irregularidad papilar. Sin embargo este diagnóstico fue similar entre los 2 profesionales con una elevada concordancia en las 4 variables analizadas.
En cuanto a la RD nuestros resultados muestran un supradiagnóstico llevado a cabo por el médico APS en especial en la RD de fondo leve y en el EMCS. Sin embargo, la concordancia final fue aceptable ya que el porcentaje de falsos negativos resultó ser bajo. Es evidente que un supradiagnóstico conlleva el inconveniente de una mayor derivación pero es más importante asegurar una baja proporción de patología no detectada, hecho que se consiguió en el presente estudio. Este supradiagnóstico podría ser subsanado con la pericia que desarrollaría el médico APS si esta interpretación se instaurara dentro de su práctica habitual.
Los falsos positivos de EMCS diagnosticados por el médico APS, eran pacientes que presentaban lesiones en el fondo de ojo que correspondían a otro tipo de enfermedades oculares desconocidas para dicho profesional. En el caso de la RD de fondo leve la mayor experiencia del oftalmólogo pudo hacer que no considerara valorables la presencia de mínimas lesiones como algún microaneurisma aislado.
El índice kappa valoró la concordancia de diagnósticos como moderada en el caso de la alteración de la agudeza visual y de la sospecha de RD y como buena en el caso de sospecha de glaucoma. La proporción de falsos positivos acaba influyendo de forma negativa en la valoración de este índice, sin embargo consideramos que la relevancia clínica de un falso positivo es mucho menor que la de un falso negativo.
Analizando experiencias previas publicadas en la literatura la concordancia del diagnóstico global de RD en este estudio fue inferior a la observada por Andonegui et al29. Esto podría estar relacionado con una mayor variabilidad en los resultados dado que el número de médicos de APS que interpretaban las fotografías fue mayor que en el del trabajo del citado autor hecho que, por otro lado, hace que el estudio se asemeje más a la realidad diaria de la asistencia del paciente diabético en la APS. Otras diferencias respecto al estudio de Andonegui, es que nuestro trabajo tiene su origen y diseño desde la APS y contempla no solo el cribaje de la RD sino la exploración oftalmológica global de la población diabética.
Para el paciente y el sistema sanitario, aparte del diagnóstico, es fundamental la realización de una derivación correcta al servicio de atención especializada. En este estudio, la concordancia, entre el médico de APS y el oftalmólogo fue buena tanto en la derivación diferida como en la preferente.
Una de las limitaciones del presente estudio pudo ser la dedicación de un tiempo insuficiente de formación de los facultativos de APS. Sin embargo la experiencia que se obtendría con la incorporación de esta actividad en la práctica clínica habitual del médico de la APS acabaría influyendo en la mejora de los resultados. A dicha actividad deberían incorporarse, de forma voluntaria, los médicos APS interesados y sensibilizados en las complicaciones oculares del paciente diabético.
Analizando los datos de derivación se puede destacar que el oftalmólogo vería un 16% más de pacientes de los que le correspondería por patología (el 10% de forma diferida y el 6% de forma preferente) pero dejaría de visitar el 54% de pacientes diabéticos que no tienen ningún tipo de lesión.
El aumento en el número de pacientes cribados por la mayor accesibilidad de la exploración y por el hecho de que esta sea más completa comportaría un mayor número de diagnósticos, de exploraciones complementarias y tratamientos. Así, los oftalmólogos realizarían un menor número de visitas de cribaje y un mayor número de visitas de pacientes con patología.
El nivel de concordancia en los diagnósticos entre el médico de APS y el oftalmólogo hace fiable la exploración oftalmológica del paciente diabético desde la APS. A pesar del supradiagnóstico y de la derivación no justificada realizada por parte del médico de APS, la derivación al oftalmólogo se evita en casi la mitad de los pacientes. Esto último acabaría repercutiendo de forma favorable sobre el propio paciente.
Resultaría interesante y factible la ampliación de esta experiencia a otros territorios, hecho que se podría realizar si se consiguieran las condiciones necesarias entre las cuales estaría la presencia del optometrista en el ámbito de la APS.
La diabetes mellitus tipo II es una enfermedad cuyo diagnóstico y control debe realizarse básicamente desde la APS y por lo tanto desde ella debería diseñarse y dirigir todas las intervenciones a realizar en los pacientes diabéticos, siempre con el soporte de la atención especializada. Para ello es imprescindible facilitar los recursos necesarios a este ámbito a fin de poder llevar a cabo correctamente sus objetivos.
Puntos clave
Lo conocido sobre el tema
-
•
Baja cobertura de exploración oftalmológica en pacientes con diabetes mellitus, a pesar de ser una de las principales causas de ceguera en países desarrollados.
-
•
La cámara de retina no midriática es un buen método para la exploración del fondo de ojo del paciente diabético.
Qué aporta este estudio
-
•
La realización de una exploración oftalmológica completa (agudeza visual, PIO y fotografía de fondo de ojo) del paciente diabético desde el ámbito de la APS con la incorporación de la figura del optometrista.
-
•
La interpretación de los resultados de dicha exploración oftalmológica por parte del médico de Atención primaria y del oftalmólogo, con buena concordancia.
-
•
Derivación exclusiva a la atención especializada de los pacientes diabéticos con patología ocular o con fondo de ojo no visible con el método de la cámara de retina no midriática.
Financiación
Beca FIS (Fondo de Investigación Sanitaria) del Instituto de Salud Carlos III. Ministerio de Sanidad y Consumo, 2005–07.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- 1.Resnikoff S., Pascolini D., Etya’ale D., Kocur I., Pararajasegaram R., Pokharel G.P. Global data on visual impairtment in the year 2002. Bulletin of the World Health Organization. 2004;82:844–851. [PMC free article] [PubMed] [Google Scholar]
- 2.O.N.C.E. Datos visuales y sociodemográficos de los afiliados a la ONCE. Año 2007. [consultado 5/1/2010]. Disponible en: http://www.once.es/home.cfm?id=192&nivel=3&orden=6.
- 3.Fernández-Vigo J., Macarro A., Sabugal J.F., Chacón J. Diabetes ocular (I): Retinopatía diabética. Av Diabetol. 1994;8:89–106. [Google Scholar]
- 4.Fernández-Vigo J., Macarro A., Perianes J.F., Chacón J. Diabetes ocular (II): Neuro-oftalmopatía. Catarata. Glaucoma. Otras manifestaciones. Av Diabetol. 1994;9:5–18. [Google Scholar]
- 5.Bonovas S., Peponis V., Filoussi K. Diabetes mellitus as a risk factor for primary open-angle glaucoma: a meta-analysis. Diabet Med. 2004;21:609–614. doi: 10.1111/j.1464-5491.2004.01173.x. [DOI] [PubMed] [Google Scholar]
- 6.Pasquale L.R., Kang J.H., Manson J.E., Willet W.C., Rosner B.A., Hankinson S.E. Prospective study of type 2 diabetes mellitus and risk of primary open-angle glaucoma in women. Ophthalmology. 2006;113:1081–1086. doi: 10.1016/j.ophtha.2006.01.066. [DOI] [PubMed] [Google Scholar]
- 7.Sprafka J.M., Fritsche T.L., Baker R., Kurth D., Whipple D. Prevalence of Undiagnosed Eye Disease in High-Risk Diabetic Individuals. Arch Intern Med. 1990;150:857–861. [PubMed] [Google Scholar]
- 8.Espinàs J., Salla R.M., Bellvehí M., Reig E., Iruela T., Muñoz E. Reevaluación del programa de diabetes mellitus tipo II. Propuesta de indicadores de calidad. Aten Primaria. 1993;11:123–126. [PubMed] [Google Scholar]
- 9.González-Clemente J.M. Diabetes Mellitus no dependiente de insulina: asistencia en un área de Barcelona. Med Clin (Barc) 1997;108:91–97. [PubMed] [Google Scholar]
- 10.Sender Palacios M.J., Vernet Vernet M., Larrosa Sáez P., Tor Figueras E., Foz Sala M. Características sociodemográficas y clínicas de una población de pacientes con diabetes mellitus. Aten Primaria. 2002;29:474–480. doi: 10.1016/S0212-6567(02)70616-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Peters A.L., Davidson M.B., Ziel F.H. Cost-Effective Screening for diabetic retinopathy using nonmydriatic retinal Camera in a prepaid health-care setting. Diab Care. 1993;16:1193–1195. doi: 10.2337/diacare.16.8.1193. [DOI] [PubMed] [Google Scholar]
- 12.Hernáez Ortega M.C., Soto Pedre E., Vázquez J.A., Gutiérrez M.A., Asua J. Estudio de la eficiencia de una cámara de retina no midriática en el diagnóstico de retinopatía diabética. Rev Clín Esp. 1998;198:194–199. [PubMed] [Google Scholar]
- 13.Sender Palacios M.J., Maseras Bover M., Vernet Vernet M., Larrosa Sáez P., De la Puente Martorell M.L., Foz Sala M. Aplicación de un método de detección precoz de retinopatía diabética en la atención primaria de salud. Rev Clin Esp. 2003;203:224–229. doi: 10.1016/s0014-2565(03)71249-1. [DOI] [PubMed] [Google Scholar]
- 14.Sender Palacios M.J., Montserrat Bagur S., Badia Llach X., Maseras Bover M., De la Puente Martorell M.L., Foz Sala M. Cámara de retina no midriática: estudio coste-efectividad en la detección precoz de retinopatía diabética. Med Clin. 2003;121:446–452. [PubMed] [Google Scholar]
- 15.Stellingwerf C., Hardus P.L., Hooymans J.M. Two-field photography can identify patiens with vision-threatening diabetic retinopathy: a screening approach in the primary care setting. Diabetes Care. 2001;24:2086–2090. doi: 10.2337/diacare.24.12.2086. [DOI] [PubMed] [Google Scholar]
- 16.Baeza Díaz M., Gil Guillén V., Orozco Beltrán D., Pedrera Carbonell V., Ribera Montes C., Pérez Pons I. Validez de la cámara no midriática en el cribado de la retinopatía diabética y análisis de indicadores de riesgo de la retinopatía. Arch Soc Esp Oftalmol. 2004;79:433–442. doi: 10.4321/s0365-66912004000900005. [DOI] [PubMed] [Google Scholar]
- 17.Cabrea López F., Cardona Guerra P., López Bastida J., Díaz Arriaga J. Evaluación de la efectividad y coste-efectividad de la imagen digital en el diagnóstico de la retinopatía diabética. Arch Soc Can Oftal. 2004;15:21–31. [Google Scholar]
- 18.Sarrión Ferre M.T., Hervás J.M., Blanquer Gregori J.J., Mulet Pons M.J., Marín Rueda N., Barea Montoro A. Cribado del glaucoma en pacientes diabéticos mediante el tonómetro de Schiörtz. Aten Primaria. 1996;17:18–22. [PubMed] [Google Scholar]
- 19.Piniés J.A. Retinografía con cámara no midriática. Av Diabetol. 2005;21:217–221. [Google Scholar]
- 20.Lin D.Y., Blumenkranz M.S., Brothers R.J., Grosvenor D.M. The sensitivity and specificity of single-field nonmydriatic monochromatic digital fundus photography with remote image interpretation for diabetic retinopaty screening: a comparison with ophtalmoscopy and standardized mydriatic color photography. Am J Ophthalmol. 2002;134:204–213. doi: 10.1016/s0002-9394(02)01522-2. [DOI] [PubMed] [Google Scholar]
- 21.Ahmed J., Ward T.P., Bursell S.E., Aiello L.M., Cavallerano J.D., Vigersky M.D. The sensitivity and specificity of nonmydriatic digital stereoscopic retinal imaging in detecting diabetic retinopathy. Diabetes Care. 2002;25:2205–2209. doi: 10.2337/dc06-0295. [DOI] [PubMed] [Google Scholar]
- 22.Massin P., Aubert J.P., Eschwege E., Erginay A., Bourovitch J.C., BenMehidi A. Evaluation of a screening program for diabetic retinopathy in a primay care setting. Dodia (Déspistage ophtalmologique du diabète) study. Diabetes Metab. 2005;31:153–162. doi: 10.1016/s1262-3636(07)70181-7. [DOI] [PubMed] [Google Scholar]
- 23.Tuulonen A., Airaksinen P., Montagna A., Nieminen H. Screening for glaucoma with a non-mydriatic fundus camera. Acta Ophthalmol. 1990;68:445–449. doi: 10.1111/j.1755-3768.1990.tb01674.x. [DOI] [PubMed] [Google Scholar]
- 24.Komulainen R., Tuulonen A., Airaksinen P. The follow-up of patients screened for glaucoma with non-mydriatic fundus photography. Int Ophthalmol. 1992;16:465–469. doi: 10.1007/BF00918438. [DOI] [PubMed] [Google Scholar]
- 25.Tuulonen A., Ohinmaa T., Alanko H., Hyytinen P., Juutinen A., Toppinen E. The application of teleophthalmology in examining patients with glaucoma: a pilot study. J Glaucoma. 1999;8:367–373. [PubMed] [Google Scholar]
- 26.Yogesan K., Constable I.J., Barry C.J., Eikelboom R.H., Morgan W., Tay-Kearney M.L. Evaluation of a portable fundus camera for use in the teleophthalmologic diagnosis of glaucoma. J Glaucoma. 1999;8:297–301. [PubMed] [Google Scholar]
- 27.Detry-Morel M., Zeyen T., Kestelyn P., Collignon J., Goethals M. Screening for glaucoma in a general population with the non-mydriatic fundus camera and the frequency doubling perimeter. Eur J Of Ophthalmol. 2004;14:387–393. doi: 10.1177/112067210401400505. [DOI] [PubMed] [Google Scholar]
- 28.Sender Palacios MJ, Vernet Vernet M, Ondategui Parra JC, Salvador Playà A, Pascual Batlle L, Maseras Bover, M. Exploracion oftalmologica basica del paciente diabetico en la Atención Primaria. [consultado 5/1/2010]. Disponible en: http://www.siicsalud.com/dato/experto.php/84753.
- 29.Andonegui J., Berástegui L., Serrano L., Eguzkiza A., Gaminde I., Aliseda D. Concordancia en el estudio de retinografías en diabéticos: oftalmólogos vs médicos de familia. Arch Soc Esp Oftalmol. 2008;83:527–532. doi: 10.4321/s0365-66912008000900004. [DOI] [PubMed] [Google Scholar]