Resumen
Objetivo
Comparar 3 diferentes métodos de medida de la multimorbilidad en función del uso de recursos sanitarios (coste de la asistencia) en atención primaria (AP).
Diseño
Estudio retrospectivo realizado a partir de registros médicos informatizados.
Emplazamiento
En 13 equipos de AP de Cataluña.
Participantes
Pacientes adscritos que demandaron atención durante el año 2008.
Medidas principales
Variables sociodemográficas, de comorbilidad y de coste. Los métodos de comparación fueron: a) índice de comorbilidad combinado (ICC): se elaboró un índice propio a partir de las puntuaciones de episodios agudos y crónicos; b) índice de Charlson (iCh), y c) índices de casuística de los Adjusted Clinical Groups: bandas de utilización de recursos (BUR). El modelo de costes se estableció diferenciando los costes fijos (funcionamiento de los centros) y los variables. Análisis estadístico: se desarrollaron 3 modelos de regresión lineal para evaluar la capacidad explicativa de cada medida de comorbilidad; que se compararon a partir del coeficiente de determinación (R2), p < 0,05.
Resultados
Se seleccionaron 227.235 pacientes; el promedio/unitario del coste de la asistencia fue de 654,2 €. El ICC explica un R2 = 50,4%, el iCh un R2 = 29,2% y las BUR un R2 = 39,7% de la variabilidad del coste. El comportamiento del ICC es aceptable, no obstante con puntuaciones bajas (entre 1 y 3 puntos) no se consiguen resultados tan concluyentes.
Conclusiones
El ICC se muestra como un sencillo y posible predictor del coste de la asistencia en AP en situación de práctica clínica habitual. De confirmarse estos resultados posibilitarían una mejora en la comparación de la casuística.
Palabras clave: Adjusted Clinical Groups, Comorbilidad, Uso de recursos, Atención primaria, Coste sanitario
Abstract
Objective
To compare three methods of measuring multiple morbidity according to the use of health resources (cost of care) in primary healthcare (PHC).
Design
Retrospective study using computerized medical records.
Setting
Thirteen PHC teams in Catalonia (Spain).
Participants
Assigned patients requiring care in 2008.
Main measurements
The socio-demographic variables were co-morbidity and costs. Methods of comparison were: a) Combined Comorbidity Index (CCI): an index itself was developed from the scores of acute and chronic episodes, b) Charlson Index (ChI), and c) Adjusted Clinical Groups case-mix: resource use bands (RUB). The cost model was constructed by differentiating between fixed (operational) and variable costs. Statistical analysis: 3 multiple lineal regression models were developed to assess the explanatory power of each measurement of co-morbidity which were compared from the determination coefficient (R2), p< .05.
Results
The study included 227,235 patients. The mean unit of cost was €654.2. The CCI explained an R2 = 50.4%, the ChI an R2 = 29.2% and BUR an R2 = 39.7% of the variability of the cost. The behaviour of the ICC is acceptable, albeit with low scores (1 to 3 points), showing inconclusive results.
Conclusions
The CCI may be a simple method of predicting PHC costs in routine clinical practice. If confirmed, these results will allow improvements in the comparison of the case-mix.
Keywords: Adjusted Clinical Groups, Comorbidity, Resource use, Primary healthcare, Health care costs
Lo conocido sobre el tema
-
•
La multimorbilidad es la concurrencia de varias enfermedades o condiciones de salud en una persona sin dominancia entre ambas.
-
•
La presencia de múltiples enfermedades es muy frecuente en edades avanzadas. Estudios poblacionales han comprobado como el número de enfermedades que presentan los sujetos aumenta con la edad.
-
•
Existen diferentes índices de comorbilidad que permiten la reducción de las enfermedades de una persona a una puntuación final.
Qué aporta este estudio
-
•
La comparación entre tres índices de comorbilidad.
-
•
Se elabora un Índice de Comorbilidad Combinado (ICC) a partir de un grupo de trabajo.
-
•
El ICC se muestra como un sencillo predictor del coste de la asistencia en AP en situación de práctica clínica habitual.
-
•
De confirmarse estos resultados posibilitarían una mejora en la comparación de la casuística entre centros de AP, en función del coste de la asistencia.
Introducción
El envejecimiento progresivo de la población ocasiona un aumento de la morbilidad y como consecuencia un incremento en el uso de los recursos sanitarios1, 2, 3, 4. Desde una perspectiva conceptual deberíamos diferenciar el término «comorbilidad» (entidad, enfermedad o condición de salud que ha existido o puede ocurrir durante el curso evolutivo de un paciente a partir de una enfermedad base), del de «multimorbilidad/pluripatología» (concurrencia de varias enfermedades o condiciones de salud en una persona sin dominancia entre ambas). Estos 2 términos aparecen en la literatura médica de forma indistinta, a pesar de expresar diferentes conceptos5, 6, 7.
La afectación de diferentes problemas de salud en el mismo sujeto puede tener consecuencias en el diagnóstico de las enfermedades8, el tratamiento9, el uso de los servicios sanitarios10, la calidad de vida12, 13, la discapacidad14 y el riesgo de muerte15, por citar algunos ejemplos. Además, la pluripatología, entendida como la aparición de 2 o más enfermedades crónicas en un mismo paciente cada vez es más frecuente en nuestra sociedad16. La presencia de múltiples enfermedades es muy frecuente en edades avanzadas, y estudios poblacionales han comprobado cómo el número de enfermedades que presentan los sujetos aumenta con la edad. Se ha descrito que el 24% de los mayores de 65 años y el 31,4% de los mayores de 85 años presentan 4 o más condiciones crónicas17, 18, 19.
Existen diferentes índices de comorbilidad que permiten la reducción de las enfermedades de una persona a una puntuación final. Para medir este concepto de comorbilidad/pluripatología se pueden usar indicadores sencillos (suma de problemas crónicos), aunque desde el ámbito clínico se emplean indicadores que tengan en cuenta la gravedad/severidad de las diferentes enfermedades consideradas20, 21, 22, 23. En la bibliografía con frecuencia se utiliza el índice de Charlson (iCh)24 que adjudica distintos pesos a cada enfermedad según el riesgo de muerte y también el Cumulative Illnes Rating Scale Geriatrics25, 26 en el que cada uno de los problemas considerados se gradúa según una escala de gravedad. No obstante, el Functional Comorbidity Index27, el Index of CoExistent Disease28 o el índice de Kaplan29 son también métodos válidos, reproducibles y frecuentemente utilizados. En nuestro medio también se utilizan sistemas de clasificación por isoconsumo de recursos en función del grado de morbilidad de los pacientes, como los Adjusted Clinical Groups (ACG). Estos fueron desarrollados por Starfield y Weiner30 (Universidad Johns Hopkins), y su objetivo principal es medir el grado de enfermedad basándose en distintos niveles de comorbilidad31.
Las evidencias disponibles en cuanto a la relación entre los índices de comorbilidad, el consumo de recursos y los costes reales de la asistencia en atención primaria (AP) son limitadas. Por tanto, los estudios dirigidos a mejorar el conocimiento entre la asociación de estas variables en la predicción de los costes de la asistencia resultan pertinentes10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32. El objetivo del estudio fue la comparación entre 3 métodos de medida de la multimorbilidad para determinar su asociación con el uso de los recursos sanitarios y sus costes en varios centros de AP de Cataluña, en situación de práctica clínica habitual.
Pacientes y método
Diseño y ámbito del estudio
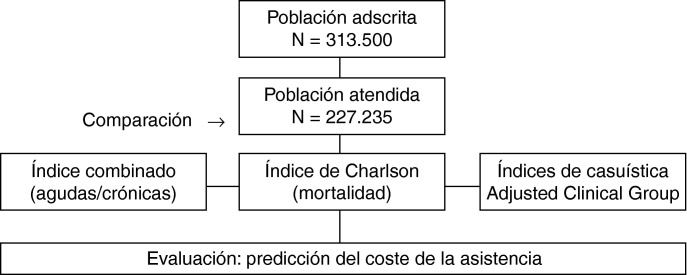
Estudio multicéntrico de carácter retrospectivo (cohorte histórica), realizado a partir de los registros médicos (historias clínicas informatizadas) de pacientes seguidos en AP. La población de estudio está formada por personas de ambos sexos asignadas a 13 centros de AP de Cataluña pertenecientes a 4 entidades proveedoras (Badalona Serveis Assistencials: Apenins-Montigalá, Morera-Pomar, Montgat-Tiana, Nova Lloreda, Martí-Julià y La Riera; Consorci Sanitari Integral: Gaudí, Sagrada Familia, Torrassa y Collblanc; GesClínic: Les Corts y Rosselló) y La Roca del Vallès (La Roca); que tienen asignada en su zona de influencia a una población de unos 313.500 habitantes, de los que un 16,1% son mayores de 64 años. La población asignada a los equipos fue en su mayoría urbana, de nivel socioeconómico medio-bajo y de predominio industrial. La organización sanitaria presenta en todos los centros una gestión de titularidad pública y provisión privada de servicios (concertados con el Servicio Catalán de la Salud: CatSalut). Fueron incluidos en el estudio todos los pacientes que demandaron atención y que estuvieran adscritos (asignados) a los centros durante el año 2008. Se excluyeron los sujetos trasladados a otros centros de AP, los desplazados y los que únicamente fueron atendidos por los especialistas integrados (atención especializada) durante el período de estudio.
Principales medidas
Se analizaron las siguientes variables: a) generales: edad, sexo, entidad proveedora, centro, servicio clínico (medicina de familia [pacientes mayores de 14 años], pediatría [entre 0-14 años]); b) de casuística o comorbilidad (episodios de atención); y c) de coste directo total. El conjunto de visitas relacionadas con el problema de salud concreto fue definido como el contacto (centro de salud y/o domicilio) entre el equipo de profesionales y el paciente. La extensión de la utilización se definió como el cociente de los pacientes atendidos entre los habitantes asignados. Se consideró un episodio de atención o un motivo de consulta como un proceso equivalente al diagnóstico, y se definió según la Clasificación Internacional de la AP (CIAP-2)33. El diseño del sistema de costes parciales se definió teniendo en cuenta los requerimientos de información y el grado de desarrollo de los sistemas de información disponibles.
Métodos de comparación de la comorbilidad
Índice de Comorbilidad Combinado (ICC)
Para su elaboración se constituyó un grupo de trabajo formado por 6 profesionales (un documentalista, 4 médicos clínicos y un técnico consultor). Procedimiento realizado: a) identificación de los episodios/motivos de consulta agudos y crónicos de la CIAP-2 (n = 686 códigos), en sus componentes 1 (signos y síntomas) y 7 (enfermedades), que se estableció a partir de un criterio subjetivo y en función de su práctica clínica. En este sentido, las enfermedades recurrentes en el tiempo se consideraron crónicas (rinitis alérgica, lumbalgia, etc.). Se requirieron un total de 6 sesiones de trabajo para establecer un acuerdo total entre el grupo de trabajo (consenso total); b) establecer una puntuación a cada episodio: agudo (1 punto) y crónico (2 puntos); c) asignar una suma de puntuaciones a cada paciente en función del número de episodios atendidos durante el período de estudio; y d) además, se constató la concordancia existente entre los resultados del grupo de trabajo (criterio de validación) y los descritos por los autores de la CIAP-2 (criterio de referencia: O‘Halloran et al.)19 (tabla 1). En este sentido la concordancia (índice de Kappa) fue del 81,5% (IC del 95%: 72,7-90,3%).
Tabla 1.
Concordancia entre el criterio de asignación de los episodios agudos y crónicos entre la CIAP-2 (referencia) y los descritos en el estudio (validación)
| Método de validación | Criterio de referencia | |
|---|---|---|
| Variable ICC | Autores CIAP-2 |
|
| n = 686 | Positivo | Negativo |
| Positivo | 501 | 39 |
| Negativo | 8 | 138 |
| Índices/estadísticos | Valor (%) | IC del 95% |
|---|---|---|
| Validez de la medida | ||
| Sensibilidad | 98,4 | 87,5-99,3 |
| Especificidad | 78,1 | 75,0-81,2 |
| Valor predictivo positivo | 92,8 | 90,9-94,7 |
| Valor predictivo negativo | 94,5 | 91,9-97,1 |
| Fiabilidad | ||
| Área bajo la curva ROC | 93,6 | 89,1-98,2 |
| Concordancia | ||
| Kappa ponderado (Cohen) | 81,5 | 72,7-90,3 |
ICC: índice de comorbilidad combinado; CIAP-2: Clasificación Internacional de la Atención Primaria; IC: intervalos de confianza.
Significación estadística: p < 0,001 en todos los casos.
Índice de comorbilidad de Charlson (iCh)
Es el índice de comorbilidad más utilizado en la literatura médica, con propósitos diversos34. Fue desarrollado por Charlson et al.24 en los años 1980, consta de 22 condiciones y fue diseñado para predecir la mortalidad a un año. A cada condición se le asigna una puntuación de 1, 2, 3 o 6, dependiendo del riesgo de fallecer; después se suman las puntuaciones, obteniendo una puntuación total por paciente
Índices de casuística obtenidos a partir de los Adjusted Clinical Groups (ACG)
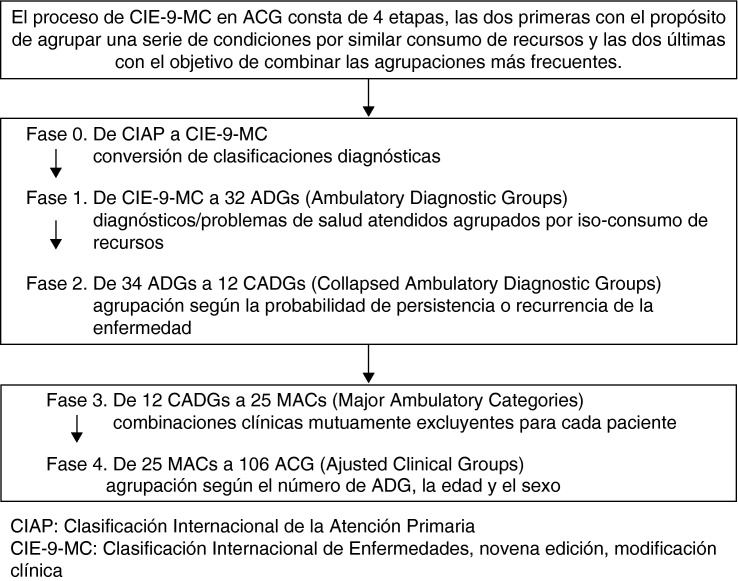
El algoritmo de funcionamiento del Grouper ACG versión 8.2 (http://www.acg.jhphs.edu)35 está formado por una serie de pasos consecutivos hasta la obtención de 106 ACG, grupos mutuamente excluyentes para cada paciente atendido. Para la construcción de un ACG se requiere la edad, el sexo y los motivos de consulta o diagnósticos codificados según la CIE-9-MC. El proceso de CIE-9-MC en ACG consta de 4 etapas, las 2 primeras con el propósito de agrupar una serie de condiciones según sea similar el consumo de recursos y las 2 últimas con el objetivo de combinar las agrupaciones más frecuentes (fig. 1). A partir de los grupos ACG el aplicativo proporciona las bandas de utilización de recursos (BUR), donde cada paciente en función de su morbilidad queda agrupado en una de las 5 categorías mutuamente excluyentes (1: usuarios sanos; 2: morbilidad baja; 3: morbilidad moderada; 4: morbilidad elevada; y 5: morbilidad muy elevada)
Figura 1.
Breve algoritmo de funcionamiento del Grouper ACG (versión 8.2).
Modelo de costes y uso de recursos
La unidad de producto asistencial que sirvió de base al cálculo final fue el coste por paciente atendido durante el período de seguimiento (año 2008). El modelo desarrollado para cada paciente en AP se estableció diferenciando los costes semifijos (funcionamiento) y las variables (en función de la actividad desarrollada por cada paciente que los genera). Las principales partidas contables pertenecientes al primer grupo fueron: personal (sueldos y salarios), compras (fármacos, material sanitario, instrumental y los gastos procedentes de las compras de otros aprovisionamientos), servicios externos y un conjunto de gastos pertenecientes a los servicios de estructura y gestión del centro, de acuerdo con el Plan General Contable para los Centros de Asistencia Sanitaria. La asignación de los gastos semifijos a cada paciente se hizo en función de un criterio de reparto por visita realizada (promedio/unitario: gastos semifijos/número total de visitas). Los costes variables/paciente se calcularon en función de las solicitudes diagnósticas, terapéuticas (prescripción farmacéutica) o derivaciones efectuadas por los profesionales del centro. Los diferentes conceptos de estudio y su valoración económica fueron los siguientes: laboratorio (muestras solicitadas de hematología, bioquímica, serología o microbiología; gasto medio por petición), radiología (peticiones de radiología simple, radiología con contraste, ecografías, mamografías y ortopantomografías; gasto medio por petición), pruebas complementarias (tarifa adaptada); interconsultas (derivaciones efectuadas a los especialistas de referencia o a los centros hospitalarios; tarifa adaptada), prescripciones (recetas a cargo del CatSalut, agudas, crónicas o a demanda; precio de venta al público por envase). Las tarifas utilizadas procedieron de los estudios de contabilidad analítica realizados en los centros o facturas de productos intermedios emitidas por los diferentes proveedores (tabla 2). Se obtuvo un coste medio por visita realizada y se efectuó un reparto directo final para cada paciente. Por tanto, el coste por paciente fue: Cp = (coste medio por visita x número de visitas [costes semifijos]) + (costes variables). Toda la información requerida para el estudio se obtuvo a partir de las historias clínicas informatizadas de los centros, a excepción de la prescripción farmacéutica que se consiguió del aplicativo (SPF) del CatSalut.
Tabla 2.
Detalle del promedio de los costes unitarios del año 2008
| Recursos sanitarios | Coste unitario (€) |
|---|---|
| Visita sanitaria | 23,62 |
| Pruebas de laboratorio | 22,70 |
| Radiología convencional | 18,84 |
| Pruebas diagnósticas/terapéuticas | 37,85 |
| Derivación a especialista de referencia | 106,29 |
| Prescripción farmacéutica | PVPiva |
PVPiva: precio de venta al público con IVA.
Fuente de los recursos sanitarios: contabilidad analítica propia.
Confidencialidad de la información
Se respetó la confidencialidad de los registros marcada por la Ley Orgánica de Protección de Datos (15/1999, de 13 de Diciembre), disociando los datos. El proyecto del estudio fue aprobado por el Comité de Ética e Investigación Clínica del Instituto de Investigación Clínica Jordi Gol (IDIAP Jordi Gol).
Análisis estadístico
Como paso previo al análisis, y en particular a la fuente de información perteneciente a las historias clínicas informatizadas, se revisaron cuidadosamente los datos, observando sus distribuciones de frecuencia y buscando posibles errores de registro o de codificación. Se efectuó un análisis estadístico descriptivo con valores de media, desviación típica/estándar (DE) y percentiles, y se comprobó la normalidad de la distribución con la prueba de Kolmogorov-Smirnov. En el análisis bivariante se utilizaron las pruebas paramétricas de ANOVA y ji al cuadrado. La comparación descriptiva de las 3 medidas de multimorbilidad se efectuó con la correlación lineal y para determinar la variabilidad de cada categoría, el coeficiente de variación de Pearson (CV: desviación estándar entre la media aritmética). Con la finalidad de conseguir una mejor adaptación a la normalidad de la distribución, en el análisis se realizó una transformación de la variable dependiente del coste de la asistencia a partir del logaritmo neperiano. Para determinar que índice de multimorbilidad predice mejor el coste (variable dependiente), se realizó un modelo de regresión lineal múltiple (procedimiento: pasos consecutivos), con la edad y el sexo como covariables fijas. En concreto, el poder explicativo de cada método (corregido por edad y sexo) se estableció en función del cociente de determinación (R2) del modelo, y este se obtuvo entre el cociente de la varianza intragrupo y la total. Se utilizó el programa SPSSWIN versión 18, estableciendo una significación estadística para valores de p < 0,05.
Esquema general del estudio: Estudio retrospectivo realizado a partir de registros médicos informatizados de 13 equipos de AP de Cataluña, durante el año 2008.
Resultados
El número de habitantes adscritos a los centros de AP durante el año 2008 fue de 227.235, un 86,5% a medicina de familia y un 13,5% a pediatría. En la tabla 3 se detallan las características generales de la serie estudiada, la comorbilidad y algunos resultados de utilización de servicios (coste de la asistencia). Los pacientes presentaron una media de 4,5 (3,2) episodios y 8,1 (8,2) visitas realizadas/año. El porcentaje de varones (51,1 frente a 43,3%, p < 0,001) y de visitas (9,7 frente a 7,8; p < 0,001) fueron superiores en el servicio de pediatría. La frecuentación fue de 5,9 visitas/habitante/año, siendo superior en el servicio de pediatría 9,5 visitas/habitante/año. La edad media de las mujeres fue superior a la de los hombres, 39,2 frente a 37,8 (p < 0,001). Destaca una fuerte asociación entre el número de visitas realizadas y el promedio de episodios atendidos (r = 0,798; p < 0,001) en los pacientes. Cabe destacar que el coste total fue de 148,7 millones de euros, un 92,9% de medicina de familia. Al 80,1% de los pacientes se les prescribió algún tipo de medicamento; al 62,2% de medicina de familia se les realizó alguna prueba de laboratorio; mientras que al 33,0% de pediatría se les efectuó algún tipo de derivación. Los costes de funcionamiento o fijos representan el 29,1%, y los variables el 70,9% sobre el total, destacando un 47,5% la prescripción farmacéutica. Por tanto, el coste unitario total por visita realizada/año fue de 190,7 € (193,3) y el promedio de coste total por paciente/año de 654,2 € (702,5 € en medicina de familia y 344,6 € en pediatría, p < 0,001). En relación con los centros participantes, estas variables no mostraron diferencias destacadas.
Tabla 3.
Características generales del estudio: comorbilidad y modelo de costes sanitarios
| Características | Total |
|---|---|
| Pacientes | n = 227.235 |
| Generales | |
| Número de médicos | 224 |
| Número de episodios | 1.020.606 |
| Número de visitas | 1.834.326 |
| Promedio de edad, años | 44,1 (23,7) |
| - Percentil 25 | 27,0 |
| - Percentil 50 | 43,0 |
| - Percentil 75 | 67,0 |
| Sexo (mujeres) | 55,6% |
| Comorbilidad general | |
| Promedio de episodios | 4,5 (3,2) |
| Promedio índice de Charlson | 0,2 (0,6) |
| BUR | 2,4 (0,8) |
| - 1 usuario sano | 16,9% |
| - 2 morbilidad baja | 31,0% |
| - 3 morbilidad moderada | 47,9% |
| - 4 morbilidad elevada | 3,8% |
| - 5 morbilidad muy elevada | 0,5% |
| Modelo de costes (en euros) por año | Promedio/unitario | Porcentaje |
|---|---|---|
| - Funcionamiento (costes fijos) | 190,7 (193,3) | 29,1% |
| - Laboratorio | 51,9 (73,8) | 7,9% |
| - Radiología convencional | 21,4 (34,1) | 3,3% |
| - Pruebas complementarias | 6,2 (19,6) | 1,0% |
| - Derivaciones a especialistas | 73,1 (117,3) | 11,2% |
| - Prescripción farmacéutica | 310,8 (681,2) | 47,5% |
| Coste total en AP | 654,2 (851,7) | 100,0% |
| - Coste en medicina de familia | 92,9% | |
| - Coste en pediatría (0–14 años) | 7,1% |
Valores expresados en media (DE: desviación estándar) o porcentaje.
AP: atención primaria; BUR: bandas de utilización de recursos.
En la tabla 4 se describe el modelo de correlaciones binarias entre las variables estudiadas. Tomando como referencia el coste bruto en AP se obtienen correlaciones moderadas con la edad (r = 0,458), el iCh (r = 0,449) y BUR (r = 0,459), p < 0,001. Las correlaciones mejoran con el ICC (r = 0,633), p < 0,001. Considerando los costes transformados (logaritmo neperiano), las mejores correlaciones se consiguen también con el ICC (r = 0,701), p < 0,001. Diferenciando los episodios agudos y los crónicos, estos últimos en relación con el coste total alcanzan una mayor correlación (r = 0,478 frente a r = 0,687; p < 0,001), respectivamente.
Tabla 4.
Correlaciones binarias entre las variables estudiadas
| Correlaciones | Edad | Sexo | ICC | iCh | BUR | Coste |
|---|---|---|---|---|---|---|
| Sexo | 0,070 | |||||
| Episodios | 0,307 | 0,116 | ||||
| ICC | 0,404 | 0,104 | ||||
| iCh | 0,347 | −0,059 | 0,479 | |||
| BUR | 0,385 | 0,067 | 0,675 | 0,397 | ||
| Coste en AP | 0,458 | 0,048 | 0,633 | 0,449 | 0,459 | |
| LN del coste | 0,492 | 0,078 | 0,701 | 0,388 | 0,623 | 0,777 |
| IC del 95% | 0,463-0,521 | 0,067-0,089 | 0,667-0,735 | 0,362-0,414 | 0,591-0,655 | 0,741-0,813 |
AP: Atención Primaria; IC: intervalos de confianza. ICC: índice de comorbilidad combinado; iCh: índice de Charlson; BUR: bandas de utilización de recursos; LN: logaritmo neperiano.
Detalle del test de normalidad de la variable coste: coste bruto: ji cuadrado = 64,954, p < 0,001; LN del coste, con transformación: ji cuadrado = 4,975, p = 0,001.
Método: correlaciones binarias de Pearson; significación estadística: p < 0,01 en todos los casos.
Los modelos de regresión lineal múltiple para la predicción de las variables explicativas se muestran en la tabla 5. En el modelo de costes brutos el ICC y la edad explican el 44,3%, mientras que en el corregido el 52,8% de la variabilidad. En los 2 casos (coste bruto y corregido), el iCh ocupa una posición intermedia y las BUR del sistema de clasificación ACG aportan un poder explicativo menor (< 1%). La influencia del sexo en los 2 modelos es escasa (último paso). El 60,1% de la casuística atendida se agrupa en 10 ACG. El poder explicativo de la toda la clasificación ACG (ajuste del modelo) fue del 36,9% para el coste total. Es importante destacar que por cada uno de los modelos específicos desarrollados, el ICC explican un R2 = 50,4%, el iCh un R2 = 29,2% y las BUR un R2 = 39,7%.
Tabla 5.
Modelos de regresión lineal múltiple. Variables explicativas
| Modelos | Variables incluidas | Costes brutos |
Costes trasformados |
||
|---|---|---|---|---|---|
| R2 | β | R2 | β | ||
| Modelo generala | |||||
| 1 | ICC | 0,411 | 0,361 | 0,483 | 0,191 |
| 2 | Edad | 0,443 | 0,216 | 0,528 | 0,184 |
| 3 | Índice de Charlson | 0,447 | 0,139 | 0,567 | 0,241 |
| 4 | BUR | 0,451 | 0,106 | 0,575 | 0,316 |
| Modelos específicos | |||||
| Modelo 1 | ICC | 0,447 | 0,504 | ||
| Modelo 2 | BUR | 0,352 | 0,397 | ||
| Modelo 3 | Índice de Charlson | 0,275 | 0,292 | ||
β: coeficientes tipificados; costes transformados (logaritmo neperiano); BUR: bandas de utilización de recursos; ICC: índice de comorbilidad combinado; R2: coeficiente de determinación.
Orden de entrada: la variable sexo no obtuvo resultados estadísticamente significativos. Modelos específicos (variables dependientes: ICC, BUR e índice de Charlson, respectivamente) corregidos por edad y sexo.
Modelo general (variable dependiente: coste sanitario); método de entrada en la predicción: pasos consecutivos; significación estadística: p < 0,001.
En la tabla 6 se detalla la distribución del promedio/unitario del coste de la asistencia según las puntuaciones obtenidas por los 3 índices de multimorbilidad estudiados. En general, el ICC presenta un peor comportamiento (CV > 130%) en los rangos de puntuación bajos entre 1-3. Desde la puntuación 6 hasta la 19 (percentil 99) se consiguen CV < 100%. Las puntuaciones del ICC presentan un mejor comportamiento individual en Pediatría. En el caso del iCh el 82,0% de los pacientes no quedan asignados a ninguna puntuación definida (puntuación 0); además, el promedio/unitario del coste no sigue una tendencia ascendente según la escala de puntuaciones (rangos: 473,7–3.930,3 €). En las BUR se observa un efecto parecido; el 47,9% de los pacientes se concentran en las bandas 1 y 2, con una elevada variabilidad intragrupo (169,3 y 121,2%, respectivamente).
Tabla 6.
Distribución del promedio/unitario del coste de la asistencia según la comparación de los 3 índices de multimorbilidad y por los servicios de medicina de familia y pediatría
| Puntuaciones obtenidas | Total n = 227.235 |
Medicina de Familia N = 196.593 |
Pediatría N = 30.642 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|
| N | % | Mediaa | CV | N | Mediaa | CV | N | Mediaa | CV | |
| A) Índice de comorbilidad combinado | ||||||||||
| 1 | 33.339 | 14,7% | 165,9 | 205,3% | 29.015 | 175,3 | 204,8% | 4.324 | 102,4 | 152,0% |
| 2 | 30.408 | 13,4% | 246,1 | 152,6% | 25.928 | 260,6 | 153,1% | 4.480 | 162,2 | 102,2% |
| 3 | 28.050 | 12,3% | 357,0 | 130,8% | 23.507 | 379,8 | 131,8% | 4.543 | 238,7 | 76,7% |
| 4 | 23.973 | 10,5% | 446,0 | 112,4% | 19.857 | 474,9 | 113,2% | 4.116 | 306,9 | 70,9% |
| 5 | 21.264 | 9,4% | 567,8 | 116,9% | 17.628 | 606,7 | 117,6% | 3.636 | 379,4 | 67,6% |
| 6 | 17.571 | 7,7% | 666,2 | 97,9% | 14.669 | 709,3 | 98,0% | 2.902 | 448,2 | 59,6% |
| 7 | 14.831 | 6,5% | 794,2 | 91,3% | 12.646 | 841,4 | 90,9% | 2.185 | 521,1 | 57,8% |
| 8 | 11.974 | 5,3% | 918,7 | 90,4% | 10.393 | 967,6 | 90,2% | 1.581 | 597,4 | 52,1% |
| 9 | 9.718 | 4,3% | 1.060,6 | 79,0% | 8.669 | 1.105,2 | 77,9% | 1.049 | 692,2 | 68,9% |
| 10 | 7.806 | 3,4% | 1.190,5 | 75,6% | 7.158 | 1.228,1 | 74,1% | 648 | 775,4 | 85,6% |
| 11 | 6.192 | 2,7% | 1.316,6 | 71,6% | 5.756 | 1.354,9 | 70,8% | 436 | 810,8 | 51,3% |
| 12 | 4.963 | 2,2% | 1.447,5 | 67,1% | 4.666 | 1.479,9 | 66,5% | 297 | 938,5 | 57,0% |
| 13 | 3.847 | 1,7% | 1.631,5 | 68,4% | 3.695 | 1.655,3 | 68,1% | 152 | 1.053,4 | 50,8% |
| 14 | 3.030 | 1,3% | 1.760,7 | 62,7% | 2.940 | 1.782,1 | 62,3% | 90 | 1.061,7 | 42,1% |
| 15 | 2.309 | 1,0% | 1.922,9 | 63,6% | 2.242 | 1.946,3 | 63,3% | 67 | 1.139,4 | 31,3% |
| 16 | 1.786 | 0,8% | 2.059,0 | 57,0% | 1.763 | 2.071,2 | 56,8% | 23 | 1.122,8 | 32,6% |
| 17 | 1.377 | 0,6% | 2.188,4 | 57,5% | 1.359 | 2.200,5 | 57,3% | 18 | 1.274,9 | 40,1% |
| 18 | 949 | 0,4% | 2.263,7 | 57,7% | 945 | 2.268,3 | 57,6% | 4 | 1.166,7 | 26,5% |
| 19 | 753 | 0,3% | 2.451,2 | 58,8% | 748 | 2.455,4 | 58,9% | 5 | 1.820,6 | 37,3% |
| B) Índice de Charlson | ||||||||||
| 0 | 186.348 | 82,0% | 473,7 | 125,5% | 156.887 | 500,3 | 125,9% | 29.461 | 332,1 | 95,5% |
| 1 | 24.720 | 10,9% | 1.284,4 | 81,6% | 23.675 | 1.311,5 | 80,5% | 1.045 | 669,5 | 83,3% |
| 2 | 9.520 | 4,2% | 1.622,5 | 82,6% | 9.399 | 1.635,7 | 82,1% | 121 | 599,5 | 105,7% |
| 3 | 4.190 | 1,8% | 1.874,3 | 80,3% | 4.180 | 1.876,7 | 80,2% | 10 | 887,8 | 76,9% |
| 4 | 1.354 | 0,6% | 2.288,8 | 67,0% | 1.353 | 2.289,9 | 67,0% | 1 | 784,1 | 0,0% |
| 5 | 502 | 0,2% | 2.589,7 | 67,6% | 502 | 2.589,7 | 67,6% | 4 | 526,2 | 70,3% |
| 6 | 459 | 0,2% | 1.602,9 | 102,4% | 455 | 1.612,4 | 102,1% | — | ||
| 7 | 82 | 0,0% | 2.550,1 | 74,2% | 82 | 2.550,1 | 74,2% | — | ||
| 8 | 38 | 0,0% | 3.930,3 | 152,8% | 38 | 3.930,3 | 152,8% | — | ||
| 9 | 22 | 0,0% | 2.162,0 | 102,9% | 22 | 2.162,0 | 72,9% | — | ||
| C) Bandas de utilización de recursosb | ||||||||||
| 1 | 38.360 | 16,9% | 185,0 | 169,3% | 30.657 | 193,2 | 176,9% | 7.703 | 153,4 | 102,2% |
| 2 | 70.348 | 31,0% | 344,5 | 121,2% | 56.197 | 347,0 | 128,4% | 14.151 | 334,5 | 83,5% |
| 3 | 108.847 | 47,9% | 896,1 | 99,2% | 100.362 | 928,3 | 98,2% | 8.485 | 515,2 | 74,7% |
| 4 | 8.651 | 3,8% | 1.964,8 | 74,9% | 8.351 | 2.003,0 | 73,5% | 300 | 901,7 | 109,1% |
| 5 | 1.029 | 0,5% | 2.746,8 | 63,2% | 1.026 | 2.751,2 | 63,1% | 3 | 1.252,3 | 83,3% |
N: número de pacientes; las puntuaciones del índice de comorbilidad combinado fueron truncados en el percentil 99: 19,0 puntos (total de pacientes: 98,6%; medicina de familia: 98,5%; pediatría: 99,7%).
Valores expresados en euros; CV: coeficiente de variación de Pearson.
Bandas de utilización de recursos (BUR) obtenidos a partir del sistema de clasificación de pacientes por isoconsumo de recursos Adjusted Clinical Groups (ACG).
Discusión
Nuestro estudio relaciona la carga de morbilidad a partir de la comparación de 3 métodos de comorbilidad, con el uso de los recursos sanitarios y los costes de la asistencia, con el propósito de evaluar su adecuación en pacientes atendidos en varios centros de AP de Cataluña. En este aspecto, cabe destacar que la organización de la AP en nuestro país, a partir de la asignación poblacional de base territorial y la creciente informatización de sus centros, ofrecen un marco idóneo para realizar estudios de alcance geográfico en situación de práctica clínica habitual2, 3. No obstante, cabe destacar que sin una adecuada estandarización de las metodologías en cuanto a las características de los pacientes, así como en el número y medida de las variables estudiadas, los resultados obtenidos deben de interpretarse con prudencia obligándonos a ser cautelosos en la validez externa de los resultados36. Una aportación importante del estudio fue poder seleccionar un número de pacientes elevado, además del consenso obtenido en la categorización de enfermedad aguda o crónica por parte del grupo de trabajo, aspecto que entraña una cierta dificultad técnica en determinadas enfermedades.
Los costes de funcionamiento representan un 29% y los variables un 71% del total, destacando un 47,5% en la prescripción farmacéutica. Si bien estos resultados son de difícil comparación internacional, por la confluencia de distintos modelos de política sanitaria y sistemas organizativos, sí son similares a los estudios publicados tanto en nuestro país como en el entorno europeo37, 38, 39. Cabe destacar que en el modelo de costes empleado representó un 11% del coste, por lo que se pueden modificar las proporciones de los diferentes conceptos de estudio40. Parece evidente que a mayor carga de morbilidad, más utilización de los recursos, aumento del número de visitas y mayor necesidad de derivación a la atención especializada.
Los resultados generales de la población estudiada (variables demográficas, casuística y niveles de uso de recursos, se enmarcan dentro de los parámetros esperables en la AP en salud de nuestro país41. En este aspecto, en nuestro estudio se clasifican las enfermedades/problemas de salud en agudos y crónicos (ICC). Tomando como referencia la propia CIAP-2, y a modo de ejemplo, se observan algunas diferencias destacables con los propios autores19. El grupo de trabajo consideró que eran crónicas las anomalías congénitas, las neoplasias inespecíficas o la rinitis alérgica; mientras que el acné, el codo del tenista o el síndrome del túnel carpiano, las consideraron agudas. Si bien no es fácil esta distinción, las diferencias observadas pueden ser debidas a: a) la interpretación subjetiva del grado de severidad o recurrencia que pueda tener la enfermedad en un momento temporal concreto; b) al criterio/metodología empleado; c) a que las enfermedades recurrentes se consideraron crónicas; y/o d) a que durante los 25 años de funcionamiento de la CIAP-2 el diagnóstico/tratamiento de las enfermedades ha variado.
El coste en AP mostró unas correlaciones moderadas/altas con el ICC (r = 0,701). Por tanto, la comparación del ICC, iCh y de los índices de casuística de los ACG en relación al grado de predicción de los costes ha mostrado un cierto grado de variabilidad. El ICC incorpora de una forma sencilla un sistema de puntuación basado en enfermedades agudas y crónicas; sin tener en cuenta el grado de ponderación que pueda tener la propia prevalencia de la enfermedad o el correcto registro de la enfermedad en cuestión, parece evidente que en la AP se realizan muchas actividades (prevención, curación, etc.) que necesita tener presente la enfermedad aguda (resfriado común: prevalencia del 11%) que conlleva un destacado uso de recursos. El iCh fue diseñado como un índice de mortalidad hospitalaria (aunque sus usos han sido muy diversos); en el estudio de Charlson et al.10, uno de los pocos trabajos realizados similares al nuestro, se consiguió un coeficiente de determinación del 22%; en nuestro estudio se sitúa en una posición intermedia. En la literatura consultada, el sistema ACG muestra una moderada capacidad de adaptación al entorno de Cataluña41, y le da una indudable aplicación práctica. Una posible explicación puede ser debida a que este sistema está pensado para un entorno poblacional, y no específicamente para AP. No obstante, las diferencias entre países en cuanto a modelos de políticas sanitarias y organizativas repercute en una capacidad de adaptación limitada42, 43. Por tanto, los diferentes índices de comorbilidad o sistemas de clasificación de pacientes por uso de recursos deben de aplicarse en función del motivo por el cual han sido diseñados, teniendo presente que la incorporación de estos a nuestro sistema sanitario no está exento de dificultades conceptuales y metodológicas.
En el estudio, el ICC explica el 50,4% de la variabilidad del coste. Aunque estos datos son de difícil interpretación por sí solos, no dejan de ser muy correctos en comparación con otros métodos empleados por isoconsumo de recursos10, 30. Además, su comportamiento a partir de la puntuación 6, consiguió CV < 100%. En puntuaciones bajas (1-3), no se consiguen resultados tan concluyentes, circunstancia que podría ser debida a una baja calidad de los registros o también a un gran número de enfermedades muy diversas con un diferente uso de recursos. Es posible que este índice pueda mejorar su capacidad explicativa (coste) si se realizara un rango de puntuaciones agudas y crónicas; y se ponderara el efecto de la edad.
Las limitaciones más destacadas del estudio deben relacionarse con el grado de desarrollo de los sistemas de información. En este sentido puede afectar la posible variabilidad en la selección del diagnóstico por parte de los médicos (incertidumbre en la codificación de diagnósticos), la existencia de poca especificidad clínica (validez del diagnóstico), y/o al método de cálculo de los costes (por haber elegido un sistema en base a tarifas)19, 24, 32. Pero la mayor limitación se presenta en la validez externa de los resultados, por una parte los centros estudiados no necesariamente son representativos de un universo general, puesto que fueron seleccionados por la calidad de sus sistemas de información; y por otra, la falta de gravedad/severidad de las enfermedades que puede ocasionar un sesgo de selección.
Futuras investigaciones de ámbito poblacional pueden tener su aplicación en el ajuste de riesgos de pago capitativo y en la gestión clínica de los centros30, 41. La proliferación de estudios similares, con criterios de definición homogéneos entre las variables, favorecerían la posibilidad de benchmarking entre centros y profesionales de diferentes organizaciones. No obstante, deberíamos profundizar en el comportamiento de las puntuaciones bajas en el ICC para reducir su porcentaje de variabilidad. Este índice podría ser la base para el desarrollo de un sistema de clasificación propio por isoconsumo de recursos sanitarios. Además, en cuanto a las posibles implicaciones de los resultados sobre la práctica diaria, podría obtenerse en la utilización de este tipo de medidas del estado de salud de los pacientes, para la asignación del presupuesto de farmacia.
En conclusión, entre los índices comparados el ICC se muestra como un sencillo predictor del coste de la asistencia en AP en situación de práctica clínica habitual. De confirmarse estos resultados posibilitarían una mejora en la comparación de la casuística entre centros. Además, los resultados aportan una posible aplicación práctica en la gestión clínica en AP, aunque se requeriría un mejor comportamiento en los rangos bajos de puntuación.
Financiación
Proyecto parcialmente financiado por el Fondo de Investigaciones Sanitarias de la Seguridad Social (Instituto de Salud Carlos III, Majahonda [Madrid], referencia: PI 08/1567).
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Anexo 1. Miembros del Grupo de Estudio ACG
Formado por: Grupo de Cataluña (Milagrosa Blanca-Tamayo, Esperanza Escribano-Herranz, Ferran Flor-Serra, Josep Ramón Llopart-López, Daniel Rodríguez-López, Encarna Sánchez-Fontcuberta, Josep Maria Vilaseca-Llobet), Grupo de Baleares (José Estelrich-Bennasar, Vicente Juan Verger, María Antònia Mir-Pons, María Vega Martín-Martín, Juan Antonio Pérez-Artigues) y Grupo de Aragón (José María Abad-Díez, María Mercedes Aza Pascual-Salcedo, Daniel Bordonaba-Bosque, Amaia Calderón-Larrañaga, Francisca González-Rubio, Anselmo López-Cabañas, Jesús Magdalena-Belio, Beatriz Poblador-Plou, Antonio Poncel-Falcó).
Bibliografía
- 1.World Health Organization . World Health Organization; Ginebra: 2002. The World Health Report 2002: reducing risk, promoting healthy life. [Google Scholar]
- 2.Forrest C.B., Lemke K.W., Bodycombe D.P., Weiner J.P. Medication, diagnostic, and cost information as predictors of high-risk patients in Need of Care Management. Am J Manag Care. 2009;15:41–48. [PubMed] [Google Scholar]
- 3.Rico A., Saltman R.B., Boerma W.G.W. Organizational restructuring in European health care systems: the role of primary care. Social Policy Admin. 2003;37:592–608. [Google Scholar]
- 4.Starfield B., Lemke K.W., Bernhardt T., Foldes S.S., Forrest C.B., Weiner J.P. Comorbidity: implications for the importance of primary care in ‘case’ management. Ann Fam Med. 2003;1:8–14. doi: 10.1370/afm.1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Boyd C.M., Ritchie C.S., Tipton E.F., Studenski S.A., Wieland D. From Bedside to Bench: summary from the American Geriatrics Society/National Institute on Aging Research Conference on Comorbidity and Multiple Morbidity in Older Adults. Aging Clin Exp Res. 2008;20:181–188. doi: 10.1007/bf03324775. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.John R., Kerby D.S., Hennessy C.H. Patterns and impact of comorbidity and multimorbidity among community-resident American Indian elders. Gerontologist. 2003;43:649–660. doi: 10.1093/geront/43.5.649. [DOI] [PubMed] [Google Scholar]
- 7.Valderas J.M., Starfield B., Sibbald B., Salisbury C., Roland M. Defining comorbidity: implications for understanding health and health services. Ann Fam Med. 2009;7:357–363. doi: 10.1370/afm.983. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Marrie R.A., Horwitz R., Cutter G., Tyry T., Campagnolo D., Vollmer T. Comorbidity delays diagnosis and increases disability at diagnosis in MS. Neurology. 2009;72:117–124. doi: 10.1212/01.wnl.0000333252.78173.5f. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Loga S., Loga-Zec S. Comorbidity in psychiatry: its impact on psychopharmacological treatment. Psychiatr Danub. 2009;21:347–349. [PubMed] [Google Scholar]
- 10.Charlson M.E., Charlson R.E., Peterson J.C., Marinopoulos S.S., Briggs W.M., Hollenberg J.P. The Charlson comorbidity index is adapted to predict costs of chronic disease in primary care patients. J Clin Epidemiol. 2008;61:1234–1240. doi: 10.1016/j.jclinepi.2008.01.006. [DOI] [PubMed] [Google Scholar]
- 11.Medrano Gonzalez F., Melero Bascones M., Barba Romero M.A., Gamez Garrido J., Llabres Diaz J., Moreno Salcedo J. Comorbidity, pluripathology, resource use and prognosis of patients hospitalized in internal medicine areas. An Med Intern. 2007;24:525–530. doi: 10.4321/s0212-71992007001100003. [DOI] [PubMed] [Google Scholar]
- 12.Chen H.Y., Baumgardner D.J., Rice J.P. Health-related quality of life among adults with multiple chronic conditions in the United States, behavioral risk factor surveillance system, 2007. Prev Chronic Dis. 2011;8:A09. [PMC free article] [PubMed] [Google Scholar]
- 13.Fortin M., Bravo G., Hudon C., Lapointe L., Almirall J., Dubois M.F. Relationship between multimorbidity and health-related quality of life of patients in primary care. Qual Life Res. 2006;15:83–91. doi: 10.1007/s11136-005-8661-z. [DOI] [PubMed] [Google Scholar]
- 14.Kriegsman D.M., Deeg D.J., Stalman W.A. Comorbidity of somatic chronic diseases and decline in physical functioning: the Longitudinal Aging Study Amsterdam. J Clin Epidemiol. 2004;57:55–65. doi: 10.1016/S0895-4356(03)00258-0. [DOI] [PubMed] [Google Scholar]
- 15.Menotti A., Mulder I., Nissinen A., Giampaoli S., Feskens E.J., Kromhout D. Prevalence of morbidity and multimorbidity in elderly male populations and their impact on 10-year all-cause mortality: The FINE study (Finland, Italy, Netherlands, Elderly) J Clin Epidemiol. 2001;54:680–686. doi: 10.1016/s0895-4356(00)00368-1. [DOI] [PubMed] [Google Scholar]
- 16.Denton F.T., Spencer B.G. Chronic health conditions: changing prevalence in an aging population and some implications for the delivery of health care services. Can J Aging. 2010;29:11–21. doi: 10.1017/S0714980809990390. [DOI] [PubMed] [Google Scholar]
- 17.Bartke A., Coschigano K., Kopchick J., Chandrashekar V., Mattison J., Kinney B. Genes that prolong life: Relationships of growth hormone and growth to aging and life span. J Gerontol Biol Sci. 2001;56A:B340–B349. doi: 10.1093/gerona/56.8.b340. [DOI] [PubMed] [Google Scholar]
- 18.Fried L.P., Bandeen-Roche K., Kasper J.D., Guralnik J.M. Association of comorbidity with disability in older women: The Women's Health and Aging Study. J Clin Epidemiol. 1999;52:27–37. doi: 10.1016/s0895-4356(98)00124-3. [DOI] [PubMed] [Google Scholar]
- 19.O‘Halloran J., Miller G.C., Britt H. Defining chronic conditions for primary care with ICPC-2. Fam Pract. 2004;21:381–386. doi: 10.1093/fampra/cmh407. [DOI] [PubMed] [Google Scholar]
- 20.Abizanda Soler P., Paterna Mellinas G., Martinez Sanchez E., Lopez Jimenez E. Evaluación de la comorbilidad en la población anciana: utilidad y validez de los instrumentos de medida. Rev Esp Geriatr Gerontol. 2010;45:219–228. doi: 10.1016/j.regg.2009.10.009. [DOI] [PubMed] [Google Scholar]
- 21.Chu Y.T., Ng Y.Y., Wu S.C. Comparison of different comorbidity measures for use with administrative data in predicting short- and long-term mortality. BMC Health Serv Res. 2010;10:140. doi: 10.1186/1472-6963-10-140. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.de Groot V., Beckerman H., Lankhorst G.J., Bouter L.M. How to measure comorbidity: a critical review of available methods. J Clin Epidemiol. 2003;56:221–229. doi: 10.1016/s0895-4356(02)00585-1. [DOI] [PubMed] [Google Scholar]
- 23.Harboun M., Ankri J. Comorbidity indexes: review of the literature and application to studies of elderly population. Rev Epidemiol Sante Publique. 2001;49:287–298. [PubMed] [Google Scholar]
- 24.Charlson M.E., Pompei P., Ales K.L., Mackenzie C.R. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chronic Dis. 1987;40:373–383. doi: 10.1016/0021-9681(87)90171-8. [DOI] [PubMed] [Google Scholar]
- 25.Linn B.S., Linn M.W., Gurel L. Cumulative illness rating scale. J Am Geriatr Soc. 1968;16:622–626. doi: 10.1111/j.1532-5415.1968.tb02103.x. [DOI] [PubMed] [Google Scholar]
- 26.Miller M.D., Paradis C.F., Houck P.R., Mazumdar S., Stack J.A., Rifai A.H. Rating chronic medical illness burden in geropsychiatric practice and research: Application of the Cumulative Illness Rating Scale. Psychiatry Res. 1992;41:237–248. doi: 10.1016/0165-1781(92)90005-n. [DOI] [PubMed] [Google Scholar]
- 27.Groll D.L., To T., Bombardier C., Wright J.G. The development of a comorbidity index with physical function as the outcome. J Clin Epidemiol. 2005;58:595–602. doi: 10.1016/j.jclinepi.2004.10.018. [DOI] [PubMed] [Google Scholar]
- 28.Greenfield S., Apolone G., McNeil B.J., Cleary P.D. The importance of co-existent disease in the occurrence of postoperative complications and one-year recovery in patients undergoing total hip replacement. Comorbidity and outcomes after hip replacement. Med Care. 1993;31:141–154. doi: 10.1097/00005650-199302000-00005. [DOI] [PubMed] [Google Scholar]
- 29.Kaplan M.H., Feinstein A.R. The importance of classifying initial comorbidity in evaluating the outcome of diabetes mellitus. J Chronic Dis. 1974;27:387–404. doi: 10.1016/0021-9681(74)90017-4. [DOI] [PubMed] [Google Scholar]
- 30.Starfield B., Weiner J., Mumford L., Steinwachs D. Ambulatory Care Groups: a categorization of diagnoses for research and management. Health Ser Res. 1991;26:53–74. [PMC free article] [PubMed] [Google Scholar]
- 31.Buglioli M., Bonilla M., Ortún Rubio V. Sistemas de ajuste por riesgo. Rev Med Uruguay. 2000;16:123–132. [Google Scholar]
- 32.Palomo L., Rubio C., Gervas J. La comorbilidad en atención primaria. Gac Sanit. 2006;20(Suppl 1):182–191. doi: 10.1157/13086042. [DOI] [PubMed] [Google Scholar]
- 33.Lamberts H., Wood M., Hofmans-Okkes I.M., editors. The International Classification of Primary Care in the European Community. With a multi-language layer. Oxford University Press; Oxford: 1993. [Google Scholar]
- 34.Hall WH, Ramachandran R, Narayan S, Jani AB, Vijayakumar S. An electronic application for rapidly calculating Charlson comorbidity score. BMC Cancer. 2004;4:94. [DOI] [PMC free article] [PubMed]
- 35.The Johns Hopkins A.C.G. Johns Hopkins Bloomberg School of Public Health; Baltimore: 2008. Case-mix System version 8.2. [Google Scholar]
- 36.Sackett D., Rosenberg W., Gray J., Haynes Rb., Richardson W.S. Evidence based medicine: what it is and what it isn‘t. BMJ. 1996;312:71–72. doi: 10.1136/bmj.312.7023.71. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Vargas I. La utilización del mecanismo de asignación per cápita: la experiencia de Cataluña. Cuadernos de Gestión. 2002;8:167–178. [Google Scholar]
- 38.Engstrom S.G., Carlsson L., Ostgren C.J., Nilsson G.H., Borgquist L.A. The importance of comorbidity in analysing patient costs in Swedish primary care. BMC Public Health. 2006;6:36. doi: 10.1186/1471-2458-6-36. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Aguado A., Guino E., Mukherjee B., Sicras A., Serrat J., Acedo M. Variability in prescription drug expenditures explained by adjusted clinical groups (ACG) case-mix: a cross-sectional study of patient electronic records in primary care. BMC Health Serv Res. 2008;8:53. doi: 10.1186/1472-6963-8-53. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Sicras-Mainar A., Serrat-Tarrés J., Navarro-Artieda R., Llausí-Sellés R., Ruano-Ruano I., González-Ares J.A. Adjusted Clinical Groups use as a measure of the referrals efficiency from primary care to specialized in Spain. Eur J Public Health. 2007;17:657–663. doi: 10.1093/eurpub/ckm044. [DOI] [PubMed] [Google Scholar]
- 41.Sicras-Mainar A., Serrat-Tarres J. Measurement of relative cost weights as an effect of the retrospective application of adjusted clinical groups in primary care. Gac Sanit. 2006;20:132–141. doi: 10.1157/13087324. [DOI] [PubMed] [Google Scholar]
- 42.Carlsson L., Strender L.E., Fridh G., Nilsson G. Types of morbidity and categories of patients in a Swedish county. Applying the Johns Hopkins Adjusted Clinical Groups System to encounter data in primary health care. Scand J Prim Health Care. 2004;22:174–179. doi: 10.1080/02813430410006567. [DOI] [PubMed] [Google Scholar]
- 43.Chang H.Y., Weiner J. An in-depth assessment of a diagnosis-based risk adjustment model based on national health insurance claims: the application of the Johns Hopkins Adjusted Clinical Group case-mix system in Taiwan. BMC Medicine. 2010;8:7. doi: 10.1186/1741-7015-8-7. [DOI] [PMC free article] [PubMed] [Google Scholar]