Resumen
El reconocimiento de la heterogeneidad clínica de la EPOC sugiere un abordaje terapéutico específico dirigido por los llamados fenotipos clínicos de la enfermedad. La Guía Española de la EPOC (GesEPOC) es una iniciativa de la SEPAR que, conjuntamente con las sociedades científicas implicadas en la atención a pacientes con EPOC y el Foro Español de Pacientes, ha elaborado una nueva guía de práctica clínica. En el presente artículo se describe la clasificación de gravedad y el tratamiento farmacológico de la EPOC estable. La GesEPOC identifica 4 fenotipos clínicos con tratamiento diferencial: no agudizador, mixto EPOC-asma, agudizador con enfisema y agudizador con bronquitis crónica. La base del tratamiento farmacológico de la EPOC es la broncodilatación, a la que se añaden diversos fármacos según el fenotipo clínico y la gravedad. La gravedad se establecerá por las escalas multidimensionales BODE/BODEx. Una aproximación a la gravedad también se puede conseguir a partir de la obstrucción del flujo aéreo, la disnea, el nivel de actividad física y la historia de agudizaciones. La GesEPOC supone una nueva aproximación al tratamiento de la EPOC más individualizada según las características clínicas de los pacientes.
Palabras clave: EPOC, Tratamiento, Normativa
Abstract
Recognizing the clinical heterogeneity of COPD suggests a specific therapeutic approach directed by the so-called clinical phenotypes of the disease. The Spanish COPD Guidelines (GesEPOC) is an initiative of SEPAR, which, together with the scientific societies involved in COPD patient care, and the Spanish Patient Forum, has developed these new clinical practice guidelines. This present article describes the severity classification and the pharmacological treatment of stable COPD. GesEPOC identifies four clinical phenotypes with differential treatment: non-exacerbator, mixed COPD-asthma, exacerbator with emphysema and exacerbator with chronic bronchitis. Pharmacological treatment of COPD is based on bronchodilation in addition to other drugs depending on the clinical phenotype and severity. Severity is established by the BODE/BODEx multidimensional scales. Severity can also be approximated by assessing airflow obstruction, dyspnea, level of physical activity and history of exacerbations. GesEPOC is a new, more individualized approach to COPD treatment according to the clinical characteristics of the patients.
Keywords: COPD, Treatment, Guidelines
Introducción
La enfermedad pulmonar obstructiva crónica (EPOC) se caracteriza esencialmente por una limitación crónica al flujo aéreo poco reversible y asociada principalmente al humo de tabaco. Se trata de una enfermedad infradiagnosticada, con una elevada morbimortalidad, y supone un problema de salud pública de gran magnitud1. La EPOC es una enfermedad compleja y con una presentación clínica muy heterogénea. Dentro de lo que hoy denominamos EPOC se pueden definir diversos fenotipos con repercusión clínica, pronóstica y terapéutica2.
Desde 2009, el Ministerio de Sanidad y Política Social, a través del Plan de Calidad del Sistema Nacional de Salud (SNS) y la Estrategia en EPOC, han estado trabajando para identificar la manera de mejorar la atención y la calidad de vida de las personas con EPOC y reducir su incidencia. El equipo multidisciplinario de la Estrategia en EPOC3 ha impulsado el desarrollo de una normativa con la participación de todos sus integrantes. En este contexto nace la Guía Española de la EPOC (GesEPOC) a partir de una iniciativa de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), que conjuntamente con las sociedades científicas implicadas en la atención a pacientes con EPOC y el Foro Español de Pacientes, ha desarrollado GesEPOC, las recomendaciones de referencia de la EPOC en España4.
GesEPOC supone una continuidad de las guías elaboradas por la SEPAR, fundamentalmente la guía SEPAR-ALAT de 20085 y la SEPAR-SemFyC de 20106, a las que incorpora los últimos avances en el diagnóstico, tratamiento y clasificación de gravedad. La GesEPOC también recoge y adapta recomendaciones contenidas en la última versión de la Global Initiative for Obstructive Lung Diseases (GOLD) para el diagnóstico y el tratamiento de la EPOC7.
En este artículo se resumen los aspectos más novedosos del tratamiento farmacológico de la EPOC estable. Por necesidades de extensión no se considerarán aspectos de tratamiento no farmacológico ni se abordarán aspectos metodológicos de evaluación de la evidencia. Todos estos aspectos, junto al tratamiento de la EPOC agudizada y la atención al paciente con EPOC en la etapa final de la vida, se pueden consultar en la versión completa de la guía.
Fenotipos clínicos de la EPOC
La EPOC es una enfermedad muy heterogénea, y por ello no es posible categorizarla utilizando solo el volumen espiratorio máximo en el primer segundo (FEV1). La denominación de fenotipo se utiliza para referirse a formas clínicas de los pacientes con EPOC8, 9. Un grupo de expertos internacional ha definido fenotipo de la EPOC como «aquellos atributos de la enfermedad que solos o combinados describen las diferencias entre individuos con EPOC en relación con parámetros que tienen significado clínico (síntomas, agudizaciones, respuesta al tratamiento, velocidad de progresión de la enfermedad o muerte)»8. Por lo tanto, el fenotipo debería ser capaz de clasificar a los pacientes en subgrupos con valor pronóstico y que permitan determinar la terapia más adecuada para lograr mejores resultados clínicos10, 11, 12.
La guía GesEPOC propone 4 fenotipos que determinan un tratamiento diferenciado: 1) no agudizador, con enfisema o bronquitis crónica; 2) mixto EPOC-asma; 3) agudizador con enfisema, y 4) agudizador con bronquitis crónica. A continuación se exponen las características y la definición de los fenotipos básicos, que en el caso de los agudizadores se combinan con la bronquitis crónica o el enfisema para establecer el fenotipo definitivo.
Definición de fenotipo agudizador
Se define como fenotipo agudizador a todo paciente con EPOC que presente 2 o más agudizaciones moderadas o graves al año, definidas como aquellas que precisan al menos tratamiento con corticosteroides sistémicos y/o antibióticos13. Estas exacerbaciones han de estar separadas al menos 4 semanas desde la resolución de la exacerbación previa o 6 semanas desde el inicio de la misma en los casos donde no han recibido tratamiento, para diferenciar el nuevo episodio de un fracaso terapéutico previo14.
La identificación del fenotipo agudizador se basa en la historia clínica y se ha demostrado que el diagnóstico basado en la declaración del paciente sobre su historial de agudizaciones con relevancia clínica es fiable15. El fenotipo agudizador subraya la importancia de preguntar por la historia de agudizaciones en la entrevista clínica e identifica a pacientes que pueden tener indicación de tratamiento antiinflamatorio añadido a los broncodilatadores. Las agudizaciones frecuentes pueden presentarse en cualquiera de los 3 fenotipos restantes: enfisema, bronquitis crónica o mixto EPOC-asma.
Definición de fenotipo mixto EPOC-asma
El fenotipo mixto en la EPOC se define como una obstrucción no completamente reversible al flujo aéreo acompañada de síntomas o signos de una reversibilidad aumentada de la obstrucción16, 17. En otras normativas se les conoce como «pacientes con EPOC con componente asmático prominente»18 o como «asma que complica la EPOC»19.
Para el diagnóstico de fenotipo mixto, un grupo de expertos ha consensuado unos criterios que se presentan en la tabla 1. Para el diagnóstico se deben cumplir 2 criterios mayores o uno mayor y 2 menores20. Esta clasificación es restrictiva debido a la falta de evidencia concluyente entre la relación de los distintos criterios y la respuesta al tratamiento en la EPOC. Se requiren estudios prospectivos para la validación de estos criterios.
Tabla 1.
Criterios mayores y menores para establecer el diagnóstico de fenotipo mixto EPOC-asma en la EPOC20
| Criterios mayores |
| Prueba broncodilatadora muy positiva (incremento del FEV1 > 15% y > 400 ml) |
| Eosinofilia en esputo |
| Antecedentes personales de asma |
| Criterios menores |
| Cifras elevadas de IgE total |
| Antecedentes personales de atopia |
| Prueba broncodilatadora positiva en al menos 2 ocasiones (incremento del FEV1 > 12% y > 200 ml) |
Definición del fenotipo enfisema
El fenotipo enfisema incluye a aquellos pacientes con EPOC con diagnóstico clínico/radiológico/funcional de enfisema que presentan disnea e intolerancia al ejercicio como síntomas predominantes. Los pacientes con fenotipo enfisema presentan una tendencia a un índice de masa corporal (IMC) reducido. No debe confundirse el diagnóstico de fenotipo enfisema con la presencia de enfisema, que puede estar presente en cualquiera de los fenotipos, e incluso en fumadores sin criterios de EPOC.
El fenotipo enfisema suele tener menos agudizaciones que el fenotipo bronquitis crónica, pero es posible que pacientes con enfisema sean también agudizadores, en especial aquellos con formas más graves de la enfermedad21. El enfisema grave también se asocia a un mal pronóstico al ser predictor de un mayor descenso anual del FEV122.
Definición del fenotipo bronquitis crónica
La bronquitis crónica se definió en el Simposio Ciba el 1958 —ratificado por la Organización Mundial de la Salud (OMS) en 1961 y por la American Thoracic Society (ATS) un año después— como la presencia de tos productiva o expectoración durante más de 3 meses al año y durante más de 2 años consecutivos23. El fenotipo bronquitis crónica identifica al paciente con EPOC en el cual la bronquitis crónica es el síndrome predominante. La hipersecreción bronquial en la EPOC se ha asociado a una mayor inflamación en la vía aérea y mayor riesgo de infección respiratoria24, lo que puede explicar que los pacientes con bronquitis crónica tengan una mayor frecuencia de agudizaciones que los pacientes sin expectoración crónica25, 26, 27. Un número significativo de pacientes con bronquitis crónica y agudizaciones repetidas pueden tener bronquiectasias si se someten a una exploración por tomografía computarizada (TC) de tórax de alta resolución (HRCT)28, 29.
Caracterización del fenotipo
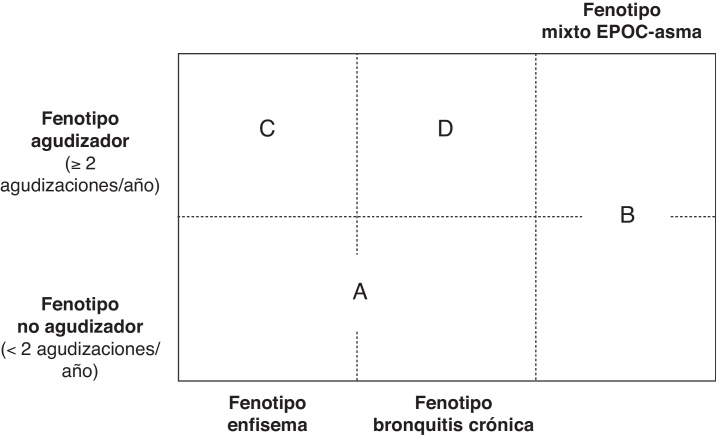
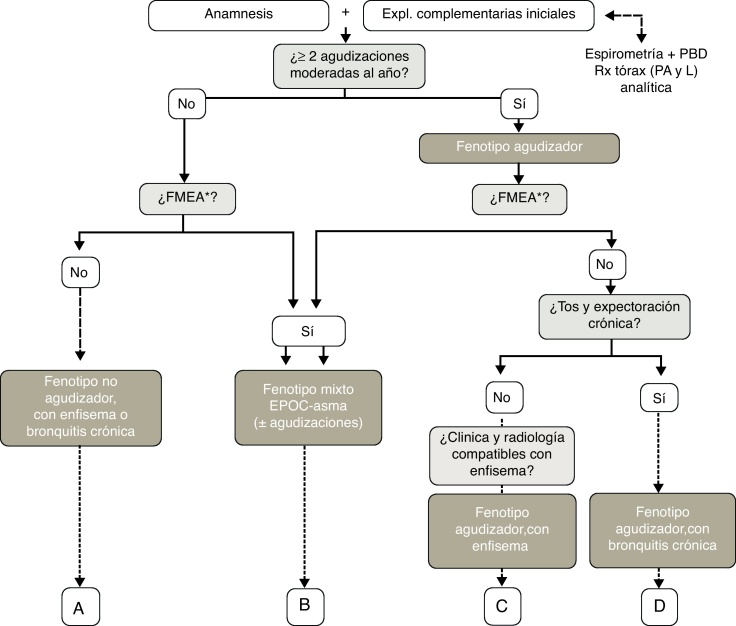
Los fenotipos mixto, enfisema y bronquitis crónica son excluyentes, y el diagnóstico se basa en las manifestaciones clínicas predominantes y el cumplimiento de los criterios diagnósticos. El fenotipo agudizador coexiste con los 3 fenotipos anteriores formando 4 combinaciones fenotípicas con tratamiento diferenciado (fig. 1), según el algoritmo diagnóstico presentado en la figura 2:
-
•
Tipo A: EPOC no agudizadora con enfisema o bronquitis crónica.
-
•
Tipo B: EPOC mixta con asma, tenga o no agudizaciones frecuentes.
-
•
Tipo C: EPOC agudizadora con enfisema.
-
•
Tipo D: EPOC agudizadora con bronquitis crónica.
Figura 1.
Fenotipos clínicos de la EPOC.
Figura 2.
Algoritmo diagnóstico de los fenotipos clínicos. FMEA: fenotipo mixto EPOC-asma.
Casos de fenotipo no aclarado
Pueden existir casos de difícil clasificación, que compartan características propias de más de un fenotipo. En este caso prestaremos atención al problema más importante para el paciente. En primer lugar, si presenta agudizaciones frecuentes debemos dirigir el tratamiento a su prevención, y en segundo lugar, si presenta signos de fenotipo mixto debemos tratar el componente inflamatorio. En pacientes con bronquitis crónica es posible descubrir lesiones de enfisema si se realiza una TC de tórax, pero la presencia de tos con expectoración seguirá siendo el síntoma principal que clasifica a estos pacientes como fenotipo bronquitis crónica.
¿Se puede cambiar de fenotipo?
A pesar de que los fenotipos son en general estables, puede ser que espontáneamente o por acción del tratamiento cambien en su expresión. Por ejemplo, un paciente agudizador puede dejar de sufrir agudizaciones o un paciente mixto puede negativizar su prueba broncodilatadora y reducir su inflamación eosinofílica gracias al tratamiento. En los casos en que los cambios son debidos al tratamiento es recomendable continuar con la misma pauta terapéutica.
Clasificación de gravedad según GesEPOC
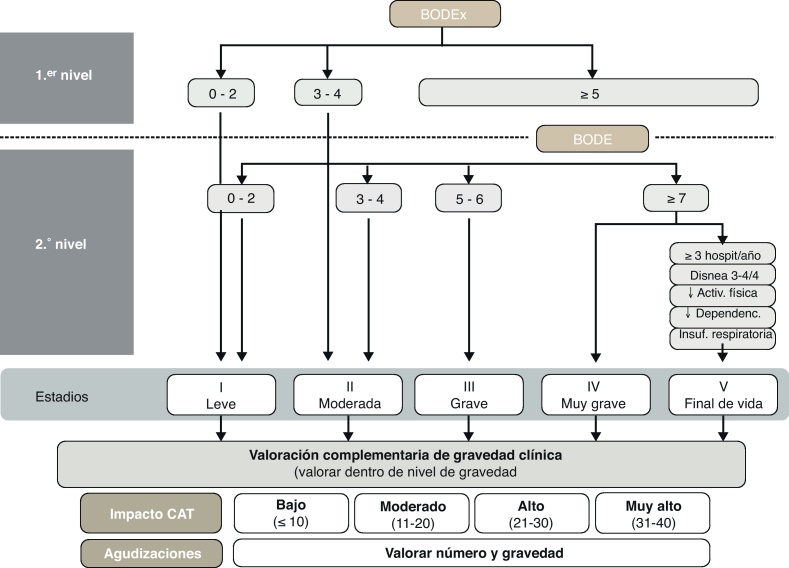
De acuerdo al principio de valoración multidimensional, GesEPOC propone una clasificación de gravedad en 5 niveles, cuyo determinante principal de gravedad es el índice BODE y sus distintos cuartiles30. En ausencia de información sobre la distancia recorrida en la prueba de los 6 min marcha, GesEPOC recomienda utilizar el índice BODEx como una alternativa, únicamente para los niveles I y II (EPOC leve o moderada)31. Todos los pacientes que tengan un BODEx igual o superior a los 5 puntos deberían realizar la prueba de ejercicio para precisar su nivel de gravedad. Los centros que no dispongan de esta prueba en su cartera de servicios deberían valorar derivar al paciente a un segundo nivel asistencial. El GesEPOC propone un quinto nivel de gravedad, destinado a identificar a los pacientes con elevado riesgo de muerte o ya al final de su vida y que se pueden beneficiar de una valoración multidimensional por equipos expertos en cuidados paliativos. Los criterios orientativos para reconocer este nivel V se incluyen en la tabla 2.
Tabla 2.
Criterios de gravedad del estadio V: EPOC al final de vida
| BODE ≥ 7 puntos y además al menos uno de los siguientes: |
| ≥ 3 hospitalizaciones al año |
| Disnea 3 o 4 de la escala mMRC, a pesar de tratamiento óptimo |
| Sedentarismo o baja actividad física |
| Elevada dependencia para las actividades diarias |
| Insuficiencia respiratoria crónica |
Valoración complementaria de la gravedad de la EPOC
Los índices multidimensionales guardan una relación más estrecha con el pronóstico de la EPOC que cualquier variable considerada individualmente, pero no existe aún evidencia de que el tratamiento orientado por estos índices consiga mejores resultados clínicos que el orientado por los síntomas clásicos y la función pulmonar. Además, la implementación de los índices BODE/BODEx en la práctica asistencial requiere familiarizarse con la utilización de escalas de riesgo. Esta aproximación puede requerir un periodo de adaptación, y por este motivo GesEPOC sugiere una aproximación alternativa que puede ser orientativa de la gravedad del paciente y que es más intuitiva a partir de los datos habituales recogidos en la visita clínica. La última normativa GOLD 2011, aunque con una aproximación discretamente diferente, también recomienda realizar una valoración multidimensional en la que, además del FEV1, se contemplan la frecuencia de agudizaciones, los síntomas (disnea) y la puntuación del COPD Assessment Test (CAT)7.
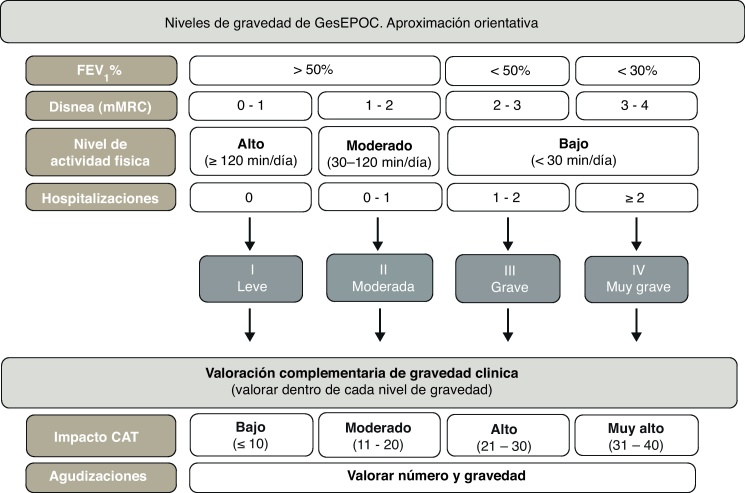
Las variables que se pueden utilizar para esta aproximación al nivel de gravedad son: la obstrucción al flujo aéreo medida por el FEV1 (%), la disnea medida por la escala mMRC, el nivel de actividad física y las hospitalizaciones en los 2 años precedentes. De acuerdo con la guía GOLD, el punto de corte de FEV1 (%) = 50% es el umbral para considerar a un paciente grave o muy grave7. La escala mMRC de disnea permite una aproximación a la gravedad del paciente32. Diversos estudios han demostrado el valor pronóstico de la disnea, que en algunos trabajos incluso supera en valor predictivo de mortalidad al FEV1 (%)33. La medida de la actividad física también tiene un valor pronóstico muy importante en la EPOC, tanto para exacerbaciones y descenso de la función pulmonar, como hospitalizaciones y finalmente para la mortalidad34, 35. Para evaluar la actividad física, las medidas autorreferidas por los pacientes son sencillas, están al alcance de todos los niveles asistenciales y han ofrecido muy buenos resultados como predictores de desenlaces de gravedad (hospitalización y muerte)34. Para la medida de la actividad física se propone el cálculo de los minutos de actividad física diaria de intensidad equivalente a más de 3,0 MET36 o minutos diarios de actividad física moderada. Respecto a las hospitalizaciones, se ha demostrado que son un factor muy importante de riesgo de mortalidad futura en pacientes con cualquier nivel de gravedad de la obstrucción al flujo aéreo37. Además, son circunstancias fáciles de recordar por los pacientes. Los puntos de corte orientativos se exponen en la figura 3. Se debe recordar que ningún parámetro por sí solo permite clasificar el nivel de gravedad de la EPOC. Si no se ha calculado el índice BODE o BODEx, el médico que atiende el paciente debe considerar todos los aspectos enumerados y clasificar de forma orientativa al paciente en uno de los niveles de gravedad GesEPOC según una valoración global de todos los factores. El cálculo del índice BODE o BODEx precisará en cualquier caso la clasificación definitiva de gravedad, y se recomienda su uso como primera opción.
Figura 3.
Estadios de gravedad de la EPOC según BODE/BODEx.
Ajuste de la intensidad del tratamiento en cada nivel de gravedad de la EPOC
La elección del tratamiento debe basarse en el fenotipo clínico del paciente, y la intensidad del mismo se determinará por el nivel de gravedad multidimensional, según el esquema anterior. Sin embargo, dentro de un mismo nivel de gravedad existen otros parámetros que pueden modular la intensidad del tratamiento, entre los que destacan la gravedad de los síntomas, la frecuencia e intensidad de las agudizaciones o el deterioro de la calidad de vida relacionada con la salud medida mediante el cuestionario CAT (COPD Assessment Test). El CAT es un cuestionario estandarizado, breve y sencillo que ha sido recientemente desarrollado para ser utilizado en la práctica clínica asistencial38, 39. En la actualidad no existen umbrales de CAT que permitan recomendar una modificación en la pauta terapéutica, aunque la Guía GOLD 2011 recomienda usar 10 unidades como punto de corte de gravedad para intensificar el tratamiento. Para orientar sobre la gravedad de los pacientes y el impacto de la enfermedad se recomiendan los umbrales reconocidos en el desarrollo y validación del cuestionario (www.catestonline.org) (fig. 4)39.
Tratamiento de la EPOC estable
Puntos clave
-
•
La base del tratamiento de la EPOC estable son los broncodilatadores de larga duración (BDLD).
-
•
Los fármacos que se deben añadir a BDLD dependerán del fenotipo del paciente.
-
•
El tratamiento del fenotipo no agudizador, sea enfisema o bronquitis crónica, se basa en el uso de los BDLD en combinación.
-
•
El tratamiento del fenotipo mixto se basa en la utilización de BDLD combinados con corticosteroides inhalados (CI).
-
•
El tratamiento del fenotipo agudizador con enfisema se basa en BDLD a los que se pueden añadir los CI y la teofilina según el nivel de gravedad.
-
•
En el tratamiento del fenotipo agudizador con bronquitis crónica, a los BDLD se pueden añadir CI, inhibidores de la fosfodiesterasa IV o mucolíticos según la gravedad o, en casos especiales, antibióticos de forma preventiva.
-
•
Se debe prestar especial atención a las comorbilidades, optimizando su control.
Figura 4.
Estadios y criterios clínicos de gravedad de la EPOC.
Objetivos del tratamiento
Los objetivos generales del tratamiento de la EPOC se resumen en 3: reducir los síntomas crónicos de la enfermedad, disminuir la frecuencia y gravedad de las agudizaciones y mejorar el pronóstico. Se deben alcanzar tanto los beneficios a corto plazo (control de la enfermedad) como los objetivos a medio y a largo plazo (reducción del riesgo de agudizaciones, caída acelerada de función pulmonar o muerte)7, 40.
Existen una serie de medidas generales a tener en cuenta en todo paciente con EPOC que comprenden el abandono del tabaco, la adecuada nutrición, la actividad física regular, la evaluación y tratamiento de las comorbilidades y la vacunación, que no van a ser abordadas en esta publicación pero que se describen con mayor detalle en la publicación completa de la guía.
Tratamiento de la EPOC A: fenotipo no agudizador con enfisema o bronquitis crónica
El tratamiento de este fenotipo consistirá en uno o 2 broncodilatadores de grupos terapéuticos diferentes. Los pacientes que no presentan agudizaciones no tienen indicación de tratamiento antiinflamatorio ni mucolítico.
Broncodilatadores de acción corta
El primer paso en el tratamiento de la EPOC es la broncodilatación. Los broncodilatadores de acción corta (anticolinérgicos —SAMA por su nombre en inglés, short-acting muscarinic antagonist— como el bromuro de ipratropio y β2 agonistas de acción corta —SABA por su nombre en inglés, short-acting β-agonist— como el salbutamol o la terbutalina) son fármacos eficaces en el control rápido de los síntomas. Estos fármacos, añadidos al tratamiento de base, son de elección para el tratamiento de los síntomas a demanda, sea cual sea el nivel de gravedad de la enfermedad41.
Cuando el paciente tiene síntomas frecuentes, precisa tratamiento con broncodilatadores de corta duración de forma frecuente o sufre una limitación al ejercicio, requiere tratamiento de base regular. En este caso se debe administrar un broncodilatador de larga duración (BDLD).
Broncodilatadores de larga duración
Los BDLD pueden ser beta-2-adrenérgicos (salmeterol, formoterol e indacaterol —LABA por su nombre en inglés, long-acting β-agonists—) o anticolinérgicos (bromuro de tiotropio —LAMA por su nombre en inglés, long-acting muscarinic antagonist—). Deben utilizarse como primer escalón en el tratamiento de todos los pacientes con síntomas permanentes que precisan tratamiento de forma regular, porque permiten un mayor control de los síntomas y mejoran tanto la calidad de vida como la función pulmonar y la tolerancia al ejercicio, y además reducen las agudizaciones42, 43, 44, 45, 46. Existen diferencias entre los diversos BDLD. Los hay con una duración de acción de 12 h (salmeterol y formoterol) y de 24 h (tiotropio e indacaterol). El formoterol y el indacaterol tienen un rápido inicio de acción, y el tiotropio y el salmeterol inician su acción broncodilatadora de forma más lenta. Las comparaciones de LAMA frente a LABA en 2 revisiones sistemáticas47, 48 no mostraron diferencias en la frecuencia de exacerbaciones entre ambos tratamientos, pero sí en el subanálisis de los pacientes con FEV1 ≤ 40%, donde el tiotropio fue más eficaz en la reducción de agudizaciones47. Más recientemente, un ensayo clínico aleatorizado (ECA) potenciado para agudizaciones demostró que el tiotropio era más eficaz que el salmeterol en la prevención de agudizaciones en pacientes con EPOC e historia de al menos una agudización el año previo49. Estos resultados corresponden a comparaciones entre tiotropio y salmeterol. No disponemos de estudios comparativos entre tiotropio e indacaterol en la prevención de agudizaciones.
Doble terapia broncodilatadora
En pacientes sintomáticos o con una limitación al ejercicio evidente aun tras la monoterapia broncodilatadora se debe ensayar la doble terapia broncodilatadora. La asociación de LABA y LAMA ofrece un beneficio funcional añadido con reducción de la necesidad de medicación de rescate y mejoría de los síntomas y de la calidad de vida frente a la monoterapia50, 51. Por este motivo, en un segundo escalón de tratamiento, en pacientes con un nivel de gravedad II en adelante se puede asociar un BDLD de un tipo farmacológico distinto al que el paciente llevara en el primer nivel de gravedad, sea LAMA o LABA. De esta manera se consigue optimizar el efecto broncodilatador.
Teofilinas
Las teofilinas son fármacos broncodilatadores débiles pero que presentan efectos aditivos a los broncodilatadores habituales. Se ha descrito un efecto positivo de estos fármacos sobre la fuerza del diafragma, un aumento del rendimiento de los músculos respiratorios, una reducción del atrapamiento aéreo, una mejoría del aclaramiento mucociliar y una reducción de las agudizaciones52. En cualquier caso, su limitada eficacia clínica y su estrecho margen terapéutico las relega a ocupar un lugar de segunda línea, principalmente en pacientes graves con nivel de gravedad IV o V53.
Tratamiento sustitutivo con alfa-1-antitripsina
El tratamiento sustitutivo con alfa-1-antitripsina (AAT) purificada es recomendado por las principales sociedades científicas (ATS, European Respiratory Society y la Sociedad Española de Neumología y Cirugía Torácica) en los pacientes con enfisema pulmonar con un déficit de AAT grave y con fenotipo homocigoto PiZZ o variantes raras deficitarias. Sus criterios de inclusión y exclusión están bien definidos en las normativas específicas54, 55.
Todo paciente con EPOC, y en especial si se trata de un fenotipo enfisema, debe tener al menos una medición de sus concentraciones de AAT sérica para descartar que pueda presentar un déficit de esta enzima.
Tratamiento de la EPOC B: fenotipo mixto EPOC-asma
Es posible que un paciente con fenotipo mixto EPOC-asma pueda ser catalogado como tal, o también como asmático fumador no completamente reversible56. Su principal característica es que presenta un mayor grado de inflamación eosinofílica bronquial que sería la responsable de su mayor respuesta clínica y espirométrica a los corticosteroides inhalados (CI)57, 58 y justifica el uso de los CI asociados a un BDLD como primera opción en el nivel de gravedad I o II con el objetivo de mejorar su función pulmonar, los síntomas respiratorios y reducir las agudizaciones si las hubiere11, 59.
En los casos de mayor gravedad (niveles de gravedad III y IV) puede ser necesario el tratamiento triple CI/LABA más LAMA. Esta triple combinación ha demostrado su eficacia en pacientes con EPOC que presentaban gran reversibilidad en la obstrucción al flujo aéreo60. Además, el tiotropio ha demostrado su eficacia en pacientes con asma61.
También en los casos más graves (nivel de gravedad IV) se puede añadir al tratamiento la teofilina o, si existe tos con expectoración crónica, el roflumilast. No existen estudios específicos de la eficacia y seguridad de estos fármacos en EPOC grave con fenotipo mixto, pero se conoce la eficacia de ambos fármacos en el asma.
Tratamiento de la EPOC C: fenotipo agudizador con enfisema
Los pacientes con enfisema también pueden ser agudizadores y requerirán un tratamiento dirigido a la reducción de agudizaciones, además de mejorar el resto de parámetros de la enfermedad. Los BDLD en el primer escalón de tratamiento (nivel de gravedad I-II), solos o combinados, son eficaces para reducir las agudizaciones, pero en algunos pacientes van a ser insuficientes y precisarán una intensificación del tratamiento farmacológico.
Corticosteroides inhalados
Distintas guías de práctica clínica5, 6, 7 reconocen la utilidad del empleo de los CI en pacientes que presentan frecuentes agudizaciones, pese a realizar un tratamiento broncodilatador óptimo, por cuanto su uso asociado a los BDLD produce una disminución significativa del número de agudizaciones y una mejoría en la calidad de vida, si bien no han mostrado un efecto beneficioso sobre la mortalidad62, 63, 64. Aunque la prevención de agudizaciones se ha evaluado en la mayoría de los estudios para los pacientes agudizadores graves o muy graves (grado de obstrucción III y IV, FEV1 < 50%), existen algunos estudios en pacientes con menor gravedad funcional (FEV1 < 60%) en los que también los resultados avalan el uso de estos fármacos, por lo que parece que el principal determinante del beneficio sea la presencia de agudizaciones repetidas, es decir, el fenotipo agudizador, y no el grado de obstrucción al flujo aéreo62. Por este motivo pueden ensayarse en pacientes en nivel de gravedad II que persisten con agudizaciones a pesar de un tratamiento con uno o 2 BDLD. En la EPOC los CI se deben utilizar siempre en asociación con un BDLD.
En pacientes con nivel de gravedad III y que no presentan un nivel de control de los síntomas o de las agudizaciones con 2 fármacos (sean 2 BDLD o un BDLD más un CI) se puede utilizar la triple terapia LAMA + LABA + CI. Los escasos estudios existentes con triple terapia indican un mayor efecto sobre la función pulmonar y una disminución de las agudizaciones y las hospitalizaciones en pacientes graves60, 65.
Tratamiento de la EPOC D: fenotipo agudizador con bronquitis crónica
La presencia de tos y expectoración crónica es un factor reconocido que predispone a las agudizaciones en la EPOC25. El primer escalón de tratamiento en nivel de gravedad I serán los BDLD, por su capacidad de reducir las agudizaciones. En el nivel de gravedad II se recomienda una terapia doble con 2 BDLD, o con un BDLD más un antiinflamatorio, sea un CI o roflumilast.
Inhibidores de la fosfodiesterasa 4. Roflumilast
El roflumilast es un fármaco antiinflamatorio oral que actúa mediante la inhibición selectiva de la fosfodiesterasa 4 (IPD4) y que ha demostrado prevenir las agudizaciones en pacientes con EPOC grave que presentan tos y expectoración crónica y, además, sufren agudizaciones frecuentes66, 67, por lo que es un fármaco indicado para el fenotipo agudizador con bronquitis crónica. Este efecto se mantiene cuando se añade roflumilast al tratamiento de mantenimiento con un BDLD, sea LABA o LAMA. Además consigue un incremento significativo del FEV1 valle de entre 50 y 70 ml sobre el conseguido con salmeterol o tiotropio68, 69.
Tanto el roflumilast como los CI son fármacos antiinflamatorios, aunque sus modos de acción son diferentes. Los resultados obtenidos en ensayos clínicos con la administración concomitante de CI y roflumilast indican que esta asociación es segura y que roflumilast mantiene su eficacia clínica67. Puede ser útil cuando se considere asociar ambas acciones antiinflamatorias en pacientes con alto riesgo de agudizaciones, siempre asociados con un BDLD. No se recomienda la utilización de roflumilast con teofilinas.
Mucolíticos
En 2 revisiones sistemáticas se demostró una reducción de las exacerbaciones con el tratamiento mucolítico frente a placebo en el paciente con EPOC70, 71. Estos resultados deben interpretarse con cautela, ya que los estudios incluidos tenían un escaso tamaño muestral y eran heterogéneos. Sin embargo, los mismos resultados se confirmaron en un ensayo clínico de mayor envergadura en el que el uso de carbocisteína a largo plazo, comparado con placebo, reducía el número de exacerbaciones, retrasaba el empeoramiento de los síntomas y mejoraba la calidad de vida de los pacientes con EPOC72. Los efectos de la N-acetilcisteína (NAC) a largo plazo en pacientes con EPOC se han evaluado en un ensayo clínico, en el que se demostró una disminución del número de exacerbaciones en pacientes no tratados con CI de forma concomitante73; no obstante, la evidencia es insuficiente para poder generar una recomendación sobre los efectos de la NAC en los pacientes con EPOC que no están tratados con CI.
La carbocisteína se puede emplear como tratamiento de segunda línea en pacientes con niveles de gravedad III y IV, con agudizaciones frecuentes a pesar de un tratamiento broncodilatador óptimo.
Utilización de antibióticos en la EPOC estable
La utilización de antibióticos en la EPOC estable se ha llevado a cabo empíricamente desde los años sesenta en lo que se llamaba profilaxis antibiótica. Una revisión sistemática de los ensayos realizados hasta los años ochenta concluyó que existía un efecto beneficioso significativo en la reducción de agudizaciones, aunque de escasa magnitud74. Estos estudios incluían poblaciones mal definidas, con frecuencia pacientes con bronquitis crónica, sin confirmación diagnóstica de EPOC.
En la última década se han llevado a cabo ensayos clínicos con un diseño más riguroso que pretenden conocer la eficacia de los antibióticos administrados en fase estable para la prevención de las agudizaciones. Podemos dividir estos estudios en 2 grupos: a) los que utilizan macrólidos con intención de aprovechar también su acción antiinflamatoria, y b) los que utilizan quinolonas para lograr una máxima erradicación bacteriana.
Los macrólidos, administrados de forma prolongada y a dosis bajas, por su actividad antiinflamatorio e inmunomoduladora75, en pacientes estables con EPOC grave han demostrado reducir de forma significativa el número de agudizaciones76, 77, 78. Sin embargo, las poblaciones estudiadas fueron distintas y las pautas diferentes, por lo que es difícil hacer una recomendación. Cabe destacar que en el estudio de Albert et al.78 se comprobó un aumento de las resistencias bacterianas a macrólidos y un ligero aumento de problemas auditivos en los pacientes tratados con azitromicina.
La utilización de quinolonas durante los períodos de estabilidad (tratamiento de la infección bronquial crónica) ha demostrado erradicar las bacterias presentes en el esputo en la mayoría de pacientes con EPOC grave, infección bronquial crónica y agudizaciones frecuentes79. La administración de moxifloxacino 5 días al mes cada 2 meses durante un año redujo un 45% las agudizaciones en los pacientes que presentaban esputo mucopurulento, es decir, aquellos con mayor probabilidad de presentar una infección bronquial bacteriana crónica. En este estudio no se evidenció un incremento significativo de las resistencias80.
Estos tratamientos se reservarán a casos muy seleccionados de pacientes con nivel de gravedad IV y agudizaciones frecuentes que, a pesar de un tratamiento correcto de su EPOC, el año previo requirieron múltiples tratamientos antibióticos o ingresos hospitalarios. Además, su uso se debe restringir a centros de referencia con seguimiento clínico, auditivo y de bioquímica hepática y microbiológico con identificación de microorganismos en esputo y estudio de sensibilidad a los antibióticos.
Los pacientes candidatos a tratamiento crónico o cíclico con antibióticos son pacientes con gran probabilidad de ser portadores de bronquiectasias28, 29, y pueden ser de aplicación las normativas de tratamiento de las bronquiectasias para conseguir el control de la infección bronquial crónica81.
En la tabla 3 se presenta un resumen del tratamiento farmacológico por fenotipos y nivel de gravedad.
Tabla 3.
Tratamiento farmacológico de la EPOC según fenotipos y niveles de gravedad (I-IV)
| Estadio de gravedad |
||||
|---|---|---|---|---|
| Fenotipo | I | II | III | IV |
| A No agudizador con enfisema o BC |
LAMA o LABA SABA o SAMAa |
LAMA o LABA LAMA + LABA |
LAMA + LABA | LAMA + LABA + Teofilina |
| B Mixto EPOC-asma |
LABA + CI | LABA + CI | LAMA + LABA + CI | LAMA + LABA + CI (valorar añadir Teofilina o IPE4 si hay expectoración) |
| C Agudizador con enfisema |
LAMA o LABA | (LAMA o LABA) + CI LAMA + LABA LAMA o LABA |
LAMA + LABA + CI | LAMA + LABA + CI (valorar añadir teofilina) |
| D Agudizador con BC |
LAMA o LABA | (LAMA o LABA) + (CI o IPE4) LAMA + LABA LAMA o LABA |
LAMA + LABA + (CI o IPE4) (LAMA o LABA) + CI + IPE4 (valorar añadir carbocisteína) |
LAMA + LABA + (CI o IPE4) LAMA + LABA + CI + IPE4 (valorar añadir carbocisteína) (valorar añadir teofilina) (valorar añadir antibióticos) |
BC: bronquitis crónica; SABA: beta-2-agonista de corta duración; SAMA: anticolinérgico de corta duración; CI: corticosteroide inhalado; LAMA: anticolinérgico de larga duración; LABA: beta-2-agonista de larga duración; IPE4: inhibidor de la fosfodiesterasa 4.
En caso de síntomas intermitentes.
Adecuación del tratamiento durante el seguimiento
Está bien establecido el incremento del tratamiento según la progresión de la enfermedad o su gravedad. Sin embargo, es muy escasa la evidencia existente sobre la posible reducción o retirada de tratamiento en pacientes EPOC que consiguen una mejoría o estabilidad clínica. En function de esta escasa evidencia se puede recomendar:
-
a)
El tratamiento broncodilatador ejerce su efecto solamente durante su administración, por lo que es muy probable que la retirada de un broncodilatador o su sustitución por otro de menor potencia broncodilatadora o menor duración de acción produzca un empeoramiento funcional y/o sintomático82.
-
b)
En pacientes con fenotipo mixto se puede ensayar la reducción de dosis de CI hasta conseguir la mínima dosis eficaz, al igual que se realiza en el asma. No se recomienda dejar a estos pacientes con tratamiento con BDLD sin CI.
-
c)
En pacientes con fenotipo agudizador no es posible especificar una pauta de reducción de tratamiento en caso de estabilidad. Para plantear una reducción del tratamiento deberá haber transcurrido al menos un año sin agudizaciones. Deberá realizarse según juicio clínico empezando por la retirada de aquellos fármacos que probablemente son menos activos o que presentan mayor probabilidad de efectos adversos a corto o largo plazo.
-
d)
En pacientes leves o moderados (nivel de gravedad I-II), sin fenotipo mixto y que sigan tratamiento con CI a dosis altas, se debe reevaluar la necesidad de proseguir con estos fármacos. Existen estudios que señalan que la retirada brusca de CI puede desencadenar una agudización83, aunque una revisión sistemática reciente concluye que no existe evidencia suficiente para relacionar la retirada de CI con las agudizaciones84. En cualquier caso se deberá individualizar la indicación, nunca en pacientes que persisten con una prueba broncodilatadora positiva o con eosinofília en el esputo a pesar del tratamiento con CI85, 86, y realizarla solamente en pacientes estables, sin agudizaciones por lo menos durante un año, fuera de las temporadas invernales de mayor incidencia de agudizaciones86, con reducción progresiva de las dosis y con un seguimiento clínico y espirométrico estrecho.
Conclusiones
El tratamiento de la EPOC en fase estable ha experimentado en los últimos años cambios importantes derivados de la introducción de nuevos fármacos y de la publicación de nuevos ensayos clínicos y metaanálisis, algunos en pacientes con características determinadas. Estos avances obligan a replantear la aproximación al tratamiento de acuerdo con una estrategia basada en los fenotipos clínicos que caracterizan y agrupan a los pacientes EPOC que presentan una determinada respuesta al tratamiento. Un planteamiento nuevo implica necesariamente una serie de recomendaciones que aún no están respaldadas por un alto grado de evidencia, pero tal como especifica la nueva guía GOLD, «no es lo mismo no tener evidencia de que un tratamiento es eficaz a tener evidencia de que un tratamiento no es eficaz»7. Basándose en la mejor evidencia disponible se ha desarrollado GesEPOC, y en el documento completo se exponen nuevas líneas de investigación que ayudarán a mejorar esta propuesta en el futuro.
Organización de GesEPOC
Coordinador: Marc Miravitlles, Sociedad Española de Neumología y Cirugía Torácica (SEPAR). Integrantes del grupo de trabajo: Myriam Calle y Juan José Soler-Cataluña (SEPAR); Joan B. Soriano (SEPAR-epidemiología); Julio Ancochea, coordinador científico de la Estrategia en EPOC del SNS; Pere Almagro, Sociedad Española de Medicina Interna (SEMI); Daniel López (SEPAR-Fisioterapia); Esther Marco, Sociedad Española de Rehabilitación y Medicina Física y Sociedad de Rehabilitación Cardiorrespiratoria (SERMEF/SORECAR); Juan Antonio Riesco, Comité Nacional de Prevención del Tabaquismo (CNPT); José Antonio Quintano, Sociedad Española de Médicos de Atención Primaria (SEMERGEN); Juan Antonio Trigueros, Sociedad Española de Médicos Generales y de Familia (SEMG); Jesús Molina, Sociedad Española de Medicina de Familia y Comunitaria (semFYC) y Sociedad de Respiratorio en Atención Primaria (GRAP); Mercè Marzo (semFYC-Metodología); Pascual Piñera y Adolfo Simón, Sociedad Española de Medicina de Urgencias y Emergencias (SEMES); Antonia Cachinero (SEPAR-Enfermería); María Dolors Navarro, Foro Español de Pacientes (FEP); Montse Llamas (UOC-AlaOeste-comunicación).
GESEPOC cuenta como socios estratégicos con Almirall, AstraZeneca, Boehringer Ingelheim-Pfizer, Faes Farma, Grupo Ferrer, GlaxoSmithKline, Novartis y Nycomed-Merck Sharp & Dhome. Como colaboradores, con Chiesi, Esteve Teijin y Grupo Uriach Pharma.
Conflicto de intereses
Marc Miravitlles ha recibido honorarios por impartir conferencias en eventos educacionales organizados por Boehringer Ingelheim, Pfizer, AstraZeneca, Bayer Schering, Novartis, Talecris, Takeda-Nycomed, Merck, Sharp & Dohme y Novartis, y por asesoría científica de Boehringer Ingelheim, Pfizer, GSK, AstraZeneca, Bayer Schering, Novartis, Almirall, Merck, Sharp & Dohme y Takeda-Nycomed. Juan José Soler ha recibido honorarios por impartir conferencias en eventos educacionales y/o por asesoría científica y/o investigación de Boehringer Ingelheim, Pfizer, AstraZeneca, Bayer Schering, Novartis, Takeda-Nycomed, Merck, Sharp & Dohme, Almirall, Grupo Ferrer, GSK y Vifor Pharma. Myriam Calle ha recibido honorarios por impartir conferencias en eventos educacionales y/o por asesoría científica y/o investigación de Carburos Médica, AstraZeneca, Merck, Sharp & Dohme y Almirall. Jesús Molina no tiene conflicto de interés. Pere Almagro ha recibido honorarios por impartir conferencias en eventos educacionales y/o por asesoría científica y/o investigación de Boehringer Ingelheim, Pfizer, Takeda-Nycomed, Merck, Sharp & Dohme, Almirall, GSK, Chiesi y Esteve. José Antonio Quintano no tiene conflicto de interés. Juan Antonio Riesco no tiene conflicto de interés. Juan Antonio Trigueros ha recibido honorarios por impartir conferencias en eventos educacionales y/o por asesoría científica y/o investigación de Boehringer Ingelheim, Pfizer y Bayer Schering. Pascual Piñera no tiene conflicto de interés. Adolfo Simón no tiene conflicto de interés. José Luis López-Campos ha recibido honorarios por impartir conferencias en eventos educacionales y/o por asesoría científica y/o investigación de Boehringer Ingelheim, Pfizer, AstraZeneca, Novartis, Takeda-Nycomed, Merck, Sharp & Dohme, Almirall, GSK, Esteve y Faes Farma. Joan B. Soriano ha recibido honorarios por impartir conferencias en eventos educacionales y/o por asesoría científica y/o investigación de Almirall. Julio Ancochea ha recibido honorarios por impartir conferencias en eventos educacionales y/o por asesoría científica y/o investigación de Boehringer Ingelheim, Novartis, Takeda-Nycomed, Almirall, GSK, Intermunne, Faes Farma, Chiesi y Actelion.
Agradecimientos
Los autores quieren agradecer la colaboración de los siguientes expertos que han actuado como revisores del manuscrito: Pilar de Lucas (Madrid), José Luis Izquierdo Alonso (Guadalajara), German Peces-Barba (Madrid), Francisco Casas Maldonado (Granada), Luis Muñoz (Córdoba), Borja García-Cossio (Palma), Cristóbal Esteban (Galdakano), Adolfo Baloira (Pontevedra), Luis Pérez de Llano (Lugo), Ramon Agüero (Santander), Teodoro Montemayor (Sevilla), José Luis Viejo Bañuelos (Burgos), Carlos Alvarez (Madrid), Francisco García Río (Madrid), Luis Puente Maestu (Madrid), Alfredo de Diego (Valencia), José Miguel Rodríguez González-Moro (Madrid).
Footnotes
Documento publicado simultáneamente en Archivos de Bronconeumología Arch Bronconeumol. 2012. http://dx.doi.org/10.1016/j.arbres.2012.04.001.
En este documento de consenso han participado las siguientes sociedades científicas e instituciones: SEPAR, SEMI, SERMEF/SORECAR, CNPT, SEMERGEN, SEMG, semFYC, GRAP, SEMES, SEPAR-ENFERMERÍA, FEP y UOC.
Bibliografía
- 1.Chapman K.R., Mannino D.M., Soriano J.B., Vermeire P.A., Buist A.S., Thun M.J. Epidemiology and costs of chronic obstructive pulmonary disease. Eur Respir J. 2006;27:188–207. doi: 10.1183/09031936.06.00024505. [DOI] [PubMed] [Google Scholar]
- 2.Miravitlles M., Calle M., Soler-Cataluña J.J. Clinical phenotypes of COPD. Identification, definition and implications for guidelines. Arch Bronconeumol. 2012;48:86–98. doi: 10.1016/j.arbres.2011.10.007. [DOI] [PubMed] [Google Scholar]
- 3.Estrategia en EPOC del Sistema Nacional de Salud . Ministerio de Sanidad y Política Social; 2009. Plan de Calidad para el Sistema Nacional de Salud. [Google Scholar]
- 4.Grupo de trabajo GESEPOC Hacia un nuevo enfoque en el tratamiento de la EPOC. La Guía Española de la EPOC (GESEPOC) Arch Bronconeumol. 2011;47:379–381. doi: 10.1016/j.arbres.2011.05.008. [DOI] [PubMed] [Google Scholar]
- 5.Peces-Barba G., Barberà J.A., Agustí A., Casanova C., Casas A., Izquierdo J.L. Guía Clínica SEPAR-ALAT de diagnóstico y tratamiento de la EPOC. Arch Bronconeumol. 2008;44:271–281. [PubMed] [Google Scholar]
- 6.Grupo de trabajo de la guía de práctica clínica sobre Atención Integral al paciente con Enfermedad Pulmonar Obstructiva Crónica (EPOC) Sociedad Española de Neumología y Cirugía Torácica (SEPAR) y Sociedad Española de Medicina de Familia (semFYC) 2010 [Google Scholar]
- 7.Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2011 [consultado 13 Mar 2012]. Disponible en: http://www.goldcopd.org
- 8.Han M.K., Agustí A., Calverley P.M., Celli B.R., Criner G., Curtis J.L. Chronic obstructive pulmonary disease phenotypes. The future of COPD. Am J Respir Crit Care Med. 2010;182:598–604. doi: 10.1164/rccm.200912-1843CC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Pistolesi M., Bigazzi F., Cestelli L., Paoletti M., Camiciottoli G. Phenotypes of chronic obstructive pulmonary disease. Hot Topics Respir Med. 2010;5:7–11. [Google Scholar]
- 10.Lopez-Campos J.L. Estrategias de tratamiento en la enfermedad pulmonar obstructiva crónica: una propuesta de sistematización. Arch Bronconeumol. 2010;46:617–620. doi: 10.1016/j.arbres.2010.06.003. [DOI] [PubMed] [Google Scholar]
- 11.Anderson D., MacNee W. Targeted treatment in COPD: a multi-system approach for a multi-system disease. Int J Chron Obst Pulm Dis. 2009;4:321–335. doi: 10.2147/copd.s2999. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Miravitlles M. Tratamiento individualizado de la EPOC: una propuesta de cambio. Arch Bronconeumol. 2009;45(Suppl 5):27–34. doi: 10.1016/S0300-2896(09)72952-7. [DOI] [PubMed] [Google Scholar]
- 13.Hurst J.R., Vestbo J., Anzueto A., Locantore N., Müllerova H., Tal-Singer R. Susceptibility to exacerbation in chronic obstructive pulmonary disease. N Engl J Med. 2010;363:1128–1138. doi: 10.1056/NEJMoa0909883. [DOI] [PubMed] [Google Scholar]
- 14.Soler Cataluña J.J., Martínez García M.A., Catalán Serra P. The frequent exacerbator. A new phenotype in COPD? Hot Topics Respir Med. 2011;6:7–12. [Google Scholar]
- 15.Quint J.K., Donaldson G.C., Hurst J.R., Goldring J.J.P., Seemungal T.R., Wedzicha J.A. Predictive accuracy of patient-reported exacerbation frequency in COPD. Eur Respir J. 2011;37:501–507. doi: 10.1183/09031936.00035909. [DOI] [PubMed] [Google Scholar]
- 16.Gibson P.G., Simpson J.L. The overlap syndrome of asthma and COPD: what are its features and how important is it? Thorax. 2009;64:728–735. doi: 10.1136/thx.2008.108027. [DOI] [PubMed] [Google Scholar]
- 17.Miravitlles M. The overlap syndrome between asthma and COPD: implications for management. Hot Topics Respir Med. 2011;16:15–20. [Google Scholar]
- 18.O’Donnell D.E., Aaron S., Bourbeau J., Hernandez P., Marciniuk D.D., Balter M. Canadian Thoracic Society recommendations for management of chronic obstructive pulmonary disease – 2007 update. Can Respir J. 2007;14(Suppl B):5B–32B. doi: 10.1155/2007/830570. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Nagai A., Aizawa H., Aoshiba K., Asano K., Hirata K., Ichinose M. 3rd ed. The Japanese Respiratory Society, Medical Review Co. Ltd.; Tokyo (Japan): 2009. Guidelines for the diagnosis and treatment of COPD. [Google Scholar]
- 20.Soler-Cataluña J.J., Cosío B., Izquierdo J.L., López-Campos J.L., Marín J.M., Agüero R. Documento de consenso sobre el fenotipo mixto EPOC-asma en la EPOC. Arch Bronconeumol. 2012 doi:10.1016. [Google Scholar]
- 21.Han M.K., Kazerooni E.A., Lynch D.A., Liu L.X., Murray S., Curtis J.L. Chronic obstructive pulmonary disease exacerbations in the COPDGene study: associated radiologic phenotypes. Radiology. 2011;261:274–282. doi: 10.1148/radiol.11110173. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Nishimura M., Makita H., Nagai K., Konno S., Nasuhara Y., Hasegawa M. Annual change in pulmonary function and clinical phenotype in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2012;185:44–52. doi: 10.1164/rccm.201106-0992OC. [DOI] [PubMed] [Google Scholar]
- 23.American Thoracic Society Chronic bronchitis, asthma, and pulmonary emphysema, a statement by the Committee on Diagnostic Standards for Nontuberculous Respiratory Diseases. Am Rev Respir Dis. 1962;85:762–768. [Google Scholar]
- 24.Prescott E., Lange P., Vestbo J. Chronic mucus hypersecretion in COPD and death from pulmonary infection. Eur Respir J. 1995;8:1333–1338. doi: 10.1183/09031936.95.08081333. [DOI] [PubMed] [Google Scholar]
- 25.Miravitlles M. Cough and sputum production as risk factors for poor outcomes in patients with COPD. Respir Med. 2011;105:1118–1128. doi: 10.1016/j.rmed.2011.02.003. [DOI] [PubMed] [Google Scholar]
- 26.Montes de Oca M., Halbert R.J., López M.V., Pérez-Padilla R., Tálamo C., Moreno D. Chronic bronchitis phenotype in subjects with and without COPD: the PLATINO study. Eur Respir J. 2012 doi: 10.1183/09031936.00141611. http://dx.doi.org/10.1183/09031936.00141611. [DOI] [PubMed] [Google Scholar]
- 27.Kim V., Han M.K., Vance G.B., Make B.J., Newel J.D., Hokanson J.E. The chronic bronchitic phenotype of COPD. An analysis of the COPDGene study. Chest. 2011;140:626–633. doi: 10.1378/chest.10-2948. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Patel I.S., Vlahos I., Wilkinson T.M.A., Lloyd-Owen S.J., Donaldson G.C., Wilks M. Bronchiectasis, exacerbation indices, and inflammation in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2004;70:400–407. doi: 10.1164/rccm.200305-648OC. [DOI] [PubMed] [Google Scholar]
- 29.Martínez-Garcia M.A., Soler-Cataluña J.J., Donat Y., Catalán S., Agramunt M., Ballestín J. Factors associated with bronchiectasis in chronic obstructive pulmonary disease patients. Chest. 2011;140:1130–1137. doi: 10.1378/chest.10-1758. [DOI] [PubMed] [Google Scholar]
- 30.Celli B.R., Cote C.G., Marín J.M., Casanova C., Montes de Oca M., Mendez R.A. The body-mass index, airflow obstruction, dyspnea, and exercise capacity index in chronic obstructive pulmonary disease. N Engl J Med. 2004;350:1005–1012. doi: 10.1056/NEJMoa021322. [DOI] [PubMed] [Google Scholar]
- 31.Soler-Cataluña J.J., Martínez-García M.A., Sánchez L., Perpiña M., Román P. Severe exacerbations and BODE index: two independent risk factors for death in male COPD patients. Respir Med. 2009;103:692–699. doi: 10.1016/j.rmed.2008.12.005. [DOI] [PubMed] [Google Scholar]
- 32.Bestall J.C., Paul E.A., Garrod R., Garnham R., Jones P.W., Wedzicha J.A. Usefulness of the Medical Research Council (MRC) dyspnoea scale as a measure of disability in patients with chronic obstructive pulmonary disease. Thorax. 1999;54:581–586. doi: 10.1136/thx.54.7.581. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Nishimura K., Izumi T., Tsukino M., Oga T. Dyspnea is a better predictor of 5-year survival than airway obstruction in patients with COPD. Chest. 2002;121:1434–1440. doi: 10.1378/chest.121.5.1434. [DOI] [PubMed] [Google Scholar]
- 34.Esteban C., Quintana J.M., Aburto M., Moraza J., Egurrola M., Pérez-Izquierdo J. Impact of changes in physical activity on health-related quality of life among patients with COPD. Eur Respir J. 2010;36:292–300. doi: 10.1183/09031936.00021409. [DOI] [PubMed] [Google Scholar]
- 35.García-Aymerich J., Lange P., Benet M., Schnohr P., Antó J.M. Regular physical activity modifies smoking-related lung function decline and reduces risk of chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2007;175:458–463. doi: 10.1164/rccm.200607-896OC. [DOI] [PubMed] [Google Scholar]
- 36.Watz H., Waschki B., Meyer T., Magnussen H. Physical activity in patients with COPD. Eur Respir J. 2009;33:262–272. doi: 10.1183/09031936.00024608. [DOI] [PubMed] [Google Scholar]
- 37.García-Aymerich J., Serra Pons I., Mannino D.M., Maas A.K., Miller D.P., Davis K.J. Lung function impairment. COPD hospitalisations and subsequent mortality. Thorax. 2011;66:585–590. doi: 10.1136/thx.2010.152876. [DOI] [PubMed] [Google Scholar]
- 38.Jones P.W., Harding G., Berry P., Wiklund I., Chen W.-H., Kline Leidy N. Development and first validation of the COPD Assessment Test. Eur Respir J. 2009;34:648–654. doi: 10.1183/09031936.00102509. [DOI] [PubMed] [Google Scholar]
- 39.Jones P.W., Brusselle G., Dal Negro R.W., Ferrer M., Kardos P., Levy M.L. Properties of the COPD assessment test in a cross-sectional European study. Eur Respir J. 2011;38:29–35. doi: 10.1183/09031936.00177210. [DOI] [PubMed] [Google Scholar]
- 40.Postma D., Anzueto A., Calverley P., Jenkins C., Make B.J., Sciurba F.C. A new perspective on optimal care for patients with COPD. Prim Care Respir J. 2011;20:205–209. doi: 10.4104/pcrj.2011.00041. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Appleton S., Jones T., Poole P., Pilotto L., Adams R., Lasserson T.J. Ipratropium bromide versus short acting beta-2 agonists for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2006;2:CD001387. doi: 10.1002/14651858.CD001387.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Stockley R.A., Whitehead P.J., Williams M.K. Improved outcomes in patients with chronic obstructive pulmonary disease treated with salmeterol compared with placebo/usual therapy: results of a meta-analysis. Respir Res. 2006;7:147. doi: 10.1186/1465-9921-7-147. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Aalbers R., Ayres J., Backer V., Decramer M., Lier P.A., Magyar P. Formoterol in patients with chronic obstructive pulmonary disease: a randomized, controlled, 3-month trial. Eur Respir J. 2002;19:936–943. doi: 10.1183/09031936.02.00240902. [DOI] [PubMed] [Google Scholar]
- 44.Tashkin D.P., Celli B., Senn S., Burkhart D., Kesten S., Menjoge S. A 4-year trial of tiotropium in chronic obstructive pulmonary disease. N Engl J Med. 2008;359:1543–1554. doi: 10.1056/NEJMoa0805800. [DOI] [PubMed] [Google Scholar]
- 45.Beier J., Beeh K.M. Long-acting β-adrenoceptor agonists in the management of COPD: focus on indacaterol. Int J Chron Obstruct Pulmon Dis. 2011;6:237–243. doi: 10.2147/COPD.S7371. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Brusasco V., Hodder R., Miravitlles M., Korducki L., Towse L., Kesten S. Health outcomes following six months treatment with once daily tiotropium compared to twice daily salmeterol in patients with COPD. Thorax. 2003;58:399–404. doi: 10.1136/thorax.58.5.399. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Puhan M.A., Bachmann L.M., Kleijnen J., Ter Riet G., Kessels A.G. Inhaled drugs to reduce exacerbations in patients with chronic obstructive pulmonary disease: a network meta-analysis. BMC Med. 2009;7:2. doi: 10.1186/1741-7015-7-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Wilt T.J., Niewoehner D., MacDonald R., Kane R.L. Management of stable chronic obstructive pulmonary disease: a systematic review for a clinical practice guideline. Ann Intern Med. 2007;147:639–653. doi: 10.7326/0003-4819-147-9-200711060-00009. [DOI] [PubMed] [Google Scholar]
- 49.Vogelmeier C., Hederer B., Glaab T., Schmidt H., Rutten van Molkën M.P.M.H., Beeh K.M. Tiotropium versus salmeterol for the prevention of exacerbations of COPD. N Engl J Med. 2011;364:1093–1103. doi: 10.1056/NEJMoa1008378. [DOI] [PubMed] [Google Scholar]
- 50.Van Noord J.A., Aumann J.-L., Janssens E., Smeets J.J., Verhaert J., Disse B. Comparison of tiotropium once daily, formoterol twice daily and both combined once daily in patients with COPD. Eur Respir J. 2005;26:214–222. doi: 10.1183/09031936.05.00140404. [DOI] [PubMed] [Google Scholar]
- 51.Van Noord J.A., Buhl R., LaForce C., Martin C., Jones F., Dolker M. QVA149 demonstrates superior bronchodilation compared with indacaterol or placebo in patients with chronic obstructive pulmonary disease. Thorax. 2010;65:1086–1091. doi: 10.1136/thx.2010.139113. [DOI] [PubMed] [Google Scholar]
- 52.Zhou Y., Wang X., Zeng X., Qiu R., Xie J., Liu S. Positive benefits of theophylline in a randomized, double-blind, parallel-group, placebo-controlled study of low-dose, slow-release theophylline in the treatment of COPD for 1 year. Respirology. 2006;11:603–610. doi: 10.1111/j.1440-1843.2006.00897.x. [DOI] [PubMed] [Google Scholar]
- 53.Ram F.S.F., Jardim J.R., Atallah A., Castro A.A., Mazzini R., Goldstein R. Efficacy of theophylline in people with stable chronic obstructive pulmonary disease: a systematic review and meta-analysis. Respir Med. 2005;99:135–144. doi: 10.1016/j.rmed.2004.10.009. [DOI] [PubMed] [Google Scholar]
- 54.American Thoracic Society European Respiratory Society Statement: standards for the diagnosis and management of individuals with alpha-1-antitrypsin deficiency. Am J Respir Crit Care Med. 2003;168:818–900. doi: 10.1164/rccm.168.7.818. [DOI] [PubMed] [Google Scholar]
- 55.Vidal R., Blanco I., Casas F., Jardí R., Miravitlles M., the National Alpha-1-antitrypsin Registry Committee Guidelines for the diagnosis and management of alpha-1-antitrypsin deficiency. Arch Bronconeumol. 2006;42:645–659. doi: 10.1016/s1579-2129(07)60007-x. [DOI] [PubMed] [Google Scholar]
- 56.Hardin M., Silverman E.K., Barr R.G., Hansel N.H., Schroeder J.D., Make B.J., for the COPDGene Investigators The clinical features of overlap between COPD and asthma. Respir Res. 2011;12:127. doi: 10.1186/1465-9921-12-127. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Papi A., Romagnoli M., Baraldo S., Braccioni F., Guzzinati I., Saetta M. Partial reversibility of airflow limitation and increased exhaled NO and sputum eosinophilia in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2000;162:1773–1777. doi: 10.1164/ajrccm.162.5.9910112. [DOI] [PubMed] [Google Scholar]
- 58.Siva R., Green R.H., Brightling C.E., Shelley M., Hargadon B., McKenna S. Eosinophilic airway inflammation and exacerbations of COPD: a randomised controlled trial. Eur Respir J. 2007;29:906–913. doi: 10.1183/09031936.00146306. [DOI] [PubMed] [Google Scholar]
- 59.Miravitlles M. Arguments in favor of inhaled corticosteroids in COPD by phenotype instead of by severity. Arch Bronconeumol. 2011;47:271–273. doi: 10.1016/j.arbr.2011.01.003. [DOI] [PubMed] [Google Scholar]
- 60.Welte T., Miravitlles M., Hernandez P., Eriksson G., Peterson S., Polanowski T. Efficacy and tolerability of budesonide/formoterol added to tiotropium in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2009;180:741–750. doi: 10.1164/rccm.200904-0492OC. [DOI] [PubMed] [Google Scholar]
- 61.Peters S.P., Kunselman S.J., Nikolina Icitovic M.A., Moore W.C., Pascual R., Ameredes B.T. Tiotropium bromide step-up therapy for adults with uncontrolled asthma. N Engl J Med. 2010;363:1715–1726. doi: 10.1056/NEJMoa1008770. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Calverley P.M.A., Anderson J.A., Celli B., Ferguson G.T., Jenkins C., Jones P.W. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med. 2007;356:775–778. doi: 10.1056/NEJMoa063070. [DOI] [PubMed] [Google Scholar]
- 63.Kardos P., Wencker M., Glaab T., Vogelmeier C. Impact of salmeterol/fluticasone propionate versus salmeterol on exacerbations in severe chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2007;175:144–149. doi: 10.1164/rccm.200602-244OC. [DOI] [PubMed] [Google Scholar]
- 64.Nannini L.J., Cates C.J., Lasserson T.J., Poole P. Combined corticosteroid and long-acting beta-agonist in one inhaler versus long-acting beta-agonists for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2007;4:CD006829. doi: 10.1002/14651858.CD006829. [DOI] [PubMed] [Google Scholar]
- 65.Aaron S.D., Vandemheen K.L., Fergusson D., Maltais F., Bourbeau J., Goldstein R. Tiotropium in combination with placebo, salmeterol, or fluticasone-salmeterol for treatment of chronic obstructive pulmonary disease: a randomized trial. Ann Intern Med. 2007;146:545–555. doi: 10.7326/0003-4819-146-8-200704170-00152. [DOI] [PubMed] [Google Scholar]
- 66.Calverley P.M.A., Sanchez-Toril F., McIvor A., Teichmann P., Bredenbroeker D., Fabbri L.M. Effect of 1-year treatment with roflumilast in severe chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2007;176:154–161. doi: 10.1164/rccm.200610-1563OC. [DOI] [PubMed] [Google Scholar]
- 67.Rennard S.I., Calverley P.M.A., Goehring U.M., Bredenbröker D., Martinez F.J. Reduction of exacerbations by the PDE4 inhibitor roflumilast — the importance of defining different subsets of patients with COPD. Respir Res. 2011;12:18. doi: 10.1186/1465-9921-12-18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.Fabbri L.M., Calverley P.M.A., Izquierdo-Alonso J.L., Bundschuh D.S., Brose M., Martinez F.J. Roflumilast in moderate-to-severe chronic obstructive pulmonary disease treated with long acting bronchodilators: two randomised clinical trials. Lancet. 2009;374:695–703. doi: 10.1016/S0140-6736(09)61252-6. [DOI] [PubMed] [Google Scholar]
- 69.Bateman E.D., Rabe K.F., Calverley P.M., Goehring U.M., Brose M., Bredenbroker D. Roflumilast with long-acting b2-agonists for COPD: influence of exacerbation history. Eur Respir J. 2011;38:553–560. doi: 10.1183/09031936.00178710. [DOI] [PubMed] [Google Scholar]
- 70.Grandjean E.M., Berthet P., Ruffmann R., Leuenberger P. Efficacy of oral long-term N-acetylcysteine in chronic bronchopulmonary disease: a metaanalysis of published double-blind, placebo-controlled clinical trials. Clin Ther. 2000;22:209–221. doi: 10.1016/S0149-2918(00)88479-9. [DOI] [PubMed] [Google Scholar]
- 71.Poole P.J., Black P.N. Mucolytic agents for chronic bronchitis or chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2006;3:CD001287. doi: 10.1002/14651858.CD001287.pub2. [DOI] [PubMed] [Google Scholar]
- 72.Zheng J.P., Kang J., Huang S.G. Effect of carbocisteine on acute exacerbation of chronic obstructive pulmonary disease (PEACE Study): a randomized placebo-controlled study. Lancet. 2008;371:2013–2018. doi: 10.1016/S0140-6736(08)60869-7. [DOI] [PubMed] [Google Scholar]
- 73.Decramer M., Rutten-van M.M., Dekhuijzen P.N., Troosters T., Van Herwaarden C., Pellegrion R. Effects of N-acetylcysteine on outcomes in chronic obstructive pulmonary disease (Bronchitis Randomized on NAC Cost-Utility Study. BRONCUS): a randomized placebo-controlled trial. Lancet. 2005;365:1552–1560. doi: 10.1016/S0140-6736(05)66456-2. [DOI] [PubMed] [Google Scholar]
- 74.Staykova T, Black PN, Chacko EE, Poole P. Prophylactic antibiotic therapy for chronic bronchitis. Cochrane Review: 21 Jan 2009; http://dx.doi.org/10.1002/14651858.CD004105. [DOI] [PubMed]
- 75.Sevilla-Sánchez D., Soy-Muner D., Soler-Porcar N. Utilidad de los macrólidos como antiinflamatorios en las enfermedades respiratorias. Arch Bronconeumol. 2010;46:244–254. doi: 10.1016/j.arbres.2009.10.008. [DOI] [PubMed] [Google Scholar]
- 76.Pomares X., Montón C., Espasa M., Casabon J., Monsó E., Gallego M. Long-term azithromycin therapy in patients with severe COPD and repeated exacerbations. Int J Chron Obst Respir Dis. 2011;6:449–456. doi: 10.2147/COPD.S23655. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77.Seemungal T.A.R., Wilkinson T.M.A., Hurst J.R., Perera W.R., Sapsford R.J., Wedzicha J.A. Long-term erythromycin therapy is associated with decreased chronic obstructive pulmonary disease exacerbations. Am J Respir Crit Care Med. 2008;178:1139–1147. doi: 10.1164/rccm.200801-145OC. [DOI] [PubMed] [Google Scholar]
- 78.Albert R.K., Connett J., Biley W.C., Casaburi R., Cooper J.A.D., Criner G.J. Azithromycin for prevention of exacerbations of COPD. N Engl J Med. 2011;365:689–698. doi: 10.1056/NEJMoa1104623. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.Miravitlles M., Marín A., Monsó E., Vilà S., de la Roza C., Hervás R. Efficacy of moxifloxacin in the treatment of bronchial colonization in COPD. Eur Respir J. 2009;34:1066–1071. doi: 10.1183/09031936.00195608. [DOI] [PubMed] [Google Scholar]
- 80.Sethi S., Jones P.W., Theron M.S., Miravitlles M., Rubinstein E., Wedzicha J.A. Pulsed moxifloxacin for the prevention of exacerbations of chronic obstructive pulmonary disease: a randomized controlled trial. Respir Res. 2010;11:10. doi: 10.1186/1465-9921-11-10. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Vendrell M., de Gracia J., Olveira C., Martínez M.A., Girón R., Máiz L. Diagnóstico y tratamiento de las bronquiectasias. Arch Bronconeumol. 2008;44:629–640. doi: 10.1157/13128330. [DOI] [PubMed] [Google Scholar]
- 82.Adams S.G., Anzueto A., Briggs D.D., Jr., Leimer I., Kesten S. Evaluation of withdrawal of maintenance tiotropium in COPD. Respir Med. 2009;103:1415–1420. doi: 10.1016/j.rmed.2009.05.018. [DOI] [PubMed] [Google Scholar]
- 83.Van der Valk P., Monninkhof E., van del Palen J., Zielhuis G., van Herwaarden C. Effect of discontinuation of inhaled corticosteroids in patients with chronic obstructive pulmonary disease. The COPE study. Am J Respir Crit Care Med. 2002;166:1358–1363. doi: 10.1164/rccm.200206-512OC. [DOI] [PubMed] [Google Scholar]
- 84.Nighat J., Nadeem N.J., Taylor S., Eldridge S.M. Withdrawal of inhaled corticosteroids in individuals with COPD — a systematic review and comment on trial methodology. Respir Res. 2011;12:107. doi: 10.1186/1465-9921-12-107. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 85.Schermer T.R.J., Hendriks A.J.C., Chavannes N.H., Dekhuijzen P.N.R., Wouters E.F.M., van der Hoogen H. Probability and determinants of relapse after discontinuation of inhaled corticosteroids in patients with COPD treated in general practice. Prim Care Respir J. 2004;13:48–55. doi: 10.1016/j.pcrj.2003.11.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 86.Liesker J.J.W., Bathoorn E., Postma D.S., Vonk J.M., Timens W., Kerstjens H.A.M. Sputum inflammation predicts exacerbations after cessation of inhaled corticosteroids in COPD. Respir Med. 2011;105:1853–1860. doi: 10.1016/j.rmed.2011.07.002. [DOI] [PubMed] [Google Scholar]