Abstract
目的
观察丹皮酚对牙龈卟啉单胞菌作用下对体外培养的小鼠骨髓来源巨噬细胞(BMM)炎性因子分泌及向破骨细胞分化能力的影响,并探讨其作用机制。
方法
体外分离获得小鼠生长良好的BMM,加入不同浓度丹皮酚溶液处理1 h,再加入牙龈卟啉单胞菌进行24 h诱导刺激。采用流式细胞术检测炎症相关蛋白程序性死亡分子配体1(PD-L1)的表达量,采用酶联免疫吸附试验(ELISA)检测细胞上清液中肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)及白细胞介素-6(IL-6)水平;在核因子κB受体活化因子配体(RANKL)和巨噬细胞集落刺激因子(M-CSF)刺激后的BMM中加入不同浓度的丹皮酚溶液处理1 h后,加入牙龈卟啉单胞菌刺激,采用抗酒石酸性磷酸酶(TRAP)染色观察破骨细胞形成情况,Western blot检测破骨细胞形成相关蛋白TRAP和核因子κB受体活化因子(RANK)的表达。
结果
丹皮酚在10~50 µmol·L−1的范围内,对BMM无毒性作用。流式细胞术结果提示丹皮酚可以抑制牙龈卟啉单胞菌诱导PD-L1的表达,并存在剂量依赖效应。ELISA实验证明丹皮酚能以剂量依赖性方式抑制BMM释放TNF-α、IL-1β及IL-6(P<0.01)。牙龈卟啉单胞菌可以明显诱导BMM分化形成破骨细胞;TRAP染色显示丹皮酚各浓度组能抑制BMM向破骨细胞分化;Western blot结果显示丹皮酚抑制TRAP和RANK表达且存在剂量依赖效应。
结论
丹皮酚可以剂量依赖方式抑制牙龈卟啉单胞菌诱导的BMM炎性因子TNF-α、IL-1β及IL-6的分泌及其向破骨细胞分化的能力。
Keywords: 丹皮酚, 牙龈卟啉单胞菌, 骨髓来源巨噬细胞, 破骨细胞, 炎症, 分化
Abstract
Objective
This work aims to examine the effects of paeonol treatment on the ability of bone marrow-derived macrophage (BMM) to excrete inflammatory factors and to differentiate into osteoclasts upon induction with Porphyromonas gingivalis (P. gingivalis). This work also aims to investigate the underlying mechanisms of these abilities.
Methods
BMM culture was treated with different paeonol concentrations at for 1 h and then stimulated with P. gingivalis for 24 h before programmed death-ligand 1 (PD-L1) was quantified with flow cytometry. Tumor necrosis factor-α (TNF-α), interleukin (IL)-1β, and IL-6 were detected by enzyme-linked immunosorbent assay (ELISA). The BMM culture was treated with the receptor activator for nuclear factor-κB ligand (RANKL) and macrophage colony-stimulating factor (M-CSF), and then with paeonol for 1 h prior to induction with P. gingivalis. Then, osteoclast formation was assessed using tartrate resistant acid phosphatase (TRAP) staining. The osteoclast-related proteins TRAP and receptor activator of nuclear factor-κB (RANK) were quantified by Western blotting.
Results
Paeonol was nontoxic to BMM within a range of 10–50 µmol·L−1. Flow cytometry showed that paeonol inhibited PD-L1 expression in P. gingivalis-induced BMM in a dose-dependent manner. ELISA indicated that paeonol dose-dependently inhibited the excretion of TNF-α, IL-1β, and IL-6 by P. gingivalis-induced BMM (P<0.01). TRAP staining revealed that paenol treatment inhibited the differentiation of P. gingivalis-induced BMM into osteoclasts. Western blot results suggested that paeonol decreased the expression of TRAP and RANK in BMM.
Conclusion
Paeonol dose-dependently inhibited the excretion of the inflammatory factors TNF-α, IL-1β, and IL-6 by P. gingivalis-induced BMM in a dose-dependent manner. Moreover, paenol treatment prevented the differentiation of P. gingivalis-induced BMM differentiation into osteoclasts.
Keywords: paeonol, Porphyromonas gingivalis, bone marrow-derived macrophage, osteoclast, inflammatory, differentiation
慢性牙周炎是导致成人失牙的最常见的慢性感染性炎症疾病[1]。牙龈卟啉单胞菌(Porphyromonas gingivalis,P. gingivalis)是牙周炎的主要致病菌,被认为是牙周毒力最强的致病菌之一。牙龈卟啉单胞菌能产生大量毒力因子,参与牙周炎发生、发展及牙周组织的破坏过程[2]–[3]。在慢性牙周炎组织中,巨噬细胞在宿主免疫反应中担当重要作用,具有趋化作用,并能集中在炎症部位,发挥强大的抗原呈递和吞噬作用。有报道显示牙龈卟啉单胞菌可以激活宿主免疫细胞巨噬细胞,诱导炎症相关基因转录,产生促炎症因子分泌,如肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1及IL-6等,诱导炎症反应的发生,具有强烈的细胞毒性和组织损伤性;并在杀死病原体同时,也导致牙周结缔组织损伤和牙槽骨吸收[4]。正常生理状态下,牙槽骨的骨改建是一终身动态且和谐的重塑过程,由成骨细胞和破骨细胞调节的骨形成和骨吸收完成。其中破骨细胞是人体内唯一具有吸收骨质功能的细胞,是一种多核的巨核细胞,来源破骨前体细胞及单核巨噬细胞。慢性牙周炎主要临床特征为牙槽骨吸收,即有过量的破骨细胞形成,骨吸收多于骨形成,最终导致牙槽骨吸收,牙齿脱落。因此,如何控制巨噬细胞的炎症反应及其过度向破骨细胞分化,是减少牙周组织破坏的关键。
丹皮酚(paeonol)是从牡丹根皮及萝摩科徐长卿提取的主要活性成分,具有抗菌消炎、免疫调节、镇静解痉、退热止痛等药理作用[5]。抗炎方面,丹皮酚能够下调TNF-α诱导的血管内皮细胞炎性因子的表达,抑制内皮细胞炎症反应;丹皮酚还可抑制脂多糖诱导的星形胶质细胞的炎性因子分泌。此外,丹皮酚能抑制由核因子κB受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL)诱导的破骨细胞形成[6]。然而,目前其在抑制牙龈卟啉单胞菌诱导的牙周炎症反应的作用报道较少。因此,本研究通过观察丹皮酚作用下骨髓来源巨噬细胞(bone marrow-derived macrophage,BMM)分泌和表达细胞炎性因子及向破骨细胞形成的影响,为丹皮酚在牙周炎治疗中的应用提供理论依据。
1. 材料和方法
1.1. 主要试剂和仪器
α-MEM培养基、胎牛血清(fetal bovine serum,FBS)、胰蛋白酶(Gibco公司,美国),丹皮酚、淋巴细胞分离液Ficoll、抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色试剂盒(Sigma公司,美国),抗小鼠程序性死亡分子配体1(programmed death-ligand 1,PD-L1)流式抗体(Santa公司,美国),小鼠TNF-α、IL-1β及IL-6酶联免疫检测试剂盒(Bioscience公司,美国)。
1.2. 细菌培养
牙龈卟啉单胞菌ATCC33277菌株(由美国阿拉巴马大学牙学院张平教授惠赠)接种于富胰酪胨琼脂平板(含有5%去纤维蛋白绵羊血、1%含酵母提取物、5 µg·mL−1氯化血红素、1 µg·mL−1甲萘醌),37 °C厌氧(10%H2、2%CO2和85%N2)培养5~7 d,生化鉴定、传代。细菌收获,离心,洗涤。利用分光光度计在580 nm波长检测细菌光密度值(optiacl density,OD),以确定细菌总数。
1.3. 细胞获取
本实验选用8~10周龄雌性C57BL/6小鼠(获得美国阿拉巴马大学医学伦理委员会批准),断颈处死。无菌条件下去除鼠股骨和胫骨游离附着软组织。切断长骨两端,使用装有α-10的25号注射针反复冲洗骨髓。通过机械分散法将骨髓细胞充分打散,培养在加湿7.5%CO2培养箱中,37 °C过夜。次日,收获非贴壁细胞,利用Ficoll提取试剂盒(分离淋巴细胞与单核细胞),获得破骨细胞前体细胞。
1.4. 流式细胞仪检测BMM中PD-L1的表达
将收获的前体细胞培养于含10%FBS的α-MEM培养基中,按照相应处理进行分组,对照组:不加刺激;阳性刺激组:直接加牙龈卟啉单胞菌刺激,其感染复数(multiplicity of infection,MOI)=10;模型组:不同浓度(10、30和50 µmol·L−1)的丹皮酚预处理1 h,加入牙龈卟啉单胞菌(MOI=10)。
将各组细胞分别用流式细胞荧光分选技术(fluorescence activated cell sorting,FACS)缓冲液洗涤2次,调整细胞浓度为每100 µL FACS缓冲液中含1×106个细胞,进行抗体孵育。每组细胞中分别加入0.5 µL PE标记抗小鼠PD-L1单克隆抗体,避光条件下37 °C孵育0.5 h。再用FACS缓冲液洗涤2次,重悬于300 µL FACS缓冲液中,上流式细胞仪BDcaliber检测BMMs细胞中PD-L1阳性表达百分率。
1.5. 酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)测定细胞上清液
取生长状态良好的细胞,以浓度为每毫升8×103个接种96孔板,待生长至60%~70%融合时按1.4中的分组给药刺激后,收集细胞培养上清液。按ELISA试剂盒说明,分别测定各组细胞培养上清中细胞因子IL-1β、IL-6和TNF-α的浓度。
1.6. 破骨细胞培养及染色
细胞模型处理条件和药物浓度依据文献和预实验结果[7]。按浓度为每毫升5×104个将细胞接种于24孔细胞培养板,在RANKL和巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)刺激后的BMM中,按1.4分组情况,加入不同浓度的丹皮酚溶液处理1 h后,加入MOI=50的牙龈卟啉单胞菌进行刺激,诱导破骨细胞形成。4 d后,根据本实验组以前操作步骤进行TRAP染色。
1.7. Western blot检测
各组细胞培养48 h后,利用蛋白酶抑制剂和RIPA裂解混合液(1︰100)提取蛋白质,BCA法检测蛋白浓度后,将各组蛋白按相同浓度进行变性处理,条件为95 °C下煮沸5 min。配胶上样后,凝胶电泳。半干法转膜,将样本转至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜。室温下5%脱脂奶粉封闭1 h PVDF膜,分别孵育于抗小鼠核因子κB受体活化因子(receptor activator of nuclear factor-κB,RANK)和TRAP的兔抗小鼠单克隆一抗中,4 °C摇床过夜。再在室温条件下孵育在羊抗兔IgG二抗中1 h,TBST洗膜5次,每次5 min。电化学发光(electrochemiluminescence,ECL)液发光后,暗室曝光。
1.8. 统计学分析
采用SPSS 19.0统计学软件对实验数据进行分析,计量资料参数采用均数±标准差表示,采用两样本t检验对结果进行分析,P<0.05为差异有显著性。
2. 结果
2.1. 丹皮酚对牙龈卟啉单胞菌诱导BMM表达PD-L1的影响
经流式细胞术检测,牙龈卟啉单胞菌作用BMM细胞24 h后,细胞PD-L1蛋白显著上升;同阳性刺激组相比,浓度为10、30和50 µmol·L−1的丹皮酚溶液呈浓度依赖性抑制牙龈卟啉单胞菌上调PD-L1蛋白的水平,表明丹皮酚可能通过抑制PD-L1激活来减轻牙龈卟啉单胞菌诱导的BMM细胞炎症反应。而不同浓度的丹皮酚单独处理后,对PD-L1的表达影响较小(图1)。
图 1. 流式细胞术检测BMM表面PD-L1的阳性表达率.
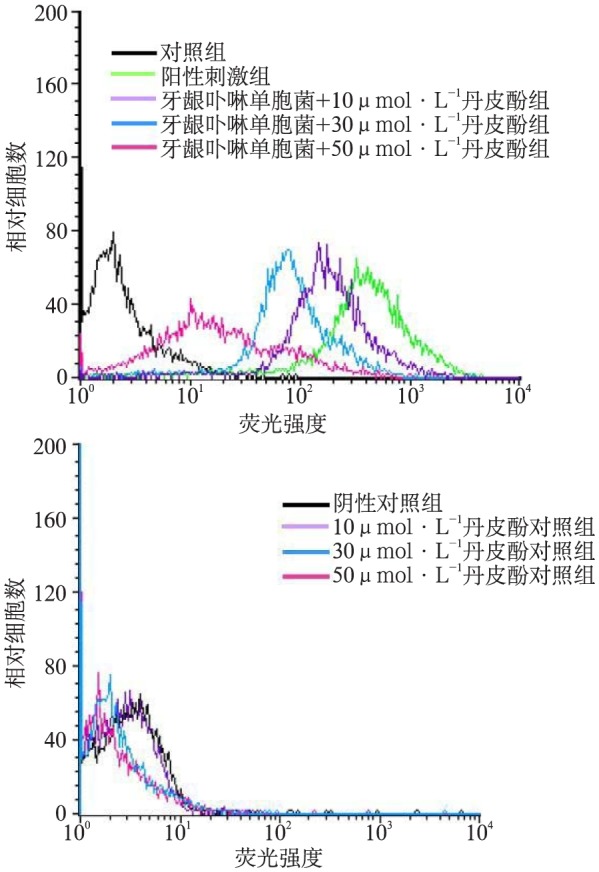
Fig 1 The expression of PD-L1 in the BMM by flow cytometry
2.2. 丹皮酚对牙龈卟啉单胞菌诱导BMM细胞炎性因子分泌的影响
在阳性刺激组中,牙龈卟啉单胞菌作用BMM 24 h后,细胞上清液中IL-1β、IL-6和TNF-α水平显著升高(P<0.01)。而在模型组中,分别加入10、30 和50 µmol·L−1丹皮酚后,各浓度组呈浓度依赖性抑制BMM分泌细胞炎性因子,IL-1β、IL-6和TNF-α水平显著下调(P<0.05或P<0.01),表明丹皮酚对牙龈卟啉单胞菌诱导的BMM细胞炎症反应具有明显的抑制作用。为确定丹皮酚单独作用BMM是否会产生炎性刺激,在BMM中加入不同浓度丹皮酚溶液后,发现各组细胞分泌IL-1β、IL-6和TNF-α水平较空白对照组无明显差异(P<0.05),表明丹皮酚在该浓度范围作用24 h对BMM无显著炎症反应(表1)。
表 1. 各组细胞上清中IL-1β、IL-6和TNF-α含量比较.
Tab 1 Expression of IL-1β, IL-6 and TNF-α in different groups cells supernatant
| 组别 | IL-1β | IL-6 | TNF-α |
| 对照组 | 41.86±10.010 | 556.7±27.850 | 27.03±13.050 |
| 10 µmol·L−1丹皮酚对照组 | 36.51±9.590 | 526.0±2.960 | 16.88±6.095 |
| 30 µmol·L−1丹皮酚对照组 | 54.41±8.326 | 481.2±4.462 | 6.55±0.608 |
| 50 µmol·L−1丹皮酚对照组 | 189.80±56.230 | 447.2±3.256 | 14.93±1.994 |
| 阳性刺激组 | 906.20±22.930 | 7 172.0±25.000 | 1 319.00±27.370 |
| 牙龈卟啉单胞菌+10 µmol·L−1丹皮酚组 | 34.48±26.310*** | 4 977.0±72.160** | 621.10±85.850*** |
| 牙龈卟啉单胞菌+30 µmol·L−1丹皮酚组 | 48.09±12.380*** | 2 637.0±138.200*** | 267.10±10.670*** |
| 牙龈卟啉单胞菌+50 µmol·L−1丹皮酚组 | 53.61±3.067*** | 872.8±26.610*** | 277.90±53.680*** |
注:**与阳性刺激组比较,P<0.01;***与阳性刺激组比较,P<0.001。
ng·L−1, x±s
2.3. 丹皮酚对牙龈卟啉单胞菌诱导BMM分化破骨细胞能力的影响
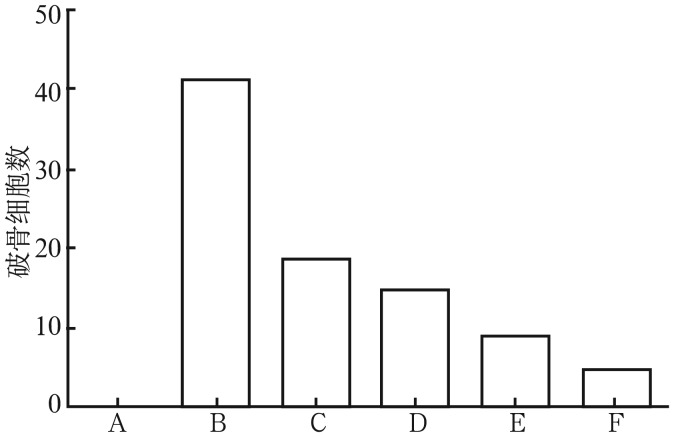
对各组细胞进行TRAP染色及计数。用RANKL预处理细胞24 h后,在培养基中去除,加入牙龈卟啉单胞菌刺激4 d后,大量破骨细胞形成。同阳性刺激组相比,10、30和50 µmol·L−1丹皮酚能显著抑制牙龈卟啉单胞菌诱导的破骨细胞形成(P<0.05),抑制能力呈浓度依赖性递增。而用RANKL预处理细胞24 h后,加入不同浓度的丹皮酚,对RANKL诱导的破骨形成无明显影响(P>0.05)(图2、3)。
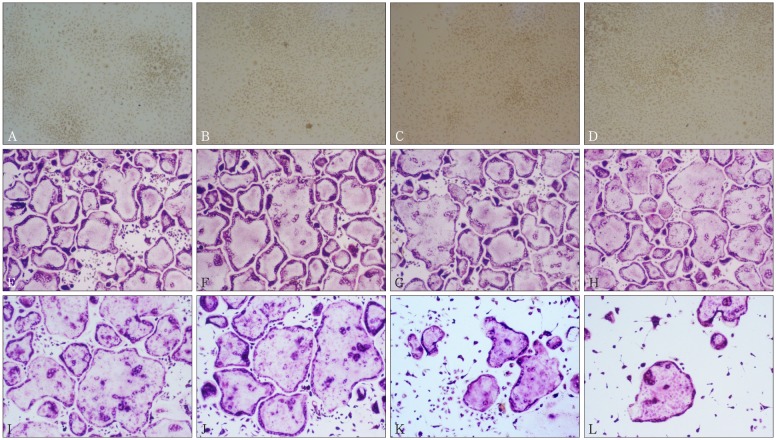
图 2. 破骨细胞TRAP染色结果 TRAP × 10.
Fig 2 TRAP staining of positive multinucleated osteoclasts TRAP × 10
A:对照组;B:10 µmol·L−1丹皮酚对照组;C:30 µmol·L−1丹皮酚对照组;D:50 µmol·L−1丹皮酚对照组;E:破骨细胞诱导组;F:破骨诱导+10 µmol·L−1丹皮酚组;G:破骨诱导+30 µmol·L−1丹皮酚组;H:破骨诱导+50 µmol·L−1丹皮酚组;I:牙龈卟啉单胞菌感染破骨细胞组;J:牙龈卟啉单胞菌+10 µmol·L−1丹皮酚组;K:牙龈卟啉单胞菌+30 µmol·L−1丹皮酚组;L:牙龈卟啉单胞菌+50 µmol·L−1丹皮酚组。
图 3. 破骨细胞TRAP阳性细胞数的统计.
Fig 3 Quantification of TRAP positive multinucleated osteoclasts
A:对照组;B:破骨细胞诱导组;C:牙龈卟啉单胞菌感染破骨细胞组;D:牙龈卟啉单胞菌+10 µmol·L−1丹皮酚组;E:牙龈卟啉单胞菌+30 µmol·L−1丹皮酚组;F:牙龈卟啉单胞菌+50 µmol·L−1丹皮酚组。
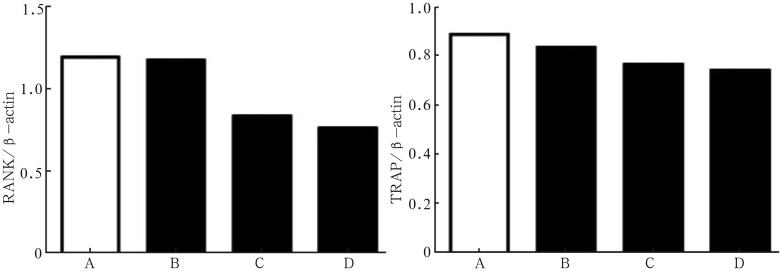
2.4. Western blot检测RANK和TRAP蛋白水平
各组细胞RANK和TRAP蛋白表达情况见图4、5。与阳性刺激组相比,随着丹皮酚浓度增高,RANK和TRAP蛋白表达明显减弱(P<0.05)。上述结果说明,丹皮酚可抑制破骨细胞RANK和TRAP蛋白水平表达。
图 4. Western blot检测RANK和TRAP蛋白的表达.
Fig 4 The expression of RANK and TRAP using Western blot
A:阳性刺激组;B:牙龈卟啉单胞菌+10 µmol·L−1丹皮酚组;C:牙龈卟啉单胞菌+30 µmol·L−1丹皮酚组;D:牙龈卟啉单胞菌+50 µmol·L−1丹皮酚组。
图 5. RANK和TRAP蛋白的表达.
Fig 5 Quantification of RANK and TRAP
左:RANK蛋白的表达;右:TRAP蛋白的表达;A:阳性刺激组;B:牙龈卟啉单胞菌+10 µmol·L−1丹皮酚组;C:牙龈卟啉单胞菌+30 µmol·L−1丹皮酚组;D:牙龈卟啉单胞菌+50 µmol·L−1丹皮酚组。
3. 讨论
在牙周炎发生发展过程中,BMM参与的特异性免疫应答起着重要作用,过度免疫反应会破坏牙周组织,导致附着丧失和牙槽骨吸收。牙龈卟啉单胞菌能够有效刺激免疫细胞产生炎症反应,BMM受到刺激后产生一系列炎性因子,参与牙周炎的病变发展。有研究[8]发现牙龈卟啉单胞菌能刺激BMM产生大量的IL-1β、IL-6、TNF-α和前列腺素2,这些因子与牙周炎的严重程度成正相关。此外,牙龈卟啉单胞菌可直接或间接刺激BMM分化成破骨细胞造成牙槽骨吸收,最终导致牙脱落[9]。因此,抑制牙龈卟啉单胞菌诱导的BMM分泌过量炎性因子和破骨细胞形成对于改善和治疗牙周炎起到至关重要的作用。
丹皮酚的抗炎作用已经得到证实。体外实验发现,丹皮酚可抑制脂多糖诱导的小鼠BMM和小角质细胞释放IL-6、TNF-α和IL-1炎性因子[10]。对细胞因子的测定中,采用ELISA法,结果显示牙龈卟啉单胞菌可显著增加BMM细胞的IL-1β、IL-6和TNF-α分泌,丹皮酚可显著抑制牙龈卟啉单胞菌诱导BMM炎性因子的释放,在此结果基础上,笔者用流式细胞术检测炎症相关蛋白PD-L1。PD-L1蛋白是程序性死亡因子(programmed death-1,PD-1)的配体,与自身免疫疾病、慢性炎症及肿瘤密切相关[11]。在脓毒血症小鼠动物模型中发现,PD-L1在单核细胞的表达量与IL-6和TNF-α的分泌成正比。本实验结果显示,较对照组,随丹皮酚浓度增高,丹皮酚干预细胞组的PD-L1表达降低。提示丹皮酚可通过抑制PD-L1降低牙龈卟啉单胞菌介导的BMM炎症因子的释放。
破骨细胞是人体内唯一具有骨吸收功能的多核巨噬细胞,来源于单核巨噬细胞系统,可以通过消化酶和酸来溶解骨组织完成骨吸收,进而实现骨修复重建。M-CSF和RANKL是破骨细胞分化成熟必不可少的两个重要因子,它们通过调节破骨前体细胞的增殖、融合、分化等功能来实现破骨细胞分化[12]。本实验中用BMM原代诱导的方法,该法比较接近体内破骨细胞分化的微环境,被广泛用于药物干预和调控方面的研究。在预实验中发现在M-CSF存在的前提下,牙龈卟啉单胞菌直接作用BMM不能诱导其分化为破骨细胞,只有在RANKL预处理后才能诱导BMM分化为破骨细胞,结果与其他研究[13]结果一致。故本实验中,在培养体系中加入M-CSF浓度为44 ng·mL−1,RANKL浓度为100 ng·mL−1,预处理24 h去除RANKL后,加入牙龈卟啉单胞菌。本实验结果显示经过4 d诱导各浓度丹皮酚组破骨细胞的形成数量均明显减少,较对照组有显著性差异,且抑制能力呈浓度依赖性增强,此外,TRAP染色结果显示,对照组诱导较丹皮酚各组的破骨细胞细胞核多,体型大,提示丹皮酚可以抑制BMM向成熟破骨细胞的分化。RANK和TRAP是破骨细胞形成的重要标志蛋白,在免疫应答、淋巴结形成及炎症中起着不可或缺的作用[14]。TRAP是破骨细胞的特征性酶,参与骨基质中固体钙磷矿化底物的降解。RNAK蛋白是位于破骨细胞以及前体细胞表面的Ⅰ型跨膜受体,是RANKL发挥破骨细胞分化作用唯一靶信号受体。只有当RANKL与RANK结合后,才能激活核因子κB等信号通络,进而启动破骨细胞的分化。本实验研究发现,与对照组相比较,丹皮酚各实验组细胞的TRAP和RANK蛋白量均减少,丹皮酚低浓度组与高浓度组相差也有统计学意义(P<0.05)。说明丹皮酚可能通过下调RANK及TRAP抑制牙龈卟啉单胞菌诱导的破骨细胞分化成熟。
已有报道丹皮酚可抑制实验性牙周炎大鼠体内炎症因子IL-1β、IL-6和TNF-α的分泌及骨丧失[15],本研究亦证实丹皮酚能明显抑制牙龈卟啉单胞菌诱导的BMM炎症因子IL-1β、IL-6和TNF-α的分泌,PD-L1可能参与了丹皮酚对BMM炎症反应的抑制作用。同时,丹皮酚能明显抑制牙龈卟啉单胞菌诱导的BMM破骨细胞分化能力。初步揭示了丹皮酚抑制牙龈卟啉单胞菌诱导BMM炎症及破骨反应的分子作用机制,为进一步研究丹皮酚防治牙周炎提供了新的实验依据。
Funding Statement
[基金项目] 贵阳市高层次创新型青年科技人才培养计划[筑教发(2-012HK)209-50号];西部地区人才培养出国特别项目[(2013)5044号]
Supported by: Innovative Talents Program of Guiyang City [(2012HK)209-50]; Special Project of Talent Cultivation in the Western Region [(2013)5044].
References
- 1.Moore WE, Moore LV. The bacteria of periodontal diseases[J] Periodontol 2000. 1994;5(1):66–77. doi: 10.1111/j.1600-0757.1994.tb00019.x. [DOI] [PubMed] [Google Scholar]
- 2.Holt SC, Kesavalu L, Walker S, et al. Virulence factors of Porphyromonas gingivalis[J] Periodontol 2000. 1999;20(1):168–238. doi: 10.1111/j.1600-0757.1999.tb00162.x. [DOI] [PubMed] [Google Scholar]
- 3.Bostanci N, Belibasakis GN. Porphyromonas gingivalis: an invasive and evasive opportunistic oral pathogen[J] FEMS Microbiol Lett. 2012;333(1):1–9. doi: 10.1111/j.1574-6968.2012.02579.x. [DOI] [PubMed] [Google Scholar]
- 4.Mysak J, Podzimek S, Sommerova P, et al. Porphyromonas gingivalis: major periodontopathic pathogen overview[J] J Immunol Res. 2014;2014:636893. doi: 10.1155/2014/476068. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.郭 齐, 李 贻奎, 王 志国, et al. 丹皮酚药理研究进展[J] 中医药信息. 2009;26(1):20–22. [Google Scholar]; Guo Q, Li YK, Wang ZG, et al. Research progress on paeonol pharmacological[J] Information Traditional Chin Med. 2009;26(1):20–22. [Google Scholar]
- 6.Tsai HY, Lin HY, Fong YC, et al. Paeonol inhibits RANKL-induced osteoclastogenesis by inhibiting ERK, p38 and NF-kappaB pathway[J] Eur J Pharmacol. 2008;588(1):124–133. doi: 10.1016/j.ejphar.2008.04.024. [DOI] [PubMed] [Google Scholar]
- 7.Jules J, Feng X. In vitro investigation of the roles of the proinflammatory cytokines tumor necrosis factor-α and interleukin-1 in murine osteoclastogenesis[J] Methods Mol Biol. 2014;1155:109–123. doi: 10.1007/978-1-4939-0669-7_10. [DOI] [PubMed] [Google Scholar]
- 8.Shaik-Dasthagirisaheb YB, Kantarci A, Gibson FC., 3rd Immune response of macrophages from young and aged mice to the oral pathogenic bacterium Porphyromonas gingivalis[J] Immun Ageing. 2010;7:15. doi: 10.1186/1742-4933-7-15. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Zhang W, Ju J, Rigney T, et al. Porphyromonas gingivalis infection increases osteoclastic bone resorption and osteoblastic bone formation in a periodontitis mouse model[J] BMC Oral Health. 2014;14:89. doi: 10.1186/1472-6831-14-89. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Chen N, Liu D, Soromou LW, et al. Paeonol suppresses lipopolysaccharide-induced inflammatory cytokines in macrophage cells and protects mice from lethal endotoxin shock[J] Fundam Clin Pharmacol. 2014;28(3):268–276. doi: 10.1111/fcp.12019. [DOI] [PubMed] [Google Scholar]
- 11.Qu QX, Huang Q, Shen Y, et al. The increase of circulating PD-L1-expressing CD68(+) macrophage in ovarian cancer[J] Tumour Biol. 2016;37(4):5031–5037. doi: 10.1007/s13277-015-4066-y. [DOI] [PubMed] [Google Scholar]
- 12.Boyle WJ, Simonet WS, Lacey DL. Osteoclast differentiation and activation[J] Nature. 2003;423(6937):337–342. doi: 10.1038/nature01658. [DOI] [PubMed] [Google Scholar]
- 13.Zhang P, Liu J, Xu Q, et al. TLR2-dependent modulation of osteoclastogenesis by Porphyromonas gingivalis through differential induction of NFATc1 and NF-kappaB[J] J Biol Chem. 2011;286(27):24159–24169. doi: 10.1074/jbc.M110.198085. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Kim JH, Kim N. Signaling pathways in osteoclast differentiation[J] Chonnam Med J. 2016;52(1):12–17. doi: 10.4068/cmj.2016.52.1.12. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Chang CY, Fu E, Chiang CY, et al. Effect of paeonol on tissue destruction in experimental periodontitis of rats[J] Am J Chin Med. 2014;42(2):361–374. doi: 10.1142/S0192415X14500244. [DOI] [PubMed] [Google Scholar]