Abstract
目的
优化羧甲基壳聚糖/氧化海藻酸钠(CMCS/OSA)复合水凝胶制备工艺,并应用于软骨组织工程。
方法
制备氨基与醛基比例分别为2∶1、1∶1、1∶2的CMCS/OSA复合水凝胶,并通过扫描电子显微镜观察、流变学检测、黏附拉力测试、溶胀率分析及细胞实验等方法评价复合水凝胶的微观形态、物理特性以及生物相容性,以制备满足软骨再生领域需求的水凝胶。
结果
氨基与醛基比为1∶1时,制备出的水凝胶具有良好的孔隙率、适宜的成胶时间、较强的黏附力及稳定的溶胀率等性质,对细胞有良好的生物相容性。
结论
氨基与醛基比为1∶1时制备出的CMCS/OSA复合水凝胶是软骨组织工程优异的支架材料。
Keywords: 羧甲基壳聚糖, 氧化海藻酸钠, 水凝胶, 脐带间充质干细胞, 软骨组织工程
Abstract
Objective
This study aimed to optimize the preparation of carboxymethyl chitosan/sodium alginate (CMCS/OSA) compound hydrogels. This study also aimed to investigate the applicability of the hydrogels in cartilage tissue engineering.
Methods
Three groups of CMCS/OSA composite hydrogels with amino-to-aldehyde ratios of 2∶1, 1∶1 and 1∶2 were prepared. The microstructure, physical properties, and cell biocompatibility of the three groups of CMCS/OSA composite hydrogels were evaluated. Samples were subjected to scanning electron microscopy, rheological test, adhesion tension test, swelling rate test, and cell experiments to identify the CMCS/OSA composite hydrogel with the cross-linking degree that can meet the requirements for scaffolds in cartilage tissue engineering.
Results
The experimental results showed that the CMCS/OSA hydrogel with a amine-to-aldhyde ratio of 1∶1 had good porosity, suitable gelling time, strong adhesive force, stable swelling rate, and good cellular biocompatibility.
Conclusion
The CMCS/OSA compound hydrogel prepared with a 1∶1 ratio of amino and aldehyde groups has potential applications in cartilage tissue engineering.
Keywords: carboxymethyl chitosan, sodium alginate, hydrogel, umbilical cord mesenchymalstem cell, cartilage tissue engineering
颞下颌骨关节炎(osteoarthritis,OA)是口腔颌面部常见病之一,以髁突表面关节软骨破坏与耗损为主要特征,其临床症状主要表现为关节疼痛、杂音及关节功能障碍等[1]–[2]。目前的临床治疗手法都存在各种不足,而组织工程技术是修复关节软骨损伤较为理想的方法[3]–[6]。
作为一种高度仿生的支架,水凝胶是近年来研究的热点[7]–[11],利用壳聚糖和海藻酸制备水凝胶具备安全、稳定、实用性高等优势[12]–[15],已经在药物缓释和神经组织再生等领域得到了广泛且深入的研究,但在软骨组织工程中的应用还鲜有报道。由于组织和细胞存在特异性,在软骨组织工程中应用此水凝胶需要考察其各项物理性能以及细胞相容性,以满足软骨组织再生应用的需求。本实验制备羧甲基壳聚糖/氧化海藻酸钠(carboxymethyl chitosan/sodium alginate,CMCS/OSA)不同交联度的水凝胶并进行性能评测,优化出可以应用于软骨再生领域的CMCS/OSA水凝胶制备方法。
1. 材料和方法
1.1. 主要试剂和设备
海藻酸钠、高碘酸钠、羧甲基壳聚糖(上海麦克林生化科技有限公司);戊二醛、叔丁醇、二甲苯、伊红染色试剂,苏木素染色试剂(北京索莱宝生物科技有限公司),Live/Dead试剂盒(Abcam公司,美国),磁力搅拌器(巩义市英峪予华仪器厂),精密电子天平(Sartorius公司,德国),真空冷冻干燥机(北京博医康实验仪器公司),力学测试仪(济南市华兴试验设备有限公司),体视显微镜(Leica公司,德国),Quanta 200扫描电子显微镜(scanning electron microscope,SEM)(FEI公司,美国),流变分析仪(Malvern Instruments公司,美国)。
1.2. 3种不同交联度的CMCS/OSA复合水凝胶的制备
首先配置质量分数为2%的海藻酸钠溶液,在避光条件下将过量高碘酸钠缓慢加入2%海藻酸钠溶液中不断搅拌,充分反应4 h后,加入过量乙二醇溶液中和未反应的高碘酸钠,最后用截留相对分子质量3 500的透析袋透析3 d,并收集透析袋内溶液经冷冻干燥处理后即可得到氧化海藻酸钠,室温保存备用。
将冻干的氧化海藻酸钠配制成5%溶液作为醛基相,将羧甲基壳聚糖配制成3%溶液作为氨基相,按照氨基与醛基比例分别为2∶1、1∶1、1∶2,分别向氧化海藻酸钠溶液中加入不同体积的3%羧甲基壳聚糖溶液,迅速搅拌均匀后待其成胶。
1.3. CMCS/OSA水凝胶的宏观及微观结构观察
1)肉眼观察3组不同交联度的CMCS/OSA水凝胶的形态和透明度。2)通过SEM观察3组水凝胶的微观孔隙结构。将成胶后的样品依次经过-20 °C和-80 °C梯度降温后置于冷冻干燥机中冻干3 d,彻底脱水后切成1 mm以内的薄片,使用双面导电胶将凝胶片贴于SEM装置台上,真空下喷金,观察凝胶微观形态。
1.4. CMCS/OSA水凝胶的流变学测试
使用旋转流变仪对3组不同交联度的CMCS/OSA水凝胶进行凝胶时间和自愈合特性的检测,前者采用振动模式,后者采用应变扫描模式。流变仪器设定转子直径为25 mm,板间距离500 µm,每组3个平行样。
1)凝胶时间:设定温度为37 °C(模拟生物体温度环境),选择以时间变化扫描模式,将应变参数规定为10%,转速为10 rad·s-1。
2)水凝胶的自愈合性能测定:温度设定为37 °C,选择应变模式,设定扫描值范围为1%~2 000%,记录应变反应的临界点(G″>G′),此临界点对应的就是凝胶状态转变为溶液状态的应变值。之后以此临界点为基准,采用时间扫描模式,交替变化应变值,设置应变扫描值范围为1%~300%,循环扫描3次,观察G″和G′的大小变化,最后根据数据分析凝胶是否有自愈合特性。G′为储能模量,G″为损耗模量,G″>G′表示凝胶成溶液状态,G′>G″为凝胶状态。
1.5. CMCS/OSA水凝胶与软骨组织的拉伸模量测试
选用新鲜的羊耳朵数只,剃毛去皮后切成尺寸为5 cm×1.5 cm的软骨长条,选取较为平整的部位将水凝胶预成胶溶液均匀涂抹于软骨组织表面,再将另一块软骨组织覆盖其上,构成三层夹心结构,放置在37 °C环境下固定10 min。最后使用万能试验机测试水凝胶对羊耳软骨组织的拉伸模量,设定位移速度为5 mm·min-1,采用公式计算水凝胶对组织的拉伸模量,以评价不同交联度水凝胶与软骨组织的黏附性能的差异,计算公式如下:拉伸模量(kPa)=最大黏附力(N)/黏附面积(cm2)。
1.6. CMCS/OSA水凝胶的溶胀率分析
将3组不同交联度的CMCS/OSA的水凝胶分别浸泡在装有10 mL去离子水的试管内,置于37 °C环境下使其吸水溶胀,并在特定时间点(1、6、12、24 h)取出各组水凝胶样本。用吸水纸吸走凝胶表面多余的液体,分别称重记为Wt;再将各组水凝胶样品冷冻干燥,分别称重记为Wo,通过公式计算各组样品的溶胀率,并分析交联度对水凝胶吸水溶胀率的影响。计算公式如下:溶胀率(t)=(Wt-Wo)/Wo×100%。
1.7. CMCS/OSA水凝胶的生物相容性评价
从胎儿脐带(来自天津医院妇产科,本研究经天津市天津医院伦理委员会批准,编号为2018医伦审025)中提取脐带间充质干细胞培养至第3代备用。首先向24孔板中每孔加入250 µL 3%羧甲基壳聚糖溶液,然后将人脐带间充质干细胞以每毫升1×107的密度加入5%氧化海藻酸钠溶液中,按照氨基与醛基比为1∶1向每孔加入适量的氧化海藻酸钠溶液。用无菌枪头迅速搅拌使三者均匀混合,置于37 °C恒温培养箱内等待数分钟,成胶后即为包载人脐带间充质干细胞的细胞-水凝胶复合体。此复合体用于检测氨基与醛基比为1∶1时水凝胶对人脐带间充质干细胞增殖和活性的影响,从而分析此交联度的CMCS/OSA水凝胶应用于软骨再生研究的可行性。
1.7.1. 水凝胶对细胞增殖的影响
首先在96孔板内制备氨基与醛基比为1∶1的水凝胶,待胶体稳定后,将人脐带间充质干细胞悬液的密度调节为每毫升3.5×104个,每孔取100 µL细胞悬液注入96孔板内的凝胶表面,用干细胞培养液培养此细胞-支架复合体,分别在1、3、5、7 d的时间点通过Cell counting Kit(CCK8)试剂盒对细胞数量进行分析,每个时间点取3个平行样。加入CCK8检测液后继续孵育3 h,然后用酶标仪(检测波长为450 nm)检测样品的OD值,分析细胞在水凝胶表面增殖情况。
1.7.2. 水凝胶对细胞活性状态的影响
将细胞-凝胶复合体培养在24孔板内,分别在1、7、21 d时吸出培养液,用无菌PBS液冲洗2~3次后加入Live/Dead检测液(根据试剂盒说明书将检测液稀释到标准浓度),继续孵育10 min后小心取出,在共聚焦显微镜下观察细胞活性状态,活细胞会被染为绿色,死细胞会被染为红色。
1.8. 统计学分析
使用SPSS 19.0进行数据分析,实验结果数据以均数±标准差的模式来表示。采用单因素方差分析比较组间差异,检验水准为双侧α=0.05。
2. 结果
2.1. 不同交联度的CMCS/OSA水凝胶结构分析
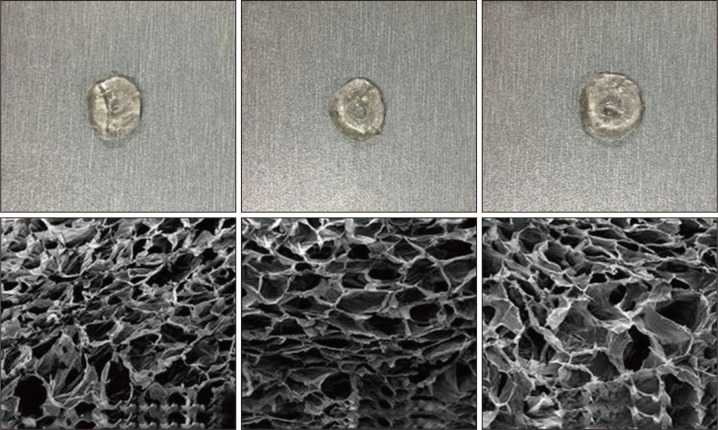
3组水凝胶肉眼观察无明显差异(图1上),均能维持一定形态,呈半透明状。SEM下观察水凝胶微观结构见图1下,3组样品都呈现密集和排列均匀的孔隙状结构,表明两种材料成胶稳定且交联较均匀;随着交联比例的变化,水凝胶孔隙大小随之发生改变。当氨基与醛基比为2∶1和1∶1时,水凝胶孔隙有所减小,大小较为均一,孔隙彼此之间较为连续和致密(图1左、中);当氨基与醛基比为1∶2时,水凝胶的孔隙较为松散和宽大,排列不够紧密和均一(图1右)。由此分析得出,当氨基与醛基比为2∶1和1∶1时,氨基可与醛基充分交联,交联作用强,结构稳定,因此微观结构中孔径较小,且均一、致密;而当氨基与醛基比小于1∶1的时候,羧甲基壳聚糖和氧化海藻酸钠之间的交联作用不强,所形成水凝胶的微观形态也较为松散和不均一。
图 1. 3种交联度CMCS/OSA水凝胶的结构.
Fig 1 Structure of three kinds of CMCS/OSA hydrogels with different crosslinking degrees
上:肉眼观;下:SEM × 400;从左至右分别为氨基与醛基比2∶1、1∶1、1∶2。
2.2. 水凝胶流变学分析
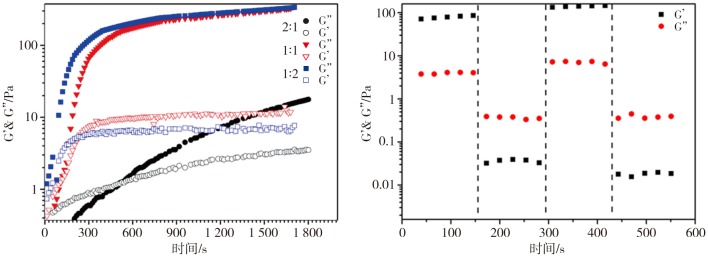
水凝胶成胶时间的流变分析如图2所示。样品初始状态时所测胶体都为溶液状态,3组不同交联度凝胶的G″(损耗模量)都小于G′(储能模量);当G″(损耗模量)大于G′(储能模量)时,样品由溶液状转变成凝胶状,转变的临界点即成胶时间点。从图2可见,氨基与醛基比为2∶1时,成胶时间8 min左右;而当氨基与醛基比为1∶1时,成胶时间约为2 min,该成胶时间满足手术时将溶胶注入软骨损伤部位快速成胶的需求,具有良好的临床实用性;氨基与醛基比为1∶2时,数秒内溶胶就转变成凝胶状态,该成胶时间过快,临床应用时给予手术操作的时间过短,缺乏良好的实用价值。
图 2. 3种不同交联度CMCS/OSA水凝胶流变学分析.
Fig 2 Rheological analysis of three CMCS/OSA hydrogels with different degrees of crosslinking
左:3种交联度CMCS/OSA水凝胶成胶时间的比较,2∶1、1∶1、1∶2分别代表氨基与醛基的比例;右:氨基与醛基比为1∶1时,CMCS/OSA水凝胶的自愈合状态。
水凝胶的自愈能力见图2右。用氨基与醛基比为1∶1的样品测试凝胶自愈合能力。在低应变(1.0%)情况下,CMCS/OSA水凝胶的储能模量(G′)高于损耗模量(G″),表明CMCS/OSA混合物呈现凝胶状态。在高应变(500%)情况下,CMCS/OSA水凝胶的储能模量(G′)低于损耗模量(G″),表明了CMCS/OSA水凝胶的三维网络结构被破坏,造成网络塌陷,实现胶液转变。在低应变(1.0%)的情况下,CMCS/OSA混合物再次实现溶胶转变,形成三维网络结构,水凝胶的储能模量(G′)高于损耗模量(G″)。上述结果表明,CMCS/OSA水凝胶具有优越的自愈合性能。
2.3. CMCS/OSA水凝胶与软骨组织的拉伸模量测试
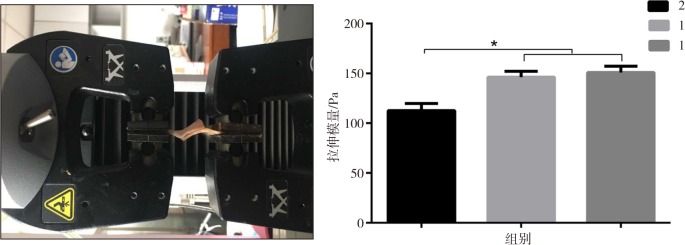
通过力学测试仪测量CMCS/OSA水凝胶与软骨组织之间的拉伸模量,结果见图3。当氨基与醛基比为1∶2和1∶1时,两者拉伸模量相当,无明显差异;而当氨基与醛基比为2∶1时,其拉伸模量值明显降低。这一结果与水凝胶微观结构分析结果相吻合,当羧甲基壳聚糖内的氨基与氧化海藻酸钠中的醛基充分交联时,形成的水凝胶黏度和弹性较大,与软骨组织具有更强的黏附性,能够非常密合地填充软骨缺损部位,有利于软骨再生修复;同时水凝胶本身的自愈合特性也是黏附性能的体现,两者检测结果相吻合。
图 3. 3种不同交联度的CMCS/OSA水凝胶对软骨黏附性能的比较.
Fig 3 Comparison of the adhesion properties of three different cross-linking degrees CMCS/OSA hydrogels on cartilage
左:水凝胶拉伸实验;右:3种凝胶的拉伸模量。*P<0.05。
2.4. CMCS/OSA水凝胶的溶胀率分析
3组CMCS/OSA水凝胶的溶胀率随时间的变化趋势见图4。当氨基与醛基比为2∶1时溶胀率随时间变化较为明显,尤其前6 h的变化最为显著,6 h后趋于平稳;当氨基与醛基比为1∶1和1∶2时,24 h内整体溶胀率变化较小。溶胀率变化较小的样品能够保持稳定的凝胶状态,因此从溶胀率方面分析,氨基与醛基比为1∶1和1∶2较为合适。
图 4. 3种不同交联度CMCS/OSA水凝胶在各时间点的溶胀率.
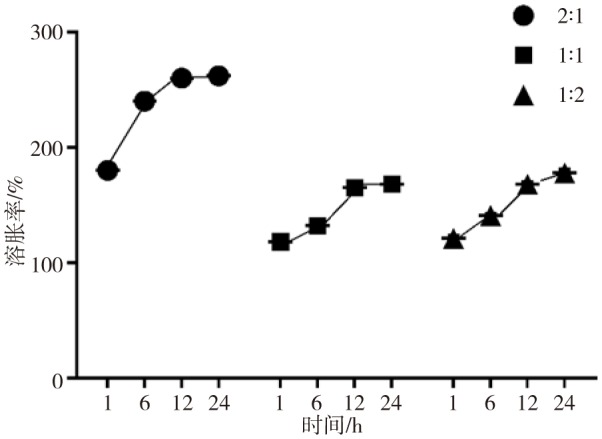
Fig 4 Swelling rates of three kinds of CMCS/OSA hydrogels with different degrees of crosslinking at each time point
2.5. CMCS/OSA水凝胶生物相容性评价
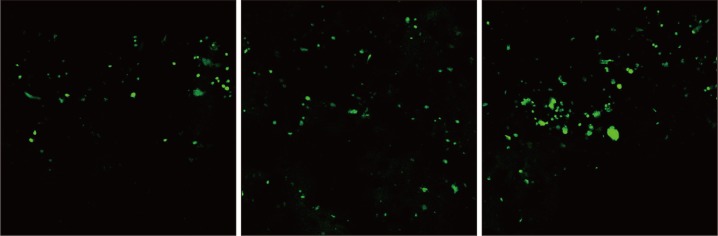
脐带间充质干细胞在凝胶表面的增殖情况见图5:凝胶组在1、3、5、7 d的OD值呈明显的递增关系,与对照组具有相同的增长趋势,且差异有统计学意义(P<0.05),说明细胞在凝胶表面具有良好的生长和增殖能力。1、7、21 d水凝胶中的细胞存活情况见图6:未见明显的红色荧光染色,随着培养时间延长绿色荧光面积逐渐增大,提示细胞数量随着时间延长而增多,说明细胞在支架中有良好的正常的活力。荧光染色结果与CCK8结果一致,均证明该水凝胶对脐带间充质干细胞有良好的生物相容性。
图 5. CCK-8法评价水凝胶对人脐带间充质干细胞增殖的影响.
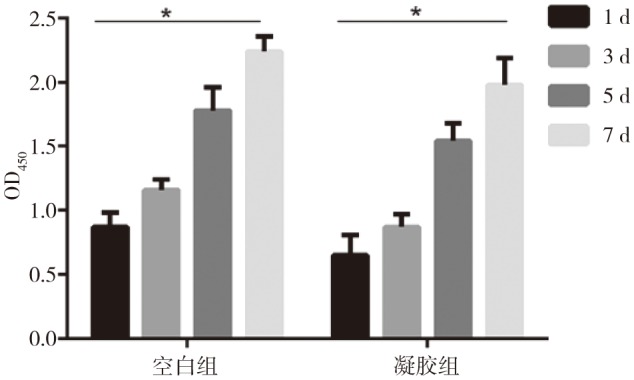
Fig 5 CCK-8 method to evaluate the effect of hydrogel on the proliferation of human umbilical cord mesenchymal stem cells
*P<0.05。
图 6. 细胞-凝胶复合体的Live/Dead细胞染色结果 共聚焦显微镜 × 100.
Fig 6 Live/Dead cell staining of the cell-gel complex confocal microscopy × 100
从左至右分别为培养第1、7、21天。
3. 讨论
使用软骨组织工程修复软骨缺损会面临一系列难题:如软骨创面不规整,支架材料与周围组织密合性差;创面处于负重区,支架材料易断裂;支架材料降解速率与软骨新生速率不匹配等。软骨组织工程中理想的支架材料需要与正常软骨组织具有一定的黏附性,从而密合填充缺损部位;同时具备一定的抗压性能,为种子细胞提供三维生长空间;此外,材料降解速率应与软骨再生速率相匹配。制备一种可注射自愈合水凝胶为软骨再生修复提供了新思路[8],[10],[16]–[19]。
壳聚糖提取于甲壳纲类动物的甲壳素,具有来源丰富、成本低、生物相容性好等优点,并且其分子链上存在大量活性基团(羟基、氨基),易于化学修饰[20]–[24]。海藻酸钠是提取于褐色海藻的多糖类天然材料,具有良好的生物相容性和亲水性,尤其是降解速率较慢,能够较长时间地填充缺损部位并支持周围组织,适合用于软骨组织工程[25]–[27]。壳聚糖分子中的氨基与海藻酸钠分子中的醛基能发生席夫碱反应,短时间内自交联形成水凝胶,这一体系安全、稳定,具有可注射性[28]。鉴于此水凝胶的优势性能,本实验通过调节两种成分交联度优选出适用于软骨组织工程的 CMCS/OSA水凝胶制备工艺。
鉴于髁突软骨部位的特殊性,支架材料需要承受一定的压力和摩擦力。本实验通过流变学检测发现,CMCS/OSA水凝胶具有黏附和自愈合特性,壳聚糖中的氨基和海藻酸钠中的醛基可以发生动态结合,负载压力后的凝胶尽管会受损裂开,但当压力减小后断裂的材料又彼此黏附在一起,维持支架材料的完整和稳定性,非常适用于负重区组织再生修复应用。同时此黏附性也使水凝胶材料与软骨组织紧密结合,有利于密合填充不规则缺损区,既有利于缺损区完整的软骨再生,也有利于充分支撑周围健康软骨组织,避免二次损伤。
临床操作中水凝胶成胶时间也颇为关键,成胶时间以数分钟最为适宜,过长会提高感染坏死概率,过短不利于手术操作。本实验对比3种交联度CMCS/OSA水凝胶成胶时间,结果发现,氨基与醛基比为2∶1和1∶1时,成胶时间都为数分钟,而当氨基与醛基比为1∶2时,成胶时间过短,不适合临床应用。
水凝胶的溶胀性能可以增强周围体液与材料内细胞的物质交换代谢活动。当凝胶的溶胀系数过大时,周围的体液可以轻易进入凝胶内部,会大大降低凝胶的力学强度,使得凝胶结构变形、膨胀,对组织再生极为不利,尤其是髁突软骨处于负重区,应避免溶胀系数过大的材料;而溶胀系数过小时,由于体积大小和空间结构的变化受限,材料缺乏适度的收缩和膨胀,细胞得不到适当的力学刺激,无法顺利与周围组织液进行物质交换,不利于细胞存活和功能表达[28]。从吸水溶胀性角度分析,当氨基与醛基比为1∶1和1∶2时,凝胶溶胀率大小适宜并且随时间变化较小,适合应用于髁突软骨修复。对以上各方面进行综合分析,氨基与醛基比为1∶1制备的水凝胶可以作为支架材料用于软骨组织工程。
在筛选出合适交联比例的CMCS/OSA水凝胶后,本实验继续探究了人脐带间充质干细胞对该凝胶的生物相容性情况。人脐带间充质干细胞是组织工程中非常具有代表性的,具有多向分化潜能的优良种子细胞[29]–[31],水凝胶良好的生物相容性是种子细胞功能表达进而修复组织缺损的前提条件。本实验中,细胞在材料中的活性染色和CCK8增殖检测都证明了此水凝胶体系对细胞生长繁殖未产生明显不良影响,为细胞进一步分化并分泌软骨基质提供了良好的环境基础。
综上所述,本研究依据软骨组织工程对支架材料的性能需求,对不同交联度的CMCS/OSA水凝胶体系进行了筛选,最终确定氨基与醛基比为1∶1时构建的水凝胶具有良好的结构特征、物理性能以及生物相容性,是软骨组织工程优异的支架材料。
Funding Statement
[基金项目] 国家自然科学基金(31300798,31470937,81572154);天津市卫生局科技攻关重点项目(15KG125,16KG114)
Supported by: The National Science Foundation of China (31300798, 31470937, 81572154); The Research Foundation of Tianjin Health Bureau (15KG125, 16KG114).
References
- 1.Abrahamsson AK, Kristensen M, Arvidsson LZ, et al. Frequency of temporomandibular joint osteoarthritis and related symptoms in a hand osteoarthritis cohort[J] Osteoarthr Cartil. 2017;25(5):654–657. doi: 10.1016/j.joca.2016.12.028. [DOI] [PubMed] [Google Scholar]
- 2.Nitzan DW, Svidovsky J, Zini A, et al. Effect of arthrocentesis on symptomatic osteoarthritis of the temporomandibular joint and analysis of the effect of preoperative clinical and radiologic features[J] J Oral Maxillofac Surg. 2017;75(2):260–267. doi: 10.1016/j.joms.2016.08.017. [DOI] [PubMed] [Google Scholar]
- 3.Zhou YG, Chyu J, Zumwalt M. Recent progress of fabrication of cell scaffold by electrospinning technique for articular cartilage tissue engineering[J] Int J Biomater. 2018:1953636. doi: 10.1155/2018/1953636. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Xie XP, Zhang Q, Zhou TF, et al. The review of nanomaterials inducing the differentiation of stem cells into chondrocyte phenotypes in cartilage tissue engineering[J] Curr Stem Cell Res Ther. 2018;13(7):600–607. doi: 10.2174/1574888X13666180511164509. [DOI] [PubMed] [Google Scholar]
- 5.Gurer B, Cabuk S, Karakus O, et al. In vivo cartilage tissue engineering[J] J Orthop Surg Res. 2018;13(1):107. doi: 10.1186/s13018-018-0823-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Jiang XF, Liu JT, Liu Q, et al. Correction: therapy for cartilage defects: functional ectopic cartilage constructed by cartilage-simulating collagen, chondroitin sulfate and hyaluronic acid (CCH) hybrid hydrogel with allogeneic chondrocytes[J] Biomater Sci. 2018;6(6):1616–1626. doi: 10.1039/c8bm00354h. [DOI] [PubMed] [Google Scholar]
- 7.Qi C, Liu J, Jin Y, et al. Photo-crosslinkable, injectable sericin hydrogel as 3D biomimetic extracellular matrix for minimally invasive repairing cartilage[J] Biomaterials. 2018;163:89–104. doi: 10.1016/j.biomaterials.2018.02.016. [DOI] [PubMed] [Google Scholar]
- 8.Radhakrishnan J, Subramanian A, Sethuraman S. Injectable glycosaminoglycan-protein nano-complex in semi-interpenetrating networks: a biphasic hydrogel for hyaline cartilage regeneration[J] Carbohydr Polym. 2017;175:63–74. doi: 10.1016/j.carbpol.2017.07.063. [DOI] [PubMed] [Google Scholar]
- 9.Zhou TF, Li XL, Li G, et al. Injectable and thermosensitive TGF-β1-loaded PCEC hydrogel system for in vivo cartilage repair[J] Sci Rep. 2017;7(1):10553. doi: 10.1038/s41598-017-11322-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Chen WL, Li CH, Peng M, et al. Autologous nasal chondrocytes delivered by injectable hydrogel for in vivo articular cartilage regeneration[J] Cell Tissue Bank. 2018;19(1):35–46. doi: 10.1007/s10561-017-9649-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Chen F, Ni YZ, Liu B, et al. Self-crosslinking and injectable hyaluronic acid/RGD-functionalized pectin hydrogel for cartilage tissue engineering[J] Carbohydr Polym. 2017;166:31–44. doi: 10.1016/j.carbpol.2017.02.059. [DOI] [PubMed] [Google Scholar]
- 12.Treenate P, Monvisade P. In vitro drug release profiles of pH-sensitive hydroxyethylacryl chitosan/sodium alginate hydrogels using paracetamol as a soluble model drug[J] Int J Biol Macromol. 2017;99:71–78. doi: 10.1016/j.ijbiomac.2017.02.061. [DOI] [PubMed] [Google Scholar]
- 13.Wang YY, Peng WZ, Liu X, et al. Study of bilineage differentiation of human-bone-marrow-derived mesenchymal stem cells in oxidized sodium alginate/N-succinyl chitosan hydrogels and synergistic effects of RGD modification and low-intensity pulsed ultrasound[J] Acta Biomater. 2014;10(6):2518–2528. doi: 10.1016/j.actbio.2013.12.052. [DOI] [PubMed] [Google Scholar]
- 14.Rassu G, Salis A, Porcu EP, et al. Composite chitosan/alginate hydrogel for controlled release of deferoxamine: a system to potentially treat iron dysregulation diseases[J] Carbohydr Polym. 2016;136:1338–1347. doi: 10.1016/j.carbpol.2015.10.048. [DOI] [PubMed] [Google Scholar]
- 15.Bu Y, Xu HX, Li X, et al. A conductive sodium alginate and carboxymethyl[J] RSC Adv. 2018;8:10806–10817. doi: 10.1039/c8ra01059e. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Li Y, Cao J, Han S, et al. ECM based injectable thermosensitive hydrogel on the recovery of injured cartilage induced by osteoarthritis[J] Artif Cells Nanomed Biotechnol. 2018;46(Suppl 2):152–160. doi: 10.1080/21691401.2018.1452752. [DOI] [PubMed] [Google Scholar]
- 17.Naghizadeh Z, Karkhaneh A, Khojasteh A. Simultaneous release of melatonin and methylprednisolone from an injectable in situ self-crosslinked hydrogel/microparticle system for cartilage tissue engineering[J] J Biomed Mater Res A. 2018;106(7):1932–1940. doi: 10.1002/jbm.a.36401. [DOI] [PubMed] [Google Scholar]
- 18.Boyer C, Figueiredo L, Pace R, et al. Laponite nanoparticle-associated silated hydroxypropylmethyl cellulose as an injectable reinforced interpenetrating network hydrogel for cartilage tissue engineering[J] Acta Biomater. 2018;65:112–122. doi: 10.1016/j.actbio.2017.11.027. [DOI] [PubMed] [Google Scholar]
- 19.Chen F, Yu SR, Liu B, et al. An injectable enzymatically crosslinked carboxymethylated Pullulan/Chondroitin sulfate hydrogel for cartilage tissue engineering[J] Sci Rep. 2016;6:20014. doi: 10.1038/srep20014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Comblain F, Rocasalbas G, Gauthier S, et al. Chitosan: a promising polymer for cartilage repair and viscosupplementation[J] Biomed Mater Eng. 2017;28(s1):209–215. doi: 10.3233/BME-171643. [DOI] [PubMed] [Google Scholar]
- 21.Muzzarelli RA, El Mehtedi M, Bottegoni C, et al. Genipin-crosslinked chitosan gels and scaffolds for tissue engineering and regeneration of cartilage and bone[J] Mar Drugs. 2015;13(12):7314–7338. doi: 10.3390/md13127068. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Meng QY, Man ZT, Dai LH, et al. A composite scaffold of MSC affinity peptide-modified demineralized bone matrix particles and chitosan hydrogel for cartilage regeneration[J] Sci Rep. 2015;5:17802. doi: 10.1038/srep17802. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Zhao M, Chen Z, Liu K, et al. Repair of articular cartilage defects in rabbits through tissue-engineered cartilage constructed with chitosan hydrogel and chondrocytes[J] J Zhejiang Univ Sci B. 2015;16(11):914–923. doi: 10.1631/jzus.B1500036. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.García-López J, Garciadiego-Cázares D, Melgarejo-Ramírez Y, et al. Chondrocyte differentiation for auricular cartilage reconstruction using a chitosan based hydrogel[J] Histol Histopathol. 2015;30(12):1477–1485. doi: 10.14670/HH-11-642. [DOI] [PubMed] [Google Scholar]
- 25.莫 湘涛, 邓 力, 李 秀群, et al. 软骨细胞-海藻酸钠水凝胶-SIS复合体修复全层关节软骨缺损的实验研究[J] 中国修复重建外科杂志. 2009;23(8):974–979. [PubMed] [Google Scholar]; Mo XT, Deng L, Li XQ, et al. Experimental study of repairing full-thickness articular cartilage defect with chondrocyte-sodium alginate hydrogel-SIS complex[J] Chin J Reparat Reconstruct Surg. 2009;23(8):974–979. [PubMed] [Google Scholar]
- 26.Miralles G, Baudoin R, Dumas D, et al. Sodium alginate sponges with or without sodium hyaluronate: in vitro engineering of cartilage[J] J Biomed Mater Res. 2001;57(2):268–278. doi: 10.1002/1097-4636(200111)57:2<268::aid-jbm1167>3.0.co;2-l. [DOI] [PubMed] [Google Scholar]
- 27.Pelletier S, Hubert P, Payan E, et al. Amphiphilic derivatives of sodium alginate and hyaluronate for cartilage repair: rheological properties[J] J Biomed Mater Res. 2001;54(1):102–108. doi: 10.1002/1097-4636(200101)54:1<102::aid-jbm12>3.0.co;2-1. [DOI] [PubMed] [Google Scholar]
- 28.Yu W, Liu Y, Sheng N, et al. A soft tissue adhesive based on aldehyde-sodium alginate[J] Front Mater Sci. 2017;11(3):215–222. [Google Scholar]
- 29.Wu Y, Yuan L, Sheng NA, et al. A soft tissue adhesive based on aldehyde-sodium alginate and amino-carboxymethyl chitosan preparation through the Schiff reaction[J] Front Mater Sci. 2017;11(3):215–222. [Google Scholar]
- 30.Sadlik B, Jaroslawski G, Puszkarz M, et al. Cartilage repair in the knee using umbilical cord wharton's jelly-derived mesenchymal stem cells embedded onto collagen scaffolding and implanted under dry arthroscopy[J] Arthrosc Tech. 2018;7(1):e57–e63. doi: 10.1016/j.eats.2017.08.055. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Desancé M, Contentin R, Bertoni L, et al. Chondrogenic differentiation of defined equine mesenchymal stem cells derived from umbilical cord blood for use in cartilage repair therapy[J] Int J Mol Sci. 2018;19(2):pii: E537. doi: 10.3390/ijms19020537. [DOI] [PMC free article] [PubMed] [Google Scholar]