Abstract
目的
探究IPS e.max Press玻璃基铸造陶瓷和WIELAND氧化锆陶瓷邻面板固位粘接桥修复下颌第二前磨牙缺失的抗折性能及模拟短期使用后的修复效果。
方法
选取成人离体下颌第一前磨牙和第一磨牙各32颗,体外建立下颌第二前磨牙缺失模型。随机分为4组(n=8),E0组:IPS e.max Press铸瓷粘接桥;E1组:IPS e.max Press铸瓷粘接桥+30万次机械循环加载;W0组:WIELAND氧化锆全瓷粘接桥;W1组:WIELAND氧化锆全瓷粘接桥+30万次机械循环加载。万能测试机测试各实验组的破坏载荷力值。
结果
机械循环加载后试件均无松动或脱落,无明显裂纹。万能测试机测试结果:E0、E1、W0、W1组破坏载荷分别为(1 242.85±260.11)、(1 062.60±179.98)、(1 650.85±206.77)、(1 167.61±265.50) N,均大于下颌第二前磨牙所受最大 力(360 N),差异有统计学意义(P<0.001)。E0组破坏载荷小于W0组(P<0.05)。循环加载后,E1组和W1组间差异无统计学意义(P>0.05)。循环加载后,铸瓷组(E1、E0)破坏载荷变化不显著(P>0.05),氧化锆组(W0、W1)明显降低(P<0.05)。
力(360 N),差异有统计学意义(P<0.001)。E0组破坏载荷小于W0组(P<0.05)。循环加载后,E1组和W1组间差异无统计学意义(P>0.05)。循环加载后,铸瓷组(E1、E0)破坏载荷变化不显著(P>0.05),氧化锆组(W0、W1)明显降低(P<0.05)。
结论
IPS e.max Press铸瓷和WIELAND氧化锆全瓷邻面板固位粘接桥修复下颌第二前磨牙缺失均能够获得良好的抗折性能,短期修复效果满意。
Keywords: 全瓷, 邻面板, 粘接桥, 破坏载荷
Abstract
Objective
This study aims to investigate the fracture resistance and short-term restorative effects of resin-bonded fixed partial dentures (RBFPDs) made from heat-pressed lithium-disilicate-based glass-ceramic (IPS e.max press) and zirconia ceramic (WIELAND) and retained by all-ceramic guiding plates when used to restore missing mandibular second premolars.
Methods
A total of 64 human mandibular first premolars and first molars were prepared as abutments, then were randomly divided into 4 groups (n=8): E0, heat-pressed ceramic RBFPDs, no cyclic loading; E1, heat-pressed ceramic RBFPDs exposed to 300 000 cycles of dynamic loading; W0, zirconia ceramic RBFPDs, no cyclic loading; and W1, zirconia ceramic RBFPDs exposed to 300 000 cycles of dynamic loading. Fracture strength was tested in a universal testing machine.
Results
The medians of fracture strength were 1 242.85 N±260.11 N (E0), 1 650.85 N±206.77 N (W0), 1 062.60 N±179.98 N (E1), and 1 167.61 N±265.50 N (W1). Statistical analysis showed that all the groups exhibited significantly higher fracture strength compared with the maximum bite force in the premolar region (360 N; P<0.001). The W0 group had significantly higher fracture strength than the E0 group (P<0.05). Meanwhile, no significant difference in fracture strength was observed between the E1 and W1 groups (P>0.05). Significant statistical differences were found between the zirconia ceramic groups (W0 and W1, P<0.05) but not between the glassceramic groups (E0 and E1, P>0.05) after dynamic loading.
Conclusion
The RBFPDs retained by all-ceramic guiding plates exhibited promising fracture properties and optimal short-term restorative effects when used to restore missing mandibular second premolars.
Keywords: all-ceramic, guiding plate, resin-bonded fixed partial dentures, fracture load
近年来,随着粘接材料和粘接技术的发展,粘接桥修复设计不断完善,其成功率也得到了很大的提高,同时,全瓷粘接桥的出现,使该类修复技术在美观和生物相容性方面有了极大的改善[1]。前磨牙在全口牙列中位置特殊,针对该区域的牙列缺损的粘接桥修复,兼具较高力学和美学要求。能否将全瓷粘接桥应用于个别前磨牙缺失的修复并取得良好的修复效果;如何设计固位体才能尽可能在减小损伤的情况下获得良好的抗力和固位效果,这对于临床工作是十分重要的问题。针对以上问题,本研究体外设计了新型邻面板固位的全瓷粘接桥,修复下颌第二前磨牙缺失,探究能否获得良好的抗力及固位效果。
1. 材料和方法
1.1. 材料和设备
成人离体下颌第一前磨牙、下颌第一磨牙;玻璃基铸造陶瓷(IPS e.max Press)、5%氢氟酸(义获嘉伟瓦登特公司,列支敦士登),氧化锆陶瓷(ZENO®Zr,WIELAND公司,德国),聚醚橡胶印模材料(Impregum,3MESPE公司,美国),37%磷酸酸蚀剂(格鲁玛酸蚀剂,贺利氏古莎公司,德国),硅烷偶联剂(Clearfil瓷处理剂)、帕娜碧亚F2.0树脂粘接套装(可乐丽公司,日本),自制电动循环加载机、万能力学测试机(INSTRON5565,Instron公司,美国),光学显微镜(MODEL EPIPHOT 200,尼康公司,日本)。
1.2. 实验方法和步骤
1.2.1. 离体牙收集
纳入标准:牙体完整,无龋坏及牙体组织缺损;牙体形态、大小、质地无异常,无发育畸形;放大镜下检查,釉质完整,无裂纹。
按上述纳入标准收集近3个月内拔除的成人下颌第一前磨牙和第一磨牙各32颗。刮除牙面及根面残留肉芽组织及牙结石,储存于浓度0.1%的麝香草酚溶液中,备用。
1.2.2. 样本分组
将收集到的下颌第一前磨牙和第一磨牙按牙体形态、大小及其相互间的位置关系进行两两配对。按修复体制作材料及处理方式不同,随机分为铸瓷组(E0、E1)、氧化锆组(W0、W1),每组8对。E0组:IPS e.max Press铸瓷粘接桥;E1组:IPS e.max Press铸瓷粘接桥+30万次机械循环加载;W0组:WIELAND氧化锆粘接桥;W1组:WIELAND氧化锆粘接桥+30万次机械循环加载。
1.2.3. 基牙包埋
将离体基牙根尖至釉牙骨质界下1 mm的牙根用医用胶布均匀包裹,厚度为0.2~0.3 mm,以模拟牙周膜的厚度。以正常下颌第二前磨牙的近远中径(7.0~7.5 mm)为标准,参考口内牙弓形态,用自凝树脂包埋基牙牙根。
1.2.4. 牙体预备和制取印模
基牙近缺隙侧 面预备类似支托凹外形,深为1 mm,避开
面预备类似支托凹外形,深为1 mm,避开 面牙尖。邻面颈缘线位于釉牙骨质界上1 mm处,消除邻面倒凹,边缘终止线为直角圆肩台。铸瓷组(E0、E1)肩台宽度为0.8 mm,氧化锆组(W0、W1)肩台宽度为0.5 mm。颊舌向扩展至自洁区,并保持基牙邻面原有弧度(图1)。牙体预备完成后,将基牙清洗吹干,采用下颌不锈钢印模托盘、聚醚橡胶印模材料取模,灌注超硬石膏工作模型。
面牙尖。邻面颈缘线位于釉牙骨质界上1 mm处,消除邻面倒凹,边缘终止线为直角圆肩台。铸瓷组(E0、E1)肩台宽度为0.8 mm,氧化锆组(W0、W1)肩台宽度为0.5 mm。颊舌向扩展至自洁区,并保持基牙邻面原有弧度(图1)。牙体预备完成后,将基牙清洗吹干,采用下颌不锈钢印模托盘、聚醚橡胶印模材料取模,灌注超硬石膏工作模型。
图 1. 基牙牙体预备.
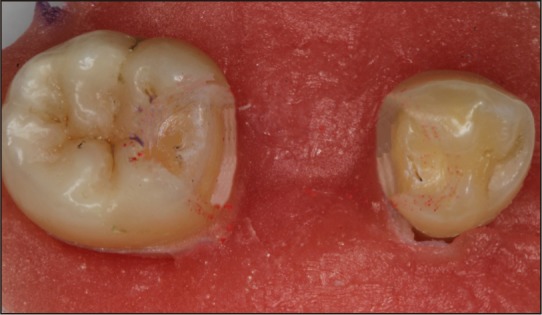
Fig 1 Preparation of the abutment teeth
1.2.5. 修复体制作
修复体形态设计要求 修复体应确保足够的连接体面积[2],第一前磨牙处连接体 龈向高度≥3 mm,连接体面积≥9 mm2;第一磨牙处连接体
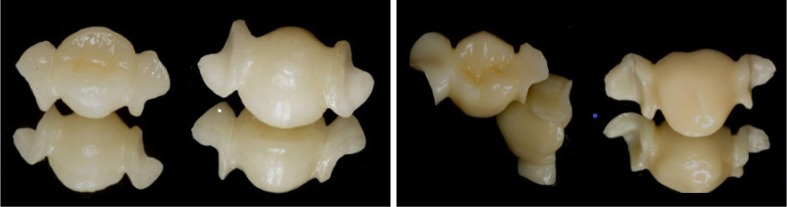
龈向高度≥3 mm,连接体面积≥9 mm2;第一磨牙处连接体 龈向高度≥4 mm,连接体面积≥16 mm2。铸瓷组(E0、E1)采用IPS e.max Press瓷块为原材料,失蜡法制作修复体,修复体铸造成形,非粘接面上釉完成制作(图2左)。氧化锆组(W0、W1)采用成品氧化锆瓷块(ZENO®Zr)为原材料,计算机辅助设计与制作(computer aided design/computer aided manufacturing,CAD/CAM)设备(ZENOTEC easy CAD/CAM,WIELAND公司,德国)扫描工作模型,进行修复体的设计、切削、烧结、上釉,完成制作(图2右)。
龈向高度≥4 mm,连接体面积≥16 mm2。铸瓷组(E0、E1)采用IPS e.max Press瓷块为原材料,失蜡法制作修复体,修复体铸造成形,非粘接面上釉完成制作(图2左)。氧化锆组(W0、W1)采用成品氧化锆瓷块(ZENO®Zr)为原材料,计算机辅助设计与制作(computer aided design/computer aided manufacturing,CAD/CAM)设备(ZENOTEC easy CAD/CAM,WIELAND公司,德国)扫描工作模型,进行修复体的设计、切削、烧结、上釉,完成制作(图2右)。
图 2. 粘接桥修复体.
Fig 2 Production of resin-bonded fixed partial dentures
左:铸瓷粘接桥;右:氧化锆粘接桥。
1.2.6. 粘接
铸瓷组(E0、E1)粘接面使用5%氢氟酸酸蚀20 s,冲洗、吹干;涂布硅烷偶联剂15 s,吹干。氧化锆组(W0、W1)采用50 µm氧化铝进行粘接面喷砂,喷头垂直于粘接面,距离10 mm,压强0.25 MPa,时间10 s。将喷砂处理后的修复体在95%乙醇中超声清洗2 min,吹干待粘接。然后对基牙待粘接面进行清洁、冲洗、吹干。37%磷酸酸蚀剂酸蚀基牙粘接面30 s,冲洗、吹干。按照说明书步骤使用双固化自粘接树脂水门汀(帕娜碧亚F2.0)将修复体粘接于基牙上,去除多余粘接剂,光照固化。将试件浸泡于37 °C蒸馏水中24 h,待粘接剂完全固化(图3)。
图 3. 粘接后的修复体.
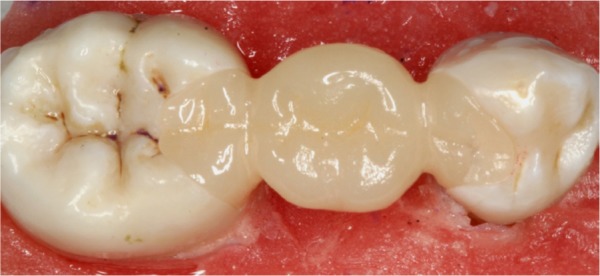
Fig 3 The dentures after cementation
1.2.7. 机械循环加载
将E1、W1组试件放置于自制电动循环加载机上进行循环加载,加载力值为50 N,树脂加载头尖端直径为3 mm,垂直于粘接桥桥体 面中心加载,加载频率2 Hz,加载次数30万次。机械加载过程中保持基牙湿润(图4)。
面中心加载,加载频率2 Hz,加载次数30万次。机械加载过程中保持基牙湿润(图4)。
图 4. 机械循环加载示意图.
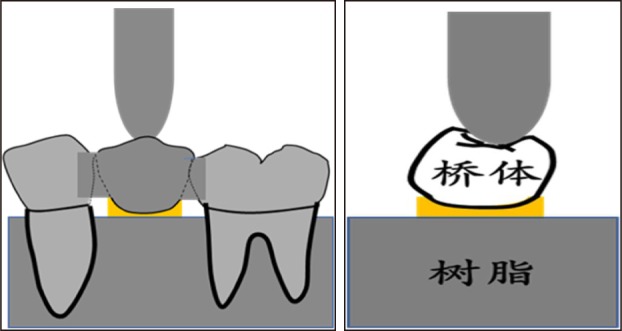
Fig 4 Schematic diagram of dynamic loading
左:颊面观;右:邻面观。
1.2.8. 破坏载荷测试
E1、W1组试件机械循环加载完成后,将所有样本放置在显微镜下(×10)观察有无微小裂纹,若有则归为失败。将E1、W1组所有成功试件和E0、W0组所有试件在万能力学测试机上进行破坏载荷测试。试件平放于底座,尖端直径为3 mm的不锈钢加载头垂直放置于桥体 面,与颊舌斜面成三点接触,加载头与加载面之间放置0.5 mm厚的锡箔纸,加载速度为1 mm·min-1,直至修复体发生裂纹或折裂,记录此时破坏载荷的力值。记录并观察试件破坏类型。
面,与颊舌斜面成三点接触,加载头与加载面之间放置0.5 mm厚的锡箔纸,加载速度为1 mm·min-1,直至修复体发生裂纹或折裂,记录此时破坏载荷的力值。记录并观察试件破坏类型。
1.3. 统计分析
采用SPSS 19.0软件对实验数据进行分析,采用单样本资料的t检验分析各组实验数据与下颌第二前磨牙所受最大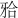 力(360 N)间的关系,采用单因素方差分析(one-way ANOVA)方法对各组实验数据进行两两比较。
力(360 N)间的关系,采用单因素方差分析(one-way ANOVA)方法对各组实验数据进行两两比较。
2. 结果
2.1. 机械循环加载后的效果观察
E1、W1组试件经30万次循环加载后,修复体均未发生松动或脱落,金相显微镜下(×10)观察未发现明显裂纹。
2.2. 破坏载荷的统计分析
E0、E1、W0、W1组破坏载荷分别为(1 242.85±260.11)、(1 062.60±179.98)、(1 650.85±206.77)、(1 167.61±265.50) N。各实验组破坏载荷均显著高于下颌第二前磨牙所受最大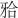 力(360 N),差异有统计学意义(P<0.001)。W0组即刻破坏载荷高于E0组,差异有统计学意义(P<0.05)。机械循环加载后,W1组破坏载荷与E1组间差异无统计学意义(P>0.05)。循环加载后,铸瓷组(E1、E0)破坏载荷变化不显著(P>0.05),氧化锆组(W0、W1)明显降低(P<0.05)。
力(360 N),差异有统计学意义(P<0.001)。W0组即刻破坏载荷高于E0组,差异有统计学意义(P<0.05)。机械循环加载后,W1组破坏载荷与E1组间差异无统计学意义(P>0.05)。循环加载后,铸瓷组(E1、E0)破坏载荷变化不显著(P>0.05),氧化锆组(W0、W1)明显降低(P<0.05)。
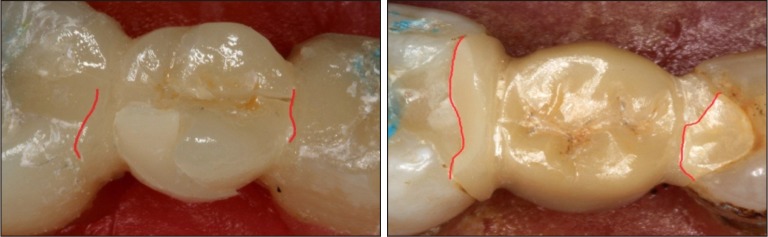
2.3. 试件破坏类型
铸瓷组(E0、E1)试件(16例)破坏全部表现为修复体的崩裂,修复体与基牙之间无脱粘接(图5左)。氧化锆组(W0、W1)试件破坏多伴有固位体部分脱粘接(10例)(图5右)。其中W1组有1例试件在破坏载荷下出现基牙折断。
图 5. 试件破坏类型.
Fig 5 Failure type of dentures
左:铸瓷组;右:氧化锆组。红线示修复体折裂的裂纹。
3. 讨论
固定义齿固位体的设计应兼顾微创、固位、抗力、支持等多方面的考虑,报道显示,对于后牙全瓷固定桥而言,除了采用传统的全冠固位体外,多以嵌体式固位体设计为主[3]。本实验采用一种新型邻面板固位体设计,从机械固位方面考虑,基牙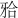 面预备类似于支托凹外形,与邻面龈缘肩台共同作用,可防止修复体边缘下沉。固位体水平向边缘扩展至基牙颊舌侧自洁区,对基牙形成弧形包绕,连同两侧边缘终止线共同抵抗修复体所受颊舌向的侧向力。在粘接力获得方面,该类固位体设计相对于嵌体式固定桥而言[4]–[5],减小了牙体预备的深度,尽可能多地保留了基牙粘接面的釉质组织,能够有效增强修复体的粘接固位效果。该类固位形设计的边缘线位于龈上及自洁区,可有效防止固位体边缘菌斑聚集,减低了继发龋的风险。
面预备类似于支托凹外形,与邻面龈缘肩台共同作用,可防止修复体边缘下沉。固位体水平向边缘扩展至基牙颊舌侧自洁区,对基牙形成弧形包绕,连同两侧边缘终止线共同抵抗修复体所受颊舌向的侧向力。在粘接力获得方面,该类固位体设计相对于嵌体式固定桥而言[4]–[5],减小了牙体预备的深度,尽可能多地保留了基牙粘接面的釉质组织,能够有效增强修复体的粘接固位效果。该类固位形设计的边缘线位于龈上及自洁区,可有效防止固位体边缘菌斑聚集,减低了继发龋的风险。
粘接桥的固位力获得主要依靠粘接力。全瓷固位体的粘接依赖于粘接剂和粘接面间的微机械固位和化学结合,要求全瓷粘接面有适宜的粗糙度和表面活性。实验结果显示,修复体经30万次机械循环加载后,均未出现松动、脱落,表明两种材料的全瓷粘接桥均能获得良好的短期固位效果。对于玻璃基铸造陶瓷而言,氢氟酸可选择性地溶解陶瓷材料内的玻璃基质,形成不规则表面,增大粘接面积,利于粘接剂渗入形成机械锁结[6]。同时,硅烷偶联剂的应用一方面可改善粘接剂在陶瓷表面的润湿性,另一方面可以分别与陶瓷粘接面和树脂粘接剂形成化学结合,从而增强陶瓷与树脂间的粘接固位[7]。对于氧化锆陶瓷而言,不但不能被氢氟酸酸蚀,其粘接面也不能与单纯涂布的硅烷偶联剂形成化学结合,临床粘接效果不佳。报道显示,氧化铝喷砂处理可以增加其表面粗糙度,形成有效的微机械固位结构,从而增强氧化锆陶瓷与树脂粘接剂间的粘接强度[8]。氧化铝喷砂技术是目前临床上常用的用于增强氧化锆陶瓷粘接性能的表面处理方式。分析试件的破坏类型,铸瓷组修复体与基牙间无脱粘接,而氧化锆组修复体破坏的同时多伴有固位体部分脱粘接,在一定程度上提示铸瓷粘接桥的粘接性能更佳。
修复体的抗力性能与多方面因素有关。首先是修复材料的选择,本实验所选用的两种全瓷修复材料中,IPS e.max press玻璃基铸造陶瓷挠曲强度高达400 MPa,已有学者[9]–[10]将其应用于后牙区牙体和牙列缺损的修复,并取得了不错的修复效果。氧化锆陶瓷是目前临床中使用的机械强度最高的陶瓷材料之一,氧化钇稳定型氧化锆陶瓷的挠曲强度超过900 MPa,可用于后牙固定桥修复[11]。同时,修复体黏固后,树脂粘接剂可以弥补陶瓷材料内部的微裂纹和缺陷,进一步提高其抗折强度。再者,修复体的形态结构也是影响其抗力性的重要因素。有限元分析显示,固定桥的应力主要集中于修复体连接体处,连接体的断裂是后牙全瓷固定桥修复失败的一个主要风险因素[12]。确保足够的连接体面积,尤其是足够的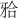 龈向厚度,是粘接桥获得良好抗折性能的前提。因此,本实验邻面板固位体的设计,要求在第一前磨牙侧连接体
龈向厚度,是粘接桥获得良好抗折性能的前提。因此,本实验邻面板固位体的设计,要求在第一前磨牙侧连接体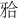 龈向高度≥3 mm,第一磨牙侧≥4 mm,在保证适当的修复体外展隙的基础上,可获得较嵌体固位型更大的连接体面积(主要是增加了颊舌向宽度),以增强该薄弱部位的抗折强度。实验结果显示,经30万次机械循环加载,试件均未出现折裂。各实验组测得的破坏载荷均显著高于第二前磨牙生理状态下所受最大
龈向高度≥3 mm,第一磨牙侧≥4 mm,在保证适当的修复体外展隙的基础上,可获得较嵌体固位型更大的连接体面积(主要是增加了颊舌向宽度),以增强该薄弱部位的抗折强度。实验结果显示,经30万次机械循环加载,试件均未出现折裂。各实验组测得的破坏载荷均显著高于第二前磨牙生理状态下所受最大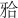 力。表明本实验设计下的粘接桥修复体均具有良好的抗力性,能够满足修复后的负载。
力。表明本实验设计下的粘接桥修复体均具有良好的抗力性,能够满足修复后的负载。
修复体黏固后处于复杂的口腔力学环境中,修复体和基牙不断承受着咀嚼力的作用,长期受力将导致全瓷材料的机械疲劳和粘接剂的老化,从而降低全瓷修复体的机械性能[13]。
所以,本实验设计机械循环加载模拟修复体在口内承受咀嚼力情况,再测试其破坏载荷,能够更好地反映修复体在使用过程中的抗力性能。实验结果显示,经机械循环加载后,氧化锆组修复体的抗折性能明显降低。这可能是由于在湿润环境下机械循环加载可引起氧化锆材料出现亚临界裂纹扩展现象,从而导致材料的机械强度下降[14]。相反,铸瓷组修复体在循环加载前后,其所能承受的破坏载荷无明显变化。表明在本实验条件下铸瓷粘接桥表现出更加稳定的抗力性能。究其原因,可能是由于树脂粘接剂能在铸瓷修复体与基牙之间形成结构良好的粘接层,该粘接层作为内在弹性缓冲层而吸收了修复体所承受的载荷[15],从而减弱了循环加载力对修复体的作用。Attia等[16]的研究也显示机械循环加载并没有明显降低 Panavia F粘接剂黏固的Empress 2铸瓷全冠所能承受的破坏载荷。
本实验初步探究了一种新型固位体设计的全瓷粘接桥用于下颌第二前磨牙缺失的修复效果,选取了两种临床常用的、各项性能较为良好的全瓷修复材料,通过对修复体固位、抗力等的研究,显示该类修复体表现出良好的修复效果,其短期临床模拟观察结果也令人满意,提示该种修复具有良好的临床应用前景。必须指出,作为一种新型的临床修复方式,该类邻面板固位全瓷粘接桥修复的远期效果还有待进一步的实验研究和长期临床观察的证明。
References
- 1.Balasubramaniam GR. Predictability of resin bonded bridges—a systematic review[J] Br Dent J. 2017;222(11):849–858. doi: 10.1038/sj.bdj.2017.497. [DOI] [PubMed] [Google Scholar]
- 2.Wolfart S, Ludwig K, Uphaus A, et al. Fracture strength of all-ceramic posterior inlay-retained fixed partial dentures[J] Dent Mater. 2007;23(12):1513–1520. doi: 10.1016/j.dental.2006.12.006. [DOI] [PubMed] [Google Scholar]
- 3.Castillo-Oyagüe R, Sancho-Esper R, Lynch CD, et al. All-ceramic inlay-retained fixed dental prostheses for replacing posterior missing teeth: a systematic review[J] J Prosthodont Res. 2018;62(1):10–23. doi: 10.1016/j.jpor.2017.06.007. [DOI] [PubMed] [Google Scholar]
- 4.Gumus HS, Polat NT, Yildirim G. Evaluation of fracture resistance of inlay-retained fixed partial dentures fabricated with different monolithic zirconia materials[J] J Prosthet Dent. 2018;119(6):959–964. doi: 10.1016/j.prosdent.2017.06.008. [DOI] [PubMed] [Google Scholar]
- 5.Cekic-Nagas I, Egilmez F, Ergun G, et al. Load-bearing capacity of novel resin-based fixed dental prosthesis materials[J] Dent Mater J. 2018;37(1):49–58. doi: 10.4012/dmj.2016-367. [DOI] [PubMed] [Google Scholar]
- 6.Panah FG, Rezai SM, Ahmadian L. The influence of ceramic surface treatments on the micro-shear bond strength of composite resin to IPS empress 2[J] J Prosthodont. 2008;17(5):409–414. doi: 10.1111/j.1532-849X.2007.00296.x. [DOI] [PubMed] [Google Scholar]
- 7.Hooshmand T, van Noort R, Keshvad A. Storage effect of a pre-activated silane on the resin to ceramic bond[J] Dent Mater. 2004;20(7):635–642. doi: 10.1016/j.dental.2003.08.005. [DOI] [PubMed] [Google Scholar]
- 8.Özcan M, Bernasconi M. Adhesion to zirconia used for dental restorations: a systematic review and meta-analysis[J] J Adhes Dent. 2015;17(1):7–26. doi: 10.3290/j.jad.a33525. [DOI] [PubMed] [Google Scholar]
- 9.Sailer I, Bonani T, Brodbeck U, et al. Retrospective clinical study of single-retainer cantilever anterior and posterior glassceramic resin-bonded fixed dental prostheses at a mean follow-up of 6 years[J] Int J Prosthodont. 2013;26(5):443–450. doi: 10.11607/ijp.3368. [DOI] [PubMed] [Google Scholar]
- 10.Gehrt M, Wolfart S, Rafai N, et al. Clinical results of lithium-disilicate crowns after up to 9 years of service[J] Clin Oral Investig. 2013;17(1):275–284. doi: 10.1007/s00784-012-0700-x. [DOI] [PubMed] [Google Scholar]
- 11.Raigrodski AJ, Hillstead MB, Meng GK, et al. Survival and complications of zirconia-based fixed dental prostheses: a systematic review[J] J Prosthet Dent. 2012;107(3):170–177. doi: 10.1016/S0022-3913(12)60051-1. [DOI] [PubMed] [Google Scholar]
- 12.Lakshmi RD, Abraham A, Sekar V, et al. Influence of connector dimensions on the stress distribution of monolithic zirconia and lithium-di-silicate inlay retained fixed dental prostheses—a 3D finite element analysis[J] Tanta Dent J. 2015;12(1):56–64. [Google Scholar]
- 13.Zhang Y, Sailer I, Lawn BR. Fatigue of dental ceramics[J] J Dent. 2013;41(12):1135–1147. doi: 10.1016/j.jdent.2013.10.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Cotes C, Arata A, Melo RM, et al. Effects of aging procedures on the topographic surface, structural stability, and mechanical strength of a ZrO2-based dental ceramic[J] Dent Mater. 2014;30(12):e396–e404. doi: 10.1016/j.dental.2014.08.380. [DOI] [PubMed] [Google Scholar]
- 15.Gu XH, Kern M. Marginal discrepancies and leakage of all-ceramic crowns: influence of luting agents and aging conditions[J] Int J Prosthodont. 2003;16(2):109–116. [PubMed] [Google Scholar]
- 16.Attia A, Kern M. Influence of cyclic loading and luting agents on the fracture load of two all-ceramic crown systems[J] J Prosthet Dent. 2004;92(6):551–556. doi: 10.1016/j.prosdent.2004.09.002. [DOI] [PubMed] [Google Scholar]