Abstract
目的
研究vps4b基因突变对牙齿发育相关蛋白——牙本质涎磷蛋白(DSPP)和Ⅰ型胶原蛋白(COL-Ⅰ)表达的影响。
方法
取胚胎E13.5 d、E14.5 d、E16.5 d的胎鼠头部及出生后P2.5 d、P7 d的幼鼠下颌骨组织,石蜡包埋后获取第一磨牙牙胚组织切片,采用免疫组织化学染色法检测野生型小鼠和vps4b基因敲除小鼠牙胚中DSPP、COL-Ⅰ的表达。
结果
野生鼠蕾状期和帽状期DSPP、COL-Ⅰ均未表达;钟状期DSPP在内釉上皮和牙乳头中有表达,COL-Ⅰ表达于牙乳头和牙囊;分泌期和矿化期DSPP、COL-Ⅰ在成釉细胞、成牙本质细胞、牙囊内均有表达,COL-Ⅰ在牙乳头内亦可见表达。小鼠vps4b基因敲除后,DSPP在钟状期牙乳头和分泌期牙乳头及牙囊内未见表达,COL-Ⅰ在钟状期及矿化期表达部位与野生型小鼠一致,分泌期在牙乳头的表达发生改变。
结论
vps4b基因在牙胚发育中发挥重要作用;DSPP、COL-Ⅰ的表达可能受vps4b基因的调控,并与vps4b共同调节牙齿牙本质的发育。
Keywords: 牙本质涎磷蛋白, Ⅰ型胶原蛋白, vps4b基因敲除鼠, 牙胚发育
Abstract
Objective
To verify the effect of the mutant gene vps4b on the expression of tooth development-related proteins, dentin sialophosphoprotein (DSPP) and collagenⅠ (COL-Ⅰ).
Methods
Paraffin tissue sections of the first molar tooth germ were obtained from the heads of fetal mice at the embryonic stages of 13.5, 14.5, and 16.5 days and from the mandibles of larvae aged 2.5 and 7 days after birth. The immunohistochemical method was used to detect the expression and location of DSPP and COL-Ⅰ in wild-type mouse and vps4b knockout mouse.
Results
DSPP and COL-Ⅰ were not found in the bud and cap stages of wild-type mouse molar germ. In the bell stage, DSPP was positively expressed in the inner enamel epithelium and dental papilla, whereas COL-Ⅰ was strongly expressed in the dental papilla and dental follicle. During the secretory and mineralized periods, DSPP and COL-Ⅰ were intensely observed in ameloblasts, odontoblasts, and dental follicles, but COL-Ⅰ was also expressed in the dental papilla. After vps4b gene knockout, DSPP was not expressed in the dental papilla of the bell stage and in the dental papilla and dental follicle of the secretory phase. The expression position of COL-Ⅰ in the bell and mineralization phase was consistent with that in the wild-type mice. Moreover, the expression of COL-Ⅰ in the dental papilla changed in the secretory stage.
Conclusion
Gene vps4b plays a significant role in the development of tooth germ. The expression of DSPP and COL-Ⅰ may be controlled by gene vps4b and regulates the development of tooth dentin and cementum together with vps4b.
Keywords: dentin sialophosphoprotein, collagenⅠ, vps4b knockout mouse, tooth germ development
牙本质发育异常是一类以牙齿中胚层及牙乳头发育异常为主的常染色体显性遗传病,分为牙本质发育不全(dentinogenesis imperefcta,DGI)和牙本质发育不良(dentin dysplasia,DD)两型。Shields等[1]根据临床及X线表现将DGI分为3型,DD分为2型。DGI-Ⅰ是由Ⅰ型胶原蛋白( collagenⅠ,COL-Ⅰ)突变所致[2],DGI-Ⅱ、DGI-Ⅲ和DD-Ⅱ的致病基因则均为dspp基因[3]。DD-Ⅰ又被称为“无根牙”或“根部牙本质发育不良”,临床表现为冠部颜色和形态基本正常而牙根短小或缺如。该病具有遗传异质性,已在不同的家系中发现3种不同的致病基因smoc2、ssuh2和vps4b[4]。本课题组对豫北地区的一个DD-Ⅰ家系分析后发现致病基因为vps4b[5]。
COL-Ⅰ是牙本质基质的支架结构,也是骨组织中含量最丰富的基质蛋白[6]。牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP)是牙本质基质中重要的非胶原蛋白,主要在成牙本质细胞中表达,在前成釉细胞中一过性表达,与牙齿发育和生物矿化密切相关[7]。vps4b基因位于染色体18q21,是转运必需内体分选复合物(endosomal sorting complex required for transport,ESCRT)系统的重要组成部分,在多泡体成熟、病毒出芽、细胞有丝分裂和溶酶体降解等过程中起重要作用[8]。COL-Ⅰ、DSPP和细胞液泡分选蛋白4B(vacuolar protein sorting 4B,VPS4B)共同作为遗传性牙本质发育异常性疾病的致病相关蛋白,在调节牙本质的发育中可能存在一定的相互作用关系。本研究拟采用免疫组织化学法观察dspp、col-Ⅰ基因在野生型小鼠和vps4b基因敲除小鼠磨牙牙胚发育中的时空表达分布,探讨vps4b基因在牙胚发育过程中可能的作用,及其与DSPP、COL-Ⅰ相互的时空关联性。
1. 材料和方法
1.1. 实验动物及主要试剂
野生型C57BL/6J小鼠(济南朋悦实验动物繁育有限公司),vps4b基因敲除小鼠(南京大学-南京生物医药研究院制作)。DSPP抗体、COL-Ⅰ抗体(北京博奥森生物技术有限公司),SP免疫组织化学试剂盒、DAB显色试剂盒(武汉博士德生物工程有限公司),KAPA DNA快速提取试剂盒(北京普凯瑞生物科技有限公司),寡核苷酸引物、Taq PCR试剂盒(北京鼎国昌盛生物技术有限责任公司)。
1.2. 标本制备
采用断颈法处死胚胎(embryonic,E)13.5 d、E14.5 d、E16.5 d的孕鼠及出生后(postnatal,P)2.5 d、P7 d的幼鼠,剪取鼠尾。操作时注意每份样本使用一套独立工具,避免交叉污染,并用灭菌水反复冲洗,置于无菌EP管中,通过PCR鉴定基因型。取胎鼠头部及幼鼠下颌骨,浸于4%多聚甲醛中于4 °C条件下固定24 h,梯度乙醇脱水、二甲苯透明、浸蜡、包埋,制备5 µm连续切片(幼鼠下颌骨固定后需先在10%EDTA溶液中脱钙3~6 d)。
1.3. 小鼠基因型验证
1.3.1. 小鼠基因组DNA(genomic DNA,gDNA)提取
将鼠尾剪碎,置于1.5 mL离心管中,提取小鼠gDNA。
1.3.2. PCR扩增反应及琼脂糖凝胶电泳
PCR扩增引物由北京鼎国昌盛生物技术有限责任公司合成,聚丙烯酰胺凝胶纯化后-20 °C备用。PCR扩增反应体系根据使用说明,按25 µL反应体系进行扩增,dNTP 0.5 µL、待测gDNA 0.5 µL、正向以及反向引物各0.5 µL、10×Taq buffer 2.5 µL、Taq酶0.5 µL,加ddH2O 20 µL后混匀,离心数秒,放入PCR仪进行扩增。vps4b gDNA基因型鉴定的PCR引物见表1。PCR反应循环设置:vps4b-1为94 °C预变性5 min,94 °C 30 s、60 °C 30 s、72 °C 1 min,循环数为35次,最后72 °C延伸10 min,4°C 保存。vps4b-2为降落PCR程序,95 °C预变性5 min,95 °C 30 s、(65 °C-0.5 °C)30 s、72 °C 30 s,循环数为20次;接着95 °C 30 s、55 °C 30 s、72 °C 30 s,循环数为20次,然后72 °C延伸10 min,16 °C保存。取5 µL PCR产物和2 000 bp DNA marker,进行1%琼脂糖凝胶电泳,并用凝胶成像分析仪进行分析。
表 1. vps4b gDNA基因型鉴定的PCR引物.
Tab 1 PCR primers for vps4b gDNA genotype identification
| 基因 | 引物序列(5′—3′) |
| vps4b-1 | F1:TGCTTTAGGCAAAGCAGCAC |
| R1:GCTGAAACTGGAGGGTTAGG | |
| vps4b-2 | F2:TGCTTTAGGCAAAGCAGCAC |
| R2:TTTCTGTGTGAGGGAGGCAA |
1.4. 免疫组织化学染色
取E13.5 d、E14.5 d、E16.5 d的胎鼠头部以及P2.5 d、P7 d的幼鼠下颌骨组织,获取不同发育阶段第一磨牙牙胚的组织切片,采用SP免疫组织化学法进行染色。石蜡组织块切片脱蜡至水,梯度乙醇脱水,PBS洗5 min×3次,在微波炉里蒸煮柠檬酸抗原修复液(pH为6.0)至沸腾后放入切片蒸煮90 s,断电5~10 min,重复1次,PBS冲洗5 min×2次,3% H2O2室温避光浸泡切片30 min,盖上盖子从而除去内源性过氧化氢酶,防止造成非特异性背景染色,PBS洗3 min×3次,滴加10%山羊血清室温封闭1 h,滴加1∶100稀释的VPS4B,1∶800稀释的COL-Ⅰ多克隆抗体,4 °C湿盒过夜;次日室温复温1 h,PBS漂洗5 min×4次;滴加生物素化二抗,37 °C孵育30 min,PBS洗5 min×3次;滴加辣根过氧化物酶,37 °C温箱孵育30 min,DAB显色,苏木精复染;乙醇脱水,二甲苯透明,中性树胶封片;显微镜下观察并拍照。
1.5. 免疫组织化学结果分析
染色结果参考文献[9]设置的标准进行判定,DSPP、COL-Ⅰ阳性表达为细胞质内出现淡黄色或棕黄色颗粒。1)阴性表达:细胞质内无淡黄色及棕黄色颗粒,苏木素复染后呈蓝色;2)弱阳性表达:细胞内有淡黄色颗粒,阳性着色细胞面积低于该组织的10%;3)阳性表达:细胞内有淡黄色或棕黄色颗粒,阳性着色细胞面积占该组织的10%~60%,染色清晰;4)强阳性表达:细胞内有淡黄色或棕黄色颗粒,阳性着色面积占该组织的60%以上,染色强。
2. 结果
2.1. 基因型鉴定结果
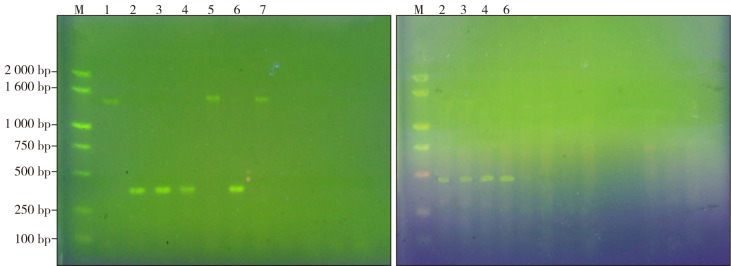
以F1/R1为引物的PCR扩增显示有2种类型条带:1条1 383 bp条带(野生型)或1条384 bp条带(基因敲除型)。在实际操作过程中,由于竞争性抑制作用,为了防止杂合型小鼠的野生型等位基因被遗漏而导致鉴定错误,又在被删除序列的内部设计了引物R2,利用F1/R2扩增的另一反应中,野生型和杂合型均可扩增出425 bp条带,隐性纯合型无条带。由图1可见,1、5、7号小鼠只有1 383 bp条带,为野生型(图1左);2、3、4、6号为杂合型基因敲除鼠。利用F1/R2扩增进一步鉴定,2、3、4、6号小鼠均可扩增出425 bp条带(图1右),说明为vps4b基因敲除鼠。
图 1. 小鼠vps4b基因gDNA扩增结果.
Fig 1 Mouse vps4b gDNA amplification results
左:以F1/R1为引物扩增出2种条带;右:以F1/R2为引物扩增出1种条带。M:2 000 bp DNA marker。
2.2. DSPP和COL-Ⅰ蛋白表达的分布
不同发育期的DSPP和COL-Ⅰ免疫组织化学染色结果见图2~4。在E13.5 d(蕾状期)和E14.5 d(帽状期),DSPP和COL-Ⅰ无表达。
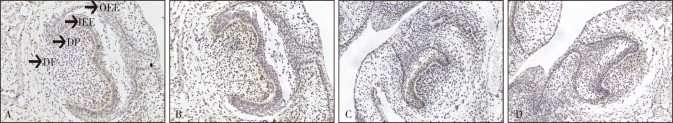
图 2. 钟状期牙胚DSPP、COL-Ⅰ表达 SP × 200.
Fig 2 The expression of DSPP and COL-Ⅰ in bell stage tooth germ SP × 200
A、B:野生型小鼠DSPP、COL-Ⅰ表达;C、D:vps4b基因敲除小鼠DSPP、COL-Ⅰ表达。OEE:外釉上皮;IEE:内釉上皮;DP:牙乳头;DF:牙囊。
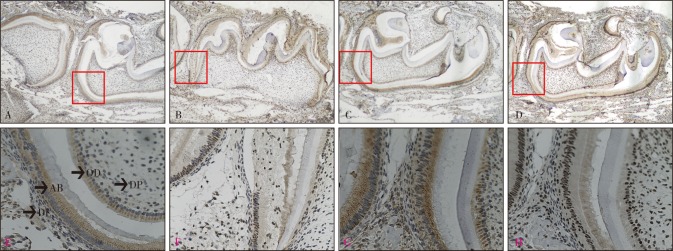
图 4. 矿化期牙胚DSPP和COL-Ⅰ表达.
Fig 4 The expression of DSPP and COL-Ⅰ in mineralization stage tooth germ
A、B分别为野生型小鼠DSPP、COL-Ⅰ表达;C、D分别为vps4b基因敲除小鼠DSPP、COL-Ⅰ表达。E、F、G、H分别为A、B、C、D红色方框放大区域。上:SP ×40;下:SP × 200。AB:成釉细胞;OD:成牙本质细胞;DP:牙乳头;DF:牙囊。
E16.5 d(钟状期),此时细胞分为4层:外釉上皮、内釉上皮、星网状层和中间层。野生型小鼠中DSPP在内釉上皮弱阳性表达,在牙乳头中呈阳性表达(图2A);COL-Ⅰ在牙乳头和牙囊内阳性表达(图2C)。基因敲除小鼠的DSPP在内釉上皮呈阳性表达,牙乳头阴性表达(图2B);COL-Ⅰ在牙乳头和牙囊内呈阳性表达(图2D)。
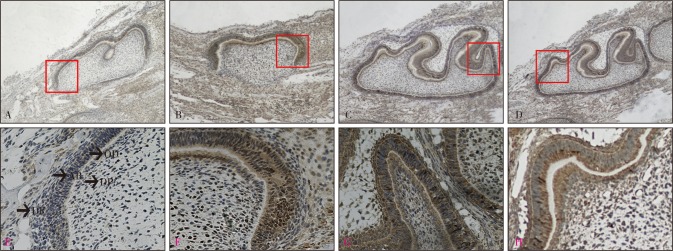
P2.5 d,牙胚进入分泌期,内釉上皮和相邻的牙乳头细胞分别分化为成釉细胞和成牙本质细胞,细胞呈高柱状,并具有分泌细胞基质的功能,分泌大量的釉质基质和牙本质基质。野生鼠DSPP在成釉细胞和成牙本质细胞内呈强阳性表达,牙囊细胞呈弱阳性表达,牙乳头阴性表达(图3A、E);COL-Ⅰ强阳性表达于成牙本质细胞和成釉细胞内,在牙乳头和牙囊内亦可见表达(图3B、F)。基因敲除鼠的DSPP仅表达于成釉细胞和成牙本质细胞内,牙乳头及牙囊细胞均呈阴性表达(图3C、G);COL-Ⅰ在成釉细胞和成牙本质细胞内强阳性表达,在牙尖处的牙乳头中阳性表达,牙囊中弱阳性表达(图3D、H)。
图 3. 分泌期牙胚DSPP和COL-Ⅰ表达.
Fig 3 The expression of DSPP and COL-Ⅰ in secretory stage tooth germ
A、B分别为野生型小鼠DSPP、COL-Ⅰ表达;C、D分别为vps4b基因敲除小鼠DSPP、COL-Ⅰ表达。E、F、G、H分别为A、B、C、D红色方框放大区域。上:SP ×40;下:SP × 200。AB:成釉细胞;OD:成牙本质细胞;DP:牙乳头;DF:牙囊。
P7 d,牙胚进入矿化期,牙冠发育基本完成,成釉细胞和成牙本质细胞分泌的基质蛋白发生矿化,继而形成釉质和牙本质。DSPP强阳性表达于成釉细胞和成牙本质细胞内,牙囊细胞内呈弱阳性表达,牙乳头阴性表达(图4A、E);COL-Ⅰ高表达于成牙本质细胞、成釉细胞和牙尖处的牙乳头内(图4B、F);基因敲除鼠牙胚中DSPP、COL-Ⅰ的表达部位与野生型小鼠一致(图4C、D、G、H)。
3. 讨论
本研究中的vps4b基因敲除小鼠是运用CRISPR-Cas9技术构建完成的。基因敲除小鼠虽然被认为是一种有价值的研究工具,但存在一些缺陷,约有15%的基因敲除是发育致死性的[10]。本实验所用基因敲除小鼠均为杂合子,因此其子代有可能出现vps4b+/+、vps4b+/-、vps4b-/-共3种表型,PCR结果显示子代鼠中无vps4b-/-类型。笔者猜测,vps4b基因可能是小鼠胚胎发育过程中不可或缺的基因,该基因的纯合突变导致了小鼠在胚胎发育过程中的发育障碍并最终诱发早期胚胎死亡,但其在牙齿发育过程中的具体作用仍需进一步研究。
牙齿发育是一个连续、长期、极其复杂的生物学过程,涉及包括生长因子、受体分子及特异基质蛋白等不同分子组成的信号网络系统对牙齿发育的形态结构进行精确的调控[11]。DSPP信号通路与牙本质发育密切相关。DSPP作为牙本质磷蛋白(dentin phosphoprotein,DPP)和牙本质涎蛋白(dentin sialoprotein,DSP)的复合体,该蛋白前体必须经蛋白酶解后形成两种功能不同的产物——DSP和DPP,才能发挥作用。相关报道[12]证实,DSP参与了牙本质早期的矿化,并调节牙本质早期矿化及再矿化过程。DPP作为一种酸性蛋白,通过吸引Ca2+并促进羟磷灰石晶体在胶原基质上的形成和生长,进而诱导前期牙本质向牙本质的转化[13]。本实验发现DSPP在钟状期牙乳头中不表达,说明vps4b基因的异常影响了DSPP的分布,可能通过干扰成牙本质细胞的分化影响牙本质的形成;至分泌期,基因敲除型小鼠的牙乳头、牙囊中均未见DSPP的表达,因此推测vps4b基因突变可能通过影响DSPP分布,进而抑制牙本质及牙骨质的正常矿化,最终导致牙齿牙根发育异常。
COL-Ⅰ蛋白由col1a1和col1a2基因编码,主要作用是形成骨骼、结缔组织并保持骨架的完整性,也在细胞外周微环境的形成中发挥重要作用[6]。成牙本质细胞主要合成和分泌的蛋白质是Ⅰ型胶原,Ⅰ型胶原可能在牙本质矿化开始时起作用,提供牙本质结构支架、强度和弹性。本研究中COL-Ⅰ在基因敲除小鼠分泌期仅在牙尖处牙乳头中表达,可能是因为vps4b基因突变后导致COL-Ⅰ在牙乳头中表达分布发生异常,进而引起牙本质矿化不良。
本研究通过定点交配繁殖技术,获得基因敲除鼠的子代鼠,经免疫组织化学方法观察DSPP、COL-Ⅰ在野生型小鼠和基因敲除小鼠中表达分布的改变,证实vps4b基因在牙胚发育中发挥重要作用。vps4b基因突变导致DSPP、COL-Ⅰ蛋白的表达发生改变,推测编码这两种蛋白的基因可能位于vps4b基因的下游,DSPP、COL-Ⅰ的表达受vps4b基因的调控,并与vps4b共同调控牙齿牙本质的发育。
Funding Statement
[基金项目] 国家自然科学基金(81470033)
Supported by: The National Natural Science Foundation of China (81470033).
References
- 1.Shields ED, Bixler D, el-Kafrawy AM. A proposed classification for heritable human dentine defects with a description of a new entity[J] Arch Oral Biol. 1973;18(4):543–553. doi: 10.1016/0003-9969(73)90075-7. [DOI] [PubMed] [Google Scholar]
- 2.Rebelo M, Lima J, Vieira JD, et al. An unusual presentation of osteogenesis imperfecta type Ⅰ[J] Int Med Case Rep J. 2011;4:25–29. doi: 10.2147/IMCRJ.S17929. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Kim JW, Hu JC, Lee JI, et al. Mutational hot spot in the DSPP gene causing dentinogenesis imperfecta type Ⅱ[J] Hum Genet. 2005;116(3):186–191. doi: 10.1007/s00439-004-1223-6. [DOI] [PubMed] [Google Scholar]
- 4.Chen D, Li X, Lu F, et al. Dentin dysplasia type Ⅰ—a dental disease with genetic heterogeneity[J] Oral Dis. 2019;25(2):439–446. doi: 10.1111/odi.12861. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Yang Q, Chen D, Xiong F, et al. A splicing mutation in VPS4B causes dentin dysplasia Ⅰ[J] J Med Genet. 2016;53(9):624–633. doi: 10.1136/jmedgenet-2015-103619. [DOI] [PubMed] [Google Scholar]
- 6.Garnero P. The role of collagen organization on the properties of bone[J] Calcif Tissue Int. 2015;97(3):229–240. doi: 10.1007/s00223-015-9996-2. [DOI] [PubMed] [Google Scholar]
- 7.郭 婷, 余 擎, 肖 明振, et al. 小鼠牙本质涎磷蛋白基因上游启动子的克隆和序列测定[J] 华西口腔医学杂志. 2004;22(6):513–515. [PubMed] [Google Scholar]; Guo T, Yu Q, Xiao MZ, et al. Cloning and sequencing of the upstream of mouse dentin sialophosphoprotein promoter[J] West China J Stomatol. 2004;22(6):513–515. [PubMed] [Google Scholar]
- 8.Cui G, Wang YF, Yu SS, et al. The expression changes of vacuolar protein sorting 4B (VPS4B) following middle cerebral artery occlusion (MCAO) in adult rats brain hippocampus[J] Cell Mol Neurobiol. 2014;34(1):83–94. doi: 10.1007/s10571-013-9989-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Shi ZR, Itzkowitz SH, Kim YS. A comparison of three immunoperoxidase techniques for antigen detection in colorectal carcinoma tissues[J] J Histochem Cytochem. 1988;36(3):317–322. doi: 10.1177/36.3.3278057. [DOI] [PubMed] [Google Scholar]
- 10.徐 瑛, 周 常文. 神经系统条件性基因敲除研究进展[J] 中国优生与遗传杂志. 2008;16(2):1–3. [Google Scholar]; Xu Y, Zhou CW. Research progress of conditioned gene knockout in nervous system[J] Chin J Birth Health Heredity. 2008;16(2):1–3. [Google Scholar]
- 11.Lan Y, Jia S, Jiang R. Molecular patterning of the mammalian dentition[J] Semin Cell Dev Biol. 2014(25/26):61–70. doi: 10.1016/j.semcdb.2013.12.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Maciejewska I, Chomik E. Hereditary dentine diseases resulting from mutations in DSPP gene[J] J Dent. 2012;40(7):542–548. doi: 10.1016/j.jdent.2012.04.004. [DOI] [PubMed] [Google Scholar]
- 13.Baba O, Qin CL, Brunn JC, et al. Colocalization of dentin matrix protein 1 and dentin sialoprotein at late stages of rat molar development[J] Matrix Biol. 2004;23(6):371–379. doi: 10.1016/j.matbio.2004.07.008. [DOI] [PubMed] [Google Scholar]