Abstract
目的
探究正畸牙压力区牙周膜细胞自噬相关蛋白Beclin-1与微管相关蛋白2轻链3(LC3Ⅱ)的表达。
方法
将60只雄性SD大鼠随机分为空白对照组和9个实验组,实验组正畸加力0.392 N近中移动右上第一磨牙,加力时间分别为15 min、30 min、1 h、2 h、4 h、12 h、1 d、3 d、7 d,空白对照组不做任何处理。处死大鼠后,行苏木精-伊红(HE)染色观察压力区牙周膜形态学变化、免疫组织化学染色检测Beclin-1与LC3Ⅱ的表达、抗酒石酸酸性磷酸酶(TRAP)染色计数破骨细胞。
结果
HE染色显示,加力1 d后压力区牙周膜透明样变出现,并随加力时间延长逐渐加重。免疫组织化学染色显示,实验组Beclin-1和LC3Ⅱ表达均上调,1 h达峰值,随后逐渐降低,1 d时再次增强达一小峰值,后又回降,7 d时降低至基线水平。破骨细胞中也可见Beclin-1和LC3Ⅱ的表达。TRAP染色提示,加力1 d后破骨细胞数量开始增加。
结论
自噬或许通过介导牙周膜透明样变发生和影响破骨细胞生物学作用参与正畸牙压力区牙周膜改建的过程。
Keywords: 正畸牙移动, 牙周膜, 压力, 自噬
Abstract
Objective
To investigate the expression of autophagy-related protein Beclin-1 and microtubule-associated protein 2 light chain 3 (LC3Ⅱ) in periodontal ligament cells in orthodontic tooth pressure areas.
Methods
Sixty male SD rats were randomly divided into a blank control group and nine experimental groups. In the experimental groups, 0.392 N orthodontic force was used to move the first right upper molars for 15 min, 30 min, 1 h, 2 h, 4 h, 12 h, 1 d, 3 d, or 7 d. The blank control group did not receive any treatment. The rats were euthanized. Changes in the morphology of the periodontal membrane in the pressure areas were observed through hematoxylin and eosin (HE) staining. The expression levels of Beclin-1 and LC3Ⅱ were detected by immunohistochemical staining, and tartrate-resistant acid phosphatase (TRAP) staining was performed for the counting of osteoclasts.
Results
The HE stains showed that the hyalinization of the periodontal ligament appeared in the pressure areas after 1 day of exertion and was gradually aggravated. The immunohistochemical stains showed that the expression levels of Beclin-1 and LC3Ⅱ in the experimental groups gradually increased, peaked after 1 h, and then gradually decreased. The expression levels peaked again after 1 d, then decreased to baseline levels at 7 d of exertion. Beclin-1 and LC3Ⅱ were expressed in the osteoclasts. The TRAP stains indicated that the number of osteoclasts started to increase after 1 day.
Conclusion
Autophagy may participate in the process of periodontal ligament reconstruction in orthodontic tooth pressure areas by mediating the hyalinization of periodontal ligament and affecting the biological effects of osteoclasts.
Keywords: orthodontic tooth movement, periodontal ligament, pressure, autophagy
牙周膜(periodontal ligament)是正畸力作用下牙周组织发生改建的基石,正畸力通过牙齿传导至牙周膜,并且在牙根两侧形成对应的压力区和张力区。牙周膜细胞因周围微观环境的改变而激活一系列力学—生物化学信号转导系统,促使包括牙周膜和牙槽骨在内的牙周组织发生改建从而实现牙齿移动[1]。正畸力作用下,压力区牙周膜被压缩形变,并出现微循环障碍而使细胞处于受压的机械环境和缺血缺氧的“饥饿”环境。研究[2]–[4]表明,多种刺激因素如机械力、营养饥饿等作用可以快速诱发真核细胞特有的一种生理现象——自噬(autophagy),其既维持细胞生存又介导细胞死亡,在机体的生长发育和组织改建过程中起着重要的作用[2]。当细胞感知内外环境的改变,牙周膜细胞自噬相关蛋白Beclin-1参与启动自噬[5],胞浆型微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3Ⅰ)转化为膜型微管相关蛋白2轻链3(microtubule-associated protein 2 light chain 3,LC3Ⅱ)后联合内质网或高尔基体等膜性成分构成双层膜结构[6],该结构包裹细胞内大分子等形成自噬体(autophagosome),自噬体结合溶酶体将其中包裹的成分分解为小分子实现物质再循环。这种精妙的分解过程能够“以旧换新”和提供能量以维持细胞的新陈代谢和内部环境稳态,但自噬超过一定的阈值也将引起细胞凋亡[3],[7]–[8]。
正畸牙压力区牙周膜细胞受机械压力和“饥饿”的双重刺激,其代谢与生存的维持及后期透明样变的发生是否有自噬的参与?自噬与压力区牙周膜的改建存在何种联系?本研究通过建立SD大鼠正畸牙移动模型,用苏木精-伊红(hematoxylineosin,HE)染色、免疫组织化学染色和抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色,观察大鼠正畸牙移动过程中不同时间段压力区牙周膜细胞自噬相关蛋白Beclin-1和LC3Ⅱ的表达情况,初步探究自噬在正畸牙压力区牙周膜改建中的作用。
1. 材料和方法
1.1. 实验主要器材及试剂
0.12 mm镍钛螺旋拉簧(上海埃蒙迪材料科技股份有限公司),0.20 mm正畸结扎丝、测力计(杭州西湖生物材料有限公司),LC3Ⅱ、Beclin-1兔多克隆抗体(Abcam公司,英国),DAB显色液、免疫组织化学试剂盒(北京博奥森生物技术有限公司),TRAP染色液(北京索莱宝科技有限公司),显微摄像系统(Olympus公司,日本)。
1.2. 实验动物的分组和处理
6~8周龄雄性SD大鼠60只,体重(247±33)g,由西南医科大学实验动物中心提供,动物许可证号:SCXK(川)2013-17。遵循随机原则分为空白对照组和9个实验组(分别加力15 min、30 min、1 h、2 h、4 h、12 h、1 d、3 d、7 d),每组各6只。空白对照组不做任何处理。实验组大鼠于切牙与右上第一磨牙间放置镍钛拉簧,以两颗切牙为支抗,施加0.392 N力近中移动上颌第一磨牙(图1)。每天检查1次大鼠加力装置,若脱落或损坏,则排除并重新选择大鼠建模。根据分组,按时注射过量水合氯醛处死大鼠并做相关检测。本研究通过西南医科大学伦理委员会审查批准(审批号:201703026)。
图 1. 正畸加力装置.
Fig 1 Orthodontic device
1.3. HE染色观察压力区牙周膜形态学变化
取大鼠右上第一磨牙及周围组织行常规固定、脱钙、脱水、包埋,并平行牙长轴行近远中向4 µm连续切片。选取第一磨牙牙根及周围组织完整的切片常规HE染色,中性树胶封片。光镜观察和记录第一磨牙远中根的近中压力区冠1/3处牙周膜(观察区)形态学改变。
1.4. 免疫组织化学染色检测Beclin-1和LC3Ⅱ在压力区牙周膜细胞中的表达
按照免疫组化试剂盒步骤进行操作,苏木素复染,中性树胶封片。对每张切片观察区域随机选取3个不重叠视野进行图像采集,Image Pro-Plus 6.0图像分析软件分析Beclin-1和LC3Ⅱ的平均光密度(mean optical density,MOD)。
1.5. TRAP染色计数压力区破骨细胞
按TRAP试剂盒步骤进行操作,苏木素复染,中性树胶封片。按Rody等[9]的方法计数观察区TRAP阳性破骨细胞。
1.6. 统计学处理
所有测量和计数等均由同一位有经验的实验者重复3次后取平均值。采用SPSS 17.0统计学软件对多组计量资料进行方差分析(LSD法),各实验组与空白对照组进行比较后,实验组组间再进行两两对比,检验水准α=0.05。
2. 结果
2.1. HE染色
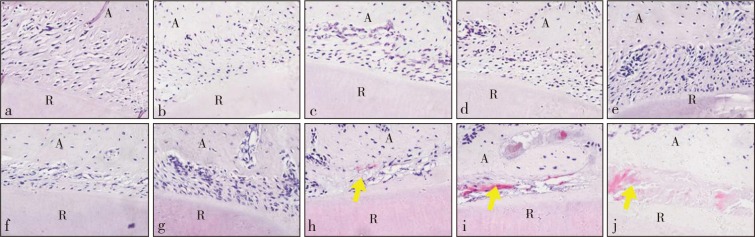
随加力时间延长,局部压力区牙周膜纤维呈皱褶样不规则排列,牙周膜间隙逐渐变窄,1 d时牙周膜开始出现透明样变,之后逐渐加重,7 d时透明样变面积最大(图2)。
图 2. 各组压力区牙周膜观察 HE × 400.
Fig 2 Observation of periodontal ligament of the pressure areas of every group HE × 400
a为对照组,b~j分别为实验组加力15 min、30 min、1 h、2 h、4 h、12 h、1 d、3 d、7 d。A:牙槽骨,R:牙根。图中黄色箭头示透明样变。
2.2. 免疫组织化学染色
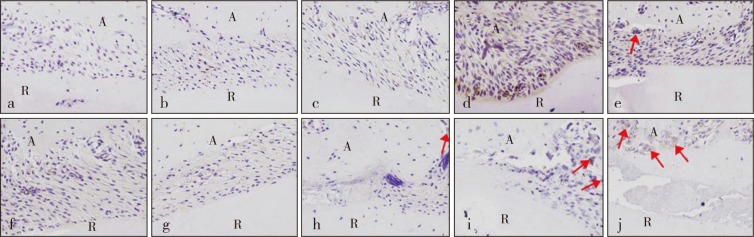
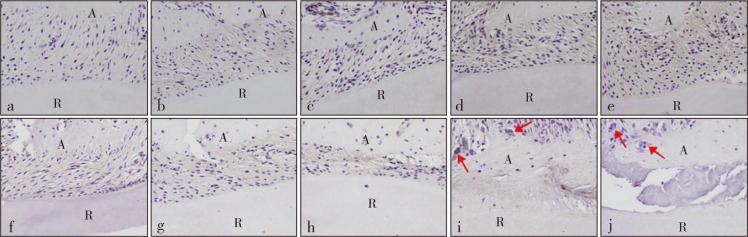
Beclin-1和LC3Ⅱ主要存在于胞质中,阳性染色为浅棕色或棕色。各组牙周膜细胞中均可见Beclin-1和LC3Ⅱ表达。对照组Beclin-1、LC3Ⅱ的MOD分别为0.019±0.002 4、0.020±0.002 8。实验组Beclin-1和LC3Ⅱ表达随着加力时间变化而出现波动,二者变化趋势类似,加力后表达均上调,在1 h时达到峰值(Beclin-1、LC3Ⅱ的MOD分别为0.057±0.003 6、0.052±0.002 7),后逐渐降低,加力至1 d时再次增强达一小峰值(Beclin-1、LC3Ⅱ的MOD分别为0.033±0.004 2、0.030±0.001 9),后又回降,7 d时降低至基线水平(Beclin-1、LC3Ⅱ的MOD分别为0.019±0.002 3、0.019±0.002 0)(P>0.05)(图3~6)。破骨细胞中也可见Beclin-1和LC3Ⅱ表达。
图 3. 各组压力区牙周膜中Beclin-1观察 免疫组织化学染色 × 400.
Fig 3 Observation of Beclin-1in periodontal ligament of the pressure areas of every group immunohistochemical staining × 400
a为对照组,b~j分别为实验组加力15 min、30 min、1 h、2 h、4 h、12 h、1 d、3 d、7 d。A:牙槽骨,R:牙根。图中红色箭头示破骨细胞。
图 6. 实验组不同加力时间压力区牙周膜中LC3Ⅱ的平均光密度值.
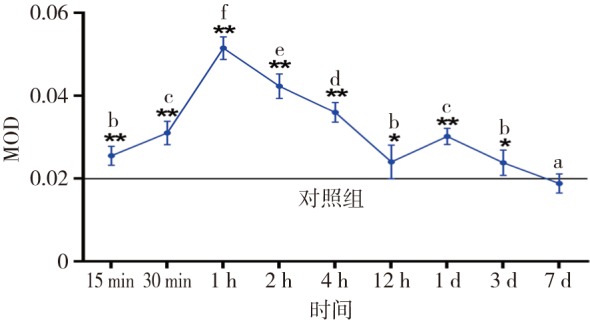
Fig 6 MOD of LC3Ⅱin periodontal ligament of the pressure areas of experiment groups at different time
a~f表示实验组组间两两对比的同类子集,*P<0.05,**P<0.01。
2.3. TRAP染色
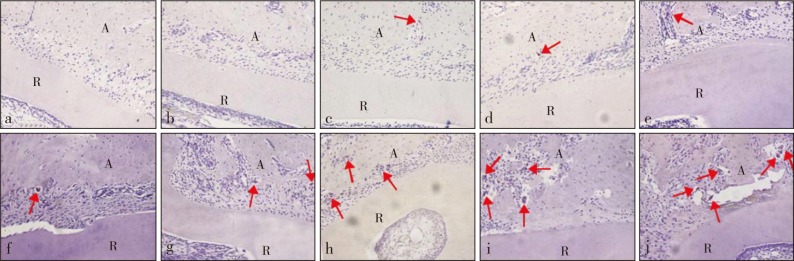
加力1 d后压力区破骨细胞数量开始增加(P<0.05),7 d达到最高(P<0.01)。破骨细胞主要出现在透明样病变区域周围近牙槽骨处(图7、8)。
图 7. 各组压力区破骨细胞观察 TRAP染色 × 200.
Fig 7 Observation of osteoclasts in pressure area of every group TRAP staining × 200
a为对照组,b~j分别为实验组加力15 min、30 min、1 h、2 h、4 h、12 h、1 d、3 d、7 d。A:牙槽骨,R:牙根。图中红色箭头示破骨细胞。
图 8. 各组压力区破骨细胞的数目.
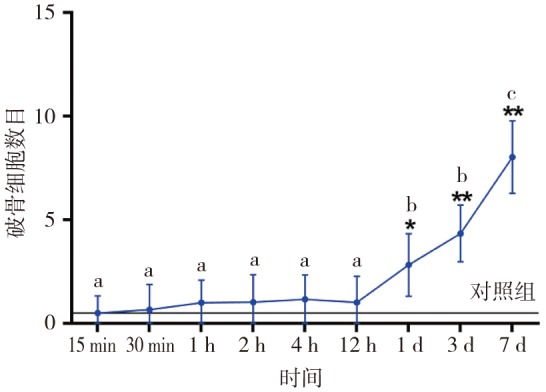
Fig 8 Number of osteoclasts in pressure area of every group
a~f表示实验组组间两两对比的同类子集,*P<0.05,**P<0.01。
图 4. 实验组不同加力时间压力区牙周膜中Beclin-1的MOD.
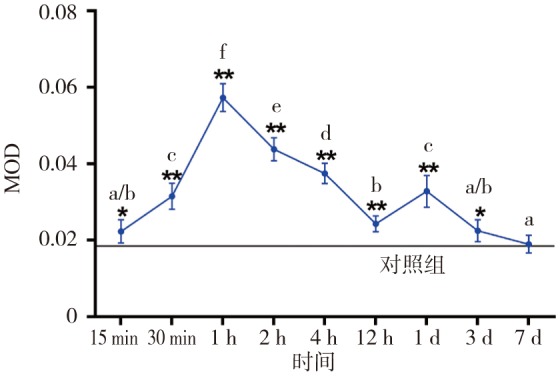
Fig 4 MOD of Beclin-1 in periodontal ligament of the pressure areas of experiment groups at different time
a~f表示实验组组间两两对比的同类子集,*P<0.05,**P<0.01。
3. 讨论
牙周膜细胞是由成纤维细胞、成骨细胞、破骨细胞等组成的混合细胞群,处于三维微观机械环境中,其必须适应各种内外环境变化,才能正常发挥功能和维持生存。自噬是细胞应对应激时的一种生理反应,正常情况下自噬维持在较低的基线水平,而一旦生存环境发生改变,如受机械刺激、营养“饥饿”等作用,细胞自噬水平将发生变化[2]–[4]。本研究中各组牙周膜细胞中均有自噬蛋白的表达,但空白组自噬水平较低,而正畸力作用使牙周膜细胞所处的复杂三维环境发生改变,压力区牙周膜细胞受机械压力刺激的同时也处于缺血缺氧的环境中,受压力与“饥饿”的双重作用,实验组自噬水平出现波动。
King等[2]认为持续性压力才能诱发自噬,给予细胞1 min的压力时,未见自噬水平的明显变化;当压力持续30 min时自噬大量诱发,即刻卸载压力,可见自噬水平在10 min内逐渐恢复至正常。本研究中正畸加力后,压力区牙周膜细胞所处的微观机械环境快速改变,自噬相关蛋白Beclin-1及LC3Ⅱ的表达随压力作用时间延长而逐渐增强,可见正畸力诱导了压力区牙周膜细胞的自噬。但随时间推移,压力区牙周膜细胞自噬水平1 h达峰值后又逐渐回落,至加力3 d期间Beclin-1及LC3Ⅱ的值都一直维持在基线水平以上。King等[2]对持续受压应力刺激后发生自噬的哺乳动物细胞应用激光共聚焦方法观测,提出自噬水平的降低过程可能是缘于受力后细胞骨架重排对压力所产生的适应。故笔者推测正畸力持续加载1 h后,牙周膜发生相应形变的同时,牙周膜细胞的细胞骨架可能发生了适应性改变,故自噬表达到达峰值后逐渐降低,但由于机械压力的一直存在使得1 h后Beclin-1及LC3Ⅱ的表达仍无法回落到正常水平。这点在Ma等[3]的研究中得到验证,细胞持续性受到机械刺激,自噬长时间高于基线水平。
图 5. 各组压力区牙周膜中LC3Ⅱ观察 免疫组织化学染色 × 400.
Fig 5 Observation of LC3Ⅱ in periodontal ligament of the pressure areas of every group immunohistochemical staining × 400
a为对照组,b~j分别为实验组加力15 min、30 min、1 h、2 h、4 h、12 h、1 d、3 d、7 d。A:牙槽骨,R:牙根。图中红色箭头示破骨细胞。
研究[4]表明,缺氧缺血条件下,细胞能量供给不足,自噬激活,分解细胞成分以提供能量,利于细胞的代谢和生存。持续正畸压力将使牙周膜内的血管受压、管径变小甚至破坏溶解,从而引起牙周膜细胞营养—废物代谢障碍,导致压力区牙周膜细胞处于营养“饥饿”的环境中。本研究中长时间压力作用使牙周膜细胞所处“饥饿”环境愈发恶劣,那么在牙周膜形变适应压力而自噬水平降低的过程中,“饥饿”刺激不断加重,持续诱发自噬,由此笔者认为“饥饿”可能也是压力区牙周膜细胞自噬水平无法恢复到正常水平的缘由之一。
Ma等[3]的体外研究表明,细胞受持续性应激时,一旦自噬过度则引发细胞凋亡。Chen等[8]研究发现,持续应激条件下自噬水平达峰值时,凋亡蛋白明显表达并随时间延长而逐渐增多。本研究中,加力至1 d时压力区牙周膜开始出现透明样变,加力3~7 d时牙周膜细胞数量明显减少,7 d时Beclin-1及LC3Ⅱ蛋白表达减少至基线水平,提示压力区牙周膜细胞凋亡发生。因此笔者推测大鼠正畸牙移动过程中,持续的机械压力刺激诱发自噬,自噬1 h达峰值时可能已有少量凋亡因子的表达。而在长时间正畸压力刺激和逐渐加重的“饥饿”刺激的双重作用下,牙周膜细胞可能自噬过度引起凋亡反应扩大,最终介导牙周膜透明样变的发生。
缺氧条件下,破骨细胞生物学作用的正常发挥也需要自噬参与[10],自噬不仅能提供破骨细胞分化成熟所需的能量[11],还能通过促进炎症因子的激活和释放[12]而介导破骨细胞的成熟和功能发挥[13]。本研究中可见自噬相关蛋白在破骨细胞中表达,这在一定程度上验证了自噬与破骨细胞之间存在某些联系。Mariño等[7]提出,自噬能介导吞噬细胞的聚集并消化死细胞,而透明样变可募集破骨细胞以吸收相邻的骨质和坏死性透明组织,当破骨细胞将坏死组织清除后,牙齿移动[1]。本研究中,自噬水平在1 d时又小幅上升,此时破骨细胞也开始在透明样变区域周围聚集,且数量不断增多,可见自噬积极介导了透明样变区域附近的破骨细胞募集。
综上,自噬参与了大鼠正畸牙移动压力区牙周膜改建过程,可能介导牙周膜细胞代谢生存的维持和透明样变的发生,并影响破骨细胞生物学作用。但因体内研究的条件限制,机械压力刺激与“饥饿”刺激各自诱导牙周膜细胞的自噬变化效应叠加,无法明确区分,二者激活牙周膜细胞自噬的分子机制还有待体外细胞研究的进一步阐明。本研究周期较短,压力区牙周膜细胞自噬水平的远期变化、自噬与透明样变的后期转归和破骨细胞三者之间的相关性也需进一步深入研究。
Funding Statement
[基金项目] 泸州市科学技术和人才工作局应用基础研究(2018-JYJ-37);泸州市-西南医科大学联合项目(2016LZXNYD-T04);西南医科大学青年基金(2016136)
Supported by: Applied Basic Research of Office of Science and Technology and Talent Work of Luzhou (2018-JYJ-37); Joint Project of Luzhou-Southwest Medical University (2016LZXNYD-T04); Youth Fund of Southwest Medical University (2016136).
References
- 1.Dutra EH, Nanda R, Yadav S. Bone response of loaded periodontal ligament[J] Curr Osteoporos Rep. 2016;14(6):280–283. doi: 10.1007/s11914-016-0328-x. [DOI] [PubMed] [Google Scholar]
- 2.King JS, Veltman DM, Insall RH. The induction of autophagy by mechanical stress[J] Autophagy. 2011;7(12):1490–1499. doi: 10.4161/auto.7.12.17924. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Ma KG, Shao ZW, Yang SH, et al. Autophagy is activated in compression-induced cell degeneration and is mediated by reactive oxygen species in nucleus pulposus cells exposed to compression[J] Osteoarthritis Cartilage. 2013;21(12):2030–2038. doi: 10.1016/j.joca.2013.10.002. [DOI] [PubMed] [Google Scholar]
- 4.Baskaran R, Poornima P, Priya LB, et al. Neferine prevents autophagy induced by hypoxia through activation of Akt/mTOR pathway and Nrf2 in muscle cells[J] Biomed Pharmacother. 2016;83:1407–1413. doi: 10.1016/j.biopha.2016.08.063. [DOI] [PubMed] [Google Scholar]
- 5.Huang ZJ, Fang WL, Liu WH, et al. Aspirin induces Beclin-1-dependent autophagy of human hepatocellular carcinoma cell[J] Eur J Pharmacol. 2018;823:58–64. doi: 10.1016/j.ejphar.2018.01.031. [DOI] [PubMed] [Google Scholar]
- 6.Adiseshaiah PP, Skoczen SL, Rodriguez JC, et al. Autophagy monitoring assay Ⅱ: imaging autophagy induction in LLC-PK1 cells using GFP-LC3 protein fusion construct[J] Methods Mol Biol. 2018;1682:211–219. doi: 10.1007/978-1-4939-7352-1_18. [DOI] [PubMed] [Google Scholar]
- 7.Mariño G, Niso-Santano M, Baehrecke EH, et al. Self-consumption: the interplay of autophagy and apoptosis[J] Nat Rev Mol Cell Biol. 2014;15(2):81–94. doi: 10.1038/nrm3735. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Chen X, Wu JX, You XJ, et al. Cold ischemia-induced autophagy in rat lung tissue[J] Mol Med Rep. 2015;11(4):2513–2519. doi: 10.3892/mmr.2014.2999. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Rody WJ, King GJ, Gu GM. Osteoclast recruitment to sites of compression in orthodontic tooth movement[J] Am J Orthod Dentofacial Orthop. 2001;120(5):477–489. doi: 10.1067/mod.2001.118623. [DOI] [PubMed] [Google Scholar]
- 10.Zhao Y, Chen G, Zhang W, et al. Autophagy regulates hypoxia-induced osteoclastogenesis through the HIF-1α/BNIP3 signaling pathway[J] J Cell Physiol. 2012;227(2):639–648. doi: 10.1002/jcp.22768. [DOI] [PubMed] [Google Scholar]
- 11.Shi J, Wang L, Zhang HY, et al. Glucocorticoids: dose-related effects on osteoclast formation and function via reactive oxygen species and autophagy[J] Bone. 2015;79:222–232. doi: 10.1016/j.bone.2015.06.014. [DOI] [PubMed] [Google Scholar]
- 12.Wu DJ, Adamopoulos IE. Autophagy and autoimmunity[J] Clin Immunol. 2017;176:55–62. doi: 10.1016/j.clim.2017.01.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Wijekoon S, Bwalya EC, Fang J, et al. Chronological differential effects of pro-inflammatory cytokines on RANKL-induced osteoclast differentiation of canine bone marrow-derived macrophages[J] J Vet Med Sci. 2017;79(12):2030–2035. doi: 10.1292/jvms.17-0393. [DOI] [PMC free article] [PubMed] [Google Scholar]