Abstract
目的
探讨当归多糖(ASP)对高糖状态下大鼠骨髓间充质干细胞(BMSCs)成骨向分化的影响。
方法
培养并收集第3代BMSCs进行成骨成脂分化诱导鉴定。将BMSCs分为3组进行培养:正常对照组(葡萄糖浓度5.5 mmol·L-1)、高糖组(葡萄糖浓度25.5 mmol·L-1)、ASP+高糖组(葡萄糖浓度25.5 mmol·L-1+40 mg·L-1 ASP)。CCK8检测各组BMSCs的增殖活性,茜素红染色和碱性磷酸酶活性检测成骨活性。实时荧光定量聚合酶链反应检测成骨标记基因Runt相关转录因子2(Runx-2)、锌指结构转录因子(Osx)、骨钙蛋白(OCN)、Ⅰ型胶原酶(COL-Ⅰ)mRNA及Wnt/β-catenin信号通路关键因子CyclinD1及β-catenin的mRNA表达。建立2型糖尿病大鼠模型,将大鼠分为3组:正常对照组(正常大鼠)、糖尿病组(糖尿病大鼠)、糖尿病+ASP组(糖尿病大鼠,ASP喂养),制备大鼠胫骨骨缺损,进行组织学检测,观察骨缺损修复情况。
结果
高糖组、ASP+高糖组的BMSCs增殖高于正常对照组(P<0.05),高糖组和ASP+高糖组二者之间无统计学差异(P>0.05)。高糖组中BMSCs钙结节数量、碱性磷酸酶活性及Runx-2、OCN、Osx、COL-Ⅰ、CyclinD1、β-catenin的mRNA表达均低于正常对照组和ASP+高糖组(P<0.05),正常对照组和ASP+高糖组之间无统计学差异(P<0.05)。组织学检测结果显示,糖尿病组骨小梁数量少于正常对照组和糖尿病+ASP组(P<0.05),而正常对照组和糖尿病+ASP组二者之间无统计学差异(P>0.05)。
结论
ASP可促进高糖状态下大鼠BMSCs的成骨分化及2型糖尿病大鼠的骨缺损修复,这种促进作用可能与Wnt/β-catenin信号通路的激活有关。
Keywords: 当归多糖, 骨髓间充质干细胞, 成骨分化, 2型糖尿病
Abstract
Objective
This study aims to evaluate the effect of Angelica sinensis polysaccharide (ASP) on the osteogenic differentiation of the bone marrow mesenchymal stem cells (BMSCs) of rats with high glucose levels.
Methods
Rat BMSCs were isolated and identified by osteogenic and adipogenic differentiation. Then, the BMSCs were divided into three groups as follows: normal control group (5.5 mmol·L-1 glucose), high glucose group (25.5 mmol·L-1 glucose), and ASP+high glucose group (25.5 mmol·L-1 glucose +40 mg·L-1 ASP). The proliferation activities of the BMSCs were detected by CCK8. Alizarin red staining, and alkaline phosphatase activity were used in the examination of osteogenic activity. Quantitative real time-polymerase chain reaction was used to detect the expression levels of the osteogenic genes (Runx2, Osx, OCN, Col-Ⅰ) and the key factors of Wnt/β-catenin signal pathway (CyclinD1, β-catenin). In vivo, a type 2 diabetes rat model was established. The rats were divided into three groups, namely, the normal control group (normal rats), diabetes group (diabetic rats), diabetes+ASP group (diabetic rats, ASP feeding). Then, the tibia bone defect was established. The repair of bone defects in each group was observed through histological examination.
Results
The proliferation of BMSCs was higher in the high glucose group and ASP+high glucose group than in the normal control group (P<0.05). No significant difference was observed between the high glucose group and ASP+high glucose group (P>0.05). The number of calcium nodules of BMSCs; alkaline phosphatase activity; and the mRNA expression of Runx2, OCN, Osx, Col-Ⅰ, CyclinD1, β-catenin in the high glucose group were lower than those in the normal control and ASP+high glucose groups (P<0.05). No significant difference was observed between the normal control and ASP+high glucose groups (P>0.05). The bone mass was significantly lower in the bone defect of the diabetes group than in the bone defect of the normal control or diabetes+ASP group (P<0.05). No statistical difference was found between the normal control and diabetes+ASP groups (P>0.05).
Conclusion
ASP can promote the osteogenic differentiation of rat BMSCs under high glucose culture and induce bone regeneration in rats with type 2 diabetes. These features may be related to the activation of the Wnt/β-catenin signaling pathway.
Keywords: Angelica sinensis polysaccharide, bone marrow mesenchymal stem cells, osteogenic differentiation, type 2 diabetes mellitus
糖尿病(diabetes mellitus)作为一种代谢紊乱综合征,主要是由于胰岛素分泌缺陷和胰岛素受体受损导致的胰岛素分泌不足和胰岛素敏感性降低,临床表现为血糖水平升高。糖尿病的发病率高[1]–[2],可以导致人体多个系统的慢性损害,如视网膜、神经、血管、肾脏以及骨骼病变等[3]。糖尿病的骨胳病变表现为骨质疏松、骨愈合障碍等,导致牙槽骨快速吸收、拔牙创愈合迟缓等不良后果[4],从而影响糖尿病患者的骨再生修复和牙种植修复。因此,探索促进糖尿病患者口腔颅颌面部骨再生修复的方法具有重要的临床意义。
近年来由于新药资源的寻找与开发,中药多糖的研究越来越受到重视。当归是我国广泛应用的一种中药。研究表明,当归提取物可以预防卵巢摘除诱导的骨丢失,功效与雌激素相当[5]。此外,当归提取物能够直接刺激人成骨细胞增殖,并以剂量依赖性方式增加碱性磷酸酶(alkaline phosphatase,ALP)活性,促进Ⅰ型胶原酶(typeⅠ collagenase,COL-Ⅰ)[6]。当归多糖(Angelica sinensis polysaccharide,ASP)是当归的主要生物活性成分,具有造血、免疫调节、保肝及抗氧化活性等功能[7]–[10],其作为当归的单体之一,对成骨相关细胞有何作用目前鲜有报道。此外,研究[11]表明,ASP能够缓解脂肪肝,降低血糖水平及改善胰岛素抵抗,提示ASP可能是治疗糖尿病的潜在药物。本研究通过体内外实验探讨ASP在高糖状态下对大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)增殖分化的影响,以及ASP对2型糖尿病大鼠骨缺损修复的作用,为研究ASP促进糖尿病状态下的骨再生提供实验理论基础。
1. 材料和方法
1.1. 实验动物及试剂
2月龄Sprague-Dawley(SD)大鼠30只,雌雄不限,体重约250 g,由四川大学华西医学实验动物中心提供。低糖α-MEM培养液、胎牛血清(fetal bovine serum,FBS)、双抗(青霉素、链霉素)、胰蛋白酶、Ⅰ型胶原酶(Gibco公司,美国),成骨成脂诱导液、茜素红染色液、油红O染色液(广州赛业生物科技有限公司),Trizol试剂、PrimeScript®RT反转录试剂盒、SYBR® Premix Ex Taq™ Ⅱ试剂盒(Takara公司,日本),Cell Counting Kit-8(CCK-8)试剂盒(Dojindo公司,日本),ALP试剂盒(南京建成生物工程研究所),链脲佐菌素(STZ)(Sig-ma公司,美国)。按10%FBS、1%双抗、89%低糖α-MEM培养液(葡萄糖浓度5.5 mmol·L-1)的比例配制正常细胞培养基,按葡萄糖浓度25.5 mmol·L-1加入正常细胞培养基中配制高糖细胞培养基。
1.2. 细胞培养及成骨成脂分化
取2月龄SD大鼠6只,10%水合氯醛麻醉处死,75%乙醇浸泡消毒5~10 min。无菌剪开皮肤及皮下组织,剥离肌肉,分离双侧股骨、胫骨,取下骨块后立即用大量含双抗PBS液冲洗。用血管钳钳住骨块,骨剪剪去两端,暴露骨髓腔,露出微红骨髓。5 mL注射器吸取5 mL含10%胎牛血清的α-MEM插入骨髓腔缓慢加压,冲出红色物质,继续反复冲洗骨髓腔直至骨块颜色变白。将培养皿中含骨髓全血的培养液吸入培养瓶中,37 °C、5%CO2培养箱中培养,每3 d换液1次,显微镜下观察细胞的生长状态,细胞生长达90%时,1︰3进行传代,取第3代细胞用于后续实验。
成骨分化诱导:收集生长对数期细胞,以2×104个·cm-2的密度接种于6孔板中,接种后加入完全培养液,置于37 °C、5% CO2的培养箱中静置培养。24 h后弃去培养基,每孔加入2 mL成骨诱导液继续培养,每3 d更换1次成骨诱导液,诱导时间为3周。3周后,去除培养基,PBS漂洗,每孔中加入2 mL 4%多聚甲醛固定30 min。吸取固定液,PBS漂洗,每孔中加入茜素红染液,室温染色30 min,去除染色液,PBS漂洗,显微镜下拍照。
成脂分化诱导:收集生长对数期细胞,以2×104个·cm-2的密度接种于6孔板中,当细胞生长至完全融合后弃培养液,更换成脂诱导液A。3 d后,弃去诱导液A,更换保持液B,1 d后再次换诱导液A诱导,诱导时间为2周。2周后,去除培养基,PBS漂洗,每孔中加入2 mL 4%多聚甲醛固定30 min。吸取固定液,PBS漂洗,每孔中加入油红O染液,室温染色30 min,去除染色液,PBS漂洗,显微镜下拍照。
1.3. CCK-8检测
将第3代BMSCs细胞悬液以3×103个·孔-1接种于96孔板中(n=3),在96孔板受试孔的四周均加入PBS。24 h细胞贴壁后用无血清培养基培养过夜,次日分别用不同葡萄糖浓度的培养基进行培养。根据培养基将细胞分为3组:正常对照组(葡萄糖浓度5.5 mmol·L-1)、高糖组(葡萄糖浓度25.5 mmol·L-1)、ASP+高糖组(葡萄糖浓度25.5 mmol·L-1+40 mg·L-1 ASP)。各组细胞分别培养24、48、72 h后,吸净96孔内的培养基,每孔加入10 µL CCK-8溶液和90 µL无血清培养基,将孔板继续孵育2 h后,酶标仪在450 nm波长处进行光密度(optical density,OD)值检测。
1.4. 茜素红染色
将第3代BMSCs细胞悬液以2×104个·孔-1的细胞密度接种于6孔板中(n=3),24 h细胞贴壁后使用无血清培养基培养过夜,次日分别使用不同葡萄糖浓度的成骨诱导培养基进行培养。细胞分组同1.3中的分组。诱导3周后,行茜素红染色及半定量分析,茜素红染色方法同1.2中的成骨分化实验步骤,采用QUANTITY ONE软件(Bio-Rad)进行半定量分析。
1.5. ALP活性检测
同1.4中将BMSCs按照不同分组进行成骨诱导3周后,使用0.25%胰酶常规消化待测各组细胞,反复冻融法破碎细胞后,根据ALP活性检测说明书操作步骤进行检测,在520 nm波长下测定各组OD值。
1.6. 实时荧光定量聚合酶链反应(quantitive real time-polymerase chain reaction,qRT-PCR)
同1.4中,各组BMSCs成骨诱导1、3周后,使用Trizol试剂盒提取细胞总RNA,利用PrimeScript® RT反转录试剂盒合成cDNA,使用SYBR Green荧光定量聚合酶链检测试剂盒进行qRT-PCR,相关基因引物序列均由大连宝生物科技有限公司合成。检测成骨标记基因Runt相关转录因子2(runt-related transcription factor-2,Runx-2)、锌指结构转录因子(zinc finger structure transcription factor,Osx)、骨钙蛋白(osteocalcin,OCN)、COL-Ⅰ mRNA的表达,同时检测Wnt/β-catenin信号通路关键因子CyclinD1及β-catenin的mRNA表达。以GAPDH作为内参基因。2 -ΔΔCt值法对所得数据进行计算和分析。相关基因引物序列见表1。
表 1. 基因引物序列.
Tab 1 Sequences of primers
| 基因 | 引物序列(5′-3′) |
| Runx2 | F:GCGGACGAGGCAAGAGTT |
| R:TTGGTGCTGAGTTCAGGGAG | |
| Osx | F:CTGTGAAACCTCAAGTCCTATGGA |
| R:GCTCTGCAGTCAAGGGAGATG | |
| OCN | F:CAGGTGCAAAGCCCAGCGACT |
| R:AGGGGATCTGGGTAGGGGGCT | |
| Col-Ⅰ | F:CCACCTGCCTCTGGCTTCT |
| R:AGCTGTGGAGGAGGGTTTCA | |
| β-catenin | F:TGGCAACCAAGAAAGCAAG |
| R:CTGAACAAGAGTCCCAAGGAG | |
| CyclinD1 | F:CCCTCGGTGTCCTACTTCA |
| R:GTTTGTTCTCCTCCGCCTCT | |
| GAPDH | F:AGACCTTCAACACCCCAG |
| R:CACGATTTCCCTCTCAGC |
1.7. 2型糖尿病大鼠模型建立及胫骨骨缺损制备
2型糖尿病大鼠模型的建立:给予高脂高糖饲料喂养大鼠2周,空腹12 h后,给予大鼠腹腔注射链脲佐菌素(35 mg·kg-1),注射后恢复大鼠正常饮水及高脂高糖饲料喂养。72 h后取大鼠尾静脉血,检测随机血糖,筛选血糖水平大于16.7 mmol·L-1的大鼠视为2型糖尿病大鼠[12]。
将24只SD大鼠分为3组:正常对照组(正常大鼠)、糖尿病组(糖尿病大鼠)、糖尿病+ASP组(糖尿病大鼠),每组各8只。3组大鼠均进行胫骨骨缺损的制备。具体方法:首先无菌切开大鼠双侧胫骨骨骺端的皮肤皮下组织,暴露骨骺端,在内侧面距离生长板1 mm处,使用慢速牙科电钻制备直径2 mm、深及骨髓腔的圆形骨缺损,不穿通对侧骨皮质,使用生理盐水冲洗降温,术后分层缝合皮肤及皮下组织,1%聚维酮碘消毒术区。术后连续3 d给予大鼠肌肉注射青霉素预防感染,每次20万单位,每天2次。
根据分组,糖尿病+ASP组大鼠每天320 mg·kg-1的ASP经口喂养[11],正常对照组及糖尿病组大鼠每天10 mL·kg-1的蒸馏水喂养。
1.8. 组织学检测
3周后,过量麻醉处死大鼠,取双侧胫骨浸泡在4%多聚甲醛液中固定48 h,冲洗标本,用10%EDTA脱钙液脱钙60 d,70%~100%乙醇梯度脱水,石蜡包埋,连续切片,厚度为5 µm,进行Masson染色。镜下采集图片并使用双盲法进行定量分析,每组随机选3张切片,每张切片在100倍镜下随机选取3个视野,使用Image-Pro Plus软件对骨组织缺损区内的骨小梁面积进行计算,并计算其与视野总面积的比值。
1.9. 统计学分析
采用SPSS 13.0软件对数据进行统计分析。整体比较采用方差分析,组间两两多重比较采用LSD法。检验水准为P=0.05,P<0.05为差异具有统计学意义。
2. 结果
2.1. 细胞培养及成骨成脂分化
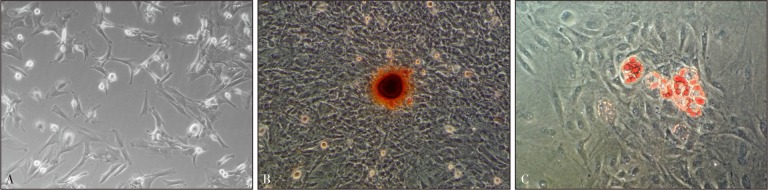
提取的原代细胞于24~48 h开始贴壁,细胞尚未完全伸展;48~72 h,贴壁细胞呈多角形、长梭形、纺锤形生长;约1周后,细胞长满培养瓶壁。传代后,细胞生长明显加快,3~4 d长满培养瓶底,连续传代后细胞形态未见明显改变,无自发性分化现象(图1A)。对传代后的细胞进行成骨诱导后,茜素红染色可见钙结节形成(图1B);成脂诱导后可见脂滴形成(图1C)。这证明所提取的细胞为具有多向分化能力的BMSCs。
图 1. 大鼠BMSCs及成骨成脂分化 倒置显微镜 × 100.
Fig 1 Rat BMSCs and osteogenic as well as adipogenic differentiation inverted microscope × 100
A:第3代BMSCs;B:钙结节形成,茜素红染色;C:脂滴形成,油红O染色。
2.2. CCK-8检测
CCK-8检测结果(图2)显示,高糖组、ASP+高糖组的BMSCs增殖高于正常对照组(P<0.05),而高糖组和ASP+高糖组二者之间无统计学差异(P>0.05)。
图 2. 各组BMSCs增殖(CCK-8).
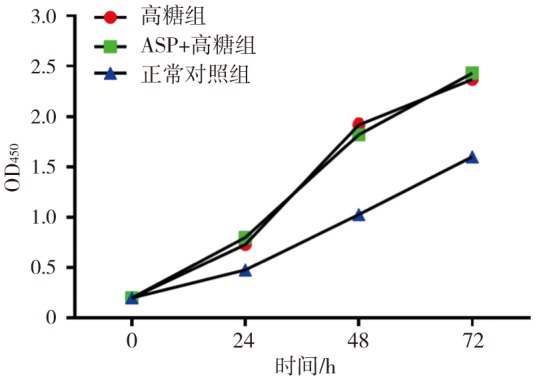
Fig 2 BMSCs proliferation (CCK-8) of every group
2.3. 茜素红染色
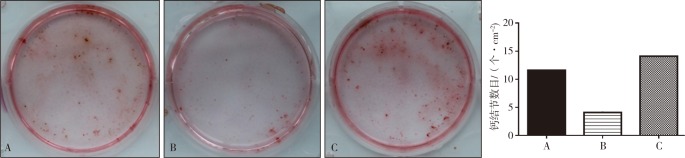
茜素红染色及半定量分析结果见图3。茜素红染色显示,高糖组BMSCs的钙结节较正常对照组和ASP-高糖组减少(P<0.05),而正常对照组和ASP+高糖组之间差异无统计学意义(P>0.05)。半定量分析结果显示,高糖组中的钙结节数量低于正常对照组和APS+高糖组,差异均具有统计学意义(P<0.05);正常对照组和ASP+高糖组二者之间无统计学差异(P>0.05)。
图 3. 各组茜素红染色及半定量分析.
Fig 3 Alizarin red staining and semi-quantitative analysis of every group
左:茜素红染色;右:半定量分析。A、B、C分别为正常对照组、高糖组、ASP+高糖组。
2.4. ALP活性检测
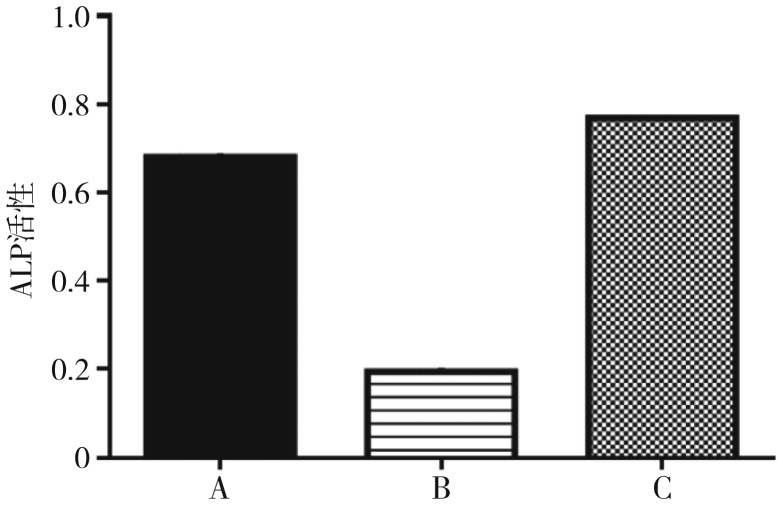
ALP活性检测结果见图4。高糖组BMSCs的ALP活性低于正常对照组和ASP+高糖组,差异具有统计学意义(P<0.05);正常对照组和ASP+高糖组二者之间无统计学差异(P>0.05)。
图 4. 各组ALP活性检测.
Fig 4 The ALP activity assay of every group
A、B、C分别为正常对照组、高糖组、ASP+高糖组。
2.5. qRT-PCR检测
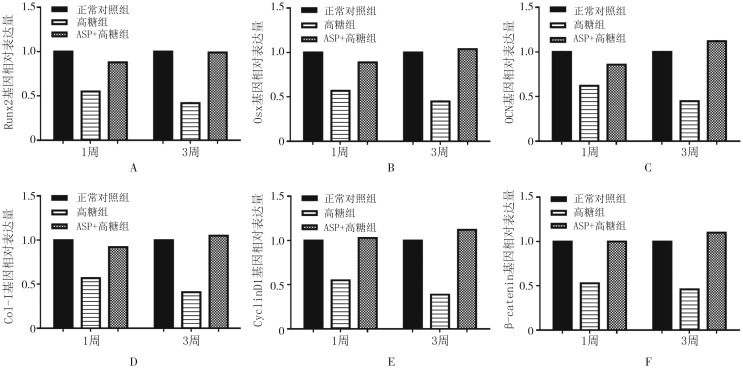
qRT-PCR检测结果(图5)显示,成骨诱导1、3周,高糖组中Runx2、OCN、Osx、Col-Ⅰ、CyclinD1及β-catenin的mRNA表达均低于正常对照组、ASP+高糖组,差异有统计学意义(P<0.05);正常对照组与ASP+高糖组间无统计学差异(P>0.05)。
图 5. 各组相关基因的表达.
Fig 5 Relative mRNA levels of every group
A:Runx2;B:Osx;C:OCN;D:Col-Ⅰ;E:CyclinD1;F:β-catenin。
2.6. 组织学检测
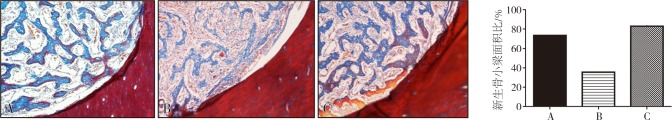
Masson染色结果显示,糖尿病组骨小梁数量、骨基质中红染胶原纤维数量显著少于正常对照组和糖尿病+ASP组,且骨小梁宽度较细,排列稀疏;正常对照组和糖尿病+ASP组间无明显差异(图6A)。
图 6. 各组Masson染色及半定量分析.
Fig 6 Masson staining and semi-quantitative analysis of every group
左:Masson染色 ×10;右:半定量分析(新生骨小梁面积比)。A、B、C分别为正常对照组、糖尿病组、糖尿病+ASP组。
半定量分析结果显示,糖尿病组新生骨小梁面积与视野总面积比值小于正常对照组和糖尿病+ASP组,差异具有统计学意义(P<0.05);正常对照组和糖尿病+ASP组二者之间无统计学差异(P>0.05)(图6B)。
3. 讨论
糖尿病骨病主要是骨代谢及钙磷代谢的紊乱,从而引起继发性骨量减少及骨质疏松等糖尿病性骨病。患者颌骨往往表现出相应的变化,如牙槽骨的丧失及颌骨的骨质疏松,从而影响口腔颌骨手术创口的愈合。首先,高血糖状态下对成骨细胞有直接的毒性作用,抑制成骨细胞的分化,对骨基质及其组成成分的产生也有不利影响[13]–[14]。其次,高血糖的渗透性利尿作用致使大量的钙、镁、磷等离子被排出体外,导致其血液中的含量降低,矿物质失衡[15]。当血液中钙磷浓度下降后,会改变甲状旁腺激素的反馈调节,促使骨组织中的钙释放入血,造成钙质进一步流失[16]。此外,糖尿病还能引起多种炎症因子的水平升高,如白细胞介素、环氧酶、前列腺素和肿瘤坏死因子等促炎因子,从而调节破骨细胞分化,引起骨吸收[17]–[18]。因此,对糖尿病患者的颌骨缺损修复,首先应控制患者的血糖水平,减少骨吸收。
中药自有药典记载以来,已有几千年的使用历史,其取自天然植物,具有多靶点作用、全身调理、毒副作用小等优点。当归是我国广泛应用的中药之一,具有促进骨形成抑制骨吸收的作用[5]–[6]。ASP是中药当归的主要生物活性成分,能缓解脂肪肝,降低血糖水平及改善胰岛素抵抗[11]。而ASP能否对骨代谢产生影响,尤其是对高糖状态下成骨作用的影响鲜有报道。因此,本实验通过体外研究高糖状态下ASP对BMSCs增殖分化的影响,以及体内研究ASP对2型糖尿病大鼠骨缺损修复的作用,为进一步研究ASP在糖尿病状态下的骨再生提供实验基础。
糖尿病体内模型的建立,目前已经比较成熟,是通过注射链脲佐菌素来诱导糖尿病模型。而对体外模拟高糖状态,本实验参考国外文献[19]报道,分别取含5.5、25.5 mmol·L-1浓度葡萄糖的培养基进行细胞培养。实验中首先通过CCK-8检测BMSCs细胞周期,结果表明不同糖浓度对细胞增殖能力的影响不同。相比5.5 mmol·L-1正常葡萄糖浓度,25.5 mmol·L-1的高糖浓度能显著促进细胞的增殖(P<0.05),而加入ASP后对于高糖状态下BMSCs的增殖能力无明显影响。理论上讲,当血糖浓度过高时,将会对细胞产生毒性作用,从而细胞的增殖受到抑制甚至凋亡。而本实验中高糖状态下72 h以内,却明显促进了细胞增殖。笔者认为这可能是由于细胞在短时间内和一定范围内能够代偿高糖环境,而高糖为细胞生长提供了足够能量,暂时促进了细胞的增殖。接下来本实验检测了ASP对高糖状态下BMSCs成骨分化的影响,结果显示高糖环境对BMSCs成骨作用产生了抑制,与其他学者[20]的研究结果基本一致。本实验同样在使用ASP进行干预后,发现BMSCs的成骨作用发生逆转,说明了ASP可以通过调节成骨相关标记物Runx2、OCN、Osx及Col-Ⅰ的mRNA表达来逆转高糖引起的BMSCs成骨能力降低。
Wnt/β-catenin信号通路已被证实在调节细胞增殖、分化中具有重要作用。研究[21]–[22]表明,在BMSCs成骨或成脂向分化过程中,Wnt/β-catenin信号通路具有重要作用。此外,CyclinD1蛋白是重要的细胞周期调控蛋白。细胞周期包括G1、S、G2、M四个时相,正常情况下,Wnt/β-catenin信号通路激活后可促进CyclinD1的基因转录,导致CyclinD1蛋白表达增多。本研究对经典的Wnt/β-catenin信号通路关键因子CyclinD1及β-catenin的mRNA表达进行了检测,结果表明,高糖组CyclinD1及β-catenin的mRNA表达较正常对照组显著下降,而ASP+高糖组CyclinD1及β-catenin的mRNA表达较高糖组逆转,显著增加,差异具有统计学意义(P<0.05)。该结果提示,高糖状态能抑制Wnt/β-catenin信号通路的激活,而ASP可能通过激活Wnt/β-catenin信号通路逆转高糖对BMSCs造成的成骨能力下降,从而促进其成骨分化。
体内实验通过建立2型糖尿病大鼠模型,研究了ASP对2型糖尿病大鼠骨缺损修复的影响。结果显示,未经ASP干预的2型糖尿病大鼠骨缺损内骨组织修复情况差于ASP干预的2型糖尿病组大鼠。研究[11]表明,ASP能够缓解脂肪肝,降低血糖水平及改善胰岛素抵抗。本实验中建立的2型糖尿病模型,通过ASP干预后,可能通过降低血糖水平,改善胰岛素抵抗来改善骨骼状态,从而促进骨组织修复。
本研究通过检测ASP对高糖状态下BMSCs增殖分化能力的影响,发现ASP能促进高糖状态下BMSCs增殖,逆转高糖状态下BMSCs成骨能力的下降。ASP可能通过激活Wnt/β-catenin信号通路促进高糖状态下大鼠BMSCs的成骨分化。本实验结果为研究ASP促进糖尿病状态下的骨再生提供了实验理论基础。
Funding Statement
[基金项目] 国家自然科学基金(81621062);四川省科技创新团队项目(2017TD0016)
Supported by: The National Natural Science Foundation of China (81621062); Technology Innovation Team Project of Sichuan Province(2017TD0016).
References
- 1.American Diabetes Association. Diagnosis and classification of diabetes mellitus[J] Diabetes Care. 2014;37(Suppl 1):S81–S90. doi: 10.2337/dc14-S081. [DOI] [PubMed] [Google Scholar]
- 2.Goldenberg R, Punthakee Z. Definition, classification and diagnosis of diabetes, prediabetes and metabolic syndrome[J] Can J Diabetes. 2013;37(Suppl 1):S8–S11. doi: 10.1016/j.jcjd.2013.01.011. [DOI] [PubMed] [Google Scholar]
- 3.Spravchikov N, Sizyakov G, Gartsbein M, et al. Glucose effects on skin keratinocytes: implications for diabetes skin complications[J] Diabetes. 2001;50(7):1627–1635. doi: 10.2337/diabetes.50.7.1627. [DOI] [PubMed] [Google Scholar]
- 4.李 昊, 周 海伦, 王 琪, et al. 调节Lnk/干细胞因子-干细胞因子受体通路对糖尿病状态骨髓间充质干细胞成骨功能的影响[J] 华西口腔医学杂志. 2015;33(6):633–637. [Google Scholar]; Li H, Zhou HL, Wang Q, et al. Changes in bone marrow mesenchymal stem cells osteogenesis by the regulation of Lnk/stem cell factor-cKit signaling[J] West Chin J Stomatol. 2015;33(6):633–637. doi: 10.7518/hxkq.2015.06.017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Lim D, Kim Y. Anti-osteoporotic effects of angelica sinensis (oliv.) diels extract on ovariectomized rats and its oral toxicity in rats[J] Nutrients. 2014;6(10):4362–4372. doi: 10.3390/nu6104362. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Yang Q, Populo SM, Zhang JY, et al. Effect of Angelica sinensis on the proliferation of human bone cells[J] Clin Chim Acta. 2002;324(1/2):89–97. doi: 10.1016/s0009-8981(02)00210-3. [DOI] [PubMed] [Google Scholar]
- 7.Zhang S, He B, Ge JB, et al. Extraction, chemical analysis of Angelica sinensis polysaccharides and antioxidant activity of the polysaccharides in ischemia–reperfusion rats[J] Int J Biol Macromol. 2010;47(4):546–550. doi: 10.1016/j.ijbiomac.2010.07.012. [DOI] [PubMed] [Google Scholar]
- 8.Zhang Y, Li MM, Zeng F, et al. Study to establish the role of JAK2 and SMAD1/5/8 pathways in the inhibition of hepcidin by polysaccharides from Angelica sinensis[J] J Ethnopharmacol. 2012;144(2):433–440. doi: 10.1016/j.jep.2012.09.040. [DOI] [PubMed] [Google Scholar]
- 9.Wang KP, Zeng F, Liu JN, et al. Inhibitory effect of polysaccharides isolated from Angelica sinensis on hepcidin expression[J] J Ethnopharmacol. 2011;134(3):944–948. doi: 10.1016/j.jep.2011.02.015. [DOI] [PubMed] [Google Scholar]
- 10.Jin ML, Zhao K, Huang QS, et al. Isolation, structure and bioactivities of the polysaccharides from Angelica sinensis (Oliv.) Diels: A review[J] Carbohydrate Polymers. 2012;89(3):713–722. doi: 10.1016/j.carbpol.2012.04.049. [DOI] [PubMed] [Google Scholar]
- 11.Wang KP, Cao P, Wang HX, et al. Chronic administration of Angelica sinensis polysaccharide effectively improves fatty liver and glucose homeostasis in high-fat diet-fed mice[J] Sci Rep. 2016;6(1):26229. doi: 10.1038/srep26229. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Srinivasan K, Viswanad B, Asrat L, et al. Combination of high-fat diet-fed and low-dose streptozotocin-treated rat: A model for type 2 diabetes and pharmacological screening[J] Pharmacol Res. 2005;52(4):313–320. doi: 10.1016/j.phrs.2005.05.004. [DOI] [PubMed] [Google Scholar]
- 13.Balint E, Szabo P, Marshall CF, et al. Glucose-induced inhibition of in vitro bone mineralization[J] Bone. 2001;28(1):21–28. doi: 10.1016/s8756-3282(00)00426-9. [DOI] [PubMed] [Google Scholar]
- 14.Terada M, Inaba M, Yano Y, et al. Growth-inhibitory effect of a high glucose concentration on osteoblast-like cells[J] Bone. 1998;22(1):17–23. doi: 10.1016/s8756-3282(97)00220-2. [DOI] [PubMed] [Google Scholar]
- 15.Carnevale V, Romagnoli E, D'Erasmo E. Skeletal involvement in patients with diabetes mellitus[J] Diabetes Metab Res Rev. 2004;20(3):196–204. doi: 10.1002/dmrr.449. [DOI] [PubMed] [Google Scholar]
- 16.Hofbauer LC, Brueck CC, Singh SK, et al. Osteoporosis in patients with diabetes mellitus[J] J Bone miner Res. 2007;22(9):1317–1328. doi: 10.1359/jbmr.070510. [DOI] [PubMed] [Google Scholar]
- 17.Colombo JS, Balani D, Sloan AJ, et al. Delayed osteoblast differentiation and altered inflammatory response around implants placed in incisor sockets of type 2 diabetic rats[J] Clin Oral Implants Res. 2011;22(6):578–586. doi: 10.1111/j.1600-0501.2010.01992.x. [DOI] [PubMed] [Google Scholar]
- 18.Wongdee K, Charoenphandhu N. Osteoporosis in diabetes mellitus: Possible cellular and molecular mechanisms[J] World J Diabetes. 2011;2(3):41–48. doi: 10.4239/wjd.v2.i3.41. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Fang SH, Jin YH, Zheng HX, et al. High glucose condition upregulated Txnip expression level in rat mesangial cells through ROS/MEK/MAPK pathway[J] Mol Cell Biochem. 2011;347(1/2):175–182. doi: 10.1007/s11010-010-0626-z. [DOI] [PubMed] [Google Scholar]
- 20.Gopalakrishnan V, Vignesh RC, Arunakaran J, et al. Effects of glucose and its modulation by insulin and estradiol on BMSC differentiation into osteoblastic lineages[J] Biochem Cell Biol. 2006;84(1):93–101. doi: 10.1139/o05-163. [DOI] [PubMed] [Google Scholar]
- 21.Day TF, Guo XZ, Garrett-Beal L, et al. Wnt/β-catenin signaling in mesenchymal progenitors controls osteoblast and chondrocyte differentiation during vertebrate skeletogenesis[J] Dev Cell. 2005;8(5):739–750. doi: 10.1016/j.devcel.2005.03.016. [DOI] [PubMed] [Google Scholar]
- 22.Rodda SJ, McMahon AP. Distinct roles for Hedgehog and canonical Wnt signaling in specification, differentiation and maintenance of osteoblast progenitors[J] Development. 2006;133(16):3231–3244. doi: 10.1242/dev.02480. [DOI] [PubMed] [Google Scholar]