Abstract
目的
探讨地塞米松(DEX)是否可以影响腭中嵴上皮细胞(MES)PAR极性复合体基因的表达,并进一步扰乱其细胞极性而影响腭融合。
方法
将孕鼠随机分为对照组和DEX组,DEX组按6 mg·kg−1腹腔注射地塞米松磷酸钠注射液,对照组注射0.9%氯化钠0.1 mL。在E13.5、E14.0、E14.5、E15.5、E17.5断颈处死孕鼠获取腭胚突,观察腭裂的发生情况,并通过苏木精-伊红染色、扫描电子显微镜观察腭上皮的形态改变,通过免疫荧光染色、蛋白质印迹及实时荧光定量聚合酶链式反应检测PAR3、PAR6、aPKC基因和蛋白的表达。
结果
DEX组腭裂发生率为46.15%,对照组腭裂发生率为3.92%,DEX组的腭裂发生率高于对照组(χ2=24.335,P=0.00)。与对照组相比,DEX组腭胚突发育延迟且短小,腭中嵴上皮为非极性排列,只由单层的上皮细胞组成,腭胚突表面平坦,球状结构减少;PAR3和PAR6蛋白仅在腭上皮中表达,aPKC则表达于腭上皮和腭间充质中;PAR3、PAR6及aPKC基因的表达均减少。DEX在蛋白和基因水平下调PAR3、PAR6、aPKC的表达。
结论
DEX可以导致腭胚突的生长发育延迟,并造成PAR极性复合体在蛋白和基因水平的表达下降,从而使MES极性丧失导致腭裂。
Keywords: 腭裂, 腭胚突, 地塞米松, 细胞极性, PAR复合体
Abstract
Objective
This study aims to investigate whether dexamethasone (DEX) can down-regulate the PAR complex and disrupt the cell polarity in the palatal epithelium during palatal fusion.
Methods
Pregnant rats were randomly divided into control and DEX groups, which were injected intraperitoneally with 0.9% sodium chloride (0.1 mL) and DEX (6 mg·kg−1), respectively, every day from E10 to E12. The palatal epithelial morphology was observed using hematoxylin and eosin staining and scanning electron microscopy. Immunofluorescence staining, Western Blot analysis, and real-time polymerase chain reaction were performed to detect the expression of PAR3, PAR6, and aPKC.
Results
The incidence of cleft palate in DEX group (46.15%) was significantly higher than that in control group (3.92%), and the difference was statistically significant (χ2=24.335, P=0.00). DEX can also retard the growth of the palatal shelves and the short palatal shelves. The morphology and arrangement of MEE cells changed from polarized bilayer cells to nonpolarized monolayer ones. Additionally, the spherical structure decreased, which caused the cleft palate. PAR3 and PAR6 were only detected in the palatal epithelium, and aPKC was expressed in the palatal epithelium and mesenchyme. DEX can reduce the expression levels of PAR3, PAR6, and aPKC in the protein and gene levels.
Conclusion
DEX can down-regulate the complex gene expression in the MEE cells, thereby destroying the cell polarity and causing cleft palate.
Keywords: cleft palate, palatal shelves, dexamethasone, cell polarity, PAR complex
唇腭裂是一种颌面部常见的出生缺陷,发病率1/500~1/1 000[1]。唇腭裂的发病与地理因素、种族、遗传背景以及社会-经济地位有关。临床上根据有无全身其他生理及发育畸形,将唇腭裂分为综合征型唇腭裂和非综合征型唇腭裂。
地塞米松(dexamethasone,DEX)是糖皮质激素的一种,作为一种脂溶性激素可以透过细胞膜与细胞浆内的糖皮质激素受体结合介导发生反应[2]。现已经在建立DEX诱发小鼠先天性腭裂模型的基础上,应用蛋白质免疫印迹法(Western Blot)检测了其在腭裂发生过程的表达变化,同时利用原代培养的腭胚突间充质细胞,观察多种影响因素下细胞增殖与膜联蛋白和胞浆磷脂酶A2的关系,揭示了致畸剂DEX诱导腭裂的发病机制、关键环节以及作用途径。Claude等[3]研究表明,DEX可以通过调节细胞极性影响胆小管的发育,而紧密连接对于细胞极性的维持起着重要的作用,DEX还可以通过调节紧密连接的形成来控制乳腺细胞对于生长因子的极性反应[4]。在发育生物学上,细胞极性是细胞发挥许多功能的基础和必须条件,如细胞分裂[5]、受精卵细胞分裂为器官[6]、分子通过上皮细胞层的转运[7]等。因此,DEX在一定程度上可以通过调节细胞极性的变化来影响器官的发育。目前越来越多的研究[8]–[13]显示PAR极性复合体对于上皮细胞极性的建立和维持具有重要的作用。PAR极性蛋白复合物定位于细胞皮层,建立和维持细胞极性,同时指导细胞命运决定因子(cell fate determinant,CFD)在细胞中极性定位,并通过控制纺锤体的定位使后代中仅有一个子细胞能够继承CFD,获得分化的细胞命运[14]。本研究的目的是探讨DEX是否可以影响腭上皮细胞PAR复合体基因的表达,并进一步扰乱其细胞极性而影响腭融合,从而为阐明DEX的致畸机制提供科学依据。
1. 材料和方法
1.1. 实验材料
实验所采用动物为8周龄SPF级C57BL/6J小鼠。C57BL/6J小鼠在SPF级动物饲养间饲养,给予充足食物,自由饮水,饲养间室温控制在20~25 °C,湿度为20%~30%。小鼠于前一天6 pm按雌雄比例为2:1进行合笼交配,次日晨8 am探查阴道栓,有阴道栓者定为怀孕0 d(embryonic day,E0)。
兔抗PAR3(11085-1-AP,Proteintech公司,美国),鼠抗PAR6A(SC-17791)、山羊抗PAR6A/B(SC-33898)、兔抗非典型性蛋白激酶C(atypical protein kinase,aPKC)(SC-216)(Santa Cruz公司,美国)。免疫组织化学试剂盒(北京中杉金桥生物技术有限公司),Western Blot试剂盒(碧云天生物技术研究所),Trizol试剂(Invitrogen公司,美国),逆转录及荧光定量聚合酶链反应(polymerase chain reaction,PCR)试剂盒购自宝生物工程(大连)有限公司,地塞米松磷酸钠注射液(湖北天药药业股份有限公司)。
1.2. 胚胎处理及腭胚突获取
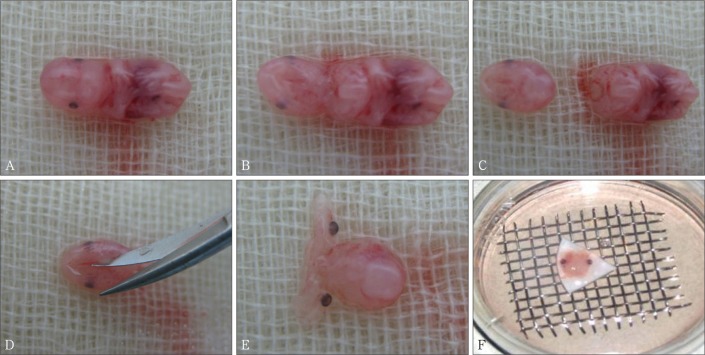
将50只孕鼠随机分为对照组和DEX组,每组25只。在E10.0~E12.0,DEX组按6 mg·kg−1腹腔注射地塞米松磷酸钠注射液,对照组腹腔注射0.9%氯化钠0.1 mL。继续按原饲养条件进行饲养,在E13.5、E14.0、E14.5、E15.5、E17.5断颈处死孕鼠,按Lu等[15]的操作方法进行腭胚突的制取和观察(图1)。将孕鼠浸泡在75%乙醇中2 min,剖开腹部后暴露子宫,将其取出后放置于装有无菌PBS的无菌培养皿中,剪开子宫壁,将胎鼠取出,体视显微镜下在两侧口角入路,去除舌体以及双侧下颌,获取双侧腭器官,观察腭胚突融合情况,记录腭裂发生例数。共获取腭胚突103个,DEX组52个,对照组51个。
图 1. 体视显微镜下获取腭胚突.
Fig 1 Obtaining palatal shelves under stereomicroscope
A:体外获取的胚胎;B:沿两侧口角剪开,暴露腭部;C:将胚胎颈部离断;D:剪下两侧腭胚突;E:获取到完整的腭胚突;F:腭胚突的体外培养。
1.3. 组织学处理及检测
2组各取30个腭胚突固定于4%中性多聚甲醛中24 h,梯度乙醇脱水,并用二甲苯做透明处理后浸蜡、包埋、切片。切片用于苏木精-伊红染色(hemotoxylin and eosin staining,HE)观察和后续的免疫荧光检测。
1.4. 扫描电子显微镜(scanning electric microscopy,SEM)检测
2组各取20个腭胚突固定于2.5%的戊二醛中24 h,梯度乙醇脱水,乙酸异戊酯置换;喷金进行样品扫描,SEM下观察腭胚突融合情况及腭胚突表面形态。
1.5. 免疫荧光染色(immunofluorescent staining,IF)
将1.3中组织学处理过的切片用二甲苯脱蜡20 min×2次;梯度乙醇水化,ddH2O洗片,5 min×2次;阻断灭活内源性过氧化物酶;3%H2O2室温避光孵育20 min;应用高温高压行抗原修复,羊血清封闭后滴加兔抗PAR3(1:200)、鼠抗PAR6A(1:150)、山羊抗PAR6A/B(1:150)、兔抗aPKC(1:150),用PBS代替一抗作阴性对照;一抗孵育过夜后滴加异硫氰酸荧光素标记的荧光二抗,37 °C避光孵育1 h;Olympus荧光显微镜下观察蛋白表达。
1.6. Western Blot
按照总蛋白提取试剂盒的操作说明书进行。获取蛋白后进行蛋白浓度测定,并进行电泳,完毕后进行转膜处理,封闭后进行抗体孵育:封闭完成后加入兔抗PAR3(1:500)、鼠抗PAR6A(1:200)、山羊抗PAR6A/B(1:200)、兔抗aPKC(1:500);TBST冲洗后加入辣根过氧化物酶标记的二抗(1:5 000),孵育后在PVDF膜上加入辣根过氧化物酶发光液(Millipore公司,美国),然后放入BIO-RAD凝胶成像系统中采集图像,采图软件为凝胶定量软件Quantity One v4.40。
1.7. 实时荧光定量聚合酶链式反应(real-time polymerase chain reaction,RT-PCR)
按照Trizol试剂说明书进行RNA的提取。应用SYBR Premix Ex Taq™ Ⅱ试剂盒进行RT-PCR操作,PAR3、PAR6、aPKC基因引物见表1。目的基因CT值以GAPDH基因CT值作为参照,以2−ΔΔct法进行数据分析。
表 1. PAR3、PAR6、aPKC基因引物序列.
Tab 1 Primer sequences of PAR3, PAR6 and aPKC
| 基因 | 正义链(5′-3′) | 反义链(5′-3′) |
| PAR3 | AGGTTTGGAATGGGACAGTT | GGAGCCTGAGACACGATTC |
| PAR6 | CAGTTCCAATGGGCTGTCTC | CCACTACCATCTCCTCGAATG |
| aPKC | ATGCCGACGGACACATTAAG | CGCTGAACCCGTACTCTTCT |
| GAPDH | CACTGAGCATCTCCCTCACA | TGGGTGCAGCGAACTTTATT |
1.8. 统计分析
采用SPSS 13.0软件对数据进行统计。统计方法为独立样本t检验及卡方检验,P<0.05为有统计学意义。
2. 结果
2.1. 腭裂的发生情况
DEX组有24个腭胚突发生腭裂,腭裂发生率为46.15%;对照组有2个腭胚突发生腭裂,腭裂发生率为3.92%。DEX组的腭裂发生率高于对照组(χ2=24.335,P=0.00),表明DEX对于腭胚突的发育有明显致畸作用。
2.2. 腭胚突发育过程中腭中嵴上皮及腭上皮的形态改变
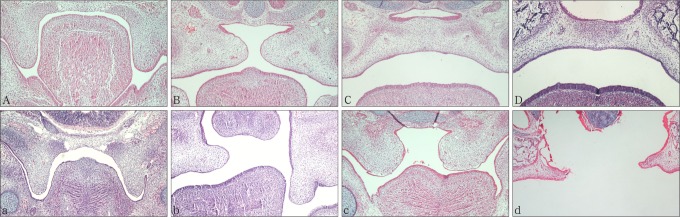
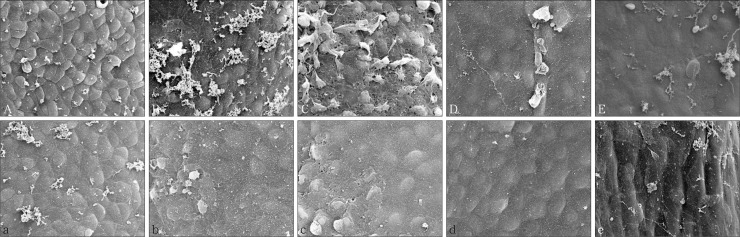
对照组:E13.5,腭胚突沿舌体两侧垂直向下生长(图2A),腭中嵴上皮呈极性排列,由立方状的基底细胞及表面的表皮细胞两部分组成,腭上皮及腭中嵴上皮细胞突出于腭胚突表面,呈圆柱形或立方状结构(图3A),此结构表明腭胚突上皮具有较强的核分裂能力;E14.0,扫描电子显微镜下腭上皮表面可看到有少许类似球状的结构出现(图3B);E14.5,腭胚突上抬到舌体背侧的上方(图2B),腭胚突表面出现较多的球状结构(图3C);E15.5,两侧的腭胚突在腭中缝处相互接触发生融合(图2C),腭胚突表面的球状结构减少(图3D);E17.5,腭部融合完成(图2D),腭上皮呈现光滑结构,球状结构消失(图3E)。DEX组在腭胚突的发育与对照组表现不一。E13.5,腭胚突仍沿舌体两侧垂直向下生长(图2a),但腭中嵴上皮非极性排列,只由单层的上皮细胞组成,而且表面不光滑(图3a);E14.0~E15.5,腭胚突表现为延迟发育且短小,从而导致两侧的腭胚突不能在腭中缝处相互接触发生腭融合(图2b、c),SEM下腭胚突表面球状结构减少甚至无球状结构出现,呈现为平坦的状态,且细胞的边界不能辨别(图3b、c、d);E17.5,腭部融合失败,腭裂发生(图2d,图3e)。
图 2. 腭胚突发育的冠状面观察 HE × 40.
Fig 2 Coronal observation of palatal development HE × 40
A~D依次为:对照组E13.5、E14.5、E15.5、E17.5。a~d依次为:DEX组E13.5、E14.5、E15.5、E17.5。
图 3. 腭胚突发育的表面观察 SEM × 2 000.
Fig 3 Surface observation of palatal development SEM × 2 000
A~E次为:对照组E13.5、E14.0、E14.5、E15.5、E17.5。a~e依次为:DEX组E13.5、E14.0、E14.5、E15.5、E17.5。
2.3. PAR3、PAR6及aPKC蛋白在腭胚突中的表达
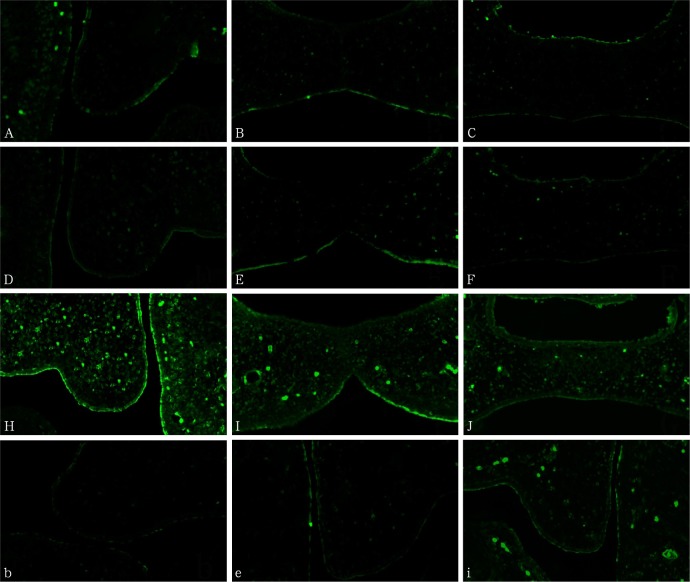
腭胚突发育过程中,对照组PAR3和PAR6蛋白在腭胚突上皮以及将来发育成的口鼻腔上皮中均可以检测到表达,而aPKC蛋白则在腭胚突上皮及腭间充质中可以检测到。DEX组中PAR6B蛋白在上皮中可以检测到表达,而PAR6A蛋白则检测不到,与Western Blot检测结果一致。
对照组:E13.5~E14.5,PAR3和PAR6蛋白高表达于腭胚突上皮中,包括基底细胞和表皮细胞(图4A、B、D、E);E15.5~E17.5,PAR3和PAR6蛋白则只表达于腭胚突上皮的表层(图4C、F);aPKC蛋白在腭胚突发育的整个过程中均高表达于腭胚突上皮及腭间充质(图4H~J)。DEX组:E13.5、E14.0时,PAR3和PAR6蛋白只表达于腭胚突上皮的表层;E14.5~E17.5,PAR3和PAR6蛋白在腭胚突中几乎检测不到(图4b、e);aPKC蛋白在腭胚突发育的整个过程中均明显表达于腭胚突上皮及腭间充质(图4i)。
图 4. PAR3、PAR6及aPKC蛋白的表达 IF × 40.
Fig 4 Protein expression of PAR3, PAR6 and aPKC IF × 40
A~C:对照组PAR3蛋白在E13.5、E14.5及E17.5的表达;D~F:对照组PAR6B蛋白在E13.5、E14.5及E17.5的表达;H~J:对照组aPKC蛋白在E13.5、E14.5及E17.5的表达;b、e、i:DEX组中PAR3、PAR6、aPKC蛋白在E14.5的表达。
2.4. DEX在蛋白和基因水平同时下调PAR3、PAR6及aPKC的表达
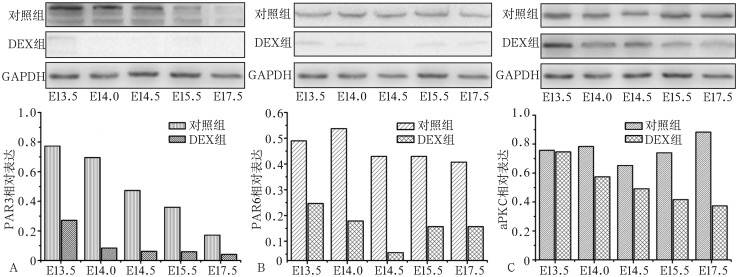
Western Blot检测(图5)显示:E13.5时,DEX组PAR3及PAR6蛋白表达低于对照组(P<0.05),aPKC蛋白表达2组无统计学差异(P>0.05);E14.0~E17.5,DEX组PAR3、PAR6及aPKC蛋白表达低于对照组。E13.5~E17.5,PAR3和aPKC蛋白表达随时间逐渐减低,PAR6蛋白表达在E14.5 时最低。
图 5. Western Blot检测PAR3、PAR6及aPKC蛋白的表达.
Fig 5 Protein expression of PAR3, PAR6 and aPKC by Western Blot
A:PAR3;B:PAR6;C:aPKC。
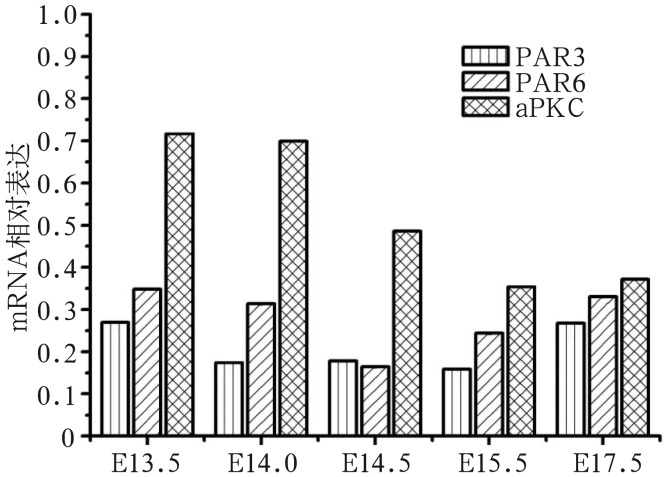
RT-PCR检测显示,DEX组PAR3、PAR6及aPKC基因表达均减少,其中PAR3基因表达最低,aPKC基因表达最高(图6)。这表明,整个腭胚突发育过程DEX均可以下调PAR3、PAR6及aPKC基因的表达。
图 6. RT-PCR检测DEX组PAR3、PAR6及aPKC mRNA基因的表达.
Fig 6 Gene expression of PAR3, PAR6 and aPKC by RT-PCR in DEX group
3. 讨论
在哺乳动物中,两侧腭胚突的融合包括两个阶段:两侧腭胚突由垂直位置上抬至水平位置和两侧腭胚突相互接触融合。在此过程中,任何致畸因素,如二恶英[16]–[18]、维甲酸[19]–[21]、尼古丁[22]、黑麦酸D[23]等,都可以干扰此发育过程,从而导致两侧腭胚突不能接触融合。一项关于唇腭裂的病例对照研究[24]显示,怀孕期间母亲使用糖皮质激素可使后代罹患唇腭裂的危险性增高。另一项关于孕期前3个月全身性使用皮质类固醇与唇腭裂相关性的研究[25]显示,二者具有较小的相关性(OR=2.59,95%CI为1.18~5.67),但也提示了胎儿在子宫内如果接触皮质类固醇则可以增加其罹患唇腭裂的敏感性。
糖皮质激素是一种参与许多生理及病理反应的重要信号分子[26]。由于其具有抗炎和免疫抑制作用在临床上被广泛应用,但对于处于孕期的女性使用是比较慎重的[27]。当给予致畸剂量的皮质类固醇激素时,DEX的致畸能力比氢化可的松和泼尼松龙高300多倍[28]。DEX由于可以透过胎盘屏障[29],所以动物实验中其诱发了较多的畸形,如恒河猴的胎儿暴露在DEX后会导致语言中枢的退化及颅神经的损伤[30];在鸡胚的羊膜内注射DEX后会出现前体屏障及面部的畸形[31];在啮齿类动物中,体内DEX可诱发腭裂,并在体外造成神经管的闭合障碍[32]。DEX在许多实验动物中均被证实具有致畸性,而最常见的畸形就是腭裂,其主要机制是影响了腭胚突的生长[33]。DEX可以导致较小腭胚突的形成,从而影响了两侧腭胚突的接触融合发生腭裂[15],[34]。本实验的研究结果与国内外学者的研究基本一致。本研究中DEX致畸后的腭胚突表现为延迟发育及上抬,并出现短小的表征,腭裂发生率为46.15%,此研究结果与He等[35]的研究一致,但略高于Zhou等[36]的研究。此外,DEX还影响了腭中嵴上皮细胞的排列,使得腭中嵴上皮细胞由双层极性排列变为单层非极性的排列。因此,DEX不仅可以造成腭胚突的发育延迟,而且可以导致腭胚突上皮的细胞极性丧失,二者可能共同导致了最后腭裂的形成。
先前的研究[15],[34],[37]已证实腭胚突上皮表面可以观察到丝状伪足的出现,其对于腭胚突的融合起了很重要的作用。Taya等[37]将其概括为以下几方面:1)丝状伪足增加了腭中嵴上皮在接触融合时的接触面积;2)丝状伪足上含有大量的细胞黏附分子和桥粒,可以更加有利于腭融合的发生,关于这一点,研究[34]显示腭胚突融合前,在腭中嵴上皮细胞的表面会出现硫酸软骨素蛋白多糖,而干扰其表达之后会明显改变体外腭胚突的融合过程,再者在野生型小鼠腭胚突表面有许多蛋白多糖分子,而转化生长因子β3(transforming growth factor β3,TGF-β3)-/-小鼠的腭胚突表面是缺如的,这说明蛋白多糖是细胞黏附分子,对于腭胚突的融合是有力的,这也就证实了先前关于糖胺聚糖和糖蛋白的抑制剂——重氮亮氨酸可以阻断腭胚突的融合的研究假设是成立的。3)丝状伪足可以减少腭中嵴上皮细胞表面的自由电荷能量,这对于两侧腭胚突的接触融合是非常重要的;4)丝状伪足也可能是腭中嵴上皮细胞运动和迁移能力增强的标志。在体内及体外腭融合过程中,DEX和二恶英会影响腭中嵴上皮细胞表面丝状伪足的形成,从而导致腭融合的失败[15],[34]。丝状伪足是上皮细胞的一种极性结构,极性的改变喻示着细胞功能和命运的变化[38]。本研究通过SEM观察腭胚突表面超微结构的变化,发现DEX造成腭胚突表面球状结构及丝状伪足的减少,从而减少了两侧腭胚突的接触面积,并导致腭上皮细胞功能障碍,而不能发生接触融合,导致腭裂。
细胞极性对于细胞功能的发挥有着重要作用,其涉及单细胞及多细胞生物体的分化、增殖及形态发生过程。细胞极性是许多细胞行为所必需的,如酵母菌的发芽[39]、细胞分裂[5]、受精卵发育成生物体的过程[6]、分子通过上皮屏障[7]等。上皮细胞的极性由面向基质的顶部以及与邻近组织和细胞接触的底侧表面两部分组成,而PAR细胞极性复合体与紧密连接对于细胞极性的维持起了重要的作用[40]。PAR细胞极性复合体最早在线虫中发现,包括三种蛋白,即PAR3、PAR6和aPKC。在哺乳动物中,三种蛋白的同源异构体——PAR6(PAR6A-D),aPKC(aPKCλ和aPKCζ)以及PAR3(或ASIP)均已被鉴定出,所有PAR3和PAR6蛋白均含有PDZ区域,可以互相结合,aPKC的PB1(phagocyte oxidase/Bem1)结构域与PAR6的PB1结构域结合,从而形成PAR极性复合体结构[14],[40]。在神经元中,阻断PAR3基因的表达可导致丝状伪足的形成障碍[41],PAR6和aPKC基因也是正常突触结构形成所必需的,干扰掉两个基因的表达后会扰乱肌动蛋白的成核现象,从而不能形成丝状伪足和板状伪足[42]。PAR3/PAR6/aPKC细胞极性复合体位于细胞的顶部,从而可以保证在有丝分裂时一些细胞的蛋白决定子不向基底部移动。PAR3基因的功能丧失可以导致不成熟的细胞周期存在,并减少体外细胞的克隆率,然而过表达PAR3及PAR6基因后可以使得体内体外自我更新细胞增加,并增加体外单个前祖细胞的克隆形成率[43]。在本研究中,DEX可以从蛋白和基因水平下调PAR3、PAR6、aPKC基因的表达,从而进一步影响腭上皮细胞的功能。因此,DEX可以通过下调腭上皮细胞中PAR3、PAR6、aPKC基因的表达水平而造成细胞极性的丧失、丝状伪足的形成障碍及腭上皮细胞功能的改变。但关于DEX是如何影响PAR极性复合体表达以及如何通过PAR极性复合体影响腭上皮细胞的功能目前还不清楚,还需进一步的深入研究。
本研究结果显示,在体内环境下,DEX不仅可以影响小鼠腭胚突的发育,使其发育延迟,并出现短小的腭胚突,而且可以导致腭中嵴上皮的形态及排列发生改变,由极性排列的双层结构变为非极性排列的单层排列。超微结构上,DEX导致了腭胚突表面球状结构及丝状伪足的形成减少。在小鼠胚胎发育的E13.5~E17.5,PAR3、PAR6、aPKC基因在腭胚突组织中表达。PAR3及PAR6基因在时空表达上仅限于在腭上皮中的表达变化,而aPKC基因则表达于腭上皮及腭间充质中。DEX可以在蛋白和基因水平下调PAR3、PAR6、aPKC的表达。本研究结果提示,DEX可能通过干扰PAR3/PAR6/aPKC细胞极性复合体的表达,并干扰腭中嵴上皮细胞的极性,从而影响腭胚突的融合。
Funding Statement
[基金项目] 国家自然科学基金(81401211)
Supported by: The National Natural Science Foundation of China (81401211).
References
- 1.Meng T, Shi B, Zheng Q, et al. Clinical and epidemiologic studies of nonsyndromic cleft lip and palate in China: analysis of 4 268 cases[J] Ann Plast Surg. 2006;57(3):264–269. doi: 10.1097/01.sap.0000221623.15710.b9. [DOI] [PubMed] [Google Scholar]
- 2.Evans RM. The steroid and thyroid hormone receptor superfamily[J] Science. 1988;240(4854):889–895. doi: 10.1126/science.3283939. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Claude A, French S. Regulation of liver cell polarity by retinoic acid in vitro: bile canaliculi formation[J] Int Hepatol Commun. 1996;6(2):99–111. [Google Scholar]
- 4.Buse P, Woo PL, Alexander DB, et al. Glucocorticoid-induced functional polarity of growth factor responsiveness regulates tight junction dynamics in transformed mammary epithelial tumor cells[J] J Biol Chem. 1995;270(47):28223–28227. doi: 10.1074/jbc.270.47.28223. [DOI] [PubMed] [Google Scholar]
- 5.Siegrist SE, Doe CQ. Microtubule-induced cortical cell polarity[J] Genes Dev. 2007;21(5):483–496. doi: 10.1101/gad.1511207. [DOI] [PubMed] [Google Scholar]
- 6.Stern CD. Evolution of the mechanisms that establish the embryonic axes[J] Curr Opin Genet Dev. 2006;16(4):413–418. doi: 10.1016/j.gde.2006.06.005. [DOI] [PubMed] [Google Scholar]
- 7.Delacour D, Jacob R. Apical protein transport[J] Cell Mol Life Sci. 2006;63(21):2491–2505. doi: 10.1007/s00018-006-6210-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Suzuki A, Yamanaka T, Hirose T, et al. Atypical protein kinase C is involved in the evolutionarily conserved par protein complex and plays a critical role in establishing epithelia-specific junctional structures[J] J Cell Biol. 2001;152(6):1183–1196. doi: 10.1083/jcb.152.6.1183. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Yamanaka T, Horikoshi Y, Suzuki A, et al. PAR-6 regulates aPKC activity in a novel way and mediates cell-cell contact-induced formation of the epithelial junctional complex[J] Genes Cells. 2001;6(8):721–731. doi: 10.1046/j.1365-2443.2001.00453.x. [DOI] [PubMed] [Google Scholar]
- 10.Gao L, Joberty G, Macara IG. Assembly of epithelial tight junctions is negatively regulated by Par6[J] Curr Biol. 2002;12(3):221–225. doi: 10.1016/s0960-9822(01)00663-7. [DOI] [PubMed] [Google Scholar]
- 11.Knoblich JA. Asymmetric cell division during animal development[J] Nat Rev Mol Cell Biol. 2001;2(1):11–20. doi: 10.1038/35048085. [DOI] [PubMed] [Google Scholar]
- 12.Müller HA. Genetic control of epithelial cell polarity: lessons from Drosophila[J] Dev Dyn. 2000;218(1):52–67. doi: 10.1002/(SICI)1097-0177(200005)218:1<52::AID-DVDY5>3.0.CO;2-L. [DOI] [PubMed] [Google Scholar]
- 13.Kemphues K. PARsing embryonic polarity[J] Cell. 2000;101(4):345–348. doi: 10.1016/s0092-8674(00)80844-2. [DOI] [PubMed] [Google Scholar]
- 14.Betschinger J, Knoblich JA. Dare to be different: asymmetric cell division in Drosophila, C. elegans and vertebrates [J] Curr Biol. 2004;14(16):R674–R685. doi: 10.1016/j.cub.2004.08.017. [DOI] [PubMed] [Google Scholar]
- 15.Lu SJ, He W, Shi B, et al. A preliminary study on the teratogenesis of dexamethasone and the preventive effect of vitamin B12 on murine embryonic palatal shelf fusion in vitro[J] J Zhejiang Univ Sci B. 2008;9(4):306–312. doi: 10.1631/jzus.B0710625. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Abbott BD. Review of the interaction between TCDD and glucocorticoids in embryonic palate[J] Toxicology. 1995;105(2/3):365–373. doi: 10.1016/0300-483x(95)03234-7. [DOI] [PubMed] [Google Scholar]
- 17.Hassoun EA, Stohs SJ. TCDD, endrin and lindane induced oxidative stress in fetal and placental tissues of C57BL/6J and DBA/2J mice[J] Comp Biochem Physiol C Pharmacol Toxicol Endocrinol. 1996;115(1):11–18. doi: 10.1016/s0742-8413(96)00116-8. [DOI] [PubMed] [Google Scholar]
- 18.Holladay SD, Sharova LV, Punareewattana K, et al. Maternal immune stimulation in mice decreases fetal malformations caused by teratogens[J] Int Immunopharmacol. 2002;2(2/3):325–332. doi: 10.1016/s1567-5769(01)00183-7. [DOI] [PubMed] [Google Scholar]
- 19.Yu Z, Xing Y. All-trans retinoic acid inhibited chondrogenesis of mouse embryonic palate mesenchymal cells by down-regulation of TGF-beta/Smad signaling[J] Biochem Biophys Res Commun. 2006;340(3):929–934. doi: 10.1016/j.bbrc.2005.12.100. [DOI] [PubMed] [Google Scholar]
- 20.Abbott BD, Birnbaum LS. Retinoic acid-induced alterations in the expression of growth factors in embryonic mouse palatal shelves[J] Teratology. 1990;42(6):597–610. doi: 10.1002/tera.1420420604. [DOI] [PubMed] [Google Scholar]
- 21.Sheng N, Xie Z, Wang C, et al. Retinoic acid regulates bone morphogenic protein signal duration by promoting the degradation of phosphorylated Smad1[J] Proc Natl Acad Sci USA. 2010;107(44):18886–18891. doi: 10.1073/pnas.1009244107. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Kang P, Svoboda KK. Nicotine inhibits palatal fusion and modulates nicotinic receptors and the PI-3 kinase pathway in medial edge epithelia[J] Orthod Craniofac Res. 2003;6(3):129–142. doi: 10.1034/j.1600-0544.2003.02236.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Dhulipala VC, Welshons WV, Reddy CS. Inhibition of human embryonic palatal mesenchymal cell cycle by secalonic acid D: a probable mechanism of its cleft palate induction[J] Orthod Craniofac Res. 2004;7(4):227–236. doi: 10.1111/j.1601-6343.2004.00299.x. [DOI] [PubMed] [Google Scholar]
- 24.Carmichael SL, Shaw GM, Ma C, et al. Maternal corticosteroid use and orofacial clefts[J] Am J Obstet Gynecol. 2007;197(6):585.e1–585.e7. doi: 10.1016/j.ajog.2007.05.046. [DOI] [PubMed] [Google Scholar]
- 25.Pradat P, Robert-Gnansia E, Di Tanna GL, et al. First trimester exposure to corticosteroids and oral clefts[J] Birth Defects Res Part A Clin Mol Teratol. 2003;67(12):968–970. doi: 10.1002/bdra.10134. [DOI] [PubMed] [Google Scholar]
- 26.Karin M. New twists in gene regulation by glucocorticoid receptor: is DNA binding dispensable[J] Cell. 1998;93(4):487–490. doi: 10.1016/s0092-8674(00)81177-0. [DOI] [PubMed] [Google Scholar]
- 27.Hviid A, Mølgaard-Nielsen D. Corticosteroid use during pregnancy and risk of orofacial clefts[J] CMAJ. 2011;183(7):796–804. doi: 10.1503/cmaj.101063. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Nanda R, van der Linden FP, Jansen HW. Production of cleft palate with dexamethasone and hypervitaminosis A in rat embryos[J] Experientia. 1970;26(10):1111–1112. doi: 10.1007/BF02112705. [DOI] [PubMed] [Google Scholar]
- 29.Varma DR, Yue TL. Influence of protein-calorie malnutrition on the pharmacokinetics, placental transfer and tissue localization of dexamethasone in rats[J] Br J Pharmacol. 1984;83(1):131–137. doi: 10.1111/j.1476-5381.1984.tb10127.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Jerome CP, Hendrickx AG. Comparative teratogenicity of triamcinolone acetonide and dexamethasone in the rhesus monkey (Macaca mulatta)[J] J Med Primatol. 1988;17(4):195–203. [PubMed] [Google Scholar]
- 31.Kosar K. Malformation spectra and embryolethality following intraamniotic administration of glucocorticoids in the chick embryo[J] Anat Anz. 1990;171(3):211–217. [PubMed] [Google Scholar]
- 32.Hansen DK, Grafton TF. Comparison of dexamethasone-induced embryotoxicity in vitro in mouse and rat embryos[J] Teratog Carcinog Mutagen. 1994;14(6):281–289. doi: 10.1002/tcm.1770140605. [DOI] [PubMed] [Google Scholar]
- 33.Abbott BD, Buckalew AR. Embryonic palatal responses to teratogens in serum-free organ culture[J] Teratology. 1992;45(4):369–382. doi: 10.1002/tera.1420450408. [DOI] [PubMed] [Google Scholar]
- 34.Thomae TL, Stevens EA, Bradfield CA. Transforming growth factor-beta3 restores fusion in palatal shelves exposed to 2,3,7,8-tetrachlorodibenzo-p-dioxin[J] J Biol Chem. 2005;280(13):12742–12746. doi: 10.1074/jbc.M410780200. [DOI] [PubMed] [Google Scholar]
- 35.He W, Meng T, Wu M, et al. Perturbation of Fgf10 signal pathway in mouse embryonic palate by dexamethasone and vitamin B12 in vivo[J] J Pediatr Surg. 2010;45(10):2030–2035. doi: 10.1016/j.jpedsurg.2010.05.018. [DOI] [PubMed] [Google Scholar]
- 36.Zhou J, Xu B, Shi B, et al. A metabonomic approach to analyze the dexamethasone-induced cleft palate in mice[J] J Biomed Biotechnol. 2011;2011:1–8. doi: 10.1155/2011/509043. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Taya Y, O'Kane S, Ferguson MW. Pathogenesis of cleft palate in TGF-beta3 knockout mice[J] Development. 1999;126(17):3869–3879. doi: 10.1242/dev.126.17.3869. [DOI] [PubMed] [Google Scholar]
- 38.Yang C, Czech L, Gerboth S, et al. Novel roles of formin mDia2 in lamellipodia and filopodia formation in motile cells[J] PLoS Biol. 2007;5(11):e317. doi: 10.1371/journal.pbio.0050317. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Pruyne D, Legesse-Miller A, Gao L, et al. Mechanisms of polarized growth and organelle segregation in yeast[J] Annu Rev Cell Dev Biol. 2004;20:559–591. doi: 10.1146/annurev.cellbio.20.010403.103108. [DOI] [PubMed] [Google Scholar]
- 40.Assémat E, Bazellières E, Pallesi-Pocachard E, et al. Polarity complex proteins[J] Biochim Biophys Acta. 2008;1778(3):614–630. doi: 10.1016/j.bbamem.2007.08.029. [DOI] [PubMed] [Google Scholar]
- 41.Zhang H, Macara IG. The polarity protein PAR-3 and TIAM1 cooperate in dendritic spine morphogenesis[J] Nat Cell Biol. 2006;8(3):227–237. doi: 10.1038/ncb1368. [DOI] [PubMed] [Google Scholar]
- 42.Georgiou M, Baum B. Polarity proteins and Rho GTPases cooperate to spatially organise epithelial actin-based protrusions[J] J Cell Sci. 2010;123(Pt 7):1089–1098. doi: 10.1242/jcs.060772. [DOI] [PubMed] [Google Scholar]
- 43.Costa MR, Wen G, Lepier A, et al. Par-complex proteins promote proliferative progenitor divisions in the developing mouse cerebral cortex[J] Development. 2008;135(1):11–22. doi: 10.1242/dev.009951. [DOI] [PubMed] [Google Scholar]