Abstract
目的
研究SD大鼠三叉神经痛模型对机械刺激的痛阈和胶质细胞源性神经营养因子(GDNF)的变化。
方法
建立大鼠三叉神经痛样动物模型,选取SD大鼠36只,随机分为手术组、假手术组和空白对照组。手术组经口内切口行右侧三叉神经的眶下神经结扎术,假手术组只分离暴露右侧眶下神经不予以结扎,空白对照组未接受手术干预。记录大鼠术前及术后的痛阈,并在不同时间点解剖三叉神经节,通过免疫组织化学方法观察GDNF的变化。
结果
手术组于术后2周出现痛觉超敏反应,一直持续到术后6周才逐渐恢复,术后10~12周才恢复到术前水平。手术组大鼠术后三叉神经节中GDNF的表达量增高,且表达量随着时间的推移而改变。
结论
大鼠眶下神经的慢性压迫性损伤(CCI-ION)可建立三叉神经痛样的动物模型。GDNF可能通过促进神经纤维的修复再生方式参与调控三叉神经痛。
Keywords: 胶质细胞源性神经营养因子, 三叉神经痛, 动物模型
Abstract
Objective
This research aims to study the changes in pain threshold and glial cell line-derived neurotrophic factor (GDNF) in a Sprague Dawley (SD) rat model of trigeminal neuralgia.
Methods
A total of 36 male SD rats were randomly divided into three groups: operative, sham-operative, and control. In the operative group, a chronic constriction injury (CCI) was caused by placing loose chromic gut ligatures around the right infraorbital nerve (ION). In the sham-operative group, the right ION was subjected to the same procedure, but without ligation. In the control group, the right ION was not subjected to any treatment. The pain thresholds of the three groups were recorded at different times after the operation. The GDNF expression in each group was analyzed via immunohistochemical staining.
Results
An allodynia to mechanical stimulation in the region of the ligated ION was observed starting on the 2nd week after operation. Pain thresholds started to increase gradually from the 6th week and returned to the original level at the 10th to 12th week after operation. Cells that expressed the GDNF markedly increased in number in the operative group with changes observed at different times.
Conclusion
We use chronic constriction injury to the infraorbital nerve (CCI–ION) to establish a trigeminal neuralgia-like animal model in SD rats. GDNF may play a role in regulating pain by promoting the restoration and regeneration of nerve fibers.
Keywords: glial cell line-derived neurotrophic factor, trigeminal neuralgia, animal model
三叉神经痛或称痛性痉挛(抽搐),是指三叉神经所支配的区域发生的强烈的阵发性疼痛。发病率约8/10万[1],多见于中老年人,平均发病年龄为(62.7±15.8)岁[2],女性多于男性。随着人口老龄化,其发病率亦有增高趋势。尽管学者们已进行了大量的临床和动物模型的研究,相继提出了许多新的观点和治疗手段[3]–[4],但其发病机制尚不清楚。因此,建立一种操作简单且稳定可靠的动物模型就显得十分必要。在众多的发病机制学说中有解剖学依据且被多数学者认可的是微血管压迫学说,动物模型的建立多以此为基础。本实验通过结扎SD大鼠眶下神经建立三叉神经痛模型,观察大鼠的行为反应和疼痛阈值及胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)在不同时间点的变化,探讨GDNF与疼痛的关系,对进一步探究三叉神经痛的病因机制具有一定的指导意义。
1. 材料和方法
1.1. 实验材料和分组
选择健康成年清洁级SD大鼠36只,体重180 g±20 g。随机选取6只作为空白对照组,手术组和假手术组各15只。手术组采用经口内右侧眶下神经慢性压迫性损伤(chronic constriction injury to the infraorbital nerve,CCI-ION)法建立三叉神经痛样动物模型,假手术组只分离暴露右侧的眶下神经而不结扎,空白对照组不暴露也不结扎眶下神经。
1.2. 方法
1.2.1. 建立模型
10%水合氯醛(0.004 mL·g−1)腹腔内注射麻醉,取仰卧位,固定头和四肢,将舌牵出并拉向一侧,在大鼠口内第一磨牙水平沿右侧龈颊边缘纵向切开约1 cm,逐层钝性分离周围组织,暴露眶下神经,在眶下神经近、远心端分别用4-0铬肠线疏松结扎,两线之间的距离约为2 mm,结扎要松紧适度,要求在显微镜下见仅减少神经的直径,但仍然保持神经表层血循环的通畅,且不阻断神经冲动传导,4-0尼龙线缝合手术创口。假手术组除不结扎眶下神经外,其余的操作均与手术组一样。空白对照组只进行麻醉、固定和消毒。所有手术操作都在无菌条件下展开,术前及术后未用抗生素。动物清醒后给予一般饲养。
1.2.2. 痛阈测定
术前及术后1~12周每周观察并记录大鼠疼痛阈值及行为反应。在大鼠适应实验环境后进行感觉测试。感觉测试器刺激的位置是眶下神经在面部的支配区(触须垫)。采用自制的大鼠固定笼固定大鼠,让大鼠适应一段时间,然后手持测试器缓慢接近大鼠,先在左侧刺激3次,再刺激右侧3次,两次之间间隔10 s,测试过程中要使细丝弯曲;每一个强度共刺激6次,刺激过程中要保证测试器的强度由低到高依次增大。阳性反应的表现为:1)不对称性搔抓面部,至少连续3次搔抓刺激区。2)攻击行为,表现为快速抓咬测试器。3)快速的后退、躲避动作,将身体倦缩靠向笼壁、头面部藏于身下或将头转向对侧以避开刺激。出现上述的任意1项或多项即可判为阳性,当3次刺激中有2次或以上为阳性时,此时所对应的细丝强度(克数)即为大鼠面部机械痛阈值,若此强度大于或等于26 g,将26 g作为该次测定的阈值。将手术侧与对侧和对照组结果进行比较和统计学分析。
1.2.3. 取材及固定
分别于手术后1、2、4、6、12周随机选取手术组和假手术组各3只大鼠处死,加上6只空白对照组大鼠共计36只,取三叉神经节组织标本。具体操作为:10%水合氯醛腹腔内注射麻醉后开胸,依次灌注0.9%氯化钠溶液和4%多聚甲醛溶液,体式镜下游离获取双侧三叉神经节,4%多聚甲醛溶液固定24 h后,放入0.1 mol·L−1 PBS,备用。
1.2.4. 三叉神经节标本GDNF免疫组织化学染色
将固定后的三叉神经节标本经梯度乙醇脱水、二甲苯透明、浸蜡、包埋。石蜡标本连续切片(厚5 µm),经脱蜡、水化、抗原修复,冷却至室温后行免疫组织化学染色:1)0.01 mol·L−1PBS冲洗,3%H2O2去离子水室温下孵育10 min;2)PBS冲洗,滴加50 µL山羊血清工作液,室温下孵育10 min;3)加入一抗(GDNF抗体,稀释度1︰200),摇匀后,4 °C过夜;4)PBS冲洗,滴加50 µL生物素化二抗工作液,室温下孵育10 min;5)PBS冲洗,滴加50 µL辣根酶标志链酶卵白素工作液,室温下孵育10 min;6)PBS冲洗,滴加50 µL新配制的DAB显色剂显色;7)自来水充分冲洗后,苏木素染液复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。光镜下观察GDNF在三叉神经节中的表达和分布情况并拍照。在手术组及假手术组每只大鼠标本的切片中按先后次序隔10张选取1张,共选10张,每张切片在400倍镜下分别随机选取10个视野拍照,将所得的照片导入到Image-Pro Plus 6.0软件中,然后进行石蜡组织切片免疫组织化学染色结果的半定量分析,计算出每个视野的累积光密度值(integrated optical density,IOD)与面积(S),然后用总的累积光密度值除以总面积,就可以得出每张切片的平均光密度值(optical density,OD)。
1.3. 统计学分析
采用SPSS 13.0统计软件的重复测量资料的方差分析和t检验对所得实验数据进行统计学分析。计量资料的实验数据都用均数±标准差表示,以P<0.05为差异具有显著性。
2. 结果
2.1. 各组大鼠的疼痛阈值及行为反应变化
2.1.1. 手术组
术前术后不同时间大鼠的痛觉反应阈值见图1。由图1可见,术后1周刺激大鼠右侧眶下神经在面部的感觉支配区域后,出现低反应期,疼痛阈值明显增高,大鼠反应迟钝。术后2周,阈值急剧下降为0.75 g±0.04 g,大鼠易激惹,表现为受极低强度的刺激,即可出现上述阳性反应,持续至术后6周,然后阈值缓慢增高,在术后10~12周恢复到手术前的水平。左侧疼痛阈值变化趋势与手术侧相似,术后1周亦出现短暂的高阈值反应迟钝期,但不如右侧明显。术后2周阈值最低,为1.00 g±0.05 g,低阈值持续至第5周,然后缓慢升高至正常水平。经统计学t检验分析表明:在术前、术后1周和10~12周,左右两侧疼痛阈值相比差异无统计学意义(P>0.05);在术后2~9周,左右两侧疼痛阈值相比差异有统计学意义(P<0.05)。
图 1. 手术组和假手术组术前术后不同时间大鼠的痛觉反应阈值.

Fig 1 The pain threshold of rats in operative and sham-operative group at different time before and after operation
2.1.2. 空白对照组与假手术组
术前及术后各时间点刺激空白对照组和假手术组大鼠左、右侧眶下神经在面部的感觉支配区域后大鼠反应正常,两组大鼠两侧疼痛阈值无明显变化(图1)。经统计分析,同组及两组大鼠之间各时间点左右两侧疼痛阈值比较差异无统计学意义。
2.2. 各组大鼠右侧疼痛阈值变化比较
术后1周手术组右侧疼痛阈值明显高于另两组,而术后2~9周疼痛阈值明显低于另两组。术后1~9周手术组右侧的疼痛阈值与另两组右侧的疼痛阈值相比,差异有统计学意义(P<0.05)。术前及术后10~12周,手术组右侧与假手术组、空白对照组右侧相比,差异无统计学意义(P>0.05)。
2.3. 大鼠三叉神经节中GDNF的表达变化和分布情况
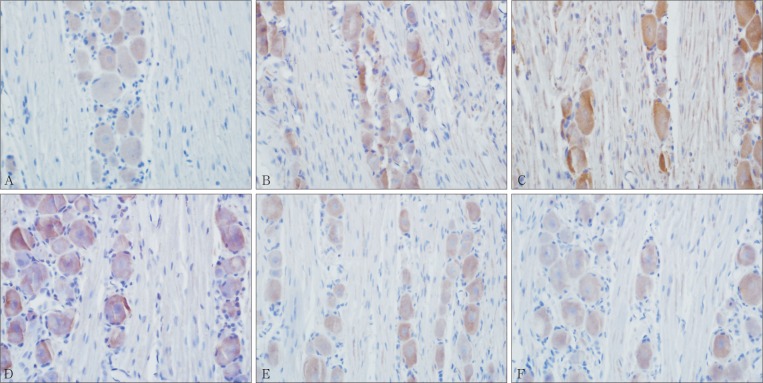
各组三叉神经节组织切片经GDNF免疫组织化学染色,均可见免疫阳性细胞,该阳性细胞多数呈椭圆形、圆形和多角形,手术组三叉神经节中阳性细胞数要多于空白对照组。免疫阳性物质大多呈现棕黄色,主要分布在细胞质及细胞核中,细胞核着色较深,但核仁没有阳性着色(图2)。手术组大鼠术后三叉神经节中GDNF的表达量增高,且表达量随着时间的推移而改变。数据经统计分析表明:与术前及假手术组相比,术后1、2、4周手术组GDNF的OD值明显升高(P<0.01),术后6周恢复至术前水平(P>0.05)。假手术组和空白对照组术前术后的OD值相比,差异无统计学意义(P>0.05)(图3)。
图 2. 手术组GDNF在大鼠三叉神经节中的表达 免疫组织化学染色 × 400.
Fig 2 The expression of GDNF in operative group trigeminal ganglia immunohistochemistry × 400
A~F分别为术前及术后1、2、4、6和12周。
图 3. 术前术后大鼠三叉神经节中GDNF的变化.

Fig 3 The changes of GDNF in trigeminal ganglia before and after surgery
3. 讨论
3.1. 建立CCI-ION动物模型的理论基础
目前三叉神经痛的临床治疗方法有很多种,但临床效果并非理想,究其原因是对三叉神经痛的发病原因和机制尚不明确。目前提出的有关三叉神经痛发病机制的学说主要可分为中枢病因学说和周围病因学说两大类。中枢学说认为是大脑皮质与丘脑过多的神经电活动导致的癫痫样发作或三叉神经脊束核与感觉核控制异常痛觉传入信号的能力下降而产生疼痛。主要的解释是闸门学说。周围学说则认为三叉神经根、节受到压迫导致的三叉神经脱髓鞘是三叉神经痛的主要病因和病理改变,其后众多学者都证实了这一观点。目前提出的主要解释有串扰学说和点燃学说。造成神经压迫的原因可以归结为血管压迫和硬膜鞘、带和骨性压迫。此后众多的学者先后建立了许多相关的动物模型:慢性缩窄环模型[5]–[6]、三叉神经末梢致痛模型[7]、三叉神经根埋植模型[8]、牙髓灌注模型[9]、经颞下窝暴露三叉神经节模型[10]、经枕骨下暴露三叉神经根和颞下暴露三叉神经节模型[11]。
本次实验建立和采用的眶下神经慢性压迫性缩窄环模型就是模拟了血管压迫学说,对神经造成压迫,观察术前术后大鼠的行为反应、疼痛阈值和神经微循环的变化。结果显示:术后1周出现一个短暂的迟钝反应期,估计可能的原因是结扎后阻碍了神经信号传入通路的通畅。术后2周大鼠处于超敏反应期,对较低的非疼痛性刺激即可产生疼痛反应和自发性疼痛。对于手术组左侧在术后2周也出现了三叉神经痛样反应的机制目前尚不十分清楚,有的学者[12]认为是由于“交叉兴奋”的原因而引起的疼痛反应,也有的学者[13]认为与三叉神经中枢核团中的P物质和酸性磷酸酶的活性增强有关系,还有的学者[14]认为是慢性压迫所导致的神经干的病变引起了高位神经中枢的病变,也有可能是动物模型的条件反射,到底是什么机制还有待于进一步研究。该方法能够有效地模拟临床上的三叉神经痛,具有操作简单、重复性好、贴近临床和成功率高等优点。通过该模型的建立可更进一步深入探究三叉神经痛的病因机制和采用不同方式的治疗观察其疗效。
3.2. 大鼠三叉神经节中GDNF的表达与三叉神经痛
GDNF属于转化生长因子超家族,是靶源性的神经营养因子,能够促进神经元的生长发育、存活及再生,还能够延长轴索的长度,使其朝靶器官的方向生长,还能保护离断轴突的感觉及运动神经元,阻止其退化和凋亡[15]。人的GDNF分子与鼠的GDNF有93%~95%同源性,在人和鼠的尾状核中有高表达,而壳核中则是低表达。GDNF还表达在感觉神经元(如三叉神经节)和自主神经元(如副交感节)所支配的组织中,并对这些神经元起着营养的作用[16]。
国内已有学者对GDNF的镇痛作用展开研究,主要的研究集中在脑、脊髓和坐骨神经损伤或结扎后GDNF的表达变化规律。吴旭等[17]通过研究脑损伤后GDNF的变化发现,其表达量具有一定的时间规律性,可以用来推断脑损伤的时间。罗伟等[18]则研究了脊髓半横断损伤后GDNF的表达变化,发现损伤后其表达明显增多,认为在其损伤的早期发挥修复作用。另有学者[19]通过各种途径增加外源性GDNF,研究其对坐骨神经损伤后病理变化的影响,结果都说明GDNF的增多能够保护受损的神经元,并能增加机械刺激疼痛阈值,参与神经痛的调控。最新的研究方向是通过构建GDNF基因载体,导入神经内使其稳定长效的表达。有学者[20]–[21]已通过构建慢病毒载体来转染T细胞与神经干细胞,并取得了很好的结果,但尚未见将其作为一种临床治疗方法的报道。
本研究应用免疫组织化学染色的方法,表明了在三叉神经节内有GDNF免疫阳性物质且大多呈现棕黄色,分布在细胞质及细胞核中,细胞核着色较深,但核仁没有阳性着色。手术组在术后1周表达量开始增多,一直持续到术后4周,此期间GDNF的表达量与假手术组相比有显著差异,说明手术造成神经轴突的损伤累及神经元细胞体导致其凋亡,从而刺激了胶质细胞和雪旺细胞GDNF的分泌,通过远端运输和旁分泌等途径进入胞体,减少神经元细胞的凋亡,促进神经元和神经纤维的修复再生和减少神经元的异常放电。这些都说明GDNF在调控口腔颌面部痛、温觉冲动的传入和三叉神经损伤后的修复再生中有一定作用。
建立稳定可靠的动物模型有利于相关实验的后续研究,慢性压迫大鼠眶下神经导致神经微循环的改变,进而引起神经纤维变性和脱髓鞘,使大鼠表现为痛觉超敏,轻微的刺激即可产生异常的电信号引发疼痛,GDNF通过提高神经营养,阻止细胞凋亡,促进轴索再生延长来修复受损神经,重建正常的神经通路,减弱和消除异常神经电信号的产生和传导,从而达到镇痛的目的。
Funding Statement
[基金项目] 辽宁省自然科学基金计划资助项目(2013023014)
References
- 1.Spatz AL, Zakrzewska JM, Kay EJ. Decision analysis of medical and surgical treatments for trigeminal neuralgia: how patient evaluations of benefits and risks affect the utility of treatment decisions[J] Pain. 2007;131(3):302–310. doi: 10.1016/j.pain.2007.02.009. [DOI] [PubMed] [Google Scholar]
- 2.Tölle T, Dukes E, Sadosky A. Patient burden of trigeminal neuralgia: results from a cross-sectional survey of health state impairment and treatment patterns in six European countries[J] Pain Pract. 2006;6(3):153–160. doi: 10.1111/j.1533-2500.2006.00079.x. [DOI] [PubMed] [Google Scholar]
- 3.Obermann M, Katsarava Z. Update on trigeminal neuralgia[J] Expert Rev Neurother. 2009;9(3):323–329. doi: 10.1586/14737175.9.3.323. [DOI] [PubMed] [Google Scholar]
- 4.Prasad S, Galetta S. Trigeminal neuralgia: historical notes and current concepts[J] Neurologist. 2009;15(2):87–94. doi: 10.1097/NRL.0b013e3181775ac3. [DOI] [PubMed] [Google Scholar]
- 5.Imamura Y, Kawamoto H, Nakanishi O. Characterization of heat-hyperalgesia in an experimental trigeminal neuropathy in rats[J] Exp Brain Res. 1997;116(1):97–103. doi: 10.1007/pl00005748. [DOI] [PubMed] [Google Scholar]
- 6.Christensen D, Gautron M, Guilbaud G, et al. Effect of gabapentin and lamotrigine on mechanical allodynia-like behaviour in a rat model of trigeminal neuropathic pain[J] Pain. 2001;93(2):147–153. doi: 10.1016/S0304-3959(01)00305-0. [DOI] [PubMed] [Google Scholar]
- 7.Ng CH, Ong WY. Increased expression of gamma-aminobutyric acid transporters GAT-1 and GAT-3 in the spinal trigeminal nucleus after facial carrageenan injections[J] Pain. 2001;92(1/2):29–40. doi: 10.1016/s0304-3959(00)00468-1. [DOI] [PubMed] [Google Scholar]
- 8.Burchiel KJ. Abnormal impulse generation in focally demyelinated trigeminal roots[J] J Neurosurg. 1980;53(5):674–683. doi: 10.3171/jns.1980.53.5.0674. [DOI] [PubMed] [Google Scholar]
- 9.Foong FW, Satoh M, Takagi H. A newly devised reliable method for evaluating analgesic potencies of drugs on trigeminal pain[J] J Pharmacol Methods. 1982;7(4):271–278. doi: 10.1016/0160-5402(82)90080-8. [DOI] [PubMed] [Google Scholar]
- 10.Liu W, Møller M. Experimental microneurosurgery of the trigeminal ganglion and ophthalmic-maxillary nerve in the rat: subtemporal fossa approach[J] J Neurosci Methods. 2000;102(2):91–94. doi: 10.1016/s0165-0270(00)00272-7. [DOI] [PubMed] [Google Scholar]
- 11.Sakas DE, Whittaker K, Abbasi KH, et al. Experimental microneurosurgery of the trigeminal nerve: surgical technique for ganglionectomy and rhizotomy in the cat[J] J Neurosci Methods. 1996;65(2):137–141. doi: 10.1016/0165-0270(95)00129-8. [DOI] [PubMed] [Google Scholar]
- 12.Devor M, Wall PD. Cross-excitation in dorsal root ganglia of nerve-injured and intact rats[J] J Neurophysiol. 1990;64(6):1733–1746. doi: 10.1152/jn.1990.64.6.1733. [DOI] [PubMed] [Google Scholar]
- 13.Vos B, Maciewicz R. Alterations of peripheral nerve morphology and chances in fluoride resistant acid phosphatase and substance P immunoreactivity in the trigeminal nucleus caudalis in an experimental model of trigeminal neuropathic pain[J] Clin J Pain. 1991;7(1):48. [Google Scholar]
- 14.Benoist JM, Gautron M, Guilbaud G. Experimental model of trigeminal pain in the rat by constriction of one infraorbital nerve: changes in neuronal activities in the somatosensory cortices corresponding to the infraorbital nerve[J] Exp Brain Res. 1999;126(3):383–398. doi: 10.1007/s002210050745. [DOI] [PubMed] [Google Scholar]
- 15.Bennett DL, Michael GJ, Ramachandran N, et al. A distinct subgroup of small DRG cells express GDNF receptor components and GDNF is protective for these neurons after nerve injury[J] J Neurosci. 1998;18(8):3059–3072. doi: 10.1523/JNEUROSCI.18-08-03059.1998. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Quartu M, Serra MP, Boi M, et al. Tissue distribution of neurturin, persephin and artemin in the human brainstem at fetal, neonatal and adult age[J] Brain Res. 2007;1143:102–115. doi: 10.1016/j.brainres.2007.01.065. [DOI] [PubMed] [Google Scholar]
- 17.吴 旭, 王 保捷, 张 国华, et al. 大鼠脑损伤后GDNF表达变化的时间规律性研究[J] 中国法医学杂志. 2004;19(1):19–21. [Google Scholar]
- 18.罗 伟, 赵 匡彦, 王 廷华. 大鼠脊髓半横断损伤后神经营养因子bFGF、GDNF的表达变化[J] 中华神经外科疾病研究杂志. 2005;4(2):152–155. [Google Scholar]
- 19.贾 东林, 吴 新民, 张 利萍. 蛛网膜下腔注射胶质细胞源性神经营养因子对大鼠神经病理性痛的影响[J] 中国疼痛医学杂志. 2009;15(4):221–225. [Google Scholar]
- 20.施 勇, 周 粱, 田 洁, et al. 携带大鼠胶质细胞源性神经营养因子基因慢病毒载体的构建及转染[J] 中国眼耳鼻喉科杂志. 2008;8(5):283–288. [Google Scholar]
- 21.张 阳, 张 志坚, 杨 光华, et al. 新型Tet-On系统大鼠GDNF和TH双基因的慢病毒载体的构建与表达[J] 中国药理学通报. 2010;26(8):1079–1084. [Google Scholar]