Abstract
目的
研究张应力刺激下Wnt/β-catenin信号通路对成牙骨质细胞Runx2表达的调控。
方法
以成牙骨质细胞样细胞OCCM30为研究对象,应用FX4000T应力加载装置对其加载张应力,时间为0、3、6、12 h,然后分别使用不同质量浓度的Dikkopf-1(DKK1)处理48 h,采用Western blot法检测β-catenin蛋白的表达水平,实时荧光定量聚合酶链反应法(RT-PCR)检测Runx2 mRNA的表达水平。选取最佳作用时间点(12 h)和最佳阻断剂质量浓度(150 ng·mL−1),将样本分为A、B、C、D共4组,A组不加力不加阻断剂,B组加力加阻断剂,C组加力不加阻断剂,D组不加力加阻断剂,测量β-catenin蛋白和Runx2 mRNA的表达水平。
结果
1)张应力加载3、6、12 h后,Runx2 mRNA表达水平和β-catenin蛋白水平与对照组相比均明显升高,差异有统计学意义(P<0.05)。2)不同质量浓度DKK1处理后,细胞内Runx2 mRNA的表达量呈下降趋势。3)未加载张应力的情况下,DKK1明显抑制了β-catenin蛋白的表达,Wnt/β-catenin通路被抑制;加载张应力情况下,DKK1处理组β-catenin蛋白表达低于未加DKK1处理组;不加阻断剂的情况下,张应力刺激增强了β-catenin蛋白的表达;阻断剂作用后,应力刺激组β-catenin蛋白表达相对较高。
结论
机械应力刺激下Wnt/β-catenin信号通路可正向调控成牙骨质细胞Runx2基因的表达。
Keywords: 成牙骨质细胞, Wnt/β-catenin, Runx2, 牙根吸收, 牙根修复
Abstract
Objective
Periodontal tissue remodeling includes remodeling of alveolar bone, periodontal ligament, and cementum. Cementoblast plays a main role in repairing root resorption. Canonical Wnt/β-catenin signaling can promote the odontogenic differentiation in osteoblast. However, the mechanism on how the orthodontic force influences the function of cementoblast and the relationship between the canonical Wnt/β-catenin signaling and Runx2 of cementoblast are not yet known. The aim of this study is focus on this relationship.
Methods
OCCM30 cementoblasts were subjected to mechanical strain by four-point bending system with tension stress for 0, 3, 6, and 12 h. They were pretreated with different concentrations of Dikkopf-1 (DKK1) for 48 h. Western blot analysis was performed to detect the β-catenin levels in the nucleus. Runx2 mRNA was observed by real-time quantitative polymerase chain reaction (RT-PCR). OCCM30 cementoblasts were then pretreated with 150 ng·mL−1 DKK1 for 48 h and subjected to mechanical strain by FX4000T system with tension stress for 12 h. Western blot analysis was conducted to detect the β-catenin levels in the nucleus, and Runx2 mRNA was observed by RT-PCR.
Results
OCCM30 cementoblasts had significantly higher Runx2 mRNA and β-catenin levels after being loaded with mechanical stress. The amount of Runx2 mRNA in OCCM30 cementoblasts was significantly decreased by DKK1. When OCCM30 cementoblasts were pretreated with DKK1 without stress, their β-catenin level was significantly decreased by DKK1 and Wnt signaling was blocked. When they were not pretreated with stress, the β-catenin level with DKK1 was lower than that without DKK1. Without DKK1, the β-catenin level in OCCM30 cementoblasts increased after being loaded with mechanical stress. With DKK1, the β-catenin level in OCCM30 cementoblasts, which were loaded with mechanical stress, was higher than that without mechanical stress.
Conclusion
Cementoblasts had higher Runx2 mRNA expression under mechanical stress because of the Wnt/β-catenin signaling pathway effect.
Keywords: cementoblast, Wnt/β-catenin, Runx2, root absorption, root repair
牙齿移动过程中,牙根受力会发生一定程度的吸收及修复。成牙骨质细胞是力学敏感细胞,与牙根部牙骨质吸收后的修复密切相关。Wnt/β-catenin是与力学刺激和成骨效应都有相关的信号通路,力学刺激能够激活成骨细胞内的Wnt/β-catenin信号通路,促进成骨细胞Runx2的表达。目前力学刺激下Wnt/β-catenin信号通路对成牙骨质细胞Runx2表达的调控作用尚未可知。本研究通过张应力刺激以及特异性阻断剂的干预,以Runx2为切入点,研究张应力刺激对成牙骨质样细胞中Wnt/β-catenin信号通路的激活效应以及该通路对Runx2的调控作用。
1. 材料和方法
1.1. 主要材料和设备
成牙骨质细胞株OCCM30(四川大学华西口腔医院白丁教授惠赠)。BioFlex加力板(Flexcellint公司,美国)。阻断剂Dikkopf-1(DKK1)(Sino biological公司,美国,目录号:10170-H08H)。实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-PCR)试剂盒(TaKaRa公司,日本);FX4000T加载装置(Flexcellint公司,美国),倒置相差显微镜及照相系统(尼康公司,日本),FTC2000型RT-PCR基因扩增仪、FTC2000型聚合酶链反应合成仪(上海枫岭生物技术有限公司),高速低温离心机(Heraeus公司,德国),凝胶成像及图像分析系统(Bio-Rad公司,美国)。本实验目的基因Runx2以及内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-phosphate dehydrogenase,GAPDH)的引物序列由上海生工生物工程技术服务有限公司设计合成,其序列见表1。
表 1. 引物序列.
Tab 1 Primer sequences
| 目的基因 | 引物序列(5′—3′) | 引物大小/bp |
| Runx2 | F:CGGACGAGGCAAGAGTTTCA | 176 |
| R:TTGGTGCAGAGTTCAGGGAG | ||
| GAPDH | F:GACAACTTTGGCATCGTGGA | |
| R:ATGCAGGGATGATGTTCTGG | 135 |
1.2. 研究方法
1.2.1. OCCM30的培养
将同一批传代的细胞按每毫升1×105个细胞的密度接种于BioFlex加力板上,每板加入培养液(90%体积分数DMEM,10%小牛血清,1%青霉素+链霉素)2 mL,于CO2孵箱内培养(37 °C;5%CO2,95%空气),每2 d更换1次培养液。
1.2.2. 应力加载下Runx2 mRNA和β-catenin蛋白的表达
待细胞生长铺满培养板底80%~90%时,将加力板置于FX4000T加力系统的孵箱中进行应力加载(加载参数为12%形变,1 Hz,1/2正弦波)。实验分为4个组,3个实验组分别加载3、6、12 h,对照组在相同孵箱内培养但不加力。力学加载结束后收集细胞样本,采用RT-PCR法半定量分析Runx2 mRNA的表达,Western blot法检测β-catenin蛋白的表达。
1.2.3. 阻断剂对Runx2 mRNA和β-catenin蛋白表达的影响
将同一批传代的细胞按每毫升1×105个细胞的密度接种于6孔板中继续培养,待生长到60%~70%时,将质量浓度分别为20、50、80、100、150 ng·mL−1的DKK1分别加入培养板中,对照组加入PBS液,继续培养,48 h后收集样本,检测Runx2 mRNA和β-catenin蛋白的表达。根据检测结果选择信号通路阻断效果最佳的DKK1质量浓度用于后续实验。
1.2.4. 应力加载以及阻断剂处理对Runx2 mRNA和β-catenin蛋白表达的影响
将实验分为A、B、C、D共4组,A组不加力不加阻断剂,B组加力并加阻断剂,C组加力不加阻断剂,D组不加力加阻断剂。同一批传代的细胞按每毫升1×105个细胞的密度分别接种于A、B、C、D四组加力板中,生长至60%~70%时,B、D组加入150 ng·mL−1 DKK1,其余两组加入PBS液,48 h后,加力组即B、C组放入加力系统(12%形变,1 Hz,1/2正弦波)的孵箱加力12 h,A、D组放入相同孵箱但不加力。培养12 h后检测4组细胞Runx2 mRNA和β-catenin蛋白表达的变化。
1.3. 统计学分析
以上实验均重复3次,应用SPSS 16.0软件对实验数据进行方差分析,采用LSD检验进行组间多重比较,检验水准为双侧α=0.05。
2. 结果
2.1. 应力加载对成牙骨质细胞Runx2 mRNA和β-catenin蛋白表达的影响
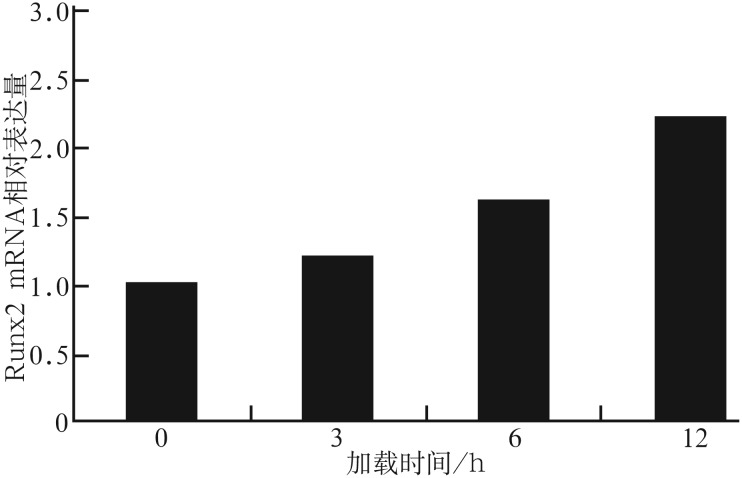
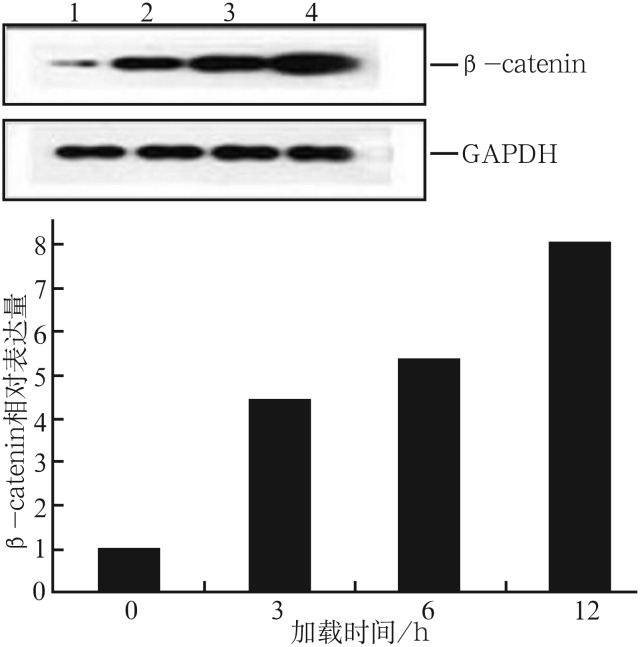
张应力加载3、6、12 h后,成牙骨质细胞内Runx2 mRNA和β-catenin蛋白的表达情况见图1、2。与对照组相比,加力后Runx2 mRNA和β-catenin蛋白的表达均增强(P<0.05)。随着加力时间延长,β-catenin表达水平及Runx2 mRNA表达活性均呈上升趋势。
图 1. 应力加载0、3、6、12 h后Runx2 mRNA的相对表达量.
Fig 1 Relative expression of Runx2 mRNA loaded by stress for 0, 3, 6, 12 h
图 2. 应力加载0、3、6、12 h后β-catenin蛋白的相对表达量.
Fig 2 Relative expression of β-catenin protein loaded by stress for 0, 3, 6, 12 h
上:Western blot结果,1~4分别为加载0、3、6、12 h;下:灰度分析。
2.2. 阻断剂处理对成牙骨质细胞Runx2 mRNA和β-catenin蛋白表达的影响
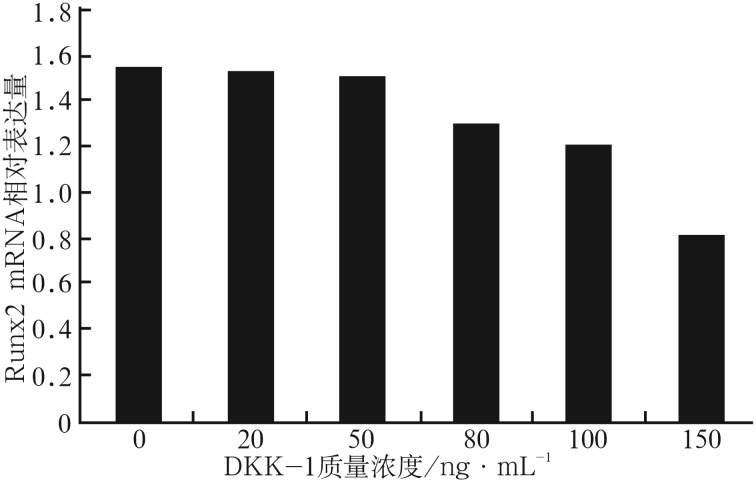
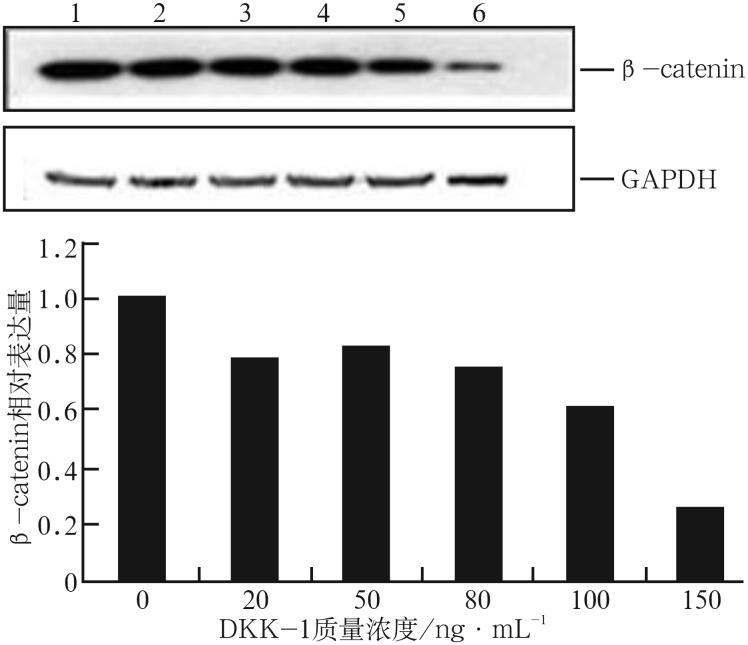
阻断剂处理后Runx2 mRNA的表达情况见图3,β-catenin表达情况见图4:经不同质量浓度的DKK1处理后,细胞内Runx2 mRNA和β-catenin的表达总体上均有下降趋势。DKK1质量浓度为20、50 ng·mL−1时,Runx2 mRNA表达量与对照组相比无明显差异(P>0.05),经80、100、150 ng·mL−1的DKK1处理后,Runx2 mRNA表达量下降,与对照组的差异有统计学意义(P<0.05)(图3)。经5种质量浓度的DKK1处理后,β-catenin蛋白的表达量较对照组均明显下降(P<0.05)(图4)。DKK1的质量浓度达到150 ng·mL−1时,β-catenin蛋白的表达量减少最明显,说明150 ng·mL−1的DKK1能有效抑制成牙骨质细胞内β-catenin蛋白的表达活性。由此可见,不同质量浓度的阻断剂阻断效应不一样,随着质量浓度的增大,阻断效应也越强,对Wnt/β-catenin信号转导通路活性的抑制作用也越强。Wnt/β-catenin信号转导通路的活性在150 ng·mL−1的DKK1作用下活性最低,可被有效抑制,因此作为本研究后续使用DKK1的最佳浓度。
图 3. 不同质量浓度DKK-1处理后Runx2 mRNA的相对表达量.
Fig 3 Relative expression of Runx2 mRNA proceed by DKK-1 of different concentrations
图 4. 不同质量浓度DKK-1处理后β-catenin蛋白的相对表达量.
Fig 4 Relative expression of β-catenin protein proceed by DKK-1 of different concentrations
上:Western blot结果,1~6分别代表DKK-1质量浓度为0、20、50、80、100、150 ng·mL−1;下:灰度分析。
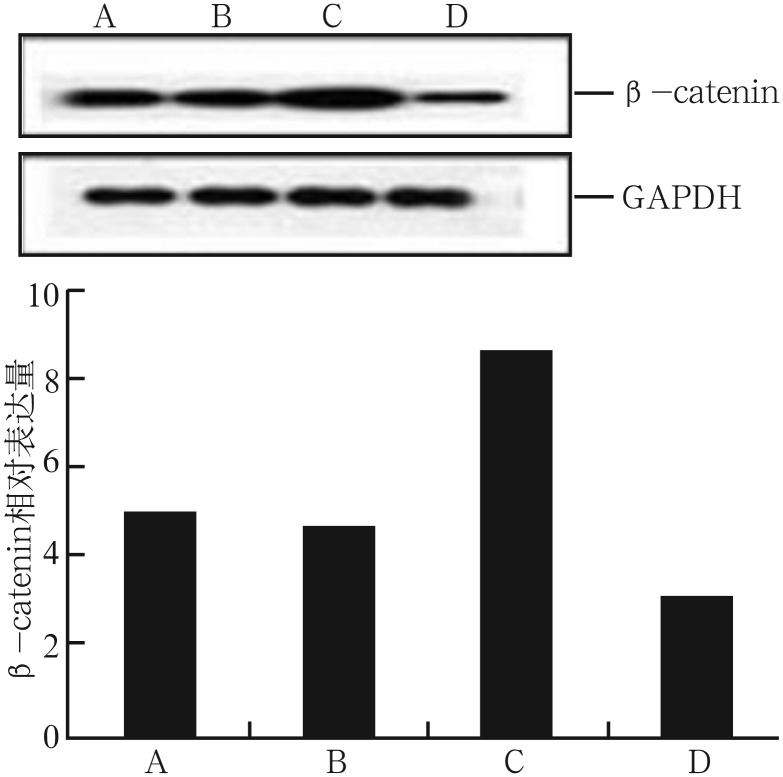
2.3. 应力加载及阻断剂处理后β-catenin蛋白以及Runx2 mRNA的表达
应力加载及阻断剂处理后β-catenin蛋白的表达情况见图5:A、D组比较,未加载张应力的情况下,DKK1明显抑制了β-catenin蛋白的表达,Wnt/β-catenin通路被抑制;B、C组比较,加载张应力的情况下,DKK1处理组β-catenin蛋白表达明显低于未加DKK1处理组;A、C组比较,不加阻断剂时,张应力刺激增强了β-catenin蛋白的表达;B、D组比较,阻断剂作用后,应力刺激组β-catenin蛋白表达相对较高。
图 5. 应力加载及阻断剂处理后各组β-catenin蛋白的相对表达量.
Fig 5 Relative expression of β-catenin protein proceed by DKK-1 of different concentrations and loaded by stress
A:不加力不加阻断剂组;B:加力并加阻断剂组;C:加力不加阻断剂组;D:不加力加阻断剂组。上:Western blot结果;下:灰度分析。
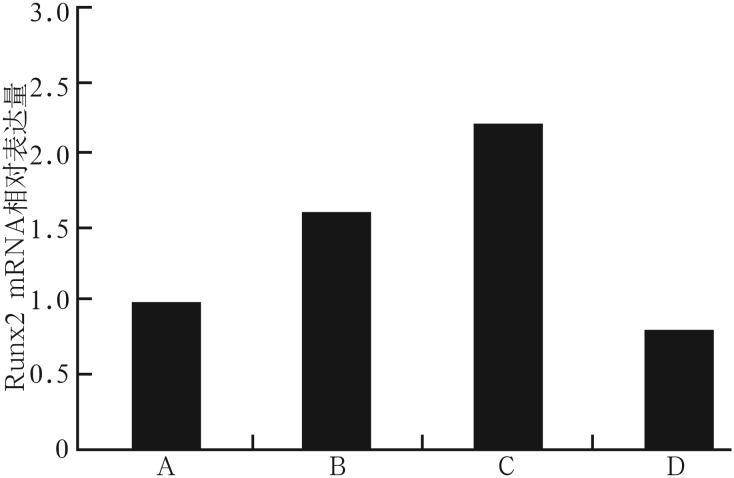
应力加载及阻断剂处理后Runx2 mRNA的表达情况见图6:B、C组比较,张应力刺激下,C组Wnt/β-catenin通路活性较高,此时Runx2基因的表达也表现为C组高于B组;B、D组比较,Wnt/β-catenin通路同时被抑制的状态下,加力组细胞通路活性仍高于不加力组,即B组活性高于D组,此状态下B组Runx2基因的表达也高于D组;而未加载张应力的A、D组结果与本研究前述结果一致,抑制Wnt/β-catenin通路后,Runx2基因的表达相对未抑制组降低。
图 6. 应力加载及阻断剂处理后各组Runx2 mRNA的相对表达量.
Fig 6 Relative expression of Runx2 mRNA proceed by DKK-1 of different concentrations and loaded by stress
A:不加力不加阻断剂组;B:加力并加阻断剂组;C:加力不加阻断剂组;D:不加力加阻断剂组。
3. 讨论
Runx2是一个力学相关因子,应力刺激可促进其在细胞内的表达。应力环境下,牙周组织中的牙周膜细胞、成骨细胞均被证实为Runx2的靶细胞[1]–[3]。成牙骨质细胞位于牙周膜中牙骨质表面。本研究通过体外实验发现,张应力刺激促进了Runx2 mRNA在成牙骨质细胞中的表达。
β-catenin是Wnt/β-catenin信号通路的第二信使,细胞核内β-catenin水平直接反映了该信号通路的活化水平[4]。本研究结果表明,张应力加载后,OCCM30细胞核内β-catenin的水平与对照组相比都增高,证实张应力刺激激活了OCCM30内经典Wnt信号通路,在加载的12 h内细胞核内积聚的β-catenin量逐渐增多,说明在加载的12 h作用时间内,Wnt信号通路都处于激活状态,且随着加力时间的延长活性增强。
本研究中,张应力刺激下细胞内β-catenin蛋白和Runx2 mRNA均增多,表明张应力刺激既能激活Wnt/β-catenin信号通路又能上调Runx2基因的表达。Runx2的活性水平由许多因素调控,信号通路是其中之一。一些与成骨相关的细胞信号传导通路可以通过激活辅助因子与Runx2的相互作用正向或负向调控其与DNA结合或转录活性,或者通过影响Runx2启动子来实现对其表达的调控[5]。另外许多关于细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号通路的研究发现,该通路也能调节Runx2的表达。有学者[6]用敲除分泌型卷曲相关蛋白1(secreted frizzled-related proteins 1,SFRP1)后的小鼠进行研究发现,Wnt/β-catenin信号通路被激活后,Runx2 mRNA以及Runx2启动子活性均增强,并且其下游骨钙素基因表达上调形成新骨。这说明Runx2是Wnt信号通路中的一个效应因子,Wnt/β-catenin信号通路调控成骨细胞分化至少部分是通过Runx2基因表达的活性实现的[7]。
本研究中,当Wnt/β-catenin信号传导通路被抑制后,Runx2基因的表达也有减少,说明Wnt/β-catenin信号传导通路对成骨效应因子Runx2有调控作用,且抑制该通路Runx2 mRNA的表达表现为下调的趋势,进一步说明Wnt/β-catenin信号通路可能通过影响Runx2基因表达进而影响成牙骨质细胞的成骨效应。正畸治疗中,矫治力是影响牙根吸收后修复及牙周组织再生的关键因素,本研究仅仅证明了Wnt/β-catenin信号通路可以调控Runx2因子,对应力促进成牙骨质细胞成骨效应机制还不能清楚说明,研究加载应力模拟临床正畸矫治力的情况下两者关系是十分有必要的。
张应力刺激作用能够激活成牙骨质细胞内Wnt/β-catenin信号通路。无张应力刺激作用时,阻断该信号通路Runx2基因的表达减少;而张应力刺激下,抑制Wnt/β-catenin通路活性,Runx2基因的表达也相应减少。由此可见,张应力刺激上调Runx2基因的表达机制中Wnt/β-catenin信号通路发挥了促进作用。应力刺激后,成牙骨质细胞内Wnt/β-catenin信号通路被激活,Runx2基因表达水平也上调,说明在正畸治疗过程中成牙骨质细胞仍能发挥成骨分化的功能,促进牙根吸收后的修复。除了Wnt/β-catenin通路外,可能还存在其他调控因素影响Runx2基因的表达。类似对成骨细胞的研究[8]也表明,力学刺激能够促进成骨细胞的成骨分化。还有学者[9]–[10]通过激活和阻断成牙骨质细胞内Wnt/β-catenin信号通路的研究发现,Wnt/β-catenin信号通路可以抑制成牙骨质细胞的分化但促进其增殖。但是,成牙骨质细胞在正畸治疗过程中的生物学功能还存在争议,尚需要进一步研究。
Funding Statement
[基金项目] 国家自然科学基金资助项目(81300914);重庆市卫生局重点基金资助项目(2011-1-060)
References
- 1.Ziros PG, Basdra EK, Papavassiliou AG. Runx2: of bone and stretch[J] Int J Biochem Cell Biol. 2008;40(9):1659–1663. doi: 10.1016/j.biocel.2007.05.024. [DOI] [PubMed] [Google Scholar]
- 2.Ziros PG, Gil AP, Georgakopoulos T, et al. The bone-specific transcriptional regulator Cbfa1 is a target of mechanical signals in osteoblastic cells[J] J Biol Chem. 2002;277(26):23934–23941. doi: 10.1074/jbc.M109881200. [DOI] [PubMed] [Google Scholar]
- 3.Li J, Jiang L, Liao G, et al. Centrifugal forces within usually-used magnitude elicited a transitory and reversible change in proliferation and gene expression of osteoblastic cells UMR-106[J] Mol Biol Rep. 2009;36(2):299–305. doi: 10.1007/s11033-007-9179-y. [DOI] [PubMed] [Google Scholar]
- 4.Moon RT. Wnt/beta-catenin pathway[J] Sci STKE. 2005(271):cm1. doi: 10.1126/stke.2712005cm1. [DOI] [PubMed] [Google Scholar]
- 5.Guo Y, Zhang CQ, Zeng QC, et al. Mechanical strain promotes osteoblast ECM formation and improves its osteoinductive potential[J] Biomed Eng Online. 2012;11:80. doi: 10.1186/1475-925X-11-80. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Pasold J, Osterberg A, Peters K, et al. Reduced expression of Sfrp1 during chondrogenesis and in articular chondrocytes correlates with osteoarthritis in STR/ort mice[J] Exp Cell Res. 2013;319(5):649–659. doi: 10.1016/j.yexcr.2012.12.012. [DOI] [PubMed] [Google Scholar]
- 7.Ohazama A, Courtney JM, Sharpe PT. Opg, Rank, and Rankl in tooth development: co-ordination of odontogenesis and osteogenesis[J] J Dent Res. 2004;83(3):241–244. doi: 10.1177/154405910408300311. [DOI] [PubMed] [Google Scholar]
- 8.Liedert A, Wagner L, Seefried L, et al. Estrogen receptor and Wnt signaling interact to regulate early gene expression in response to mechanical strain in osteoblastic cells[J] Biochem Biophys Res Commun. 2010;394(3):755–759. doi: 10.1016/j.bbrc.2010.03.065. [DOI] [PubMed] [Google Scholar]
- 9.Tamura M, Nemoto E, Sato MM, et al. Role of the Wnt signaling pathway in bone and tooth[J] Front Biosci: Elite Ed. 2010;2:1405–1413. doi: 10.2741/e201. [DOI] [PubMed] [Google Scholar]
- 10.Nemoto E, Koshikawa Y, Kanaya S, et al. Wnt signaling inhibits cementoblast differentiation and promotes proliferation[J] Bone. 2009;44(5):805–812. doi: 10.1016/j.bone.2008.12.029. [DOI] [PubMed] [Google Scholar]