Abstract
目的
检测微小RNA-17(mir-17)在糖基化终末产物(AGEs)刺激下人牙周膜干细胞(HPDLSCs)骨向分化过程中的表达,并分析其对该过程的影响。
方法
体外组织块法和有限稀释法克隆化培养HPDLSCs。实时定量聚合酶链反应(real time PCR)检测实验组细胞在骨向分化过程中不同时间点mir-17的表达;采用细胞转染技术过表达和抑制mir-17的表达,real time PCR和Western blot分别检测转染前后其成骨基因mRNA水平和蛋白水平的表达情况。
结果
成骨诱导3、7、14 d后,对照组和实验组mir-17的表达均下调,差异有统计学意义(P<0.05)。上调mir-17后,与对照组相比,实验组骨涎蛋白(BSP)、碱性磷酸酶(ALP)、Runt相关转录因子-2(Runx-2)mRNA表达水平以及Runx-2蛋白水平均明显降低;下调mir-17后,实验组BSP、ALP、Runx-2 mRNA表达水平以及Runx-2蛋白水平均高于对照组。
结论
AGEs通过影响HPDLSCs骨向分化过程中mir-17的表达从而抑制了HPDLSCs的骨向分化。
Keywords: 糖基化终末产物, 人牙周膜干细胞, 微小RNA-17
Abstract
Objective
This study aims to detect microRNA-17(mir-17) expression on the osteogenic differentiation of advanced glycation end products (AGEs)-stimulated hunman periodontal ligament stem cells (HPDLSCs) and to analyze the influence of these cells on this process.
Methods
HPDLSCs were isolated using limited dilution technique. After osteogenic differentiation occurred, different time points of mir-17 expression in the experimental groups were detected by real time polymerase chain reaction (PCR). The mir-17 overexpression and inhibition were evaluated using cell transfection technique. Differences in gene expressions were detected by real time PCR; differences in protein expressions were analyzed by Western blot.
Results
The mir-17 expression was reduced after osteogenic differentiation occurred at 3, 7, and 14 d compared with that in the control group (P<0.05). The expression levels of bone sialoprotein(BSP), Runt-related transcription factor-2 (Runx-2) and alkaline phosphatase (ALP) in the experimental groups were lower than those in the mimic control group when mir-17 expression increased. In addition, the protein expression levels of Runx-2 in the experimental groups were lower than those in the control group. The expression levels of BSP, Runx-2 and ALP in the experimental groups were higher than those in the inhibitor control group when mir-17 expression decreased. Likewise, the protein expression levels of Runx-2 in the experimental groups were higher than those in the control group.
Conclusion
AGEs inhibit the osteogenic differentiation of HPDLSCs by affecting mir-17 expression.
Keywords: advanced glycation end products, human periodontal ligament stem cells, microRNA-17
微小RNA(microRNA)是一类广泛存在于动物和植物中的高度保守的短序列单链小分子RNA,其特点是进化具有高度保守性,呈簇分布,具有组织特异性、稳定性好,表达具有时间特异性和空间特异性,通过与其靶mRNA分子的3′非编码区互补结合,在翻译水平上特异性抑制靶基因的表达或者直接使靶基因降解发挥转录后调控。microRNA参与各种疾病包括骨关节炎、细菌病毒感染、心血管疾病和癌症等的发生发展,对疾病的预后有一定的影响,并被用于疾病的诊断和治疗[1]。研究[2]表明microRNA对干细胞的自我更新和组织分化方面有着重要的作用。
糖基化终末产物(advanced glycation end products,AGEs)是糖尿病的特征性代谢产物,在前期的实验中笔者[3]研究发现AGEs能够抑制人牙周膜干细胞(human periodontal ligament stem cells,HPDLSCs)的骨向分化,并通过影响Wnt经典信号通路的相关基因抑制了HPDLSCs的增殖[4],但AGEs是通过何种途径抑制HPDLSCs的骨向分化并不清楚。通过基因芯片筛出了HPDLSCs在骨向分化中改变的mircoRNA,并研究了微小RNA-17(microRNA-17,mir-17)在炎症状态下HPDLSCs成骨分化过程中的调控作用,结果表明:mir-17通过调控其特异性靶基因smurf1抑制了炎症来源的HPDLSCs的成骨分化[5]。
近年来,国内外大量研究表明:HPDLSCs作为一种成体干细胞其骨向分化能力对于加速改建牙槽骨、平衡牙周膜功能代谢、稳定牙周关系、动员牙周膜内细胞储备及促进牙周再生,起到了重要的作用。本实验拟从mircoRNA水平寻找突破点,探究mir-17在AGEs刺激下是否发生了改变,从而影响了HPDLSCs的骨向分化,导致了糖尿病患者牙周组织的缺损不易恢复。
1. 材料和方法
1.1. 主要试剂和仪器
α-MEM培养基、胶原酶、胰蛋白酶(Gibco公司,美国),胎牛血清(杭州四季青生物工程材料有限公司),细胞总RNA提取试剂盒、一步法实时定量聚合酶链反应(real time polymerase chain reaction,real time PCR)试剂盒(Takara公司,日本),AGEs-BSA(Bio Vision公司,美国),倒置相差显微镜以及照相系统(Olympus公司,日本),real time PCR仪器(Applied biosystems公司,美国),TRIzol Reagent、Lip02000 转染试剂(Invitrigon公司,美国),mir-17 mimics、mir-17 inhibitor、mir-17 control(Ambion公司,美国)。
1.2. HPDLSCs的分离培养和纯化
收集12~18岁因正畸需要而刚拔除的健康牙齿,PBS反复冲洗后刮取根中1/3牙周膜组织并进行分离,加入α-MEM培养液混匀,离心后弃上清;加入0.3%的胶原酶2 mL至37 °C CO2孵箱中消化15 min后加入培养液中和反应,离心后弃上清。将组织块均匀的平铺于6孔板中,并覆盖上无菌盖玻片,加入含10%胎牛血清的α-MEM培养液,置37 °C、5%CO2孵箱中培养,每3 d换液,待细胞生长汇聚达80%时进行传代。
取对数生长期的第1代细胞进行纯化,将细胞密度调整至每毫升100~150个,接种于直径10 cm的一次性培养皿中,常规培养7~10 d,出现细胞克隆(细胞克隆判断标准≥50个细胞),将克隆细胞胰酶消化后常规传代培养。
1.3. 实验分组
取第3代HPDLSCs,以每毫升5×104个的密度接种于12孔板,加入含5%胎牛血清的α-MEM培养液,待细胞增殖达70%汇合时,弃原培养液并将细胞随机分为空白组、对照组(不加AGEs刺激的HPDLSC,即N-HPDLSCs)和实验组(加AGEs刺激的HPDLSC,即AGEs-HPDLSCs)。实验组加入含AGEs终浓度为10 µg·mL−1的成骨诱导液(含10 mmol·L−1 β-甘油磷酸钠、10−8 mol·L−1地塞米松、50 µg·mL−1维生素C的α-MEM诱导液),对照组加入不含AGEs的成骨诱导液,分别于3、7、14 d收集对照组和实验组细胞,提取RNA;21 d进行成骨、成脂染色,鉴定干细胞特性。空白组为正常培养液培养,作为对照(0 d)。
1.4. real time PCR检测成骨诱导后mir-17表达量的改变
1.4.1. 引物设计
mir-17的引物序列均由广州锐博生物有限公司合成,长度为89 bp,序列为5′-CAAAGUGCUUACAGUGCAGGUAG-3′。
1.4.2. microRNA的逆转录
按照Bulge-Loop TM miRNA qRT-PCR Prinmer说明配制50 µL逆转录(reverse transcription,RT)反应液,置PCR扩增仪进行RT反应。
1.4.3. PCR反应
1)反应体系:RT模板 2 µL,SYBR Green Mix 10 µL,Bulge-Loop TM miRNA Forward(5 µmol·L−1)1 µL,Bulge-Loop TM miRNA reverse(5 µmol·L−1)1 µL,RNase -free H2O至20 µL。2)反应条件:预变性95 °C 20 s(1个循环);变性95 °C 10 s,退火60 °C 20 s,延伸70 °C 8 s(40个循环)。为立即进行PCR产物的熔解曲线分析,扩增反应结束后继续从70 °C加热到95 °C,升温速率为0.4 °C·次−1,恒温时间为1 s·次−1。
1.5. 细胞转染及转染效率的测定
1.5.1. 细胞转染
根据细胞转染试剂说明书进行转染前细胞的准备和转染试剂的配制。实验当天将制备好的细胞悬液以每毫升8.8×104个接种于24孔板的培养孔中,置 37 °C孵箱培养12 h后更换完全培养基或加诱导液诱导细胞,选择实验时间点收集细胞,其中两个孔的细胞用来鉴定转染效果(48 h)。
1.5.2. 转染效率检测
转染后48 h收集细胞,检测转染后mir-17的表达量。
1.6. 基因水平和蛋白水平的检测
real time PCR检测转染前后实验组骨涎蛋白(bone sialoprotein,BSP)、Runt相关转录因子-2(Runt related transcription factor-2,Runx-2)、碱性磷酸酶(alkaline phosphatase,ALP)相关基因表达水平的改变,提取总RNA,β-actin为内参照;Western blot检测Runx-2蛋白的表达,采用Bradeford蛋白浓度测定试剂盒测定蛋白含量。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gelelectrophoresis,SDS-PAGE),转膜,封闭,免疫反应,最后进行化学发光反应,观察Runx-2在转染后的表达的改变。
1.7. 统计学分析
采用SPSS 11.0统计软件进行统计分析,两独立样本均数比较用t检验,以P<0.05为差异有统计学意义。
2. 结果
2.1. HPDLSCs的分离和纯化
采用组织块法培养原代细胞,7 d组织块周围有细胞爬出,2~3周达到80%汇集,细胞呈长梭形,胞体较小,细胞质丰富(图1)。
图 1. 原代HPDLSCs 倒置显微镜 × 10.
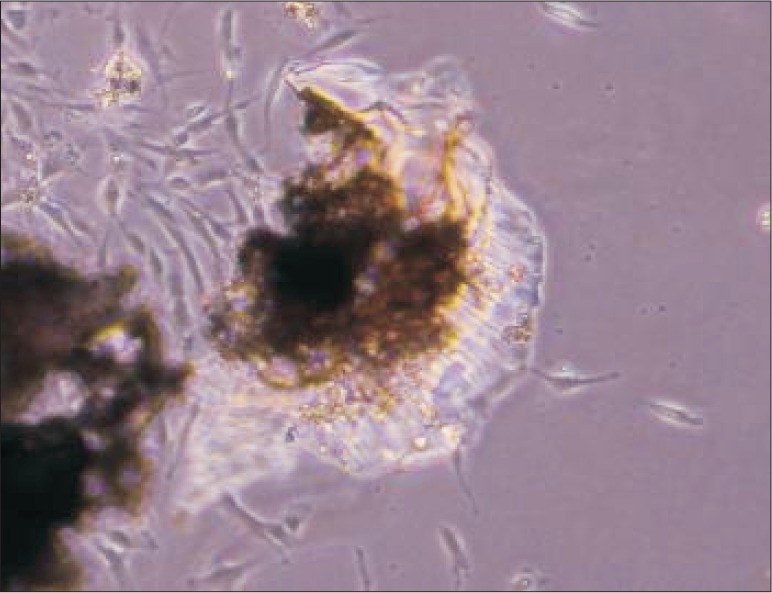
Fig 1 Primary culture of HPDLSCs inverted microscope × 10
2.2. 干细胞特性的鉴定
2.2.1. 骨向分化能力
成骨诱导液诱导牙周膜细胞21 d后行茜素红染色,可见钙化结节形成(图2)。
图 2. 成骨诱导21 d后,钙化结节形成 茜素红染色 × 10.
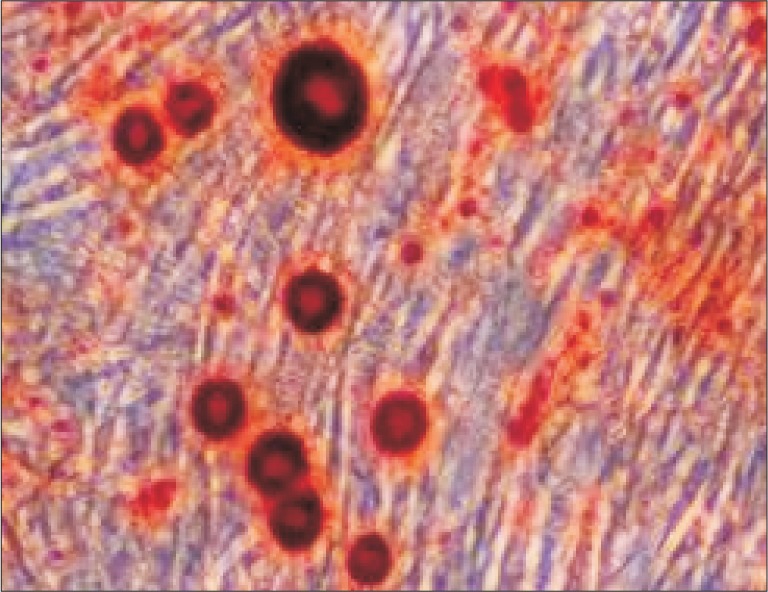
Fig 2 The formation of calcified nodules after 21 d alizarin red staining × 10
2.2.2. 脂向分化
成脂诱导液诱导牙周膜细胞21 d后行油红O染色,可见脂滴形成(图3)。
图 3. 成脂诱导21 d后,脂滴形成 油红O染色 × 10.

Fig 3 The formation of lipid droplet after 21 d oil red O staining × 10
2.3. 成骨分化过程中mir-17表达量的改变
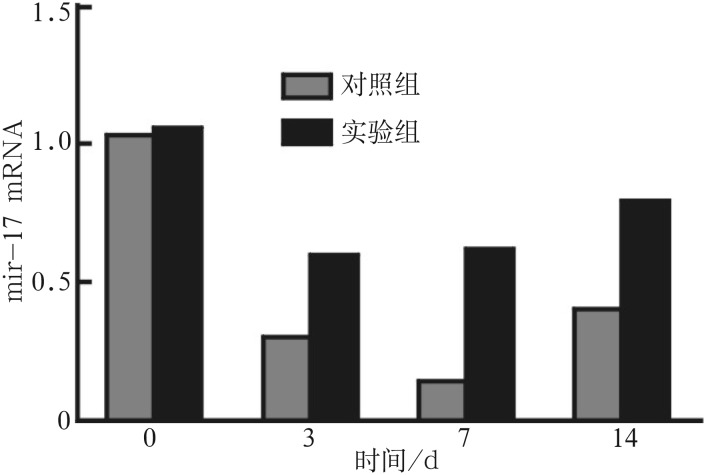
实验组和对照组成骨分化诱导后,分别在3、7、14 d提取细胞RNA,逆转录后进行real time PCR检测,结果表明:成骨诱导的过程中,实验组和对照组中的mir-17表达均下调(P<0.05),实验组表达下调的较对照组少(P<0.05)(图4)。
图 4. 成骨诱导过程中mir-17的表达.
Fig 4 Expression of mir-17 in the process of osteogenic induction
2.4. 转染效率的鉴定
对照组细胞在转染mir-17 mimics后,其表达上调了60倍;转染mir-17 inhibitor后其表达降低了近20倍。实验组细胞在转染mir-17 mimics后,其表达上调了90倍;转染mir-17 inhibitor后其表达下降了近10倍,结果表明转染成功。
2.5. 实验组mir-17对成骨分化能力的影响
转染mir-17 mimics后,成骨基因BSP、ALP、Runx-2 mRNA的表达量分别为0.753、0.679、0.712,BSP、ALP、Runx-2 mRNA水平以及Runx-2蛋白水平下降,表明上调mir-17的表达后,细胞成骨能力得到进一步的抑制。转染mir-17 inhibitor后,成骨基因BSP、ALP、Runx-2 mRNA的表达量分别为1.257、1.473、1.393,BSP、ALP、Runx-2 mRNA表达水平以及Runx-2蛋白水平上升,表明抑制mir-17的表达后,细胞的成骨能力得到一定的恢复。
3. 讨论
microRNA是一类广泛存在于动物和植物中的高度保守的单链小分子RNA,它的调控功能与细胞的增殖分裂、细胞的分化凋亡、基因的调控以及各种疾病的发生发展密切相关。microRNA可以通过抑制干细胞靶基因mRNA的表达水平来调节干细胞的自我复制和多向分化的能力,特异性microRNA是维持干细胞特性的关键分子[6],microRNA对干细胞生物学行为及命运方面有多种功能性调节作用[7]。糖尿病及其并发症与microRNA也息息相关,有研究[8]表明miR-375可以通过负调控其靶基因myotrophin的合成,抑制胰岛素分泌。Carè等[9]研究表明在糖尿病的心肌细胞中过表达miR-133能抑制心肌肥厚。
牙周炎作为糖尿病患者的并发症之一近年来也得到了广泛的研究,本实验通过探究糖尿病特征性代谢产物AGEs对HPDLSCs骨向分化的影响,拟找出导致糖尿病牙周炎患者牙周组织易破坏、破坏之后难控制的原因。在糖尿病微环境的因素影响下,HPDLSCs作为组织工程中的种子细胞,其促进牙周组织再生、改建牙槽骨的能力降低,这一现象的发生是否由于AGEs影响了HPDLSCs骨向分化过程中相关microRNA的生物学特性,从而导致了牙周膜、牙槽骨组织无法改建。
在本实验中选择mir-17作为研究对象,拟探究在这一过程中mir-17是否参与其中并发挥了调控作用。实验结果表明:在实验组和对照组中,mir-17的表达均下调,但表达量有差异,实验组mir-17的表达较对照组的表达要高,提示AGEs影响了HPDLSCs骨向分化过程中mir-17的表达,mir-17表达的改变提示microRNA调控功能发挥作用。在本实验中分别检测了3、7、14 d mir-17的表达量,结果显示:mir-17的表达量在7 d下降到最低。为了明确mir-17对实验组成骨分化能力的作用,笔者再通过细胞转染技术将过表达和抑制表达的miR-17分别转染到实验组中观察其骨相关基因的表达量是否发生了变化,结果显示:上调mir-17后,实验组中骨基因ALP、Runx-2、BSP表达受到了抑制,而下调mir-17后,ALP、Runx-2、BSP的表达量在一定程度上得到了恢复,表明mir-17负向调控了实验组的骨向分化。大量研究表明,mircoRNA是通过结合靶基因发挥作用,在接下来的实验中,笔者将进一步研究mir-17通过何种靶基因影响了AGEs-HPDLSCs的骨向分化,并明确靶基因的调控作用,拟从分子水平解释在糖尿病微环境下,HPDLSCs骨向分化能力减弱的原因,为今后的干细胞治疗积累一定的理论基础。
Funding Statement
[基金项目] 国家自然科学基金资助项目(81360168);皖南医学院重点科研项目培育基金资助项目(WK2013Z10)
References
- 1.Liu SP, Fu RH, Yu HH, et al. MicroRNAs regulation modulated self-renewal and lineage differentiation of stem cells[J] Cell Transplant. 2009;18(9):1039–1045. doi: 10.3727/096368909X471224. [DOI] [PubMed] [Google Scholar]
- 2.Gangaraju VK, Lin H. MicroRNAs: key regulators of stem cells[J] Nat Rev Mol Cell Biol. 2009;10(2):116–125. doi: 10.1038/nrm2621. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.伍 燕, 邓 超, 杨 琨, et al. 糖基化终末产物对牙周膜干细胞增殖及其Wnt经典信号通路相关基因表达的影响[J] 牙体牙髓牙周病学杂志. 2012;22(5):255–259. [Google Scholar]
- 4.邓 超, 伍 燕, 杨 琨, et al. 糖基化终末产物对人牙周膜干细胞骨向分化能力影响的研究[J] 牙体牙髓牙周病学杂志. 2012;22(5):249–254. [Google Scholar]
- 5.Liu Y, Liu W, Hu C, et al. MiR-17 modulates osteogenic differentiation through a coherent feed-forward loop in mesenchymal stem cells isolated from periodontal ligaments of patients with periodontitis[J] Stem Cells. 2011;29(11):1804–1816. doi: 10.1002/stem.728. [DOI] [PubMed] [Google Scholar]
- 6.Hatfield SD, Shcherbata HR, Fischer KA, et al. Stem cell division is regulated by the microRNA pathway[J] Nature. 2005;435(7044):974–978. doi: 10.1038/nature03816. [DOI] [PubMed] [Google Scholar]
- 7.Blakaj A, Lin H. Piecing together the mosaic of early mammalian development through microRNAs[J] J Biol Chem. 2008;283(15):9505–9508. doi: 10.1074/jbc.R800002200. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Poy MN, Eliasson L, Krutzfeldt J, et al. A pancreatic islet-specific microRNA regulates insulin secretion[J] Nature. 2004;432(7014):226–230. doi: 10.1038/nature03076. [DOI] [PubMed] [Google Scholar]
- 9.Carè A, Catalucci D, Felicetti F, et al. MicroRNA-133 controls cardiac hypertrophy[J] Nat Med. 2007;13(5):613–618. doi: 10.1038/nm1582. [DOI] [PubMed] [Google Scholar]