Abstract
目的
观察布鲁顿酪氨酸激酶(BTK)对破骨细胞增殖及分化的影响,探讨BTK对根尖周炎骨破坏的作用。
方法
破骨前体细胞RAW264.7经100 ng·L−1核因子κB受体活化因子配体(RANKL)诱导5 d后,通过观察细胞形态、抗酒石酸酸性磷酸酶(TRAP)染色及实时荧光定量PCR(RT-qPCR)的方法,验证破骨细胞是否诱导成功。破骨细胞诱导成功后,转染BTK-小干扰RNA(siRNA)24 h,利用RT-qPCR检测TRAP mRNA的表达,采用CCK-8和TRAP酶活性检测法检测破骨细胞的增殖及分化情况。
结果
RAW264.7细胞经RANKL诱导5 d后,可见大量体积较大,外观呈圆形、椭圆形,周围有不规则突起及TRAP染色阳性的多核破骨细胞。经BTK-siRNA转染24 h后,破骨细胞TRAP mRNA的表达水平显著降低(P<0.05),其增殖及分化能力也明显受到抑制(P<0.05)。
结论
抑制BTK表达,可以抑制破骨细胞的增殖及分化;BTK可作为抑制破骨细胞的新靶点。
Keywords: 破骨细胞, 布鲁顿酪氨酸激酶, 骨破坏, 小干扰RNA转染
Abstract
Objective
To observe the effect of Bruton's tyrosine kinase (BTK) on the proliferation and differentiation of osteoclasts and to explore the mechanism of BTK on bone destruction in periapical periodontitis.
Methods
After RAW264.7 cells induced with 100 ng·L−1 receptor activator for nuclear factor-κB ligand (RANKL) for 5 days, osteoclast induction was confirmed by light microscopy, tartrate-resistant acid phosphatase (TRAP) staining, and quantitative real-time PCR (RT-qPCR). Then, BTK-small interfering RNA (BTK-siRNA) was transfected into cells induced for 5 days. After 24 h, the expression of TRAP mRNA was measured using RT-qPCR, and the proliferation and differentiation of osteoclasts were detected using CCK-8 and TRAP activity assay. Statistical analysis was performed.
Results
After RAW264.7 was induced with RANKL for 5 days, a large number of round, ellipse, irregularly protuberant, and TRAP-positive macrophages were observed under light microscopy. The expression of TRAP mRNA significantly reduced after 24 h of BTK-siRNA transfection (P<0.05). The detection of CCK-8 and TRAP activities showed that the proliferation and differentiation of osteoclasts significantly decreased (P<0.05).
Conclusion
Silencing of BTK can inhibit the proliferation and differentiation of osteoclasts. BTK can be used as a new target for the inhibition of osteoclasts.
Keywords: osteoclast, Bruton's tyrosine kinase, bone destruction, small interfering RNA transfection
根尖周炎是口腔中细菌感染性、进行性疾病,慢性期时根尖区会有淋巴细胞、巨噬细胞和中性粒细胞组成的炎性浸润区,并且有大量的破骨细胞形成。免疫炎症反应长期持续性作用于机体,会引发骨代谢相关信号传导通路的变化,使骨改建的平衡失调,造成根尖周软硬组织的损伤和丧失[1]。布鲁顿酪氨酸激酶(Bruton's tyrosine kinase,BTK)是一种存在于细胞质的蛋白,是非受体Tec家族的一员,主要表达在骨髓样细胞和淋巴细胞中[2]。在炎症反应中,BTK与中性粒细胞、单核细胞以及巨噬细胞等免疫细胞的功能密切相关,同时在B细胞淋巴瘤、类风湿性关节炎、X连锁无丙种球蛋白血症中发挥关键作用[3],此外,在各种细胞转导途径中起调节作用[4]–[5]。研究[6]发现,野生小鼠在缺失BTK后,骨骼吸收功能发生缺陷,表现出强烈的骨骼石化症。
本课题组在以往研究[7]中发现,BTK的表达在大鼠实验性根尖周炎急性期处于高峰,进入慢性期后,表达开始下降,提示BTK与根尖周炎症的进展密切相关。为了进一步探究BTK在根尖周炎中的作用,本实验选择小鼠破骨细胞前体细胞系RAW264.7,通过体外培养的方法,探讨BTK对破骨细胞的增殖及分化的影响。
1. 材料和方法
1.1. 主要材料和试剂
DMEM高糖培养基、胎牛血清、胰酶(Gibco公司,美国);核因子κB受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL)[宝生物工程(大连)有限公司];抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色试剂盒(Sigma公司,美国),TRAP检测试剂盒(上海碧云天生物技术有限公司);总RNA提取试剂盒[生工生物工程(上海)股份有限公司];逆转录试剂盒、SYBR Premix ExTaqMⅡ、Xfect™ RNA Transfection Reagent[宝生物工程(大连)有限公司];CCK-8(东仁化学科技有限公司);BTK-小干扰RNA(small interfering RNA,siRNA)、Negative Control(上海吉玛制药技术有限公司);酶标仪(Thermo Fisher公司,美国)和光学显微镜(Leica公司,德国)。
1.2. 破骨细胞诱导
实验细胞为小鼠巨噬细胞系RAW264.7,使用含10%胎牛血清、1%双抗的高糖DMEM培养基的培养液,置于37 °C、5%CO2孵箱内培养。细胞使用胰酶消化3 min后传代,取第4代状态较好的细胞,铺6孔板,100 ng·L−1 RANKL诱导5 d,细胞铺板面积占30%~40%,隔天更换正常培养液。
1.3. 破骨细胞验证
1.3.1. 光学显微镜观察
将培养的细胞置于光学显微镜下观察,拍照观察RANKL诱导前后细胞形态的变化及细胞核的状态。
1.3.2. TRAP染色
采用37 °C预热的PBS清洗细胞1~2遍,4%多聚甲醛固定25 min,按TRAP染色试剂盒配液,每孔2 mL,在37 °C孵箱内避光孵育1 h,双蒸水彻底洗净后,苏木素复染3 min,PBS清洗,封片,在光学显微镜下拍照观察。若观察到2个细胞核以上且TRAP染色阳性的多核细胞即为破骨细胞。
1.3.3. 实时荧光定量PCR(quantitative real-time PCR,RT-qPCR )检测TRAP mRNA的表达
根据总RNA提取试剂盒说明,提取诱导前后RAW264.7细胞的RNA,去除基因组DNA,根据逆转录试剂盒及RT-qPCR反应说明书进行相应的操作,采用2−ΔΔ法比较mRNA的相对变化,其中小鼠TRAP及内参基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的引物委托宝生物工程(大连)有限公司设计并合成,引物序列如下。TRAP正向引物:3′-GGGTCACTGCCTACCTGTGT-5′;TRAP反向引物:3′-TCATTTCTTTGGGGCTTATCTC-5′;GAPDH正向引物:3′-TGAAGGGGTCGTTGATGG-5′;GAPDH反向引物:3′-AAATGGTGAAGGTCGGTGTG-5′。
1.4. BTK-siRNA转染
将诱导5 d后的破骨细胞铺6孔板,细胞铺板面积占总面积的30%~50%,待完全贴壁后,吸弃细胞原培养液,每孔加入1 mL DMEM培养液,根据转染试剂盒说明书配置转染液,设置实验组(Si组)、阴性对照(NC)组、空白对照(MOCK)组。Si组细胞加入BTK siRNA和转染试剂的混合液,NC组加入Negative Control和转染试剂的混合液,MOCK组只加入转染试剂。各组混合液静置15 min后加入细胞内,37 °C孵箱内饥饿培养4~6 h后更换正常培养液,24 h后收获细胞,测定BTK-siRNA的转染效率。
1.5. RT-qPCR检测BTK-siRNA转染后破骨细胞TRAP mRNA的表达
采用与1.3.3相同的方法检测转染BTK-siRNA后各组细胞TRAP mRNA的表达。
1.6. CCK-8法检测BTK-siRNA转染后破骨细胞的增殖活性
将诱导后的破骨细胞同样设置Si、NC和MOCK组,分别测定转染前(0 h)和转染24、48 h后细胞的增殖活性。在96孔板中接种各组细胞悬液,每孔100 µL,置于37 °C、5%CO2培养箱中预培养24 h,观察细胞状态和密度,之后进行转染,转染方法同1.4,加入转染试剂4~6 h更换正常培养液后,继续培养24、48 h,用酶标仪分别测定转染前(0 h)和转染24、48 h后各组细胞在450 nm处的光密度(optical density,OD)值。96孔板内每孔加入10 µL CCK-8溶液和90 µL DMEM的混合溶液,避免产生气泡,将培养板置于培养箱内孵育1 h后检测。使用SPSS 20.0软件分析各个时间点OD值的变化趋势,OD值越高说明细胞活性越高。
1.7. TRAP检测试剂盒检测BTK-siRNA转染后破骨细胞的TRAP酶活性检测
将诱导后的破骨细胞同样设置Si、NC和MOCK组,分别测定BTK-siRNA转染前(0 h)和转染24、48 h后破骨细胞TRAP酶活性。在96孔板中接种各组细胞悬液,每孔100 µL,置于37 °C、5%CO2培养箱中预培养24 h,观察细胞状态和密度,之后进行转染,转染方法同1.4,加入转染试剂4~6 h更换正常培养液后,继续培养24、48 h,收集各组样本,参照TRAP检测试剂盒(PNP微板法)说明书配置显色工作液和标准品工作液,按照表1在96孔板内加样,设置空白对照组、标准孔组、待测样品组,标准品的用量为4、8、16、24、32、40 µL,轻轻混匀后,37 °C孵育30 min,每孔加入160 µL Stopping Solution终止反应,采用酶标仪测定各组细胞在450 nm处的OD值,OD值越高代表酶活性越高。
表 1. 96孔板加样量.
Tab 1 96-well plate sample volume
| 加样液 | 空白对照组 | 标准孔组 | 待测样品组 |
| 显色工作液 | 40 | 40 | 40 |
| PNP(p-nitrophenol)溶液 | 5 | 5 | 5 |
| 检测缓冲液 | 40 | 40-x | 40-y |
| 待测样品 | - | - | y |
| 标准品工作液 | - | x | - |
µL
1.8. 统计学分析
使用SPSS 20.0统计学软件进行分析,多组之间的比较采用单因素方差分析法,检验水准为双侧α=0.05。
2. 结果
2.1. 破骨细胞的鉴定
经过RANKL诱导5 d后,光学显微镜下可见大量RAW264.7细胞被成功诱导为细胞较大,圆形、椭圆形、水煎蛋型等不同形态的多核细胞,细胞周围有明显的伪足(图1);经TRAP染色,高倍镜下观察到细胞呈酒红色,有3个及以上的细胞核,细胞核不着色,可见核仁,细胞质内可见许多深褐色的酸性磷酸酶颗粒(图2)。
图 1. RANKL诱导前(左)及诱导后(右)RAW264.7细胞的形态 光学显微镜 × 200.

Fig 1 Cell morphology of RAW264.7 cells before (left) and after (right) induced by RANKL optical microscope × 200
图 2. RANKL诱导前(左)及诱导后(右)RAW264.7细胞的TRAP染色 TRAP × 200.
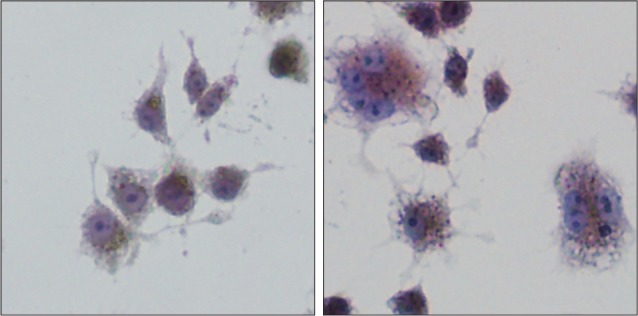
Fig 2 TRAP staining resluts of RAW264.7 cells before (left) and after (right) induced by RANKL TRAP × 200
经过RANKL诱导5 d后,RAW264.7细胞TRAP mRNA的表达较诱导前明显升高(图3),差异有统计学意义(P<0.05)。
图 3. RANKL诱导前后RAW264.7细胞中TRAP mRNA的表达情况.
Fig 3 The expression of TRAP mRNA in RAW264.7 cells before and after induced by RANKL
*P<0.05。
2.2. BTK-siRNA的转染效率
BTK-siRNA转染后破骨细胞中BTK mRNA的表达情况见图4。BTK沉默24 h后,与MOCK组和NC组相比,Si组BTK mRNA的相对表达量明显降低(P<0.05),转染效率大于50%。
图 4. BTK-siRNA转染后BTK mRNA的表达情况.
Fig 4 The expression of BTK mRNA after BTK-siRNA transfection
*P<0.05。
2.3. BTK-siRNA转染下调破骨细胞TRAP mRNA的表达
与MOCK组和NC组相比,BTK-siRNA转染后,Si组细胞中TRAP mRNA的相对表达量明显降低(P<0.05),提示转染BTK后破骨细胞的分化受到抑制(图5)。
图 5. BTK-siRNA转染后TRAP mRNA的表达情况.
Fig 5 The expression of TRAP mRNA after BTK-siRNA transfection
*P<0.05。
2.4. BTK-siRNA转染抑制破骨细胞的增殖及分化
CCK-8检测结果见图6。与NC组和MOCK组相比,Si组的细胞在24、48 h的增殖活性均明显降低(P<0.05);提示BTK表达沉默后,破骨细胞的增殖受到抑制。
图 6. BTK-siRNA转染后破骨细胞的增殖情况.

Fig 6 Proliferation of osteoclasts after BTK-siRNA transfection
*P<0.05。
TRAP酶活性检测结果见图7。与NC组和MOCK组相比,BTK-siRNA转染后,Si组细胞在24、48 h的TRAP酶活力均明显降低(P<0.05),提示破骨细胞的分化受到抑制。
图 7. BTK-siRNA转染后破骨细胞的分化情况.
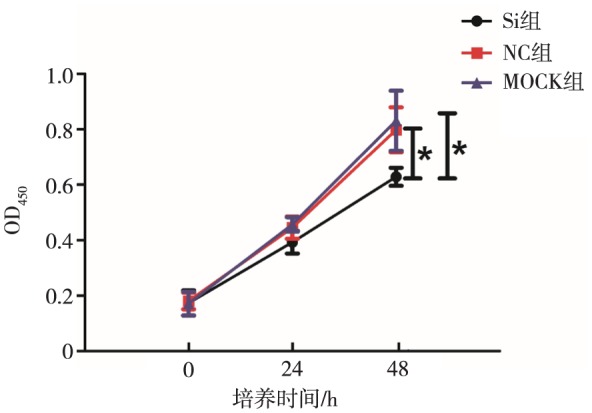
Fig 7 Differentiation of osteoclasts after BTK-siRNA transfection
*P<0.05。
3. 讨论
破骨细胞在牙周炎、根尖周炎、骨质疏松、骨肿瘤等许多疾病的骨破坏中发挥着关键作用[8],其分化过程极其复杂,有众多的细胞因子参与,其中RANKL是调控破骨分化和成骨分化的关键因子[9]–[10]。RANKL与破骨细胞前体细胞上的核因子κB受体(receptor activator for nuclear factor-κB,RANK)结合,最终引起破骨细胞特殊基因的表达并向破骨细胞分化[11]。本实验使用100 ng·L−1的RANKL作用破骨前体细胞,5 d后成功诱导出多核破骨细胞。TRAP是破骨细胞的标志性酶,是破骨细胞分化成熟的标志,反映其活性和骨吸收的状态[12]。本研究结果证实,RANKL诱导后,TRAP mRNA的表达量明显增高。
BTK参与了RANKL介导的破骨细胞信号通路, RANKL与RANK结合后激活下游的BTK,使其磷酸化后激活磷脂酶-Cγ[13],从而引发Ca2+-CN信号通路,去磷酸化后激活活化T细胞核因子(nuclear factor of activated T-cells cytoplasmic 1,NFATc1),而NFATc1是具有多项调节功能的转录因子,与破骨细胞的分化成熟及功能发挥等过程密切相关。BTK在B细胞发育、炎症和骨质破坏中起着关键作用。研究[7]发现,BTK在人类慢性根尖周炎病损组织中的相对表达量较健康牙周膜组织明显增高,并且随着根尖周病变程度的增加而增高;在实验性大鼠根尖周炎模型中也发现了一致的结果。
阻断BTK信号传导可有效改善淋巴瘤的进展和实验性关节炎[14]。有学者[15]利用BTK抑制剂PCI-32765探讨BTK在骨髓微环境中对破骨细胞生成及多发性骨髓瘤生长的影响,结果显示,PCI-32765可显著抑制小鼠体内多发性骨髓瘤的生长和骨髓瘤细胞诱导植入的人骨碎片的骨溶解。本实验通过转染BTK-siRNA,发现破骨细胞的增殖和TRAP酶活性均被抑制,TRAP mRNA的表达量也明显降低,证明BTK参与了破骨细胞的增殖与分化。还有研究[15]发现,PCI-32765通过抑制破骨细胞分化和功能来发挥作用,同时下调NFATc1的表达,并破坏成熟破骨细胞中肌动蛋白环,与本实验结果相一致。
正常的骨代谢中,骨吸收和骨形成处于一个动态平衡,破骨细胞分化的激活和功能亢进打破了这一平衡,是导致牙槽骨吸收的关键环节[9]。根尖周炎引起的骨代谢异常中,除了破骨细胞代谢异常外,成骨细胞也受到影响。研究[16]发现,BTK除在破骨细胞中发挥着关键作用外,同时参与成骨细胞的调节,可以抑制成骨细胞标志物碱性磷酸酶、骨钙素和Osterix等的表达。另外,敲除BTK后,碱性磷酸酶、骨钙素和Osterix等的表达增加。
综上所述,抑制BTK可抑制破骨细胞的增殖和分化,BTK可作为抑制破骨细胞的新靶点,但其具体的作用机制还有待进一步研究。为进一步探索BTK在根尖周炎中的作用机制,本课题组将继续研究BTK在炎症微环境中对破骨细胞和成骨细胞的影响。
Funding Statement
[基金项目] 国家自然科学基金(81171538)
Supported by: The National Natural Science Foundation of China (81171538).
References
- 1.Wang LN, Dong M, Zheng JB, et al. Relationship of biofilm formation and gelE gene expression in Enterococcus faecalis recovered from root canals in patients requiring endodontic retreatment[J] J Endod. 2011;37(5):631–636. doi: 10.1016/j.joen.2011.02.006. [DOI] [PubMed] [Google Scholar]
- 2.Lee MS, Kim YJ. Signaling pathways downstream of pattern-recognition receptors and their cross talk[J] Annu Rev Biochem. 2007;76(1):447–480. doi: 10.1146/annurev.biochem.76.060605.122847. [DOI] [PubMed] [Google Scholar]
- 3.Honigberg LA, Smith AM, Sirisawad M, et al. The Bruton tyrosine kinase inhibitor PCI-32765 blocks B-cell activation and is efficacious in models of autoimmune disease and B-cell malignancy[J] Proc Natl Acad Sci U S A. 2010;107(29):13075–13080. doi: 10.1073/pnas.1004594107. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Faris M, Bot A. In this issue: Tec kinases in the crosshairs[J] Int Rev Immunol. 2012;31(2):85–86. doi: 10.3109/08830185.2012.671692. [DOI] [PubMed] [Google Scholar]
- 5.Horwood NJ, Urbaniak AM, Danks L. Tec family kinases in inflammation and disease[J] Int Rev Immunol. 2012;31(2):87–103. doi: 10.3109/08830185.2012.670334. [DOI] [PubMed] [Google Scholar]
- 6.Lee SH, Kim T, Jeong D, et al. The Tec family tyrosine kinase Btk Regulates RANKL-induced osteoclast maturation[J] J Biol Chem. 2008;283(17):11526–11534. doi: 10.1074/jbc.M708935200. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.曲 文姝, 钟 林娜, 董 明, et al. 酪氨酸激酶Btk在根尖周炎中的表达研究[J] 中国微生态学杂志. 2017;29(1):50–53. [Google Scholar]; Qu WS, Zhong LN, Dong M, et al. Btk expression in periapical periodontitis in human and rats[J] Chin J Microecol. 2017;29(1):50–53. [Google Scholar]
- 8.Cho YA, Jue SS, Bae WJ, et al. PIN1 inhibition suppresses osteoclast differentiation and inflammatory responses[J] J Dent Res. 2015;94(2):371–380. doi: 10.1177/0022034514563335. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.何 飞, 吴 勇, 周 艳, et al. Notch信号促进核因子κB受体活化因子配体诱导的破骨细胞分化的体外研究[J] 华西口腔医学杂志. 2015;33(1):25–28. doi: 10.7518/hxkq.2015.01.006. [DOI] [PMC free article] [PubMed] [Google Scholar]; He F, Wu Y, Zhou Y, et al. Notch signaling promotes receptor activator of nuclear factor kappa B ligand-induced ostoclastogenesis of RAW264.7 cells in vitro[J] West China J Stomatol. 2015;33(1):25–28. doi: 10.7518/hxkq.2015.01.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Wang LN, Jin HW, Ye DD, et al. Enterococcus faecalis lipo-teichoic acid-induced NLRP3 inflammasome via the activation of the nuclear factor kappa B pathway[J] J Endod. 2016;42(7):1093–1100. doi: 10.1016/j.joen.2016.04.018. [DOI] [PubMed] [Google Scholar]
- 11.Levaot N, Ottolenghi A, Mann M, et al. Osteoclast fusion is initiated by a small subset of RANKL-stimulated monocyte progenitors, which can fuse to RANKL-unstimulated progenitors[J] Bone. 2015;79:21–28. doi: 10.1016/j.bone.2015.05.021. [DOI] [PubMed] [Google Scholar]
- 12.Halleen JM, Tiitinen SL, Ylipahkala H, et al. Tartrate-resistant acid phosphatase 5b (TRACP 5b) as a marker of bone resorption[J] Clin Lab. 2006;52:499–509. [PubMed] [Google Scholar]
- 13.Shinohara M, Koga T, Okamoto K, et al. Tyrosine kinases Btk and Tec regulate osteoclast differentiation by linking RANK and ITAM signals[J] Cell. 2008;132(5):794–806. doi: 10.1016/j.cell.2007.12.037. [DOI] [PubMed] [Google Scholar]
- 14.Horwood NJ, Urbaniak AM, Danks L. Tec family kinases in inflammation and disease[J] Int Rev Immunol. 2012;31(2):87–103. doi: 10.3109/08830185.2012.670334. [DOI] [PubMed] [Google Scholar]
- 15.Tai YT, Chang BY, Kong SY, et al. Bruton tyrosine kinase inhibition is a novel therapeutic strategy targeting tumor in the bone marrow microenvironment in multiple myeloma[J] Blood. 2012;120(9):1877–1887. doi: 10.1182/blood-2011-12-396853. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Kaneshiro S, Ebina K, Shi K, et al. Bruton tyrosine kinase (Btk) suppresses osteoblastic differentiation[J] J Bone Miner Metab. 2015;33(5):486–495. doi: 10.1007/s00774-014-0612-8. [DOI] [PubMed] [Google Scholar]





