Abstract
目的
研究纯钛表面加载氧化石墨烯的工艺表征及对金黄色葡萄球菌黏附和成骨细胞生物结构的影响。
方法
采用电镀法分别将4种质量浓度(20、50、80、100 µg·mL−1)氧化石墨烯加载于纯钛表面,通过场发射扫描电子显微镜、显微拉曼光谱仪和接触角测试仪对其形貌、性状及亲水性能进行测试;以金黄色葡萄球菌和成骨细胞为模型,与改性后的纯钛共培养,利用场发射扫描电子显微镜和激光共聚焦显微镜观察细菌黏附和成骨细胞形态和结构的变化。
结果
4种质量浓度的氧化石墨烯通过电镀法成功加载于纯钛表面,提高了纯钛表面的亲水性能,有利于金黄色葡萄球菌黏附和生长,并可改变成骨细胞形态和结构。
结论
纯钛-氧化石墨烯复合材料无抗菌性能,但具有较好的生物相容性。
Keywords: 纯钛, 氧化石墨烯, 工艺表征, 金黄色葡萄球菌, 细胞结构
Abstract
Objective
To evaluate the process characterization of graphene oxide loaded on pure titanium surface and effect on the biological properties of Staphylococcus aureus and osteoblasts.
Methods
Graphene oxide at four concentrations (20, 50, 80, and 100 µg·mL−1) was loaded on the pure titanium surface via electroplating, and the morphology, properties, and hydrophilic properties were measured with a field emission scanning electron microscope, micro Raman spectrometer, and contact angle tester, respectively. In addition, Staphylococcus aureus and osteoblasts were used as models and cultured with pure titanium-graphene oxide. Then, field-emission scanning electron microscopy and laser confocal microscopy were utilized to observe the changes in the amount of bacteria and osteoblast morphology and structure, respectively.
Results
Graphene oxide at the four concentrations was successfully loaded on pure titanium surface via electroplating. It improved the hydrophilic properties of pure titanium surface, which benefitted the adhesion and growth of Staphylococcus aureus and changed the morphology and structure of the osteoblasts.
Conclusion
The pure titanium-graphene oxide composite has no antibacterial properties and has good biocompatibility.
Keywords: pure titanium, graphene oxide, process characterization, Staphylococcus aureus, cell structure
钛及其合金作为种植体材料已被口腔临床广泛应用,但与骨组织结合及周围组织感染等问题仍有待解决[1]。理想的种植体材料应具备较好的生物相容性及适当的抗菌效能[2],可以加快骨整合进程,阻止细菌生物膜形成。研究[3]显示,种植体周围组织感染率高达22%,主要是因为口腔是多种微生物共存的微环境,种植体存在于这种环境中,易使细菌定植于其结构表面,尤其是穿龈结构基台的表面,唾液冲刷及物理操作不易清洁,使得种植体周围组织发生细菌感染率升高,从而进一步发生种植体-骨界面结合不良或种植体松动脱落,导致种植手术失败。如何在钛及其合金材料表面获得较优良的骨整合性能以及阻碍或抑制细菌生物膜形成的骨及牙科植入材料,是基础研究及临床应用长期关注的重要领域[4]–[5]。本研究旨在探讨氧化石墨烯(graphene oxide,GO)加载于纯钛金属表面的工艺过程,并探讨该复合材料对金黄色葡萄球菌和成骨细胞黏附性能的影响。
1. 材料和方法
1.1. 材料和仪器
纯钛片(纯度99.9%,体积10 mm×10 mm×2 mm,西北有色金属研究院);GO(南京先丰纳米材料科技有限公司);碳化硅水砂纸(400~2 000目);无水乙醇(天津市风船化学试剂科技有限公司);丙酮、戊二醛、多聚甲醛、氢氟酸(天津恒兴化学试剂制造有限公司);金黄色葡萄球菌(ATCC25923,空军军医大学口腔医院微生物实验室);脑心浸液(brian-heart infusion,BHI)培养基(Oxoid公司,英国);α-MEM基础培养液、牛血清白蛋白(Gibco公司,英国);罗丹明-鬼笔环肽(Sigma公司,美国);细胞膜染色剂CellTracker(YEASEN公司,美国);细胞核染色剂4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI;上海阿拉丁生化科技股份有限公司)。
直流稳压电源(DBO-60型,北京大华无线电仪器厂);超声波清洗机(昆山市超声仪器有限公司);磁力搅拌器(CJJ78-1型,江西金坛阳光仪器场厂);超净工作台(苏州净化设备有限公司);微量加样器(Eppendorf公司,德国);细菌浊度计(SCZ-6AXJ型,上海悦丰仪器仪表有限公司);S-4800型场发射扫描电子显微镜(field emission scanning electron microscope,FE-SEM;Hitach公司,日本);显微拉曼光谱仪(HR800型,Horiba公司,日本);接触角测试仪(EasyDrop Standard型,Kruss公司,德国);激光共聚焦显微镜(A1R/A1型,Nikon公司,日本)。
1.2. 电镀法制备Ti-GO涂层
在水环境下,纯钛片经碳化硅水砂纸(400、600、800、1 000、1 200、1 500、2 000目)顺序抛光至无明显划痕,置于分别盛有丙酮、去离子水和无水乙醇的烧杯中超声震荡各10 min,完成后浸泡于无水乙醇中封盖备用。GO加载方法:钛片为阳极,石墨片为阴极,反应液为GO水溶液,质量浓度分别为20、50、80、100 µg·mL−1,置于磁力搅拌器上(350 r·min−1)搅拌,反应电压为20 V,时间为10 min,加载前于反应液中滴加入少量氨水。纯钛片组记为CON组,不同质量浓度GO组分别标记为G20、G50、G80和G100组。
1.3. 试样表面形貌分析
试样制备完成后于室温环境下自然干燥,使用FE-SEM对其表面形貌进行观察。
1.4. 试样表面涂层分析
采用显微拉曼光谱仪对改性前后的纯钛试样表面进行表征,发射波长为633 nm,工作时间为10 s,位移为1 000~3 000 cm−1,放大倍数为100倍。
1.5. 试样表面亲水性能测试
室温环境下,将10 µL去离子水缓慢滴向各组试样表面,利用接触角测试仪对测试过程进行图像采集以及数据分析,液滴两侧角度平均值记为一次结果,每个试样表面测试9个位点,计算平均值。
1.6. 细菌黏附实验
1.6.1. 细菌培养
取金黄色葡萄球菌冻存株涂于BHI培养板中,37 °C有氧复苏24 h,挑取单菌落再次涂布于新培养板中,相同条件下继续培养24 h。用湿棉棒轻柔采集菌落,分散于新鲜BHI培养液中,利用比浊仪测定细菌光密度值,倍比稀释至106 CFU·mL−1待用。
1.6.2. 黏附实验过程
将消毒后的纯钛片和4组实验组置于24孔板中,并加入1 mL上述菌液,置于37 °C恒温箱内分别有氧培养4 h和12 h,培养结束后,用PBS轻柔漂洗3次,每孔加入2 mL 2.5%戊二醛溶液,于4 °C环境下过夜固定,次日轻柔漂洗后用乙腈梯度脱水(50%、70%、80%、90%、95%、100%),每次15 min,脱水完成后浸泡于无水乙醇中进行真空干燥、喷金和SEM观察,每组试样设置3个平行实验。
1.7. 细胞实验
1.7.1. 成骨细胞培养
使用改良型α-MEM培养基(含10%胎牛血清和1%青霉素/链霉素),在37 °C、含5%CO2环境下培养MC3T3-E1成骨细胞,每3 d换液1次,当细胞密度达到85%时,使用0.25%胰蛋白酶进行消化传代。
1.7.2. 试样表面成骨细胞形态和结构观察
将消毒后的纯钛片和4组实验组置于24孔板中,加入1 mL密度为2×104·mL−1上述细胞混合液,于37 °C培养箱内共培养24 h,培养结束后,PBS轻柔漂洗3次,CellTracker染色剂与细胞共培养30 min,漂洗后,4%多聚甲醛固定15 min,并用罗丹明-鬼笔环肽室温孵育30 min,细胞核用DAPI染色标记10 min,再次漂洗后封片保存,采用激光共聚焦显微镜观察成骨细胞的结构和形态。
1.8. 统计学分析
本研究采用SPSS 17.0统计软件包进行单因素方差分析和SNK-q检验,检验水准为双侧α=0.05。
2. 结果
2.1. Ti-GO改性对试样表面形貌的影响
试样改性前后的表面形貌分析如图1所示。CON组纯钛试样表面可见明显划痕,且边缘锐利;经GO改性后,钛片表面显示为薄膜物质,划痕随着GO质量浓度升高变浅或消失,划痕流线也变圆滑;当GO质量浓度进一步升高达到80、100 µg·mL−1时,钛片表面出现皱折样结构。
图 1. Ti-GO试样的表面形貌 FE-SEM.
Fig 1 Surface morphology of Ti-GO specimens surface FE-SEM
从左至右分别为CON、G20、G50、G80和G100组;上:× 5 000;下:× 20 000。
2.2. Ti-GO涂层性状分析
采用拉曼光谱对Ti-GO涂层的性状进行分析,结果如图2所示。CON组纯钛表面为无定形杂峰(图2黑曲线),在Y轴的位置对应于10~50之间。经GO改性后,试样表面出现了明显的双峰结构,即D峰和G峰,分别位于1 350 cm−1和1 580 cm−1附近,且随着GO质量浓度升高,D峰和G峰在Y轴上的对应值也随之增加(图2红、蓝、绿、紫曲线)。
图 2. Ti-GO试样表面涂层性状的拉曼光谱分析.

Fig 2 Raman spectroscopic analysis of surface coating properties on Ti-GO specimens surface
2.3. Ti-GO改性对试样表面亲水性能的影响
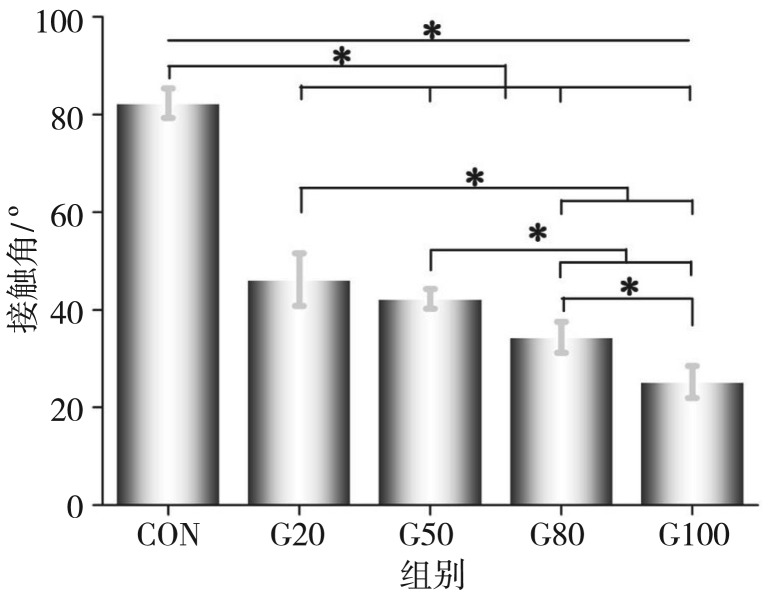
CON组纯钛表面经GO改性前后亲水性能测试结果见图3、4。去离子水滴加在纯钛表面,液滴收拢呈球状;4种质量浓度GO改性纯钛表面后,液滴形状发生变化,由椭圆逐渐变成扁平(图3)。通过接触角测试定量分析可知,改性前后纯钛表面接触角均小于90°,改性后随着质量浓度升高接触角变小(图4)。经统计学分析,组间差异有统计学意义,各组间两两比较,除G20、G50组间差异无统计学意义外,其余各组间差异均有统计学意义(P<0.05)。
图 3. Ti-GO试样表面的液滴形态示意图.
Fig 3 Tchematic diagram of the droplet shape on Ti-GO specimens surface
从左到右分别为CON、G20、G50、G80和G100组。
图 4. Ti-GO试样表面接触角.
Fig 4 Surface contact angle on Ti-GO specimens surface
*,P<0.05。
2.4. Ti-GO改性对试样表面细菌黏附的影响
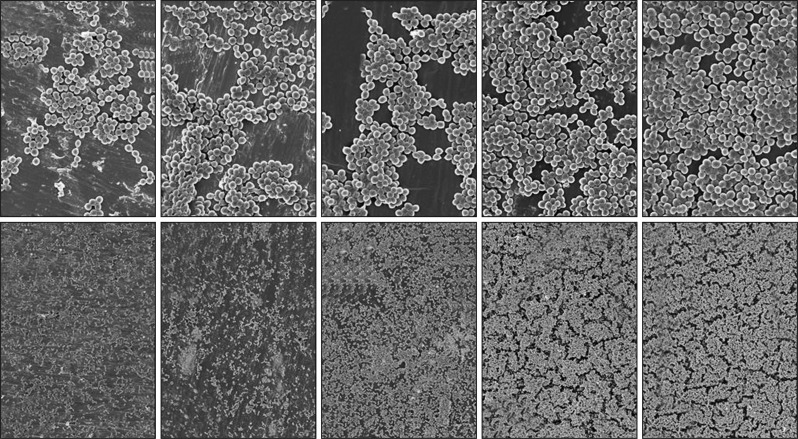
纯钛表面经GO改性前后与金黄色葡萄球菌共培养后的结果如图5所示。CON组表面可见一定数量的细菌黏附;GO改性后与细菌分别共培养4、12 h,试样表面黏附细菌较CON组明显增加。
图 5. Ti-GO试样表面细菌黏附情况 SEM.
Fig 5 Bacteria adhesion on Ti-GO specimens surface SEM
从左至右分别为CON、G20、G50、G80和G100组;上:培养4 h,× 5 000;下:培养12 h,× 1 000。
2.5. Ti-GO改性对试样表面细胞结构的影响
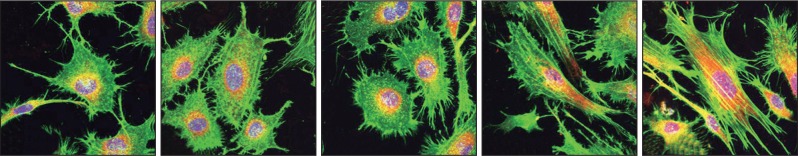
各组Ti-GO试样表面的MC3T3-E1成骨细胞培养24 h后,细胞结构染色如图6所示。图6中绿色为细胞骨架,橙黄色为细胞膜,蓝色为细胞核。CON组纯钛表面细胞呈圆形或梭形,细胞尺寸较小,边界有少量丝状伪足;经GO改性后,G20组和G50组细胞形态表现相似,呈类椭圆形,且有较丰富的丝状伪足;G80组和G100组细胞结构相似,呈梭形排列,主要以板状伪足黏附于Ti-GO表面。
图 6. Ti-GO试样表面MC3T3-E1细胞形态 激光共聚焦显微镜 × 40.
Fig 6 MC3T3-E1 cell morphology on Ti-GO specimens surface laser confocal microscope × 40
从左至右分别为CON、G20、G50、G80和G100组。
3. 讨论
如何加快种植体周围软组织封闭作用以及提高种植手术成功率一直是种植医生致力研究的问题。短期内使上皮和结缔组织附着于种植体基台表面,达到较好的封闭效果,阻止细菌生物膜形成是一个重要的研究方向。种植体周围上皮和结缔组织的附着方式类似于天然牙,如半桥粒或基底膜结合等[6]。目前,通常用两种方式实现以上目标,第1种是在手术过程中尽量避免破坏生物学宽度,第2种是通过对种植体材料表面进行修饰加快种植体周围软组织封闭功能。植体材料与周围软组织之间实现良好的封闭和结合,需要有效的表面修饰与良好的生物相容性。有效的植体材料表面修饰不仅可以有效清除玷污层促进细胞黏附,而且可以帮助周围软组织获得紧密的封闭防御功能。
GO及其复合材料是一类新型的性能优异的碳材料,拥有丰富的官能团和较高的比表面积,已被广泛研究和应用[7],如电池和生物医药领域等。GO周围及表面含有较多的含氧基团,如羟基、羰基、羧基、环氧基等,较易对GO含氧基团进行化学修饰,因此其研究和应用领域较为广泛,在基因转染、生物检测、细胞成像、药物输送、抗菌治疗、肿瘤光热治疗等方面均有涉及。本课题组成功利用银离子加载于钛及GO表面,抗菌实验结果显示,不同质量浓度的GO银复合材料对变异链球菌及牙龈卟啉单胞菌均显示出较好的抗菌效果[8]。2010年,Hu等[9]首次报道了GO的抗菌作用,当GO质量浓度为85 µg·mL−1时,大肠埃希菌的活性明显受到抑制。此后的研究[10]也显示GO对多种常见菌具有明显的抗菌作用,并且对时间和浓度有依赖性。但还有不少研究报道了相反的结果。Ruiz等[11]研究显示,GO具有促进细菌黏附、分化和增殖的作用。当GO质量浓度为200 µg·mL−1时,大肠埃希菌与其共培养3 h后,细菌存活率高达97.95%[12]。本研究抗菌实验结果显示,不同质量浓度未加银改性的Ti-GO复合材料与金黄色葡萄球菌分别共培养4 h和12 h后,均未产生抗菌效果,反而促进了细菌的黏附和生长(图5),该结果与Ruiz等[11]一致,与He等[13]研究结果相反。分析可能原因是,GO通过非共价键吸附培养基中的牛血清蛋白、氨基酸和其他蛋白质成分等,这些物质将GO包裹覆盖,使细菌无法与GO接触,并且蛋白及氨基酸成分有利于细菌及细胞黏附,从而使GO不能产生抗菌性能[12]。
FE-SEM结果显示(图1),钝Ti表面经不同质量浓度GO改性后出现类膜物质,且膜皱折程度与GO浓度呈正相关关系。可能原因是GO带负电荷或呈电负性,在不同的质量浓度下,相同面积呈正电荷的钝钛表面可能会吸引数量较多的类膜物质,而每层类膜物质太薄(仅1.1 nm±0.2 nm),共轭平面结构易被破坏,致使类膜物质沉积不平整,出现皱折。经拉曼光谱分析可知(图2),此类膜物质出现了D、G双峰结构,为GO物质。D峰值出现在1 350 cm−1附近,由无序振动造成,通常情况下,D峰值位于1 270~1 450 cm−1之间,峰值大小与所检测仪器激发波长有关[14];G峰值位于1 580 cm−1附近,是GO的主要特征峰,由碳原子内部振动造成,易受应力作用影响。
纯钛表面经不同浓度GO改性后,其表面亲水性能也随之变化,主要是因为:1)GO结构中含有丰富的含氧官能基团,这些官能团与水分子有极大的亲和性;2)GO是由碳原子组成的蜂窝状二维结构[15],这种结构可能有利于提高材料对水的亲和性。
GO所呈现出的抗菌性能已被大家所熟知,然而,作为生物材料,其生物相容性也同样受重视,GO的安全性能依赖浓度而变化。当GO质量浓度小于20 µg·mL−1,细胞活性无明显变化;当GO质量浓度大于50 µg·mL−1时,细胞活性明显受到抑制,并相继出现凋亡现象[16]。细胞与GO共培养时,通过内吞作用将GO摄入细胞内。当GO质量浓度为85 µg·mL−1时,共培养24 h后,采用流式细胞仪检测细胞活性,结果显示,细胞周期处于G2期,并未出现细胞凋亡现象[9]。本研究细胞黏附实验结果显示(图6),4种不同质量浓度的GO加载于钛片表面后,成骨细胞活性并未受明显影响,只是在形态上存在差别。可能原因是,细胞摄入不同数量的GO后,细胞内活性氧自由基含量升高,表现出不同程度的氧化应激反应[17],最终导致细胞形态出现变化。针对本实验这一研究结果,仍需进一步探讨。
综上所述,通过电镀法可将4种不同质量浓度GO加载到纯钛表面,可改变钛表面形貌和亲水性能,改性方法简单易控;通过与细菌和细胞共培养,可以发现GO可影响细菌和细胞生物学行为,且具有浓度依赖性。
References
- 1.Poli PP, Cicciu M, Beretta M, et al. Peri-implant mucositis and peri-implantitis: a current understanding of their diagnosis, clinical implications, and a report of treatment using a combined therapy approach[J] J Oral Implantol. 2017;43(1):45–50. doi: 10.1563/aaid-joi-D-16-00082. [DOI] [PubMed] [Google Scholar]
- 2.Ou KL, Weng CC, Lin YH, et al. A promising of alloying modified beta-type Titanium-Niobium implant for biomedical applications: microstructural characteristics, in vitro biocompatibility and antibacterial performance[J] J Alloys Compounds. 2017;697:231–238. [Google Scholar]
- 3.Derks J, Tomasi C. Peri-implant health and disease. A systematic review of current epidemiology[J] J Clin Periodontol. 2015;42:S158–S171. doi: 10.1111/jcpe.12334. [DOI] [PubMed] [Google Scholar]
- 4.Huang HL, Chang YY, Lai MC, et al. Antibacterial TaN-Ag coatings on titanium dental implants[J] Surface Coat Technol. 2010;205(5):1636–1641. [Google Scholar]
- 5.Nayak AG, Fernandes A, Kulkarni R, et al. Efficacy of antibacterial sealing gel and O-ring to prevent microleakage at the implant abutment interface: an in vitro study[J] J Oral Implantol. 2014;40(1):11–14. doi: 10.1563/AAID-JOI-D-10-00167. [DOI] [PubMed] [Google Scholar]
- 6.Almela T, Al-Sahaf S, Bolt R, et al. Characterization of multilayered tissue-engineered human alveolar bone and gingival mucosa[J] Tissue Eng Part C Methods. 2018;24(2):99–107. doi: 10.1089/ten.TEC.2017.0370. [DOI] [PubMed] [Google Scholar]
- 7.Sanchez VC, Jachak A, Hurt RH, et al. Biological interactions of graphene-family nanomaterials: an interdisciplinary review[J] Chem Res Toxicol. 2012;25(1):15–34. doi: 10.1021/tx200339h. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Jin JF, Zhang L, Shi MQ, et al. Ti-GO-Ag nanocomposite: the effect of content level on the antimicrobial activity and cytotoxicity[J] Int J Nanomedicine. 2017;12:4209–4224. doi: 10.2147/IJN.S134843. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Hu WB, Peng C, Luo WJ, et al. Graphene-based antibacterial paper[J] ACS Nano. 2010;4(7):4317–4323. doi: 10.1021/nn101097v. [DOI] [PubMed] [Google Scholar]
- 10.Liu SB, Zeng TH, Hofmann M, et al. Antibacterial activity of graphite, graphite oxide, graphene oxide, and reduced graphene oxide: membrane and oxidative stress[J] ACS Nano. 2011;5(9):6971–6980. doi: 10.1021/nn202451x. [DOI] [PubMed] [Google Scholar]
- 11.Ruiz ON, Fernando KAS, Wang BJ, et al. Graphene oxide: a nonspecific enhancer of cellular growth[J] ACS Nano. 2011;5(10):8100–8107. doi: 10.1021/nn202699t. [DOI] [PubMed] [Google Scholar]
- 12.Hui L, Piao JG, Auletta J, et al. Availability of the basal planes of graphene oxide determines whether it is antibacterial[J] ACS Appl Mater Interfaces. 2014;6(15):13183–13190. doi: 10.1021/am503070z. [DOI] [PubMed] [Google Scholar]
- 13.He J, Zhu X, Qi Z, et al. Killing dental pathogens using antibacterial graphene oxide[J] ACS App Mater Interfaces. 2015;7(9):5605–5611. doi: 10.1021/acsami.5b01069. [DOI] [PubMed] [Google Scholar]
- 14.Thomsen C, Reich S. Double resonant raman scattering in graphite[J] Phys Rev Lett. 2000;85(24):5214–5217. doi: 10.1103/PhysRevLett.85.5214. [DOI] [PubMed] [Google Scholar]
- 15.Li RB, Guiney LM, Chang CH, et al. Surface oxidation of graphene oxide determines membrane damage, lipid peroxidation, and cytotoxicity in macrophages in a pulmonary toxicity model[J] ACS Nano. 2018;12(2):1390–1402. doi: 10.1021/acsnano.7b07737. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Singh SK, Singh MK, Nayak MK, et al. Thrombus inducing property of atomically thin graphene oxide sheets[J] ACS Nano. 2011;5(6):4987–4996. doi: 10.1021/nn201092p. [DOI] [PubMed] [Google Scholar]
- 17.Chang Y, Yang ST, Liu JH, et al. In vitro toxicity evaluation of graphene oxide on A549 cells[J] Toxicol Lett. 2011;200(3):201–210. doi: 10.1016/j.toxlet.2010.11.016. [DOI] [PubMed] [Google Scholar]