Abstract
目的
探讨血小板衍生生长因子(PDGF)对大鼠种植体周围神经再生的影响。
方法
建立大鼠股骨植入种植体模型,愈合早期连续注射PDGF,采用免疫组化染色的方法分析PDGF对种植体周围神经再生的影响。
结果
PDGF增加大鼠股骨种植体周围早期神经纤维数量,对种植体周围后期神经纤维数量无显著影响。同时,这些神经具有周围神经纤维的典型结构。
结论
PDGF可以促进种植体周围早期神经再生。本研究为实现PDGF促进种植体周围神经再生,进而改善种植体感觉功能的临床应用,提供一定的实验依据。
Keywords: 血小板衍生生长因子, 种植体, 神经纤维, 神经再生, 骨感知
Abstract
Objective
To investigate the effect of platelet-derived growth factor (PDGF) on nerve regeneration in peri-implant tissues.
Methods
SD rats with implants in their femurs were injected with PDGF solution. The effects of PDGF on nerve regeneration in peri-implant tissues were analyzed by immunohistochemical staining.
Results
PDGF increased the number of nerve fibers in peri-implant tissues at early stage. PDGF had no significant effect on the number of nerve fibers in peri-implant tissues at late stage. Moreover, these nerves had a typical structure of peripheral nerve fibers.
Conclusion
PDGF can promote nerve regeneration in peri-implant tissues at early stage. This study provided a certain experimental basis for the clinical application of PDGF to promote nerve regeneration and further improve the sensory function of the implant.
Keywords: platelet-derived growth factor, implant, nerve fiber, nerve regeneration, osseoperception
临床观察发现,患者能够感受到施加在颌骨种植体上的机械刺激。骨结合的种植体机械加载时产生的感觉知觉,称为骨感知[1]。骨感知现象引起的感觉信号与天然牙负载时产生的感觉信号性质不同。临床研究[2]显示,种植体的触觉灵敏度比天然牙弱。临床中的种植并发症,如修复体折断、基台松动等都与种植体负载过大有关[3]。虽然临床治疗中可以通过调整咬合或者咬合力控制来避免种植体负载过大,但是如果种植体的感觉功能得到改善,对于维持种植体长期成功率以及满足患者心理和生理的更高层次需求都具有重要意义。组织学研究[4]证实,人类的骨结合种植体周围靠近种植体螺纹处的骨组织中存在有髓鞘和无髓鞘的神经纤维,即在种植术后新形成的骨内存在神经纤维。动物的电生理研究[5]也证实,种植体周围存在感觉神经反馈通路。种植体周围的神经支配在骨感知现象中的作用不可忽略。因此,促进种植体周围神经组织的再生,对于改进种植体周围的感觉功能十分必要。
血小板衍生生长因子(platelet-derived growth factor,PDGF)可以调节细胞的生长和分化,在血管生成方面作用显著[6]。同时,PDGF是一种强效的促有丝分裂元,于许多种类的细胞,如平滑肌细胞、骨细胞、软骨细胞、血细胞及间充质来源的众多细胞,特别是神经胶质细胞有较强的作用[7]。然而,PDGF能否促进牙种植体周围神经再生至今仍存在争议。本课题旨在探索PDGF对于大鼠种植体周围神经再生的影响,拟为促进种植体周围神经再生,进一步改善种植体感觉功能提供新的治疗方法。
1. 材料和方法
1.1. 动物模型制备
选取由四川大学华西动物实验中心提供的8周龄Sprague-Dawley大鼠30只,体重250~300 g,雄性,于四川大学口腔疾病研究国家重点实验室饲养。柱状纯钛种植体由四川大学国家生物材料工程研究中心提供,表面光滑,无螺纹,长度为10 mm,直径为1.0 mm。
采用1%水合氯醛进行麻醉。麻醉后,双侧后肢备皮,仰卧位固定于手术台。手术区采用2.5%聚维酮碘和75%乙醇消毒,铺巾。取双侧膝关节偏内侧纵行切口,长2 cm,沿切口剥离皮肤、皮下组织及肌肉,充分暴露股骨远端关节面。在关节面正中处用直径1.0 mm钻针制备长10 mm的种植体窝,种植体窝沿股骨长轴。将消毒后的种植体插入制备的种植体窝中。分层复位缝合,严密关闭切口。
1.2. 术后处理及分组
术后每只大鼠随机选取一侧,在种植体周围骨膜下注射1 mL PDGF注射液,作为PDGF组,并在后肢做好标记,另一侧注射1 mL生理盐水,作为对照组。PDGF注射液和生理盐水均每天注射1次,连续注射2周。同时,术后于大鼠臀部肌肉注射青霉素3 d。本实验用PDGF注射液由PDGF-BB(Peprotech公司,英国)混合生理盐水配制,浓度为100 ng·mL−1。
1.3. 标本获取
术后4周和8周分别随机抽取15只大鼠,以腹腔注射10%水合氯醛处死后取材。分离双侧完整股骨,保留股骨远端完整关节面,并保留骨膜及其上一层软组织。标本用4%多聚甲醛固定。
1.4. 组织学观察
将标本置于17%乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)中,4 °C脱钙。脱钙4周后,横行修整标本至种植体平面,将种植体从股骨远端向近端推出。石蜡包埋后,垂直于种植体长轴进行切片。切片用山羊血清封闭,分别滴加小鼠抗神经丝蛋白(neurofilament protein,NFP)抗体和兔抗S-100抗体,然后分别滴加生物素标记二抗,经S-A/HRP反应,DAB显色。显微镜下观察免疫组化染色切片,并用ImagePro-Plus 6.0进行分析。NFP免疫组化图片测量每张切片阳性结构数目(条/片),每个样本的5张切片计算均数。若5张切片均数超过3条,则记为一个阳性样本。因此,阳性率=阳性样本数量/总样本数量。
1.5. 统计学分析
采用SPSS 16.0软件对实验数据进行统计学分析,NFP免疫组化结果以百分比表示,采用χ2检验分析NFP免疫组化结果,取P=0.05为显著性检验水准。
2. 结果
2.1. NFP免疫组化染色
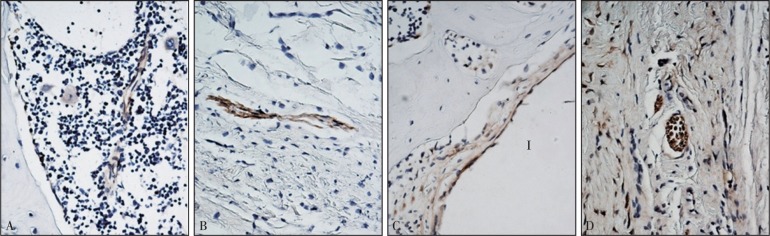
骨组织中神经结构的NFP免疫组化染色特异性较高。图1和图2中箭头所示深褐色结构即为NFP阳性神经结构。大鼠股骨种植体周围NFP阳性神经结构分布在种植窝边缘、周围骨髓腔、骨小梁的腔隙以及骨膜中。种植窝边缘的骨髓组织中可见神经纤维(图1左),未发现NFP阳性结构与种植体的直接接触。骨小梁腔隙中可见散在分布的神经纤维(图2左)。骨髓腔内可见不规则分布的神经纤维和神经纤维束(图1、2中)。骨膜层可见神经纤维束(图1、2右),多数与血管伴行。
图 1. 术后4周NFP免疫组化染色 × 400.
Fig 1 NFP immunohistochemical staining 4 weeks after surgery × 400
上:对照组;下:PDGF组;左:种植窝边缘;中:骨髓腔;右:骨膜层。I:种植体位置。箭头所示为NFP阳性神经结构。
图 2. 术后8周NFP免疫组化染色 × 400.
Fig 2 NFP immunohistochemical staining 8 weeks after surgery × 400
上:对照组;下:PDGF组;左:骨小梁腔隙;中:骨髓腔;右:骨膜层。箭头所示为NFP阳性神经结构。
4周时,PDGF组和对照组种植体周围NFP样本阳性率分别为93.33%(14/15)、53.33%(8/15),PDGF组阳性率高于对照组(P<0.05)。术后8周,PDGF组和对照组种植体周围NFP样本阳性率分别为86.67%(13/15)、73.33%(11/15),PDGF组和对照组阳性率间差异无统计学意义。
2.2. S-100免疫组化染色
S-100通常存在于来自神经嵴的细胞,如雪旺细胞、黑素细胞、神经胶质细胞。但是,成纤维细胞、单核/巨噬细胞、骨髓基质细胞、脂肪细胞等也表达S-100蛋白。因此,在分析S-100阳性结构时要根据神经的结构形态并且结合NFP免疫组化结果来辨别。种植体窝边缘的细胞表达S-100阳性(图3A和图4C),这些细胞可能是成纤维细胞或骨髓基质细胞。骨髓腔内可见不规则分布的S-100阳性神经纤维(图3C和图4A)。骨髓腔中同时可见其他S-100阳性细胞。骨膜层可见典型的神经纤维束(图3B、D,图4B、D)。其中的神经纤维束横切面(图3B和图4D)观察到神经纤维束典型结构,由数量不等的环形小管排列成束状,S-100阳性环形为雪旺细胞,同时可见数个雪旺细胞核分布其间。图3D为神经纤维纵切面,可见S-100阳性条索状结构为雪旺细胞,数个细胞核分布其间。由于S-100在其他细胞中也有表达,因此未对S-100染色结果进行定量分析。
图 3. 术后4周S-100免疫组化染色 × 400.
Fig 3 S-100 immunohistochemical staining 4 weeks after surgery × 400
A、B:对照组,分别为种植窝边缘、骨膜层;C、D:PDGF组,分别为骨髓腔、骨膜层;I:种植体位置。
图 4. 术后8周S-100免疫组化染色 × 400.
Fig 4 S-100 immunohistochemical staining 8 weeks after surgery × 400
A、B:对照组,分别为骨髓腔、骨膜层;C、D:PDGF组,分别为种植窝边缘、骨膜层;I:种植体位置。
3. 讨论
本实验结果表明,术后4周PDGF组和对照组NFP免疫组化结果有显著差异,说明PDGF可以增加种植体周围早期神经纤维数量,促进种植体周围神经再生。研究[8]表明,在神经系统中,PDGF及其受体表达于胚胎、成体及受损伤后的神经元和神经胶质细胞,具有神经营养和神经调控作用。然而,PDGF对于周围神经再生或数量影响的研究目前少有报道。通过大鼠坐骨神经损伤模型发现,PDGF大量聚集在损伤轴突和再生轴突的远端。PDGF由远端雪旺细胞大量增殖并合成表达,并且表达增加受到轴突接触的调控[8]。本实验结果也表明PDGF可增加种植体周围神经数量,其中包括由雪旺细胞包绕的神经纤维束。由此认为,在周围神经系统中,PDGF一方面发挥神经营养因子的作用,可以维持神经细胞生存、突触延长、雪旺细胞的生存和增殖。另一方面PDGF在雪旺细胞和再生轴突相互作用中也可能发挥类似信号传导功能[8]。
本研究结果发现NFP阳性神经结构分布在种植窝边缘、周围骨髓腔、骨小梁的腔隙以及骨膜中。这种神经分布与其他学者的组织学研究结果一致。Mach等[9]对于小鼠股骨的研究证实,骨髓、矿化骨和骨膜中均有神经纤维分布,并且骨髓中比矿化骨和骨膜中丰富。同时,本实验通过S-100结合NFP免疫组化图片分析,结果表明大鼠股骨种植体周围神经纤维具有周围神经纤维的典型结构,即神经轴突外有雪旺细胞呈同心圆样完全包绕形成的髓鞘,或不完全包绕。Ysander等[10]采用相同的动物模型,待8周形成种植体骨整合后,发现种植体周围骨组织中存在神经轴突和小直径感觉神经纤维,与血管伴行或在管腔内。Hill等[11]对大鼠颅骨、下颌骨和胫骨神经进行染色,发现这些神经既有感觉神经来源也有交感神经来源的。这些研究[12]表明,骨内神经支配既来自感觉神经又来自交感神经。
目前关于促进种植体周围神经再生的研究,除生长因子的应用,还包括神经肽类的应用。He等[13]设想利用神经生长因子提高神经细胞的生物学活性,从而达到促进种植体周围神经再生的目的。Ma等[14]提出降钙素基因相关肽-α能够促进雪旺细胞增殖,同时扩张血管和调节成骨细胞活性,认为局部应用该神经肽可以促进种植体周围神经再生。
种植体表面性质和种植负重方案也是影响种植体周围神经再生的重要因素。李保胜[15]研究发现不同表面对早期神经再生的影响有显著差异,后期并无显著差异。Yuan等[16]探讨了种植体表面性质对雪旺细胞生物学行为的影响,发现与塑料培养板相比,钛种植体表面能够促进雪旺细胞的生物学功能。Yin等[17]通过不同表面处理钛片上培养大鼠背根神经元的体外研究,发现与机械加工纯钛表面和喷砂酸蚀纯钛表面相比,大鼠背根神经元在电解蚀刻表面上黏附和伸展更充分,细胞之间的联系更加紧密。此外,关于种植体即刻负重和延期负重的动物实验表明,不同负重时间种植体周围的神经密度有显著差异[18]。系统综述证实,负重种植体与非负重种植体和拔牙窝相比,种植体周围的神经纤维数量明显增加,同时游离神经末梢的数量随种植体负荷的增加而增多[19]。这些研究都为促进种植体周围神经再生,进一步改善种植体感觉功能提供新的研究思路。
综上所述,PDGF可以增加大鼠股骨种植体周围早期神经纤维数量,证实PDGF可以促进种植体周围早期神经再生,同时,这些神经具有周围神经纤维的典型结构。本研究为实现PDGF促进种植体周围神经再生,进而改善种植体感觉功能的临床应用,提供了一定的实验依据。
Funding Statement
[基金项目] 国家自然科学基金面上项目(81571008);天津市口腔医院博硕士重点课题项目(2015BSZD08);生物活性材料教育部重点实验室(南开大学)开放基金(2018003)
Supported by: The National Natural Science Foundation of China (81571008); Key Project of Master's Degree in Tianjin Stomatological Hospital (2015BSZD08); Open Fund of Key Laboratory of Bioactive Material for Ministry of Education, Nankai University (2018003).
References
- 1.Bhatnagar VM, Karani JT, Khanna A, et al. Osseoperception: an implant mediated sensory motor control—a review[J] J Clin Diagn Res. 2015;9(9):ZE18–20. doi: 10.7860/JCDR/2015/14349.6532. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Enkling N, Utz KH, Bayer S, et al. Osseoperception: active tactile sensibility of osseointegrated dental implants[J] Int J Oral Maxillofac Implants. 2010;25(6):1159–1167. [PubMed] [Google Scholar]
- 3.Mishra SK, Chowdhary R, Chrcanovic BR, et al. Osseoperception in dental implants: a systematic review[J] J Prosthodont. 2016;25(3):185–195. doi: 10.1111/jopr.12310. [DOI] [PubMed] [Google Scholar]
- 4.Corpas Ldos S, Lambrichts I, Quirynen M, et al. Peri-implantbone innervation: histological findings in humans[J] Eur J Oral Implantol. 2014;7(3):283–292. [PubMed] [Google Scholar]
- 5.乔 士冲, 吕 晓飞, 庄 龙飞, et al. 牙种植体周围骨内神经感受功能的初步研究[J] 上海口腔医学. 2011;20(2):119–124. [PubMed] [Google Scholar]; Qiao SC, Lü XF, Zhuang LF, et al. Animal study of sensory function of nerve fibers surrounding dental implant[J] Shanghai J Stomatol. 2011;20(2):119–124. [PubMed] [Google Scholar]
- 6.Yang X, Thomas DP, Zhang X, et al. Curcumin inhibits platelet-derived growth factor–stimulated vascular smooth muscle cell function and injury-induced neointima formation[J] Arterioscler Thromb Vasc Biol. 2006;26(1):85–90. doi: 10.1161/01.ATV.0000191635.00744.b6. [DOI] [PubMed] [Google Scholar]
- 7.Zhang L, Zhang K, Liu G, et al. Label-free nanopore proximity bioassay for platelet-derived growth factor detection[J] Anal Chem. 2015;87(11):5677–5682. doi: 10.1021/acs.analchem.5b00791. [DOI] [PubMed] [Google Scholar]
- 8.杨 洪发. 血小板源性生长因子B在损伤周围神经再生中的作用[D] 长春: 吉林大学; 2004. [Google Scholar]; Yang HF. The role of platelet-derived growth factor B in the regeneration of peripheral nerves[D] Changchun: Jilin University; 2004. [Google Scholar]
- 9.Mach D, Rogers S, Sabino M, et al. Origins of skeletal pain: sensory and sympathetic innervation of the mouse femur[J] Neuroscience. 2002;113(1):155–166. doi: 10.1016/s0306-4522(02)00165-3. [DOI] [PubMed] [Google Scholar]
- 10.Ysander M, Branemark R, Olmarker K, et al. Intramedullary osseointegration: development of a rodent model and study of histology and neuropeptide changes around titanium implants[J] J Rehabil Res Dev. 2001;38(2):183–190. [PubMed] [Google Scholar]
- 11.Hill EL, Elde R. Distribution of CGRP-, VIP-, DβH-, SP-, and NPY-immunoreactive nerves in the periosteum of the rat[J] Cell Tissue Res. 1991;264(3):469–480. doi: 10.1007/BF00319037. [DOI] [PubMed] [Google Scholar]
- 12.Miyan JA, Broome CS, Whetton AD. Neural regulation of bone marrow[J] Blood. 1998;92(8):2971–2972. [PubMed] [Google Scholar]
- 13.He H, Yao Y, Wang Y, et al. A novel bionic design of dentalimplant for promoting its long-term success using nerve growthfactor (NGF): utilizing nano-springs to construct astress-cushioning structure inside the implant[J] Med Sci Monit. 2012;18(8):HY42–HY46. doi: 10.12659/MSM.883253. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Ma L, Xiang L, Yao Y, et al. CGRP-alphaapplication: a potential treatment to improve osseoperception of endosseous dental implants[J] Med Hypotheses. 2013;81(2):297–299. doi: 10.1016/j.mehy.2013.04.025. [DOI] [PubMed] [Google Scholar]
- 15.李 保胜. 不同种植体表面形貌对神经再生影响的初步研究[D] 长春: 吉林大学; 2013. [Google Scholar]; Li BS. Preliminary study on the effect of surface topography on nerve regeneration in different implant[D] Changchun: Jilin University; 2013. [Google Scholar]
- 16.Yuan Q, Liao D, Yang X, et al. Effect of implant surface microtopography on proliferation, neurotrophin secretion, and gene expression of Schwann cells[J] J Biomed Mater Res A. 2010;93(1):381–388. doi: 10.1002/jbm.a.32548. [DOI] [PubMed] [Google Scholar]
- 17.Yin C, Li B, Wang H, et al. Biological behaviors of RSC96 cells and dorsal root ganglion neurons on different titanium surface topographies[J] J Biomater Tissue Eng. 2016;6(12):967–974. [Google Scholar]
- 18.孙 琳琳. 牙种植修复方式对种植体周神经纤维再生及骨组织改建的影响[D] 大连: 大连医科大学; 2013. [Google Scholar]; Sun LL. Influence of innervations and bone integration by changing the protocols of implant treatment[D] Dalian: Dalian Medical University; 2013. [Google Scholar]
- 19.Huang Y, Van Dessel J, Martens W, et al. Sensory innervation around immediately vs. delayed loaded implants: a pilot study[J] Int J Oral Sci. 2015;7(1):49–55. doi: 10.1038/ijos.2014.53. [DOI] [PMC free article] [PubMed] [Google Scholar]