Abstract
目的
探讨长链非编码RNA(lncRNA)H19对口腔癌细胞侵袭、迁移的影响以及作用机制。
方法
荧光定量聚合酶链反应检测永生化口腔上皮细胞系HIOEC细胞以及口腔癌细胞系CAL27中H19、miR-107、细胞周期蛋白依赖性激酶6(CDK6)的表达。siRNA H19、miR-107 mimics、pcDNA H19、anti-miR-107转染CAL27细胞,Transwell法检测H19和miR-107对细胞侵袭、迁移的影响,TargetScan数据库预测H19、miR-107、CDK6的靶向关系,双荧光素酶报告基因检测H19、miR-107、CDK6的相互作用,蛋白质印迹法(Western blot)检测H19和miR-107对靶基因CDK6蛋白水平的影响。
结果
H19在CAL27细胞中的表达高于HIOEC细胞(P<0.05)。siRNA H19转染后,H19的表达降低,抑制CAL27细胞的侵袭、迁移能力(P<0.05)。H19与miR-107的3′-UTR特异性结合,调控miR-107的表达活性。miR-107在CAL细胞中的表达低于HIOEC细胞(P<0.05),siRNA H19转染后,miR-107的表达升高,anti-miR-107共转染可促进siRNA H19对CAL27细胞的侵袭、迁移能力(P<0.05)。CDK6在CAL27细胞中的表达高于HIOEC细胞(P<0.05),CDK6的表达可被H19和miR-107共同调控。
结论
lncRNA H19通过靶向调控miR-107/CDK6信号轴影响口腔癌细胞的侵袭、迁移能力,在口腔癌的发生发展过程中起着重要作用。
Keywords: 口腔癌, 长链非编码RNA H19, 侵袭, 迁移
Abstract
Objective
To investigate the effect of the long chain non-coding RNA H19 (lncRNA H19) on the invasion and migration of oral cancer cells and its related molecular mechanism.
Methods
The expression levels of lncRNA H19, miR-107, and cyclin-dependent kinase 6 (CDK6) in the immortalized oral epithelial cell line HIOEC and the oral cancer cell line CAL27 were detected by real-time quantitative polymerase chain reaction. CAL27 cells were transfected with siRNA H19, miR-107 mimics, pcDNA H19, or anti-miR-107, and the effects of H19 and miR-107 on the invasion and migration of cells were examined via Transwell assay. The TargetScan database predicted the targeting of H19, miR-107, and CDK6. Double luciferase reporter gene assay was performed to detect interactions among H19, miR-107, and CDK6. Western blot analysis was conducted to examine the effects of H19 and miR-107 on the protein level of the target gene CDK6.
Results
Compared with that in HIOEC cells, the expression of H19 was significantly increased in CAL27 cells (P<0.05). After transfection with siRNA H19, the expression of H19 decreased, and the invasion and migration ability of CAL27 cells were inhibited (P<0.05). H19 could bind specifically to the 3′-UTR of miR-107 to modulate the expression of miR-107. Compared with that in HIOEC cells, the expression of miR-107 significantly decreased in CAL27 cells (P<0.05). The expression of miR-107 increased after transfection with siRNA H19, and anti-mir-107 co-transfection could promote the invasion and migration ability of siRNA H19 in CAL27 cells (P<0.05). Compared with that in HIOEC cells, CDK6 expression significantly increased in CAL27 cells (P<0.05), and the expression level of the gene was co-regulated by H19 and miR-107 (P<0.05).
Conclusion
lncRNA H19 plays an important role in the development of oral cancer. It can regulate the invasion and migration of oral cancer cells by targeting the miR-107/CDK6 signaling axis.
Keywords: oral cancer, long chain non-coding RNA H19, invasion, migration
口腔癌是一种发病率较高的恶性肿瘤,治疗手段以手术为主,放疗和化疗综合使用。随着基础研究和临床治疗技术的不断发展,明显降低了患者的5年死亡率,但是其死亡率仍位于恶性肿瘤前列,是导致癌症患者死亡的主要疾病之一[1]–[3]。探究新的生物标志物和治疗靶点,对口腔癌的临床诊断和治疗具有重要意义。
研究[4]–[6]表明,长链非编码RNA(long chain noncoding RNA,lncRNA)在恶性肿瘤的发生发展过程中具有重要作用。H19是一种在多种组织广泛表达的lncRNA,位于人类11p15.5染色体,作为一种印记基因,在多种肿瘤组织中表达[7]–[8]。H19在部分肿瘤中发挥致癌作用,在部分肿瘤中发挥抑癌作用。关于H19在口腔癌中的生物信息学功能研究尤其是与下游相关miRNA的靶向作用机制的报道不多。本研究通过检测H19在口腔癌细胞系中的表达量,选择口腔癌细胞系CAL27细胞验证H19和miR-107及下游靶基因细胞周期蛋白依赖性激酶6(cyclin dependent kinase 6,CDK6)的相互关系,通过抑制H19表达观察CAL27细胞迁移、侵袭的变化,旨在探讨H19在口腔癌中的作用以及可能机制。
1. 材料和方法
1.1. 实验主要材料
永生化口腔上皮细胞系HIOEC细胞、口腔癌细胞系CAL27细胞(ATCC公司,美国),Defined Keratinocyte-SFM培养基、DMEM培养基、青霉素、链霉素(Gibco公司,美国),胎牛血清(Hyclone公司,美国),Trizol试剂(Takara公司,日本),siRNA H19、miR-107 mimics、pcDNA H19、anti-miR-107、双荧光素酶报告载体(上海吉玛生物有限公司),Lipofectamine 2000(Invitrogen公司,美国),Matrigel胶(Sigma公司,美国),Transwell(BD公司,美国),RNA结合蛋白免疫沉淀(RNA binding protein immunoprecipitation,RIP)实验试剂盒(Millipore公司,美国),CDK6抗体、β肌动蛋白(β-actin)抗体、辣根过氧化物酶标记二抗(北京博奥森生物技术有限公司),荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qPCR)仪(ABI公司,美国),双荧光素酶测定系统(Promega公司,美国)。
1.2. 细胞培养
HIOEC细胞培养于Defined Keratinocyte-SFM培养基,CAL27细胞培养于含10%胎牛血清的DMEM/F12培养基,并加入100 U·mL−1青霉素和100 µg·mL−1链霉素,放入37 °C、5%CO2的细胞培养箱中培养。
1.3. qPCR检测
通过qPCR检测CAL27、HIOEC细胞中H19、miR-107、CDK6水平。收集细胞,使用Trizol提取细胞中总RNA。以GAPDH为对照,引物序列H19上游为5′-TGATGACGGGTGGAGGGGCTA-3′,下游为5′-TGATGTCGCCCTGTCTGCACG-3′;miR-107上游为5′-AGCAGCAUUGUACAGGGCUAUCA-3′,下游为5′-AUAGCCCUGUACAAUGCUGCUUU-3′;CDK6上游为5′-TCAGGTTGTTTGA TGTGTGC-3′,下游为5′-TCCTTTATGGTTTCAGTGGG-3′。反应条件为95 °C 10 min,95 °C 15 s,60 °C 32 s,40个循环。实验重复3次,采用2−ΔΔCt法计算目的基因的相对表达量。
1.4. 细胞转染
CAL27细胞稳定传代后进行转染。转染前24 h,选取对数期CAL27细胞,加入胰酶将细胞以5×105个加入6孔板中培养,待细胞密度达到80%~90%,根据Lipofectamine 2000说明书分别将siRNA H19、miR-107 mimics、pcDNA H19、anti-miR-107转染细胞。qPCR检测转染效果。
1.5. Transwell法检测细胞的侵袭、迁移能力
收集CAL27细胞,加入0.25%胰酶消化,调整为单细胞悬液,接种至6孔板中。根据1.4所示进行转染,同时设立阴性对照。细胞经不同转染培养24 h,加入无血清培养基,以每孔5×105个细胞加入上室上孔,下室加入500 µL含10%胎牛血清的培养基,37 °C培养24 h;湿棉签擦去未穿出细胞,多聚甲醛固定20 min,结晶紫染色15 min,光学显微镜下拍照,随机取5个视野计数,取平均值。将Matrigel胶与无血清培养基按1︰3的比例混匀,包被于Transwell上室,37 °C干燥2 h,其余与迁移实验相同。
1.6. 双荧光素酶报告基因
通过TargetScan数据库(http://www.targetscan.org/vert_71/)预测H19与miR-107以及miR-107与CDK6的3′-端非编码区域(3′-UTR)碱基存在互补现象。为了证实H19与miR-107以及miR-107与CDK6是否存在靶向关系,将H19 3′-UTR或CDK 63′-UTR区域构建入野生型和突变型双荧光素酶报告载体,并共转染miR-107 mimics,37 °C、5%CO2培养48 h,收集细胞,根据双荧光素酶测定系统分析双荧光素酶的活性,检测H19、miR-107、CDK6的相互作用。
1.7. 蛋白质印迹法(Western blot)
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)分离各组细胞总蛋白,并转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜中,加入5%的脱脂奶粉溶液充分封膜;并与CDK6(1︰1 000)抗体和β-肌动蛋白(β-actin)(1︰1 000)抗体4 °C培养过夜后,TBST缓冲液清洗,与辣根过氧化物酶标记二抗37 °C孵育2 h,TBST缓冲液清洗,加入电化学发光(electrochemiluminescence,ECL)液显色,测定蛋白质的相对表达量,分析H19和miR-107对CDK6蛋白水平的影响。
1.8. 统计学分析
采用SPSS 22.0软件进行统计处理,结果以均数±标准差表示,两组间数据的比较采用t检验,多组数据间的比较采用单因素方差分析,组间多重比较采用SNK-q检验,P<0.05为差异具有统计学意义。
2. 结果
2.1. H19在口腔癌细胞中的表达及对口腔癌细胞迁移和侵袭的影响
qPCR检测结果显示,1)H19在CAL27、HIOEC细胞中的表达分别为3.124±0.328、1.002±0.086,CAL27细胞中的表达高于HIOEC细胞(P<0.05);2)siRNA H19转染后,H19在CAL27细胞中的表达由0.986±0.102降低为0.269±0.035,差异具有统计学意义(P<0.05);3)与阴性对照相比,siRNA H19转染可明显抑制CAL27细胞的侵袭、迁移能力(图1),差异具有统计学意义(P<0.05)。
图 1. H19对CAL27细胞迁移和侵袭的影响.
Fig 1 Effects of H19 on migration and invasion of CAL27 cells
上:细胞迁移;下:细胞侵袭。si-NC:阴性对照;si-H19:siRNA H19转染。*P<0.05。
2.2. H19靶向调控miR-107的表达
数据库预测结果显示,H19与miR-107的3′-UTR部分碱基可互补配对,表明H19可能对miR-107有一定的调控作用。双荧光素酶报告基因检测结果显示, miR-107 mimics共转染后,野生型H19的3′-UTR报告基因的荧光素酶相对活性由1.010±0.092降低为0.324±0.041,差异有统计学意义(P<0.05),表明miR-107 mimics共转染可抑制野生型H19的3′-UTR报告基因的荧光素酶相对活性;而突变型H19的3′-UTR报告基因的荧光素酶相对活性不受miR-107 mimics共转染的影响(共转染前后分别为1.001±0.087、0.936±0.095,P>0.05)。这表明,H19与miR-107的3′-UTR特异性结合,调控miR-107的表达活性。
2.3. miR-107在癌细胞中的表达以及anti-miR-107对siRNA H19的影响
qPCR检测结果显示,1)miR-107在CAL27、HIOEC细胞中的表达分别为0.465±0.033、1.001±0.083,CAL细胞中的表达低于HIOEC细胞(P<0.05);2)pcDNA H19转染后,miR-107在CAL27细胞中的表达由1.005±0.088降低为0.360±0.042,差异具有统计学意义(P<0.05); siRNA H19转染后,miR-107的表达由1.003±0.090升高为2.682±0.311,差异有统计学意义(P<0.05);3)与阴性对照相比,siRNA H19和anti-miR-107共转染可促进siRNA H19对CAL27细胞的侵袭、迁移能力,差异有统计学意义(P<0.05)(图2),表明下调miR-107的表达可逆转siRNA H19抑制CAL27细胞侵袭、迁移的作用。
图 2. siRNA H19和anti-miR-107共转染对CAL27细胞迁移和侵袭的影响.
Fig 2 Effects of siRNA H19 and anti-miR-107 co-transfection on migration and invasion of CAL27 cells
A:siRNA H19阴性对照;B:siRNA H19转染;C:siRNA H19+anti-miR-107阴性对照;D:siRNA H19+anti-miR-107转染。*P<0.05。
2.4. CDK6在口腔癌细胞中的表达及miR-107靶向调控CDK6的表达
qPCR检测结果显示,CDK6在CAL27、HIOEC细胞中的表达分别为3.156±0.353、1.012±0.075,CAL细胞中的表达高于HIOEC细胞,差异具有统计学意义(P<0.05)。
数据库预测结果显示,miR-107与CDK6的3′-UTR部分碱基可互补配对,表明miR-107可能对CDK6有一定的调控作用。双荧光素酶报告基因检测结果显示,miR-107 mimics共转染后,野生型CDK6的3′-UTR报告基因的荧光素酶相对活性由0.989±0.096降低为0.387±0.041,差异有统计学意义(P<0.05),表明miR-107 mimics共转染可以抑制野生型CDK6的3′-UTR报告基因的荧光素酶相对活性;而突变型CDK6的3′-UTR报告基因的荧光素酶相对活性不受miR-107 mimics共转染的影响(共转染前后分别为1.003±0.083、0.945±0.096,P>0.05)。
Western blot检测结果显示,转染miR-107 mimics或anti-miR-107对CDK6蛋白的表达量具有明显的调控作用(图3)。
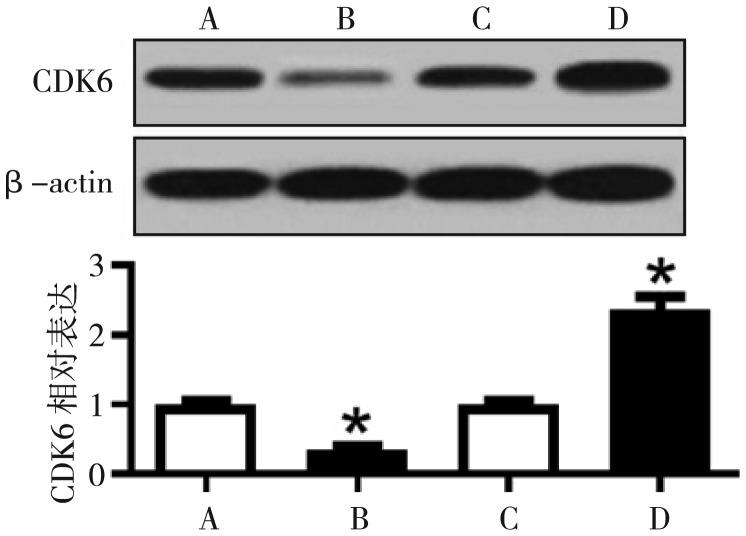
图 3. miR-107靶向调控CDK6的表达.
Fig 3 Targeted regulation of CDK6 expression by miR-107
Western blot检测,A为miR-107阴性对照,B为miR-107转染,C为anti-miR-107阴性对照,D为anti-miR-107转染。与其阴性对照相比,*P<0.05。
2.5. H19和miR-107共同调控CDK6的表达
双荧光素酶报告基因结果显示,共转染miR-107 mimics和pcDNA H19可逆转野生型CDK6的3′-UTR报告基因的荧光素酶相对活性的降低,差异具有统计学意义(P<0.05)(图4)。
图 4. siRNA H19和miR-107共同调控CDK6的表达.
Fig 4 Expression of CDK6 regulated by siRNA H19 and miR-107
左:双荧光素酶报告基因检测,横坐标中,A为野生型CDK6,B为野生型CDK6+miR-107,C为野生型CDK6+miR-107+pcDNA H19,D为野生型CDK6+miR-107+siRNA H19。中:Western blot检测,横坐标中,A为pcDNA H19,B为siRNA H19,C为siRNA H19+miR-107阴性对照,D为siRNA H19+miR-107。右:Western blot检测,A为siRNA H19阴性对照,B为siRNA H19,C为siRNA H19+ anti-miR-107阴性对照,D为siRNA H19+anti-miR-107。*P<0.05。
Western blot检测结果表明,pcDNA H19转染可升高CDK6的表达, miR-107 mimics共转染可逆转此作用,差异具有统计学意义(P<0.05);siRNA H19可以降低CDK6的表达,anti-miR-107共转染可逆转此作用,差异具有统计学意义(P<0.05)(图4)。这表明,CDK6的表达可被H19和miR-107共同调控。
3. 讨论
lncRNA在多种肿瘤细胞中发挥重要作用,参与肿瘤细胞的生长、分化、侵袭、迁移过程[9]–[11]。探究lncRNA的生物学功能可为肿瘤的治疗提供新的研究方向。H19是一种在多种组织广泛表达的lncRNA,通过选择性剪切或者干扰基因表达从而发挥调控作用。H19在多种实体瘤组织中呈现异常状态,如胆囊癌[12]、结肠癌[13]、肺癌[14]等,并在肿瘤的形成过程中发挥重要作用。H19在食管癌组织中表达量显著增加,并与食管壁的转移、浸润程度显著相关[15]。检测肺癌组织和细胞系中H19的表达量,发现H19靶向调控miR-107进而影响Notch信号通路,在肺癌细胞的侵袭和迁移过程中起重要作用[16]。miRNA介导机体蛋白部分功能,通过激活不同的下游靶基因,对口腔癌细胞的生物学行为起调控作用[17]。H19的表达水平与细胞的侵袭、迁移能力密切相关[18]–[19]。考虑到H19可能参与肿瘤细胞侵袭、迁移等生物学过程,因此本实验对H19在口腔癌细胞中的具体作用进行研究。本研究发现,H19在口腔癌细胞系CAL27中显著高表达,下调H19的表达可显著抑制口腔癌CAL27细胞的侵袭、迁移能力;H19与miR-107之间具有相互作用,miR-107通过逆向调控H19的表达,对口腔癌细胞的侵袭、迁移进行靶向调控;上调H19的表达可降低miR-107的表达,抑制CAL27细胞的侵袭、迁移,抑制miR-107的表达量可逆转H19对CAL27细胞的侵袭、迁移的作用。
细胞周期蛋白依赖性激酶(recombinant cyclin dependent kinases,CDKs)是细胞周期调控的关键因子,表达异常可促进癌症的发生发展[20]–[22]。CDK6是CDKs家族的重要成员之一,在多种肿瘤组织中表达异常,与肿瘤的发生发展密切相关[23]–[25]。本研究结果发现,miR-107与CDK6的3′-UTR存在部分碱基互补配对序列,推测miR-107可能对CDK6有一定的调控作用,双荧光素酶报告基因结果进一步证实miR-107可靶向作用于CDK6;qPCR检测发现CDK6在口腔癌细胞系CAL27中显著高表达;上调或下调miR-107的表达量可以显著影响CDK6水平。共转染pcDNA H19和miR-107 mimics质粒可逆转过表达miR-107对双荧光素酶活性的抑制作用以及过表达H19对CAL27细胞中CDK6蛋白表达量的促进作用;共转染siRNA H19和anti-miR-107可显著逆转siRNA H19下调CDK6蛋白表达量的作用。以上结果均表明H19和miR-107可共同调控CDK6的表达,从而调控口腔癌发生发展过程。
综上,本实验阐明了H19在口腔癌发生发展中的作用,其通过miR-107/CDK6信号轴调控细胞的侵袭、迁移过程,从而调节口腔癌的形成。这可为口腔癌的早期诊断和临床靶向治疗提供一定的参考意见,但本实验只在细胞系中进行了相关探究,今后尚需在动物模型以及人体肿瘤中深入研究。
Funding Statement
[基金项目] 国家自然科学基金(81402231);河南省自然科学基金(182300410319)
Supported by: The National Natural Science Foundation of China (81402231); The National Natural Science Foundation of Henan Province (182300410319).
References
- 1.Ebrahimi A, Gil Z, Amit M, et al. Comparison of the American Joint Committee on Cancer N1 versus N2a nodal categories for predicting survival and recurrence in patients with oral cancer: time to acknowledge an arbitrary distinction and modify the system[J] Head Neck. 2016;38(1):135–139. doi: 10.1002/hed.23871. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Eliav E. Oral cancer: can we do better[J] Quintessence Int. 2017;48(2):91. doi: 10.3290/j.qi.a37645. [DOI] [PubMed] [Google Scholar]
- 3.Jain P, Jain M, Prasad BV, et al. A case-control study for the assessment of correlation of denture-related sores and oral cancer risk[J] J Contemp Dent Pract. 2016;17(11):930–933. doi: 10.5005/jp-journals-10024-1956. [DOI] [PubMed] [Google Scholar]
- 4.Zhang KJ, Luo ZL, Zhang Y, et al. Circulating lncRNA H19 in plasma as a novel biomarker for breast cancer[J] Cancer Biomark. 2016;17(2):187–194. doi: 10.3233/CBM-160630. [DOI] [PubMed] [Google Scholar]
- 5.Lu T, Yu C, Ni HB, et al. Expression of the long non-coding RNA H19 and MALAT-1 in growth hormone-secreting pituitary adenomas and its relationship to tumor behavior[J] Int J Dev Neurosci. 2018;67:46–50. doi: 10.1016/j.ijdevneu.2018.03.009. [DOI] [PubMed] [Google Scholar]
- 6.霍 小蕾, 裴 振, 李 永芝, et al. 长链非编码RNA H19促进结直肠癌细胞株增殖的研究[J] 四川大学学报(医学版) 2017;48(6):844–849. [PubMed] [Google Scholar]; Huo XL, Pei Z, Li YZ, et al. Effects of lncRNA H19 on proliferation of human colorectal cancer SW620 cells[J] J Sichuan Univ (Med Sci Ed) 2017;48(6):844–849. [PubMed] [Google Scholar]
- 7.Liang WC, Fu WM, Wong CW, et al. The lncRNA H19 promotes epithelial to mesenchymal transition by functioning as miRNA sponges in colorectal cancer[J] Oncotarget. 2015;6(26):22513–22525. doi: 10.18632/oncotarget.4154. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Huang C, Cao LH, Qiu LM, et al. Upregulation of H19 promotes invasion and induces epithelial-to-mesenchymal transition in esophageal cancer[J] Oncol Lett. 2015;10(1):291–296. doi: 10.3892/ol.2015.3165. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Liz J, Esteller M. lncRNAs and microRNAs with a role in cancer development[J] Biochim Biophys Acta. 2016;1859(1):169–176. doi: 10.1016/j.bbagrm.2015.06.015. [DOI] [PubMed] [Google Scholar]
- 10.Schmitt AM, Chang HY. Long noncoding RNAs in cancer pathways[J] Cancer Cell. 2016;29(4):452–463. doi: 10.1016/j.ccell.2016.03.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Zhang YJ, Pitchiaya S, Cieślik M, et al. Analysis of the androgen receptor-regulated lncRNA landscape identifies a role for ARLNC1 in prostate cancer progression[J] Nat Genet. 2018;50(6):814–824. doi: 10.1038/s41588-018-0120-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Wang SH, Wu XC, Zhang MD, et al. Long noncoding RNA H19 contributes to gallbladder cancer cell proliferation by modulated miR-194-5p targeting AKT2[J] Tumour Biol. 2016;37(7):9721–9730. doi: 10.1007/s13277-016-4852-1. [DOI] [PubMed] [Google Scholar]
- 13.Wu KF, Liang WC, Feng L, et al. H19 mediates methotrexate resistance in colorectal cancer through activating Wnt/β-catenin pathway[J] Exp Cell Res. 2017;350(2):312–317. doi: 10.1016/j.yexcr.2016.12.003. [DOI] [PubMed] [Google Scholar]
- 14.Zhang QQ, Li XL, Li X, et al. LncRNA H19 promotes epithelial-mesenchymal transition (EMT) by targeting miR-484 in human lung cancer cells[J] J Cell Biochem. 2018;119(6):4447–4457. doi: 10.1002/jcb.26537. [DOI] [PubMed] [Google Scholar]
- 15.Tan D, Wu Y, Hu L, et al. Long noncoding RNA H19 is up-regulated in esophageal squamous cell carcinoma and promotes cell proliferation and metastasis[J] Dis Esophagus. 2017;30(1):1–9. doi: 10.1111/dote.12481. [DOI] [PubMed] [Google Scholar]
- 16.李 纪远, 张 灿斌, 马 新, et al. 长链非编码H19靶向调节miR-107通过Notch通路对肺癌的侵袭迁移的影响[J] 中国免疫学杂志. 2017;33(9):1392–1397. [Google Scholar]; Li JY, Zhang CB, Ma X, et al. Long non-coding RNA H19 promoted lung cancer cells migration and invasion through miR-107[J] Chin J Immunol. 2017;33(9):1392–1397. [Google Scholar]
- 17.Farooqi A, Shu CW, Huang HW, et al. TRAIL, wnt, sonic hedgehog, TGFβ, and miRNA signalings are potential targets for oral cancer therapy[J] Int J Mol Sci. 2017;18(7):1523. doi: 10.3390/ijms18071523. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Yan L, Zhou J, Gao Y, et al. Regulation of tumor cell migration and invasion by the H19/let-7 axis is antagonized by metformin-induced DNA methylation[J] Oncogene. 2015;34(23):3076–3084. doi: 10.1038/onc.2014.236. [DOI] [PubMed] [Google Scholar]
- 19.Zhou XY, Ye F, Yin CQ, et al. The interaction between MiR-141 and lncRNA-H19 in regulating cell proliferation and migration in gastric cancer[J] Cell Physiol Biochem. 2015;36(4):1440–1452. doi: 10.1159/000430309. [DOI] [PubMed] [Google Scholar]
- 20.Gubern A, Joaquin M, Marquès M, et al. The N-terminal phosphorylation of RB by p38 bypasses its inactivation by CDKs and prevents proliferation in cancer cells[J] Mol Cell. 2016;64(1):25–36. doi: 10.1016/j.molcel.2016.08.015. [DOI] [PubMed] [Google Scholar]
- 21.Liao YF, Feng Y, Shen J, et al. The roles and therapeutic potential of cyclin-dependent kinases (CDKs) in sarcoma[J] Cancer Metastasis Rev. 2016;35(2):151–163. doi: 10.1007/s10555-015-9601-1. [DOI] [PubMed] [Google Scholar]
- 22.凌 骏, 王 越, 支 燕乐, et al. 细胞周期依赖性激酶抑制剂在胃肠道癌症中的应用[J] 广东化工. 2016;43(5):105–106. [Google Scholar]; Ling J, Wang Y, Zhi YL, et al. Development of cyclin-dependent kinase inhibitors in gastrointestinal cancers[J] Guangdong Chem Ind. 2016;43(5):105–106. [Google Scholar]
- 23.Patnaik A, Rosen LS, Tolaney SM, et al. Efficacy and safety of abemaciclib, an inhibitor of CDK4 and CDK6, for patients with breast cancer, non-small cell lung cancer, and other solid tumors[J] Cancer Discov. 2016;6(7):740–753. doi: 10.1158/2159-8290.CD-16-0095. [DOI] [PubMed] [Google Scholar]
- 24.Wang HZ, Nicolay BN, Chick JM, et al. The metabolic function of cyclin D3-DK6 kinase in cancer cell survival[J] Nature. 2017;546(7658):426–430. doi: 10.1038/nature22797. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Yang C, Li Z, Bhatt T, et al. Acquired CDK6 amplification promotes breast cancer resistance to CDK4/6 inhibitors and loss of ER signaling and dependence[J] Oncogene. 2017;36(16):2255–2264. doi: 10.1038/onc.2016.379. [DOI] [PMC free article] [PubMed] [Google Scholar]