Abstract
目的
应用3D打印熔融沉积(FDM)技术制作个性化种植修复体,评估其与天然牙的误差。
方法
通过Mimics 15.0软件提取锥形束CT(CBCT)扫描的6颗因正畸减数而需拔除牙(体内牙)的数据模型并制作个性化种植修复体。在相同参数下重新扫描拔除后的正畸减数牙(体外牙)及个性化种植修复体获取数据模型,利用Geomagic studio软件比较3种数据模型之间的三维偏差大小。
结果
个性化种植修复体与体内牙数据模型整体模型间的高低区域偏差的平均值为0.19 mm和−0.16 mm,体内牙与体外牙数据模型整体模型间的高低区域偏差的平均值为0.14 mm和−0.07 mm;两组数据经独立样本t检验,差异均无统计学意义(P>0.05)。
结论
1)应用3D打印FDM技术制作的个性化种植修复体精密度良好。2)基于相同参数CBCT扫描数据获得的体内牙与体外牙的数据模型仍存在一定误差。
Keywords: 3D打印技术, 熔融沉积技术, 个性化种植修复体, 数据模型
Abstract
Objective
The aim of this study was to determine the accuracy of personalized implant fabricated via 3D printing and fused deposition modeling technique (FDM) and to compare the results with a real tooth.
Methods
Six prepared extracted orthodontic teeth (in vivo) were scanned via cone beam computed tomography (CBCT) to obtain 3D data and to build the data models by using Mimics 15.0 software. The extracted orthodontic teeth (in vitro) and the personalized implants designed via 3D printing and FDM were scanned via CBCT to obtain data and to build the data models at the same parameters. The 3D deviations were compared among the in vivo teeth data models, in vitro teeth data models, and printing personalized implant data models by using the Geomagic studio software.
Results
The average deviations of high and low areas between date models of in vivo teeth and personalized implants were 0.19 mm and −0.16 mm, respectively, and the average deviations between in vitro and in vivo teeth were 0.14 mm and −0.07 mm, respectively. The independent t test showed that no statistically significant difference was observed between the two groups (P>0.05).
Conclusion
1) The personalized dental implants were manufactured via 3D printing and FDM with a high degree of precision. 2) Errors between the data models of in vitro and in vivo teeth were observed at the same CBCT parameters.
Keywords: 3D printing technique, fused deposition modeling technique, personalized dental implant, date model
3D打印技术是根据物体的扫描数据进行建模,导入设备并控制打印材料在工作台上进行精确的3D堆积,制作出与原物体相似的模型的一种先进的技术[1]–[2]。近年来,3D打印技术在口腔种植学领域的应用越来越多。在种植修复体制备方面采用的3D打印技术主要包括选择性激光熔融(selective laser melting,SLM)技术和电子束熔融(electron beam melting,EBM)技术。SLM和EBM技术都是基于激光或其他光源烧结的成形技术,设备造价和制作模型成本比较高昂,制备材料多为金属粉末,限制了该技术在生物医学方面的应用。
熔融沉积(fused deposition modeling,FDM)技术是基于熔化原料并挤压成型的3D打印技术,成型速度快且相对准确,无需昂贵的激光烧结设备,价格相对低廉。由于该技术可挤压生物降解性的支架材料,包括聚乳酸、聚酰胺、聚酯、聚碳酸酯、聚乙烯、聚丙烯等[3],使得FDM技术在制备复合型生物医用高分子支架材料上的应用越来越多。但是目前在种植修复体制作方面,FDM技术的应用还相对较少。
本实验采用FDM技术制作个性化种植修复体,同时建立了基于CBCT数据的体内牙、体外牙与个性化种植修复体的三维数据模型,以评估个性化种植修复体与天然牙的误差,为FDM技术应用于制备个性化种植修复体提供理论依据。
1. 材料和方法
1.1. 样本选择
选取6颗因正畸减数需要而拔除的样本牙,要求为单根牙,冠根完整,无龋坏、充填体和修复体等。拔牙前于兰州大学口腔医院放射科进行锥形束CT(cone beam computed tomography,CBCT)检查。CBCT仪器为德国KaVo公司产品,扫描参数为0.25 mm、14.7 s。
1.2. 个性化种植修复体的制作
将拔牙前采集的CBCT数据的DICOM文件导入Mimics 15.0(Materialise公司,比利时)中,经过Mimics阈值分割和区域增长后提取体内牙数据模型;随后将三维数据模型导入MakerBot Replicator 2X型3D打印机(MakerBot公司,美国)中,制作个性化种植修复体。修复体制作材料为聚乳酸,打印厚度为0.15 mm。
1.3. 个性化种植修复体模型和体外牙的三维建模
将FDM技术下制作的个性化种植修复体和体外牙分别置于颌骨模型牙槽窝内,在同等参数(0.25 mm,14.7 s)下再次行CBCT扫描。依据CBCT扫描数据,建立相应的数据模型。
1.4. 软件分析
将各体内牙、体外牙、个性化种植修复体数据模型的STL文件导入Geomagic studio三维检测软件(Raindrop Geomagic公司,美国)中,进行最佳拟合,并配对模型进行三维偏差的比较分析。
2. 结果
2.1. 外形观察
依据CBCT模型制作的个性化种植修复体与体外牙外形特征基本一致,无明显制作缺陷(图1)。将个性化种植修复体和体外牙分别放置在颌骨模型牙槽窝内(图2),经CBCT扫描后建立的体内牙、体外牙和个性化种植修复体的三维模型见图3。个性化种植修复体与体外牙三维模型的最佳拟合对齐和三维偏差彩色分析图见图4,由图4可见,两种模型的偏差分布比较均匀。
图 1. 体外牙(左)及FDM技术打印的个性化种植修复体(右).
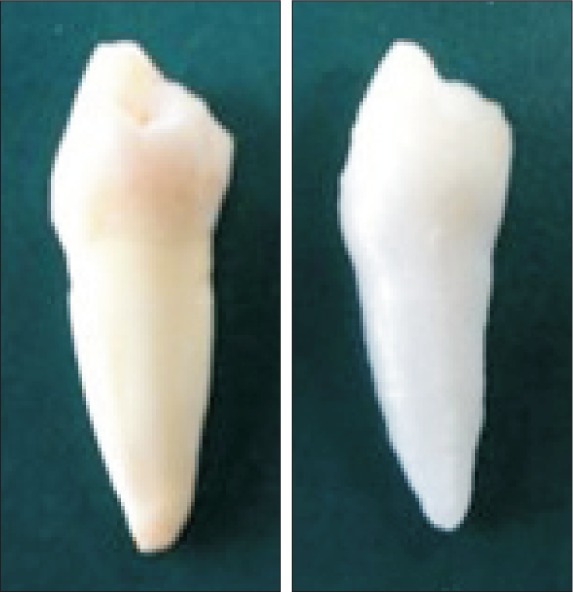
Fig 1 In vitro tooth (left) and personalized dental implant by FDM (right)
图 2. 体外牙(左)和个性化种植修复体(右)放置在颌骨标本中.
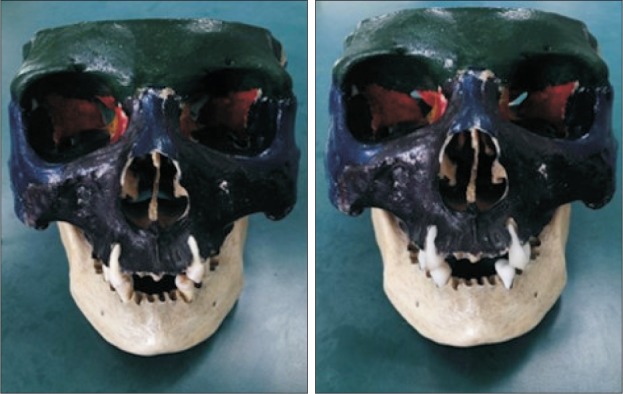
Fig 2 In vitro teeth (left) and personalized dental implants (right) were placed into the jaw bone specimens
图 3. 体内牙(左)、体外牙(中)和个性化种植修复体(右)的数据模型.
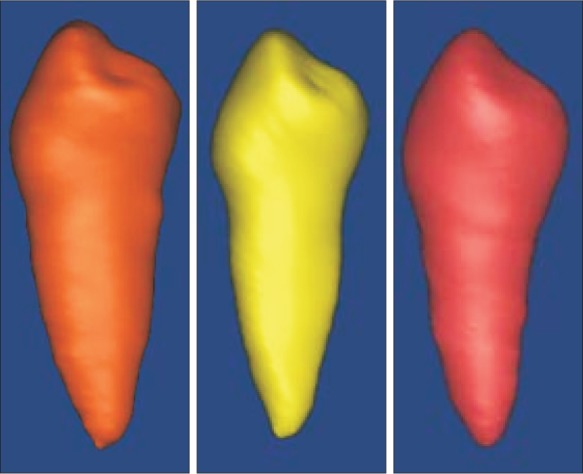
Fig 3 Data models of in vivo tooth (left), in vitro tooth (middle), and personalized dental implant (right)
图 4. 数据模型的最佳拟合(左)和拟合后的三维偏差分析图(右).
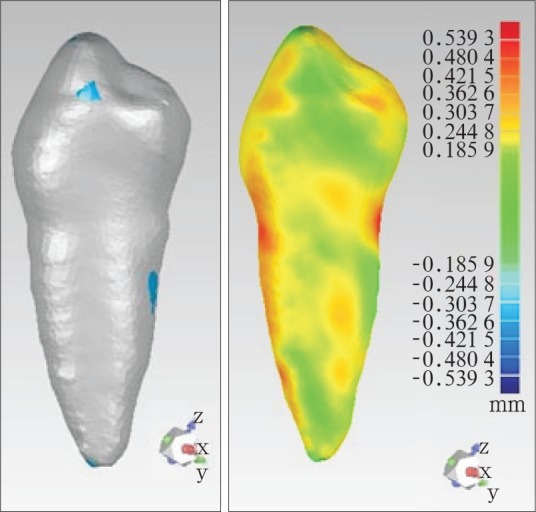
Fig 4 Best matching of data models (left) and three dimension deviation analysis diagram after best matching (right)
2.2. 计算机分析结果
结合CBCT和FDM技术制作的个性化种植修复体与体内牙的数据模型进行对比,二者间最高区域与最低区域的偏差平均值分别为0.59 mm和−0.56 mm,整体模型间的高低区域偏差的平均值为0.19 mm和−0.16 mm(表1)。体内牙与体外牙数据模型进行对比,二者之间的最高区域与最低区域偏差平均值为0.47 mm和−0.33 mm,整体模型间的高低区域偏差的平均值为0.14 mm和−0.07 mm(表2)。
表 1. 个性化种植修复体与体内牙数据模型间的偏差.
Tab 1 The deviation between the data models of personalized dental implants and in vivo teeth
| 样本编号 | 最小偏差 | 最大偏差 | 最小平差均偏 | 最大平均偏差 | 标准偏差 |
| 1 | −0.53 | 0.64 | −0.14 | 0.17 | 0.20 |
| 2 | −0.58 | 0.52 | −0.14 | 0.18 | 0.17 |
| 3 | −0.40 | 0.78 | −0.07 | 0.24 | 0.16 |
| 4 | −0.67 | 0.67 | −0.13 | 0.29 | 0.18 |
| 5 | −0.63 | 0.39 | −0.31 | 0.11 | 0.19 |
| 6 | −0.55 | 0.57 | −0.17 | 0.19 | 0.22 |
| 平均值 | −0.56 | 0.59 | −0.16 | 0.19 |
mm
表 2. 体内牙与体外牙数据模型间的偏差.
Tab 2 The deviation between the data models of in vivo teeth and in vitro teeth
| 样本编号 | 最小偏差 | 最大偏差 | 最小平均偏差 | 最大平均偏差 | 标准偏差 |
| 1 | −0.10 | 0.53 | −0.03 | 0.19 | 0.09 |
| 2 | −0.13 | 0.48 | −0.02 | 0.17 | 0.10 |
| 3 | −0.19 | 0.49 | −0.04 | 0.20 | 0.11 |
| 4 | −0.52 | 0.56 | −0.13 | 0.11 | 0.15 |
| 5 | −0.56 | 0.32 | −0.08 | 0.08 | 0.10 |
| 6 | −0.49 | 0.48 | −0.14 | 0.11 | 0.28 |
| 平均值 | −0.33 | 0.47 | −0.07 | 0.14 |
mm
2.3. 数据模型差异分析
通过提取CBCT扫描的体内牙数据模型、体外牙模型与个性化种植牙的模型,6例样本比对结果通过软件Origin 9.0(MicroCal,美国)曲线图分析后显示总体趋势趋于平稳(图5)。最大平均偏差进行独立样本t检验,结果无统计学意义(P=0.563);最小平均偏差进行独立样本t检验,也无统计学意义(P=0.051)。
图 5. 6例样本不同数据模型间偏差的Origin曲线图.
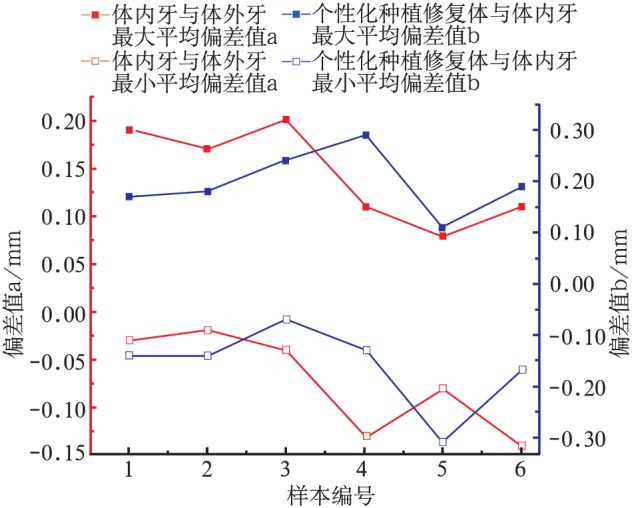
Fig 5 Origin curves of the deviation between different data models of six cases
3. 讨论
20世纪60年代,Hodosh等[4]首次提出制作个性化根形种植体以期实现种植体与拔牙窝的吻合。2012—2014年,Moin等[5]结合Figliuzzi等[6]的研究,成功地将SLM技术打印的钛合金根形种植体用于临床并获得了成功。2014年,胡洪成等[7]应用EBM技术制备了高度精密的种植体。SLM和EBM技术均为高精度3D打印技术,每层厚度可达到(0.015~0.020)mm。现有文献报导,通过SLM及EBM技术制备的个性化根形种植体的制作误差为(0.18±0.04)mm[6]和(0.08~0.35)mm[7]。该技术采用的材料为金属类材料,材料本身不能诱导周围组织向其生长,因此需要CBCT高清晰的成像以及打印设备的无误差操作,才能保证修复体与拔牙窝的高度密合,实现修复体与周围组织的骨结合。
本研究采用FDM技术制作个性化种植修复体,肉眼观察种植修复体大小与体外牙相似。对数据模型进行分析,结果表明:个性化种植修复体与体内牙数据模型高低区域偏差的均值分别为0.19 mm和−0.16 mm,其中高的偏差为正值,低的偏差为负值,即制作的个性化模型较体内牙高出部分的平均值为0.19 mm,低的部分均值为0.16 mm,说明通过FDM技术制作的修复体与真实牙误差较小。FDM技术的优点在于:1)制作材料可以是聚乳酸类的复合型材料,比如羟磷灰石/聚乳酸,其良好的生物相容性和诱导性可诱导牙槽窝周围成骨细胞向修复体定向黏附[8],促进骨组织生长,提高修复体强度[9],增强个性化种植修复体的固位力、摩擦力以及后期的稳定性;2)可根据患者余留牙的颜色选择复合材料的颜色,符合美学的原则;3)FDM技术加工工艺相对简单,一次成型且制作数量多,价格相对低廉。研究表明,FDM技术制作的复合材料植入物用作修复低平牙槽嵴时植入的嵌入体[10]和拔牙后维持牙槽嵴高度的支架[11],均具有良好的生物相容性和引导骨再生的能力。
本研究同时将拔牙前的体内牙数据模型与体外牙置入颌骨后的数据模型进行对比,结果显示不同模型之间存在一定的误差,高低区域平均偏差范围为−0.07 mm~0.14 mm。误差原因可能来自于周围软组织的影响,提取模型时阈值的主观判断,患者拍摄CBCT过程中的晃动、噪声、电磁干扰以及CBCT设备的不同体素[12]等。两组数据经过Origin曲线图分析,结果可以发现,除样本数量较小以及个别因素引起的偏差外,此类对比研究适用于后期植入体与体内牙数据模型的误差比较。
综上所述,通过FDM技术制备的个性化即刻种植修复体能够较好地模拟体外牙的形态,与周围牙槽窝达到基本吻合。
Funding Statement
[基金项目] 中国科学院西部之光人才培养计划(2014);国家自然科学基金资助项目(51171202);甘肃省自然科学基金资助项目(145RJZA126)
References
- 1.Leong KF, Cheah CM, Chua CK. Solid freeform fabrication of three-dimensional scaffolds for engineering replacement tissues and organs[J] Biomaterials. 2003;24(13):2363–2378. doi: 10.1016/s0142-9612(03)00030-9. [DOI] [PubMed] [Google Scholar]
- 2.Yeong WY, Chua CK, Leong KF, et al. Rapid prototyping in tissue engineering: challenges and potential[J] Trends Biotechnol. 2004;22(12):643–652. doi: 10.1016/j.tibtech.2004.10.004. [DOI] [PubMed] [Google Scholar]
- 3.贺 超良, 汤 朝晖, 田 华雨, et al. 3D打印技术制备生物医用高分子材料的研究进展[J] 高分子学报. 2013(6):722–732. [Google Scholar]
- 4.Hodosh M, Povar M, Shklar G. The dental polymer implant concept[J] J Prosthet Dent. 1969;22(3):371–380. doi: 10.1016/0022-3913(69)90200-5. [DOI] [PubMed] [Google Scholar]
- 5.Moin DA, Hassan B, Parsa A, et al. Accuracy of preemptively constructed, cone beam CT-, and CAD/CAM technology-based, individual root analogue implant technique: an in vitro pilot investigation[J] Clin Oral Implants Res. 2014;25(5):598–602. doi: 10.1111/clr.12104. [DOI] [PubMed] [Google Scholar]
- 6.Figliuzzi M, Mangano F, Mangano C. A novel root analogue dental implant using CT scan and CAD/CAM: selective laser melting technology[J] Int J Oral MaxillofacSurg. 2012;41(7):858–862. doi: 10.1016/j.ijom.2012.01.014. [DOI] [PubMed] [Google Scholar]
- 7.胡 洪成, 卢 松鹤, 毋 育伟, et al. 电子束熔融技术制作的个性化根形种植体的制作精度评价[J] 口腔医学研究. 2014;30(6):558–562. [Google Scholar]
- 8.Nainar SMM, Begum S, Ansari MNM, et al. Effect of compatibilizers on in vitro biocompatibility of PLA-HA bioscaffold[J] Bioinspired Biomimetic Nanobiomaterials. 2014;3(4):208–216. [Google Scholar]
- 9.Jaszkiewicz A, Bledzki AK, Franciszczak P. Improving the mechanical performance of PLA composites with natural, man-made cellulose and glass fibers—a comparison to PP counterparts[J] Polimery. 2013;58(6):435–442. [Google Scholar]
- 10.Goh BT, Chanchareonsook N, Tideman H, et al. The use of a polycaprolactone-tricalcium phosphate scaffold for bone regeneration of tooth socket facial wall defects and simultaneous immediate dental implant placement in Macacafascicularis[J] J Biomed Mater Res A. 2014;102(5):1379–1388. doi: 10.1002/jbm.a.34817. [DOI] [PubMed] [Google Scholar]
- 11.Goh BT, Teh LY, Tan DB, et al. Novel 3D polycaprolactone scaffold for ridge preservation—a pilot randomised controlled clinical trial[J] Clin Oral Implants Res. 2015;26(3):271–277. doi: 10.1111/clr.12486. [DOI] [PubMed] [Google Scholar]
- 12.Al-Rawi B, Hassan B, Vandenberge B, et al. Accuracy assessment of three-dimensional surface reconstructions of teeth from cone beam computed tomography scans[J] J Oral Rehabil. 2010;37(5):352–358. doi: 10.1111/j.1365-2842.2010.02065.x. [DOI] [PubMed] [Google Scholar]


