Abstract
目的
研究抑菌浓度的米诺环素对成骨细胞增殖、分化和矿化及Runt相关转录因子2(Runx2)、碱性磷酸酶(ALP)、骨桥蛋白(OPN)mRNA表达的影响。
方法
将米诺环素溶液(0、0.1、0.5、1、10 µg·mL−1)与原代成骨细胞共培养,CCK-8检测增殖活性,通过ALP活性检测、茜素红染色、荧光定量聚合酶链反应检测探讨米诺环素对成骨细胞分化、矿化的影响。
结果
0.1、0.5、1 µg·mL−1的米诺环素可以促进细胞的增殖,上调ALP、Runx2 mRNA的表达水平,增加钙含量及钙化结节的形成,其中1 µg·mL−1具有最大促进作用(P<0.05);当浓度为10 µg·mL−1时这种促进作用开始下降,并对ALP活性和OPN表达有显著抑制作用(P<0.01)。
结论
适宜抑菌浓度的米诺环素能促进成骨细胞增殖,上调Runx2、ALP、OPN的表达水平,促进成骨细胞分化和矿化。
Keywords: 米诺环素, 成骨细胞, 碱性磷酸酶, 增殖
Abstract
Objective
To study the effect of the inhibitory concentration minocycline on the proliferation, differentiation, and expression of Runt-related transcription factor 2 (Runx2), alkaline phosphatase (ALP) and osteopontin (OPN) mRNA of osteoblasts.
Methods
Primary osteoblasts were cultured in osteogenic induction medium containing 0, 0.1, 0.5, 1, 10 µg·mL−1 minocycline. Cell counting kit-8 was used to observe cell proliferation. ALP activity assay, alizarin red S staining, and real-time quantitative polymerase chain reaction (PCR) were used to determine cell differentiation and mineralization.
Results
The groups with 0.1, 0.5, 1 µg·mL−1 minocycline promoted cell proliferation. The mRNA expression levels of ALP and Runx2 were up-regulated. Osteoblast-mediated mineralization was increased. The group with 1 µg·mL−1 showed maximal promotion effect (P<0.05). When the concentration increased to 10 µg·mL−1, the promoting effect began to decline, and the ALP activity and OPN expression were significantly inhibited (P<0.01).
Conclusion
Appropriate concentration of minocycline can promote osteoblasts proliferation, up-regulate the expression levels of Runx2, ALP and OPN, and increase the differentiation and mineralization of osteoblasts.
Keywords: minocycline, osteoblast, alkaline phosphatase, proliferation
牙周病是成人失牙最主要的原因,其特征是牙槽骨的病理性吸收。菌斑微生物及其毒性产物是引发牙周病必不可少的始动因子,消除细菌感染、促进新骨形成是牙周再生治疗的重点。米诺环素(minocycline,又名二甲胺四环素)是一种半合成的盐酸四环素族药物,给药后吸收迅速、完全,组织穿透力强,生物利用度高[1],对牙周致病菌有较强的抑制作用,还可抑制基质金属蛋白酶的活性[2],抑制破骨细胞活性、减少骨吸收[3]–[4],促进牙周组织再生[5]等。但常规用药剂量较大,易产生耐药和菌群失调等不良反应,亚抗菌剂量的四环素作为宿主免疫调节剂治疗慢性牙周病在临床实验中显示出了良好的治疗效果[6]–[7]。1 µg·mL−1是口服标准剂量米诺环素后常见的血浆和龈沟液内药物浓度,具有一定的抑菌作用。任蕾等[8]通过药物筛选试验发现:米诺环素对牙龈卟啉单胞菌、中间普氏菌、具核梭杆菌等的最小抑菌浓度(minimum inhibitory concentration,MIC)为0.25 µg·mL−1,对黏性放线菌的MIC为1 µg·mL−1。国外研究表明,米诺环素对伴放线放线杆菌的MIC为0.25 µg·mL−1[9],对齿垢密螺旋体的MIC<0.125 µg·mL−1[10]。口服标准用量米诺环素后,1 h血浆药物浓度约1.37 µg·mL−1,2 h达峰值2.18 µg·mL−1,相应的龈沟液内药物浓度分别为0.75、1.45 µg·mL−1,唾液药物浓度分别为0.2、0.31 µg·mL−1[11]。
牙周膜细胞(periodontal ligament cell,PDLC)是牙周再生的主要细胞。研究[12]发现,一定浓度的米诺环素可以促进PDLC的增殖和蛋白合成等生物活性,促进牙周新附着的形成。葛少华等[13]还发现,米诺环素可以提高PDLC的碱性磷酸酶(alkaline phosphatase,ALP)活性,促进其向成骨转化的趋势。成骨细胞是骨形成的主要功能单位,其增殖和分化等生物活性控制着骨的形成,促进成骨细胞的增长是有效修复骨缺损的关键因素[14]。研究[15]发现,在牙周骨缺损的修复过程中成骨细胞增生活跃,紧密排列在骨小梁表面,并可见新骨和结缔组织形成。由此可见,成骨细胞也参与了牙周骨缺损的再生和修复过程。但是目前关于米诺环素和成骨细胞的研究相对较少。如果米诺环素在维持有效抑菌活性的同时对成骨细胞的功能活性也具有一定的促进作用,对于牙周骨缺损的修复治疗效果将更加理想。因此本实验拟通过米诺环素与成骨细胞共培养,探讨抑菌浓度的米诺环素对成骨细胞的影响,为牙周病引起的骨缺损修复治疗提供更多的参考和依据。
1. 材料和方法
1.1. 实验动物
选取由重庆医科大学动物实验中心提供的新生SD鼠(≤3 d)5只,雌雄不限,实验过程中对动物的处置符合伦理学要求。
1.2. 主要试剂和仪器
盐酸米诺环素、Ⅱ型胶原酶(Sigma公司,美国),CCK-8试剂盒(日本同仁公司),0.1%TritonX-100、ALP活性检测试剂盒(上海碧云天生物技术公司),电解质分析仪(南京攀事达电子仪器有限公司),荧光定量聚合酶链反应(polymerase chain reaction,PCR)检测试剂盒(Takara公司,日本),α-MEM培养基、PBS(Hyclone公司,美国),β-甘油磷酸钠、维生素C和茜素红S(北京索莱宝科技有限公司),荧光定量PCR仪(Bio-Rad公司,美国),酶联免疫吸附测定法(enzyme-linked immunosorbent assa,ELISA)试剂盒(北京Bioss公司),倒置相差显微镜(Nikon公司,日本)。
1.3. 实验方法
1.3.1. 培养基的配置
基础培养基:α-MEM培养基+10%胎牛血清+1%青-链霉素;成骨诱导培养基:基础培养基+50 µg·mL−1维生素C+10 mmol·L−1 β-甘油磷酸钠+10 nmol·L−1地塞米松;不同浓度的米诺环素:用成骨诱导培养基将米诺环素配置为5个浓度组(0、0.1、0.5、1、10 µg·mL−1)。
1.3.2. 乳鼠颅顶骨成骨细胞原代培养
成骨细胞原代培养方法参照文献[16],结合组织块法和二次酶消化法并稍作改进。5只SD大鼠在75%乙醇中浸泡10 min,无菌条件下剪开头部皮肤,沿骨缝小心分离、取出颅顶骨,置于盛有PBS缓冲液的培养皿漂洗2~3次,小心去除附着的骨膜和结缔组织,剪碎成1 mm×1 mm的碎骨块,加入1 mg·mL−1Ⅱ型胶原酶37 °C水浴消化1 h,加入0.25%胰酶继续消化30 min,1 000 r·min−1离心4 min,弃上清,将碎骨块均匀接种于T25培养瓶,加入基础培养基,37 °C、5%CO2孵箱孵育,1周换液2次,待细胞融合约80%时传代,换用成骨诱导培养基。取第3代细胞通过ALP染色和形态观察行成骨细胞鉴定,取生长良好的第4代细胞用于实验。
1.3.3. 细胞增殖活性检测
将生长良好的第4代成骨细胞以每毫升2×104个接种于96孔板,每孔100 µL,次日换液。将各浓度组含米诺环素的培养基分别加入96孔板(0 µg·mL −1为对照组,其余各组为实验组),37 °C、5%CO2条件下孵育,倒置相差显微镜观察细胞形态,分别于培养的1、3、7 d按照试剂盒操作说明每孔加入CCK-8检测液10 µL,37 °C、5%CO2条件下孵育3 h,于450 nm处测定各组光密度(optical density,OD)值。
1.3.4. ALP活性检测
成骨细胞以每毫升2×104个接种于24孔板,每孔1 mL,次日换液,分组同前。分别于培养的3、7 d行ALP活性检测。ALP活性检测采用0.1%TritonX-100获得细胞裂解液,按照ALP活性检测试剂盒进行检测,于405 nm处测定各组OD值。
1.3.5. 骨桥蛋白(osteopontin,OPN)含量检测
细胞培养及分组同1.3.4,收集7 d的细胞上清液,按照ELISA试剂盒操作说明,于450 nm处测定各组OD值,根据标准品标准曲线计算出蛋白含量。
1.3.6. 钙含量检测
细胞培养及分组同1.3.4,收集21 d的细胞培养基,使用电解质分析仪检测细胞基质总钙含量。
1.3.7. 矿化结节染色
细胞培养及分组同1.3.4,于21 d弃培养基,PBS漂洗2~3次,4%多聚甲醛室温固定30 min,PBS振荡清洗5次,每次5 min,每孔加入茜素红S染液200 µL,37 °C摇箱孵育30 min,PBS清洗2~3次,每次5 min,镜下观察拍照。
1.3.8. 荧光定量PCR
成骨细胞以每毫升2×104个接种于6孔板,次日换液。分组同前,于第7天按总RNA提取试剂盒操作说明提取各组总RNA,按照cDNA合成试剂盒将所得总RNA逆转录为cDNA,荧光定量PCR反应参照试剂盒(TakaRa No.RR820A),目的基因为ALP、Runt相关转录因子2(Runt-related transcription factor 2,Runx2)、OPN,内参为β-actin。引物序列如下。ALP上游引物序列:5′-CTCCATCTTTGGTCTGGCTCC-3′,下游引物序列:5′-CATTTTCCCGTTCACCGTCC-3′;Runx2上游引物序列:5′-CCAACTTCCTGTGCTCCGTG-3′,下游引物序列:5′-TCGTTGAACCTGGCTACTTGG-3′;OPN上游引物序列:5′-TTCACTCCAATCGTCCCTACAG-3′,下游引物序列:5′-TCCTTAGACTCACCGCTCTTCAT-3′;β-actin上游引物序列:5′-AGATTACTGCTCTGGCTCCTAGC-3′,下游引物序列:5′-ACTCATCGTACTCCTGCTTGCT-3′。反应条件:95 °C 30 s;95 °C 5 s,60 °C 30 s,40个循环;95 °C 10 s;65 °C 5 s,95 °C 5 min。
1.4. 统计学分析
采用SPSS 17.0软件对实验数据进行统计分析,组间差异比较采用单因素方差分析,两两比较采用LSD多重检验法。P<0.05表示差异有统计学意义。
2. 结果
2.1. 成骨细胞原代培养和鉴定
原代培养第3天,倒置相差显微镜下见成骨细胞从碎骨块周围爬出,呈放射状贴壁生长,形态不规则,呈多边形或三角形,有较多突起,单核卵圆形,1~2个核仁,胞质丰富清晰,ALP染色呈阳性,蓝黑色颗粒沉积在胞浆及细胞核ALP活性部位(图1)。
图 1. 成骨细胞原代培养和鉴定 倒置相差显微镜.
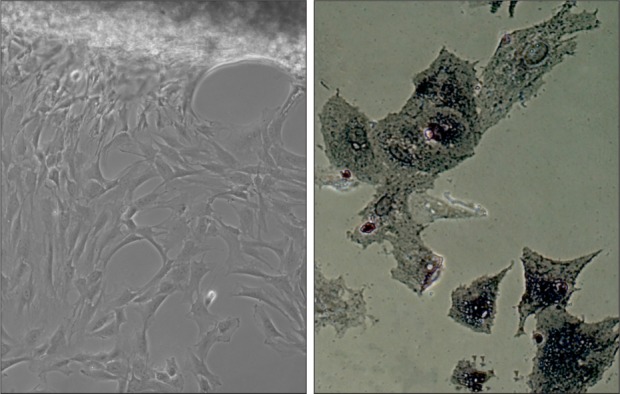
Fig 1 Primary culture and identification of osteoblasts inverted microscope
左:× 40;右:ALP染色,× 200。
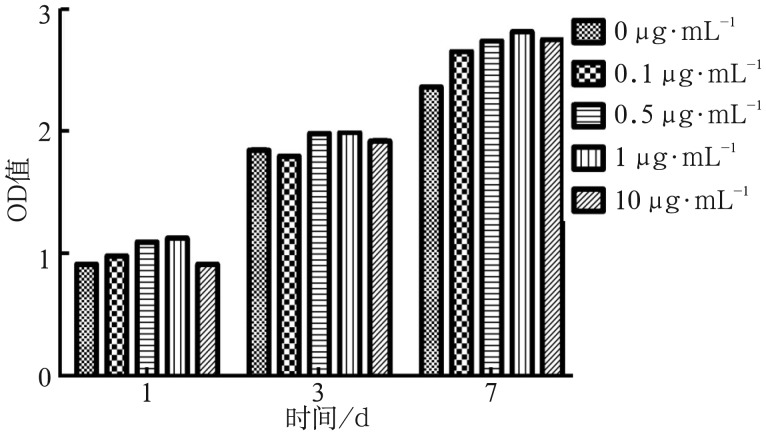
2.2. 米诺环素对成骨细胞增殖的影响
成骨细胞的增殖活性随培养时间的增加而增高,1、3 d时,0.5、1 µg·mL−1组的细胞增殖活性均高于对照组(P<0.05)。7 d时,0.1、0.5、1、10 µg·mL−1组的细胞增殖活性均高于对照组(P<0.01),其中1 µg·mL−1为最大促增殖浓度,10 µg·mL−1组的细胞增殖效应较1 µg·mL−1组有所下降(图2)。表明一定浓度的米诺环素可以促进成骨细胞的增殖,而随着浓度的增加这种促增殖作用开始下降。
图 2. 米诺环素对成骨细胞增殖的影响.
Fig 2 Effect of minocycline on the proliferation of osteoblasts
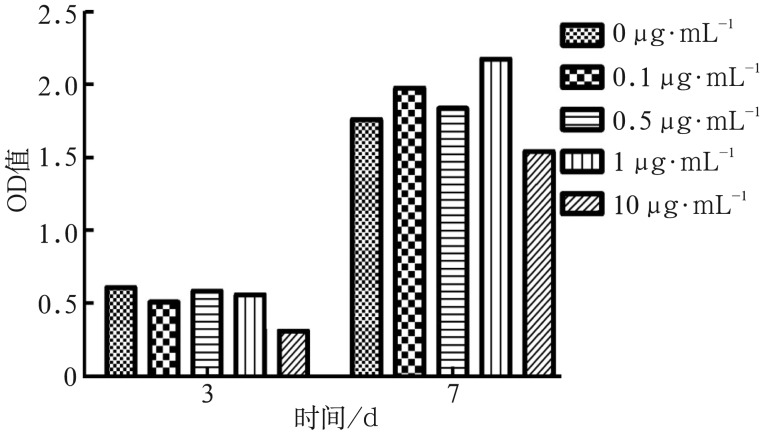
2.3. 米诺环素对成骨细胞ALP活性的影响
3 d时,米诺环素对ALP活性有一定的抑制作用,各浓度组ALP活性值均低于对照组,0.1 µg·mL−1和10 µg·mL−1组与对照组间差异有统计学意义(P<0.01),0.5 µg·mL−1和1 µg·mL−1组与对照组间差异无统计学意义(P>0.05)。7 d时,0.1 µg·mL−1和1 µg·mL−1组ALP活性值均高于对照组且差异有统计学意义(P<0.01),1 µg·mL−1时达最大促进效应,10 µg·mL−1组ALP活性值低于对照组(P<0.01)(图3)。
图 3. 米诺环素对成骨细胞ALP活性的影响.
Fig 3 Effect of minocycline on osteoblasts ALP activity
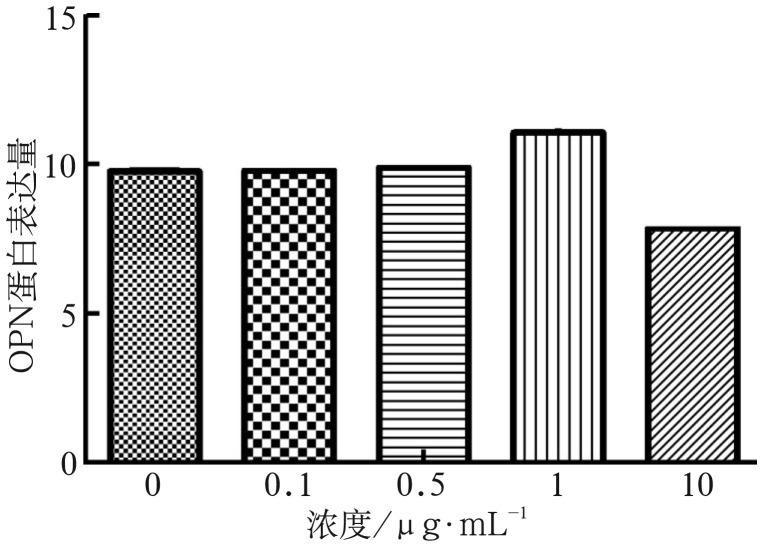
2.4. OPN含量检测
0.1、0.5 µg·mL−1组OPN表达量与对照组差异无统计学意义(P>0.05),1 µg·mL−1组蛋白表达量高于对照组(P<0.01),10 µg·mL−1组蛋白表达量明显低于对照组(P<0.01)(图4)。
图 4. OPN表达检测.
Fig 4 Expression of OPN
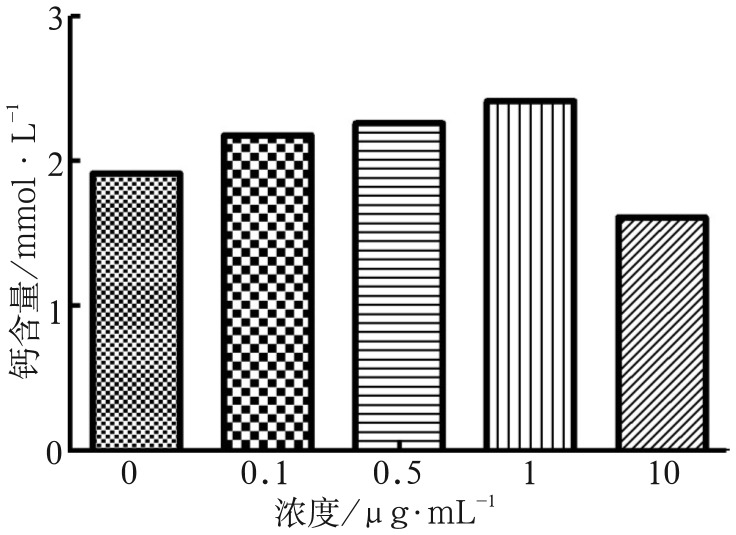
2.5. 钙含量检测
米诺环素处理21 d后0.1、0.5、1 µg·mL−1组钙含量高于对照组(P<0.05),10 µg·mL−1组钙含量较对照组明显降低(P<0.01)(图5)。
图 5. 钙含量检测结果.
Fig 5 Results of calcium content
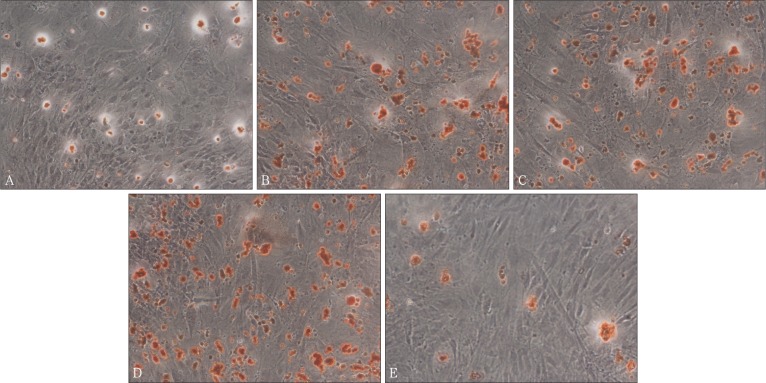
2.6. 矿化结节染色
倒置显微镜下观察可见细胞呈多层重叠生长,各组细胞间均可见橘红色矿化结节,与对照组相比,0.1、0.5、1 µg·mL−1米诺环素可以促进成骨细胞钙盐沉积和矿化,其中以1 µg·mL−1促进效果最佳,矿化结节形成较多;10 µg·mL−1组则表现出一定的抑制作用,形成的矿化结节少而散在(图6)。
图 6. 成骨细胞茜素红染色结果 茜素红染色 × 100.
Fig 6 Alizarin red staining results of osteoblasts alizarin red staining × 100
A:0 µg·mL−1组;B:0.1 µg·mL−1组;C:0.5 µg·mL−1组;D:1 µg·mL−1组;E:10 µg·mL−1组。
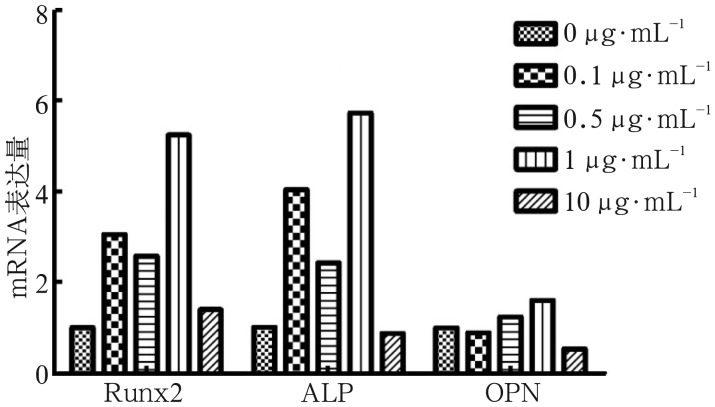
2.7. 荧光定量PCR
1 µg·mL−1米诺环素可以上调成骨细胞相关基因Runx2、ALP、OPN mRNA的表达,与对照组相比差异有统计学意义(P<0.01);0.1、0.5 µg·mL−1组可以上调Runx2、ALP mRNA表达水平(P<0.01),10 µg·mL−1组相较于对照组Runx2 mRNA表达水平上调,ALP和OPN mRNA表达水平下调,其中OPN与对照组相比差异有统计学意义(P<0.01)(图7)。
图 7. 成骨细胞相关基因mRNA表达水平.
Fig 7 Gene expression level of osteoblasts
3. 讨论
研究[17]发现米诺环素可以有效减少牙松动度、牙龈指数及牙槽骨吸收等。刘迪等[5]指出:米诺环素脂质体控释凝胶能够改善牙周组织病变,制抑单核细胞和破骨细胞的数量,并可促进新牙周纤维及新骨的生成。近期有学者[18]提出米诺环素可以促进间充质干细胞的增殖、迁徙、细胞外基质的附着以及黏附因子、生长因子的释放等,从而调节其再生能力。
成骨细胞是骨形成的主要功能单位,能合成有机基质并调节矿化过程。刺激成骨细胞增殖并促进其分化成熟是调节骨代谢、促进新骨形成、修复骨缺损的重要方法。CCK-8法是检测细胞增殖的指标,可以反映生活细胞的代谢水平。本研究采用CCK-8法检测米诺环素对成骨细胞增殖活性的影响,结果显示米诺环素在0.1、0.5、1 µg·mL−1时对体外培养的成骨细胞有明显的促增殖作用,1 µg·mL−1时对成骨细胞有最大促增殖作用,当浓度为10 µg·mL−1时,促增殖效应开始下降。表明一定浓度的米诺环素能促进成骨细胞的增殖,达到高浓度后具有一定细胞毒性,具有抑制细胞增殖的趋势。
ALP是成骨细胞分泌的一组膜结合糖蛋白,是成骨细胞早期分化的特异性标志,在硬组织的形成及矿化中有重要作用。ALP活性的高低,能较客观地反映成骨细胞分化成熟的程度。Runx2是调节成骨细胞分化和骨形成的关键转录因子,是骨形成过程中最具特征性的标志物。本实验中,通过ALP活性检测及荧光定量PCR两种方法检测了米诺环素对成骨细胞分化的影响,取得了一致的结果。在最初的3 d,ALP活性值较低,分析可能与细胞正处于增殖阶段,尚未分化有关。随后ALP活性值开始增加,且ALP mRNA、Runx2 mRNA表达量和ALP活性值均在1 µg·mL−1时具有最大值;而10 µg·mL−1组ALP活性值及ALP mRNA水平均低于对照组。分析米诺环素促进成骨细胞ALP活性的原因可能是:1)与促进细胞增殖有关,成骨细胞数量的增加,分泌的ALP也随之增加;2)上调ALP mRNA表达水平,促进ALP的分泌,调节成骨细胞的分化;3)上调Runx2 mRNA表达水平。有实验证明Runx2能调节多种成骨细胞特异性标志物的表达[19]。OPN是成骨细胞分化中晚期的主要功能蛋白和标志物,具有钙离子螯合作用,是骨基质矿化中非常重要的非胶原蛋白。本实验通过ELISA法和荧光定量PCR两种方法检测了各组OPN的表达情况,结果显示1 µg·mL−1米诺环素可以上调OPN mRNA和蛋白的表达,10 µg·mL−1组蛋白和基因表达量较其他各组明显降低。
成骨细胞分化成熟后多层重叠生长形成结节样结构,并不断分泌基质和矿物质,形成矿化结节。茜素红染色等方法可以观察矿化结节的形成情况,测定成骨细胞的钙化程度。由于本实验采用了成骨诱导培养基,β-甘油磷酸钠经ALP的水解作用释放出磷离子,有利于矿物盐的沉积和矿化结节的形成,故对照组和各实验组均可见橘红色钙化结节形成。其中0.1、0.5、1 µg·mL−1组的矿化结节和钙含量均多于对照组;而10 µg·mL−1米诺环素形成的矿化结节少而散在,钙含量也较对照组低。表明适宜浓度的米诺环素对成骨细胞的矿化能力有一定的促进作用。
综上所述,本实验研究了抑菌浓度的米诺环素对成骨细胞的影响,结果发现0.1、0.5、1 µg·mL−1的米诺环素可促进成骨细胞的生物活性,其中1 µg·mL−1具有最大促进作用,不仅可以增加成骨细胞的数量,还能上调成骨相关基因Runx2、ALP及OPN mRNA的表达,增加ALP活性和骨基质的矿化。由此推测适宜浓度的米诺环素具有良好的抑菌作用和促进成骨双重作用。研究[20]表明,米诺环素对多种牙周致病菌有较强的抑菌作用,其抑菌作用随浓度增加而增强。但本实验发现随着浓度的增加,米诺环素对成骨细胞生物活性的促进作用开始下降,当浓度为10 µg·mL−1时则出现了一定的抑制作用。这也为进一步研究米诺环素用于牙周病导致的骨缺损的治疗奠定了基础,后续本实验组将通过局部用药载体的研究及动物模型进一步研究其机制和实用价值。
Funding Statement
[基金项目] 国家自然科学基金(81200767,H1402);重庆市基础科学与前沿技术研究专项资助(cstc2017jcyjAX0215);重庆市渝中区科技计划项目(20170117);重庆市渝北区科技计划项目(渝北财签[2011]102号);2016年重庆高校创新团队建设计划资助项目(CXTDG201602006)
Supported by: The National Natural Science Foundation of China (81200767, H1402); Chongqing Research Program of Basic Research and Frontier Technology (cstc2017jcyjAX0215); Science and Technology Planning Project of Chongqing Yuzhong (20170117); Science and Technology Planning Project of Chongqing Yubei ([2011]102); Program for Innovation Team Building at Institutions of Higher Education in Chongqing in 2016 (CXTDG201602006).
References
- 1.Garrido-Mesa N, Zarzuelo A, Gálvez J. Minocycline: far beyond an antibiotic[J] Br J Pharmacol. 2013;169(2):337–352. doi: 10.1111/bph.12139. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.包 柳明, 叶 皓玫. 米诺环素对慢性牙周炎龈沟液中MMP-2及其TIMP-2的影响及疗效观察[J] 放射免疫学杂志. 2013;26(4):530–532. [Google Scholar]; Bao LM, Ye HM. Effect of minocycline on MMP-2 and TIMP-2 in gingival crevicular fluid of chronic periodontitis[J] J Radioimmunol. 2013;26(4):530–532. [Google Scholar]
- 3.Udagawa N, Koide M, Nakamura M, et al. Minocycline to be used a potential anti-bone resorption agents due to the suppression of osteoclastic bone resorption[J] J Oral Biosci. 2013;55(1):16–22. [Google Scholar]
- 4.Nagasawa T, Arai M, Togari A. Inhibitory effect of minocycline on osteoclastogenesis in mouse bone marrow cells[J] Arch Oral Biol. 2011;56(9):924–931. doi: 10.1016/j.archoralbio.2011.02.002. [DOI] [PubMed] [Google Scholar]
- 5.刘 迪, 杨 丕山, 胡 德渝, et al. 盐酸米诺环素脂质体控释凝胶改善大鼠实验性牙周炎的作用评价[J] 华西口腔医学杂志. 2013;31(6):592–596. [PubMed] [Google Scholar]; Liu D, Yang PS, Hu DY, et al. Minocycline hydrochloride liposome controlled-release gel improves rat experimental periodontitis[J] West Chin J Stomatol. 2013;31(6):592–596. [PubMed] [Google Scholar]
- 6.徐 燕, 魏 伟. 亚抗菌剂量的米诺环素对大鼠实验性牙周炎治疗作用的初步观察[J] 实用口腔医学杂志. 2006;22(6):831–834. [Google Scholar]; Xu Y, Wei W. Effects of minocycline at subantimicrobial dosage in the treatment of experimental periodontitis in rats[J] J Pract Stomatol. 2006;22(6):831–834. [Google Scholar]
- 7.Golub LM, Elburki MS, Walker C, et al. Non-antibacterial tetracycline formulations: host-modulators in the treatment of periodontitis and relevant systemic diseases[J] Int Dent J. 2016;66(3):127–135. doi: 10.1111/idj.12221. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.任 蕾, 杨 圣辉, 刘 颖. 牙周炎常见菌对抗菌药物的筛选及活性测定[J] 现代口腔医学杂志. 2000;14(4):256–257. [Google Scholar]; Ren L, Yang SH, Liu Y. Screening and activity determination of antimicrobial agents of common bacteria in periodontitis[J] J Modern Stomatol. 2000;14(4):256–257. [Google Scholar]
- 9.Takahashi N, Ishihara K, Kato T, et al. Susceptibility of Actinobacillus actinomycetemcomitans to six antibiotics decreases as biofilm matures[J] J Antimicrob Chemother. 2007;59(1):59–65. doi: 10.1093/jac/dkl452. [DOI] [PubMed] [Google Scholar]
- 10.Okamoto-Shibayama K, Sekino J, Yoshikawa K, et al. Antimicrobial susceptibility profiles of oral Treponema species[J] Anaerobe. 2017;48:242–248. doi: 10.1016/j.anaerobe.2017.10.005. [DOI] [PubMed] [Google Scholar]
- 11.Sakellari D, Goodson JM, Kolokotronis A, et al. Concentration of 3 tetracyclines in plasma, gingival crevice fluid and saliva[J] J Clin Periodontol. 2000;27(1):53–60. doi: 10.1034/j.1600-051x.2000.027001053.x. [DOI] [PubMed] [Google Scholar]
- 12.Suzuki A, Yagisawa J, Kumakura S, et al. Effects of minocycline and doxycycline on cell survival and gene expression in human gingival and periodontal ligament cells[J] J Periodontal Res. 2006;41(2):124–131. doi: 10.1111/j.1600-0765.2005.00843.x. [DOI] [PubMed] [Google Scholar]
- 13.葛 少华, 杨 丕山, 赵 宁, et al. 米诺环素对人牙周韧带细胞矿化能力的影响[J] 现代口腔医学杂志. 2005;19(1):63–66. [Google Scholar]; Ge SH, Yang PS, Zhao N, et al. The effect of minocycline on the mineral characteristics of human periodontal ligament cells[J] J Modern Stomatol. 2005;19(1):63–66. [Google Scholar]
- 14.李 晓峰, 赵 劲民, 苏 伟, et al. 大鼠成骨细胞的原代培养和鉴定[J] 中国组织工程研究与临床康复. 2011;15(6):990–994. [Google Scholar]; Li XF, Zhao JM, Su W, et al. Primary culture and identification of rat osteoblasts[J] J Clin Rehabil Tissue Eng Res. 2011;15(6):990–994. [Google Scholar]
- 15.董 红宾, 张 琴, 何 惠宇, et al. 三种异种骨材料修复牙周骨缺损的比较[J] 中国组织工程研究. 2015;19(8):1170–1176. [Google Scholar]; Dong HB, Zhang Q, He HY, et al. Three kinds of heterogeneous bone materials for repair of periodontal bone defects[J] Chin J Tissue Eng Res. 2015;19(8):1170–1176. [Google Scholar]
- 16.李 娟, 申 广浩, 程 光, et al. 组织块法培养SD大鼠的成骨细胞及鉴定[J] 中国组织工程研究. 2012;16(46):8571–8574. [Google Scholar]; Li J, Shen GH, Cheng G, et al. Explant culture and identification of SD rat's osteoblasts[J] Chin J Tissue Eng Res. 2012;16(46):8571–8574. [Google Scholar]
- 17.Xu Y, Wei W. A comparative study of systemic subantimicrobial and topical treatment of minocycline in experimental periodontitis of rats[J] Arch Oral Biol. 2006;51(9):794–803. doi: 10.1016/j.archoralbio.2006.03.018. [DOI] [PubMed] [Google Scholar]
- 18.Guerra AD, Rose WE, Hematti P, et al. Minocycline enhances the mesenchymal stromal/stem cell pro-healing phenotype in triple antimicrobial-loaded hydrogels[J] Acta Biomater. 2017;51:184–196. doi: 10.1016/j.actbio.2017.01.021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Adhami MD, Rashid H, Chen H, et al. Loss of Runx2 in committed osteoblasts impairs postnatal skeletogenesis[J] J Bone Miner Res. 2015;30(1):71–82. doi: 10.1002/jbmr.2321. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.陈 菲, 庄 德舒, 张 洪波, et al. 生物活性透明质酸联合盐酸米诺环素对牙龈卟啉单胞菌抑菌作用研究[J] 中国实用口腔科杂志. 2017;10(5):283–286. [Google Scholar]; Chen F, Zhuang DS, Zhang HB, et al. Effect of bioactive hyaluronie acid combined with minocycline hydrochloride on the antibacterial function of Porphyromonas gingivalis[J] Chin J Pract Stomatol. 2017;10(5):283–286. [Google Scholar]