Abstract
目的
探讨利用小型猪建立下颌骨放射性骨坏死(ORN)动物模型的可行性。
方法
应用三维适形放疗(3D-CRT)技术,采用电子直线加速器照射源对24只小型猪右侧下颌骨进行25 Gy和28 Gy一次性照射,于照射结束后2个月拔除双侧下颌第一磨牙,通过定期局部观察、X线、CT检查和组织病理学方法诊断下颌骨ORN的发生。
结果
照射结束后3~4个月,拔牙后的小型猪先后全部发生了下颌骨ORN,28 Gy+拔牙组症状较重。
结论
25 Gy单一剂量放射小型猪下颌骨+拔牙能建立有效的、可信的下颌骨ORN模型,可用于ORN病因学及治疗等方面的进一步研究。
Keywords: 放射性骨坏死, 下颌骨, 小型猪, 动物模型
Abstract
Objective
To establish a miniature pig model of mandibular osteoradionecrosis (ORN).
Methods
A single dose of irradiation (IR25 Gy, 28 Gy) was delivered via an electronic linear accelerator to the right mandible of 24 miniature pigs by utilizing three dimensional conformal radiotherapy (3D-CRT). The first molar of the mandible was extracted 2 months after radiation. Mandibular ORN was diagnosed through gross observation, X-ray film, CT, and histopathologic examination.
Results
At 3–4 months after radiation, all animals suffered from mandibular ORN after dental extraction. The symptoms of ORN were more severe in the 28 Gy group than in the 25 Gy group.
Conclusion
A miniature pig model of mandibular ORN can be established through 25 Gy irradiation+dental extraction.
Keywords: osteoradionecrosis, mandible, miniature pig, animal model
下颌骨放射性骨坏死(osteoradionecrosis,ORN)是头颈部恶性肿瘤放射治疗后所发生的严重并发症,该病最早由Regaud于1922年提出,近年有报道其发病率可高达37%[1]–[2]。迄今为止,关于下颌骨ORN的病因病理尚不十分清楚,临床上进行治疗也存在很大困难。随着放射治疗技术的发展,以往的一些动物实验在动物选择及照射技术等方面显示出不足之处。本研究首次应用现代三维适形放疗(three dimensional conformal radiotherapy,3D-CRT)技术,采用电子直线加速器为照射源,建立了小型猪下颌骨ORN动物模型,为进一步研究下颌骨ORN的基础和临床问题奠定基础。
1. 材料和方法
1.1. 实验动物和分组
本研究选用北京农业科学院实验动物研究所提供的实验用小型猪24只,体重25~30 kg,年龄12~15个月。单笼饲养,每日早晚喂食标准混合饲料2次,自由饮水,适应性饲养2周后,进行实验。根据照射剂量的不同,随机分为25 Gy组和28 Gy组,每组12只。
1.2. 照射源和照射方法
1.2.1. 照射源
照射源用电子直线加速器(美国瓦里安公司),射线平均能量6 mV,剂量率320跳·min−1。
1.2.2. 照射方法
借助模拟定位(CT-SIMULATION,CT-SIM)辅以计算机治疗计划系统,利用Pinnacle3软件(ADAC公司,美国)制定3D-CRT计划。采取一次性照射方法,2组动物的照射剂量分别为25 Gy和28 Gy。根据线性—二次模式总效应方程换算,单次照射25 Gy相当于分割照射剂量和为65 Gy的总效应;单次照射28 Gy相当于分割照射剂量和为80 Gy的总效应。照射前按0.1 mL·kg−1剂量,小型猪耳后肌肉内注射噻胺酮(氯胺酮和麻保静)麻醉。小型猪的照射体位为俯卧位,射线以右侧下颌骨为中心,呈37°和217°对穿照射,加30°楔形板校正剂量。照射野为右侧下颌骨,上界为下颌骨上缘,下界为下颌骨下缘,前界为下颌第一磨牙前缘,后界为下颌升支前后缘间的中线。
1.3. 拔牙
照射结束后2个月随机选取2组动物各9只,拔除双侧下颌第一磨牙。
1.4. 观察指标
1.4.1. 肉眼观察
包括局部皮肤颜色和毛发状况,有无颌面部皮肤及黏膜坏死溃烂、瘘道形成、张口受限。
1.4.2. X线及CT检查
照射结束后定期摄片观察骨质密度和骨质破坏吸收情况。X线片拍摄应用自制头颅固定装置,取下颌骨斜侧位,避免双侧下颌骨影像叠加。
1.4.3. 病理检查
对颌面部死骨暴露的动物,麻醉后钳取小块暴露之死骨;其余动物分别于照射结束后6~8个月处死,切取坏死骨组织。标本浸入中性甲醛液中固定,常规脱钙、包埋、切片、苏木精-伊红(hematoxylin-eosin,HE)染色后于光镜下观察。
2. 结果
2.1. 肉眼观察
照射结束后,25 Gy组和28 Gy组动物右下颌均出现不同程度的坏死。照射结束后3~4周首先出现放射野内黏膜的脱色,与照射野外的黏膜之间界限清晰,随后出现黏膜上皮的充血水肿和上皮脱落,伴有或不伴有溃疡,上述症状于照射结束后7周达高峰状态,之后逐渐减轻。照射结束后2个月,25 Gy组动物照射野内皮肤发生脱屑及色素加深;28 Gy组动物照射野内皮肤出现大疱,随后疱顶上皮脱落而形成溃疡,溃疡愈合后表面遗留色素斑和瘢痕。照射结束后6个月始,各组动物照射区域内皮肤均发生不同程度的萎缩,牙齿拔除的动物出现皮下组织僵硬、固定。各组动物的左下颌(非放射侧)第一磨牙拔牙创均于拔牙后1个月左右愈合;右下颌(放射侧)第一磨牙拔牙创形成慢性不愈创口,25 Gy+拔牙组动物黏膜坏死溃烂,右侧颌面部瘘管形成,长期流脓,恶臭明显(图1);28 Gy+拔牙组中有3例动物于拔牙后1个月形成右侧颌面部洞穿性缺损,张口受限严重,咬合错乱(图2)。
图 1. 照射结束后3个月,25 Gy+拔牙动物右侧颌下照射区域内出现瘘道,内有坏死组织(箭头示).
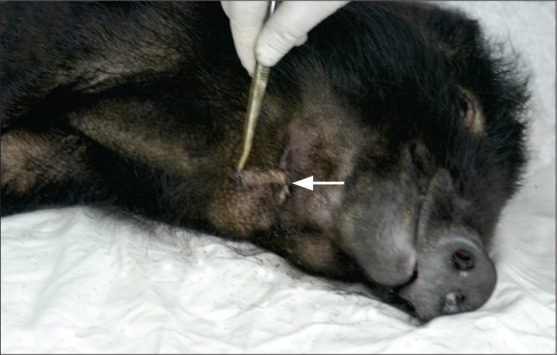
Fig 1 Three months after irradiation, group of 25 Gy+tooth extraction, mandible irradiated area appeared fistula on the right side of the jaw, necrotic tissue inside (arrow)
图 2. 照射结束后3个月,28 Gy+拔牙动物照射区域内形成洞穿性缺损,创口不愈(箭头示).
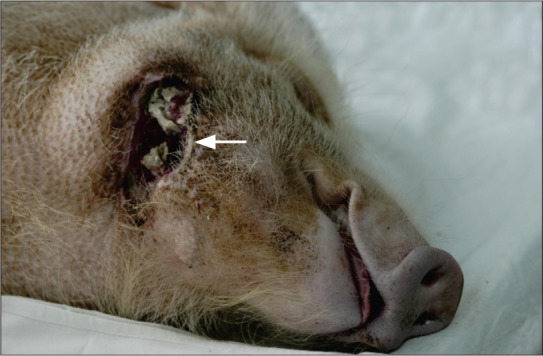
Fig 2 Three months after irradiation, group of 28 Gy+tooth extraction, mandible irradiated area formatted perforated defect, wound was not healing (arrow)
2.2. X线及CT改变
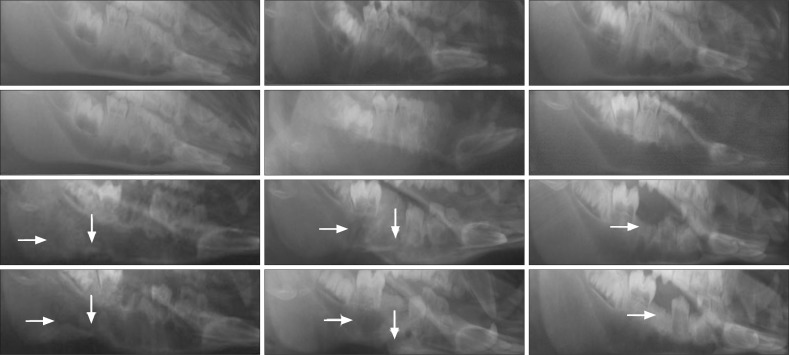
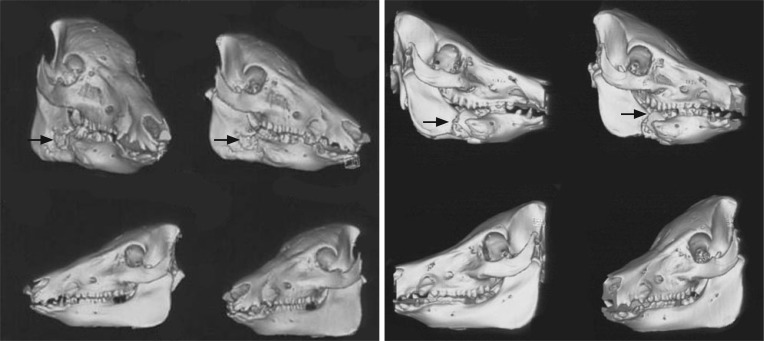
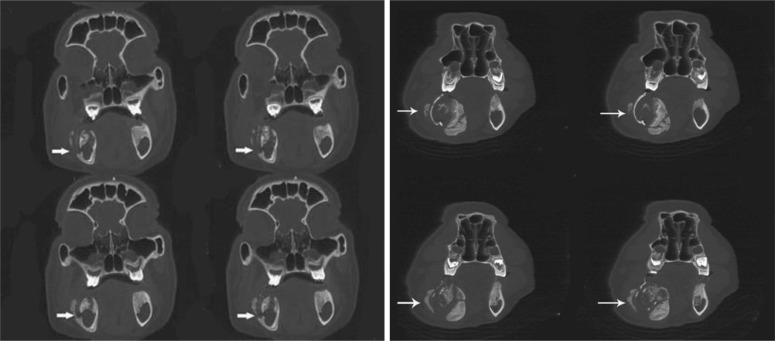
右下颌第一磨牙拔除后1个月,各组动物右侧下颌骨斜侧位片可见照射区域内骨质密度不均,骨小梁模糊或消失,呈不规则斑点状破坏,边缘模糊;右下颌第一磨牙拔除后3个月,照射区域骨质密度更低,同时在阴影区背景内夹杂着团块或点状密度增高的病理性骨沉积,骨质破坏区形态不规则,范围扩大(图3);随后的观察中可见大小不等、形态不一的死骨,1例28 Gy+拔牙动物于拔牙后3个月出现病理性骨折(图3)。截止照射结束后8个月,未拔牙动物双侧下颌骨骨小梁及骨密度未见异常改变。各组动物左下颌第一磨牙拔牙创正常愈合,3个月后X线片显示骨质密度接近正常(图3)。右下颌第一磨牙拔除后2个月,螺旋CT表面遮盖(shaded surface display,SSD)三维重建显示下颌骨照射区域内不规则骨质破坏区,骨密质不连续;冠状CT薄层扫描骨窗显示骨质密度减低,骨密质破坏,骨松质变形增厚,骨髓腔与外界相通(图4、5)。在上述的改变中,28 Gy+拔牙动物组动物症状出现的早而重。
图 3. 下颌骨X线片观察结果.
Fig 3 X-ray observation of mandible
从左至右分别为25 Gy+拔牙动物右侧下颌骨、28 Gy+拔牙动物右侧下颌骨、拔牙动物左侧下颌骨。从上至下依次为:照射前、照射后60 d、照射后90 d(牙齿拔除后1个月)、照射后150 d(牙齿拔除后3个月)。第一、二列中箭头所示为骨质破坏区,第三列中箭头所示为拔牙窝。
图 4. 螺旋CT三维重建结果.
Fig 4 Reconstructed results of three-dimensional spiral CT
左:25 Gy+拔牙组,照射后115 d;右:28 Gy+拔牙组,照射后100 d;箭头所示为骨质破坏区。
图 5. 冠状CT薄层扫描结果.
Fig 5 Coronary CT thin layer scanning results
左:25 Gy+拔牙组,照射后115 d,箭头所示为骨质破坏区,骨密质断裂;右:28 Gy+拔牙组,照射后100 d,箭头所示为骨质破坏区,骨质破坏范围大,整个颌骨骨质坏死膨隆。
2.3. 病理切片观察
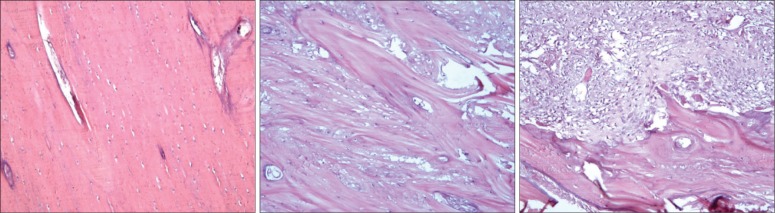
放射结束后3个月,25 Gy+拔牙动物右侧下颌骨照射区域内光镜检查见板层骨纹理粗糙,部分骨细胞消失,骨陷窝空虚,成骨和破骨现象均不明显;28 Gy+拔牙动物切片显示板层骨结构模糊或断裂,骨细胞大部分消失,镜下表现为缺少细胞结构的紊乱的一团组织。牙齿拔除动物左侧下颌骨及未拔牙动物的双侧下颌骨光镜检查未见明显改变(图6)。
图 6. 下颌骨组织病理观察结果 HE × 100.
Fig 6 Observations of mandibular histopathology HE × 100
左:正常下颌骨,骨小梁排列规整;中:25 Gy+拔牙组,骨细胞部分消失;右:28 Gy+拔牙组,骨陷窝空虚,骨小梁破坏加重。
3. 讨论
3.1. 放射技术和放射线的种类
放射治疗作为治疗肿瘤的外照射治疗方式已有上百年的历史,国内外一些学者[3]–[5]采用传统的放射治疗技术建立了不同动物的下颌骨ORN动物模型。由于受技术限制,传统放射治疗不能将放射剂量都集中于靶区,靶区空间定位和界定描述精度差,导致实验结果的剂量值不精确[6]。本研究首次采用了目前临床应用的3D-CRT技术,建立了小型猪下颌骨ORN动物模型,更好地模拟了当今放射治疗的临床实际情况。与以往通过传统放射治疗技术建立的模型相比,本研究中的下颌骨靶区是被3D-CRT一层层(slice by slice)界定的,从而使射线的高剂量区在立体空间上与靶区的实际形状一致,实验结果的剂量值更精确。
放射线的种类也直接影响对下颌骨的损害程度,以往的下颌骨ORN动物模型均是采用深部X线或60Co作为照射源的。深部X线主要用于表浅病灶的放射治疗,其低能量部分毫无治疗价值,对骨的损伤大;60Co衰变过程中放出的γ射线的穿透力大于深部X线,但能量固定且半衰期短。直线加速器的剂量率高,能量可调控,近年已逐步在临床放射治疗中占主导地位。本研究所有动物均采用电子直线加速器作为照射源,建立的动物模型更具有基础研究价值和实际临床意义。
3.2. 下颌骨ORN模型动物
动物实验是医学研究的重要手段,1958年Chambers等[3]率先采用狗进行动物实验,观察牙齿与ORN的关系。此后少数的国外学者采用鼠、兔、猴等动物进行过相关的基础研究。国内学者[4]–[5]先后通过制作狗的颌骨ORN动物模型开展研究工作。从动物选择角度分析,鼠、兔等动物体型小,对放射耐受力差,口内操作困难,下颌骨骨量小且颌弓狭窄,不易通过X线及CT检查观察颌骨损害,也不便进行同一个体双侧下颌骨的对照研究;猴、猩猩等灵长类动物不便饲养,价格昂贵,来源困难,限制了应用;狗是常用的实验动物,耐受力强,但研究表明狗不患龋齿等某些人类口腔疾病,与人类差异较大,仍不能作为较理想的下颌骨ORN实验动物。
小型猪在生理和免疫等方面与人类相近,在医学研究领域的应用日益广泛。同时,小型猪的颌面部解剖、牙齿的萌出和替换也与人类有很大的相似性,并患人类的某些口腔疾病,因此是研究下颌骨ORN较为理想的实验动物。本研究选用的小型猪是由北京农业科学院实验动物研究所进行多代选种,封闭饲养繁殖,经遗传学、微生物学及多项生理生化指标的检测证明其具有独立遗传特性,从而保证了实验结果的科学性和可靠性。
3.3. 下颌骨ORN动物模型的可信性
下颌骨ORN是头颈部恶性肿瘤放射治疗后所发生的严重并发症,下列因素被认为与其发生紧密相关:1)放射剂量超过65 Gy;2)放射周期短;3)下颌骨位于照射区域内;4)拔牙、外科手术或其他类型的外伤刺激存在[7]–[9]。本研究分别采用25 Gy和28 Gy单一剂量照射,根据线性—二次模式总效应方程换算,其剂量分别相当于多次分割照射的65 Gy和80 Gy,均≥65 Gy的临界性指标。单次照射减少了实验动物麻醉意外和全麻次数对实验结果的影响,而且与多次分割照射相比,单次照射使正常组织的耐受力降低,缩短发生并发症的潜伏期,便于在有限的时间内观察到下颌骨ORN发生、发展的全过程。本研究的放射区域位于下颌骨体后部,下颌骨的血管解剖特点使下颌骨的血运供应要较上颌骨和其他颌骨差,而下颌骨体后部的骨质致密且内有未萌出的恒牙,同其他颌骨相比该区域更易遭受射线的损伤。照射结束后2个月,随机选取2组动物各9只拔除双侧下颌第一磨牙,左下颌第一磨牙拔牙创1个月余愈合,而右下颌第一磨牙拔牙创不愈,黏膜坏死溃烂,造成持续的刺激。
下颌骨ORN的诊断主要依靠临床症状和局部体征,X线及CT检查仍为临床上广泛应用的重要诊断指标。本研究中,右下颌第一磨牙拔除后1个月,25 Gy+拔牙组动物口内拔牙创周围黏膜溃烂,放射区域内皮肤形成口内外瘘管,随后创口不愈,长期流脓,下颌骨逐渐暴露;X线片显示典型下颌骨ORN表现,早期放射区域内骨质密度降低,骨质破坏区形态不规则,逐渐颌骨骨质呈弥散性片状破坏,可见大小不一死骨;25 Gy+拔牙组动物拔除右下颌第一磨牙后2个月行CT和冠状CT薄层扫描骨窗检查显示出不规则骨质破坏区,骨密质不连续;病理切片检查从组织病理学角度也验证了下颌骨ORN的发生,主要表现为骨的变性与坏死。
2组动物左下颌第一磨牙创口均于拔除后1个月左右愈合,骨质密度也于3个月左右接近正常,排除了实验中发生化脓性颌骨骨髓炎的可能性;临床上,下颌骨ORN需要同放疗期间的肿瘤复发与肿瘤坏死相鉴别,本研究均采用的是正常实验用小型猪,故不涉及此问题。
本研究中,25 Gy和28 Gy组拔牙动物都先后出现下颌骨ORN局部体征,并通过上述手段加以验证了下颌骨ORN的发生,只是随剂量的加大,28 Gy+拔牙组动物症状出现早而重。因此,本研究认为25 Gy+拔牙能建立有效、可信的小型猪下颌骨ORN动物模型,为进一步研究其病因及治疗奠定了基础。
Funding Statement
[基金项目] 国家自然科学基金资助项目(81170935)
References
- 1.Shaha AR, Cordeiro PG, Hidalgo DA, et al. Resection and immediate microvascular reconstruction in the management of osteoradionecrosis of the mandible[J] Head Neck. 1997;19(5):406–411. doi: 10.1002/(sici)1097-0347(199708)19:5<406::aid-hed7>3.0.co;2-3. [DOI] [PubMed] [Google Scholar]
- 2.Lyons A, Osher J, Warner E, et al. Osteoradionecrosis—a review of current concepts in defining the extent of the disease and a new classification proposal[J] Br J Oral Maxillofac Surg. 2014;52(5):392–395. doi: 10.1016/j.bjoms.2014.02.017. [DOI] [PubMed] [Google Scholar]
- 3.Chambers F, Ng E, Ogden H, et al. Mandibular osteomyelitis in dogs following irradiation[J] Oral Surg Oral Med Oral Pathol. 1958;11(8):843–859. doi: 10.1016/0030-4220(58)90199-3. [DOI] [PubMed] [Google Scholar]
- 4.孙 勇刚, 王 光和, 邹 兆菊, et al. 下颌骨放射性骨坏死的动物实验模型[J] 口腔医学纵横. 1991;7(2):82–85. [Google Scholar]
- 5.解 雪涛, 邱 蔚六, 袁 文化, et al. 放射性骨坏死微血管铸型的动物实验[J] 中华口腔医学杂志. 1999;34(1):9–12. [PubMed] [Google Scholar]
- 6.Tubiana M, Eschwège F. Conformal radiotherapy and intensity-modulated radiotherapy—clinical data[J] Acta Oncol. 2000;39(5):555–567. doi: 10.1080/028418600750013249. [DOI] [PubMed] [Google Scholar]
- 7.Jacobson AS, Zevallos J, Smith M, et al. Quality of life after management of advanced osteoradionecrosis of the mandible[J] Int J Oral Maxillofac Surg. 2013;42(9):1121–1128. doi: 10.1016/j.ijom.2013.03.022. [DOI] [PubMed] [Google Scholar]
- 8.Schwartz HC, Kagan AR. Osteoradionecrosis of the mandible: scientific basis for clinical staging[J] Am J Clin Oncol. 2002;25(2):168–171. doi: 10.1097/00000421-200204000-00013. [DOI] [PubMed] [Google Scholar]
- 9.宗 春琳, 郭 宇轩, 窦 庚, et al. 兔下颌骨放射性骨坏死模型的建立及评估[J] 中国口腔颌面外科杂志. 2014;12(6):481–486. [Google Scholar]