Abstract
目的
本研究通过小干扰RNA(siRNA)沉默人牙周膜干细胞(hPDLSCs)YAP基因,观察YAP基因沉默后对细胞增殖凋亡的影响。
方法
将化学合成siRNA序列以脂质体Lipofectamine™ 2000介导瞬时转染hPDLSCs,采用实时荧光定量逆转录聚合酶链反应(RT-PCR)、Western blot检测转染后YAP表达水平,细胞增殖活性检测试剂盒(CCK-8)检测siRNA在体外对hPDLSCs增殖能力的影响,流式细胞仪检测细胞周期及凋亡率的变化。采用SPSS 19.0软件对数据进行处理,设P<0.05为差异有统计学意义。
结果
在转染48 h后hPDLSCs的YAP mRNA和蛋白水平明显降低(P<0.001),YAP蛋白表达水平在细胞被转染48、72 h后无显著差异,表明siRNA可以持续有效地抑制YAP的表达;CCK-8增殖活性实验结果显示细胞增殖活性受到抑制;沉默YAP基因后细胞早期及晚期凋亡率均增加。细胞周期检测结果显示细胞周期发生改变,G1及S期细胞比例增多(P<0.01),G2期细胞比例明显减少(P<0.05)。
结论
siRNA沉默YAP基因后hPDLSCs增殖活性降低,细胞凋亡率明显增加,细胞的周期分布发生改变;YAP基因可以调控hPDLSCs的增殖与凋亡。
Keywords: 小干扰RNA, YAP基因, 人牙周膜干细胞, 增殖, 凋亡
Abstract
Objective
To investigate the effects of small interfering RNA (siRNA) targeting YAP on the proliferation and apoptosis of human periodontal ligament stem cells (hPDLSCs).
Methods
Synthesized sequences of siRNA were transfected into hPDLSCs by Lipofectamine™ 2000. The expression of YAP was identified by using real-time quantitative reverse transcription-polymerase chain reaction (RT-PCR) and Western blot analysis. Proliferation activity was detected by using cell counting kit-8 (CCK-8). Changes in the cell cycle and apoptosis rate were detected by using flow cytometry. Results were analyzed by using SPSS 19.0, and P<0.05 was considered statistically significant.
Results
Expression of YAP mRNA and protein were significantly downregulated after 48 h of transfection (P<0.001). No obvious difference was found in the expression levels of YAP protein between 48 and 72 h, thus indicating that siRNA could inhibit the expression of YAP persistently and effectively. Proliferation activity was inhibited, and apoptosis rate was increased. Cell cycle was changed as the proportion of G1 and S phases increased (P<0.01) and G2 phase decreased (P<0.05).
Conclusion
Knocking down YAP gene by siRNA could inhibit proliferation activity, induce apoptosis, and change the cell cycle of hPDLSCs. Thus, YAP could regulate the proliferation and apoptosis of hPDLSCs.
Keywords: small interfering RNA, YAP gene, human periodontal ligament stem cells, proli-feration, apoptosis
牙周膜是一个自我更新的系统,存在一类未分化的、具有自我更新和多向分化潜能的牙周膜干细胞(periodontal ligament stem cells,PDLSCs)[1],它是牙周组织再生和重建的“基石”。近来的研究[2]相继证实PDLSCs是一类维持牙周组织动态平衡和缺损修复的关键细胞,然而,关于PDLSCs的诸多研究仍处于基础阶段,如何高效获得大量细胞并有效控制其定向分化仍有待于解决;PDLSCs的增殖分化受多种因素的影响,包括组织来源、供者年龄、炎性状态等[3]。YAP蛋白是Hippo信号通路中一个起中心作用的开关蛋白,YAP作为一种基因转录共激活因子在维持干细胞自我更新及分化方面起着重要作用[4]。目前PDLSCs增殖、分化的机制尚不明确,国内外也尚未见YAP对PDLSCs增殖分化具有重要调控作用的相关报导与研究。本实验拟研究小干扰RNA(small interfering RNA,siRNA)沉默YAP基因对人牙周膜干细胞(human periodontal ligament stem cells,hPDLSCs)增殖以及凋亡的影响,为进一步研究YAP对hPDLSCs的调控奠定基础。
1. 材料和方法
1.1. 主要材料
hPDLSCs(课题组冻存),胎牛血清(fetal bovine serum,FBS)和α-MEM液体培养基(HyClone 公司,美国),Opti-MEM(Gibco公司,美国),RNAiso Plus RNA提取试剂及反转录试剂盒、SYBR Premix Ex Taq(TAKARA公司,日本),RIPA裂解液(北京Solarbio公司),YAP多克隆抗体(Cell Signaling Technology公司,美国),HRP标记山羊抗兔IgG(Jackson公司,美国),BCA蛋白定量试剂盒及细胞周期与凋亡检测试剂盒(上海碧云天生物研究所),细胞增殖活性检测试剂盒(cell counting kit-8,CCK-8)(日本同仁公司),引物合成(上海博尚生物有限公司)。
1.2. 实验分组
实验分组如下。siRNA-1、siRNA-2、siRNA-3组:使用YAP-siRNA进行干预;NC组:使用非特异性siRNA进行干预;空白对照组:仅使用脂质体对细胞进行干预。YAP-siRNA碱基序列如下。siRNA-1:5′-GCAUCUUCGACAGUCUUCUTT-3′;siRNA-2:5′-GGUGAUACUAUCAACCAAATT-3′;siRNA-3:5′-CUGCCACCAAGCUAGAUAATT-3′。非特异性序列为:5′-UUAUCUAGCUUGGUGGCAGTT-3′。
1.3. hPDLSCs的培养及转染
hPDLSCs培养方法见文献[5]–[6],用含有10%FBS的α-MEM培养液在37 °C、5%CO2培养箱中常规培养,隔天换液,取对数生长期的hPDLSCs细胞以每孔1.5×105个接种于6孔培养板,待细胞约60%融合时,采用Lipofectamine™2000脂质体转染siRNA,siRNA终浓度为50 nmol·L−1,按照实验分组加入不同脂质体和siRNA混合液,每组设3个复孔。转染过程中使用Opti-MEM无血清培养基,6 h后更换成常规培养液继续培养。
1.4. 逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测YAP mRNA 的表达
转染后48 h收集细胞,RNAiso Plus试剂提取细胞总RNA,RNA浓度和纯度经过检测后逆转录为cDNA,使用特异性引物序列对YAP基因进行聚合酶链反应(polymerase chain reaction,PCR) 扩增。RT-PCR反应条件设为:95 °C预变性5 min,95 °C变性30 s,56 °C退火30 s,72 °C延伸30 s,共45个循环后,72 °C终末延伸5 min。采用Roche LightCycler® 480Ⅱ实时荧光定量PCR系统,对各组YAP mRNA表达量进行相对定量分析。实验重复3次。
目的基因YAP上游引物序列为:5′-AATGACGACCAATAGCTCAGATCC-3′,下游引物序列为:5′-CACTGTAGCTGCTCATGCTYAGTCC-3′;内参甘油醛三磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上游引物序列为:5′-AGAAGGCTGGGGCTCA7ITITIG-3′,下游引物序列为:5′-AGGGGCCATCCACAGTCTTC-3′。
1.5. Western blot检测YAP蛋白的表达
分别收集转染48、72 h后的各组细胞,RIPA裂解液提取总蛋白,二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度。蛋白每孔上样量为25 µg,使用10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE)将蛋白分离,电泳结束将其转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜,5%脱脂奶粉室温封闭2 h。加入兔抗人YAP一抗(1︰1 000稀释)4 °C孵育过夜,TBST洗膜,加山羊抗兔IgG(1︰5 000稀释)室温孵育1 h。最后经TBST充分漂洗后,增强化学发光显影,洗片。
1.6. CCK-8试剂盒检测hPDLSCs增殖能力
将细胞以每孔5 000个接种于96孔培养板中,待细胞约60%融合时,采用Lipofectamine™2000脂质体转染siRNA,siRNA终浓度为50 nmol·L−1。实验每组均设5个复孔。按照CCK-8试剂盒说明书操作,转染后1、2、3、4、5 d分别测定490 nm波长下各孔吸光度值,比较组间有无差异。实验重复3次。
1.7. 流式细胞仪检测hPDLSCs细胞周期及凋亡
细胞转染72 h后,用0.25%胰酶消化,PBS清洗2遍,离心去上清。按照细胞凋亡检测说明书操作步骤进行,上流式细胞仪检测细胞凋亡率。同样,细胞转染72 h后进行细胞周期检测,将细胞经70%乙醇固定过夜后上流式细胞仪检测分析。
1.8. 统计学处理
采用SPSS 19.0软件进行统计学分析,计量资料用均数±标准差表示,多样本均数比较用单因素方差分析,设P<0.05为差异有统计学意义。
2. 结果
2.1. YAP-siRNA干扰效率的测定
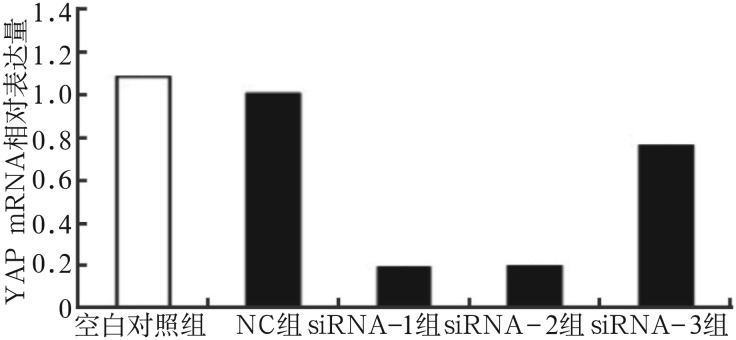
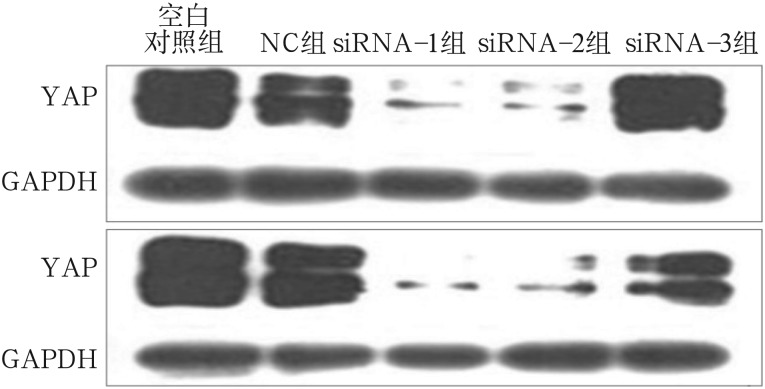
对RT-PCR结果进行相对定量分析,空白对照组与NC组组间YAP mRNA表达量差异不明显(P>0.05);siRNA-1及siRNA-2组YAP mRNA表达量显著降低(P<0.001),分别降至NC组的19.49%±5.43%、20.49%±7.34%;siRNA-3组表达量也有明显降低(P<0.01)(图1)。Western blot检测结果显示,YAP蛋白表达水平与mRNA表达量结果基本一致,并且选取的48、72 h两个时间点之间也基本无差异,siRNA-1及siRNA-2组YAP蛋白表达量显著降低(图2)。以上结果表明,本实验所设计的siRNA干扰靶序列可以高效而特异地沉默YAP基因。
图 1. RT-PCR检测YAP mRNA的表达.
Fig 1 Expression of YAP mRNA detected by RT-PCR
图 2. Western blot检测YAP蛋白的表达.
Fig 2 Expression of YAP protein detected by Western blot
上:转染后48 h;下:转染后72 h。
2.2. YAP-siRNA对hPDLSCs增殖的影响
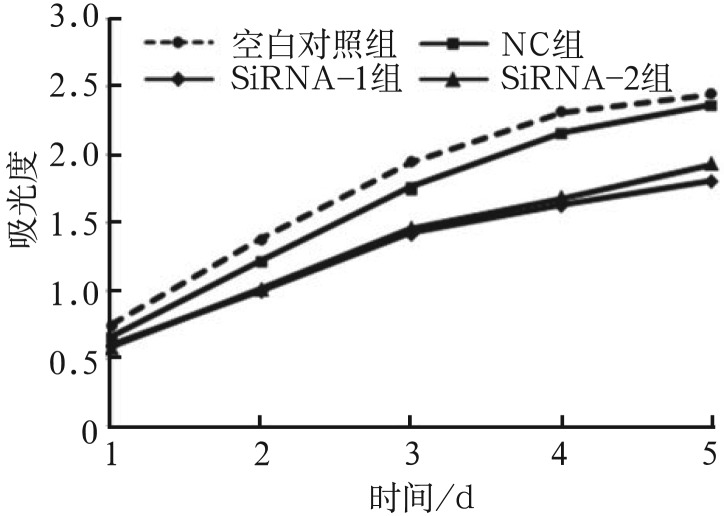
CCK-8结果显示,与空白对照组及NC组相比,转染后2 d siRNA-1组增殖活性开始有明显降低(P<0.05),转染后3、4 d siRNA-1及siRNA-2组细胞增殖活性显著降低(P<0.001),第5天细胞增殖活性有所回升(P<0.01),这可能与siRNA作用时间有限有关。由此可见,YAP基因被沉默后细胞生长速度减慢,并且这种细胞生长抑制在一定时间内可以持续稳定存在(图3)。
图 3. 各组转染后的吸光值.
Fig 3 Absorbance value of each group
2.3. YAP-siRNA对hPDLSCs凋亡的影响
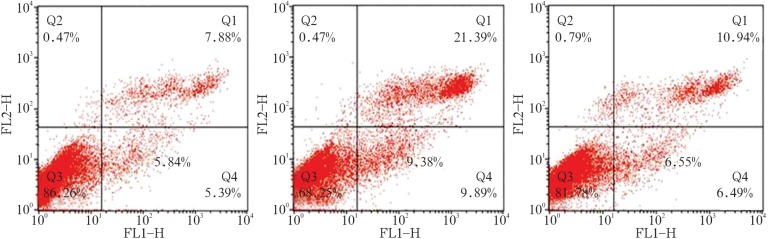
各组细胞凋亡率见图4。
图 4. 各组细胞凋亡率.
Fig 4 Apoptosis rate of each group
左:NC组;中:siRNA-1组;右:siRNA-2组。Q1:晚期凋亡细胞;Q2:坏死细胞;Q3:正常细胞;Q4:早期凋亡细胞。
以上结果表明siRNA-1、siRNA-2组YAP干扰效率较高并且持续稳定。选取这2组为实验组,NC组为对照组进行后续实验。NC组、siRNA-1组、siRNA-2组细胞早期凋亡率分别为5.84%±0.45%、9.38%±0.62%、6.55%±0.18%。siRNA-1组早期凋亡率明显增多(P<0.001);各组晚期凋亡率分别为8.24%±0.45%、21.95%±1.22%、12.22%±0.18%,siRNA-1组及siRNA-2组晚期凋亡率显著增多(P<0.001,P<0.01)(图4)。
2.4. YAP-siRNA对hPDLSCs细胞周期的影响
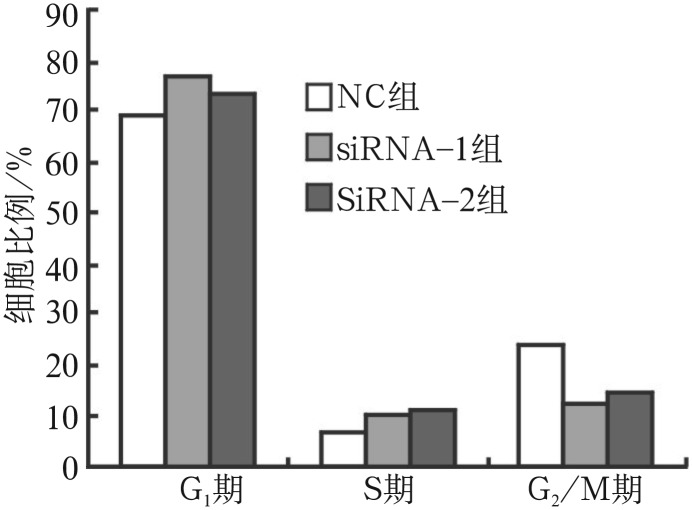
hPDLSCs大部分处于细胞周期G0/G1期,为慢周期性。与NC组相比,siRNA-1、siRNA-2组细胞周期分布发生改变,G1及S期细胞比例明显增多(P<0.01),而G2期细胞则明显减少(P<0.01,P<0.05)(图5)。
图 5. 细胞周期分布图.
Fig 5 Cell cycle distribution of each group
3. 讨论
hPDLSCs是近来发现的来源于牙周膜组织的成体干细胞,它在维持正常的牙周组织更新和牙周组织修复中起着重要作用[7]–[8]。牙周组织具有自身的更新和修复能力,其修复活动是通过牙周膜中的不同细胞亚群的定向迁移和分化实现的[9]。在疾病或在受到外界刺激时,通过牙周膜中干细胞的不断增殖和分化使牙周组织修复再生,而目前这种影响hPDLSCs增殖的机制尚未明确。
YAP蛋白是Hippo信号通路中一个起中心作用的开关蛋白,在细胞正常生长发育过程中,YAP结合转录因子TEAD等促进下游目的基因的表达,从而促进细胞生长、抑制细胞凋亡。过表达YAP引起未分化祖细胞大量增殖[10],多功能性敲除或RNA干涉YAP的表达都显著地降低了干细胞的多向分化潜能,并且与维持干细胞特性相关的基因Oct4和Sox2的表达也显著降低[11]。近年来的研究[12]–[13]表明YAP基因参与干细胞的更新调控。在神经祖细胞的研究中表明,过表达YAP不仅能抑制祖细胞的分化同时也会促进神经祖细胞的大量增殖;YAP同时调节组织特异性的前体细胞,在正常小鼠的小肠中,YAP表达在小肠上皮前体细胞中,YAP过表达可以显著调控前体细胞数量的扩增,同时会抑制前体细胞向成熟的终末细胞分化[10]。由此表明,YAP作为一种基因转录共激活因子在维持干细胞自我更新及分化方面起着重要作用。并且YAP的促增殖功能与TEAD密切相关,YAP/TEAD的激活促进相关基因如周期蛋白D1(cyclin D1)等的表达而抑制干细胞退出细胞周期、抑制凋亡等,从而有利于干细胞的增殖。
本研究使用siRNA沉默YAP后,CCK-8结果显示细胞增殖活性降低,细胞生长速度减慢,并且这种细胞生长抑制持续存在;细胞周期检测显示YAP-siRNA组细胞周期发生改变;YAP基因干扰后细胞的凋亡率明显增多,这表明YAP可以有效地调控hPDLSCs的增殖及凋亡。细胞周期检测中G1和S期细胞比例增多而G2期显著降低,YAP参与细胞周期的调节。最新的研究[14]发现YAP在内皮细胞G1期进入S期过程中发挥重要作用,YAP基因被敲除后G1期细胞增多而S期细胞明显减少,而对Hela细胞YAP基因进行敲出后细胞周期分布并无明显变化。因此推测YAP在不同种细胞中其对细胞周期的调控机制有所不同。本实验初步成果表明YAP能促hPDLSCs的增殖、抑制hPDLSCs凋亡,这可能为基于干细胞的牙周组织再生工程提供新思路。但YAP的调控机制现仍不清楚,YAP表达上调或降低之后hPDLSCs其他的生物学特性变化仍需进一步研究。
Funding Statement
[基金项目] 国家自然科学基金资助项目(81300885);山东省自然科学基金资助项目(ZR2013HQ052,ZR2013HM086);山东省医药卫生发展计划基金资助项目(2013WS0212);山东大学青年学者未来计划基金资助项目(2015WLJH53);山东大学基本科研业务费专项基金资助项目(2015QY003)
References
- 1.Seo BM, Miura M, Gronthos S, et al. Investigation of multipotent postnatal stem cells from human periodontal ligament[J] Lancet. 2004;364(9429):149–155. doi: 10.1016/S0140-6736(04)16627-0. [DOI] [PubMed] [Google Scholar]
- 2.Gronthos S, Mrozik K, Shi S, et al. Ovine periodontal ligament stem cells: isolation, characterization, and differentiation potential[J] Calcif Tissue Int. 2006;79(5):310–317. doi: 10.1007/s00223-006-0040-4. [DOI] [PubMed] [Google Scholar]
- 3.Zhu W, Liang M. Periodontal ligament stem cells: current status, concerns, and future prospects[J] Stem Cells Int. 2015;2015:972313. doi: 10.1155/2015/972313. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Zhu C, Li L, Zhao B. The regulation and function of YAP transcription co-activator[J] Acta Biochim Biophys Sin: Shanghai. 2015;47(1):16–28. doi: 10.1093/abbs/gmu110. [DOI] [PubMed] [Google Scholar]
- 5.Wen Y, Lan J, Huang H, et al. Application of eGFP to label human periodontal ligament stem cells in periodontal tissue engineering[J] Arch Oral Biol. 2012;57(9):1241–1250. doi: 10.1016/j.archoralbio.2012.02.017. [DOI] [PubMed] [Google Scholar]
- 6.姜 宝岐, 文 勇, 黄 海云, et al. 增强型绿色荧光蛋白慢病毒载体标记人牙周膜干细胞的实验研究[J] 华西口腔医学杂志. 2012;30(1):82–85. [Google Scholar]
- 7.Gao W, Clancy JA, Han F, et al. Molecular dissection of a dormancy QTL region near the chromosome 7 (5H) L telomere in barley[J] Theor Appl Genet. 2003;107(3):552–559. doi: 10.1007/s00122-003-1281-5. [DOI] [PubMed] [Google Scholar]
- 8.Zhao M, Berry JE, Somerman MJ. Bone morphogenetic protein-2 inhibits differentiation and mineralization of cementoblasts in vitro[J] J Dent Res. 2003;82(1):23–27. doi: 10.1177/154405910308200106. [DOI] [PubMed] [Google Scholar]
- 9.Shimono M, Ishikawa T, Ishikawa H, et al. Regulatory mechanisms of periodontal regeneration[J] Microsc Res Tech. 2003;60(5):491–502. doi: 10.1002/jemt.10290. [DOI] [PubMed] [Google Scholar]
- 10.Camargo FD, Gokhale S, Johnnidis JB, et al. YAP1 increases organ size and expands undifferentiated progenitor cells[J] Curr Biol. 2007;17(23):2054–2060. doi: 10.1016/j.cub.2007.10.039. [DOI] [PubMed] [Google Scholar]
- 11.Lian I, Kim J, Okazawa H, et al. The role of YAP transcription coactivator in regulating stem cell self-renewal and differentiation[J] Genes Dev. 2010;24(11):1106–1118. doi: 10.1101/gad.1903310. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Alarcón C, Zaromytidou AI, Xi Q, et al. Nuclear CDKs drive Smad transcriptional activation and turnover in BMP and TGF-beta pathways[J] Cell. 2009;139(4):757–769. doi: 10.1016/j.cell.2009.09.035. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Varelas X, Sakuma R, Samavarchi-Tehrani P, et al. TAZ controls Smad nucleocytoplasmic shuttling and regulates human embryonic stem-cell self-renewal[J] Nat Cell Biol. 2008;10(7):837–848. doi: 10.1038/ncb1748. [DOI] [PubMed] [Google Scholar]
- 14.Shen Z, Stanger BZ. YAP regulates S-phase entry in endothelial cells[J] PLoS ONE. 2015;10(1):e0117522. doi: 10.1371/journal.pone.0117522. [DOI] [PMC free article] [PubMed] [Google Scholar]