Abstract
目的
探讨Wnt经典通路相关因子Dickkopf蛋白1(DKK-1)、β-链蛋白(β-catenin)在糖基化终末产物(AGEs)介导的人牙周膜干细胞(hPDLSCs)骨分化过程中的变化。
方法
通过体外组织块法和有限稀释法克隆化培养获取hPDLSCs,实验分两组:正常hPDLSCs组(N-hPDLSCs组)和AGEs刺激的正常hPDLSCs组(A-hPDLSCs组)。对2组细胞成骨矿化诱导后行碱性磷酸酶(ALP)和茜素红染色;实时聚合酶链反应(real time PCR)检测成骨基因,以及Wnt经典通路中相关因子DKK-1、β-catenin;Western blot检测相关成骨蛋白、细胞核蛋白β-catenin。
结果
成骨诱导后,A-hPDLSCs组ALP染色明显浅于N-hPDLSCs组;茜素红染色A-hPDLSCs组钙化结节少于N-hPDLSCs组;real time PCR与Western blot的结果显示A-hPDLSCs组BSP、ALP、Runx-2的表达都较低,差异有统计学意义(P<0.05)。Wnt经典信号通路中相关因子:A-hPDLSCs组β-catenin表达高于N-hPDLSCs组,A-hPDLSCs组DKK-1表达明显低于N-hPDLSCs组,并且Weston blot显示A-hPDLSCs组核蛋白β-catenin的表达高于N-hPDLSCs组。
结论
AGEs可以使hPDLSCs骨向分化过程中Wnt经典通路的抑制因子DKK-1下调,细胞核中的β-catenin表达升高,激活了Wnt经典通路,并且抑制了骨分化。
Keywords: 糖基化终末产物, 人牙周膜干细胞, 骨向分化, Wnt经典通路
Abstract
Objective
The effect of advanced glycation end products (AGEs) on the osteogenic differentiation of human periodontal ligament stem cells(hPDLSCs) was discussed. Changes in the Wnt signaling pathway during glycation were also determined.
Methods
In vitro tissue explanting method was primarily applied. Limiting diluted clone was cultured to obtain hPDLSCs in vitro. The subjects were divided into two groups: the healthy group (N-hPDLSCs) and the AGEs-stimulating group (A-hPDLSCs). Osteoblast mineralization was induced in the experimental groups. The following processes were performed: alizarin red staining; alkaline phosphatase (ALP) staining; real time polymerase chain reaction (real time PCR) for detecting osteogenic genes and Wnt classical pathway-related factors, DKK-1 and β-catenin; Western blot analysis. Bone protein and β-catenin were correlated in the nuclear expression.
Results
The cells were osteogenically induced. ALP staining showed that the N-hPDLSCs displayed the deepest color. Alizarin red staining indicated that the A-hPDLSCs group had less calcified nodules than the N-hPDLSCs group. The real time PCR results suggested that the expression of relative osteogenic genes in A-hPDLSCs was quite low. Statistically significant differences in differentiation were found between groups (P<0.05). The Western blot result was similar to that of real time PCR. Classical Wnt signaling pathway-related factor β-catenin was higher in A-hPDLSCs than in N-hPDLSCs. By contrast, DKK-1, which is an inhibitor in the Wnt pathway, had a significantly lower expression rate in A-hPDLSCs than in N-hPDLSCs. The Western blot result also showed that β-catenin expression in the nucleoprotein in A-hPDLSCs was notably higher than in N-hPDLSCs.
Conclusion
AGEs can inhibit hPDLSCs osteogenic differentiation. AGEs induce changes in the normal periodontal ligament stem cells classical Wnt pathway. Canonical Wnt pathway is reactivated because of AGEs stimulation.
Keywords: advanced glycation end products, human periodontal ligament stem cells, osteogenic differentiation, classical Wnt pathway
糖基化终末产物(advanced glycation end products,AGEs)与糖尿病多种并发症的发生密切相关[1]。近年来,有研究[2]表明糖尿病患者晚期AGEs的大量积聚可促进糖尿病的发展,并且可诱导牙周病的发生和发展。人牙周膜干细胞(human periodontal ligament stem cells,hPDLSCs)具有自我更新和多向分化潜能,在维持牙周结构稳态方面起着重要的作用,其功能数量的变化会导致牙周膜的破坏[3]。研究[4]表明AGEs能使hPDLSCs增殖过程中的Wnt经典通路受到抑制,最终导致该细胞增殖能力有所减弱,AGEs又可以抑制该细胞的成骨分化能力,并在一定范围内呈浓度依赖性[5]。但AGEs是否影响了hPDLSCs骨向分化过程中的Wnt经典信号通路,目前尚无定论,故本实验旨在研究AGEs介导下的hPDLSCs骨向分化过程中的Wnt经典通路,并与正常细胞进行比较,从而探讨糖尿病牙周炎的发病机制。
1. 材料和方法
1.1. 主要试剂和仪器
α-MEM培养基、胰蛋白酶(Gibco公司,美国),胶原酶、胎牛血清(杭州四季青生物工程材料有限公司),AGEs-BSA(Bio Vision公司,美国),细胞总RNA提取试剂盒、一步法逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒(Takara公司,日本),茜素红(上海化学试剂采购供应站),β-链蛋白(β-catenin)兔抗人单克隆抗体(Abcam公司,美国),体式显微镜、倒置相差显微镜以及照相系统(Olympus公司,日本),流式细胞仪(Beckmen Coulter公司,美国),实时聚合酶链反应(real time polymerase chain reaction,real time PCR)仪器(Applied biosystems公司,美国)。
1.2. 取材和细胞培养
收集12~18岁因正畸需要而拔除的牙周健康、无龋坏的年轻前磨牙,PBS冲洗后刮取根中1/3牙周膜组织,移入无菌培养皿内,加入少许α-MEN培养液,将牙周膜组织锐性分离,离心后弃上清,加入胶原酶至37 °C、CO2孵箱中消化15 min,加入正常培养液终止其消化作用,离心后取上清,将分离的组织块均匀平铺于6孔板中,以无菌盖玻片覆盖组织块,加入含10%胎牛血清的α-MEM培养液,置37 °C、5%CO2孵箱中培养,待组织块周围有细胞爬出时去除盖玻片,每3 d换液,待细胞生长达80%时进行传代。
1.3. 有限稀释法克隆化培养纯化hPDLSCs
参照以往文献报道采用有限稀释法对hPDLSCs进行克隆分离。首先获取第一代牙周膜细胞,将第一代牙周膜细胞悬液有限稀释至密度为每毫升10个,用加样器向96孔培养板每孔内加0.15 mL,使每孔细胞悬液中约1个细胞,经过37 °C、5%CO2培养箱中培养,细胞贴壁后在倒置显微镜下检查,挑选含单细胞孔,做标记并补加0.1 mL培养基,待孔中细胞增至占孔底面积l/3~l/2时,常规培养传代。
1.4. hPDLSCs初步鉴定
取克隆纯化的hPDLSCs,弃培养液,PBS洗2次,胰蛋白酶消化3 min,α-MEM培养基终止,800 r·min−1离心5 min,弃上清;再以含3%胎牛血清的PBS重悬细胞,使细胞密度达到每升3.0×109个,分装到Eppendof管中,每管200 µL的细胞悬液,室温下每个管加入2 µL的STRO-1、CD14、CD105、CD29小鼠抗人单克隆抗体,避光4 °C冰箱孵育1 h;再用含3%胎牛血清的PBS清洗3次,1 000 r·min−1离心5 min,最后再以含3%胎牛血清的PBS重悬。使用同型对照单克隆抗体确定背景标记,用流式细胞仪分析荧光细胞,专用的配套软件计算细胞表面抗原阳性表达率,单位用百分比表示。
1.5. 分组成骨诱导后碱性磷酸酶(alkaline phosphatase,ALP)和茜素红染色
实验分为正常hPDLSCs组(N-hPDLSCs组)和AGEs刺激的正常hPDLSCs组(A-hPDLSCs组)。N-hPDLSCs组用含10%血清的正常α-MEM培养基培养;A-hPDLSCs组加入含10 µg·mL−1AGEs,10%血清的α-MEM培养基培养。分别取第3代克隆形成细胞以每毫升5×104个的密度接种于6孔板中,待细胞增殖到70%时,按以上分组加成骨诱导液(10 mmol·L−1 β-甘油磷酸钠、10−8 mol·L−1地塞米松、50 µg·mL−1维生素C)分别诱导7 d和21 d,每3 d换液一次;对照组细胞不加诱导液,常规培养,7 d后行ALP染色,21 d后行茜素红染色。
1.6. real time PCR检测
分别取第3代克隆形成细胞以每毫升5×104个的密度接种于小瓶中,待细胞增殖到70%时,分4组:N-hPDLSCs组(用含10%血清的正常α-MEM培养基培养);Os N-hPDLSCs组(用含有成骨诱导液的10%血清的α-MEM培养基培养);A-hPDLSCs组(用含10 µg·mL−1AGEs,10%血清的α-MEM培养基培养);Os A-hPDLSCs组(用含10 µg·mL−1AGEs,且含成骨诱导液的10%血清的α-MEM培养基培养)。每3 d换液一次,7 d后分别提取RNA,RT-PCR检测成骨相关基因骨涎蛋白(bone sialoprotein,BSP)、ALP、runt相关转录因子2(runt related transcription factor 2,Runx-2)及Dickkopf-1蛋白(DKK-1)、β-catenin表达。用细胞总RNA提取试剂盒一步法提取培养细胞总RNA,β-actin为内参照。参照GenBank数据库,采用Primer primer 5.0计算机软件设计引物,由Takara公司(日本)合成,反应条件参考产品说明书,引物序列如下。β-actin上游引物序列:5′-TGGCACCCAGCACAATGAA-3′,下游引物序列:5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′;Runx-2上游引物序列:5′-CACTGGCGCTGCAACAAGA-3′,下游引物序列:5′-CATTCCGGAGCTCAGCAGAATAA-3′;ALP上游引物序列:5′-GGACCATTCCCACGTCTTCAC-3′,下游引物序列:5′-CCTTGTAGCCAGGCCCATTG-3′;BSP上游引物序列:5′-CTGGCACAGGGTATACAGGGTTAG-3′,下游引物序列:5′-ACTGGTGCCGTTTATGCCTTG-3′;β-catenin上游引物序列:5′-AGGAAGCTTCCAGACACGC-3′,下游引物序列:5′-CGCACTGCCATTTTAGCTCC-3′;DKK-1上游引物序列:5′-CACTGCATTTGGATAGCTGGTT-3′,下游引物序列:5′-GAAGGTCTGTCTTGCCGGATAC-3′。
1.7. Western blot检测
采用Western blot检测各组总蛋白中成骨蛋白BSP、Runx-2的表达及核蛋白中β-catenin的表达,采用细胞核蛋白与细胞浆蛋白抽提试剂盒进行核蛋白提取,蛋白含量测定采用Bradeford蛋白浓度测定试剂盒。十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE)电泳,转膜,封闭,免疫反应,最后进行化学发光反应,对2组间相关蛋白表达进行分析。
1.8. 统计学分析
采用SPSS 17.0软件进行统计分析,两独立样本均数比较采用t检验,以P<0.05为差异具有统计学意义。
2. 结果
2.1. hPDLSCs的分离与培养
本实验采用酶解组织块法培养原代细胞,一般3~10 d组织块周围有细胞爬出(图1),再通过有限稀释法得到正常的hPDLSCs,该细胞形态呈长梭形,胞核聚集在中心,胞体丰满,2周左右可达80%汇合。
图 1. 原代细胞(左)和第一代牙周膜细胞(右)的形态观察 倒置显微镜 × 20.
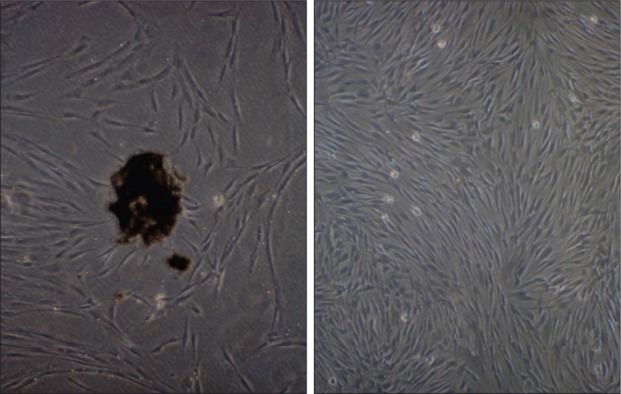
Fig 1 Morphology of primary cells (left) and the first generation of periodontal ligament cells (right) inverted microscope × 20
2.2. 流式细胞仪对干细胞初步鉴定
采用流式细胞仪对表型分子进行鉴定,表面抗原STRO-1、CD14、CD105、CD29阳性率分别为10.4%、0.6%、96.0%、98.4%。
2.3. 分组成骨诱导后ALP和茜素红染色比较
诱导7 d后,进行ALP染色,A-hPDLSCs组明显浅于N-hPDLSCs组(图2)。诱导21 d后,比较2组成骨诱导形成的钙化结节:发现在相同视野下,A-hPDLSCs组形成的钙化结节明显少于N-hPDLSCs组(图3)。
图 2. ALP染色结果.
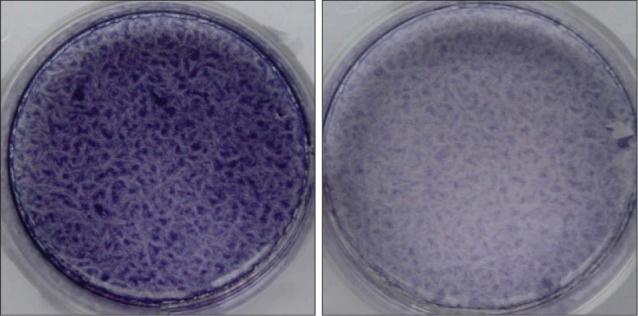
Fig 2 ALP staining
左:N-hPDLSCs组;右:A-hPDLSCs组。
图 3. 成骨诱导21 d后,钙化结节形成 茜素红染色 × 10.
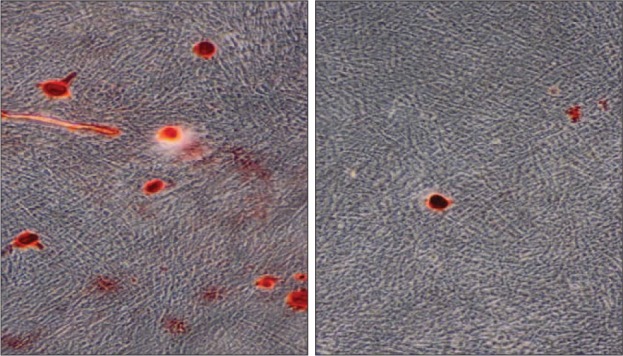
Fig 3 After 21 days, the formation of calcified nodules alizarin red staining × 10
左:N-hPDLSCs组;右:A-hPDLSCs组。
定量分析得到,A-hPDLSCs组和N-hPDLSCs组OD值分别为0.145 75±0.036 29、0.538 50±0.033 04,二者间差异有统计学意义(P<0.05)。
2.4. RT-PCR检测成骨相关基因及Wnt经典通路相关基因表达
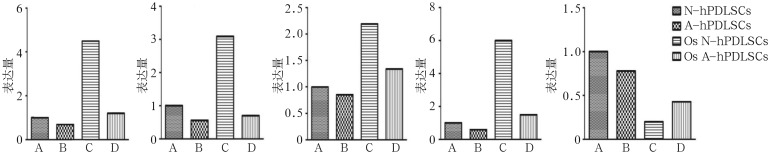
通过RT-PCR检测诱导7 d后的成骨基因,发现A-hPDLSCs组ALP、BSP、Runx-2基因表达均低于N-hPDLSCs组(P<0.05),差异有统计学意义(图4)。诱导7 d后Wnt经典通路相关基因:N-hPDLSCs组DKK-1明显上调,β-catenin表达下调,而A-hPDLSCs组DKK-1表达低于N-hPDLSCs组,β-catenin表达高于N-PDLSCs组(P<0.05),差异具有统计学意义(图4)。
图 4. 成骨诱导前后N-hPDLSCs组和A-hPDLSCs组ALP、BSP、Runx-2、DKK-1、β-catenin基因的比较.
Fig 4 The expression levels of ALP, BSP, Runx-2, β-catenin and DKK-1 between N-hPDLSCs and A-hPDLSCs before and after the osteogenic induction
从左至右依次ALP、BSP、Runx-2、DKK-1、β-catenin基因。A、B、C、D分别为N-hPDLSCs组、A-hPDLSCs组、Os N-hPDLSCs组、Os A-hPDLSCs组。
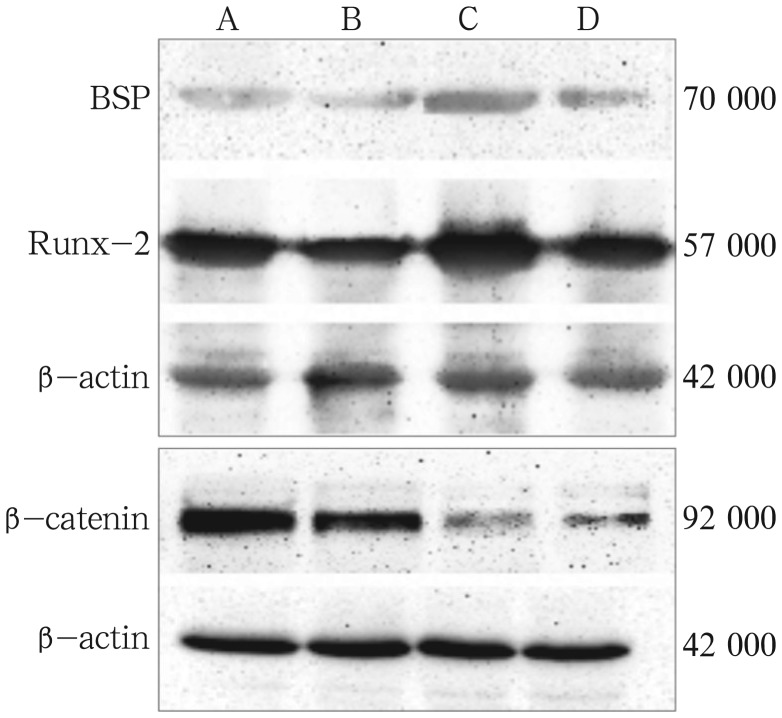
2.5. Western blot比较成骨相关蛋白以及细胞核中β-catenin蛋白表达
成骨诱导前后N-hPDLSCs组和A-hPDLSCs组BSP、Runx-2和β-catenin的表达见图5。
图 5. 成骨诱导前后N-hPDLSCs组和A-hPDLSCs组BSP、Runx-2 和β-catenin的表达.
Fig 5 Expression of BSP, Runx-2, β-catenin between N-hPDLSCs and A-hPDLSCs before and after the osteogenic induction
上:Runx-2、BSP蛋白表达;下:β-catenin的表达。A、B、C、D分别为N-hPDLSCs组、A-hPDLSCs组、Os N-hPDLSCs组、Os A-hPDLSCs组。
图5结果显示,A-hPDLSCs组骨相关蛋白表达都弱于N-hPDLSCs组,N-hPDLSCs组在成骨诱导后细胞核中的β-catenin表达明显地减弱,成骨诱导后A-hPDLSCs组β-catenin的表达明显高于N-hPDLSCs组。
3. 讨论
hPDLSCs是具有自我更新和多向分化潜能,在维持牙周结构稳态方面起着重要的作用,牙周组织再生中最直接、最可靠、最不可缺少的干细胞,具备向其他类型组织细胞分化的潜能,当牙周组织受到损伤后,牙槽骨缺失,hPDLSCs会迁移并且分化为成骨细胞修复牙槽骨的缺损[6]。研究[7]–[9]显示,在体外成骨诱导培养的条件下,hPDLSCs能分化为成骨样细胞,形成钙化结节,表达一些成骨相关蛋白:骨钙素、骨桥素、胶原等。
对于糖尿病患者,其AGEs是不断积累的,在前期的研究结果中表明AGEs能够在一定浓度上抑制hPDLSCs的成骨分化,并且100 µg·mL−1 AGEs刺激该细胞能使该细胞增殖过程中的Wnt经典信号通路受到抑制,为了研究骨分化过程中的信号通路不受到细胞增殖方面的干扰,本实验选择10 µg·mL−1 AGEs浓度刺激该细胞,首先确认10 µg·mL−1 AGEs对该细胞成骨能力的影响,实验结果显示体外成骨诱导1周后的ALP染色,A-hPDLSCs组的染色明显浅于N-hPDLSCs组,并且在诱导3周后,对细胞进行矿化结节染色,镜下观察可见,矿化结节在同一个视野下,N-hPDLSCs组矿化结节形成较多且很明显,而A-hPDLSCs组形成的结节偏少。最后进行定量分析,得到的结果也是A-hPDLSCs组形成的矿化结节少于N-hPDLSCs组细胞;其次,本实验在成骨诱导7 d后检测成骨基因ALP、Runx-2、BSP结果显示,2组细胞在加了成骨诱导液后,成骨基因表达都有所上升,但A-hPDLSCs组成骨基因表达上调不明显,与N-hPDLSCs组相比较明显偏低,差异有统计学意义。这种趋势与成骨能力表象的比较相一致。故在10 µg·mL−1 AGEs刺激下,hPDLSCs成骨的能力下调。
各信号通路之间的相互作用决定着干细胞的命运和组织再生,其中的Wnt经典信号通路研究较成熟,该通路由分泌型的Wnt蛋白与卷轴受体结合而起始,最终导致β-catenin在胞浆中稳定积累并大量进入细胞核内激活淋巴增强因子(lymphoidenchancer factor,LEF)/ T细胞因子(T-cell factor,TCF)转录因子,激活了该通路,启动靶基因转录[10]。故本实验主要检查该通路里细胞核中的β-catenin以确定该信号通路的状态。
Wnt信号通路在不同类型、不同分化阶段中的干细胞作用是不相同的,该信号通路中相关因子的相互作用调控着该条通路的开启和关闭,最终以达到调节干细胞中相关的基因,从而调控细胞的形态及决定其分化的能力。有研究发现Wnt经典信号通路的激活可以促进成骨:LRP5(是Wnt经典通路通路中主要相关因子)的功能丧失性突变,造成Wnt经典信号通路的抑制,最终导致骨质密度降低,而功能获得性突变使得Wnt经典信号通路激活则会导致骨质密度增高症[11];sFRP1基因缺陷的小鼠表现为Wnt信号通路的激活和骨量增多,在其骨骼中,TCF1、Runx-2和骨钙素表达明显增多[12]。相反也有研究[13]表明Wnt经典通路的激活也可以抑制成骨:通过在含有Wnt3a无血清条件培养基中培养或表达Wnt1的慢病毒载体转染,激活了通路,最终人骨髓间充质细胞(human mesenchymal stem cells,hMSCs)的骨向分化受到抑制、细胞增殖能力增强;Derfoul等[14]通过基因转染使鼠胚胎间充质系C3HIOTl/2表达Wnt3a,结果发现Wnt3a能显著抑制其他成骨的标志基因如BSP、骨桥蛋白基因的表达。本实验主要检测该通路中的主要抑制因子DKK-1基因表达和β-catenin(其中包括β-catenin基因表达及单独提取细胞核中的β-catenin蛋白的表达),通过比较该2个因子在正常hPDLSCs成骨诱导前后的变化以及诱导后N-hPDLSCs组与A-hPDLSCs组的区别,来探讨AGEs刺激下,hPDLSCs骨分化过程中的Wnt经典通路是否受到影响。本实验研究结果显示对于正常hPDLSCs而言,成骨诱导后DKK-1基因表达明显上调,β-catenin基因表达下调,并且核蛋白里的β-catenin蛋白表达下调,可以确定Wnt通路处于抑制状态,故可以推断正常牙周膜干细胞在向成骨分化的过程中Wnt经典通路是受到了一定程度的抑制。通过对诱导后的正常组与AGEs刺激组比较,由于AGEs的刺激,抑制因子DKK-1基因表达降低,β-catenin基因表达明显升高,并且细胞核中的β-catenin蛋白表达升高,得到AGEs激活了的Wnt经典通路,这与正常的hPDLSCs骨分化过程中Wnt经典通路的抑制状态相反。
综上所述,AGEs能改变正常hPDLSCs骨分化过程中的Wnt经典通路,使该通路处于激活状态;AGEs抑制了hPDLSCs成骨分化。而AGEs是否通过激活Wnt经典通路影响hPDLSCs的骨分化能力,还需要大量的实验研究。
Funding Statement
[基金项目] 国家自然科学基金资助项目(81360168)
References
- 1.Stitt AW, Jenkins AJ, Cooper ME. Advanced glycation end products and diabetic complications[J] Expert Opin Investig Drugs. 2002;11(9):1205–1223. doi: 10.1517/13543784.11.9.1205. [DOI] [PubMed] [Google Scholar]
- 2.Tan KC, Chow WS, Ai VH, et al. Advanced glycation end products and endothelial dysfunction in type 2 diabetes[J] Diabetes Care. 2002;25(6):1055–1059. doi: 10.2337/diacare.25.6.1055. [DOI] [PubMed] [Google Scholar]
- 3.Seo BM, Miura M, Gronthos S, et al. Investigation of multipotent postnatal stem cells from human periodontal ligament[J] Lancet. 2004;364(9429):149–155. doi: 10.1016/S0140-6736(04)16627-0. [DOI] [PubMed] [Google Scholar]
- 4.伍 燕, 邓 超, 杨 琨, et al. 糖基化终末产物对牙周膜干细胞增殖及其wnt经典通路相关基因表达的影响[J] 牙体牙髓牙周病学杂志. 2012;22(5):255–259. [Google Scholar]
- 5.邓 超, 伍 燕, 杨 琨, et al. 糖基化终末产物对人牙周膜干细胞骨向分化能力影响的研究[J] 牙体牙髓牙周病学杂志. 2012;22(5):249–254. [Google Scholar]
- 6.Ohta S, Yamada S, Matuzaka K, et al. The behavior of stem cells and progenitor cells in the periodontal ligament during wound healing as observed using immunohistochemical methods[J] J Periodont Res. 2008;43(6):595–603. doi: 10.1111/j.1600-0765.2007.01002.x. [DOI] [PubMed] [Google Scholar]
- 7.Seo BM, Miura M, Gronthos S, et al. Investigation of multipotent postnatal stem cells from human periodontal ligament[J] Lancet. 2004;364(9429):149–155. doi: 10.1016/S0140-6736(04)16627-0. [DOI] [PubMed] [Google Scholar]
- 8.Techawattanawisal W, Nakahama K, Komaki M, et al. Isolation of multipotent stem cells from adult rat periodontal ligament by neurosphere-forming culture system[J] Biochem Biophys Res Commun. 2007;357(4):917–923. doi: 10.1016/j.bbrc.2007.04.031. [DOI] [PubMed] [Google Scholar]
- 9.贺 慧霞, 刘 洪臣, 王 东胜, et al. 矿化液促进犬牙周膜细胞异位成骨实验[J] 中华老年口腔医学杂志. 2008;6(3):203–207. [Google Scholar]
- 10.Mulholland DJ, Dedhar S, Coetzee GA, et al. Interaction of nuclear receptors with the Wnt/beta-catenin/Tcf signaling axis: Wnt you like to know[J] Endocr Rev. 2005;26(7):898–915. doi: 10.1210/er.2003-0034. [DOI] [PubMed] [Google Scholar]
- 11.Little RD, Carulli JP, Del Mastro RG, et al. A mutation in the LDL receptor-related protein 5 gene results in the autosomal dominant high-bone-mass trait[J] Am J Hum Genet. 2002;70(1):11–19. doi: 10.1086/338450. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Gaur T, Lengner CJ, Hovhannisyan H, et al. Canonical WNT signaling promotes osteogenesis by directly stimulating Runx2 gene expression[J] J Biol Chem. 2005;280(39):33132–33140. doi: 10.1074/jbc.M500608200. [DOI] [PubMed] [Google Scholar]
- 13.Liu G, Vijayakumar S, Grumolato L, et al. Canonical Wnts function as potent regulators of osteogenesis by human mesenchymal stem cells[J] J Cell Biol. 2009;185(1):67–75. doi: 10.1083/jcb.200810137. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Derfoul A, Carlberg AL, Tuan RS, et al. Differential regulation of osteogenic marker gene expression by Wnt-3a in embryonic mesenchymal multipotential progenitor cells[J] Differentiation. 2004;72(5):209–223. doi: 10.1111/j.1432-0436.2004.07205003.x. [DOI] [PubMed] [Google Scholar]